一、醚的分类和命名
醚的官能团是醚键(C-O-C),醚键的氧连接两个烃基。如果两个烃基相同时称为单醚,通式为R-O-R。两个烃基不同时称为混醚,通式为R-O-R‘。烃基可以是脂肪烃基、脂环烃基或芳香烃基。
简单的醚。采用与氧原子相连的两上烃基的名称来命名。单醚就先写出烃基的名称,省略“二”字,然后加上“醚”字即可。混合醚的名称中,较小的烃基名称放在前面;如果有一个烃基是链状的,另一个是芳香烃基时,则把芳香烃基名称放在前面。例如:
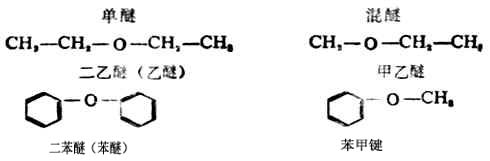
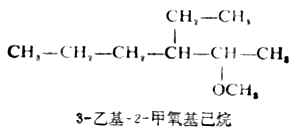
构造比较复杂的醚可用系统命名法命名。链状醚是选择包括连有氧原子的碳在内的最长碳链为主链,当作母体,把烃氧基(RO-或ArO-)作为取代基。
二、醚的性质
多数醚是易挥发、易燃的液体。由于醚分子间不能形成氢键,所以醚的沸点比同相对分子质量的醇的沸点低得多,如甲醚的沸点为-24.9℃,而乙醇的沸点则为78.5℃。一般醚都很难溶于水。
醚的化学性质与醇或酚有很大的不同。醚是比较稳定的化合物。醚与金属钠无反应,对碱及还原剂相当稳定。因此,常用一些醚作为有机反应中的溶剂。
(一)金羊盐的生成
醚键上的氧原子具有未共享电子对,作为刘易斯碱能接受强酸的H+,形成金羊盐。因此,醚能溶于强酸如浓HCL、浓H2SO4中。
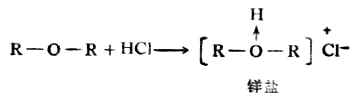
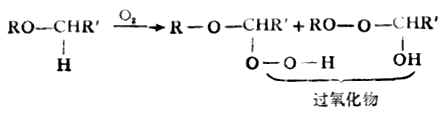
(二)烷基醚的氧化
含有α-氢的烷基醚由于受烃氧基的影响,在空气中放置时会被氧气氧化,生成过氧化物。过氧化物性质不稳定,温度较高时能迅速分解而发生爆炸。因此,在使用醚类时,应尽量避免将它们暴露在空气中。贮存时,宜放入棕色瓶中,并可加入少量阻氧化剂(如对苯二酚)以防止过氧化物的生成。用蒸馏法纯制醚类时,应检验有无过氧化物存在。其方法是,用FeSO4与KCNS的混合溶液与醚一起振摇。如醚中有过氧化物存在,则将Fe2+氧化为Fe3+而生成红色的[Fe(CNS)3-6。也可用酸性碘化钾溶液检验,若有过氧化物存在,则会游离出碘。
三、乙醚在医学上的应用
乙醚为无色液体,沸点34.5℃,极易挥发、燃烧,故使用时要特别小心,防止接近明火。
乙醚是一种应用很广泛的有机溶剂
■[此处缺少一些内容]■
