这一项包括几种因子,其中最重要的是底物种类和浓度,这是每种测酶活性浓度方法中首先需要选择的项目,选择恰当与否,对该酶测定至关重要。后面几项则不是每种酶测定都会遇到的选择。
(一)选合适的底物种类和浓度
如所测的酶专一性不强,可作用于多种底物,首先就需决定选择哪一类底物作为测此酶的底物。如该项酶测定主要用于临床诊疗工作,则首先应考虑选有较高诊断价值的底物。例如临床上测定酸性磷酸酶主要用于诊断前列腺癌,所选的底物应对前列腺酸性磷酸酶有较高的特异性。不易被其它组织如红细胞、血小板中酸性磷酸酶所作用,在常用的底物中以麝香草酚磷酸盐最符合上述选择条件。但如进行酶基础研究,探讨其在体内作用时,则选择酶在体内的生理底物更为合适,一般而言在多种底物中,Km最小的底物往往是此酶的生理底物。
选择Km小的底物测定酶还有一个优点,就是在最大反应速度V的底物浓度也将最低。在实际工作中可能意味着试剂成本可能较低,不易出现底物难溶解的困难。
底物专一性强的酶虽然不面临上述选择,但只要所测酶催化的是可逆反应,则和专一性不强酶一样,都面临着是选择正向还是逆向反应来测定酶,不同反应方向的底物必然是不一样的。这方面的选择更多从技术和实用方面加以考虑往往选择速度较快的方向,因为这可以提高测定的灵敏度,如测定肌酸激酶(CK),由于磷酸肌酸价格昂贵且不稳定,早期多选用正向反应,底物为肌酸和ATP速度太慢,只是逆向反应的1/6,测定灵敏度太低,以致正常标本结果误差很大。近年来都改用逆向反应测定CK,明显提高CK测定的精密度和准确度。在此问题上,实用考虑也起了不小作用。例如测定乳酸脱氢酶(LD)时,如考虑到正向反应明显快于逆向反应,则应考虑以丙酮酸和NADH为底物,这正是IFCC和其它一些学会推荐的方法。但目前市售的测LD的试剂盒不少都以乳酸和NAD+为底物。因为NAD+价格明显低于NADH,并且稳定可长期储存。科研工作中如需测LD,还是最好采用IFCC的方法。
确定底物种类后,重要的问题是选择底物的合适浓度,在讨论此问题之前,有必要先简单复习一下底物浓度和酶反应速度之间的关系,因其不同于其它化学反应有其独特之处,图17-2很形象表示出这种差异。
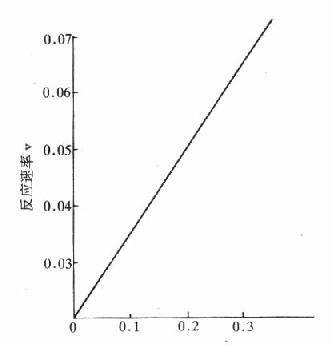
反应物浓度[S]
图17-2a 反应物浓度对化学反应的影响
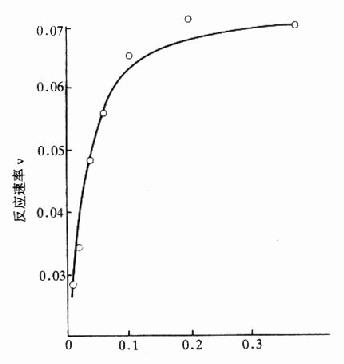
底物浓度[S]
图17-2b 底物浓度对酶反应的影响
图a表示在一般化学反应中遵循质量作用定律,反应速度随反应物质浓度增加成正比例增加,图b则表示酶反应中底物浓度对反应速度的影响,当底物浓度很低时,酶反应速度几乎随底物增加成正比例加快,进一步升高底物浓度,虽然反应速度也加快,但增加速度愈来愈慢,不成比例。到一定程度,反应速度趋于恒定为一常数,实际上就是趋向最大反应速度V,测定此处的反应速度V,最能准确地反映酶量多少。在此处底物浓度变化,对反应速度影响很小。
Michaclis和Menten二式首先在本世纪初对酶反应的此项独特现象从理论上加以合理解释。并推导出著名的米-门方程式:
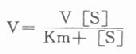
此公式对选择酶测定的底物浓度有重要的指导作用。Km对每一种酶而言在一定条件下为一常数,并可从上述方程式求出,在反应速度为最大反应速度V一半时,代入上式得:
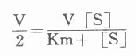
Vkm+V[S]=2V[S]
VKm=V[S]
[S]=Km
换言之,当酶促反应速度为最大反应速度一半时,此时的底物就相当于酶的米氏常数Km。以mol/L表示之,大多数酶Km在10-3至10-5mol/L之间。
当我们知道或计算出某一酶的Km后就可以计算出不同底物浓度和Km间的比值,化入米-门方程式就可计算出此时酶促反应速度相当于最大反应速度的百分比,见表:17-3
表17-3 底物浓度与Km比值相当的最大反应百分比
| [S]/Km | V/V×100 |
| 100.0 | 99.0 |
| 10.0 | 91.0 |
| 1.0 | 50.0 |
| 0.1 | 9.0 |
| 0.01 | 0.99 |
依据上表一般都认为酶测定时底物浓度最好为Km的20倍乃至100倍。在实际工作考虑到底物溶解度的限制,价格的昂贵,可将底物浓度降为Km的10倍。再低就不适合酶的测定,可能产生较大误差。
以上规律适用于大多数酶。一些酶还有其特殊情况,常能遇到的是当底物浓度增加到一定范围后,酶反应速度不仅不增加,反而下降。如乳酸脱氢酶,当丙酮酸浓度超过一定量时,酶活性反而下降,故丙酮酸浓度不能过高。
以上介绍的米-门方程式只适用于单一底物的酶,不少酶催化反应二底物乃至更多底物,有关二底物的米-门方程以及此时底物浓度的选择可参考一些有关书籍。实际工作中最简单的作法是先将其中底物之一的浓度选得很高,使酶饱和,然后求出另一底物的表观Km,反之亦然,最后按上述规律决定二底物的合适浓度。
(二)辅因子、活化剂的种类和浓度
从广义上说,凡能促进酶及反应物进入活化状态从而加速酶催化反应的物质都能称为辅因子,它包括种类很广的物质。英汉生化词典将辅因子(cofactors)定义为“一种酶的活性所需要的一种非蛋白质成分”。这种辅因子可能是一种金属离子激活剂或一种有机分子(辅酶)。它们或松或紧地与酶相结合;紧密接合的辅因子称为“辅基”。将激活剂(activator)定义为“一种金属离子,作为一种酶的辅助因子。”
在前面已谈到,测酶活性浓度时应该在最适条件下测酶反应的最大速度。如测定酶需要辅因子,活化剂时,应选择合适的种类和浓度加入到测定酶的体系中,在些过程中可能会涉及到下列四类物质。
首先是辅酶(Coenzyme)。很多酶反应都必须有辅酶参加。如相当部分的还原酶需要辅酶Ⅰ(NAD+)和辅酶Ⅱ(NADD+)参加。ATP是激酶(Kinase)反应中不可少的辅酶,这类物质一般是小的有机化合物,和辅基不同点是与酶蛋白结合很松弛,用透析和其它方法很易将它们与酶分开,尽管它们不用于酶的底物,特异性不强,往往参加一系列酶反应和代谢过程。但在作用方式上和底物类似,在酶反应过程中与酶结合、分离及反复循环。在方法学上,可将它们按底物处理,即可按米-门方程式求出其Km,按底物规律选择其浓度。
第二是辅基,辅基虽也是小的有机化合物,但却是酶蛋白不可分割部分,不含辅基的酶蛋白称为脱辅基酶蛋白(apoenzyme),没有催化活性,必须加入足量辅基,和它结合成为全酶(holoenzyme),才可能有催化活性。最典型的例子是各种转氨酶需要磷酸吡哆醛为其辅基,在反应过程中。氨基酸将其氨基交给吡哆醛变为吡哆胺,本身接受醛基成为酮酸,然后吡哆胺将氨基转交给酮酸生成氨基酸,本身又变回吡哆醛。从此机制不难理解为何脱辅基酶蛋白无催化活性。
辅基和辅酶不同点不仅表现在和酶蛋白结合紧密,不易为透析所除去,和酶作用方式也不同,不似辅酶迅速与酶结合,又迅速分解为酶和产物,辅基显著特点之一是与酶结合需要一定时间,因此在酶测定时,如按底物一样来处理辅基,在酶反应开始时才加入辅基,则开始阶段反应较慢,经过一段延滞期后,反应才达到应有速度。因此在酶测定时,往往是先加入足量辅基,作用一定时间如10分钟后,再加入底物开始酶反应。
很多辅酶和辅基来自维生素或结构中含有维生素,如NAD和NADP来自维生素尼克酸,转氨酶的辅基磷酸吡哆醛来自维生素B6(吡哆醇)。来自维生素B1的焦磷酸硫胺素是丙酮酸脱羧反应的辅羧化酶。从维生素B2(核黄素)形成的FAD,FMN是很多呼吸链上酶的辅基,维生素H(生物素)在羧化和脱羧作用中起辅基作用,叶酸衍生物参与一碳基团的转移。维生素B12的衍生物钴胺酰胺参与酶催化的异构反应。
第三类物质是离子,很多酶需要特定离子帮助才能使其反应达到最大速度。最常见的是二价金属离子如Mg2+、Zn2+、Mn2+、Ca2+、Fe2+等。所有转移磷酸的酶,如激酶类和碱性磷酸酶的反应都需要Mg2+的参加。所以如在反应体系中加入金属螯合剂如ED-TA或以他们为抗凝剂常抑制一些酶的活性。因此酶测定的标本多采用血清而不采用血浆,以外还有单价的K+。如丙酮酸激酶反应同时需要K+和Mg2+。淀粉酶催化的反应需要阴离子Cl-,5mmol/L氯离子可加速淀粉酶的反应三倍。
离子加速酶反应的机制是多种多样,Zn2+是碱性磷酸酶和羧基肽酶A整体结构的一部分,可稳定酶的三级和四级结构。Cl-加速淀粉酶反应的机制可能与它能与酶分子中某些带阳电荷基团结合有关,改变了在催化作用中起重要作用的基团的电离常数,有些离子可使酶分子带阳电荷,和带阴性电荷的底物结合,在酶反应中起了桥梁作用。必须注意的是,过量的离子往往抑制酶反应速度,在测定酶时要选择合适的浓度。
第四类是一些无法包括在前三类的其它加速酶反应物质,如巯基化合物可稳定酶的双硫键。在肌酸激酶反应体系中加入它将明显增高酶活性,并且随所加巯基化合物的不同,增加的速度也有差异,所以在测肌酸激酶时要选择好巯基化合物的种类与合适的浓度。
还有所谓的表观激活作用,该物质并不是真正加快反应速度,而是由于和抑制剂作用抵消了抑制作用,从表面上看似乎是加速了酶的反应作用。
(三)选变构剂的种类与浓度
有一类特殊的酶叫变构酶(allosteric enzyme),其反应速度和底物关系不同于一般酶的双曲线,而出现S形曲线,这是由于这种酶具有二个或更多个独特的部位-或是相互作用的催化部位,或是相互作用的催化部位与调节部位,其结果是酶与底物作用速度将受另一类物质的影响,这类物质命名为变构剂或效应物。根据作用不同又分为变构激活剂和变构抑制剂或者正负效应物,而不同浓度的变构剂会明显改变曲线形状。变构酶在物质代谢中有重要的调节作用。在测定变构酶活性浓度时,必须选择好变构剂种类和浓度。一般来说应选择在饱和浓度的变构剂的条件下测定构酶的活性浓度。
