连续监测法具有众多的优点,随着科学技术的发展,自动生化仪的使用,正在逐步取代“固定时间法”,发达国家从50年代到70年代末用了约20余年的时间,我国从80年代初开始使用连续监测法,虽然发展很快,但至少仍有不少地区医院实验室仍使用老的方法,就是已使用新法的实验室,也不一定掌握得很好,本节将比较详细地从分类,酶偶联反应,测定注意事项等方面对连续监测法加以介绍。
(一)连续监测法种类
⒈直接连续监测法这类方法是使用各种分析手段,如分光亮度法、荧光法、pH计、旋光计、电导仪等等,在不停止酶反应条件下直接测反应体系中底物或产物的变化,从而计算出酶活性浓度,其中尤以分光光度法应用最多,应用最广的有NAD(P)H反应系统,可以测定大部分的脱氢酶,还有的是所谓“色素原”底物,其本身为无色或微黄色,在酶作用下生成有色化合物,适用于测定水解酶和一些转移酶。
⒉间接连续监测法直接法试剂简单,操作方便,可惜的是只有当底物与产物之间,在光学性质或其它理化性质有显著差异时,才有可能使用此法。到目前为止,大部分酶都无法用直接法测定。
科学家还曾设法在原来反应体系中添加一些试剂,这些试剂必须不与酶作用也不影响酶活性,同时又能与酶反应物迅速作用,产生可以被直接测定的物质,典型的例子是Ellman的胆碱酯酶测定法,底物为硫代乙酰胆碱,酶水解产物硫代胆碱与添加的二硫代硝基苯甲酸(DTNB)作用立刻生成黄色化合物,可在412nm用分光光度法连续监测。
实际工作中,更多的是在反应体系中加入另一酶试剂。进行适当的酶促反应,完全可以胜任上述工作。目前酶偶联法已经成为应用最广、最频繁测酶活性浓度的方法。
最简单的酶偶联反应为以下模式:
![]()
Ex为所要测定的酶,A、B二物质分别为其底物和产物,对此二物质变化,无法直接监测,此时可加入其它酶,其底物为Ex的产物B,其反应产物C可直接监测,这样通过第二个酶反应有可能推测出第一个酶的活性浓度,外加的第二个酶称之为指示酶Ei。
如果一些酶反应找不到合适的指示酶与其直接偶联,此时往往可以加入另一种酶,将二者连接起来,模式如下:
![]()
将这种联接的酶称之为辅助酶(Ea)。个别情况可能使用二种乃至二种以上的辅助酶。
酶偶联反应与一般酶反应的一个重要区别处在于其有一个明显的延滞期。酶偶联反应一开始只存在着底物A,不存在指示酶的反应,随着产物B的出现和增加,指示酶反应随之加快,Ex和Ei反应速度相等,也就是达到稳态。从酶反应开始至稳态期间,指示酶反应较慢且不稳定,称为延滞期。显然这期间指示酶反应速度不能代表测定酶量多少。设计或选择酶测定方法时,如果用酶偶联法,延滞期越短越好,测定时间一定要避开此期。
是不是所有类型的酶偶联反应都可用来测酶活性浓度?回答是否定的。因为测酶的活性浓度是依据测定酶反应速度——△A/△t或△B/△t求出。在酶偶联法,此值无法直接求出,而是通过测定指示酶反应△C/△t间接求出,要使酶偶联法测得的酶活性浓度准确可靠,则Vind=Vx。换言之,指示酶的最大反应速度必须等于或接近测定酶的最大反应速度。
当测定酶的反应速度明显大于指示酶,此时A很快转变为B,由于指示酶反应慢,中间产物B大量推积,最终产物产生速度明显慢于底物A的消失速度。
当指示酶速度加大后,中间产物B堆积减小,指示酶反应速率偏差程度也变小。只有当指示酶大量存在时,出现产物B就能将其迅速变为C。
可以看出在延滞期后(即B达到高峰后的时期),C和A的变化速度非常一致。也就是只有在些情况下,才是测定酶浓度的理想条件。
从理论上说,用酶偶联反应测酶活性浓度时,最好条件应是测定酶反应为限速反应。动力学上为零级反应,而指示酶为一级反应,酶反应速度与指示酶底物浓度相关。
(二)指示酶、辅助酶的种类和浓度
指示酶、辅助酶的种类:常规化验中常用的酶偶联法中,多以脱氢酶为指示酶,在常规化验中的自动分析仪几乎无一例外都有340nm波长,通过NAD(P)H系统可以很方便地监测到指示酶反应。但从理论上说,往往可以有不止一种偶联方法,只要设法使偶联反应中最后一个是指示酶反应,前面已提到测CK可以正向逆向二个方向建立二种不同酶偶联的反应。又如在丙氨酸转氨基酶(ALT)测定法中,正向反应后产生丙酮酸和谷氨酶,目前最常用的是用乳酸脱氢酶与丙酮酸偶联反应,伴有NADH下降。但也可以用谷氨酸脱氢酶与谷氨酸作用,伴有NADH生成。
总之,酶偶联法为实验室工作者开辟了一个广阔前景。在设计和选择测定酶活性浓度方法时,应该创造更新的方法,而不应拘泥于书本上的方法。
在选择时首先应考虑方法的特异性。在ALT方法,测定丙酮酸显然优于测谷氨酸,因为多种氨基转移酶都能产生谷氨酸,而只有ALT产生丙酮酸。还有干扰反应或副反应,在ALT测定中,由于正常以及病理血清中含有一定量丙酮酸,将受到它的干扰,又由于底物中含有大量α-酮戊二酸,可被血中谷氨酸脱氢酶作用消耗NADH。
其次应考虑酶偶联反应的合理性,如能直接与指示酶偶联,就没有必要加入辅助酶,所选用的指示酶、辅助酶除了应选Km小的酶(这样容易使它们催化反应速度大大超过测定酶反应速度),还必须考虑指示酶、辅助酶是在测定酶的“最适条件”下工作,此时往往不是指示酶、辅助酶的最适条件,如二者差异太大不利于整个酶系统的反应,例如乳酸脱氢酶最适pH为7.4,而丙氨酸氨基转移酶最适pH也是7.4,乳酸脱氢酶作为指示酶比谷氨酸脱氢酶更为合适,因后者最适pH为8.4。
如最后制成试剂盒,则还需从经济角度选择一些价廉物美,又易取材、纯化得到的酶制剂。
(三)指示酶、辅助酶的浓度
从上节描述中可以知道建立一个合适的酶偶联反应体系,不是很容易的指示酶,辅助酶的反应要能准确反映出测定酶含量,中间产物必须低,延滞期必须短,要作到此点,这些工具酶用量很大,但用量过大经济上不合算,所以在酶偶联测定法中,选用适当量的指示酶是一个重要的问题。一般可用反复试验法,即试验性地选用不同量的指示酸直到偶联酶反应中指示酶反应速度不随工具酶的增加而升高,并在所选用的“最适条件”下,指示酶反应速度和酶活性浓度成正比例。
这种方法工作量大,而且不一定能得到最适结果,较好的办法是可先从理论上进行计算,得出一个大约结果,然后在此范围内进行试验,这样可以节约时间和精力。
最简单的方法是根据Vx/(Km)x=Vi/(Km)i的比值来选择指示酶的用量Vi,式中Vx为测定酶的测定上限,(Km)x和(Km)i分别是测定酶和指示酶的米氏常数;有人计算过当比值为1:100时,测定值低4%;如改为1:10时,指示酶的反应速度将比测定酶反应速度慢28%,如增加到1:1000,则误差只有0.7%。
这是因为,当我们用酶偶联反应体系测酶活性浓度时,测定酶的反应必须是体系中的限速反应,工具酶所催化的最大反应速度必须远远大于测定酶,由于工具酶所催化的反应必须在中间产物浓度很低条件下进行,并且将其很快转变为最终产物,反应体系中不应有中间产物堆积,否则将导致误差。
下面举一实例,在肌酸激酶测定法中,CK的Km为2.4mmol/L,指示酶6-磷酸葡萄糖脱氢酶的Km为0.27mmol/L,如我们将CK测定上限定为450μ/L(实际测定时标本稀释60倍,实际为7.5μ/L),如希望上述比例为1:100。代入上式:
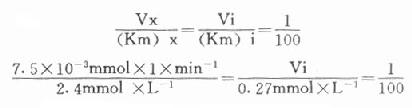
Vi=3.1×10-3×min-1×0.27mmol×1
=0.835×10-3×mmol×min-1
=0.835U
如反应体系为1ml,求出在此反应体系中只需0.835U的6-磷酸葡萄糖脱氢酶即可。
另一法可以根据米氏方程式来计算,在酶偶联反应中,指示酶催化速度(Vi)的米氏方程式为:
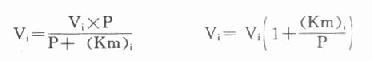
以天冬氨酸氨基转移酶(AST)为例希望中间产物P浓度很低,定为0.001mmol/L,指示酶苹果酸脱氢酶。Km为0.0165mmol/L,如设定AST上限为300U/L(标本为1:12稀释,实测上限为25U/L)。代入上式:
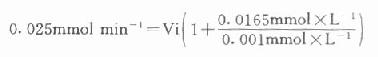
Vi=0.0014mmol min-1=1.4U
得1.4U,如反应体系为3ml,则试剂中苹果酸脱氢酶用量为466U/L,目前试剂中用量为600U/L。从以上计算来看,试剂中用量是足够的。
在酶偶联反应体系中,不可避免会出现延滞期,在测定酶时希望此延滞期愈短愈好,此时可利用Mcclure介绍的计算法计算出一定延滞期时所需指示酶的量。
Mcclure假定在下面酶偶联反应中:
![]()
第一个反应为零级反应,第二个反应为一级反应,且中间产物B浓度远小于指示酶的Km,即B<<(Km)i。
通过推导,可得
dB/dt=k1-k2B
上式积分得:
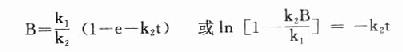
当t足够大时,e-k2t→0,此时B浓度不变达到稳态,此时B的浓度为Bss,代入上式:
首先可得 Bss=k1/k2
以及ln[1-B/Bss] =-k2t
同时在稳态下,k2是指示酶正向反应的常数,在一级反应中k2=Vi/(Km)i。
令F=B/Bss,此即在时间t时产物B为其稳态浓度的百分数,一般选用0.99。
最后可得公式:
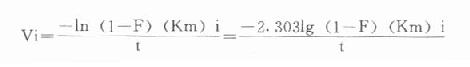 Vi=
Vi=
例如在CK测定中,指示酶6-磷酸葡萄糖脱氢酶Km为0.11mmol/L,我们希望延滞时间为1分钟,则指示酶用量为:
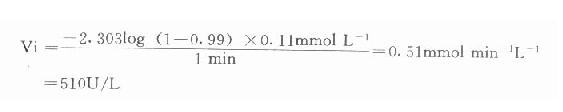
总之,从上式可清楚看到,延滞时间t与指示酶的Km成正比例,用量成反比。
