17.1 缺铁性贫血
缺铁性贫血(iron deficiency anemia,IDA)是常见的营养缺乏病,发病遍及世界各国,以6月至3岁小儿发病率最高。根据WHO资料小儿发病率高达52%,男性成人约为10%,女性20%以上,孕妇40%,上海医科大学儿科医院从城市1042名初生至13岁小儿的调查结果发现:3月组IDA发病率13.2%,6月组42.2%,1~〈2岁组31.8%,2岁以上较低,7~13岁组15.1%,又根据上海医科大学华山医院资料在非妊娠育龄女工中的IDA(Hb〈110g·L-1发病率为11.39%,妊娠女工中(Hb〈100g·L-1〉为19.28%。因此研究防治IDA,尤其是高发年龄组的IDA,是广大医务工作者的重要职责。
目前,认为由于各种原因引起的体内铁缺乏后至IDA出现有一演进过程:①铁减少期(iron depletion,ID),此时仅有体内储铁减少; ②红细胞生成缺铁期 (iron deficient erythropoiesisIDE); ③缺铁性贫血期。以上各期可分别用各种指标检测。由于铁缺乏研究的深入,所以,十分有利于防治工作的开展。
17.1.1 病因
体内铁的65%组成Hb,约30%以铁蛋白和含铁血黄素的形式储存于肝、脾、骨髓等网状内皮系统内,余下的分布于肌红蛋白、细胞色素及细胞内与氧化还原过程有关的酶中。血液中转运的铁仅占总量的0.12%左右。体内铁含量随年龄、体重及Hb水平而异。正常男性成人的总铁量约为50mg·kg-1,女性约为35mg·kg-1,新生儿约为60~70mg·kg-1。
铁的代谢是在一个基本闭合的循环中进行,红细胞经过约120天后破坏释放的铁,其中80%转运至骨髓而被再利用,20%则贮存于肝细胞及网状内皮系统备用。每天排出的铁量从摄入食物中得到补充,铁代谢处于动态平衡中。正常成人男性每日的铁排泄量为0.5~1.5mg,女性因月经每天平均多失铁1mg,故每天排泄量约2mg,哺乳期每天多1.5mg。最初2个月小儿从粪便丢失的铁相对地较成人为多,每天约1mg,小儿体表面积相对较大,自皮肤丢失的铁亦相对地较多,正常情况下<2岁小儿丢失铁约0.04mg·kg-1·d-1,2~8岁0.03mg·kg-1· d-1.如有额外需要如生长发育、妊娠、失血等,则必须从食物中吸收更多的铁以满足需要。各年龄组为维持体内铁的平衡每日所必需吸收的铁量见表17-1 。
(1)体内贮铁不足 婴儿时期的铁缺乏症与新生儿储铁有关,影响新生成储铁的因素有:
①妊娠时间与新生儿体重 妊娠前6个月时胎儿储铁较少,在最后3个月时储铁大量增多,所以早产儿、双胎、低出生体重儿易有铁营养缺乏。
②脐带结扎时间与方法 脐带血管内约有75~125ml血,此量约等于新生儿血容量之1/4~1/3。延缓脐带结扎,将脐带血挤入新生儿或结扎时胎盘位置低于产妇时,均可增加新生儿的血红蛋白值及体内含铁量;
③有无胎儿至胎儿或胎儿至母体的输血 已知约有15%的单绒毛膜胎盘的双胎有明显的胎胎间输血。
④母亲的铁营养状态 多数学者认为IDA与正常母亲的新生儿,其脐血的血红蛋白值无差异但另有学者发现随母亲贫血程度不同,脐血的血红蛋白虽在正常范围,但脐血的血清铁、运铁蛋白饱和度血清铁蛋白的含量有明显差异。并认为母体妊娠早期出现的中度至重度贫血,可影响胎盘结构和功能,如铁的转运和其他造血物质进入胎儿而使脐血血红蛋白值下降。妊娠后期发生贫血时,胎盘结构和功能不受影响,脐血血红蛋白浓度正常。
(2)铁摄入不足或吸收不良
①食物中铁的含量及吸收度:食物中的铁有血红素铁及非血红素铁。前者存在于鱼、畜及禽类的肉中,能在肠道上皮细胞直接吸收,不受消化液或其他食物因素的影响。后者则受这些因素的影响,且必须游离还原为二价铁或三价铁,与其他物质螯合后才能吸收。
人乳每100ml含铁0.15mg,但人乳因含乳糖和维生素C较多,含磷酸较少,故铁的吸收率达50~70%,牛乳每100ml含铁0.1mg,吸收率仅10%。动物性食物含铁较高,吸收率亦高,如各种鱼类含铁0.7~1.6mg·100g-1,吸收率仅11%。,各种肉类1.5~3.2mg·100g-1,猪肝25mg·100g-1 ,吸收率均达22%。鸡蛋含量虽为2.750mg·100g-1 ,吸收率仅1%,玉米及小麦含铁约1.650mg·100g-1 ,吸收率各为3及5%.绿叶蔬菜一般含铁量较其他蔬菜,瓜果为高,菠菜虽含铁2.550mg·100g-1,但吸收率仅1.3%。豆类含铁量高,尤其黄豆含铁1150mg·100g-1,且吸收率达7%。
②食物相互作用对铁吸收的影响:
A.抑制铁吸收的配位体(ligands);有草酸盐、碳酸盐、磷酸盐、植酸盐等,大都存在于植物性食物内,可与铁结合成大的多聚体(polymers),不能溶解而沉淀,从而使铁的吸收受阻。含纤维量高的麦麸也能影响铁的吸收。茶叶与咖啡中的鞣酸对铁的抑制率可达41~95%。牛奶中的磷高,蛋黄中的磷酸盐和磷蛋白均使铁不易吸收。
B.促进铁吸收的配位体 此种配位体能与铁螯合形成小分子量的可溶性单体(monomers),可阻止铁沉淀和形成多聚体,从而有利于铁的吸收,如乳酸盐、柠檬酸、琥珀酸、氨基酸、肌苷、脂肪、山梨醇、葡萄糖、蔗糖及果糖。而最强的维生素C和存在于牛、羊、猪、鸡、鱼的肉和肝内的“内因子”。
维生素促进非血红素铁吸收的作用十分明显,且与剂量大小成正比。在膳食中添加维生素C可使铁的吸收率提高5~10倍,但维生素C必须与食物同时进食才能起作用。肉食加入植物性食物中同食时,也可促进非血红素铁的吸收。如铁强化面包铁的吸收率为2.1%。同时吃一小块肉(30g),铁的吸收率可提高3倍,如多吃一些肉还可再提高。
C.蛋白质对食物中铁吸收的影响:最近Cook的研究认为除乳制品外,其他动物蛋白均能提高血红素铁及非血红素铁的吸收,但发现一些半提纯的蛋白质反而能使非血红素铁吸收下降,如黄豆蛋白可使铁吸收下降80~90%,而这种抑制作用不能用加热或提纯来消除。
D.固体食物对人乳中铁吸收的影响:近来发现人乳喂养小儿时,添加固体食物如水果或蔬菜泥后,反使铁吸收量减少,体内储铁下降。故目前认为添加固体食物能使人乳喂养小儿的铁摄入不足。
因此膳食搭配尤其是同时进食时,各类食物的搭配对非血红素铁和无机铁的吸收有重要的影响,由于搭配不同,每餐铁的吸收率不同。铁的生物可利用密度(bioavailablenutrient density)也不同,它是搭配膳食的铁营养价值的指标。即铁营养状态在正常或缺乏时,自某餐每提供4200kJ(1000keal)的食物中,可吸收的铁毫克数,为该餐食物铁的生物可利用密度。如某餐食物含铁2.8mg,供热能1344kJ(320kcal),铁的吸收率5.7%,铁吸收量为0.15mg,则该餐的铁的生物可利用密度为0.5mg4200kJ-1。
由于以上多种因素可以影响铁的吸收,膳食中铁的吸收率一般为5~10%,每日膳食中应摄取的铁量应为每日的需要量(表17-1)×10。婴儿时期以乳类食物为主,所进辅食不多,加上可能存在搭配不当与食物相互作用等因素,易有含铁量不足,吸收率不高等情况。所以营养性缺铁性贫血的发病率高。成人如不注意膳食成分及搭配也有可能产生营养性缺铁性贫血。
表17-1 每日铁需要量(WHO1970 ,1972)
| 年龄 | 每日必须吸收量(mg) |
| 婴儿5-12月 | 0.7 |
| 儿童1-12岁 | 1.0 |
| 男孩13-16岁 | 1.8 |
| 女孩13-16岁 | 2.4 |
| 经期妇女 | 2.8 |
| 成年男子 | 0.9 |
| 孕妇第一胎期 | 0.8 |
| 第二胎期 | 3.0 |
| 哺乳期妇女 | 2.4 |
③吸收障碍:铁的吸收主要在十二脂肠及小肠上端进行,胃肠吻合术时,食物不经过铁吸收的主要部位十二指肠,萎缩性胃炎时胃酸缺乏,以上疾病均可影响铁的吸收。
(3)需要量增加:儿童处在生长发育期,随体重增加,血容量及组织铁相应增加,生长速率愈快,铁的需要量相应愈大,愈易发生缺铁。足月儿1岁时体重增加3倍,早产儿可增加5~6倍,每增加1kg体重约需增加铁35~45mg,足月儿第一年内约需补充外源性铁200mg,低出生体重儿约需补充280~350mg,所以婴儿期尤其是低出生体重儿更易发生缺铁性贫血。妊娠及哺乳期妇女需铁量增加,青年妇女由于月经失血,需要量也应增加。
(4)丢失或消耗增多:正常婴儿在生后两个月内,由粪便排出的铁比由饮食中摄取的铁多,由皮肤损失的铁也相对较多。牛乳喂养小儿,可因对牛乳过敏或不能耐受大量牛乳(常超过50ml·d-1)而引起肠道病变,导致出血,重者可造成漏肠综合征,以致其他物质如血浆白蛋白,免疫球蛋白及铜、钙的丢失。牛乳中热不稳定蛋白部分为引起过敏的因素,牛乳煮沸后,蒸发乳或奶粉可使蛋白质变性,此种现象可得到减轻或消失。
急性腹泻时,大便失铁较其他感染或正常幼儿为多,其他反复感染,铁的消耗增多,钩虫感染可引起肠道失血(1ml血含铁0.5mg)。
在缺铁性贫血患者中,约有50%大便大潜血阳性,而正常婴儿中仅7%阳性。因此IDA可增加铁的丢失。
其他失铁情况尚有肠道畸形、慢性上消化道出血、月经过多、痔疮出血以及其他部位的出血等。肾病综合征时由于运铁蛋白自尿中漏出,可引起缺铁性贫血。
(5)其他 如先天性无运铁蛋白症,先天性运铁蛋白运转至红细胞有缺陷,铁动用缺陷伴有IgA缺乏,原发性肺含铁血黄素沉着症及Goodpasture综合征等。
17.1.2 发病机理
体内含铁化合物中,血红蛋白及肌红蛋白具有带氧功能、细胞色素、琥珀酸脱氢酶及NADH脱氢酶等能运送电子,过氧化氢酶能分解过氧化氢。铁除包含在上述含铁化合物中外,尚与很多酶的活性有关(铁依赖性),如单胺氧化酶、酪氨酸羟化酶、核糖核苷酸还原酶等。此类酶控制着体内重要的氧化、水解和转换过程。因此铁与组织呼吸、氧化磷酸化、卟啉代谢、胶原合成、淋巴细胞与粒细胞功能、神经介质的合成与分解、躯体与神经组织的发育都有关系。
(1)缺铁对对造血系统的影响 铁是合成血红蛋白的原料。血浆中转运的铁到达骨髓造血组织时,铁即进入幼红细胞内,被线粒体摄取与小卟啉结合而形成正铁血红素。后者再与珠蛋白合成血红蛋白。当体内缺铁时,正铁血红素形成不足,使血红蛋白合成减少,新生的红细胞中血红蛋白量不足。明显缺铁时,由于影响到DNA的合成,对幼红细胞的分裂增殖也有一定影响,但远不如对血红蛋白合成的影响明显。故新生的红细胞体积变小,胞浆中血红蛋白量减少,而形成小细胞性低色素性贫血。
红细胞自骨髓释放至血的速度减低,在严重IDA时,红细胞的寿命缩短,红细胞内已糖激酶活力增加,自身溶血增加,红细胞变形性差,因此易被脾脏破坏。谷胱甘肽过氧化物酶活性力明显低下,因此细胞膜易受氧化物损害而变硬。珠蛋白,尤其α-链合成降低。IDA时红细胞内叶酸盐含量显著升高,服铁后下降到正常,IDA时可能幼红细胞叶酸利用有障碍。
外周血和骨髓淋巴细胞可肿胀,有空泡形成。血小板数可减低或增高。
(2)缺铁对中枢神经系统的影响 最近证明,缺铁鼠和人脑细胞的生化改变,可能是行为改变如易怒、注意力不集中等的物质基础。缺铁鼠脑中单胺氧化酶活力降低,IDA婴儿和儿童尿中香草扁桃酸(vanilmandelic acid,VMA)和去甲肾上腺素排泄量增加,铁治疗后均可恢复正常,后者升高可能是单胺氧化酶活力低的结果。另证明称缺铁鼠脑中羟醛氧化酶活力降低,血清素降解障碍,使其含量增高,铁治疗后恢复正常。血清素可能是一种神经介质。
(3)缺铁对消化系统的影响 缺铁后胃酸可减少,口腔粘膜有异常角化,口腔粘膜变薄,色素减低,上皮发生炎症,咽部环状软骨的后方,有时可有纤维组织结构或蹼样物形成而造成吞咽困难。萎缩性胃炎可能为对胃的体细胞产生自身抗体所致。小肠粘膜绒毛可变宽变钝、融合,上皮下可有炎症。大便隐血可阳性,对木糖吸收有障碍,严重时可产生渗出性肠病变及吸收不良综合征,导致脂肪、白蛋白、免疫球蛋白、维生素等物质的丧失。
(4)缺铁与感染 缺铁对感染发生率的关系仍有争论,大多认为缺铁时感染率增加,其理由为:①临床经验表明IDA儿童患者,感染率较健康儿童为高,有些学者在儿童中证实IDA纠正后,呼吸道感染发病率减低;②很多学者证明缺铁时与杀菌有关的很多含铁酶或铁依赖的酶的活力明显降低,而且铁可以直接影响淋巴组织的发育;③抗原刺激后淋巴细胞转化率及巨噬细胞移动抑制因子的产生均减低,经铁治疗后转为正常;④中性粒细胞吞噬功能减低,皮肤过敏试验反应减弱,说明细胞免疫功能有一定程度的损害,且发现损害程度与贫血程度有关。四川医学院及天津医学院从免疫学及临床上证实了以上情况。
相反的理论认为:①非洲IDA儿童中,细菌感染率较低;②铁剂治疗能诱发疟疾;③试管和动物实验证实细菌生长需要铁,IDA时运铁蛋白增高,而运铁蛋白能与细菌竞争铁,故能抑制细菌生长;④动物实验证实铁能刺激非洲致病性细菌的生成。(5)缺铁对肌肉功能、皮肤及骨骼的影响 有报告称IDA患者服铁4天后,体力已明显改善,此现象提示与血红蛋白及肌红蛋白量无关,而与 α-甘油磷酸氧化酶异常及与α-甘油磷酸盐介导的磷酸化有关。反甲可能为半胱氨酸代谢异常所致。骨骼生长可迟缓。
(6)其他 缺铁时甲状腺功能受影响,鼠在低温环境下T4不能转为T3而发生低温。
17.1.3 临床表现
任何年龄均可发病,小儿发病率高,尤以6个月至2岁最多见,哺乳期及妊娠期妇女亦多见。发病缓慢,多不能确定发病日期,不少患者常因其疾病就诊时才被发现,其表现随病情轻重而异。
(1)消化系统症状 食欲低下,体重减低,可有异食癖,爱吃泥土、黄沙、粉笔及冰,胃酸可减低,大便隐血可阳性;渗出性肠病变及吸收不良综合征患者有腹泻,以致丢失很多营养素而引起相应的缺乏症。萎缩性舌炎、萎缩性胃炎及吞咽困难,不见于婴儿患者,幼童亦罕见。成人中13~52%有舌炎,10~20%有口角炎,有些患者可于进入甜菜后排出红色尿液(甜菜尿beeturia),是由于肠粘膜吸收过多的色素甜菜苷(betanin)引起。
(2)中枢神经系统表现 很多学者观察到IDA小儿有行为异常,智能比对照组差,婴儿对外界反应差,易怒,不安,Bayley婴儿发育记分和智力发育指数均较对照组低。3~4岁小儿注意力不集中,儿童智商(IQ),词汇试验 (Vocabulary test)、学校标准考试记分较对照组低,用铁剂治疗后好转。婴儿时期患过IDA的小儿,在6~7岁时,其注意力不集中及活动过多的发生率比对照组高,说明IDA对行为的影响可持续较长的时间。另也有学者发现IDA时,婴儿的行为受到影响。
少数患儿在哭后,有屏气现象(breath holding spells),用铁治疗可好转。
严重IDE时,可出现神经乳头水肿。
(3)心血管系统症状Hb<70g·L-1时,心律加快,更严重时,可有心脏扩大及收缩期杂音。
(4)皮肤肌肉及骨胳 易疲乏。严重IDA时,X线上还显示板障增宽,似慢性溶血样。成人中有25%出现指(趾)甲改变(反甲),小儿少见。
(5)髓外造血表现 见于小儿。肝、脾、淋巴结可轻度肿大。年龄越久,贫血越重,肝脾肿大越明显,但罕见中等程度以上的肿大,淋巴结肿大程度更轻。
(6)对发育的影响 IDA小儿体重可明显低于正常,可能与食欲降低、小肠吸收功能紊乱或DNA、RNA合成障碍有关。
(7)免疫指标 淋巴细胞转化率、中性粒细胞杀菌力及四唑氮兰试验常降低,皮肤过敏反应亦降低。
后遗症问题,由于IDA为一全身性疾病,IDA严重时将影响全身组织及功能,因此不能忽视其长远的影响。
17.1.4 实验室检查
(1)目前诊断铁缺乏症均采用 生化方法,常用指标有;
①血清铁蛋白 (serumferritin ,SF):是反映体内铁储存的一个较正确与灵敏的方法。体内铁缺乏时SF减低。
②红细胞内游离原卟啉(freeerythrocyte protoporphyrin,FEP):IDE、IDA时FEP增 高。FEP/Hb较FEP更敏感,IDE、IDA时增高。
③血清铁(serumiron.SI)常单行减低,总铁结合力(total iron binding capacity,TIBC)常增高,运铁蛋白饱和度(transferrin saturation,TS)常降低。
(2)血象 IDA时有改变,早期仅的血红蛋白(Hb)降低,疾病发展后红细胞计数(RBC)逐渐降低,但H较RBC降低更明显。红细胞平均容积(MCV)、红细胞平均血红蛋白量(MCH)均较正常为小或低。红细胞平均血红蛋白浓度(MCHC)正常或减低。明显贫血患者血液涂片红细胞大小不均,直径偏小,有异形。淡染,中央苍白区增大。
(3)骨髓象检查 仅用于鉴别诊断需要时,骨髓铁染色也可反映体内铁贮存,但在5岁以下小儿不能以此区别储铁正常与减少。
(4)其他检查 有肝细胞储铁测定。组织含铁总量测定,铁吸收测定,铁动力学测定,Co排泄率测定等。但它们或不实用或不敏感,不能代替常用的生化诊断指标。
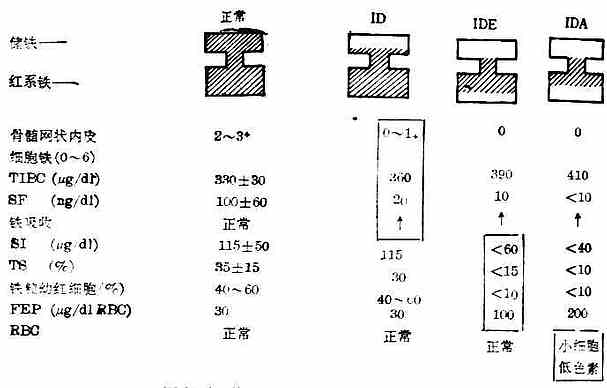
图17-1 体铁含量逐渐减少时有关指标延续改变情况
17.1.5 诊断
(1)体铁含量逐渐减少时,有关指标延续改变情况见图17-1。
从图17-1可见ID期时储铁减少后,骨髓细胞外铁首先受到影响,T1BC、SF已有改变,但仍在临界值上,铁吸收已增加。IDE期上述指标改变更明显,且出现SI、TS、铁粒幼红细胞计数与FEP异常,反映了红细胞生成缺铁。IDA时,红细胞出现小细胞低色素性改变。临床上可选用上述适当指标来确定缺铁及缺铁程度。
(2)选择诊断缺铁指标,估计铁营养状况时须注意
①各常用诊断指标的灵敏度和特异性SF是反映储铁的指标。储铁下降是SF值下降的唯一原因。SF灵敏度高,但当缺铁伴急慢性感染、炎症、肿瘤、心肝肾疾病时,SF可正常或稍增高。因此在此种情况下,以SF为诊断指标时,漏诊率增加。FEP灵敏度亦高,上述疾病(急性感染除外)时可增加。SI的生理变异较大,在急慢性炎症时下降时明显。SI、TS降低较SF、FEP出现为晚。TIBC的正常值范围较大,影响因素亦较多。人工测定MCV变异较大,肉眼观察红细胞形态误差更大。
②一项指标的正常值与异常值常有重叠,且各指标均有一定程度漏诊率,因此同时检测多项指标,可提高铁缺乏诊断的正确性和检出率。一般认为SF与任何一个指标相结合可提高铁缺乏诊断的灵敏度和特异性,另有学者认为MCH和FEP相结合是灵敏与特异的初筛方法。
上海医科大学儿科医院资料说明SF、FEP、FEP/Hb对诊断缺铁较SI、TIBC及TS灵敏,后三者需至IDA较明显时,才有较大诊断价值。该院以SF、SF+FEP、SF+FEP+Hb依次诊断ID、IDE及IDA,并以FEP+FEP/Hb+Hb筛查IDA。
③各年龄及性别有各指标不同的正常值。
(3)诊断准标
1982年全国小儿血液病座谈会上制定的小儿营养性缺铁性贫血的诊断标准草案如下(成人亦可参考,但①的低限不同):
①低色素性贫血 生后10天以内的新生儿,Hb<140g·L-1,6月~6岁<110g·L-1,6~14岁<120g·L-1,RBC形态有明显低色素表现,MCV<80μl,MCH<27pg,MCHC<31%。
②有明确的铁营养缺乏病因和表现。
③SF〈16μg·L-1
④骨髓细胞外铁明显减少或消失(0~+),铁粒幼红细胞〈15%。
⑤FEP〉500μg·L-1
⑥SI〈600μg·L-1
⑦TIBC〉3500μg·L-1,TS〈15%
⑧铁剂治疗有效。
符合第一条和2~8条中任2条上者,可确诊为缺铁性贫血。
ID期的诊断应有缺铁病因,SF及骨髓铁有上述改变。IDE期的诊断指标除ID期指标外,FEP、FEP/Hb或SI,TIBC,TS或RBC形态三者之一应有上述改变。如遇感染时,SF值如〈50μg/L时,仍可考虑有铁缺乏。
(4)IDA的鉴别诊断
①其他营养性贫血,如巨幼红细胞性贫血,混合性营养性贫血等可藉血象、骨髓象以及其他生化指标加以鉴别。
②其他低色素性贫血,如慢性感染时的贫血、地中海贫血、肿瘤或药物(Pb,INH)引起的贫血,铜缺乏及先天性铁代谢异常引起的贫血等,需藉病史,体格检查及实验室检查如SI、SF、FEP、血红蛋白电泳、骨髓铁染色等加以鉴别。
17.1.6 治疗
(1)一般疗法 对重症小儿宜加强护理,预防及治疗各种感染。
(2)病因疗法 如系营养性缺铁,必须增加含铁丰富、铁吸收率高、富于维生素C及蛋白质的食物。在小儿宜根据消化功能逐渐增加,其他病因必须去除。
(3)口服铁剂 常用铁剂有二价铁药物如:①硫酸亚铁片剂或溶液,后者适用于小儿,但易被氧化,仅能短期保存。硫酸亚铁含元素铁20%;②富马酸铁,含元素铁33%。口服铁剂元素铁每天3~6mg·kg-1计算,分次,餐间服用为宜。10%枸橼酸铁铵为三价铁,剂量为每天1~2ml·kg-1。铁剂宜与维生素C同服以增加铁的吸收。总疗程2~3个月即血红蛋白恢复正常后,再继续服用1~2个月以增加铁的储存。铁剂治疗2~3天后食欲精神状态即可恢复,2~4天后网织红细胞开始上升,7~10天达高峰,上升高度及红细胞数成反比,1月后血红蛋白恢复正常。铁剂治疗无效时应考虑到是否:①剂量不足;②铁剂失效;③持续失血;④诊断不正确;⑤伴有其他疾病而影响铁的吸收及利用;⑥胃肠吸收不良。
(4)注射铁剂 由于肌注或静注铁剂有一定副作用,因此仅用于:①严重胃肠道反应,不能耐受口服铁剂者;②慢性腹泻或胃肠道手术后;③需要迅速纠正缺铁,如妊娠晚期伴有严重贫血及需要外科手术时;④继续失血,其量超过肠的铁吸收量。
静注铁剂有右旋糖酐铁,含糖氧化铁等。
(5)输血及交换输血 严重贫血时,可考虑输血或输红细胞,伴心衰或急需手术时可考虑部分换血。
17.1.7 预防
首先应广泛宣传防治铁缺乏症的重要性,引起领导、社会及群众的重视。铁缺乏对小儿的危害更大。目前IDA的防治已列为儿童保健工作中重点防治的四病之一,但宣传工作尚应更广泛深入。
成人中除积极治疗能引起各种IDA的原发病外,对育龄期妇女,妊娠期及哺乳期妇女应每日摄取足够的铁(可用药物铁或用铁强化食物或增加营养来补充)。
小儿中应做好以下预防工作:
(1)胎儿期的预防措施
①孕母膳食应供给足够的铁,以防止妊娠前3个月的IDA而影响胎盘结构和功能及严重缺铁影响胎儿储铁的可能。
②预防早产及低出生体重儿。
③出生时,尤其早产儿断脐不应过早。
(2)合理安排膳食保证食物中有足够的含铁量及良好的铁吸收率,是预防婴幼儿IDA的关键问题。
①婴儿时期膳食的安排。
A,鼓励母乳喂养,至少至4个月,其间不加固体食物。
B.足月儿最晚自4个月开始补铁,每天1mg·kg-1,未成熟儿最晚自2个月开始补铁,每天6mg·kg-1,持续补充至1岁末,最好到2岁。
C.自2~3个月起,于哺乳后喂水果汁或维生素C50~100mg ,以促进铁的吸收。
D.人工喂养者尽量采用婴儿乳方或经煮沸牛奶,鲜牛奶量不应超过750~1000ml·d-1,以减少胃肠道隐性出血。
E.人工喂养宜采用铁强化乳方,5~6个月后采用铁强化谷物补铁。
F.6~7个月以后可以粥内添加鱼或肉泥以供给血红素铁及“内因子”,9~12个月于添加肉末与菜粥的同时供给维生素C和“内因子”。喂给这些固体食物或蛋类时,要与人乳喂哺至少相隔4h,喂给鱼肉等尚可提高蛋白质供应量。
②幼儿时期膳食的安排:此期如不注意膳食安排,缺铁性贫血的发病率亦高,可以从以下原则着手:
A.要保证有足够的动物性蛋白和豆类食物,不仅可供优质蛋白质,铁含量高,吸收率也高。鸡鸭血、猪血也是铁的好来源。豆浆比牛奶供铁量多。
B.每日需摄入足够量的新鲜蔬菜或水果,并于进餐时食用或餐后即刻食用,以供给维生素C而促进铁的吸收。
C.铁强化饼干或其他仪器必须注明含铁量及每日摄入量,可作为点心等食用以补充铁,但必须防止过食以免引起铁中毒。
(3)药物铁预防 如无铁强化食物,足月儿可于3月起给铁,每天16mg·kg-1,早产儿于2月起每天给26mg·kg-1。体重过低的早产儿宜避免更早开始用较大剂量铁剂,以防发生维生素E缺乏性溶血。
(4)预防及治疗各种感染和疾病。
17.1.8 铁强化食品
由于IDA的广泛存在,因此各国都很重视铁强化食品的制备和应用。美国自1941年起即在面粉中强化铁,目前其膳食中约25%铁系另外加入的,瑞典膳食中42%铁来自强化食品。其他如加拿大、英国、日本、印度、泰国、菲律宾和中美各国都在这方面进行了大量研究。我国铁强化仪器的制备也已受到有关各方面的重视而开始起步。
为使铁强化食品起到有效的作用。首先应摸清那些人群最需要补铁,然后选择一种合适的铁剂及适当的食物或食品来进行强化。应对成品进行色香味及保存期限的观察,铁吸收率及利用率的测定,先行试用再推广应用,并建立监测制度以了解其效用及不良反应。
选择强化铁剂必须从生物利用率、加入后食物的色香味和稳定性以及出售价格几方面来考虑。但有时不可兼得。用于强化液体乳方的铁剂较多,且生物利用率高,如硫酸亚铁、枸橼酸亚铁、乳酸亚铁等,但后二者价格较贵。硫酸亚铁也可用以强化粉剂乳方。谷物的强化较困难。正磷酸铁和焦磷酸铁在强化面粉时不变色也无味,但其生物利用率差,价格也较贵。元素铁不论是用氢还原、电解还原或为铁羰络合物,其价格低廉,为目前强化谷物的较好铁剂。但其生物利用率与铁颗粒大小有关,小颗粒(5~10μm)者吸收利用率高,性能稳定。硫酸亚铁可用于强化面包。
婴儿乳方中强化铁一般为每100g加硫酸亚铁15mg,牛乳或乳方中则1000g加硫酸亚铁10~12mg,铁的吸收率约4%,虽不如人乳中铁的吸收率高,但因强化奶粉中铁的总量增加,故其绝对吸收量也随之提高。婴儿谷物粉一般为每1g加硫酸亚铁或小颗粒还原铁0.45mg,平均铁的吸收率4%左右。铁剂与食物的比例应根据具体情况,如人群缺铁程度、食品的每日消耗量以及对食品色香味及稳定性的影响而加以考虑。
智利采用牛血红蛋白强化饼干,认为很理想。
加用铁强化食物后,每日自食物中摄入的总铁量以满足每日需要量为度。国外一些国家经用铁强化食物的防治后,育龄妇女的IDA已自60年代初的25~30%降到70年代的5~10%。
正常人长期进食铁后是否引起铁中毒的问题尚未解决,文献报道的极少数病例,未排除原发性血色病杂合子的可能。
17.2 营养性巨幼红细胞性贫血
营养性巨幼红细胞性贫血又称营养性大细胞性贫血,主要是由于缺乏维生素B12及叶酸所致,常见于婴幼儿时期,也见于孕妇及哺乳妇女,其他年龄较少见,确切的发病率欠详。随着人民生活经济情况的好转,在大中城市此病已属罕见,但在华北,西北,东北和西南等地的农村尚不少见。
17.2.1 病因
(1)有关叶酸及维生素B12的一些问题 肝、肾、坚果、新鲜绿叶与黄叶蔬菜、豆类、柠檬、柑桔及酱果中均富有叶酸,肝中含量最高,约300μg·100g-1,其他肉类食物、新鲜蔬菜,谷类约含10~100μg·kg-1,人乳及巴氏消毒牛乳中叶酸含量仅3.5μg·kg-1,羊乳仅0.6μg·kg-1。。煮沸或罐制能使叶酸含量降低50~95%。孕妇常见轻度叶酸盐缺乏,但不论足月儿或早产儿,其脐血血清叶酸盐浓度的均值较母血高2倍以上。足月儿生后,血清叶酸盐浓度迅速下降,至8周时已明显降低,早产儿更甚。.体内贮存量一般可供一个月的需用,缺乏4个月后,才出现贫血。1972年WHO科学小组推荐每天叶酸需要量0~6个月为40~50μg。7~12个月120μg,1~12岁200μg,13岁以上400μg,妊娠期800μg,哺乳期600μg。
维生素B12在动物性食物如肝、肾、肉类、贝壳类动物及家禽等中含量丰富,其中尤以肝内含量最多(1μg·g-1),蛋及奶中含量较少,蛋3.13μg·100g-1,人乳0.11μg·100g-1,牛乳0.36μg·100g-1。植物类食物中几乎不含维生素B12。维生素B12除在碱性状态下外,一般不被烹调破坏。维生素B12可通过胎盘传给胎儿。正常新生儿储存于肝内的维生素B12,共约为20~25μg。如孕妇于妊娠期间缺乏维生素B12,则新生儿肝内的储存量明显减少,甚至可低至2~4μg。母亲于维生素B12缺乏时,乳中含量亦降低。由于每日排泄量甚少,所以储存量很少于1年内耗尽。成人体内维生素B12储存量约3~6mg,如不进入维生素B12,储存量大约可供造血3~5年。当储存少于5~19%时,可出现巨幼红细胞性贫血。1972年WHO科学小组推荐维生素B每天的需要量0~12个月为0.3μg,1~3岁0.9μg,4~9岁1.5μg,10岁以上2μg.,妊娠期3.0μg,哺乳期2,5μg。
(2)引起维生素B12及/或叶酸缺乏的原因
①摄入不足:A。如母亲饮食单调,缺乏肉类及蔬菜者,其乳汁中维生素B12及叶酸盐含量减少,婴儿以此长期喂养,不加辅食,则易发生维生素B12及叶酸盐缺乏。B.长期主食奶粉或煮沸后牛乳或以羊乳喂养者,易得叶酸盐缺乏;C。长期偏食,一般见于年长儿及成人。
②需要增加;婴儿尤其早产儿生成发育快,需要量多。婴儿期饮食能勉强维持维生素B12及叶酸盐的需要。孕妇及哺乳期需要量增加,如摄入不足则易导致二者的缺乏。
③疾病因素;感染、疟疾及慢性溶血时,需要量增加,感染又影响吸收。
④维生素C缺乏;维生素C缺乏时,不能使叶酸变为具有活性的四氢叶酸(tetrahydrofolic acid,THFA)。叶酸能代替维生素C参与酪氨酸代谢,当维生素C缺乏时,可引起机体对叶酸的需要量增加,造成叶酸不足。
17.2.2 发病机理
叶酸和维生素B12均为细胞核内DNA合成的必需物质。细胞的增殖分裂,关键是DNA的复制和加倍。DNA是由2条多核苷酸链组成,其基本单位是由4种不同的碱基单核苷酸组成的聚合体,四种碱基为腺嘌呤、鸟嘌呤、胸腺嘧啶和胞嘧啶。
叶酸在肝内经二氢叶酸还原酶的作用,变为具有活性的THFA。THFA是体内转移一碳基团的辅酶。这些基团来自一些氨基酸的分解代谢和甲酸等化合物,可连接在THFA的分子上,并可转移至其它中间代谢物上,参与核酸等重要化合物的合成。如参与嘌呤的合成、嘧啶的生物合成、氨基酸的转化以及甲酸盐的生成和利用。
维生素B12在人体主要参与四个重要代谢反应:①使无活性的甲基THFA变为有活性的THFA,提高了叶酸利用率;②促进叶酸进入细胞内;③参与脱氧胸腺嘧啶核苷酸的生成。由上可见,维生素B12缺乏是通过叶酸代谢障碍,引起DNA合成失常,故其引起贫血的临床表现和形态学变化,难与叶酸缺乏引起的贫血区别。这说明为什么维生素B12可使叶酸缺乏的贫血好转,以及大量叶酸能改变维生素B12缺乏的血液学变化的现象;④维生素B12能促使脂肪代谢产物参与三羧酸循环,这一作用与神经髓鞘中脂蛋白的形成有关,因而能保持中枢和外周有髓鞘的神经纤维的完整功能。维生素B12缺乏时,上述神经纤维发生病变,因而出现精神神经症状。因叶酸不参与此代谢。不能改变维生素B12缺乏所致的神经系统损害。叶酸增加造血细胞对维生素B12的利用,故可加剧神经系统的症状。
叶酸和维生素B12缺乏时,嘌呤和胸腺嘧啶合成不足,DNA复制受阻。复制时由于α聚合酶的活力显著降低,使新合成的DNA短片在形成长链时发生障碍,在重螺旋化时易受机械损伤,染色体断裂,细胞死亡而形成无效造血。DNA合成障碍也使细胞分裂受阻,DNA含量多,加之螺旋化不佳,故呈现细胞核大,染色质网状结构。同时由于蛋白质及RNA合成相对较好,而导致胞浆量多,核浆发育不平衡的巨幼样变。此变化也累及骨髓中的粒及巨核细胞系统及体内细胞代谢快速的共他组织如胃肠道粘膜等。由于以上机理,临床上可出现贫血,神经精神症状及消化系统等症状及典型的血及骨髓象。
17.2.3 临床表现
发病缓慢,小儿中以6~18月婴儿常见。若出生时为早产儿,则由于其先天的叶酸贮存量较少,生长发育快,尿中的排出量相对较多,又由于奶类消毒后,叶酸破坏,进入量较少,所以出生体重较低者可于生后6~10周即发病。
(1)一般症状 小儿病例初起时表现安静,不哭不闹。面色逐渐苍白或因色素过度沉着、轻度贫血等因素,面色可为蜡黄。颜面因轻度浮肿而呈虚胖样。头发黄而稀疏。成人病例可有头昏、耳鸣、心慌等。
(2)消化系统症状 出现较早。厌食、恶心、呕吐较常见。时有稀便。舌面可光滑,舌乳头由舌尖沿两侧缘逐渐向中心萎缩,或舌乳头充血粗糙。
(3)神经精神方面症状 小儿较成人常见。有表情呆滞、眼神发直、对周围反应迟钝、嗜睡、智力及动作能力均可有倒退。另外,可有手足无意识的运动、头、舌、唇及肢体震颤。部分病例可出现膝反射亢进及踝阵挛。重症时,肢体张力可增高。少数病例可能由于9、10对颅神经功能障碍而出现声音嘶哑或咽部有痰声。植物神经系统受累时,可出现少泪、无泪、少汗等症状。此等症状多见于维生素B12缺乏。
(4)造血器官 肝肿大远较脾肿大为多,肿大程度亦较脾脏为著,淋巴结肿大不明显。
(5)其他 因贫血可引起心脏扩大、心脏杂音,皮肤可因血小板少而出现紫癜,红细胞寿命可缩短而出现黄疸。
17.2.4 实验室检查
(1)血象 贫血多较严重,红细胞减少较血红蛋白减少为著,MCV及MCH>正常,MCHC正常;红细胞轻度大小不均,大者较多,着色较深,中央苍白区不显,常见卵圆形红细胞;网织红细胞数常低于正常。白细胞总数稍低或正常,淋巴细胞相对增多,粒细胞减少,胞体大,核染色质疏松,核呈右移,可见巨多节核中性粒细胞。严重病例血小板数可减少。
(2)骨髓象 有核细胞数可轻度增加、正常或减少。各期幼红细胞呈巨幼变,如原红及早幼红细胞增多,则更有诊断意义。白细胞分类多接近正常,淋巴细胞有时可相对增加。中性粒细胞中可出现巨中幼、巨晚幼或巨杆状核中性粒细胞。重症病例巨核细胞数可减少,形态也有改变。
(3)特殊试验
①血清维生素B12测定。在维生素B12、叶酸及缺铁时均可减低。
②维生素B12吸收试验,如吸收差,则尿中带有同位素标记的维生素B12的排泄量减少。
③组氨酸耐量试验(formiminoglutamic acid试验),组氨酸在体内转化为N-亚氨基甲基谷氨酸(FIGLU)后,需要四氢叶酸进一步降解为谷氨酸。如给患者一次组氨酸负荷,由于叶酸缺乏,FIGLU堆积,尿中排出量增加。但本试验除可有假阳性和假阴性外,在叶酸及维生素B12缺乏时均可阳性。
④血清叶酸盐测定,方法学尚不稳定。
⑤红细胞内叶酸盐测定,目前认为较可靠。
血清维生素B12含量降低、红细胞或血清叶酸盐含量正常或增高,提示维生素B12缺乏;血清维生素B12含量正常,红细胞或血清叶酸盐含量降低,提示叶酸盐缺乏;以上同时降低可见于维生素B12及/或叶酸缺乏。
17.2.5 诊断
应注意年龄、喂养史及有无可导致维生素B12及叶酸缺乏的疾病。神经系统症状及体征为本贫血特有的表现。本病血象中,血红蛋白降低不如红细胞降低明显,红细胞形态大,色素充盈良好,与另一种常见的缺铁性贫血不同。骨髓象的改变为确诊的重要依据,但骨髓检查必须在治疗前进行,应用叶酸或维生素B123h后骨髓象即起变化,48h后骨髓象的诊断意义已很小。
经诊断为本病后,最好能明确系维生素B12缺乏或叶酸缺乏。如不能进行上述特殊试验时,可进行治疗性诊断。患者必须无明显感染、肾脏无恶性疾病,不进含叶酸盐高的食物如肉类、内脏、新鲜绿叶或黄叶蔬菜及果汁,每日给予维生素B121~5μg肌注或叶酸50~100μg口服,如应用上述维生素之一后,网织红细胞迅速上升,即证明为该物质缺乏。
小儿营养性巨幼红细胞性贫血最易与有明显神经系统症状的营养性混合性贫血相混淆。营养性混合性贫血时,红细胞大小不均相差悬殊,大红细胞中央苍白区增大,骨髓象中同时具有幼红细胞及粒细胞的巨幼变及幼红细胞中因缺铁而引起的血红蛋白形成不足现象。
本症尚须与下列情况鉴别:
(1)可以引起叶酸缺乏的疾病,如先天性选择性叶酸吸收障碍、慢性腹泻、胃切除、小肠切除、空肠疾患;药物如抗痉挛药、抗代谢药及抗结核药等引起的叶酸缺乏;某些先天性酶缺陷及婴儿期感染所致的叶酸代谢障碍;慢性肝肾疾患引起的叶酸丢失过多等。
(2)可以引起维生素B12缺乏的疾病,如幼年型恶性贫血、胃切除、萎缩性胃炎,肠盲端综合征、脂肪泻、回肠疾患及运钴铵素蛋白Ⅱ缺乏等。
(3)能引起骨髓巨幼变的疾病如红血病、红白血病、白血病、增生型再障、溶血性贫血及肿瘤等。
17.2.6 治疗
(1)加强护理,去除同时存在的其他疾病。
(2)选择易消化、富有蛋白质、叶酸及维生素B12的食物。
(3)药物治疗,如明确系叶酸或维生素B12缺乏时,可给相应药物治疗。如不明确时,神经系统症状以应用维生素B12的收效较佳,单用叶酸反有加重症状的可能。若同时有维生素B12及叶酸的缺乏,应用其中的一种有可能使另一种更为缺乏,故宜两药同时应用。
①叶酸 剂量为5~10mg·d-1,治后1~2日食欲精神即改善,无效红细胞生成逆转,网织红细胞逐渐上升,至4~7天达高峰,于2~6周后恢复正常。治后24~48h,白细胞及血小板计数即上升。骨髓中除巨晚幼粒等细胞可持续存在数日外,于治疗48h后已很少有其他变化。叶酸的疗程常需数月,即用至体内年老红细胞均被新生富于叶酸的红细胞替代为止。但去除病因及改善饮食是保证不再复发的重要措施。服用叶酸的同时需服用维生素C。
②维生素B12 剂量为25~100μg,症状严重时可每日1次肌注,否则可每周2~3次肌注,至网织红细胞恢复正常时为止。如病因暂时不能去除,则需减量,维持至红细胞及血红蛋白恢复正常而停药。血及骨髓象的恢复过程与叶酸缺乏相似,神经系统症状恢复较慢。
如治疗后不出现上述反应,需考虑有无诊断错误、感染及并发症可能。
③血象恢复期间宜加用铁剂以弥补造血旺盛后铁的不足。
④重症患者应加用氯化钾0。25~0。5g·-1 ,每日3次治疗以防由于心肌处于缺氧状态,在治疗开始48h内,红细胞系统生成明显增加,血钾突然下降而可造成猝死的可能。
(4)输血 仅用于严重病例。
17.2.7 预防
主要针对病因进行。
17.3 微量元素、矿物质与贫血
17.3.1 缺铜性贫血
由于缺铜常与缺乏其他营养素同时存在,且症状较轻,所以报道较少。
铜是体内微量元素之一,在人体内主要分布于肝、心、脾、肾、脑和血液中,其中约10%储存于肝内。铜为构成含铜酶的生要成分。这些酶的主要功能是参与氧化还原反应、组织呼吸、铁的吸收和利用、红细胞生成、保持骨骼和胶原组织正常结构的功能等。铜主要在十二指肠近端吸收。食物中的铜仅约1/3被吸收,其吸收受食物成分影响,如锌、镉、硫酸盐、植酸盐等可干扰或妨碍铜的吸收。除一部分铜以肝铜蛋白的形式储存于肝内外,另一部分合成铜蓝蛋白,输送入血液以满足各器官组织对铜的需要。铜主要从消化道排出,以胆汁及消化液中排出最多。
牛肝、紫菜、黄豆、核桃、花生、猪肝等含铜量较高,鸡蛋、谷类、蔬菜含铜量低,牛乳及人乳含铜量更低(分别仅0.03mg及0.05mg·100ml-1).铜的摄入量成人为1.55mg·d-1,小儿为0.09 mg·kg-1·d-1。
(1)病因
①摄入不足:婴儿虽自母体得来一定量的铜,可供生后6个月的需要。但由于人乳及牛乳含铜量低,所以婴儿是处于铜缺乏的边缘状态。消化道手术后或早产儿长期用静脉营养均可引起铜缺乏。营养不良者常并发本病。
②吸收障碍:如慢性腹泻伴有低蛋白血症者,长期口服大剂量锌或碱性药物时,均可发生本病。
③生长发育:未成熟儿生长发育快,体内铜储量不足,如摄入量不足,常可于3个月时即发病。
(2)发病机理 铜缺乏所致的临床表现主要与含铜酶活力降低,其中尤其是铜蓝蛋白(铜氧化酶)降低有关。铜蓝蛋白含有血浆中96%的铜,铜蓝蛋白可促进铁的吸收和使肝内储铁的释放。因而缺铜时,产生缺铁样的血红素合成减少而形成低色素性小细胞性贫血。但骨髓中环形铁粒幼红细胞增加,铁剂治疗无效。
铜有促进中性粒细胞的分裂和增殖作用,铜缺乏可引起骨髓中性粒细胞成熟代谢障碍,寿命缩短而导致中性粒细胞减少。
含铜氧化酶有维持血管纤维蛋白和胶原纤维结构的完整性作用。缺铜时,血管可广泛性扩张或因弹力纤维层破裂而致血管破裂。
单胺氧化酶等有维持结缔组织的骨髓胶原纤维稳定性的作用。缺铜时此酶活力降低可引起骨髓的病理改变而致X线表现异常。
酪氨酸酶催化酪氨酸转变为多巴的作用。后者与黑色素合成有关,缺铜时,此酶活性降低。黑色素合成减?
■[此处缺少一些内容]■
作以下检查:
①血浆铜蓝蛋白:新生儿时铜蓝蛋白含量很低,以后逐渐增高,至12岁时达成人水平。成人正常值为250~370mg·L-1,〈150mg·L-1提示缺铜。
②血清铜:小儿血清铜的正常值为12~21μmol·L-1,<11μmol·L-1提示缺铜。
③红细胞铜:其正常值为0.9~1.5μg·10-10红细胞,缺铜时常降至0.462μg·10-10红细胞。
尿铜,发铜测定有参考意义。铜剂试服有效时,诊断亦可成立。
(5)治疗
①去除病因。
②铜剂治疗:1%硫酸铜,2~3mg·d-1(含元素铜400~600μg·d-1),治疗有效者,血象及临床症状很快获得改善。不能口服者,可改为皮下注射。
(6)预防 婴儿应及时添加含铜量较高的食物。早产儿自2个月起每日口服硫酸铜1~5mg。成人需长期静脉营养者应于每升营养液中加硫酸铜1.65mg。每升含铜0.4mg,每日输注3L可得铜1.2mg·d-1。设体重为60kg,则可获得铜20μg·kg·d-1 (推荐供给量0.5~1.5mg·d-1,AMA1979)。近年来国外用铜强化牛奶或奶粉来预防未成熟儿铜缺乏。
原发病应加预防。
17.3.2 钴与贫血
在体内,钴主要通过形成维生素B12发挥生物学作用及生理功能,无机钴盐也有直接生化刺激作用。钴主要存在于肝、肾,是人体微量元素之一。钴有刺激造血的功能,其机理可能是通过:
(1)促进胃肠道内铁的吸收,并加速储存铁的动用,使之较易被骨髓利用。
(2)钴能抑制细胞内很多重要呼吸酶。引起细胞缺氧,使促红细胞生成素合成增加,同时钴盐可增强亚铁血红素氧化酶活性,增加血红蛋白的破坏,并亦能直接抑制亚铁血红素的合成,使血红素的合成减少,破坏增多。上述的最后结果为代偿性的造血功能增加。
(3)钴能通过维生素B12参与核糖核酸与造血有关物质的代谢,钴缺乏后可引起巨幼红细胞性贫血。
最近研究证明钴盐对炎症性贫血、生物引起的贫血、婴儿及儿童一般性贫血、地中海贫血和镰状细胞性贫血,都有一定生血治疗作用。
17.3.3 其他微量元素与贫血
锰 锰为DNA、RNA多聚酶的组成部分,它参与蛋白质代谢,可能与遗传信息的传递有关。锰具有激活DNA和RNA 聚合酶活力的作用,锰对造血有重要作用,动物胚胎在肝造血期中,肝内已含较多锰,贫血动物给以小剂量锰后可使血红蛋白、中幼红细胞、成熟红细胞及循环血量增多。锰能改善机体对铜的利用,锰与卟啉的合成也有关。
锌 体内含锌酶有40余种,如碱性磷酸酶、碳酸酐酶、乳酸脱氢酶及多种还原酶等。有些含锌酶在核酸代谢及蛋白合成中起重要作用。锌还与中性粒细胞,单核细胞及T淋巴细胞的功能有关,还可保护红细胞免遭某些溶血素的作用。
缺锌可由摄入不足、吸收不良、排泄增加或遗传性吸收的障碍而引起的。
在谷类食物为主的一些国家,由于谷类食物中含有较多的6-磷酸肌醇与锌结合形成难溶性复合物,阻碍锌的吸收,导致体内缺锌而引起一种综合征,表现为生长发育停滞,第二性征发育不合,性功能低下,肝脾肿大,常伴发缺铁性贫血及异食癖。
钼 钼是人体内黄嘌呤氧化酶等酶的重要成分。黄嘌呤氧化酶对人体内嘌呤化合物的代谢及铁的代谢有密切关系,能催化肝脏中铁蛋白释放铁,使血浆中Fe2+氧化成Fe3+,加速铁与β1球蛋白的结合,运送铁以供组织作用。
硒 含硒酶谷胱甘肽过氧化物酶为一组织抗氧化物质。缺乏此酶何产生新生儿溶血性黄疸。
钛、铬、钡都有刺激造血作用。其机理均为妨碍体内还原氧化系统,引起组织缺氧刺激骨髓造血功能。
铅、砷等由于污染,中毒时可引起贫血,铅主要影响卟啉代谢,并能干扰铁与原卟啉结合所需的血红素合成作用。砷可以干扰细胞呼吸及分裂。
17.3.4 矿物质与贫血
严重低磷血症(血清磷〈0.323mmol·L-1〉可由长期静脉营养、糖尿病性酮中毒、透析时磷与磷酸盐结合物质的结合、饥饿恢复期、严重烧伤后合并利尿状态、低磷饮食、持续呼吸性碱中毒不引起。其临床表现可有感觉异常、抽搐、舞蹈病、共济失调、震颤、昏迷、面无力、横纹肌溶解、呼吸衰竭、充血性心肌病、骨骼疼痛及可能的肝细胞损害,糖酵解受阻而导致红细胞内ATP及2,3-DPG含量减低,对氧亲和力增加,红细胞变硬产生溶血。当ATP低于正常的15%时,红细胞呈小球形,也可引起溶血。低磷血症时,血中性白细胞的趋化、吞噬功能、杀菌力均减低,患者易有感染。
17.4 维生素缺乏与贫血
17.4.1 维生素C缺乏
维生素C缺乏时,叶酸在体内还原为具有生物活性的四氢叶酸受阻。叶酸能代替维生素C参与酪氨酸代谢,维生素C缺乏时,叶酸需要量增加。由于以上两方面的原因,维生素C缺乏可引起巨幼红细胞性贫血。维生素C缺乏引起贫血另一原因为出血。
17.4.2 维生素E缺乏
维生素E缺乏多发生在早产儿及低出生体重儿,尤其在出生体重低于1500g者易见。
其原因有摄入不足,吸收不良,运转维生素E的脂蛋白量降低,生长发育迅速时,维生素E的需要量增加,食物中含有大量不饱和脂肪酸,饮食中不饱和脂肪酸的增加,可增加红细胞膜不饱和脂肪酸的含量。
维生素E为抗氧化剂,有防止红细胞膜上不饱和脂肪酸被氧化的作用。维生素E缺乏时,红细胞膜上脂质易被氧化,尤其在遇到过氧化氢,巴比妥酸、维生素K及低出生体重儿服用较大量铁剂以预防缺铁性贫血时。
本症常发生在早产儿和低出生体重儿,尤其是人工喂养者,于生后6~10周出现维生素E缺乏综合征,症状包括不安宁、惊醒、浮肿、轻度溶血等。血红蛋白可低至70~90g·L-1,红细胞大小不均,异形,破碎细胞,偶有球形,血小板常增多,过氧化氢试验呈阳性,维生素E测定常〈10μmol·L-1。
正常婴儿维生素E的需要量各人报道并不一致。用乳类喂养者为0.4 mg·d-1,用其他食物喂养者为1.5mg·d –1。
早产儿的维生素E含量明显低于足月儿,至生后2~3个月后,早产儿肠道吸收的量于达到足月儿水平,维生素E含量才升高。由于维生素E缺乏而引起的严重贫血并不常见,但为了尽量减少此病的发生,对低出生体重儿应给予维生素E以作预防,剂量为15~25mg·d-1,出生体重低于1000g者增加到50mg·d–1,可使维生素E维持到正常水平。有胰腺囊性纤维化和慢性脂肪吸收不良的患儿,应增加到100mg·d–1。肌注比口服效果好。肌注为隔日一次,共用2~3次。
17.4.3 其他维生素缺乏与贫血
其他维生素缺乏也可引起贫血,如维生素A、B2缺乏。另有原因不明的维生素B1反应性巨幼红细胞性贫血。维生素B6参与δ-ALA合成酶的代谢,缺乏时血红素合成发生障碍,出现小细胞性低色素性贫血,临床上极少见。另一种维生素B6反应性贫血(小细胞性低色素性),能被大剂量维生素B6所纠正,其发病机理可能为线粒体内铁的利用障碍,血红素离开线粒体时需要维生素B6的作用。尼克酸缺乏时(由于腹泻等)可引起贫血。
17.5 蛋白质-能量营养不良与贫血
极度蛋白质-能量营养不良如夸希奥克(kwashiorkor)时,可能有轻度贫血,但血红蛋白也有低至50~60g·L-1之报告。有时在治疗后2~3周。血红蛋白由于血浆容量增加及/或骨髓红系暂时性增生低下而进一步下降。
贫血常为正色素性或大细胞性,少数为小细胞性。引起贫血的原因可有:
(1)蛋白质缺乏后可使促红细胞生成素产生减低。
(2)叶酸盐缺乏,其发生率可高至28~50%。但未见维生素B12缺乏之证据。
(3)铁缺乏较为少见,系由于铁吸收减低所致。由于蛋白质合成不足,运铁蛋白合成不足,因此血清铁及总铁结合力均降低,但前者降低较后者为少,因此运铁蛋白饱和度增加。
(4)溶血属于轻度,对贫血的发生不起重要作用。
(5)维生素E缺乏,对某些正色素性、巨幼红细胞性贫血患者用维生素E治疗有效。
除贫血外,患者白细胞计数常正常,泥膏样严重营养不良者淋巴细胞计数可增高。四唑氮蓝(NBT)试验、中性粒细胞吞噬力正常,杀菌力及趋化性有时有缺陷。补体降低随营养不良程度而异。B细胞功能正常,T细胞计数及功能均降低。出血倾向少见,出血是由维生素K缺乏或DIC引起。
参考文献
1.Oski FA et al:Ped,Clin NAm27(2):237,1980
2.Agrawal RMD et al:Acta Pediatr,Scand 72(4):545,1983
3.Hallberg L:Seminars in Hematol,.19(1):31,1982
4. JacobsA:Clinics in Hematol, 11(2):353,1982
5.廖清奎综述:国外医学输血及血液学分册 4(3):155,1981.
6.Dallman PR:Seminars in Hematol, 19(1):19,1982
7. OskiFA et al:Ped71(6):877,1982
8. CavillI: Clinis in Hematol, 2(2):259,1982
9.施智桦综述:国外医学儿科学分册 (4):177,1984
10 .马伴吟等:中华儿科杂志 21 (5):25 7,19 83
11 .全国小儿血液病座谈会:中华儿科杂志 21 (2):10 3,19 83
12 .刘湘云:小儿膳食的合理安排以预防缺铁性贫血,上海第一医学院附属儿科医院全国小儿缺铁性贫血防治学习班讲义。
13 .邵文斌;维生素B12 ,医师进修杂志 7(8):4,19 84
14 .叶彼德:营养性巨幼红细胞性贫血 儿科学(宋名通主编),第2版,23 8页,人民卫生出版社,北京,19 84
15 .周朗等:巨幼细胞性贫血 小儿临床血液病学,14 6页,天津科学技术出版社,天津 19 83 。
16 .孔祥瑞:必需微量元素的营养、生理及临床意义 安徽科学技术出版社,安徽,19 82
17 .潘恩潭:医师进修杂志 7(8):7,19 84
18 . WilliamsDM:Seminars in Hematol 20 (2):11 8,41 98 3
19 . LascariAD:Hematologic Manifestations of Childhood Diseases,p29 7,Thieme-Stratton,New York,19 84
20 .金勒立等:上海第一医学院学报 9(2):11 3,19 82
21 .张伟利:国外医学儿科学分册 (1):5,19 83
