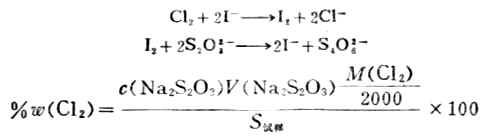(一)基本原理
碘量法是利用I2的氧化性和I-的还原性进行滴定的分析方法。
I2+2e-φ2I-φ=0.535V
从φ值可知,I2是一种较弱的氧化剂,而I-是中等 强度的还原剂。低于φ电对的还原性物质如S2-,SO2-3,AsO3-3,SbO3-3,维生素C等,能用I2标准溶液直接滴定,这种方法叫直接碘量法或碘滴定法。高于φ电对的氧化性物质如Cu2+,Cr2O2-7,CrO2-4,MnO2-4,NO-2,CL2,H2O2,漂白粉等,可将I-氧化成I2,再用Na2S2O3标准溶液滴定生成的I2。这种滴定方法叫间接碘量法或滴定碘量法。
1.直接碘量法
用直接碘量法来测定还原性物质时,一般应在弱碱性、中性或弱酸性溶液中进行,如测定AsO3-3需在弱碱性NaHCO3溶液中进行。
![]()
若反应在强酸性溶液中进行,则平衡向左移动,且I-易被空气中的O2氧化:
4I-+O2+4H+→2I2+2H2O
如果溶液的碱性太强,I2就会发生歧化反应:
![]()
I2标准溶液可用升华法制得的纯碘直接配制。但I2具有挥发性和腐蚀性,不宜在天平上称量,故通常先配成近似浓度的溶液,然后进行标定。由于碘在水中的溶解度很小,通常在配制I2溶液时加入过量的KI以增加其溶解度,降低I2的挥发性。直接碘量法可利用碘自身的黄色或加淀粉作指示剂,I2遇淀粉呈蓝色。
2.间接碘量法
间接碘量法测定氧化性物质时,须在中性或弱酸性溶液中进行。例如,测定K2Cr2O7含量的反应如下:
Cr2O72-+6I-+14H+→2Cr3+3I2+7H2O
I2+2S2O22-→2I-+S4O2-6
若溶液为碱性,则存在如下事反应:
I2+S2O22-+10OH-→8I-+2SO42-+5H2o
在强酸性溶液中,S2O2-3易被分解:
S2O22-+2H-→S↓+SO2+H2O
间接碘量法也用淀粉作指示剂,但它不是在滴定前加入,若指示剂加得过早,则由于淀粉与I2形成的牢固结合会使I2不易与Na2S2O3立即作用,以致滴定终点不敏锐。故一般在近终点时加入。应用碘量法除须掌握好酸度外,还应注意以下几点:
(1)防止碘挥发。其办法有:
①加入过量的KI,使I2变成I-。
②反应时溶液不可加热。
③反应在碘量瓶中进行,滴定时不要过分摇动溶液。
(2)防止I-被空气氧化。方法有:
①避免阳光照射。
②Cu2+、NO-2等能催化空气对I-的氧化,应该设法除去。
③滴定应该快速进行。
(二)碘量法应用示例
1.维生素C含量测定
维生素C分子中含有烯二醇基,易被I2定量氧化成含二酮基的脱氢维生c,故可用直接碘量法测定定含量。
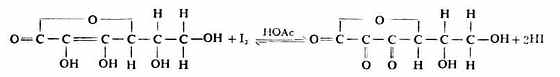
从上式可以看出,在碱性条件下有利于反应向右进行,但维生素C的还原性很强,在碱性环境中易被空气中的O2氧化,故滴定时加一些HOAc使滴定在弱酸性溶液中进行,以减少维被空气氧化所造成的误差。操作如下:
(1)配制0.05mol·L-1I2标准溶液称取6.5gI2和12.5gKI,置于小研钵中,加水少许,研磨至全部溶解后移入棕色瓶中,加水500ml,摇匀后避光阴凉处放置过夜。
(2)标定I2溶液浓度吸取25.00mlI2溶液置于250ml锥形瓶中,加水50ml,用标定过的Na2S2O3标准溶液滴定至浅黄色后,加入0.2%淀粉溶液2-4滴,继续用Na2S2O3溶液滴定至蓝色恰好退去,根据下式计算I2溶液的浓度。
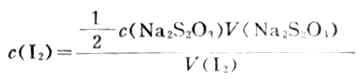
(3)维生素C含量的测定准确称取约0.2g维生素C,放入锥形瓶中,加入新蒸过的蒸馏水50ml2mol·L-1HOAc使其溶解,加淀粉指示剂1ml,立即用I2标准溶液滴定至浅蓝色,按下式计算维生素C的含量
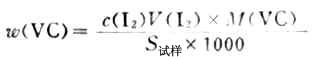
2.漂白粉中有效氯含量的测定
漂白粉的主要成分为CaCL(OCL)和CaCL2的混合物,前者与酸反应放出CL2具有漂白、杀菌和消毒作用,故称之为有效氯。漂白粉的质量是以有效氯的含量为衡量标准的。
CoCl(OCl)+2H+→Ca2++HOCl+HCl
HOCl+HCl→Cl2+H2O
操作步骤如下:
(1)配制0.1mol·L-1Na2S2O3标准溶液 称取约2.5g Na2S2O3溶于500ml新煮并冷却的蒸馏水中,加少许Na2CO3,将溶液贮于棕色瓶中,在暗处放一周后标定其浓度.
(2)标定Na2S2O3标准溶液浓度准确称取约0.15g在130-140℃烘干的分析纯K2Cr2O7,加水溶解后加过量KI和一定量的硫酸,加水稀释至约100ml。用待标定的Na2S2O3溶液滴定至呈黄绿色后,滴加淀粉指示剂,继续滴之下至溶液蓝色消失而呈亮绿色为止。根据下式计算溶液的浓度:
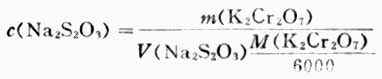
3.漂白粉中有效氯的测定 在漂白粉试样的酸性溶液中,加入过量的KI,然后用Na2S2O3标准溶液滴定生成I2,从而计算出有效氯含量。