组织学
第一章 组织学绪论
一、组织学发展概况及研究内容与意义
组织学(histology)与胚胎学(embryology)是相互关联的两门学科,我国医学教育习惯地将它们列为一门基础课程。组织学是研究机体微细结构及其相关功能的科学,它是以显微镜观察组织切片为基本方法的,故又称显微解剖学(microanatomy)。从细胞的发现和细胞学说的建立起始,组织学发展迄今为已有300余年历史。英国人Hooke(1635~1703)用放大镜观察软木塞薄片,首先描述了细胞壁所成的小室,称之为“cell”。意大利人Malpighi(1628~1694)用放大镜观察了脾、肺、肾等的组织结构,荷兰人Leeuwenhoek(1632~1723)用较高倍的放大镜发现了精子、红细胞、肌细胞、神经细胞等,荷兰人Graaf(1641~1673)观察报道了卵泡。法国人Bichat(1771~1822)用放大镜观察肉眼解剖的组织,并于1801年发表的“膜的研究”一文,首次提出“组织”(法文tissu,原意为编织物)一词,还将人体的组织分为21种。德国人Meyer(1819)又将组织重新分类为8种,并创用Histology一词。Brown(1831)进而发现了细胞核,对细胞的结构有了初步的认识。在有机体结构长期研究和争议的基础上,德国学者Schleiden(1804~1881)和Schwann(1810~1882)于1838~1839年分别指出细胞是一切植物和动物的结构、功能和发生的重要单位,创立了细胞学说,成为组织学、胚胎学、生理学、病理学等生命科学发展的重要里程碑,被誉为是19世纪自然科学的三大发现(细胞学说、物质和能量守恒定律、达尔文进化论)之一。此后不久,德国学者Virchow(1821~1902)于1858指出细胞只源于细胞,细胞损害是一切疾病的基础,建立了细胞病理学说,使细胞学说更趋完善。19世纪中期以后,随着光学显微镜、切片技术及染色方法的不断改进与充实,推进组织学的继续发展。本世纪初至中期,陆续制成相差显微镜、偏光显微镜、暗视野显微镜、荧光显微镜、紫外光显微镜等特殊显微镜,并用之于组织学研究;与此同时,组织化学、组织培养、放射自显影等技术也渐建立和完善并广泛应用,组织学研究更趋深入,资料日益丰富。本世纪40年代电子显微镜问世,并不断改进,至今已广泛用于观察细胞和组织的微细结构及其不同状态下的变化,使人类对生命现象结构基础的认识深入到更微细的境界,其中许多重要资料已列为现代组织学的基本内容。
我国组织学研究起始于本世纪之初,组织学是从人体解剖学分化出来的一门较年轻的科学。我国老一辈组织学家如马文昭(1886~1965)、鲍鉴清(1893~1982)、王有琪(1899~)、张作干(1907~1969)、李肇特(1913~)、薜社普(1917~)等,他们在学科建设、科学研究和人才培养等方面做出了历史性贡献。
近30年科学技术发展更为迅猛,许多新技术、新设备不断涌现并用之于细胞学和组织学的研究,诸如免疫细胞化学术、单克隆技术、细胞分离术、细胞融合术、显微分光光度计、图像分析仪与立体计量术、同位素示踪术、流式细胞术、蛋白质和核酸的分离提取及原位检测、原位杂交等核酸分子杂交术、X-射线衍射技术、X-射线显微分析术,以及分子重组与基因工程等。这些新技术大多与计算机技术相结合,对细胞进行微观和微量的定性和定量分析,使组织学的研究进入更深入而广阔的境地。
组织(tissue)是由细胞(cell)和细胞间质(intercellular substance)组成,众多细胞由细胞间质组合在一起构成一细胞群体。细胞是组织的结构和功能单位,高等动物和人体的细胞有成百上千种类型,各种细胞具有一定的形态结构特点,合成与功能相关的特殊蛋白质,表达某种代谢特点和功能活动,即为细胞的表现型(phenotype)。细胞间质是由细胞产生的非细胞物质,包括纤维、基质和不断流动的体液(血浆、淋巴、组织液等),它们参与构成细胞生存的微环境(microenvironment),起支持、联系、营养和保护细胞的作用,对细胞的分化、运动、信息沟通也有重要影响。组织微环境的稳定是保持细胞增殖、分化、代谢和功能活动的重要条件,微环境成分的异常变动也可使细胞发生病理变化。组织有多种类型,每种组织具有某些共同的形态结构特点和相关的功能。一般传统性将组织分为四种,即上皮组织、结缔组织、肌组织和神经组织,称为基本组织(primary tissue)。但现代组织学的研究愈来愈多地发现,一种组织内的细胞结构和功能往往是多种多样的,它们的起源也不同;因此应认识到,组织分类是一种归纳性的相对意义的概念,不能机械僵化地理解。几种组织相互结合,组成器官(organ)和系统(system),人体的组成包括神经、内分泌、免疫、循环、皮肤、感官、消化、呼吸、泌尿、生殖等系统。
医学组织学的研究对象是人体,但人体材料来源受限,尤其是许多实验性研究的开展,需选用实验动物为材料。应用显微镜观察机体的组织结构及其形态演变,称为描述组织学。一般光学显微镜下所见的结构,称光镜结构;电子显微镜下显示的结构,称超微结构(ultrastructure)研究不同动物种系的组织结构和功能的,称为比较组织学。应用实验方法研究组织结构与功能的动态变化、理化因子或生物因子的调节或影响,以及致病、致癌等机理,秒为实验组织学。从分子水平探讨细胞和组织的功能及其异常变化的机理,则属分子生物学。
不言而喻,学习医学科学必须首先熟悉人体的结构、组成及其基本生命现象,组织学、从微观水平阐明机体的结构与相关功能,无疑是医学教育的重要入门课程之一,它为生理学、生物化学、免疫学、病理学以及临床医学等的学习奠定坚实基础。组织学是以微细结构的形态描述为其基本内容,但随着生命科学的研究不断深入,现代组织学的内容与60年代相比已发生巨大变化。它的内容不断充实、更新和扩展,不仅形态观察更微细深入,而且涉及的领域更为广阔,从整体水平、细胞水平和分子水平探索许多复杂生命现象的物质基础以及环境与生物体的相互关系;不仅与现代生物学和医学的许多重大理论进展相关,而且与人类社会面临的众多实际问题和疾病防治密切相关。诸如:细胞增殖与分化的调控,细胞突变、癌变与逆转,细胞运动与迁移,细胞识别与通讯,细胞与组织的移植,细胞与组织的衰老,细胞与免疫、组织与器官的再生,神经调节与体液调节,环境污染与组织病变等等。这些问题的研究与解决,都需要多学科的密切协作和高技术的综合应用,组织学也处于当代生命科学各学科相互交叉的网络中,与分子生物学、细胞生物学、生理学、生物化学、生物物理学、免疫学、病理学、肿瘤学、环境毒理学等,理论上相互关联渗透,技术上相互引用促进,关系日益密切。在基础医学各门课程的教学中,处处可看到现代医学的这种发展势头。
二、组织学研究方法
(一)一般光学显微镜术
应用一般光学显微镜(简称光镜)观察组织切片是组织学研究的最基本方法。取动物或人体的新鲜组织块,先用固定剂(fixative)固定(fixation),使组织中的蛋白质迅速凝固,防止细胞自溶和组织腐败。常用的固定剂如洒精、甲醛、醋酸、苦味酸、四氧化锇等,一般常将几种固定剂配制成混合固定液,以抵消或减弱单种固定剂对组织的收缩或膨胀等缺点,达到更好固定效果。固定后的组织块(约3~5mm3大小)用石蜡、火棉胶或树脂等包埋(embedding)成硬块,以切片机(microtome)切成5~10μm厚的组织切片(tissue section),切片贴在载玻片上经脱蜡等步骤后进行染色。组织块也可立即投入液氮(-196℃)内快速冻结,用恒冷箱切片机(cryostat)制成冷冻切片(frozen section),这种方法制片迅速,细胞内酶活性保存较好,常用于酶组织化学染色。血细胞和分离培养的细胞可直接涂在玻片上,制成涂片(smear)。疏松结缔组织和肠系膜等软组织可撕成薄片铺在玻片上(铺片),牙和骨等坚硬组织可磨成薄片(磨片)。组织切片等标本经染色、透明后,以封固剂和盖片封固,即可长期保存,镜下观察。
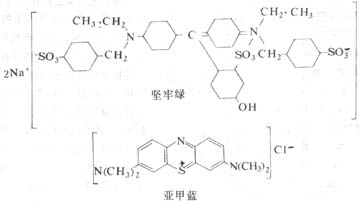
图1-1 坚牢绿(酸性染料)与亚甲蓝(碱性染料)的化学结构及其染色反应示意
染色(staining)是用染料使组织切片着色,便于镜下观察。天然和人工合成的染料甚多,它们都是含发色团的有机化合物,当染料具有助色团成为盐类物质,即可溶解于水并具电荷,与组织有亲合力,使组织着色。含氨基(-NH2)、二甲氨基〔-N(CH3)2〕等碱性助色团的染料,称碱性染料(basic dye),它的盐溶液具阳电荷;含羧基(-COOH)、羟基(-OH)或磺基(-SO3H)等酸性助色团的染料,称酸性染料(acid dye),它的溶液具阴电荷(图1-1)。组织的染色原理一般认为基于化学结合或物理吸附作用。细胞和组织的酸性物质或结构与碱性染料亲合力强者,称嗜碱性(basophilia);而碱性物质或结构与酸性染料亲合力强者,称嗜酸性(acidophilia);若与两种染料的亲合力均不强者,称中性(neutrophilia)。组织的基本成分是蛋白质,构成蛋白质的氨基酸常是即有含氨基的,也有含羧基的,是两性电解质。各种蛋白质的等电点因氨基酸成分的不同而异,其电荷性质又与溶液的pH值相关,根据研究目的选用合适的染色方法,调整好染液的pH值,即可取得良好染色效果。常用的酸性染料如伊红、坚牢绿、橙黄G等,碱性染料如苏木精、亚甲蓝、碱性品红等。组织学中最常用的是苏木精(hematoxylin)和伊红(eosin)染色法,简称HE染色法。苏木精使细胞核和胞质内的嗜碱性物质着蓝紫色,伊红使细胞质基质和间质内的胶原纤维等着红色。
物理吸附作用的染色方法,如用苏丹染料显示脂肪组织,染料溶于脂肪内,使细胞内的脂滴显色。又如用硝酸银、氯化金等重金属盐显示细胞和组织的某些结构,则是使金属微粒附着在结构表面而呈棕黑色或棕黄色。银染法中有些组织结构可直接使硝酸银还原而显示,称此为亲银性(argentaffin);有些结构无直接还原作用,需加入还原剂方能显色,则称为嗜银性(argyrophilia)。还有些组织成分如结缔组织和软骨基质中的糖氨多糖,当用甲苯胺蓝(toluidine blue)等碱性染料染色后呈紫红色,这种现象称为异染性(metachromasia),其原理可能是该染料在溶液中呈单体状态时显蓝色,当它与多阴离子的高分子物质耦合后,染料分子聚合成多聚体而显红色(图1-2)。还有些染色方法的原理至今还不清楚。
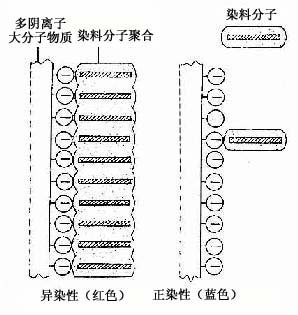
图1-2 异染性示意图
(二)几种特殊显微镜的应用
1.荧光显微镜 荧光显微镜(fluorescence microscope)是用来观察标本中的自发荧光物质或以荧光素染色或标记的细胞和结构。荧光显微镜是以高压汞灯产生的短波紫外线为光源,并配有激发、阻断、吸热和吸收紫外线等滤片系统,标本中的荧光物质在紫外线激发下产生各种颜色的荧光,借以研究该荧光物质在细胞和组织内的分布。组织中的自发性荧光物质如神经细胞和心肌细胞等内的脂褐素呈棕黄色荧光,肝贮脂细胞和视网膜色素上皮细胞内的维生素A呈绿色荧光,某些神经内分泌细胞和神经纤维内的单胺类物质(儿茶酚胺、5-羟色胺、组胺等)在甲醛作用下呈不同颜色的荧光,组织内含有的奎宁、四环素等药物也呈现一定的荧光。细胞内的某些成分可与荧光素结合而显荧光,如溴化乙锭与吖啶橙可与DNA综合,进行细胞内DNA含量测定。荧光显微镜更广泛用于免疫细胞化学研究,即以异硫氰酸或罗丹明等荧光素标记抗体(一抗或二抗),用该标记抗体直接或间接地与细胞内的相应抗原结合,以检测该抗原的存在与分布。
2.相差显微镜 相差显微镜(phase contrast microscope)是用于观察组织培养中活细胞形态结构的。活细胞无色透明,一般光镜下不易分辨细胞轮廓及其结构。相差显微镜的特点是将活细胞不同厚度及细胞内各种结构对光产生的不同折射作用,转换为光密度差异(明暗差),使镜下结构反差明显,影像清楚。组织培养研究常用的是倒置相差显微镜(inverted phase contrast microscope),它的光源和聚光器在载物台的上方,物镜在载物台的下方,便于观察贴附在培养器皿底壁上的活细胞。
3.暗视野显微镜 暗视野显微镜(dark-field microscope)主要用于观察因反差或分辨力不足的微小颗粒。此种显微镜主要是有一个暗视野集光器,使光线不直接进入物境,故呈暗视野。而标本内的小颗粒产生的衍射光或散射光进入物镜,暗视野中的颗粒呈明亮小点,如同在暗室可见一束光线中的微小尘粒一般。普通通光镜最大分辨率为0.2μm,暗视野显微镜则可分辨0.004~0.2μm的微粒,适用于观察细胞内线粒体运动及标本中细菌等微粒的运动等。
4.共集激光扫描显微镜 共焦激光扫描显微镜(confocal laser scanning microscope,CLSM)是近10年研制成的高光敏度、高分辨率的新型仪器。它以激光为光源,光束经聚焦后落在样品(组织厚片或细胞)不同深度的微小一点,并作移动扫描,通过电信号彩色显像,经过微机图像分析系统进行二维和三维分析处理。CLSM可对细胞进行三维结构图像分析,细胞内各种荧光标记物的微量分析,细胞内Ca2+、pH值等的动态分析测定,细胞的受体移动、膜电位变化、酶活性和物质转运的测定,并以激光对细胞及其染色体进行切割、分离、筛选和克隆。因此,CLSM是一种高技术产品,可对细胞的多种功能进行全自动、高效、快速的微量定性和定量测定。
其他如偏光显微镜用于研究组织晶体物质及纤维等的光学性质,紫外光显微镜用于研究细胞内核酸的分布与定量等。
(三)组织化学和细胞化学术
组织化学(histochemistry)和细胞化学(cytochemistry)技术是通过化学或物理反应原理显示组织切片细胞内某种化学成分,进行定位、定量及其与功能相关的研究。如糖类、脂类、酶、核酸等与试剂发生化学物理反应,形成有色终末产物,在光镜下观察,有的可在电镜下观察。
1.糖类显示多糖和蛋白多糖的常用方法是过碘酸-雪夫反应(periodic acid Schiff reaction,PAS反应)。基本原理是过碘酸的氧化作用先使糖分子的乙二醇基变为乙二醛基,后者继而与Schiff试剂(无色亚硫酸品红复合物)结合,形成紫红色反应产物(图1-3)。颜色反应的深浅取决于组织内多糖的乙二醇分子的多寡。
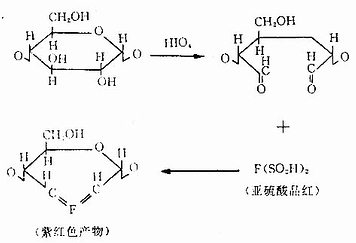
图1-3 PAS反应原理示意图
2.脂类脂类物质包括脂肪和类脂。标本用甲醛固定,冷冻切片,脂类保存较好。多用苏丹染料、油红O、尼罗蓝等溶于脂类的染料染色,使脂质呈色。也可用四氧化锇(OSO4)染色,脂肪酸或胆碱可使OSO4还原为OSO2而呈黑色。
3.酶细胞内的酶种类甚多,有氧化还原酶、水解酶、合成酶、转移酶等几类,目前已有100多种酶组织化学染色法。酶组化反应的基本原理是利用酶对其相应底物的水解、氧化等作用,然后再使底物的反应产物与某种捕获剂发生反应,形成沉淀或有色的最终产物,借此检测该酶在组织切片或细胞内的分布及活性强弱。如细胞的磷酸酶是一种重要的水解酶,碱性磷酸酶(ALP)和酸性磷酸酶(ACP)在合适的pH条件下可水解有机磷酸脂。小肠上皮细胞表面的纹状缘和肾近曲小管表面的刷状缘处,微绒毛含有丰富的ALP,与物质的吸收和转运功能相关;许多细胞的溶酶体内则含大量ACP,参与细胞内物质代谢。这两种酶均可以β-甘油磷酸钠为底物,底物被水解产生磷酸根,再以Ca2+、Co2+(显示ALP)或Pb2+(显示ACP)捕获磷酸根,最后用硫化铵处理,即形成硫化钴或硫化铅黑色最终产物,出现在组织切片中该酶存在的部位。因此,酶组化染色不是酶本身的直接显色,而是酶作用底物的化学反应产物显色的。
4.核酸 显示DNA的传统方法是Feulgen反应,切片先用稀盐酸处理,使DNA分子中脱氧核糖与嘌呤之间的连接键打开,形成醛基,再与Schiff 试剂作用,原理同PAS反应,使细胞核DNA显紫红色。还可用甲基绿-焦宁染色法同时显示DNA和RNA,这两种染料都是碱性,甲基绿使细胞核内的DNA呈蓝绿色,焦宁使细胞质和核仁内的RNA呈红色。
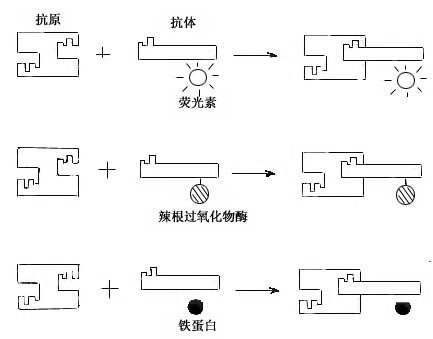
图1-4 免疫细胞化学术示意图
图1-5 人呼吸道分离上皮细胞粘蛋白免疫荧光像
(美国戴维斯加州大学 吴忍教授供图)
(四)免疫细胞化学术
免疫细胞化学(immunocytochemistry)术是应用抗原与抗体结合的免疫学原理,检测细胞内多肽、蛋白质及膜表面抗原和受体等大分子物质的存在与分布。这种方法特异性强,敏感度高,进展迅速,应用广泛,成为生物学和医学众多学科的重要研究手段。近年随着纯化抗原和制备单克隆抗体的广泛开展以及标记技术不断提高,免疫细胞化学的进展更是日新月异,不仅用于许多基本理论的研究,并取得重大突破,而且也用于疾病的早期快速诊断等临床实际。组织的多肽和蛋白质种类繁多,具有抗原性。分离纯化人或动物组织某种蛋白质,作为抗原注入另一种动物体内,后者即产生相应的特异性抗体(免疫球蛋白)。从被免疫动物的血清中提取出该抗体,再以荧光素、酶、铁蛋白或胶体金标记,用这种标记抗体处理组织切片或细胞,标记抗体即与细胞的相应蛋白质(抗原)发生特异性结合(图1-4)。常用的荧光素是异硫氰酸荧光素(FITC)和四甲基异硫氰酸罗丹明(TRITC),在荧光显微镜下可观察荧光抗体抗原复合物(图1-5)。常用的酶是辣根过氧化物酶(horseradish peroxidase,HRP,从辣根菜中提取的),它的底物是3,3'-二氨基、联苯胺(DAB)和H2O2,HRP使DAB氧化形成棕黄色产物,可在光镜和电镜下观察(图1-6)。铁蛋白和胶体金标记抗体与抗原的结合,也可在光镜和电镜下观察(图1-7)。
图1-6 大鼠腺垂体免疫组织化学(PAS法)示生长激素细胞
(上海医科大赵培林教授供图)
图1-7 免疫细胞化学(蛋白A-胶体金法)和原位杂交术示大鼠垂体
催乳素细胞电镜像 N催乳素细胞核
↑分泌颗粒内显示金粒
![]()
粗面内质网(RER)显示银粒
(加拿大Douglas医院研究中心童毅爱博士赠图)
标记抗体民被检抗原的结合方式有两种。一是直接法,即如上述用标记抗体与样品中的抗原直接结合(图1-8)。这种方法操作简便,但敏感度不及间接法。间接法是将分离的抗体(第一抗体简称一抗)再作为抗原免疫另一种动物,制备该抗体(抗原)的抗体(第二抗体简称二抗),再以标记物标记二抗。先后以一抗和标记二抗处理样品,最终形成抗原一抗-标记二抗复合物(图1-8)。间接法中的一个抗原分子可通过一抗与多个标记二抗相结合,因此它的敏感度较高,而且目前国内外均有多种标记二抗商品供应,使用方便。间接法中较常用的是一种称之为过氧化物酶-抗过氧化物酶复合物法(peroxidase-antiperoxidase complexmethod,PAS法),该法除需一抗和二抗外,还需制备HRP标记的抗酶抗体,即以HRP作为抗原免疫动物,制成抗HRP抗体,再以HRP标记该抗体制成由3个酶分子与2个抗酶抗体组成的相当稳定的环形PAP复合物。标本先后以一抗、二抗和PAP复合物处理后,再以DAB显色,即可检测抗原的分布。此法由于细胞内的抗原通过抗体的层层放大而与多个酶分子结合,因此敏感性很强(图1-9)。
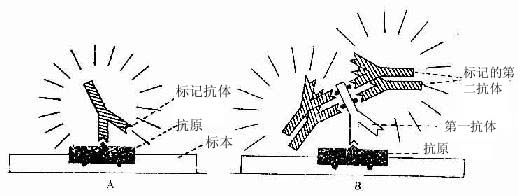
图1-8 免疫细胞化学直接法(A)与间接法(B)示意图
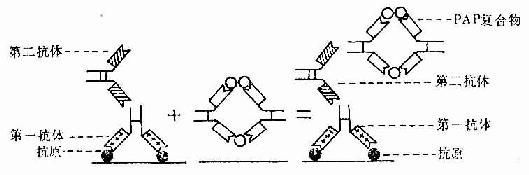
图1-9 免疫细胞化学PAP法示意图
免疫细胞化学术近10年来又有新进展,如生物素-亲合素等新颖试剂的应用,为检测微量抗原、受体、抗体开辟了新途径。生物素(biotin)又称维生素H,是从卵黄和肝中提取的一种小分子物质(分子量244.31);亲合素(avidin)又称卵白素,是从卵白中提取的一种糖蛋白(分子量68kD)。每个亲合素分子有生物素结合的4个位点,二者可牢固结合成不可逆的复合物。生物素-亲合素的应用大致有三种方法。①标记亲合素-生物素法(labelled avidin- biotin method,LAB法):将亲合素与标记物(HRP)结合,一个亲合素可结合多个HRP;将生物素与抗体(一抗与二抗)结合,一个抗体分子可连接多个生物素分子,抗体的活性不受影响。细胞的抗原(或通过一抗)先与生物素化的抗体结合,继而将标记亲合素结合在抗体的生物素上,如此多层放大提高了检测抗原的敏感性(图1-10)。②桥连亲合素-生物素法(bridged avidin-biotin method,BAB法):先使抗原与生物素化的抗体结合,再以游离亲合素将生物素化的抗体与酶标生物素搭桥连接,也达到多层放大效果(图1-10)。③亲合素-生物素-过氧化物酶复合物法(avidin-biotin-peroxidase complexmethod,ABC法);此法是前两种方法的改进,即先按一定比例将亲合素与酶标生物素结合在一起,形成亲合素-生物素-过氧化物酶复合物(ABC复合物),标本中的抗原先后与一抗、生物素化二抗、ABC复合物结合,最终形成晶格样结构的复合体,其中网络了大量酶分子,从而大大提高了检测抗原的灵敏度(图1-10)。现有配制现成的ABC药盒商品供应,操作简便,是目前广泛应用的一种方法。
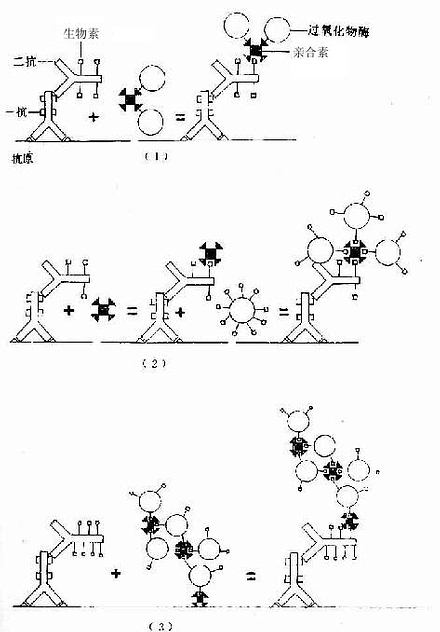
图1-10 生物素-亲合素免疫细胞化学示意图
(1)标记亲合素-生物素法
(2)桥连亲合素-生物素法
(3)亲合素-生物素-过氧化物酶复合物法(ABC法)
(五)同位素示踪术
同位素示踪术是用放射性核素的射线作用,研究细胞对某种物质的吸收、合成、转运和分泌等代谢过程。将放射性核素或其标记物注入动物体内或加入细胞培养的培养基内,细胞摄取该物质后,取被检组织制成切片或细胞涂片。可用显微镜放射自显影术(microau toradiography)检测该放射性物质在细胞内的原位分布及其代谢转归,即将薄层感光乳胶涂在切片或涂片的表面,标本在暗盒内保存一定时间后,细胞内的放射性核素产生的射线使乳胶中的溴化银还原为银粒,经显影和定影后在光镜下观察银粒的分布。β射线能量低,射程短,电离作用强,常用的β射线核素是3H、14C、32P、35S、45Ca、131I。如用3H-胸腺嘧啶核苷研究细胞DNA合成及细胞增殖动态(图1-11)。用35S-蛋氨酸研究某些腺细胞分泌物的合成与排泄,用131I-碘化钠研究甲状腺素的合成等。还可做标本中的银粒数计量或其光密度测定,进行定量分析。另外,也可用液体闪烁计数器测定分离细胞或其匀浆的放射线强度,进行定量研究。
(六)原位杂交术
原位杂交术(in situ hybridization)是一种核酸分子杂交技术,它是通过检测细胞内mRNA和DNA序列片段,原位研究细胞合成某种多肽或蛋白质的基
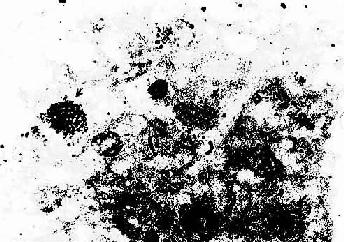
图1-11 大鼠肝大部切除后再生过程中增殖期肝细胞
摄取3H标记的胸腺嘧啶核苷放射自显影像
↑ 增殖期肝细胞核
因表达。其基本原理是根据两条单链核苷酸互补碱基序列专一配对的特点,应用已知碱基序列并具有标记物的RNA或DNA片段即核酸探针(probe),与组织切片或细胞内的待测核酸(RNA或DNA片段)进行杂交,通过标记物的显示,在光镜或电镜下观察目的mRNA或DNA的存在与定位。此项技术需首先制备某种核酸探针,其种类主要有三种:①利用大肝杆菌重组带有目的基因的质粒DNA,制成互补DNA探针(cDNA);②应用限制性核酸内切酶消化制成线性DNA模板,在体外转录获得反意RNA探针(cDNA);③依照待测核酸的核苷酸序列,应用DNA合成仪合成寡聚核苷酸探针。cRNA和cDNA的常用标记物有32S、32P、3H等放射性核素和荧光素、生物素、地高辛等非放射性物质。组织学应用的原位杂交术主要是染色体原位杂交和细胞原位杂交。前者是研究遗传基因、抗原基因、受体基因、癌基因等在染色体上的定位与表达;后者是研究细胞某种蛋白质的基因转录物mRNA在胞质内的定位与表达(图1-7,1-12)。核酸分子杂交术有很高的敏感性和特异性,它是免疫细胞化学的基础上,进一步从分子水平探讨细胞功能的表达及其调节机制的,已成为当前细胞生物学、分子生物学研究的重要手段。
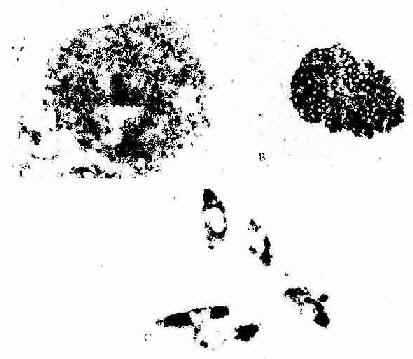
图1-12 原位杂交术光镜像
A32P标记胰岛素cRNA探针放射自显影显示大鼠胰岛B细胞内胰岛素mRNa
B 地高辛-碱性磷酸酶标记胰岛素cRNA探针显示大鼠胰岛B细胞内胰岛素mRNA
C 地高辛-碱性磷酸酶标记心钠素cRNA探针显色示体外培养的人胎儿脐静脉
内皮细胞内的心钠素mRNA ×850
(第三军医大学蔡文教授供图)
(七)细胞和细胞化学定量术
组织和细胞形态结构及其化学成分的定量研究,是以量的测定及其数据变化阐述组织和细胞的生长、分化、代谢和功能的演变以及对环境因素和致病因素的反应。生命科学的研究不断深入,定量技术的应用日益广泛并有所进展。
1、显微镜分光亮度定量术此方法是应用显微分光亮度计(microspectrophotometer)测定组织化学和免疫组织化学染色标本的反应强弱,进行化成分的定量分析的。基本原理是细胞内某种物质的含量不同,其染色反应的深浅不一,对一定波长的光吸收也就不同,即某物质的消亮度与一定厚度和面积内的该物质浓度成正比。通过光电组合自动控制系统将消光度转换为电信号,即可得出光密度值(O、D值),进行定量分析比较。前述荧光素染色、酶和核酸组织化学染色、多肽和蛋白质免疫组化染色、放射自显影和原位杂交等标本,均可应用显微分光光度计做定量分析。
2、形态计量术 形态计量术(morphometry)是运用数学和统计学原理对组织和细胞进行二维和三维的形态测量研究,如细胞及其微细结构成分的数量、体积、表面积、周长等的相对和绝对值的测量,其中三维立体结构的研究又称体视学(stereology)。机体组织的光镜结构计量已有不少有意义的资料,如人和动物的肺泡数量和表面积,肾小体的数量和体积比,肝细胞的体积和数量,胰岛的数量及各类细胞的数量比,腺垂体各种内分泌细胞的数量比等。通过组织切片或照片(光镜和电镜)平面图像的测量,推算其立体结构数值,传统方法是将测试系统(点、线、方格等)投影或覆盖在切片上或照片上,把若干样品的平面测量数据按数学公式推算出其立体数值。目前已广泛应用图像分析仪(image analyzer)进行形态计量研究,该仪器也是光学、电子学和计算机高技术产品,它是将切片或照片图像通过摄像机显示于监示器屏幕上,并根据不同结构的颜色深浅(灰度)及各像点的大小位置,快速准确地得出所需的各种形态数据。组织化学和免疫组织化学染色标本,也可应用图像分析仪测定其光密度值,进行定量分析。
3、流式细胞术 流式细胞术(flow cytometry,FCM)是近年建立的细胞分类和定量研究技术,它是应用流式细胞仪(或称荧光激活细胞分类器,fluroescent activated cell sorter)对单个细胞生物化学和生物物理特性进行快速定量测定的。工作原理是先分离被检细胞制成悬液,并作荧光染色或标记,使单细胞液流快速通过该仪器的激光器照射分析区,被检细胞产生的不同荧光信号转变为电脉冲,分别输入计算机内贮存,并显示于示波器屏幕上,即可获得该细胞群体中不同类型细胞的有关数据,如不同细胞的数量、荧光强度以及细胞体积、表面积和内部结构等参数;还可使细胞附有不同电荷,分类收集各种细胞,该技术的特点是速度快,精确性高,灵敏度大,已成为一种重要手段广泛用于细胞动力学、遗传学、免疫学、肿瘤学等的研究。如细胞DNA,RNA或某种蛋白质的含量分析,单个染色体DNA含量及分选,淋巴细胞膜抗原或受体的分析及细胞亚群分选,杂交细胞等的分选等,也用于肿瘤临床诊断及疗效和预后的分析等。
(八)电子显微镜术
1、透射电镜术 透射电镜(transmission electron microscope,TEM)是以电子束穿透样品(组织的超薄切片),经聚合放大后,显像于荧光屏上进行观察和摄片的。电镜的放大倍数的分辨率比光镜大得多,放大倍数为几万至几十万倍,分辨率可达0.2nm。标本制备较光镜的更严格,新鲜组织切成小块(lmm3),用戊二醛,多聚甲醛、四氧化锇等固定,树脂包埋,以超薄切片机切成厚50~80nm的超薄切片,经醋酸铀和柠檬酸铅等重金属电子染色后,置于电镜下观察,标本在荧光屏上呈黑白反差的结构影像。被重金属浸染呈黑色的结构,称电子密度高(electron-dense);反之,浅染的部分称电子密度低(electron-lucent),这种染色称正染色(positive staining)。若被染结构着色浅淡,而其周围部分染成黑,是称为负染色(negative stainning)。透射电镜的电子枪加速电压50~100kV,电子束穿透力低,近年制成加速电压500kV以上的超高压电镜,电子束穿透力很强,可观察0.5~10μm厚的切片,可观察细胞内骨架等的立体超微结构。应用电镜观察细胞化学染色标本,称电镜细胞化学术(electron microscope cytochemistry);电镜观察免疫细胞化学染色标本,称免疫电镜术(immunoelectron microscopy);电镜与放射自显影结合的方法称电镜放射自显影术(electron microscopeautoradiography)。
2、扫描电镜术 扫描电镜(scanning electron microscope,SEM)是用于观察组织表面的立体结构的。组织块经固定后,置于真空镀膜仪内于燥,在标本表面先后喷镀一层碳膜和合金膜,即可置于镜下观察。扫描电镜的景深长,样品表面的金属膜可提高其导电性和图像反差,在荧光屏上扫描成像,呈现富有立体感的表面图像,如细胞表面的突起、微绒毛、纤毛及细胞的分泌与吞噬行为等(图1-13)。

图1-13大鼠分离肝巨噬细胞粘着吞噬羊红细胞扫描电镜像
M肝巨噬细胞,R羊红细胞
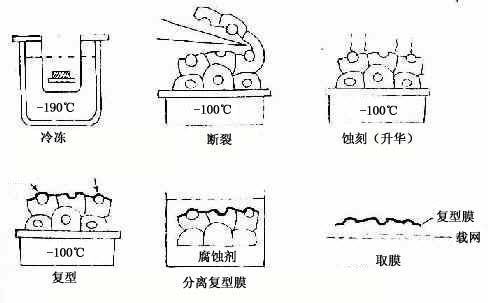
图1-14 冷冻蚀刻标本制备示意图
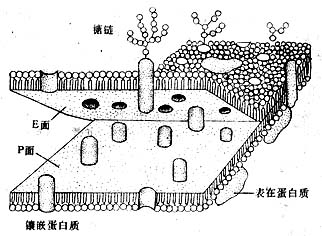
图1-15 细胞单位膜从中间层劈开示意图
3、冷冻蚀刻复型术和冷冻割断术
冷冻蚀刻复型术(tfeeze etch replica):是在透射电镜下观察组织或细胞断裂面的金属复制膜,显示细胞微细结构的立体影像。组织块先经甘油生理盐水处理(防止形成冰晶)后投入液氮快速冷冻,在低温下用钢刀将样品劈开,形成凹凸不平的断裂面:-100℃真空下使断裂面的冰晶升华,暴露不平整表面;在断裂面上先后喷镀一层合金膜和碳膜,用次氯酸等组织腐蚀掉;将反差的凸凹不平的金属复型膜置于镜下观察(图1-14)。此项技术尤适用研究生物膜的内部结构,如从单位膜的脂质分子疏水端劈开(图1-15),经蚀刻镀膜,镜下可见质膜断裂面复型膜结构状态(图1-16),其凹凸影像恰与实物相反。

图1-16小鼠肾近曲小管微绒毛冷冻蚀刻复型电镜像 ×38300
MV微绒毛 E E面,P P面(白求恩医科大学尹昕、朱秀雄教授供图)
冷冻割断术(freeze cracking):是将固定组织包埋在树脂内,低温下割断,断面喷镀合金,在扫描电镜下观察断面的立体构型。该技术适于研究组织内部微细结构的相互关系,如肝细胞与肝血窦和胆小管的关系,肾小体的肾小囊与血管球的关系等(图1-17)。
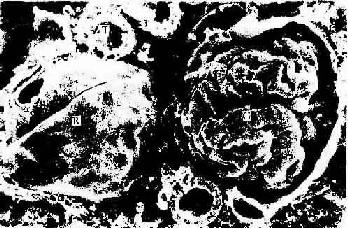
图1-17 大鼠肾冷冻割断扫描电镜示肾小体
R肾小囊外表面,G血管球,T肾小管
(白求恩医科大学尹昕、朱秀雄教授供图)
4、电镜X-射线显微分析术X-射线显微分析术(X-ray microanalysis)是研究细胞和组织内元素的种类、分布和含量的新技术。它是利用高速电子束轰击电镜内生物标本的微小区域,使该区所含的元素发射了一定波长的X-射线,通过检测器对X-射线进行波谱或能谱分析,即可测定微区内元素的性质、含量和分布。如测定细胞内Na、K、Ca、Fe、P、Cl等及某些微量元素的含量和分布变化,探讨各种元素与细胞生理和病理的关系。
(九)组织培养术
前述几种方法都是取人体或在体(in vivo)实验动物的组织,经固定等处理后,对已死亡的组织进行观察研究的。组织培养(tissue culture)或称体外实验(in vitro)则是取活组织或活细胞在体外适宜的环境中培养成活,进行实验研究。细胞在体外生存必须具有近似体内的生存条件,如充足营养供应,合理的O2与CO2比例,必要的电解质和适宜的渗透压,pH值、温度和湿度等,还需防止微生物污染。组织培养的特点在于可用研究各种理化因子(温度、激素、药物、毒物等)对活细胞的直接影响,并能观察记录(摄影、录像)。组织培养与前述方法结合应用,可研究某种因素对细胞增殖、分化、代谢、运动、吞噬、分泌等影响和调节的动态过程,以及细胞病变、癌变和逆转等机理,获得在体实验难达到的研究目的。
组织培养用液为平衡盐水及血清(小牛血清、胎盘血清等),羊水、腹水、组织浸出液等天然培养基(natural medium)。天然培养基成分复杂,且不稳定。目前广泛应用人工合成培养基(synthetic medium)现有多种商品供应,使用方便,但常仍需补充部分血清等。若仅用合成培养基和已制备好的几种必须因子与激素,称此为无血清培养基(serum-free medium),其成分和含量均是已知的,可精细研究某种因子对细胞的生物效应。
组织培养的方法甚多,常用容器有凹玻片、培养皿、培养瓶、培养板、流动小室等。取组织块贴于瓶底进行培养,可观察从组织块生长迁移出的细胞。取胚胎某器官原基或器官的一部分进行培养,称器官培养(organ culture)。更精细的方法是分离和纯化组织中的某种细胞,使之贴附在瓶底形成单层细胞(图1-18),称此为细胞培养(cell culture)。首次培养的细胞,称原代培养(primary cultrue;细胞增殖而密集再传代培养,称传代培养(subculture)。经长期培养而成的细胞群体,称细胞系(cell line);用细胞克隆(cell clone)或单细胞培养而建成的某种纯细胞群体,称细胞株(cell strain)。它们均可在液氮内长期冻存,供随时应用。现已建成多种肿瘤细胞株,广泛用于实验研究。
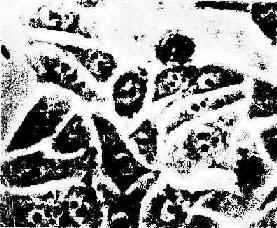
图1-18 体外培养的上皮细胞在相差显微镜下的图像(北京肿瘤研究所鄂征教授供图)
(十)细胞融合术
2个或2个以上的细胞融合成为一个细胞,称为细胞融合(cell fusion)。正常人体内也有细胞融合现象,如两性生殖细胞结合而成受精卵,多个巨噬细胞融合成一个体积很大的多核异物巨细胞。体外用人工方法使两种细胞融合,制成一种新品系的杂交细胞(hybrid cell),筛选出的此种杂交细胞有很强的生命力,增殖也很旺盛。常用的细胞融合诱导物是仙台病毒(Sendai virus)和聚乙烯二醇(polythyleneglycol,PEG)。细胞融合术是细胞遗传术、细胞免疫学、病毒学、肿瘤学等研究的一种重要手段,如将受抗原刺激后的小鼠脾淋巴细胞分离出来,与已建立的小鼠骨髓瘤(浆细胞瘤)细胞融合,筛选出的杂交瘤细胞可长期存活和增殖,成为制备单克隆抗体的细胞株。
三、组织学与胚胎学学习方法的几个要点
学习组织学与胚胎学应注意以下几方面:
1.平面与立体的关系切片和照片所显示的是细胞、组织和器官的平面结构,同一结构由于切面不同而呈现一定形态差异;通过细胞、组织、器官的平面结构的观察,还应建立对它们立体的整体结构的认识。因此应注意从平面结构的观察,树立整体结构的概念。一种传统的方法是将标本制成连续切片,观察记录每张切片中的结构,然后累积起来进行分析,或制成模型以表达其整体结构。目前则应用微机图像处理技术,在荧光屏上显示细胞和组织的三维重建图像。
2.结构与功能相联系每种细胞、组织和器官都有一定的形态结构特点。这些特点往往是它们行使一定功能的结构基础,两者密切相关。例如分泌蛋白质的腺细胞富有粗面内质网和发达的高尔基复合体,巨噬细胞则有较多的溶酶体;构成肌组织的肌细胞,形态细长,含有大量纵行肌丝,是细胞收缩的物质基础;上皮组织则细胞排列紧密,具有吸收和保护等功能相关结构。又如消化管是连续的管道,而食管、胃、小肠和大肠的粘膜又各有特点,它们与各段的相应功能相关。因此,结构与功能相结合既能达到深入理解,融会贯通,又可抓住要点,掌握规律。
3.从静态结构了解动态变化生活的细胞和组织是始终处于动态变化之中,在细胞分化,代谢和功能活动过程,其微细结构也有相应变化,细胞还不断增殖、运动、死亡和更新。即使是非细胞的间质成分包括坚硬的牙和骨的间质,也不断地被吸收和重建。胚胎时期的生长发育变化则更为显著。但在切片中所见的结构都是某一时刻的静态形象,所以要善于从组织的静态时相理解其动态变化。在动物实验中,可在不同实验时期取材观察,分析其动态过程。
4.纵横联系深化认识组织学从基本组织至各器官系统是阐述有机体统一整体的不可分割的部分,许多内容前后关联,相互印证。如细胞的结构与功能是组织学的基础,贯穿于全书始末;由细胞和细胞间质构成的各种组织组成不同的器官,器官的功能不仅建立在相关细胞特性的基础上,也与细胞间质及血管和神经的分布密切有关。又如细胞间连接结构不仅存在于上皮组织内,而且也分布在其它组织的细胞之间,并参与组织和器官的重要功能活动;淋巴细胞、内分泌细胞、神经细胞等更是在机体生命活动的整体网络中起广泛而重要的作用。
前已述及,现代医学和生物学研究进展迅速,使各学科的内容相互渗透和交叉,联系日益密切。组织学中研究方法的应用和许多基本理论的验证,都不可避免地要涉及其他学科的新技术和新成就,尤其是细胞生物学、分子生物学、免疫学、生物化学和生物物理学等。如细胞间连接、通讯及相互关系与调节,肌纤维的超微结构及其收缩机制的分子水平原理,血细胞发生中的造血干细胞学说的实验依据,淋巴细胞和抗原呈现递细胞的起源、分化及其在免疫应答中的抗原、抗体和受体的关系,许多新的内分泌细胞的发现和内分泌系统的展开,各种激素和调节因子的产生、作用及其相互关系,心血管、肺、肝、肾等器官一些细胞的结构和功能的新发现,神经元的信息传递与递质和受体的关系,生殖细胞的起源、分化和成熟等。随着组织学的进展,本书的修订在阐述基本内容的基础上,必然要有更新、充实和适当的扩展,有的内容以小字形式叙述,作为学习参考。因此在学习中应注意在掌握基本形态结构与功能的基础上,要善于自学钻研,扩充知识,纵横联系,深化认识,奠定坚实宽厚的基础,方能适应新世纪医药卫生事业发展的要求。
第二章 上皮组织
上皮组织(epithelial tissue)由密集的细胞组成,细胞形状较规则,细胞间质很少,大部分上皮覆盖于身体表面和衬贴在有腔器官的腔面,称被覆上皮。有些上皮构成腺,称腺上皮。上皮组织的细胞呈现明显的极性(polarity),即细胞的两端在结构和功能上具有明显的差别。上皮细胞的一面朝向身体表面或有腔器官的腔面,称游离面;与游离面相对的另一面朝向深部的结缔组织,称基底面。上皮细胞基底面附着于基膜,基膜是一薄膜,上皮细胞借此膜与结缔组织相连。上皮组织中没有血管,细胞所需的营养依靠结缔组织内的血管透过基膜供给。位于身体不同部位和不同器官的上皮,面临不同的环境,功能也不相同,细胞顶部常具有不同的结构,以适应各自的功能需要。上皮组织具有保护、吸收、分泌和排泄等功能,位于身体不同部位和器官的上皮常以某种功能为主。如身体表面上皮的功能主要为保护作用,而消化管腔面的上皮除有保护作用外,还有吸收和分泌功能。腺上皮的功能主要是分泌。有的器官的一些上皮细胞特化为有收缩能力的细胞,称肌上皮细胞(myoepithelial cell)。有些部位的一些上皮细胞能感受某种物理或化学性的刺激,则称感觉上皮细胞(sensory epithelial cell)。
一、被覆上皮
(一)被覆上皮的类型和结构
被覆上皮(covering epithelium)是按照上皮细胞层数和细胞形状进行分类的。单层上皮(simple epithelium)由一层细胞组成,所有细胞的基底端都附着于基膜,游离端可伸到上皮表面。复层上皮(stratified epithelium)由多层细胞组成,最深层的细胞附着于基膜上。上皮又根据细胞的形状(单层上皮)或浅层细胞的形状(复层上皮)进一步分类。将细胞的层数和细胞形状两个因素结合在一起。可将被覆上皮分为多种(表2-1)。部分腺上皮也可按上述标准分类。
表2-1 被覆上皮的类型和主要分布

1.单层扁平上皮单层扁平(鳞状)上皮(simple squamous epithelium)很薄,只由一层扁平细胞组成(图2-1。)由表面看,细胞呈不规则形或多边形,核椭圆形,位于细胞中央,细胞边缘呈锯齿状或波浪状,互相嵌合。由上皮的垂直切面看,细胞核呈扁形,胞质很薄,只有含核的部分略厚。
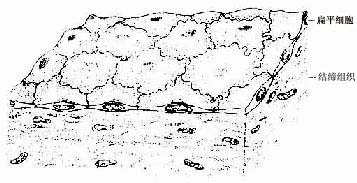
图2-1 单层扁平上皮模式图
衬贴在心、血管和淋巴管腔面的单层扁平上皮称内皮(endothelium)。内皮细胞很薄,大多呈梭形,游离面光滑,有利于血液和淋巴液流动及物质透过。分布在胸膜、腹膜和心包膜表面的单层扁平上皮称间皮(mesothelium),细胞游离面湿润光滑,便于内脏运动。
2.单层立方上皮单层立方上皮(simple cuboidal epithelium)由一层立方形细胞组成(图2-2)。从上皮表面看,每个细胞呈六角形或多角形;由上皮的垂直切面看,细胞呈立方形。细胞核圆形、位于细胞中央。这种上皮见于肾小管等处。
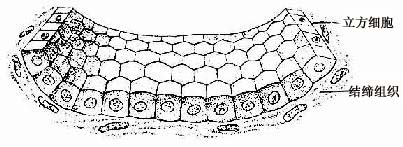
图2-2 单层立方上皮模式图
3.单层柱状上皮单层柱状上皮(simple columnar epithelium)由一层棱柱状细胞组成。从表面看,细胞呈六角形或多角形;由上皮垂直切面看,细胞呈柱状(图2-3),细胞核长圆形,多位于细胞近基底部。此种上皮大多有吸收或分泌功能 。在小肠和大肠腔面的单层柱状上皮中,柱状细胞间有许多散在的杯状细胞(goblet cell)(图2-3)。杯状细胞形似高脚酒杯,细胞顶部膨大,充满粘液性分泌颗粒,基底部较细窄。胞核位于基底部,常为较小的三角形或扁圆形,染色质浓密,着色较深。杯状细胞是一种腺细胞,分泌粘液,有滑润上皮表面和保护上皮的作用。
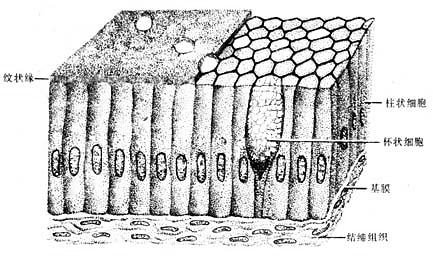
图2-3 单层柱状上皮模式图
被覆在子宫和输卵管等腔面的单层柱状上皮,细胞游离面具有纤毛,称单层纤毛柱状上皮(simple ciliated columnarepithelium)
4.假复层纤毛柱状上皮假复层纤毛柱状上皮(pseudostratified ciliated columnar)由柱状细胞、梭形细胞和锥体形细胞等几种形状、大小不同的细胞组成。柱状细胞游离面具有纤毛。上皮中也常有杯状细胞。由于几种细胞高矮不等,只有柱状细胞和杯状细胞的顶端伸到上皮游离面,细胞核的位置也深浅不一,故从上皮垂直切面看很象复层上皮。但这些高矮不等的细胞基底端都附在基膜上,故实际仍为单层上皮(图2-4)。这种上皮主要分布在呼吸管道的腔面。
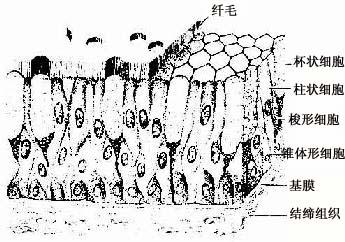
图2-4 假复层纤毛柱状上皮模式图
5.复层扁平上皮复层扁平(鳞状)上皮(stratified squamous epithelium)由多层细胞组成,是最厚的一种上皮(图2-5)。由上皮的垂直切面看,细胞的形状和厚薄不一。紧靠基膜的一层细胞为立方形或矮柱状,此层以上是数层多边形细胞,再上为梭形细胞,浅层为几层扁平细胞。最表层的扁平细胞已退化,并不断脱落。基底层的细胞较幼稚,具有旺盛的分裂能力,新生的细胞渐向浅层移动,以补充表层脱落的细胞。这种上皮与深部结缔组织的连接面弯曲不平,扩大了两者的连接面(图2-5)。
复层扁平上皮具有很强的机械性保护作用,分布于口腔,食管和阴道等的腔面和皮肤表面,具有耐磨擦和阻止异物侵入等作用。受损伤后,上皮有很强的修复能力。位于皮肤表面的复层扁平上皮,浅层细胞已无胞核,胞质中充满角蛋白(一种硬蛋白),已是干硬的死细胞,具有更强的保护作用,这种上皮称角化的复层扁平上皮(keratinized stratified squamousepithelium)(见皮肤章)。衬贴在口腔和食管等腔面的复层扁上皮,浅层细胞是有核的活细胞,含角蛋白少,称未角化的复层扁平上皮(nonkeratinized stratified squamousepithelium)。
6.复层柱状上皮复层柱状上皮(stratified columnar epithelium)的深层为一层或几层多边形细胞,浅层为一层排列较整齐的柱状细胞。此种上皮只见于眼睑结膜和男性尿道等处。
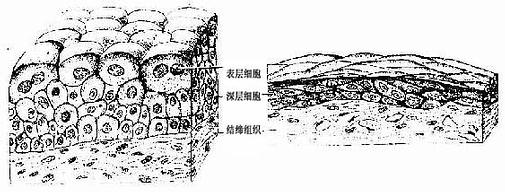
7.变移上皮变移上皮(transitional epithelium)又名移行上皮、衬贴在排尿管道(肾盏、肾盂、输尿管和膀胱)的腔面。变移上皮的细胞形状和层数可随所在器官的收缩与扩张而发生变化。如膀胱缩小时,上皮变厚,细胞层数较多,此时表层细胞呈大立方形,胞质丰富,有的细胞含两个细胞核;中层细胞为多边形,有些呈倒置的梨形;基底细胞为矮柱状或立方形(图2-6)。当膀胱充尿扩张时,上皮变薄,细胞层数减少,细胞形状也变扁(图2-6)
有人认为变移上皮是假复层上皮,所有细胞均向深部伸出长脚状突起,附着于基膜上(图2-7)
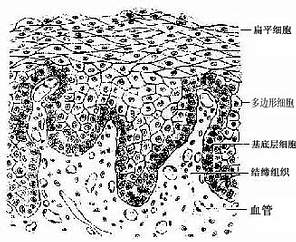
图2-5 复层扁平上皮模式图
(1)膀胱空虚时 (2)膀胱膨胀时
图2-6 变移上皮模式图(膀胱)
图2-7 变移上皮模式图(膀胱)
A.收缩状态 B.膨胀状态
(二)上皮组织的特殊结构
上皮组织与其功能相适应,在上皮的细胞的各个面常形成不同的特殊结构。这种结构有的由细胞质和细胞膜构成,有的由细胞膜、细胞质和细胞间质共同成。
1.上皮细胞的游离面
(1)细胞衣(cell coat):又称糖衣,为一薄层绒毛状的复合糖,包括糖蛋白、糖脂及蛋白多糖。上皮细胞的游离面细胞衣尤为显着(图2-8),细胞基底面及侧面也有类似细胞衣结构,但不甚明显。细胞衣具有粘着、支持、保护、物质交换及识别等功能。
(2)微绒毛(microvillus):是上皮细胞游离面伸出的细小指状突起,在电镜下才能清楚辨认(图2-8,2-9)。有些上皮细胞微绒毛少,长短不等,排列也不整齐。具有活跃吸收功能的上皮细胞有许多较长的微绒毛,且排列整齐,在高倍镜下可见细胞游离面显纵纹状的纹状缘(straited border)或刷状缘(brush border),这就是密集排列的长微绒毛的光镜图像(图2-3),除上皮细胞外,其它组织的细胞表面也常有微绒毛。
电镜下可见微绒毛表面为细胞膜,内为细胞质。微绒毛直径约0.1μm,长度因细胞种类或细胞生理状态的不同而有很大差别。绒毛轴心的胞质中有许多纵行的微丝(microfilament)。微丝一端附着于微绒毛尖端;另一端下伸到细胞顶部,附着于此部胞质中的终未网(terminal web)(图2-8,2-9)。终末网在吸收功能旺盛的上皮细胞中明显,为顶部胞质中的细丝(filametn)交织成的密网,网与细胞游离面平行,组成网的细丝固着于细胞侧面的中间连接(图2-8,2-9)。微绒毛中的微丝为肌动蛋白丝,终末网中有肌球蛋白。微绒毛大概也以肌丝滑动的方式伸长或缩短。微绒毛显著地扩大了细胞的表面积,参与细胞吸收物质的作用。
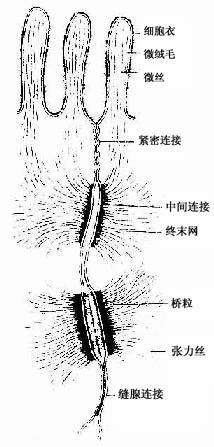
图2-8 单层柱状上皮细胞连接 超微结构模式图
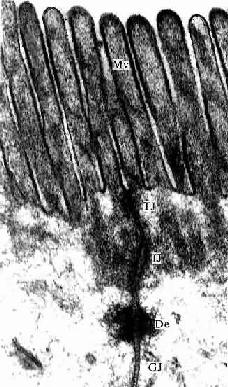
图2-9 小鼠小肠上皮细胞电镜像 ×84000
MV 微绒毛,TJ紧密连接,IJ中间连接,De桥粒,GJ缝隙连接
(上海医科大学电镜室供图)
(3)纤毛(cilium):是细胞游离面伸出的能摆动的较长的突起,比微绒毛粗且长,在光镜下能看见。一个细胞可有几百根纤毛。纤毛长约5-10μm,粗约0.2μm,根部有一个致密颗粒,称基体(basal body)。纤毛具有一定方向节律性摆动的能力。许多纤毛的协调摆动像风吹麦浪起伏,把粘附在上皮表分泌物和颗粒状物质向一定方向推送。例如呼吸道大部分的腔面为有纤毛的上皮,由于纤毛的定向摆动,可把被吸入的灰尘和细菌等排出。
纤毛的内部结构比微绒毛复杂。电镜下可见纤毛表面有细胞膜,内为细胞质,其中有纵向排列的微管。微管的排列有一定规律,中央为2条完整的微管。周围为9组成对的双联微管(图2-10,2-11)。基体的结构与中心粒基本相同,纤毛中的微管与基体的微管相连。
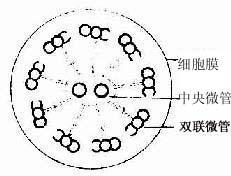
图2-10 纤毛横切面超微结构模式图
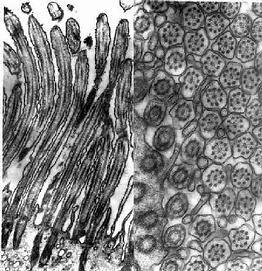
图2-11 大鼠输卵管上皮细胞纤毛电镜像 ×50000
左图 纤毛纵切, 右图 纤毛横切
(上海医科大学电镜室供图)
微管与纤毛的摆有关。有人从纤毛的双联微管中分离出一种具有ATP酶活性的蛋白质,称动力蛋白(dynein)。纤毛的运动可能是此种蛋白质分解ATp 使微管之间产生滑动所致。
2.上皮细胞的侧面在细胞紧密的组织,如上皮组织和其它某些组织,细胞排列密集,细胞间隙很窄,一般宽约15-20nm。细胞间隙中充满相邻细胞的细胞衣,并有少量糖胺多糖和钙离子,有较强的细胞粘着作用。这种粘着物质,在细胞的相邻面间广泛存在。此外,有些细胞的相邻面凹凸不平,互相嵌合,又进一步加强了细胞彼此的结合。细胞间结合更重要的结构,是在细胞相邻面形成特殊构造的细胞连接(cell junction)。上皮细胞间的连接结构发达,而且结构典型。肌细胞之间和神经细胞之间也有较多的细胞连接。结缔组织的细胞较分散,但有些相接触的细胞也有细胞连接。细胞连接由相邻细胞间局部特化的细胞膜、胞质和细胞间隙组成。
(1)紧密连接(tight junction):又称闭锁小带(zonula occludens)。这种连接呈点状、斑状或带状,带状的较典型,常见于单层柱状上皮和单层立方上皮,位于相邻细胞间隙的顶端侧面,呈箍状环绕细胞。在紧密连接的连接区、相邻两细胞的胞膜上有呈网格状的脊,这些脊彼此相对并紧贴在一起,细胞间隙消失。无脊的部分,有10-15nm的间隙(图2-8)。紧密连接除有机械连接作用外,更重要的是封闭细胞顶部的细胞间隙,阻挡细胞外的大分子物质经细胞间隙进入组织内。
(2)中间连接(intermediate junction):又称粘着小带(zonula adherens)。这种连接多为长短不等的带状,位于紧密连接下方,环绕上皮细胞顶部。相邻细胞之间有15-20nm的间隙,间隙中有较致密的丝状物连接相邻细胞的膜。在胞膜的胞质面,附着有薄层致密物质和细丝,细丝参与构成终末网(图2-8)。此种连接在上皮细胞间和心肌细胞间常见。它除有粘着作用外,大概还有保持细胞形状和传递细胞收缩力的作用。
(3)桥粒(desmosome):又称粘着斑(macula adherens)。呈斑状连接,大小不等,位于中间连接的深部,主要存在于上皮细胞间。连接区的细胞间隙宽约20-30nm,其中有低密度的丝状物,间隙中央有一条与细胞膜相平行而致密的中间线,此线由丝状物质交织而成。细胞膜的胞质面有较厚的致密物质构成的附着板,胞质中有许多直径10nm的角蛋白丝(张力丝)(tonofilament)附着于板中,并常折成袢状返回胞质,起固定和支持作用。桥粒是一种很牢固的细胞连接,在易受机械性刺激和磨擦的复层扁平上皮中多见(图2-8)。
在某些上皮细胞的基底面,即与深层结缔组织的相邻面,还可见半桥粒(hemidesmosome)(图2-12)。半桥粒为上皮细胞一侧形成桥粒一半的结构,将上皮细胞固着在基膜上。
(4)缝隙连接(gap junction):又称通讯连接(communication junction)。这种连接呈斑状,位于柱状上皮深部。此处细胞间隙很窄,仅2-3nm,并见相邻两细胞的间隙中有许多间隔大致相等的连接点(图2-8)。冷冻蚀刻复型等方法的研究证,相邻两细胞的胞膜中有许多配布规律的柱状颗粒,每个颗粒直径约7-9nm ,由6个亚单位并合组成,中央有直径约2nm的管腔。相邻两细胞膜中的颗粒彼此相接,管腔也通连,成为细胞间直接交通的管道(图2-13)。在钙离子和其它因素作用下,管道可开放或闭合。这种连接广泛存于胚胎和成体的多种细胞间,可供细胞相互交换某些小分子物质和离子,借以传递化学信息,调节细胞的分化和增殖。此种连接的电阻低,在心肌细胞之间,平滑肌细胞之间和神经细胞之间,可经此处传递电冲动。
以上四种连接,一般只要有两个或两个以上的连接挨在一起,即可称连接复合体(junctional complex)。连接结构的存在和数量常随器官不同发育阶段和功能状态及病理变化而改变。例如,在生精过程事,随着精原细胞的分化,支持细胞间的紧密连接可开放和重建(见男性生殖系统)。

图2-12 半桥粒和基膜超微结构模式图
3.上皮细胞的基底面
(1)基膜(basement membrane):又称基底膜。是上皮基底面与深部结缔组织间的薄膜。不同部位上皮的基膜甚至同一基膜的不同区域,其组成成分有所不同。基膜含有Ⅳ型胶原蛋白、层粘连蛋白和硫酸乙酰肝素蛋白多糖,有的部位基膜含纤维粘连蛋白。电镜下可将基膜分为三层(图2-12):紧贴在上皮细胞基底面的一层为透明板(lamina lucida),为电子致密度低的薄层,厚约10-50nm;其下面为电子致密度高的均质层,称致密板(lamina densa),又称基板,不同部位致密板厚度不等,约为20nm~300nm;第三层为网织板(lamina fibroreticularis),又称网板,位于致密板之下,由网状纤维和基质构成,有时可有少许胶原纤维。基膜厚薄不一,薄者仅由透明板和致密板组成。基膜除有支持和连接作用外,还是半透膜,有利于上皮细胞与深部结缔组织进行物质交换。基膜还能引导上皮细胞移动并影响细胞的分化。
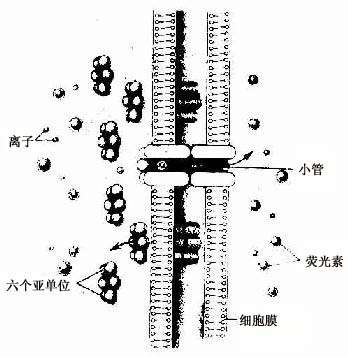
图2-13 缝隙连接超微结构模式图
↑示小分子物质经缝隙连接的小管进入相邻细胞
层粘连蛋白(laminin LN)是基膜中的一种主要成分,是一种大分子糖蛋白,含糖15%-28%,是由一条重链(A链)和2条轻链(B1,B2)构成的不对称的十字形结构,有3条短臂和一条长臂。层粘连蛋白具有与Ⅳ型胶原蛋白、硫酸乙酰肝素、半乳糖脑硫脂及神经节苷脂等分子结合的部位,这对基膜的构成具有重要意义。层粘连蛋白还可与上皮细胞、内皮细胞、神经细胞、肌细胞及多种肿瘤细胞相结合,促进它们粘着在基膜的Ⅳ型胶原蛋白上并铺展开,促进上皮细胞增殖、损伤神经元的存活及轴突生长。层粘连蛋白对保持细胞间的粘着和极性结构以及调节细胞分化皆有重要作用。最近证明,层粘连蛋白亦可增强由抗体或补体介导的巨噬细胞的吞噬功能,增强巨噬细胞对肿瘤细胞的杀伤作用。
(2)质膜内褶(plasma membrane infolding):是上皮细胞基底面的细胞膜折向胞质所形成的许多内褶(图2-14)。质膜内褶的主要作用是扩大细胞基底部的表面积,有利于水和电解质的迅速转运。由于转运过程中需要消耗能量,故在质膜内褶附近的胞质内,含有许多纵行排列的线粒体。
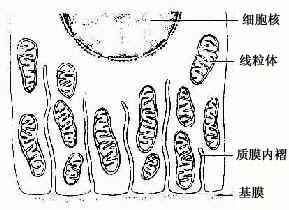
图2-14 上皮细胞基底面质膜内褶
超微结构模式图
二、腺上皮和腺
有些部位的被覆上皮除有保护和吸收功能外,也有分泌作用,如胃的单层柱状上皮等。但人体还有许多主要行使分泌功能的上皮,这些上皮称腺上皮(glandular epithelium)。以腺上皮为主要成分组成的器官称腺(gland)。腺细胞的分泌物中含酶、糖蛋白(也称粘蛋白)或激素等,各有特定的作用。
(一)外分泌腺和内分泌腺
在胚胎期,腺上皮起源于内胚层、中胚层或外胚层衍生的原始上皮。这些上皮细胞分裂增殖,形成细胞索,长入深部的结缔组织中,分化成腺。如形成的腺有导管通到器官腔面或身体表面,分泌物经导管排出,称外分泌腺(exocrine gland),如汗腺、胃腺等;如果形成的腺没有导管,分泌物经血液和淋巴输送,称内分泌腺(endocrine gland),如甲状腺、肾上腺等(图2-15)。
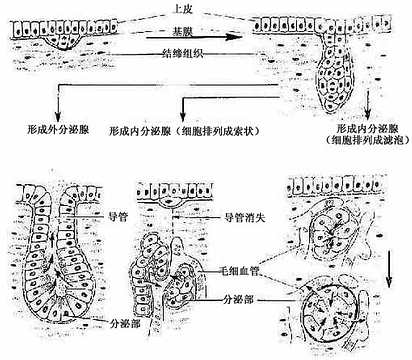
图2-15 腺发生模式图
(二)蛋白质分泌细胞
蛋白质分泌细胞(protein-secreting cell)大多呈锥体形或柱状,核圆形,位于细胞中央或靠近基底部。细胞基底部胞质显强嗜碱性,顶部聚集许多圆形分泌颗粒,HE染色呈红色,具有这些结构特点的蛋白质分泌细胞称浆液性细胞(serous cell)。电镜下见到,细胞基底部有密集平行排列的粗面内质网,并有许多线粒体位于内质网扁囊之间,核上方有发达的高尔基复合体。分泌过程经以下几个步骤(图2-16):①细胞摄入合成分泌物所需氨基酸等原料;②氨基酸结合到粗面内质网的核糖体上合成蛋白质,进入内质网腔内;③内质网以出芽方式形成小泡,将蛋白质输送到高尔基复合体;④蛋白质进入高尔基复合体,经过加工和浓缩,形成有膜包裹的分泌颗粒;⑤分泌颗粒聚集在细胞顶部,当分泌物释放时,分泌颗粒的膜与顶细胞膜融合,以出胞方式,将分泌物释放到细胞外。整个分泌过程所需要的能量由线粒体产生的ATP供给。浆液性细胞的分泌物为较稀薄的液体,其中含有不同的酶,如各种消化酶等。
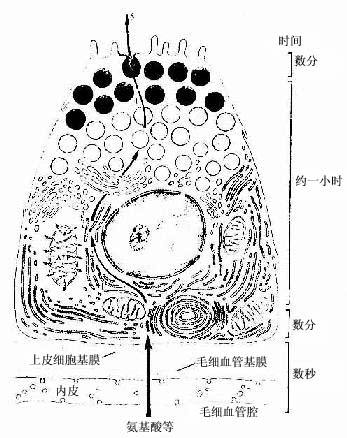
图2-16 胰腺浆液细胞分泌过程示意图
1.合成 2.输送 3.包裹 4.聚集 5.排出右侧表示每个步骤大致所需的时间
(三)糖蛋白分泌细胞
糖蛋白分泌细胞(glycoprotein-secreting cell)分泌糖蛋白,也称粘蛋白(mucoprotein,mucin)。细胞分泌的糖蛋白放后与水结合成粘性液体,称粘液(mucus),覆盖在上皮游离面,起滑润和保护上皮的作用。人体分泌粘液的细胞很多,主要分布于消化管和呼吸道。杯状细胞是散在于上皮中的一种典型的分泌粘液的细胞。另外,分泌粘液的细胞也组成大小不等的腺。分泌粘液的细胞大多呈柱状或锥体形,顶部胞质含许多较大的分泌颗粒,用PAS法染色时,颗粒着色很深;但在HE染色切片中,因不易保存分泌颗粒,致使分泌颗粒所在部位着色很浅,呈泡状或空泡状。细胞核常较扁,位于细胞基底部,核周围的胞质显弱嗜碱性。光镜下,将具有这些结构特点的细胞称粘液性细胞(mucous cell)。电镜下见到,细胞基底部有较多的粗面内质网和游离核糖体。高尔基复合体很发达,位于核上方。顶部胞质中含有许多有膜包裹的分泌颗粒。不同的腺分泌的糖蛋白化学组成有差别,腺细胞的结构也有所不同。
糖蛋白的合成包括蛋白质和多糖的合成,以及蛋白质与多糖结合形成糖蛋白。蛋白质的合成过程与蛋白质分泌细胞基本相同,多糖在高尔基复合体合成,并在此与蛋白质结合成糖蛋白。然后形成分泌颗粒,聚集在细胞顶部,以出胞方式将分泌物释放到细胞外。
(四)类固醇分泌细胞
类固醇分泌细胞(steroid secreting cell)的分泌物为类固醇激素(也称甾类激素)。细胞呈多边形或圆形,核圆形,位于细胞中央,胞质中含许多小脂滴。在HE染色切片中,脂滴中的脂类已被溶解,使胞质泡沫状。电镜下,这类细胞的胞质中粗面内质网和游离核糖体少。滑面内质网丰富,呈管状互相通连成网。高尔基复合体很大,位于核附近,有许多大小不等的线粒体,它们的嵴常呈管状。胞质中有许多含脂类的小泡,但无分泌颗粒(图2-17)。这类细胞贮存分泌物(激素)很少。脂类小泡中贮存较多的胆固醇和甘油三脂,是合成激素的原料。类固醇激素的合成是在滑面内质网和线粒体的酶共同参与下完成的,高尔基复合体也与分泌物合成有关,但确实的作用还不清楚。
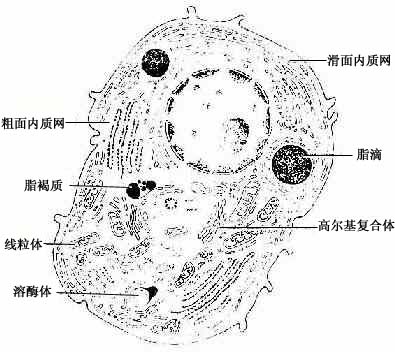
图2-17 类固醇分泌细胞超微结构模式图
(五)多肽分泌细胞
多肽分泌细胞(polyopeptide-secreting cell)能摄取胺或胺前体物,并经脱羧作用将胺前体物转变为胺,并能合成肽。具有这种共同细胞化学特性的细胞统称为APUD细胞(amine precursor uptake and decarboxylationcell)。APUD细胞常单个或成群地存在于一些器官或组织中。在光镜下,APUD细胞形状多为圆形、多边形或锥形,胞质着色浅。细胞基底部胞质内含大小不等的分泌颗粒,故又称基底颗粒细胞(basal granular cell)。HE染色标本中分泌颗粒不易辨认。有些细胞经铬盐染色,颗粒呈棕黄色,称嗜铬细胞。许多细胞可被银盐染色,颗粒着棕黑色,称亲银细胞或嗜银细胞。电镜观察,细胞基底部颗粒的大小、形状及电子致密度依细胞类型而各有不同。胞质内含少量粗面内质网及高尔基复合体,滑面内质网及游离核糖体较丰富。细胞内肽的合成过程与合成蛋白质的细胞基本相同,胺大概在滑面内质网和高尔基复合体生成。分泌物以胞吐或分子渗出方式释放到细胞外。
(六)外分泌腺的结构的分类
按组成外分泌的细胞数目,外分泌腺可分为单细胞腺(unicellular gland)和多细胞腺(multicellular gland)。前述的杯状细胞就是单细胞腺,但人体中大多数腺是多细胞腺。多细胞腺大小不等,一般都由分泌部和导管两部分组成(图2-18)。
1.分泌部分泌部(secretory portion)的形状为管状、泡状或管泡状。泡状和管泡状的分泌部常称腺泡(acinus)。分泌部一般由一层细胞组成,中央有腔。根据分泌部的形状,腺可分为管状腺(tubular)、泡状腺(acinar gland)和管泡状腺(tubuloacinar gland)(图2-18)
组成分泌部的腺细胞结构,因腺的种类和分泌物性质的不同而有显著差别。消化系统和呼吸管道的一些外分泌腺,分泌部由浆液性细胞或粘液性细胞组成;据此,可将这些腺分为以下几种类型:①浆液性腺(serous gland),腺的分泌部都由浆液性细胞组成;②粘液性腺(mucous gland),腺的分泌部都由粘液性细胞组成;③混合性腺(mixed gland),是指由浆液性细胞和粘液性腺泡共同组成的腺,并常有由浆液性细胞和粘液性细胞一起组成的混合性腺泡(mixed acinus)。但需说明,这种按浆液性细胞和粘液性细胞对腺的分类,只适用于一部分外分泌腺。还有相当多的腺不能按上述特点分类。
2.导管导管(duct)与分泌部直接通连,由单层或复层上皮构成。导管主要是排出分泌物,但有些腺的导管还有吸收水和电解质及排泌作用。导管有无分支也是外分泌腺分类的一个依据。有些腺的一个或几个分泌部通连一条不分支的导管,称单腺(simple gland);有些腺的导管分成大小不等的几级分支,最小的导管未端通连分泌部,称复腺(compound gland)。通常是把分泌部的形状和导管是否分支两个因素结合一起,将腺进行分类的(图2-18)。
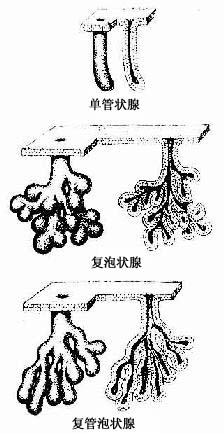
图2-18 外分泌腺的形态分类
三、上皮组织的更新和再生
上皮组织具有较强的再生能力。在生理状态下,有些部位被覆上皮的细胞不断死亡脱落,这在皮肤的复层扁平上皮和胃肠的单层柱状上皮尤为明显。上皮细胞死亡脱落后,不断由上皮中存在的幼稚细胞增殖补充,这些幼稚细胞具有分裂能力,这是生理性的更新。由于炎症或创伤等病理原因所致的上皮损伤,由周围未受损伤的上皮细胞增生补充,新生的细胞移到损伤表面,形成新的上皮,这是病理性再生。
第三章 结缔组织
结缔组织(connective tissue)由细胞和大量细胞间质构成,结缔组织的细胞间质包括基质、细丝状的纤维和不断循环更新的组织液,具有重要功能意义。细胞散居于细胞间质内,分布无极性。广义的结缔组织,包括液状的血液、松软的固有结缔组织和较坚固的软骨与骨;一般所说的结缔组织仅指固有结缔组织而言。结缔组织在体内广泛分布,具有连接、支持、营养、保护等多种功能。
结缔组织均起源于胚胎时期的间充质(mesenchyme)。间充质由间充质细胞和大量稀薄的无定形基质构成。间充质细胞呈星状,细胞间以突起相互连接成网,核大,核仁明显,胞质弱嗜碱性(图3-1)。间充质细胞分化程度低,在胚胎时期能分化成各种结缔细胞、内皮细胞、平滑肌细胞等。成体结缔组织内仍保留少量未分化的间质细胞。
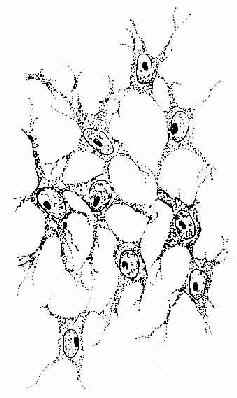
图3-1 间充质
本章讲述固有结缔组织(connectivetissue proper),按其结构和功能的不同分为疏松结缔组织、致密结缔组织、脂肪组织和网状组织。
一、疏松结缔组织
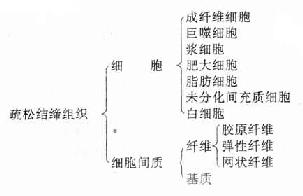
疏松结缔组织(loose connectivetissue)又称蜂窝组织(areolar tissue),其特点是细胞种类较多,纤维较少,排列稀疏。疏松结缔组织在体内广泛分布,位于器官之间、组织之间以至细胞之间,起连接、支持、营养、防御、保护和修复等功能。
疏松结缔的组成如下:
(一)细胞
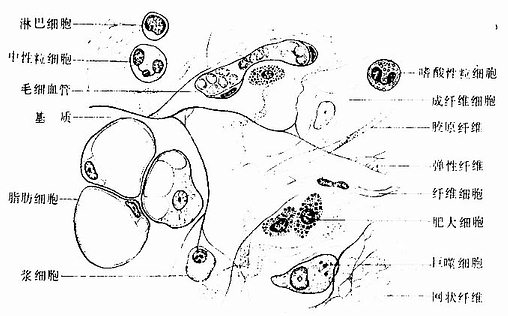
图3-2 疏松结缔组织铺片模式图
疏松结缔的细胞种类较多,其中包括成纤维细胞、巨噬细胞、浆细胞、肥大细胞、脂肪细胞、未分化的间充质细胞。此外,血液中的白细胞,如嗜酸性粒细胞、淋巴细胞等在炎症反应时也可游走到结缔组织内。各类细胞的数量和分布随疏松结缔组织存在的部位和功能状态而不同。
1.成纤维细胞成纤维细胞(fibroblast)是疏松结缔组织的主要细胞成分。细胞扁平,多突起,呈星状,胞质较丰富呈弱嗜碱性。胞核较大,扁卵圆形,染色质疏松着色浅,核仁明显(图3-2)。在电镜下,胞质内富于粗面内质网、游离核糖体和发达的高尔基复合体,表明细胞合成蛋白质功能旺盛(图3-3,3-4)。成纤维细胞既合成和分泌胶原蛋白,弹性蛋白,生成胶原纤维、网状纤维和弹性纤维,也合成和分泌糖胺多糖和糖蛋白等基质成分。
成纤维细胞处于功能静止状态时,称为纤维细胞(fibrocyte)(图3-3)。细胞变小,呈长梭形,胞核小,着色深,胞质内粗面内质网少、高尔基复合体不发达。在一定条件下,如创伤修复,结缔再生时,纤维细胞又能再转变为成纤维细胞。同时,成纤维细胞也能分裂增生。
图 3-3 成纤维细胞(左)和纤维细胞(右)超微结构模式图
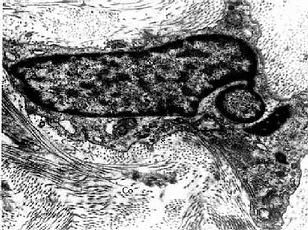
图 3-4 人真皮成纤维细胞电镜像 ×21000
Co胶原原纤维 (上海医科大学电镜室供图)
成纤维细胞常通过基质糖蛋白的介导附着在胶原纤维上。在趋化因子(如淋巴因子、补体等)的吸引下,成纤维细胞能缓慢地向一定方向移动。
2.巨噬细胞巨噬细胞(macrophage)是体内广泛存在的具有强大吞噬功能的细胞。在疏松结缔组织内的巨噬细胞又称为组织细胞(histiocyte),常沿纤维散在分布,在炎症和异物等刺激下活化成游走的巨噬细胞。巨噬细胞形态多样,随功能状态而改变,通常有钝圆形突起,功能活跃者,常伸出较长的伪足而形态不规则。胞核较小,卵圆形或肾形,多为偏心位,着色深,核仁不明显,胞质丰富,多呈嗜酸性,含空泡和异物颗粒,电镜下,细胞表面有许多皱褶、小泡和微绒毛,胞质内含大量初级溶酶体、次级溶酶体、吞噬体、吞饮小泡和残余体。细胞膜附近有较多的微丝和微管(图3-5,3-6)。
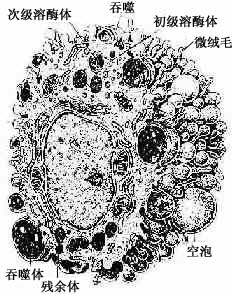
图3-5 巨噬细胞超微结构立体模式图
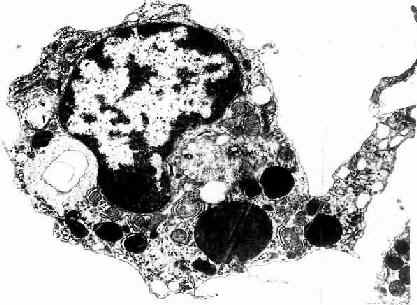
图3-6 猴巨噬细胞电镜像×8400
(白求恩医科大学尹昕、朱秀雄教授供图)
巨噬细胞是由血液内单核细胞穿出血管后分化而成。此时,细胞变大,线粒体及溶酶体增多,粘附和吞噬能力增强。在不同组织器官内的巨噬细胞存活时间不同,一般为2个月或更长。
巨噬细胞有重要的防御功能,它具有趋化性定向运动、吞噬和清除异物及衰老伤亡的细胞、分泌多种生物活性物质以及参与和调节人体免疫应答等功能。
(1)趋化性定向运动:巨噬细胞可沿某些化学物质的浓度梯度进行定向移动,聚集到产生和释放这些化学物质的病变部位,这种特性称为趋化性(chemotaxis)。这类化学物质称为趋化因子(chemotactic factor),如补体C5a、细菌的产物、炎症组织的变性蛋白等。
(2)吞噬作用:巨噬细胞具有强大的吞噬能力,包括非特异性吞噬作用和特异性吞噬作用。巨噬细胞经趋化性定向运动抵达病变部位时,即伸出伪足并粘附和包围细菌、异物、衰老伤亡的细胞等,进而摄入胞质内形成吞噬体或吞饮小泡。吞噬体、吞饮小泡与初级溶酶体融合,形成次级溶酶体,异物颗粒被溶酶体酶消化分解后,成为残余体。
在非特异性吞噬过程中,巨噬细胞直接识别和粘附被吞噬物,如碳粒、粉尘、衰老的细胞和某些细菌。巨噬细胞表面有多种受体,有的能与抗体结合(Fc受体);有的能与补体结合(C3受体);有的能与纤维粘连蛋白结合(纤维粘连蛋白受体),在特异性吞噬过程中,抗体,补体、纤维粘连蛋白作为识别因子先将细菌、病毒、异体细胞、受损伤的细胞等包裹起来,通过它们与巨噬细胞表面相应的受体结合,才能被巨噬细胞识别和粘附,启动巨噬细胞的吞噬过程,并显著增强吞噬作用(图3-7)。这种免疫吞噬作用是巨噬细胞重要的功能特征。
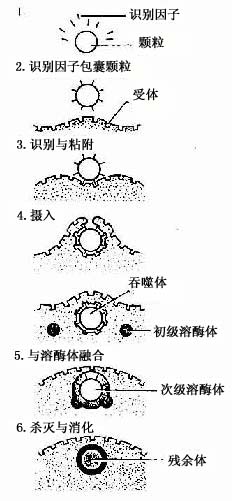
图3-7 巨噬细胞特异性吞噬过程示意图
(3)分泌作用 :巨噬细胞有活跃的分泌功能,能合成和分泌数十种生物活性物质,如溶菌酶(lysozyme)、干扰素(interferon)、补体(complement)等参与机体的防御功能。还能分泌血管生成因子、造血细胞集落刺激因子、血小板活化因子等激活和调节有关细胞功能活动的多种物质。
(4)参与和调节免疫应答:巨噬细胞能捕捉、加工处理和呈递抗原。被巨噬细胞捕捉的抗原经加工处理后,与主要组织相容性复合体(MHC)的Ⅱ类基因产物结合,形成抗原-MHCⅡ类分子复合物贮存在巨噬细胞表面、并呈递给淋巴细胞,启动淋巴细胞发生免疫应答。其次,巨噬细胞本身也是免疫效应细胞,活化的巨噬细胞能杀伤病原体和肿瘤细胞。此外,巨噬细胞分泌的某些生物活性物质如白细胞介素Ⅰ(interleukinⅠ,IL-Ⅰ)、干扰素等也参与调节免疫应答。
3.浆细胞浆细胞(plasmacell)通常在疏松结缔组织内较少,而在病原菌或异性蛋白易于入侵的部位如消化道、呼吸道固有层结缔组织内及慢性炎症部位较多。细胞卵圆形或圆形,核圆形,多偏居细胞一侧,染色质成粗块状沿核膜内面呈辐射状排列。胞质丰富,嗜碱性,核旁有一浅染区(图3-2)。电镜下,胞质内含有大量平行排列的粗面内质网和游离的多核糖体。发达的高尔基复合体和中心体位于核旁浅染区内(图3-8,3-9)。
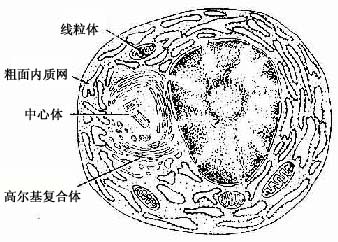
图3-8 浆细胞超微结构模式图
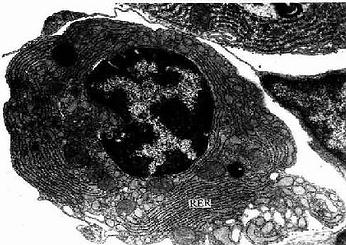
图3-9 猴浆细胞电镜像×10250
RER:粗面内质网
(白求恩医科大学尹昕、朱秀雄教授供图)
浆细胞具有合成、贮存与分泌抗体(antibody)即免疫球蛋白(immunoglobulin,Ig)的功能,参与体液免疫应答。浆细胞来源于B淋巴细胞。在抗原的反复刺激下,B淋巴细胞增殖、分化,转变为浆细胞,产生抗体。抗体能特异性地中和、消除抗原。
4.肥大细胞肥大细胞(mastcell)较大,呈圆形或卵圆形,胞核小而圆,多位于中央。胞质内充满异染性颗粒,颗粒易溶于水(图3-2)。电镜下,颗粒大小不一,圆形或卵圆形,表面有单位膜包裹,内部结构常呈多样性,在深染的基质内含螺状或网格状晶体,或含细粒状物质(图3-10)。肥大细胞分布很广,常沿小血管和小淋巴管分布。
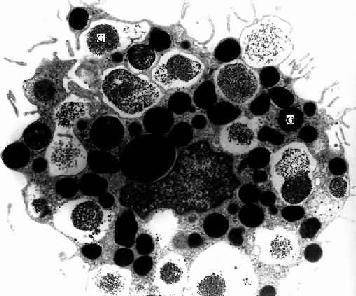
图3-10 大鼠肥大细胞脱颗粒(G)
(同济医科大学阮幼冰教授供图)
肥大细胞与变态反应有密切关系。肥大细胞合成和分泌多种活性介质,包括组胺(histamine)、嗜酸性粒细胞趋化因子(ECF-A)、白三烯(leukotriene)和肝素(heparin)等。组胺、白三烯能使细支气管平滑肌收缩,使微静脉及毛细血管扩张,通透性增加。嗜酸性粒细胞趋化因子能吸引嗜酸性粒细胞到变态反应的部位,肝素则有抗凝血作用。组胺、嗜酸性粒细胞趋化因子和肝素等合成后贮存于颗粒内并能迅速释放。释放时颗粒合并,形成脱粒管道,开口于细胞表面;白三烯则不在颗粒内贮存,其释放较组胺等迟缓(图3-11)。
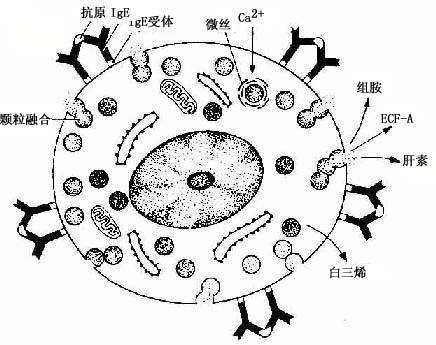
图3-11 肥大细胞脱颗粒示意图
肥大细胞脱颗粒、释放介质是一种特异性反应。机体受过敏原(如花粉、某些药物等)的刺激后,浆细胞产生亲细胞性抗体IgE。肥大细胞膜表面有IgE受体,当IgE与肥大细胞的IgE受体结合后,机体即对该过每原呈致敏状态。当机体再次接触相同的过敏原时,少量的过敏原便可与肥大细胞上的IgE结合,启动肥大细胞脱颗粒,释放介质,引起过敏反应(图3-11),如在皮肤引起荨麻疹,在呼吸道引起支气管哮喘等。
一般认为,肥大细胞的祖细胞来源于骨髓,经血流迁移到结缔组织内,发育为肥大细胞。组织内的肥大细胞可分裂增殖,其寿命数天至数月。
5.脂肪细胞脂肪细胞(fatcell)常沿血管分布,单个或成群存在。细胞体积大,常呈圆球形或相互挤压成多边形。胞质被一个大脂滴推挤到细胞周缘,包绕脂滴。核被挤压成扁圆形,连同部分胞质呈新月形,位于细胞一侧。在HE标本中,脂滴被溶解,细胞呈空泡状(图3-2)。脂肪细胞有合成和贮存脂肪、参与脂质代谢的功能。
6.未分化的间充质细胞未分化的间充质细胞(undifferentiated mesenchymal cell)是保留在成体结缔组织内的一些较原始的细胞,它们保持着间充质细胞的分化潜能,在炎症与创伤时可增殖分化为成纤维细胞、脂肪细胞。间充质细胞常分布在小血管尤其是毛细血管周围,并能分化为血管壁的平滑肌和内皮细胞。
7.白细胞血液内的白细胞,受趋化因子的吸引,常穿出毛细血管和微静脉,游走到疏松结缔组织内,行使其功能,参与免疫应答和炎症反应。疏松结缔组织内以嗜酸性粒细胞、淋巴细胞、中性粒细胞多见。游走出的单核细胞将分化为巨噬细胞。
(二)纤维
1.胶原纤维胶原纤维(collagenousfiber)数量最多,新鲜时呈白色,有光泽,又名白纤维。He 染色切片中呈嗜酸性,着浅红色。纤维粗细不等,直径1-20μm,呈波浪形,并互相交织。胶原原纤维由直径20~200nm的胶原原纤维粘合而成(图3-2)。电镜下,胶原原纤维显明暗交替的周期性横纹,横纹周期约64nm(图3-12)。胶原纤维的韧性大,抗拉力强。胶原纤维的化学成分为Ⅰ型和Ⅱ型胶原蛋白。胶原蛋白(简称胶原,collagen)主要由成纤维细胞分泌。分泌到细胞外的胶原再聚合成胶原原纤维,进而集合成胶原纤维。

图3-12 人胶原纤维电镜像×150000
(同济医科大学武忠弼教授供图)
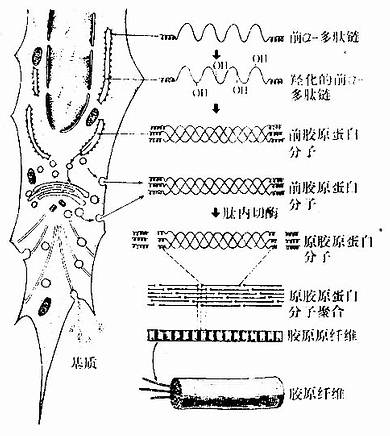
图3-13胶原纤维与基质形成过程示意图
胶原纤维形成的基本过程如下(图3-13):
(1)细胞内合成前胶原蛋白分子:成纤维细胞摄取合成蛋白质所需的氨基酸,包括脯氨酸、赖氨酸和甘氨酸,在粗面内质网的核糖体上按照特定的胶原mRNA的碱基序列,合成前α-多肽链。后者边合成边进入粗面内质网腔内,并在羟化酶的作用下,将肽链中的脯氨酸和赖氨酸羟化。经羟化后,三条前α-多肽链互相缠绕成绳索状的前胶原蛋白分子(procollagen molecule)。溶解状态的前胶原蛋白分子,两端未缠绕,呈球状构型,在粗面内质网腔内或转移到高尔基复合体内加入糖基后,分泌到细胞外。
(2)原胶原蛋白分子的细胞外聚合:细胞外的前胶原蛋白分子,在肽内切酶的作用下,切去分子两端球状构形部分,形成原胶原蛋白分子(tropocol-lagen)粗约1.5nm,长约300nm。原胶原蛋白分子平行排列聚合成胶原原纤维。聚合时,相互平行的相邻分子错开1/4分子长度,同一排的分子,首尾相对并保持一定距离,聚合成束,于是形成具有64nm周期横纹的胶原原纤维。聚合时,分子内、分子间的化学基因进行缩合、交联,增加原纤维的稳固性。若干胶原原纤维经糖蛋白粘合成粗细不等的胶原纤维。
胶原纤维的一菜成受多方面的影响和调控。如细胞内脯氨酸的含量直接影响前α-多肽链的合成。缺氧或缺乏维生素C或Fe2+等辅助因子,导致前α-多肽链的羟化受到抑制,造成前胶原蛋白合成障碍,影响创伤的愈合。聚合时,如胶原蛋白分子内和分子间的交联障碍(常因赖氨酰氧化酶不足所致)将影响胶原纤维的稳固性。除成纤维细胞外,成骨细胞、软骨细胞、某些平滑肌细胞等起源于间充质的细胞以及多种上皮细胞也能产生胶原蛋白。
不同组织的胶原蛋白其分子类型不同,已证实α-多肽链按其一级结构分为α1,α2,α3,三类,各类又分为10型,如α1(Ⅰ)、α1(Ⅱ)、α1(Ⅲ)、α1(Ⅲ)……α1(X)。
根据构成胶原蛋白三股肽链的不同,现已发现有11种不同类型的胶原。现将主要几种类型的组成、分布和特点列举于表(表3-1)。
表3-1 胶原蛋白的类型、分布和特点
| 类型 | 前胶原蛋白 的三股肽链 |
分 布 | 主 要 特 点 |
| Ⅰ | [α1(Ⅰ)]2α2(Ⅰ) | 真皮、筋膜、巩膜、被膜、腱、纤维软骨、骨、牙本质 | 构成致密并有横纹的粗纤维束,抗拉力强 |
| Ⅱ | [α1(Ⅱ)]3 | 透明软骨和弹性软骨 | 构成有横纹的细原纤维,抗压力较强 |
| Ⅲ | [α1(Ⅲ)]3 [α1(Ⅳ)]2α2(Ⅳ) |
网状纤维、平滑肌、神经内膜、动脉、肝、脾、肾、肺、子宫 | 构成有横纹的细原纤维,维持器官的形态结构 |
| Ⅳ |
二、致密结缔组织
致密结缔组织(dense connective tissue)是一种以纤维为主要成分的固有结缔组织,纤维粗大,排列致密,以支持和连接为其主要功能。根据纤维的性质和排列方式,可区分为以下几种类型。
1.规则的致密结缔组织主要构成肌腱和腱膜。大量密集的胶原纤维顺着受力的方向平行排列成束,基质和细胞很少,位于纤维之间。细胞成分主要是腱细胞,它是一种形态特殊的成纤维细胞,胞体伸出多个薄翼状突起插入纤维束之间,胞核扁椭圆形,着色深(图3-16)。

图3-16 肌腱与腱细胞
2.不规则的致密结缔组织见于真皮、硬脑膜、巩膜及许多器官的被膜等,其特点是方向不一的粗大的胶原纤维彼此交织成致密的板层结构,纤维之间含少量基质和成纤维细胞。
3.弹性组织弹性组织(elastic tissue)是以弹性纤维为主的致密结缔组织。粗大的弹性纤维或平行排列成束,如项韧带和黄韧带,以适应脊柱运动;或编织成膜状,如弹性动脉中膜,以缓冲血流压力。
机体内还有一些部位的结缔组织、纤维细密,细胞种类和数量较多,常称为细密结缔组织,如消化道和呼吸道粘膜的结缔组织。
三、脂肪组织
脂肪组织(adipose tissue)主要由大量群集的脂肪细胞构成,由疏松结缔组织分隔成小叶(图3-17)。根据脂肪细胞结构和功能的不同,脂肪组织分为两类。
1.黄(白)色脂肪组织呈黄色 (在某些哺乳动物呈白色),即通常所说的脂肪组织。它由大量单泡脂肪细胞集聚而成,细胞中央有一大脂滴,胞质呈薄层,位于细胞周缘,包绕脂滴。在HE切片上,脂滴被溶解成一大空泡。胞核扁圆形,被脂滴推挤到细胞一侧,连同部分胞质呈新月形(图3-18)。黄色脂肪组织主要分布在皮下、网膜和系膜等处,约占成人体重的10%,是体内最大的贮能库,参与能量代谢,并具有产生热量、维持体温、缓冲保护和支持填充等作用。
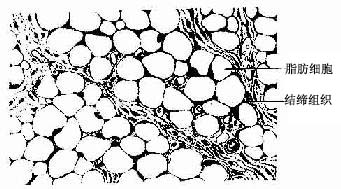
图3-17 脂肪组织
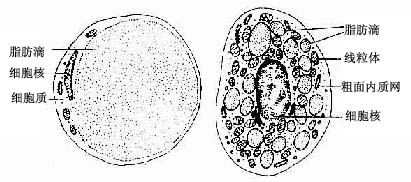
图3-18 单泡脂肪细胞和多泡脂肪细胞超微结构模式图
2.棕色脂肪组织呈棕色,其特点是组织中有丰富的毛细血管,脂肪细胞内散在许多小脂滴,线粒体大而丰富,核圆形,位于细胞中央。这种脂肪细胞称为多泡脂肪细胞(图3-18)。
棕色脂肪组织在成人极少,新生儿及冬眠动物较多,在新生儿主要分布在肩胛间区、腋窝及颈后部等处。棕色脂肪组织的主要功能是,在寒冷的刺激下,棕色脂肪细胞内的脂类分解、氧化,散发大量热能,而不转变为化学能。这一功能受交感神经调节。
四、网状组织
网状组织(reticular tissue)是造血器官和淋巴器官的基本组织成分,由网状细胞(reticular cell)、网状纤维和基质构成。网状细胞是有突起的星状细胞,相邻细胞的突起相互连接成网(图3-19)。胞核较大,圆或卵圆形,着色浅,常可见1~2个核仁。胞质较多,粗面内质网较发达。
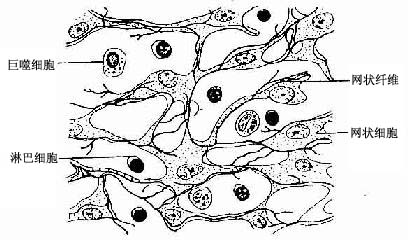
图3-19 网状组织
网状细胞产生网状纤维。网状纤维分支交错,连接成网,并可深陷于网状细胞的胞体和突起内,成为网状细胞依附的支架。网状组织为淋巴细胞发育和血细胞发生提供适宜的微环境。
第四章 软骨和骨
软骨与骨是构成身体支架的器官,它们分别以软骨组织和骨组织为主要结构成分。在人的一生中,这两种组织尤其是骨组织能不断更新和改建,从而适应成年前机体的生长发育和成年后机体支持功能的变化需求。人体99%以上的钙和85%的磷以羟基磷灰石的形式贮于骨组织中,因而骨又是人体的钙、磷贮存库。
一、软骨
软骨(cartilage)由软骨组织及其周围的软骨膜构成。软骨是固态的结缔组织,略有弹性,能承受压力和耐磨擦,有一定的支持和保护作用。胎儿早期的躯干和四肢支架主要为软骨,至成体,软骨仅分布于关节面、椎间盘、某些骨连接部位、呼吸道及耳廓等处。软骨组织由软骨细胞、基质及纤维构成。根据软骨组织所含纤维的不同,可将软骨分为透明软骨、纤维软骨和弹性软骨三种。
(一)透明软骨
透明软骨(hyaline cartilage)分布较广,成体的关节软骨、肋软骨及呼吸道的一些软骨均属这种软骨。新鲜时呈半透明状,较脆,易折断。透明软骨间质中的纤维为胶原原纤维,含量较少,基质较丰富。
1.透明软骨的结构
(1)软骨细胞(chondrocyte):位于软骨基质内的小腔――软骨陷窝(cartilage lacuna)中。陷窝周围有一层含硫酸软骨素较多的基质,称软骨囊(cartilage capsule),染色时呈强嗜碱性。软骨细胞在软骨内的分布有一定规律,靠近软骨膜的软骨细胞较幼稚,体积小,呈扁圆形,单个分布;位于软骨中部的软骨细胞接近圆形,成群分布,每群有2~8个细胞,它们是由一个细胞分裂增生而成,故称同源细胞群(isogenous group)。同源细胞群中的细胞分别围以软骨囊。软骨细胞核呈椭圆形,细胞质弱嗜碱性。新鲜软骨的软骨细胞充满于软骨陷窝内。但在HE染色切片中,细胞收缩成不规则形,故软骨囊和细胞之间出现较大的空隙(图4-1)。软骨细胞的超微结构特点是胞质内有丰富的粗面内质网和发达的高尔基复合体,还有一些糖原和脂滴,线粒体较少(图4-2)。软骨细胞主要以糖酵解方式获得能量。
(2)基质:透明软骨基质的化学成分主要为嗜碱性软骨粘蛋白,它以长链的透明质酸分子为主干,干链上以许多较短的蛋白质链连接硫酸软骨素A、C和硫酸角质素(见图3-15)。这种羽状分支的大分子结合着大量的水,大分子又引互结合构成分子筛,并和胶原原纤维结合在一起形成固态结构。软骨内无血管,但由于软骨基质内富含水分(约占软骨基质的75%),通透性强,故软骨深层的软骨细胞仍能获得必需的营养。
(3)纤维:透明软骨中无胶原纤维,但有一些由Ⅱ型胶原组成的胶原原纤维,它们呈交织状分布(图4-2)。胶原原纤维直径为10~20nm,无明显横纹,其折光率与基质相近,故在光镜下不易分辨。软骨囊含硫酸软骨素较多,含胶原原纤维少或无,故嗜碱性较强。软骨囊之间则含胶原原纤维较多,故呈弱嗜酸性。
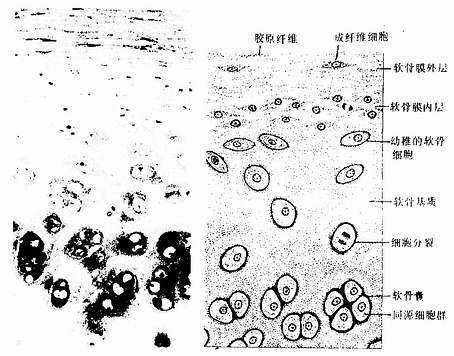
图4-1 透明软骨
左图为人气管透明软骨 HE×100
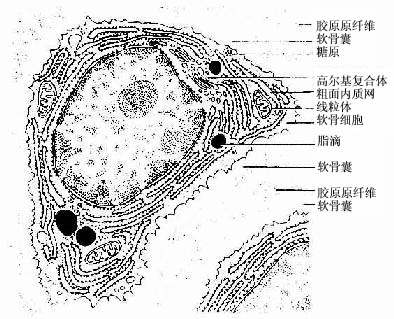
图4-2 透明软骨超微结构模式图
2.软骨膜除关节面的关节软骨外,软骨的表面均覆有较致密的结缔组织,即软骨膜(perichondrium)。软骨膜分内、外二层,外层纤维多,细胞少,主要起保护作用,内层纤维少,细胞较多,其中有些梭形小细胞,称骨原细胞,可增殖分化为软骨细胞(图4-1)。软骨的营养来自软骨周围的血管,并可通过软骨膜渗透至软骨内部,供应软骨细胞。
3.软骨的生长方式软骨有两种并存的生长方式
(1)间质生长(interstitial growth):或称软骨内生长,是通过软骨内软骨细胞的长大和分裂,进而不断地产生基质和纤维,使软骨从内部生长增大。
(2)外加生长(appositional growth):或称软骨膜下生长,是通过软骨膜内层的骨原细胞向软骨表面不断添加新的软骨细胞,产生基质和纤维,使软骨从表面向外扩大。
(二)纤维软骨
纤维软骨(fibrous cartilage)分布于椎间盘、关节盘及耻骨联合等处。结构特点是有大量呈平行或交错排列的胶原纤维束,软骨细胞较小而少,常成行分布于纤维束之间(图4-3)。HE染色切片中,胶原纤维染成红色,纤维束间的基质很少,呈弱嗜碱性,软骨囊则呈强嗜碱性。
(三)弹性软骨
弹性软骨(elastic cartilage)分布于耳廓及会厌等处。结构特点是间质中有大量交织分布的弹性纤维,软骨中部的纤维更为密集(图4-4)。弹性软骨具有较强的弹性。
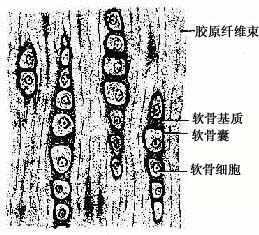
图4-3 纤维软骨
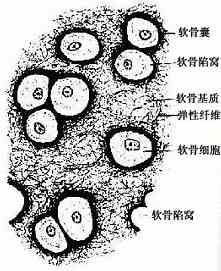
图4-4 弹性软骨
二、骨
骨由骨组织、骨膜及骨髓等构成。骨组织是坚硬而有一定韧性的结缔组织。
(一)骨组织的结构
骨组织(osseous tissue)由大量钙化的细胞间质及数种细胞组成。钙化的细胞间质称为骨基质(bone matrix)。细胞有骨原细胞、成骨细胞、骨细胞及破骨细胞四种。骨细胞最多,位于骨基质内,其余三种细胞均位于骨组织的边缘(图4-5)。
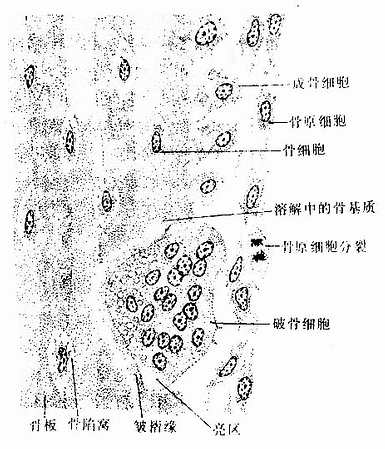
图4-5 骨组织和各种细胞
1.骨基质即骨的细胞间质,由有机成分和无机成分构成,含水极少。有机成分由成骨细胞分泌形成,包括大量胶原纤维(占有机成分的95%)及少量无定形基质。无定形基质为凝胶,内含中性或弱碱性糖胺多糖,有粘着胶原原纤维的作用。基质中还含有两种钙结合蛋白:骨钙蛋白(osteocalcin)和骨磷蛋白(phosphophoryms)。前者有两个与钙亲合力强的部位,后者则有许多钙结合部位,但只有一部分骨磷蛋白是可溶性的,其余均与胶原纤维相结合。钙结合蛋白与钙化及钙的运输有关。无机成分又称骨盐(bone mineral),主要为羟磷灰石结晶(hydroxyapatite crystal,(Ca10(PO4)6( OH )2),属不溶性中性盐,呈细针状,长10~20nm,沿胶原原纤维长轴规则排列并与之结合。有机成分与无机成分的紧密结合使骨十分坚硬。
骨基质结构呈板层状,称为骨板(bone lamella),成层排列的骨板犹如多层木质胶合板。同一骨板内的纤维相互平行,相邻骨板的纤维则相互垂直,这种结构形式有效地增强了骨的支持力。
2.骨组织的细胞
(1)骨细胞(osteocyte):单个分散于骨板内或骨板间。骨细胞是有许多细长突起的细胞,胞体较小,呈扁椭圆形,其所在空隙称骨陷窝(bone lacuna),突起所在的空隙称骨小管(bone canaliculi)(图4-6)。相邻骨细胞的突起以缝隙连接相连,骨小管则彼此连通。骨陷窝和骨小管内含组织液,可营养骨细胞和输送代谢产物(图4-7)。骨陷窝周围的薄层骨基质钙化程度较低,并可不断更新,在机体需要时,骨细胞的溶骨作用可溶解此层骨基质,使Ca2+释放入骨陷窝的组织液中,继而进入血液,对维持血钙的恒态水平有一定作用。
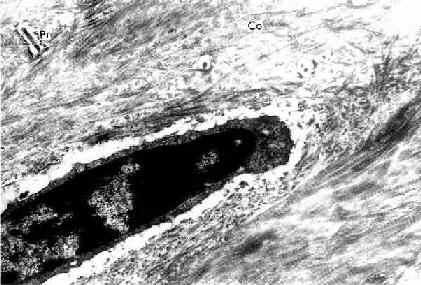
图4-6 小鼠骨细胞和骨基质(脱钙后)电镜像×25000
Pr骨细胞突起和骨小管,Co胶原原纤维
(上海医科大学电镜室供图)
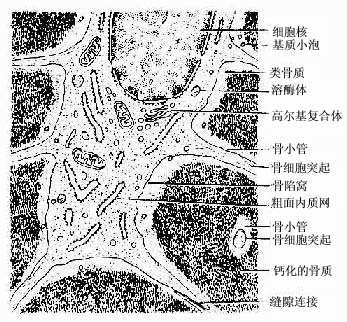
图4-7 骨细胞超微结构模式图
(2)骨原细胞(osteogenic cell):是骨组织中的干细胞,位于骨外膜及骨内膜贴近骨处。细胞较小,呈梭形,核椭圆形,细胞质少,弱嗜碱性。当骨组织生长或改建时,骨原细胞能分裂分化为成骨细胞(图4-5)。
(3)成骨细胞(osteoblast):分布在骨组织表面,成年前较多,常排成一层,成年后较少。成骨细胞是具有细小突起的细胞,胞体呈矮柱状或椭圆形,其突起常伸入骨质表层的骨小管内,与表层骨细胞的突起形成连接。核圆形,多位于细胞的游离端(图4-5)。胞质嗜碱性,电镜下可见大量粗面内质网和发达的高尔基复合体。成骨时,成骨细胞分泌骨基质的有机成分,称为类骨质(osteoid),同时以类似顶浆分泌的方式向类骨质中释放一些小泡,称基质小泡(matrix vesicle)。基质小泡直径约0.1μm,有膜包被,膜上有碱性磷酸酶、焦磷酸酶和ATP酶,泡内含钙和小的羟磷灰石结晶。一般认为,基质小泡是使类骨质钙化的重要结构。近年发现,骨基质中的钙结合蛋白均由成骨细胞分泌产生。当成骨细胞被类骨质包埋后,便成为骨细胞。
(4)破骨细胞(osteoclast):主要在骨组织表面,数目较少。破骨细胞是一种多核的大细胞,直径约100μm,含有2-50个核。目前认为它由多个单核细胞融合而成,无分裂能力。光镜下,破骨细胞贴近骨基质的一侧有纹状缘(图4-5),胞质呈泡沫状,在HE染色的切片中胞质易为伊红染色。电镜下可其贴近骨基质一侧有许多不规则的微绒毛,称为皱褶缘(ruffled border)(图4-8),即光镜下的纹状缘。在皱褶缘的周缘有一环形胞质区,内有多量微丝,而无其它细胞器,称为亮区(clear zone)。亮区的细胞膜平整并紧贴于骨基质表面,形成一道环形胞质围墙,使所包围的区域成为封闭的微环境区。破骨细胞功能活跃时,向此区释放多种蛋白酶、碳酸酐酶、乳酸及柠檬酸等,在酶及酸的作用下使骨基质溶解。皱褶缘可增大吸收面积,电镜下可见皱褶缘基部有吞饮泡和吞噬泡,泡内含小骨盐晶体及解体的有机成分,表明破骨细胞有溶解和吸收骨基质的作用。
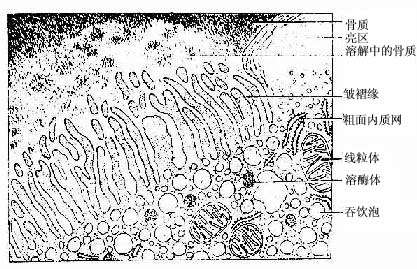
图4-8 破骨细胞超微结构模式图
(二)长骨的结构
长骨由骨松质、骨密质、骨膜、关节软骨及血管、神经等构成。
1.骨松质(spongy bone) 分布于长骨的骨骺和骨干的内侧份,是大量针状或片状骨小梁相互连接而成的多孔隙网架结构,网孔即骨髓腔,其中充满骨髓。骨小梁厚度一般为0.1-0.4mm,由数层平行排列的骨板和骨细胞构成(图4-9)。骨小管穿行表层骨板开口于骨髓腔,骨细胞从中获得营养并排出代谢产物。
2.骨密质(compact bone) 分布于长骨骨干和骨骺的外侧份。骨密质内的骨板排列很有规律,按骨板排列方工可分为环骨板、骨单位和间骨板。
(1)环骨板(circumferential lamella):分布于长骨干的外侧面及近骨髓腔的内侧面,分别称为外环骨板及内环骨板。外环骨板较厚,约有10~40层,较整齐地环绕骨干排列(图4-9)。内环骨板较薄,仅由数层骨板组成,排列不甚规则。外环骨板及内环骨板均有横向穿越的小管,统称穿通管(perforating canal,又称Volkmann管)。穿通管与纵行排列的骨单位中央管相通连(图4-9),它们都是小血管、神经及骨膜成分的通道,并含有组织液。
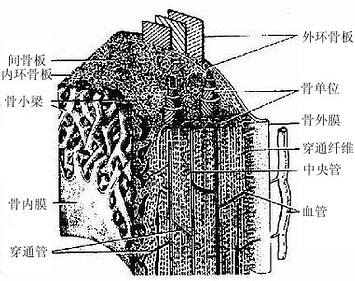
图4-9 长骨骨干结构模式图
(2)骨单位(osteon):又称哈弗系统(Haversian system),是长骨干起支持作用的主要结构单位。骨单位位于内、外环骨板之间在,数量较多,呈筒状,直径30~70μm,长0.6~2.5mm,由10~20层同心圆排列的骨板(哈弗骨板)围成。各层骨板之间有骨细胞。各层骨细胞的突起经骨小管穿越骨板相互连接。骨单位的中轴有一中央管(central canal),或称哈弗管(Haversian canal)(图4-9,4-10),内含骨膜组织、毛细血管(有的是微动静脉)和神经。
各个骨单位表面都有一层厚约2μm的粘合质,是一层含骨盐多而胶原纤维少或缺如的骨基质,在骨的横磨片上呈折光较强的轮廓线,称粘合线(cement line)(图4-10)。骨单位周边部的骨小管都在粘合线以内返折,不与相邻单位表面的骨小管通连。骨单位最内层的骨小管均开口于中央管,使每一骨单位内的骨细胞均能通过相互通连的骨小管获得营养。骨的内、外环骨板与骨单位交界处也有粘合线,但不如骨单位之间的明显。
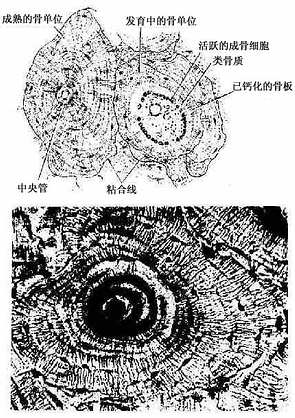
图4-10 骨单位
下图为人骨脱钙后冷冻切片硫堇染色×400
(上海医科大学组织胚胎学教研室供图)
(3)间骨板(interstitial lamella): 是填充在骨单位之间的一些不规则的平行骨板,它们是原有的骨单位或内外环骨板未被吸收的残留部分,其中除骨陷窝及骨小管外,无其它管道(图4-9)。
3.骨膜除关节面以外,骨的内、外表面分别覆以骨内膜和骨外膜。骨外膜(periosteum)分为两层:外层较厚,为致密结缔组织,纤维粗大而密集,有的纤维横向穿入外环骨板,称穿通纤维(perforating fiber)或Sharpey纤维,起固定骨膜和韧带的作用;内层较薄,结缔组织疏松,含骨原细胞和成骨细胞及小血管和神经。在骨髓腔面、骨小梁的表面、中央管及穿通管的内表面均衬有薄层结缔组织,即骨内膜(endosteum)。骨内膜的纤维细而少,细胞常排列成一层,颇似单层扁平上皮,细胞之间有缝隙连接,它们与骨细胞突起之间也有缝隙连接。这些细胞能分裂分化为成骨细胞。还有人认为这种细胞具有离子屏障功能,其作用是分隔骨细胞周液和骨髓腔内的组织液,使骨细胞周液维持一定的钙、磷浓度,有利于骨盐结晶的形成。
三、骨的发生
骨由间充质发生。从胚胎早期间充质向骨原基分化起始,到骨发育完善为止,历时约20年以上。骨的发育经历为断生长与改建的复杂演变,具体表现为两个方面,即骨组织形成与骨组织分解吸收,两者相辅相成。骨发育完善后,仍保持形成与分解吸收交替进行的内部改建,终身不止,但改建速度随年龄增长而逐渐缓慢。
骨的发生有两种方式:膜内成骨(intramembranous ossification)与软骨内成骨(endochondral ossification)
(一)膜内成骨
这种方式是先由间充质分化成为胚性结缔组织膜,然后在此膜内成骨。人体的顶骨、额骨和锁骨等即以此种方式发生。膜内成骨的具体的过程是:在将要形成骨的部位,血管增生,营养及氧供丰富;间充质细胞渐密集并分裂分化为骨原细胞,其中部分骨原细胞增大,成为成骨细胞;成骨细胞分泌类骨质,并被包埋其中,成为骨细胞;继而类骨质钙化成骨基质,形成最早出现的骨组织。最早形成骨组织的部位称为骨化中心(ossification center)。新形成的骨组织表面始终有成骨细胞或骨原细胞附着,它们向周围成骨,逐渐形成初级骨小梁(图4-11),构成初级骨松质。随后,初级骨松质周围的间充质分化为骨膜,此后即进入生长与改建阶段。以顶骨为例,随着脑的发育,原始顶骨也不断生长与改建,其外表面以成骨为主,使骨不断生长,内表面以分解吸收为主,为断改变骨的曲度,从而使顶骨的生长与脑的发育相适应。通过生长与内部改建,顶骨出现了以初级骨密质组成的外板与内板,以及其间由骨松质组成的板障,但至成年才发育完善。成年后其内部改建仍缓慢地进行。
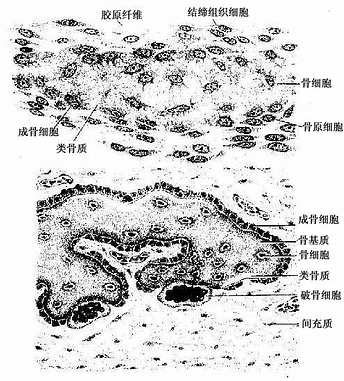
图4-11 膜内成骨过程
上图 骨化中心,类骨质形成 下图 形成初级骨小梁
(二)软骨内成骨
胎儿的大多数骨,如四肢骨、躯干骨及颅底骨等,均主要以软骨内成骨的方式发生。这种骨发生既包括与膜内成骨相似的发生过程,又包括软骨的持续生长与退化,以及软骨组织不断被骨组织取代的特有发生过程,而且其发生、生长与改建穿插交错的情况远较膜内成骨复杂。现以长骨的发生为例(图4-12)叙述如下。
1.软骨雏形形成在长骨将要发生的部位,间充质细胞密集并分化出骨原细胞,后者继而分化为软骨细胞。软骨细胞分泌软骨基质,细胞也被包埋其中,成为软骨组织。周围的间充质分化为软骨膜,于是形成一块透明软骨。其外形与将要形成的长骨相似,被称为软骨雏形(cartilage model)。
2.软骨周骨化是指软骨雏形中段周围产的骨形成。其过程先是软骨膜内出现血管,由于营养及氧供应充分,软骨膜深层的骨原细胞分裂并分化为成骨细胞。成骨细胞在软骨表面产生类骨质,自身也被包埋其中而成为骨细胞。类骨质随后钙化为骨基质,于是形成一圈包绕软骨中段的薄层初级骨松质。因此层骨松质犹如领圈,故名骨领(bone collar)。骨领表面的软骨膜从此改称骨外膜。骨外膜深层的骨原细胞不断分化为成骨细胞,向骨领表面及其两端添加新的骨小梁,使骨领的初级骨松质逐渐增厚,并从软骨中段向两端延伸。随着胚胎的发育,骨领初级骨松质中的成骨细胞不断向骨小梁壁上添加骨组织,使骨小梁的网孔逐渐变小。此过程的持续使初级骨松质逐渐成为初级骨密质。
3.软骨内骨化
(1)软骨退化与初级骨化中心形成:在骨领形成的同时,软骨雏形中段内的软骨细胞肥大并分泌碱性磷酸酶,使其周围的软骨基质钙化及肥大的软骨细胞自身退化死亡,留下较大的软骨陷窝。此变化示初级骨化中心即将在该区形成。初级骨化中心(primary ossification center)形成之初,血管连同破骨细胞及间充质等经骨外膜穿越骨领,进入退化软骨区,通过破骨细胞分解吸收钙化的软骨基质,形成许多与原始骨干长轴平行的隧道。隧道的壁为残存的钙化软骨基质,隧道的腔即初级骨髓腔。腔内充以来自间充质的骨原细胞和成骨细胞,以及破骨细胞和正在形成中的造血组织等,统称初级骨髓(primary bone marrow)。随后成骨细胞贴附于原始骨髓腔壁上(即残留的钙化软骨基质表面)生成骨组织,形成以钙化软骨基质为中轴表面附以骨组织的过渡型骨小梁。最开始出现过渡型骨小梁的部位即初级骨化中心。
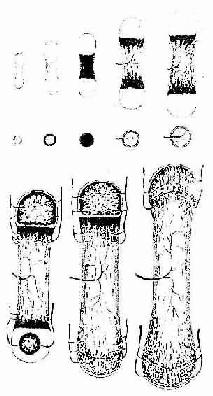
图4-12 软骨内成骨过程
中排为上排中段的横切面,小点示透明软骨,黑色
示钙化软骨基质,斜线示骨组织
(2)骨髓腔形成与骨的增长:初级骨化中心的过渡型骨小梁不久便被破骨细胞分解吸收,使许多初级骨髓腔合成一个较大的次级骨髓腔。骨领的内表面也逐渐被破骨细胞分解吸收。骨领的这种边形成边分解吸收的成骨过程,使骨干在增粗的同时保持骨组织的适当厚度,并使骨髓腔得以横向扩大。由于初级骨化中心两端的软骨组织不断生长,紧邻骨髓腔的软骨又不断退化,使初级骨化中心的骨化过程得以从骨干中段持续向两端进行,骨髓腔也随之纵向扩展。胎儿长骨的纵切面上,在骨的两端可观察到软骨内骨化的连续过程,表现为从软骨至骨干中段的骨髓腔之间,可依次分为下列代表成骨活动的四区(彩图4-13)。
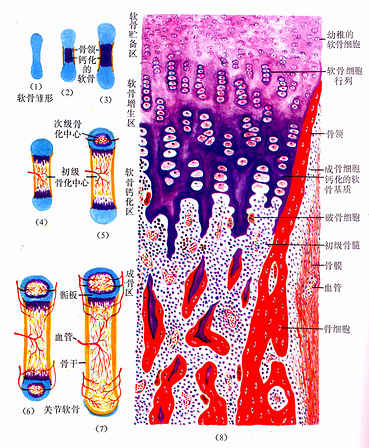
图4-13 长骨发生与生长 (1)~(7)示软骨内成骨及长骨生长
(8)示软骨被骨取代过程
软骨储备区(zone of reserve cartilage):软骨细胞较小,分散存在。软骨基质呈弱嗜碱性。
软骨增生区(zone of proliferating cartilage):软骨细胞较大,通过分裂形成的同源细胞群纵列成行,形成软骨细胞柱。
软骨钙化区(zone of calcifying cartilage):软骨细胞肥大,呈空泡状,核固缩,可见退化死亡软骨细胞留下的大陷窝。钙化的软骨基质呈强嗜碱性。
成骨区(zone of ossification):可见中轴为钙化软骨基质和表面为骨组织的过渡型骨小梁,小梁之间为隧道式初级骨髓腔。腔内有造血组织及血管,腔壁(即骨小梁表面)可见成骨细胞附着,破骨细胞也附骨小梁表面,附着处有凹陷,表明此处的骨基质已被分解吸收。
(3)次级骨化中心出现及骨骺形成:次级骨化中心(secondary ossification center)出现的时间因骨而异,早自出生前,晚至出生后数月或数年不等。出现的部位在骨干两端的软骨中央。次级骨化中心的发生过程与初级骨化中心相似。但骨化是从中央呈辐射状向四周进行的。最后以初级骨松质取代绝大部分软骨组织,使骨干两端转变成为早期骨骺。骺端表面始终保留薄层软骨,即关节软骨。早期骨骺与骨干之间亦保留一定厚度的软骨层,即骺软骨,称骺板(epiphyseal plate)(图4-12,4-13)。骺板软骨细胞继续分裂增殖及退化,破骨细胞及成骨细胞则不断从骨髓腔侧分解吸收钙化的软骨基质,并形成过渡型骨小梁,使骨化不断向两端推进,长骨因而不断增长(图4-14)至17-20岁时,骺板停止生长而被骨小梁取代,在长骨的干、骺之间留下线性痕迹,称为骺线(epiphyseal line)。早期骨骺通过生长及改建,最终形成内部为骨松质、表面为薄层骨密质的骨骺。
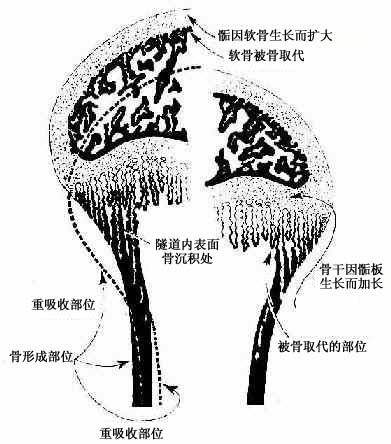
图4-14骨干骨密质形成和外形变化及骨骺发育示意图
(4)骨干骨密质形成及改建:构成原始骨干的初级骨松质,通过骨小梁增厚而使小梁之间的网孔变小,逐渐成为初级骨密质。初级骨密质中既无骨单位及间骨板,也不存在外、内环骨板。至1岁左右,由于破骨细胞在原始骨密质外表面顺长轴进行分解吸收,渐形成凹向深面的纵沟。骨外膜的血管及骨原细胞等随之进入沟内,由骨原细胞分化为成骨细胞造骨,先将纵沟封闭成管,再贴附于管壁表面,形成自外向内呈同心圆式排列的哈弗骨板。其中轴始终保留一条血管通道,即中央管。管内尚存的骨原细胞贴附于最内层哈弗骨板内表面,成为骨内膜。此即第一代骨单位(哈弗系统)的形成过程(图4-15)。第一代骨单位的形成是在初级骨密质被分解吸收的基础上进行的,故此代骨单位之间有残存的初级骨密质。以后第一代骨单位逐渐被第二代骨单位取代,残留的第一代骨单位片段便成为第二代骨单位之间的间骨板(图4-16)。后代骨单位取换前代的过程,称为骨单位改建。骨单位的出现与改建使初级骨密质成为次级骨密质。骨干伴随骨单位的相继形成而增粗,骨髓腔也因而明显扩大,成年后骨干不再增长,其内、外表面已出现环骨板。外环骨板的增厚约止于30岁左右,发育完善的骨干从此不再增粗,但其内部的骨单位改建仍持续进行。
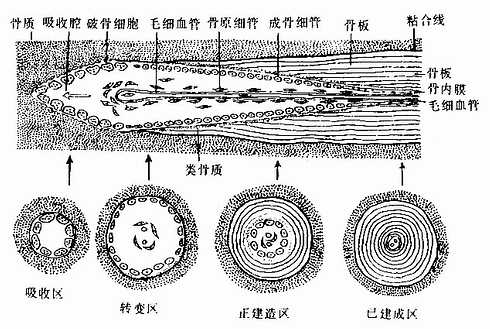
图4-15 骨单位形成过程模式图
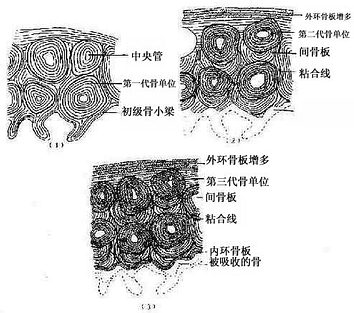
图4-16 骨密质改建示意图
(三)影响骨生长的因素
影响骨生长的因素很多,内因如遗传基因的表达和激素的作用等,外因如营养及维生素供应等。生长激素和甲状腺素可明显促进骺板软骨生长,若成年前这两种激素分泌过少,可致骺板软骨生长缓慢,肢体短小而成侏儒;若生长激素分泌过多,则骺板生长加速,可导致巨人症。甲状旁腺素通过反馈机制调节血钙水平,其调节方式是激活骨细胞和破骨细胞,通过溶骨作用分解骨盐,释放Ca2+入血,从而提高血钙水平。甲状旁腺素过多,有可能因骨盐大量分解而导致纤维性骨炎。降钙素能抑制骨盐溶解,并刺激骨原细胞分化为成骨细胞,增强成骨活动,使血钙入骨形成骨盐。雌激素可与成骨细胞膜上的雌激素受体结合,使其成骨活跃,产生足量的钙结合蛋白,促进类骨质的钙化。雌激素不足往往出现骨盐分解吸收过多,骨基质形成减少,绝经期妇女的骨质疏松症即起因于雌激素的不足。性腺发育不全可导致生长障碍而影响身高,肾上腺分泌的糖皮质激素对骨的形成有抑制作用。
维生素A可影响骨的生长速度,严重缺乏时骺板生长缓慢,以致骨生长迟缓甚至停止,维生素A过多则使破骨细胞过度活跃而易发生骨折,维生素C与成骨细胞合成胶原纤维有关,严重缺乏时,因骨的胶原纤维过少而易发生骨折,且骨折愈合极为缓慢。维生素D能影响骨钙的沉积,与类骨质能否及时钙化有关。儿童期缺乏维生素D可导致佝偻病,成人缺乏可导致骨软化症。近年发现成骨细胞表面有1,25-羟维生素D3(简称D3)受体,D3既可刺激成骨细胞分泌较多的钙结合蛋白,又能提高性碱性磷酸酶的活性而促进骨的钙化,临床疗效较好。
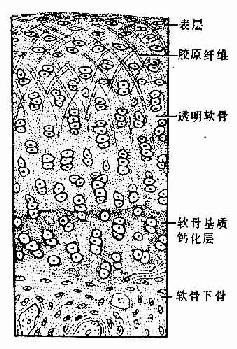
图4-17 关节软骨
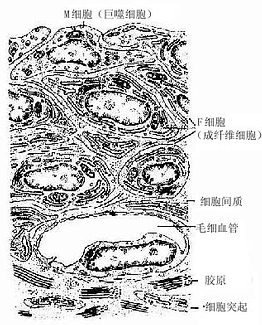
图4-18 滑腊超微结构模图
新近还发现骨内存在一些生物活性物质,通过分离和纯化骨的各种细胞和骨体外培养等研究,已肯定有些活性物质是由成骨细胞产生的。这些活性物质分别对成骨细胞及破骨细胞起激活或抑制作用,有的表现出旁分泌或自分泌作用。由于这些物质的改建密切有关,因此有人认为骨内存在着使骨生成与骨分解吸收相偶联的偶联因子。例如转化生长因子-β(TGF-β)、前列腺素、白细胞介素1和6、巨噬细胞释放的肽刺激因子等。
其它如细胞外钙、氧自由基特别是超氧阴离子、二萜烯等均能影响骨的生长发育。
四、关节
关节分可动与不可动两大类型。可动关节的结构比较复杂,由关节软骨、关节囊及滑液等构成。
1.关节软骨关节软骨(articular cartilage)为关节表面的薄层透明软骨,表面光滑,附有滑液,可减小关节运动时的磨擦力。关节软骨与一般的透明软骨有一定差异,表层的细胞较小,单个分布,深层的细胞较大,成行分布,近骨部的软骨基质钙化,钙化的软骨组织与骨骺的骨组织相连接,整个关节软骨基质内的胶原原纤维呈拱形排列,有加固软骨组织的作用(图4-17)。关节软骨的营养由滑液供应。
2.关节囊关节囊(articular capsule)可分内外两层。外层纤维排列紧密,与腱和韧带相连处明显增厚;内层较疏松,称为滑膜(synovial membrane)。滑膜内层常被覆2~4层扁平或立方形的上皮样结缔组织细胞,称为滑膜细胞(synovial cell),其基部无基膜,细胞间避孕药少量间质或纤维。电镜下可区分出两种滑膜细胞,一种似巨噬细胞,称M细胞,含溶酶体较多,有吞噬力;另一种似成纤维细胞,称F细胞,含粗而内质网较多,能分泌透明质酸和一些粘蛋白,组成滑液(图4-18)。
3.滑液滑液(synovial fluid)是关节囊内的少量透明粘性液体,其中除含大量水、透明质酸和粘液蛋白外,还含有少量细胞,主要为淋巴细胞和巨噬细胞。若所含细胞数量增多(>300个/μ1),特别是中性粒细胞增多,可作为病变的指征。
第五章 血液和血细胞发生
一.血液
血液(blood)约占体重的7%,在成人循环血容量约5L。血液由血浆(plasma)和血细胞(blood cell)组成。从血管取少量血液加入适量抗凝剂(如肝素或枸橼酸钠),有形成分经自然沉降或离心沉淀后,血液可分出三层:上层为淡黄色的血浆,下层为红细胞,中间的薄层为白细胞和血小板(图5-1)。血浆相当于结缔组织的细胞间质,约占血液容积的55%,其中90%是水,其余为血浆蛋白(白蛋白、球蛋白、纤维蛋白原)、脂蛋白、脂滴、无机盐、酶、激素、维生素和各种代谢产物。血液流出血管后,溶解状态的纤维蛋白原转变为不溶解状态的纤维蛋白,于是凝固成血块。血块静置后即析出淡黄色清明的液体,称血清(serum)。血液保持一定的比重(1.050~1.060)、PH(7.3~7.4)渗透压(313mosm)粘滞性和化学成分,以维持各种组织和细胞生理活动所需的适宜条件。
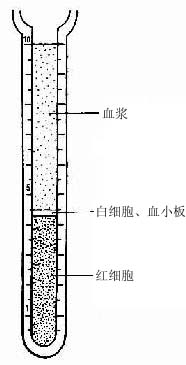
图5-1 血浆、白细胞和红细胞比积
血细胞约占血液容积的45%,包括红细胞、白细胞和血小板。在正常生理情况下,血细胞和血小板有一定的形态结构,并有相对稳定的数量。血细胞形态结构的光镜观察,通常采用Wright或Giemsa染色的血涂片标本。血细胞分类和计数的正常值如下:

血细胞形态、数量、比例和血红蛋白含量的测定称为血像。患病时,血像常有显著变化,故检查血像对了解机体状况和诊断疾病十分重要。
(一)红细胞
红细胞(erythrocyte,red blood cell)直径7~8.5μm,呈双凹圆盘状,中央较薄(1.0μm),周缘较厚(2.0μm),故在血涂片标本中呈中央染色较浅、周缘较深(彩图5-2)。在扫描电镜下,可清楚地显示红细胞这种形态特点(图5-3)。红细胞的这种形态使它具有较大的表面积(约140μm2),从而能最大限度地适应其功能――携O2和CO2。新鲜单个红细胞为黄绿色,大量红细胞使血液呈猩红色,而且多个红细胞常叠连一起呈串钱状,称红细胞缗线。
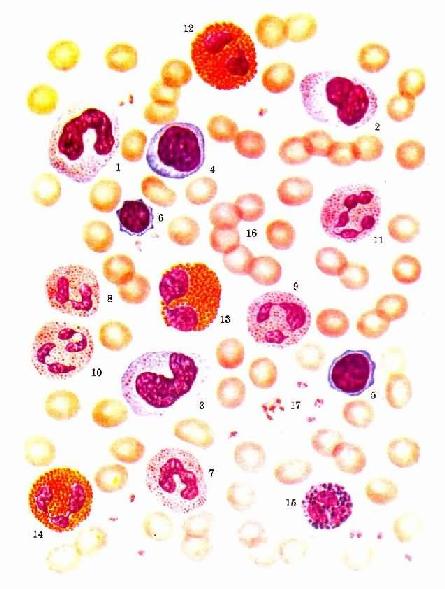
图5-2 各种血细胞 1.2.3.单核细胞 4.5.6.淋巴细胞 7.8.9.10.11.中性粒细胞
12.13.14.嗜酸性粒细胞 15.嗜酸性粒细胞 16.红细胞 17.血小板.

图5-3 人红细胞扫描电镜像 ×4800
(白求恩医科大学组织胚胎学教研究室供图)
红细胞有一定的弹性和可塑性,细胞通过毛细血管时可改变形状。红细胞正常形态的保持需ATP供给能量,由于红细胞缺乏线粒体,ATP由无氧酵解产生;一量缺乏ATP供能,则导致细胞膜结构改变,细胞的形态也随之由圆盘状变为棘球状。这种形态改变一般是可逆的。可随着ATP的供能状态的改善而恢复。
成熟红细胞无细胞核,也无细胞器,胞质内充满血红蛋白(hemoglobin,Hb)。血红蛋白是含铁的蛋白质,约占红细胞重量的33%。它具有结合与运输O2和CO2的功能,当血液流经肺时,肺内的O2分压高,CO2分压低,血红蛋白即放出CO2而与O2结合;当血液流经其它器官的组织时,由于该处的CO2分压高而O2分压低,于是红细胞即放出O2并结合CO2。由于血红蛋白具有这种性质,所以红细胞能供给全身组织和细胞所需的O2,带走所产生的部分CO2。
正常成人每微升血液中红细胞数的平均值,男性约400万~500万个,女性约350万~450万个。每100ml血液中血红蛋白含量,男性约12~15g,女性约10.5~13.5g。全身所有红细胞表面积总计,相当于人体表面积的2000倍。红细胞的数目及血红蛋白的含量可有生理性改变,如婴儿高于成人,运动时多于安静状态,高原地区居民大都高于平原地区居民,红细胞的形态和数目的改变、以及血红蛋白的质和量的改变超出正常范围,则表现为病理现象。一般说,红细胞数少于300万/μ1,血红蛋白低于10g/100ml,则为贫血。此时常伴有红细胞的直径及形态的改变,如大红细胞贫血的红细胞平均直径>9μm,小红细胞贫血的红细胞平均直径<6μm。缺铁性贫血的红细胞,由于血红蛋白的含量明显降低,以致中央淡染区明显扩大。
红细胞的渗透压与血浆相等,使出入红细胞的水分维持平衡。当血浆渗透压降低时,过量水分进入细胞,细胞膨胀成球形,甚至破裂,血红蛋白逸出,称为溶血(hemolysis);溶血后残留的红细胞膜囊称为血影(ghost)。反之,若血浆的渗透压升高,可使红细胞内的水分析出过多,致使红细胞皱缩。凡能损害红细胞的因素,如脂溶剂、蛇毒、溶血性细菌等均能引起溶血。
红细胞的细胞膜,除具有一般细胞膜的共性外,还有其特殊性,例如红细胞膜上有ABO血型抗原。
外周血中除大量成熟红细胞以外,还有少量未完全成熟的红细胞,称为网织红细胞(reticulocyte)在成人约为红细胞总数的0.5%~1.5%,新生儿较多,可达3%~6%。网织红细胞的直径略大于成熟红细胞,在常规染色的血涂片中不能与成熟红细胞区分。用煌焦蓝作体外活体染色,可见网织红细胞的胞质内有染成蓝色的细网或颗粒,它是细胞内残留的核糖体。核糖体的存在,表明网织红细胞仍有一些合成血红蛋白的功能。红细胞完全成熟时,核糖体消失,血红蛋白的含量即不再增加。贫血病人如果造血功能良好,其血液中网织红细胞的百分比值增高。因此,网织红细胞的计数有一定临床意义,它是贫血等某些血液病的诊断、疗效判断和估计预指标之一。
红细胞的平均寿命约120天。衰老的红细胞虽无形态上的特殊樗,但其机能活动和理化性质都有变化,如酶活性降低,血红蛋白变性,细胞膜脆性增大,以及表面电荷改变等,因而细胞与氧结合的能力降低且容易破碎。衰老的红细胞多在脾、骨髓和肝等处被巨噬细胞吞噬,同时由红骨髓生成和释放同等数量红细胞进入外周血液,维持红细胞数的相对恒定。
(二)白细胞
白细胞(leukocyte,white blood cell)为无色有核的球形细胞,体积比红细胞大,能作变形运动,具有防御和免疫功能。成人白细胞的正常值为4000~10000个/μ1。男女无明显差别。婴幼儿稍高于成人。血液中白细胞的数值可受各种生理因素的影响,如劳动、运动、饮食及妇女月经期,均略有增多。在疾病状态下,白细胞总数及各种白细胞的百分比值皆可发生改变。
光镜下,根据白细胞胞质有无特殊颗粒,可将其分为有粒白细胞和无粒白细胞两类。有粒白细胞又根据颗粒的嗜色性,分为中性粒细胞、嗜酸性粒细胞用嗜碱性粒细胞。无粒白细胞有单核细胞和淋巴细胞两种(图5-2)。
1.中性粒细胞中性粒细胞(neutrophilicgranulocyte,neutrophil)占白细胞总数的50%-70%,是白细胞中数量最多的一种。细胞呈球形,直径10-12μm,核染色质呈团块状。核的形态多样,有的呈腊肠状,称杆状核;有的呈分叶状,叶间有细丝相连,称分叶核。细胞核一般为2~5叶,正常人以2~3叶者居多。在某些疾病情况下,核1~2叶的细胞百分率增多,称为核左移;核4~5叶的细胞增多,称为核右移。一般说核分叶越多,表明细胞越近衰老,但这不是绝对的,在有些疾病情况下,新生的中性粒细胞也可出现细胞核为5叶或更多叶的。杆状核粒细胞则较幼稚,约占粒细胞总数的5%~10%,在机体受细菌严重感染时,其比例显著增高。
中性粒细胞的胞质染成粉红色,含有许多细小的淡紫色及淡红色颗粒,颗粒可分为嗜天青颗粒和特殊颗粒两种。嗜天青颗粒较少,呈紫色,约占颗粒总数的20%,光镜下着色略深,体积较大;电镜下呈圆形或椭圆形,直径0.6~0.7μm,电子密度较高(图5-4,5-5),它是一种溶酶体,含有酸性磷酸酶和过氧化物酶等,能消化分解吞噬的异物。特殊颗粒数量多,淡红色,约占颗粒总数的80%,颗粒较小,直径0.3~0.4μm,呈哑铃形或椭圆形,内含碱性磷酸酶、吞噬素、溶菌酶等。吞噬素具有杀菌作用,溶菌酶能溶解细菌表面的糖蛋白。
中性粒细胞具有活跃的变形运动和吞噬功能。当机体某一部位受到细菌侵犯时,中性粒细胞对细菌产物及受感染组织释放的某些化学物质具有趋化性,能以变形运动穿出毛细血管,聚集到细菌侵犯部位,大量吞噬细菌,形成吞噬小体。吞噬小体先后与特殊颗粒及溶酶体融合,细菌即被各种水解酶、氧化酶、溶菌酶及其它具有杀菌作用的蛋白质、多肽等成分杀死并分解消化。由此可见,中性粒细胞在体内起着重要的防御作用。中性粒细胞吞噬细胞后,自身也常坏死,成为脓细胞。中性粒细胞在血液中停留约6~7小时,在组织中存活约1~3天。
2.嗜酸性粒细胞嗜酸性粒细胞(eosinophilicgranulocyte,eosinophil)占白细胞总数的0.5%-3%。细胞呈球形,直径10~15μm,核常为2叶,胞质内充满粗大(直径0.5~1.0μm)、均匀、略带折光性的嗜酸性颗粒,染成桔红色(图5-2)。电镜下,颗粒多呈椭圆形,有膜包被,内含颗粒状基质和方形或长方形晶体(图5-4,5-5)。颗粒含有酸性磷酸酶、芳基硫酸酯酶、过氧化物酶和组胺酶等,因此它也是一种溶酶体。
嗜酸性粒细胞也能作变形运动,并具有趋化性。它能吞噬抗原抗体复合物,释放组胺酶灭活组胺,从而减弱过敏反应。嗜酸性粒细胞还能借助抗体与某些寄生虫表面结合,释放颗粒内物质,杀灭寄生虫。故而嗜酸性粒细胞具有抗过敏和抗寄生虫作用。在过敏性疾病或寄生虫病时,血液中嗜酸性粒细胞增多。它在血液中一般仅停留数小时,在组织中可存活8~12天。
3.嗜碱性粒细胞嗜碱性粒细胞(basoophilic granulocyte,basophil)数量最少,占白细胞总数的0~15。细胞呈球形,直径10-12μm。胞核分叶或呈S形或不规则形,着色较浅。胞质内含有嗜碱性颗粒,大小不等,分布不均,染成蓝紫色,可覆盖在核上(图5-2)。颗粒具有异染性,甲苯胺蓝染色呈紫红色。电镜下,嗜碱性颗粒内充满细小微粒,呈均匀状或螺纹状分布(图5-4,5-5)。颗粒内含有肝素和组胺,可被快速释放;而白三烯则存在于细胞基质内,它的释放较前者缓慢。肝素具有抗凝血作用,,组胺和白三烯参与过敏反应。嗜碱性粒细胞在组织中可存活12-15天。
嗜碱性粒细胞与肥大细胞,在分布、胞核的形态,以及颗粒的大小与结构上,均有所不同。但两种细胞都含有肝素、组胺和白三烯等成分,故嗜碱性粒细胞的功能与肥大细胞相似,但两者的关系尚待研究。
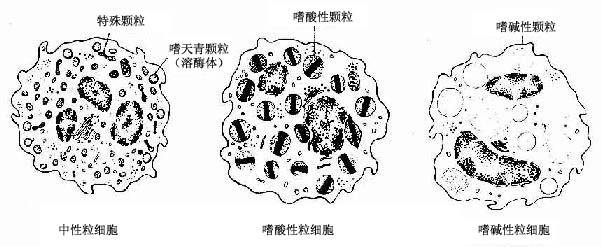
图5-4 三种粒细胞超微结构模式图
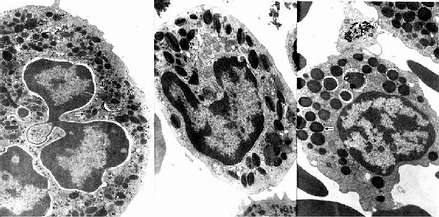
图5-5 人三种粒电镜像 ×17800
左图:中性粒细胞(白求恩医科大学尹昕、朱秀雄教授供图)
中图:嗜酸性粒细胞 左图:嗜碱性粒细胞
↑特殊颗粒,(![]() )嗜天青颗粒
)嗜天青颗粒
4.单核细胞单核细胞(monocyte)占白细胞总数的3%~8%。它是白细胞中体积最大的细胞。直径14~20μm,呈圆形或椭圆形。胞核形态多样,呈卵圆形、肾形、马蹄形或不规则形等。核常偏位,染色质颗粒细而松散,故着色较浅。胞质较多,呈弱嗜碱性,含有许多细小的嗜天青颗粒,使胞质染成深浅不匀的灰蓝色(图5-2)。颗粒内含有过氧化物酶、酸性磷酸酶、非特异性酯酶和溶菌酶,这些酶不仅与单核细胞的功能有关,而且可作为与淋巴细胞的鉴别点。电镜下,细胞表面有皱褶和微绒毛,胞质内有许多吞噬泡、线粒体和粗面内质网,颗粒具溶酶体样结构(图5-6)。
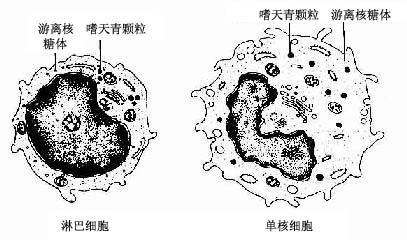
图5-6 淋巴细胞与单核细胞超微结构模式图
单核细胞具有活跃的变形运动、明显的趋化性和一定的吞噬功能。单核细胞是巨噬细胞的前身,它在血流中停留1-5天后,穿出血管进入组织和体腔,分化为巨噬细胞。单核细胞和巨噬细胞都能消灭侵入机体的细菌,吞噬异物颗粒,消除体内衰老损伤的细胞,并参与免疫,但其功能不及巨噬细胞强。
5.淋巴细胞淋巴细胞(lymphocyte)占白细胞总数的20%~30%,圆形或椭圆形,大小不等。直径6~8μm的为小淋巴细胞,9~12μm的为中淋巴细胞,13~20μm的为大淋巴细胞。小淋巴细胞数量最多,细胞核圆形,一侧常有小凹陷,染色质致密呈块状,着色深,核占细胞的大部,胞质很少,在核周成一窄缘,嗜碱性,染成蔚蓝色,含少量嗜天青颗粒。中淋巴细胞和大淋巴细胞的核椭圆形,染色质较疏松,故着色较浅,胞质较多,胞质内也可见少量嗜天青颗粒(图5-2)。少数大、中淋巴细胞的核呈肾形,胞质内含有较多的大嗜天青颗粒,称为大颗粒淋巴细胞、电镜下,淋巴细胞的胞质内主要是大量的游离核糖体,其他细胞器均不发达(图5-6)。
以往曾认为,大、中、小淋巴细胞的分化程度不同,小淋巴细胞为终末细胞。但目前普遍认为,多数小淋巴细胞并非终末细胞。它在抗原刺激下可转变为幼稚的淋巴细胞,进而增殖分化。而且淋巴细胞也并非单一群体,根据它们的发生部位、表面特征、寿命长短和免疫功能的不同,至少可分为T细胞、B细胞、杀伤(K)细胞和自然杀伤(NK)细胞等四类。
血液中的T细胞约占淋巴细胞总数的75%,它参与细胞免疫,如排斥异移体移植物、抗肿瘤等,并具有免疫调节功能。B细胞约占血中淋巴细胞总数的10%~15%。B细胞受抗原刺激后增殖分化为浆细胞,产生抗体,参与体液免疫(详见免疫系统)。
(三)血小板
血小板(blood platelet)或称血栓细胞(thrombocyte), 正常数值为10万-~40万/μ1。它是骨髓中巨核细胞胞质脱落下来的小块,故无细胞核,表面有完整的细胞膜。血小板体积甚小,直径2~4μm,呈双凸扁盘状;当受到机械或化学刺激时,则伸出突起,呈不规则形。在血涂片中,血小板常呈多角形,聚集成群。血小板中央部分有着蓝紫色的颗粒,称颗粒区(granulomere);周边部呈均质浅蓝色,称透明区(hyalomere)(图5-2)。电镜下,血小板的膜表面有糖衣,细胞内无核,但有小管系、线粒体、微丝和微管等细胞器,以及血小板颗粒和糖原颗粒等(图5-7)。
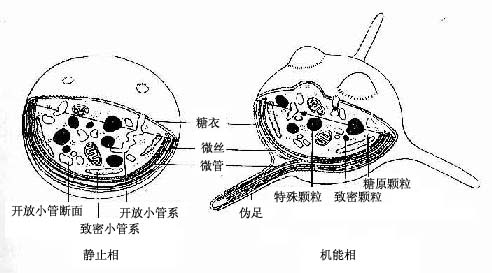
图5-7 血小板超微结构模式图
血小板在止血和凝血过程中起重要作用。血小板的表面糖衣能吸附血浆蛋白和凝血因子Ⅲ,血小板颗粒内含有与凝血有关的物质。当血管受损害或破裂时,血小板受刺激,由静止相变为机能相,迅即发生变形,表面粘度增大,凝聚成团;同时在表面第Ⅲ因子的作用下,使血浆内的凝血酶原变为凝血酶,后者又催化纤维蛋白原变成丝状的纤维蛋白,与血细胞共同形成凝血块止血。血小板颗粒物质的释放,则进一步促进止血和凝血。血小板还有保护血管内皮、参与内皮修复、防止动脉粥样硬化的作用。血小板寿命约7~14天。血液中的血小板数低于10万/μ1为血小板减少,低于5万/μ1则有出血危险。
血小板颗粒有两种:特殊颗粒和致密颗粒。特殊颗粒又称α颗粒,体积较大,圆形,电子密度中等,内含凝血因子Ⅲ、酸性水解酶等。致密颗粒较小,电子密度大,内含5-羟色胺、ADP、ATP、钙离子、肾上腺素等。两种颗粒内容物的释放均与血不板功能有关。血小板小管系也有两种:开放小管系和致密小管系。开放小管系散在分布,管腔明亮,开口于血小板表面,借此摄取血浆物质和释放颗粒内容物。致密小管系是封闭的小管,多分布在血小板周边,管腔电子密度中等,能收集钙离子和合成前列腺素等。血小板周边有环行排列的微丝和微管,与血小板的形态变化有关(图5-7)。
淋巴:淋巴(lymph)是在淋巴管内流动的液体,是组织液渗入毛细淋巴管形成的。它在回流过程中经过淋巴结添加了淋巴细胞等成分,最终汇入静脉。淋巴的组成成分和细胞数量是经常变动的,因淋巴回流部位而异。如肢体的淋巴清亮透明,小肠的淋巴因含吸收的大量脂滴而呈乳白色,称乳糜(chyle)。肝的淋巴内含有大量血浆蛋白。淋巴流经的淋巴结越多,所含的淋巴细胞也越多,有时还有单核细胞和粒细胞。淋巴是组织液回流的渠道之一,在维持全身各部组织液动态平衡和滤过防御作用中起重要作用。
二、骨髓和血细胞发生
各种血细胞都有一定的寿命,红细胞的寿命平均约120天,白细胞的寿命为数天、数周或数年。血细胞不断地衰老和死亡,由新生的血细胞不断补充,使外周血循环中血细胞数量和质量保持动态平衡。
人的血细胞最早是在胚胎卵黄囊壁的血岛生成,胚胎第6周,从卵黄囊迁入肝的造血干细胞开始造血,第4~5月脾内造血干细胞增殖分化产生各种血细胞。从胚胎后期至生后终身,骨髓成为主要的造血器官,产生红细胞系、粒细胞系、单核细胞系和巨核细胞-血小板系;这些细胞系称为骨髓成分。脾和淋巴结等淋巴器官以及淋巴组织产生淋巴成分。
(一)骨髓的结构
骨髓位于骨髓腔中,约占体重的4%-6%,是人体最大的造血器官。骨髓分为红骨髓(red bone marrow)和黄骨髓(yellow bone marrow)。胎儿及婴幼儿时期的骨髓都是红骨髓,大约从5岁开始,长骨干的骨髓腔内出现脂肪组织,并随年龄增长而增多,即为黄骨髓。成人的红骨髓和黄骨髓约各占一半。红骨髓主要分布在扁骨、不规则骨和长骨骺端的骨松质中,造血功能活跃。黄骨髓内仅有少量的幼稚血细胞,故仍保持着造血潜能,当机体需要时可转变为红骨髓进行造血。
红骨髓主要由造血组织和血窦构成。
1.造血组织主要由网状结缔组织和造血细胞组成。网状细胞和网状纤维构成造血组织的网架,网孔中充满不同发育阶段的各种血细胞,以及少量造血干细胞、巨噬细胞、脂肪细胞和间充质细胞等(图5-8)。
目前认为,造血细胞赖以生长发育的内环境也就是造血诱导微环境(hemopoieticinductive microenvironment)极为重要。骨髓造血诱导微环境包括骨髓神经成分、微血管系统及纤维、基质以及各类基质细胞组成的结缔组织成分。基质细胞(stromal cell)是造血微环境中的重要成分,包括有网状细胞、成纤维细胞、血窦内皮细胞、巨噬细胞、脂肪细胞等。一般认为,骨髓基质细胞不仅起支持作用,并且分泌体液因子,调节造血细胞的增殖与分化。发育中的各种血细胞在造血组织中的分布呈现一定规律。幼稚红细胞常位于血窦附近,成群嵌附在巨噬细胞表面,构成幼红细胞岛(erythroblastic islet)(图5-9);随着细胞的发育成熟而贴近并穿过血窦内皮,脱去胞核成为网织红细胞。幼稚粒细胞多远离血窦,当发育至晚幼粒细胞具有运动能力时,则借其变形运动接近并穿入血窦。巨核细胞常常紧靠血窦内皮间隙,将胞质突起伸入窦腔,脱落形成血小板。这种分布状况表明造血组织的不同部位具有不同的微环境造血诱导作用。
2.血窦由动脉毛细血管分支而成。血窦腔大而迂曲,最终汇入骨髓的中央纵行静脉(图5-8)。血窦形状不规则。窦壁衬贴有孔内皮,内皮基膜不完整,呈断续状。基膜外有扁平多突的周细胞覆盖,当造血功能活跃,血细胞频繁穿过内皮时,覆盖面减小。血窦壁周围和血窦腔内的单核细胞和巨噬细胞,有吞噬清除血流中的异物、细菌和衰老死亡血细胞的功能。
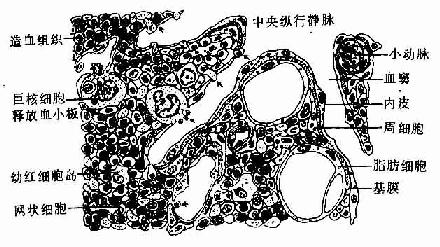
图5-8 红骨髓组织结构模式图
示巨核细胞生成血小板与成熟的血细胞进入血窦
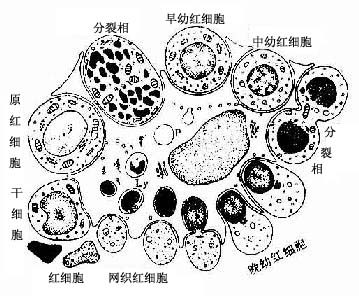
图5-9 骨髓幼红细胞岛超微结构模式图
P吞噬体 Ly溶酶体
(二)造血干细胞和造血细胞
血细胞发生是造血干细胞经增殖、分化直至成为各种成熟血细胞的过程。造血干细胞(hemoplietic stem cell)是生成各种血细胞的原始细胞,又称多能干细胞(multipotentialstem cell)。造血干细胞在一定的微环境和某些因素的调节下,增殖分化为各类血细胞的祖细胞,称造血祖细胞(hemopoieticprogenitor),它也是一种相当原始的具有增殖能力的细胞,但已失去多向分化能力,只能向一个或几个血细胞系定向增殖分化,故也称定向干细胞(committed stem cell)。
1.造血干细胞造血干细胞起源于人胚(受精后第2周末)的卵黄囊血岛;当胚体建立循环后,造血干细胞经血流迁入胚肝。第3~6月的胎儿肝是主要的造血器官,含造血干细胞较多,近年应用分离的胎肝造血细胞治疗再生障碍性贫血等血液病患者。出生后,造血干细胞主要存在于红骨髓,约占骨髓有核细胞的0.5%,其次是脾和淋巴结,外周血中也有极少量。关于造血干细胞的形态结构,至今尚无定论,多数学者认为类似小淋巴细胞,直径7~9μm,胞质内除大量游离核糖体和少量线粒体外,无其他细胞器。
造血干细胞的基本特性是:①有很强潜能,在一定条件下能反复分裂,大量增殖;但在一般生理状态下,多数细胞处于G期静止状态。②有多向分化能力,在一些因素的作用下能分化形成不同的祖细胞。③有自我复制能力,即细胞分裂后的子代细胞仍具原有特征,故造血干细胞可终身保持恒定的数量。
造血干细胞学说是60年代初提出的,此后为大量实验证实,是血细胞发生学领域的重大成就。造血干细胞最初是用小鼠脾集落生成实验证实的。实验是将小鼠骨髓细胞悬液输给受致死量射线照射的同系小鼠,使后者重新获得造血能力而免于死亡。重建造血的原因是脾内出现许多小结节状造血灶,称为脾集落(spleen colony)(图5-10)。脾集落内含有红细胞系、粒细胞系、巨核细胞系或三者混合存在。如将脾集落细胞分离后再输给另外的致死量射线照射的同系小鼠,仍能发生多个脾集落,并重建造血。脾集落生成数与输入的骨髓细胞数或脾集落细胞数成正比关系,表明骨髓中有一类能重建造血的原始血细胞。为确定一个脾集落的细胞是否起源于同一个原始血细胞,又将移植细胞经照射后出现畸变染色体,以此作为辨认血细胞发生来源的标志。将此种带标志的细胞输给受照射的小鼠,结果发现,每个脾集落中的所有细胞均具有这种相同的畸变染色体,表明每个集落的细胞是来自一个原始血细胞。每个脾集落为一个克隆(clone),称为脾集落生成单位(colony forming unit,CFU-S),它代表一个造血干细胞。近年还发现,造血干细胞中存在不同分化等级的细胞群体,如髓性造血干细胞可分化为红细胞系、粒细胞巨噬细胞系、巨核细胞系造血祖细胞;淋巴造血干细胞可分化为各种淋巴细胞(彩图5-11)。
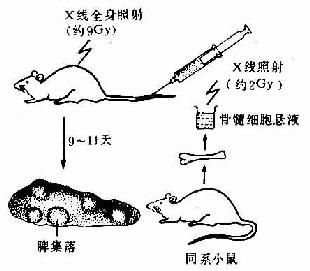
图5-10 小鼠脾集落实验
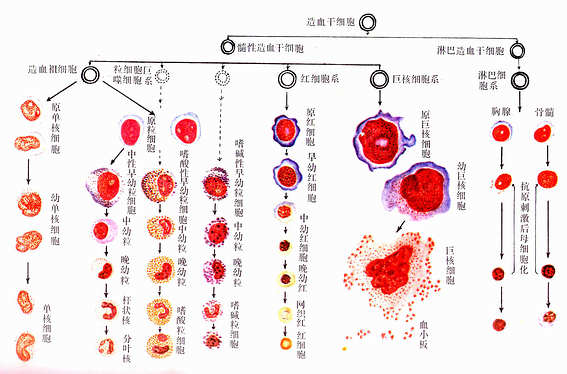
图5-11 血细胞发生
人造血干细胞的存在也有一些间接依据。如慢性粒细胞性白血病患者的红细胞系、粒细胞系和巨核细胞系均具有Ph′畸变染色体,由此推测这三种细胞来自共同的干细胞;又如人骨髓细胞体外培养,出现混合性细胞集落,也表明造血干细胞的存在。
2.造血祖细胞由造血干细胞分化为几种不同的造血祖细胞,它们进而再分别分化为形态可辨认的各种幼稚血细胞(图5-11)。造血祖细胞的增殖能力有限,它们依靠造血干细胞的增殖来补充。造血祖细胞可用体外培养的细胞集落法测定。在不同的集落刺激因子(colony stimulating factor,CSF)作用下,可分别出现不同的血细胞集落,目前已确认的造血祖细胞有:①红细胞系造血祖细胞,必需在红细胞生成素(erythropoietin,EPO,由肾等产生)作用下才能形成红细胞集落,又称红细胞集落生成单位(CFU-E)。②中性粒细胞-巨噬细胞系造血祖细胞,需在粒细胞生成素(granulopoietin,由巨噬细胞产生)作用下形成该种细胞的集落,又称粒细胞巨噬细胞系集落生成单位(CFU-GM)。③巨核细胞系造血祖细胞,需在血小板生成素(thrombopoietin)作用下形成巨核细胞集落,又称巨核细胞系集落生成单位(CFU-M)。其在细胞的造血祖细胞的存在,目前尚无确切实验结果。
(三)血细胞发生过程的形态演变
血细胞的发生是一连续发展过程,各种血细胞的发育大致可分为三个阶段:原始阶段、幼稚阶段(又分早、中、晚三期)和成熟阶段。骨髓涂片检查,是血液病诊断的重要依据。
血细胞发生过程中形态变化的一般规律如下:①胞体由大变小,而巨核细胞的发生则由小变大。②胞核由大变小,红细胞的核最后消失,粒细胞的核由圆形逐渐变成杆状乃至分叶,巨核细胞的核由小变大呈分叶状;核内染色质由细疏逐渐变粗密,核仁由明显渐至消失;核的着色由浅变深。③胞质的量由少逐渐增多,胞质嗜碱性逐渐变弱,但单核细胞和淋巴细胞仍保持嗜碱性;胞质内的特殊结构如红细胞中的血红蛋白、粒细胞中的特殊颗粒均由无到有,并逐渐增多。④细胞分裂能力从有到无,但淋巴细胞仍有很强的潜在分裂能力。
1.红细胞发生红细胞发生历经原红细胞(Proerythroblast)、早幼红细胞(或称嗜碱性成红细胞,basophilic erthroblast)、中幼红细胞(或称多染性成红细胞,polychromatophilicerythroblast)、晚幼红细胞(或称正成红细胞,normoblast),后者脱去胞核成为网织红细胞,最终成为成熟红细胞。从原红细胞的发育至晚幼红细胞大约需3~4天。巨噬细胞可吞噬晚幼红细胞脱出的胞核和其他代谢产物,并为红细胞的发育提供铁质等营养物。各阶段细胞的一般形态特点见表5-1(图5-11)
表5-1 红细胞发生过程的形态演变
| 发育阶段和名称 | 胞体 大小 形状 (μm) |
胞核 形状 染色质 核仁核质比 |
胞 质 嗜碱性 着色血红蛋白 分裂能力 |
| 原始阶段 原红细胞 幼早幼红细胞 稚 中幼红细胞 阶 晚幼红细胞 段 成 熟 网织红细胞 阶 红细胞 段 |
14~22 圆 11~19 圆 10~14 圆 9~12 圆 7~9 圆盘状 7 圆盘状 |
圆 细粒状 2~3 > 3/4 圆粗粒状 偶见 >1/2 圆 粗块状 消失 约1/2 圆 致密块 消失 更小 无 无 |
强 墨水无 有 很强墨水蓝 开始出现有 减弱 嗜多染性 增多弱 红蓝间染 弱 红大量无 微 红大量无 无 红大量无 |
2.粒细胞发生粒细胞发生历经原粒细胞(myeloblast)、早幼粒细胞(又称前髓细胞,promyelocyte)、中幼粒细胞(又称髓细胞,myelocyte)、晚幼粒细胞(又称后髓细胞,metamyelocyte)进而分化为成熟的杆状核和分叶核粒细胞。从原粒细胞增殖分化为晚幼粒细胞大约需4~6天。骨髓内的杆核粒细胞和分叶核粒细胞的贮存量很大,在骨髓停留4~5天后释放入血。若骨髓加速释放,外周血中的粒细胞可骤然增多。各阶段细胞的一般形态特点见表5-2(图-11)。
3.单核细胞发生单核细胞的发生经过原单核细胞(monoblast)和幼单核细胞(promonocyte)变为单核细胞(图5-13)。幼单核细胞增殖力很强,约38%的幼单核细胞处于增殖状态,单核细胞在骨髓中的贮存量不及粒细胞多,当机体出现炎症或免疫功能活跃时,幼单核细胞加速分裂增殖,以提供足量的单核细胞。
4.血小板发生原巨核细胞(megakaryoblast)经幼巨核细胞(promegakaryocyte)发育为巨核细胞,巨核细胞的胞质块脱落成为血小板(图5-11)。原巨核细胞分化为幼巨核细胞,体积变大,胞核常呈肾形,胞质内出现细小颗粒。幼巨核细胞的核经数次分裂,但胞体不分裂,形成巨核细胞。巨核细胞呈不规则形,直径40~70μm,甚至更大,细胞核分叶状。胞质内有许多血小板颗粒,还有许多由滑面内质网形成的网状小管,将胞质分隔成许多小区,每个小区即是一个未来的血小板,内含颗粒。并可见到巨核细胞伸出细长的胞质突起沿着血窦壁伸入窦腔内,其胞质未端膨大脱落即成血小板(图5-12)。每个巨核细胞可生成约2000个血小板。
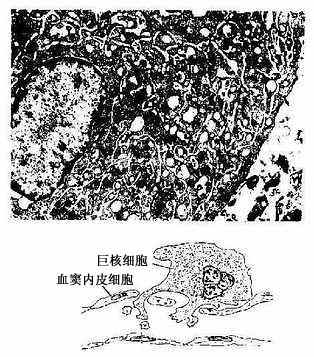
图5-12人巨核细胞电镜像(上图) ×45000
1.细胞核 2.血小板颗粒 3.滑面内质网
(白求恩医科大学尹昕、失秀雄教授供图)
下图示巨噬细胞胞质小块脱落至血窦内
表5-2 粒细胞发生过程的形态演变
| 阶段和名称 | 胞体 大小 形状 (μm) |
胞 核 形状染色质 核仁 核质 比例 |
胞 质 嗜碱性着色 嗜天青 特殊 分裂 颗粒 颗粒 能力 |
| 幼 早幼粒细胞 稚 中幼粒细胞 阶 晚幼粒细胞 段 成 熟 杆状核粒细胞 阶 分叶核粒细胞 段 |
11-18 圆 13-20圆 11-16 圆 10-15 圆 10-15 圆 10-15 圆 |
圆 细网状 2-6 >3/4 卵圆 粗网状 偶见 >1/2 半圆 网块状 消失 约1/2 肾形 网块状 消失 <1/2 带状 粗块状 消失 <1/3 分叶 粗块状 消失 更小 |
强天蓝 无 无 有 减弱 淡蓝 大量 少量 有 弱浅蓝 少 增多 有 极弱 浅红 少 明显 无 消失 淡红 少 大量 无 消失 淡红 少 大量 无 |
5.淋巴细胞发生淋巴细胞的发生较复杂。淋巴细胞有多种亚群,它们既有发生育过程,又可因抗原刺激出现小淋巴细胞母细胞化和单株增殖过程,而且还缺乏常规光镜下可见的分化标志,故很难从形态上严格划分淋巴细胞的发生和分化阶段。以往的光镜形态观察,将淋巴细胞的发生传统地分为原淋巴细胞、幼淋巴细胞和淋巴细胞三个阶段,与近年免疫学研究结果尚无明确的关联(详见免疫系统)。
第六章 肌组织
肌组织(muscle tissue)主要由肌细胞组成,肌细胞之间有少量的结缔组织以及血管和神经,肌细胞呈长纤维形,又称为肌纤维(muscle fiber)。肌纤维的细胞膜称肌膜(sarcolemma),细胞质称肌浆(sarcoplasm),肌浆中有许多与细胞长轴相平行排列的肌丝,它们是肌纤维舒缩功能的主要物质基础。根据结构和功能的特点,将肌组织分为三类:骨骼肌、心肌和平滑肌。骨骼肌和心肌属于横纹肌。骨骼肌受躯体神经支配,为随意肌;心肌和平滑肌受植物神经支配,为不随意肌。
一、骨骼肌
大多数骨骼肌(skeletal muscle)借肌健附着在骨骼上。分布于躯干和四肢的每块肌肉均由许多平行排列的骨骼肌纤维组成,它们的周围包裹着结缔组织。包在整块肌外面的结缔组织为肌外膜(epimysium),它是一层致密结缔组织膜,含有血管和神经。肌外膜的结缔组织以及血管和神经的分支伸入肌内,分隔和包围大小不等的肌束,形成肌束膜(perimysium)。分布在每条肌纤维周围的少量结缔组织为肌内膜(endomysium),肌内膜含有丰富的毛细血管(图6-1)。各层结缔组织膜除有支持、连接、营养和保护肌组织的作用外,对单条肌纤维的活动、乃至对肌束和整块肌肉的肌纤维群体活动也起着调整作用。
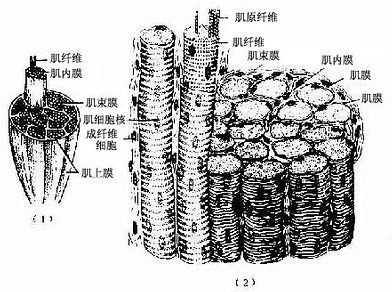
图6-1 骨骼肌与周围结缔组织膜
(1)一块骨骼肌模式图,示肌外膜、肌束膜和肌内膜
(2)骨骼肌纤维纵横切面
(一)骨骼肌纤维的光镜结构
骨骼肌纤维为长柱形的多核细胞(图6-1),长1~40mm,直径10~100μm。肌膜的外面有基膜紧密贴附。一条肌纤维内含有几十个甚至几百个细胞核,位于肌浆的周边即肌膜下方。核呈扁椭圆形,异染色质较少,染色较浅。肌浆内含许多与细胞长轴平行排列的肌原纤维,在骨骼肌纤维的横切面上,肌原纤维呈点状,聚集为许多小区,称孔海姆区(Cohnheim field)。肌原纤维之间含有大量线粒体、糖原以及少量脂滴,肌浆内还含有肌红蛋白。在骨骼肌纤维与基膜之间有一种扁平有突起的细胞,称肌卫星细胞(muscle satellite cell),排列在肌纤维的表面,当肌纤维受损伤后,此种细胞可分化形成肌纤维。
肌原纤维(myofibril)呈细丝状,直径1~2μm,沿肌纤维长轴平行排列,每条肌原纤维上都有明暗相间、重复排列的横纹(cross striation)。由于各条肌原纤维的明暗横纹都相应地排列在同一平面上,因此肌纤维呈现出规则的明暗交替的横纹。横纹由明带和暗带组成(图6-2)。在偏光显微镜下,明带(light band)呈单折光,为各向同性(isotropic),又称I带;暗带(dark band)呈双折光,为各向异性(anisotropic),又称A带。在电镜下,暗带中央有一条浅色窄带称H带,H带中央还有一条深 M线。明带中央则有一条深色的细线称Z线。两条相邻Z线之间的一段肌原纤维称为肌节(sarcomere)。每个肌节都由1/2I带+A带+1/2I带所组成(图6-3,6-4)。肌节长约2~2.5μm,它是骨骼肌收缩的基本结构单位。因此,肌原纤维就是由许多肌节连续排列构成的。
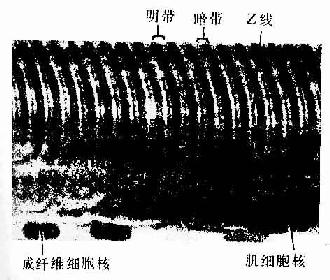
图6-2 人骨骼肌纤维纵切面

图6-3 兔骨骼肌纤维纵切
Z Z线 (白求恩医科大学尹昕、朱秀雄教授供图)
(二)骨骼肌纤维的超威结构
1.肌原纤维肌原纤维是由上千条粗、细两种肌丝有规律地平行排列组成的,明、暗带就是这两种肌丝排布的结果(图6-4)。粗肌丝(thick filament)长约1.5μm,直径约15nm,位于肌节的A带。粗肌丝中央借M线固定,两端游离。细肌丝(thin filathent)长约1μm,直径约5nm,它的一端固定在Z线上,另一端插入粗肌丝之间,止于H带外侧。因此,I带内只有细肌丝,A带中央的H带内只有粗肌丝,而H带两侧的A带内既有粗肌丝又有细肌丝(图6-4);所以在此处的横切面上可见一条粗肌丝周围有6条细肌丝;而一条细肌丝周围有3条粗肌丝(图6-4)。两种肌丝肌在肌节内的这种规则排列以及它们的分子结构,是肌纤维收缩功能的主要基础。
粗肌丝的分子结构:粗肌丝是由许多肌球蛋白分子有序排列组成的。肌球蛋白(myosin)形如豆芽,分为头和杆两部分,头部如同两个豆瓣,杆部如同豆茎。在头和杆的连接点及杆上有两处类似关节,可以屈动。M线两侧的肌球蛋白对称排列,杆部均朝向粗肌丝的中段,头部则朝向粗肌丝的两端的两端并露出表面,称为横桥(cross bridge)(图6-4)。M线两侧的粗肌丝只有肌球蛋白杆部而没有头部,所以表面光滑。肌球蛋白头部是一种ATP酶,能与ATP结合。只有当肌球蛋白分子头部与肌动蛋白接触时,ATP酶才被激活,于是分解ATP放出能量,使横桥发生屈伸运动。
细肌丝的分子结构:细肌丝由三种蛋白质分子组成,即肌动蛋白、原肌球蛋白和肌原蛋白。后二种属于调节蛋白,在肌收缩中起调节作用。肌动蛋白(actin)分子单体为球形,许多单体相互接连成串珠状的纤维形,肌动蛋白就是由两条纤维形肌动蛋白缠绕形成的双股螺旋链。每个球形肌动蛋白单体上都有一个可以与肌球蛋白头部相结合的位点。原肌球蛋白(tropomyosin)是由较短的双股螺旋多肽链组成,首尾相连,嵌于肌动蛋白双股螺旋链的浅沟内。肌原蛋白(troponin)由3个球形亚单位组成,分别简称为TnT、 TnI和 Tnc 。肌原蛋白借TnT而附于原肌球蛋白分子上, TnI是抑制肌动蛋白和肌球蛋白相互作用的亚单位, Tnc 则是能与Ca2+相结合的亚单位(图6-4)。
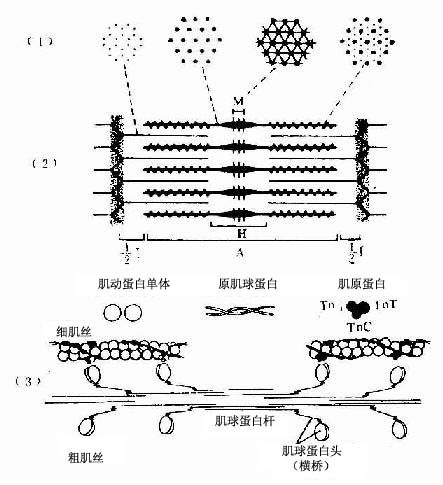
图6-4 骨骼肌肌原纤维超微结构及两种肌丝分子结构模式图(1)肌节不同部位的横切面 ,示粗肌丝与细肌丝的分布(2)一个肌节的纵切面,示两种肌丝的排列(3)粗肌丝与细肌丝的分子结构TnT肌原蛋白T,TnC肌原蛋白C,TnI肌原蛋白I
2.横小管它是肌膜向肌浆内凹陷形成的小管网,由于它的走行方向与肌纤维长轴垂直,故称横小管(transverse tubule,或称T小管)。人与哺乳动物的横小管位于A带与I带交界处,同一水平的横小管在细胞内分支吻合环绕在每条肌原纤维周围(图6-5)。横小管可将肌膜的兴奋迅速传到每个肌节。
3.肌浆网肌浆网(sarcoplasmic reticulum)是肌纤维内特化的滑面内质网,位于横小管之间,纵行包绕在每条肌原纤维周围,故又称纵小管(图6-5)。位于横小管两侧的肌浆网呈环行的扁囊,称终池(terminal cisternae),终池之间则是相互吻合的纵行小管网。每条横小管与其两侧的终池共同组成骨骼肌三联体(triad)(图6-5)。在横小管的肌膜和终池的肌浆网膜之间形成三联体连接,可将兴奋从肌膜传到肌浆网膜。肌浆网的膜上有丰富的钙泵(一种ATP酶),有调节肌浆中Ca2+浓度的作用。
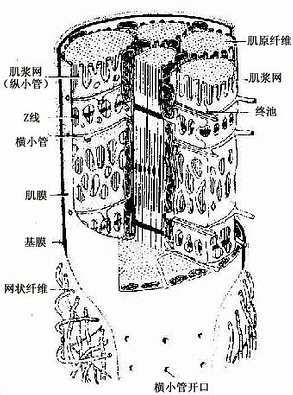
图6-5 骨骼肌纤维超微结构立体模式图
(三)骨骼肌纤维的收缩原理
目前认为,骨骼肌收缩的机制是肌丝滑动原理(sliding filament mechanism)。其过程大致如下:①运动神经末梢将神经冲动传递给肌膜;②肌膜的兴奋经横小管迅速传向终池;③肌浆网膜上的钙泵活动,将大量Ca2+转运到肌浆内;④肌原蛋白TnC与Ca2+结合后,发生构型改变,进而使原肌球蛋白位置也随之变化;⑤原来被掩盖的肌动蛋白位点暴露,迅即与肌球蛋白头接触;⑥肌球蛋白头ATP酶被激活,分解了ATP并释放能量;⑦肌球蛋白的头及杆发生屈曲转动,将肌动蛋白拉向M线(图6-6);⑧细肌丝向A带内滑入,I带变窄,A带长度不变,但H带因细肌丝的插入可消失(图6-7),由于细肌丝在粗肌丝之间向M线滑动,肌节缩短,肌纤维收缩;⑨收缩完毕,肌浆内Ca2+被泵入肌浆网内,肌浆内Ca2+浓度降低,肌原蛋白恢复原来构型,原肌球蛋白恢复原位又掩盖肌动蛋白位点,肌球蛋白头与肌动蛋白脱离接触,肌则处于松驰状态。
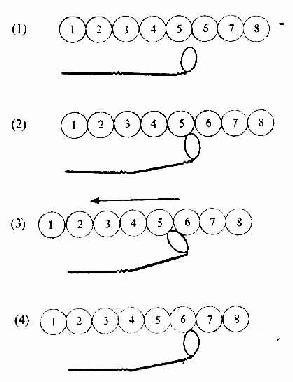
图6-6 骨骼肌纤维收缩的分子结构图解
(1)肌纤维未收缩时,肌球蛋白分子头部未与肌动蛋白接触
(2)肌纤维收缩时,肌球蛋白头部与肌动蛋白位点接触,ATP分解发,释放能量
(3)肌球蛋白头部向M线方向转动,使肌动蛋白丝部向A带滑入
(4)新的接触重新开始
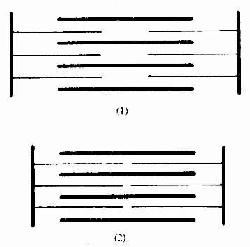
图6-7 骨骼肌纤维收缩时 肌节结构变化图解 (1)肌纤维舒张, (2)肌纤维收缩
二、心肌
心肌(cardiac muscle)分布于心脏和邻近心脏的大血管近段。心肌收缩具有自动节律性,缓慢而持久,不易疲劳。
(一)心肌纤维的光镜结构
心肌纤维呈短柱状,多数有分支,相互连接成网状。心肌纤维的连接处称闰盘(intercalated disc),在HE染色体的标本中呈着色较深的横形或阶梯状粗线(图6-8)。心肌纤维的核呈卵圆形,位居中央,有的细胞含有双核。心肌纤维的肌浆较丰富,多聚在核的两端处,其中含有丰富的线粒体和糖原及少量脂滴和脂褐素。后者为溶酶体的残余体,随年龄的增长而增多。心肌纤维显示有横纹,但其肌原纤维和横纹都不如骨骼肌纤维的明显。

图6-8 心肌纤维纵横切面
(二)心肌纤维的超威结构
心肌纤维也含有粗、细两种肌丝,它们在肌节内的排列分布与骨骼肌纤维相同,也具有肌浆网和横小管等结构(图6-9)。心肌纤维的超威结构有下列特点(图6-10):①肌原纤维不如骨骼肌那样规则、明显,肌丝被少量肌浆和大量纵行排列的线粒体分隔成粗、细不等的肌丝束,以致横纹也不如骨骼肌的明显;②横小管较粗,位于Z线水平;③肌浆网比较稀疏,纵小管不甚发达,终池较小也较少,横小管两侧的终池往往不同时存在,多见横小管与一侧的终池紧贴形成二联体(diad)(图6-10),三联体极少见;④闰盘位于Z线水平,由相邻两个肌纤维的分支处伸出许多短突相互嵌合而成,常呈阶梯状,在连接的横位部分,有中间连接和桥粒,起牢固的连接作用,在连接的纵位部分,有缝隙连接,便于细胞间化学信息的交流和电冲动的传导,这对心肌纤维整体活动的同步化是十分重要的(图6-9,6-11);⑤心房肌纤维除有收缩功能外,还有内分泌功能,可分泌心房利钠尿多肽(atrial natriuretic polypeptide)或称心钠素,具有排钠、利尿和扩张血管、降低血压的作用。
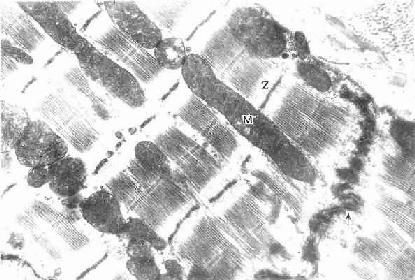
图6-9 猴心肌纤维纵切 ×18000
↑细胞连接(闰盘),Z Z线,M线粒体
(白求恩医科大学尹昕、朱秀雄教授供图)
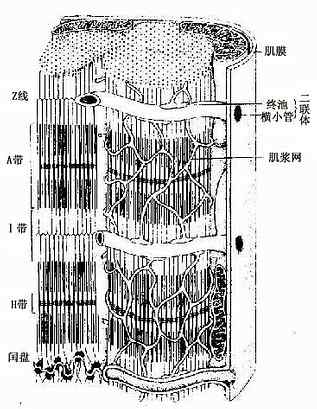
图6-10 心肌纤维超微结构立体模式图
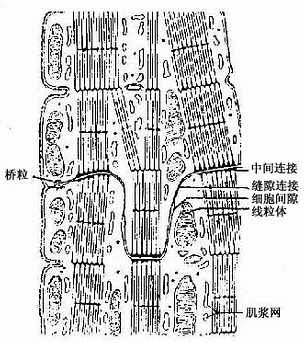
图6-11 心肌闰盘超微结构模式图
三、平滑肌
平滑肌(smooth muscle)广泛分布于血管壁和许多内脏器官,又称内脏肌。平滑肌的收缩较为缓慢和持久。
(一)平滑肌纤维的光镜结构
平滑肌纤维呈长梭形,无横纹。细胞核一个,呈长椭圆形或杆状,位于中央(图6-12),收缩时核可扭曲呈螺旋形,核两端的肌浆较丰富。平滑肌纤维大小不一,一般长200μm,直径8μm;小血管壁平滑肌短至20μm,而妊娠子宫平滑肌可长达500μm。平滑肌纤维可单独存在,绝大部分是成束或成层分布的。
(二)平滑肌纤维的超威结构
平滑肌纤维表面为肌膜,肌膜向下凹陷形成数量众多的小凹(caveola)。目前认为这些小凹相当于横纹肌的横小管。肌浆网发育很差,呈小管状,位于肌膜下与小凹相邻近。核两端的肌浆内含有线粒体、高尔基复合体和少量粗面内质网以及较多的游离核糖体,偶见脂滴(图6-13)。平滑肌的细胞骨架系统比较发达,主要由密斑、密体和中间丝组成。密斑和密体都是电子致密的小体,但分布的部位不同(图6-13,6-14)。密斑(dense patch)位于肌膜的内面,主要是平滑肌细肌丝的附着点。密体(dense body)位于细胞质内,为梭形小体,排成长链,它是细肌丝和中间丝的共同附着点。一般认为密体相当于横纹肌的Z线。相邻的密体之间由直径10nm的中间丝相连,构成平滑肌的菱形网架,在细胞内起着支架作用(图6-15)。细胞周边部的肌浆中,主要含有粗、细两种肌丝。细肌丝直径约5nm,呈花瓣状环绕在粗肌丝周围。粗、细肌丝的数量比约为1:12~30。粗肌丝直径8~16nm,均匀分布于细肌丝之间。由于肌球蛋白分子的排列不同于横纹肌,粗肌丝上没有M线及其两侧的光滑部分。粗肌丝呈圆柱形,表面有纵行排列的横桥,但相邻的两行横桥的摆动方向恰恰相反(图6-16)。若干条粗肌丝和细肌丝聚集形成肌丝单位,又称收缩单位(contractile unit)(图6-14)。相邻的平滑肌纤维之间在有缝隙连接,便于化学信息和神经冲动的沟通,有利于众多平滑肌纤维同时收缩而形成功能整体。
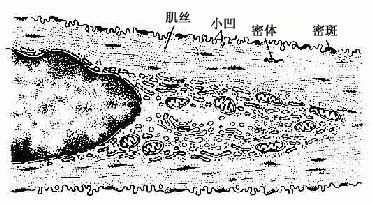
图6-13 平滑肌纵切面超微结构
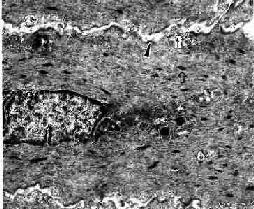
图6-14 平滑肌纤维纵切 ×10000
(![]() )密体,▲密斑,↑小凹
)密体,▲密斑,↑小凹
(湖北医学院王瑞绵教授供图)
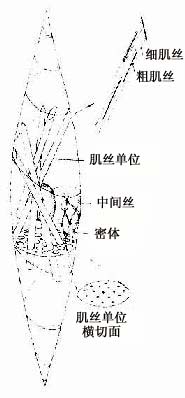
图6-15 平滑肌纤维超微结构图解
右上图示两种肌丝组成的收缩单位
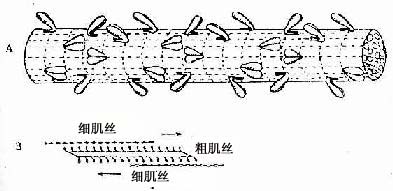
图6-16 平滑肌粗肌丝结构模式图
A.粗肌丝表面横桥排列成行,相邻两行横桥划动方向相反
B.粗肌丝的两行横桥牵拉细肌丝,方向却相反。
(三)平滑肌纤维的收缩原理
目前认为,平滑肌纤维和横纹肌一样是以“肌丝滑动”原理进行收缩的。由于每个收缩单位是由粗肌丝(肌球蛋白)和细肌丝(肌动蛋白)组成,它们的一端借细肌丝附着于肌膜的内面,这些附着点呈螺旋形。肌丝单位大致与平滑肌长轴平行,但有一定的倾斜度(图6-15)。粗肌丝没M线,表面的横桥有半数沿着相反方向摆动,所以当肌纤维收缩时,不但细肌丝沿着粗肌丝的全长滑动,而且相邻的细肌丝的滑动方向是相对的。因此平滑肌纤维收缩时,粗、细肌丝的重叠范围大,纤维呈螺旋形扭曲而变短和增粗。
第七章 神经组织
神经组织(nerve tissue)构成神经系统。神经系统分中枢神经系统(脑与脊髓)和周围神经系统(神经和神经节)两大部分,两者是相互联系的整体。神经组织是由神经细胞(nerve cell)和神经胶质细胞(neuroglial cell)组成的,它们都是有突起的细胞。神经细胞是神经系统的结构和功能单位,亦称神经元。神经元数量庞大,整个神经系统约有1011个,它们具有接受刺激、传导冲动和整合信息的能力。神经元的突起以特化的连接结构――突触彼此连接,形成复杂的神经通路和网络,将化学信号或电信号从一个神经元传给另一个神经元,或传给其组织的细胞,使神经系统产生感觉和调节其他系统的活动,以适应内、外环境的瞬息变化。有些神经元还有内分泌功能。神经胶质细胞的数量比神经元更多,但不具有神经元的上述特性,它们的功能是对神经元起支持、保护、分隔、营养等作用,两者的关系十分密切。
神经元的胞体主要分布在中枢神经系统,如大脑皮质、小脑皮质、脑内众多的神经核团和脊髓灰质;也存在于周围神经系统的神经节内,如脑神经节、脊神经节、植物神经节。神经元的突起则组成中枢神经系统的神经通路和神经网络以及遍布在的神经。分布到体表和骨骼肌的神经躯体神经(somatic nerve)分布到内脏、心血管和腺体的称内脏神经(visceral nerve)或植物神经(vegetative nerve);植物神经又分交感神经和副交感神经,分别与相应的植物神经节相连。
一、神经元
神经元(neuron)的形态多种多样,但都可分为胞体(soma)和突起(neurite)两部分(图7-1)。胞体的大小差异很大,小的直径仅5~6μm,大的可达100μm以上,突起的形态、数量和长短也很不相同。神经元突起又分树突(dendrite)和轴突(axon)两种。树突多呈树状分支,它可接受刺激并将冲动传向胞体;轴突呈细索状,末端常有分支,称轴突终末(axon terminal),轴突将冲动从胞体传向终末。通常一个神经元有一个至多个树突,但轴突只有一条(图7-2)。神经元的胞体越大,其轴突越长。
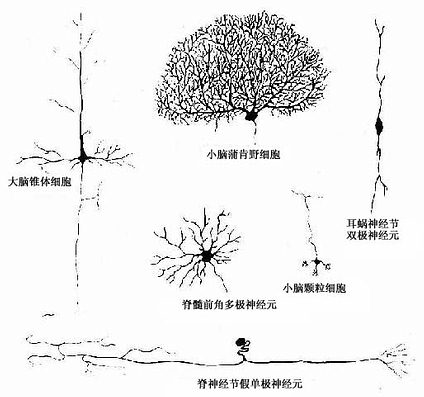
图7-1 神经元的几种主要形态类型
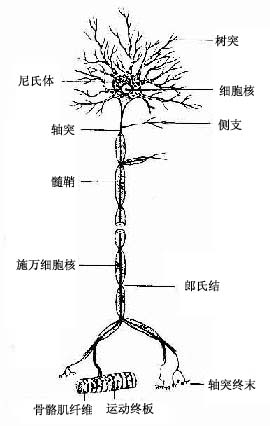
图7-2 运动神经元模式图
(一)神经元的分类
神经元有几种分类法。根据突起的多少可将神经元分为三种:①多极神经元(multipolar neuron),有一个轴突和多个树突;②双极神经元(bipolar neuron),有两个突起,一个是树突,另一个是轴突;③假单极神经元(pseudounipolar neuron),从胞体发出一个突起,距胞体不远又呈“T”形分为两支,一支分布到外周的其他组织的器官,称周围突(peripheral process);另一支进入中枢神经系统,称中枢突(central process)(图7-3)。假单极神经元的这两个分支,按神经冲动的传导方向,中枢突是轴突,周围突是树突;但周围突细而长,与轴突的形态类似,故往往通称轴突。
根据轴突的长短,神经元可分为:①长轴突的大神经元,称GolgiⅠ型神经元,最长的轴突达1m以上;②短轴突的小神经元,称GolgiⅡ型神经元,轴突短的仅数微米。
根据神经元的功能又可分:①感觉神经元(sensory neuron),或称传入神经元(afferent neuron)多为假单极神经元,胞体主要位于脑脊神经节内,其周围突的末梢分布在皮肤和肌肉等处,接受刺激,将刺激传向中枢。②运动神经元(motor neuron),或称传出神经元(efferent neuron)多为多极神经元,胞体主要位于脑、脊髓和植物神经节内,它把神经冲动传给肌肉或腺体,产生效应。③中间神经元(interneuron),介于前两种神经元之间,多为多极神经元(图7-3)。动物越进化,中间神经元越多,人神经系统中的中间神经元约占神经元总数的99%,构成中枢神经系统内的复杂网络。
根据神经元释放的神经递质(neurotransmitter),或神经调质(neuromodulator),还可分为:①胆碱能神经元(cholinergic neuron);②胺能神经元(aminergic neuron);③肽能神经元(peptidergic neuron);④氨基酸能神经元。
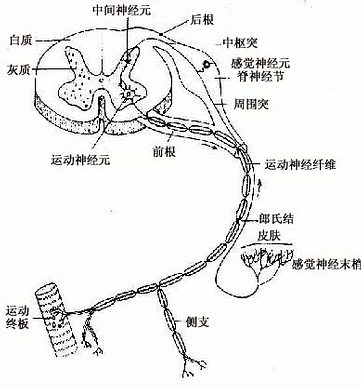
图7-3 脊髓及脊神经,示三种神经元的关系
(二)神经元的结构
1.细胞膜神经元的细胞膜是可兴奋膜(excitable membrane),它在接受刺激、传播神经冲动和信息处理中起重要作用。通常是神经元的树突膜和胞体膜接受刺激或信息,轴突膜(轴膜)传导神经冲动。神经元细胞膜的性质决定于膜蛋白的种类、数量、结构和功能,其中有些膜蛋白是离子通道(ionic channel)、按所通过的离子分别命名为钠信道、钾信道或钙信道等;还有一些膜蛋白是受体(receptor),可与相应的化学物质(神经递质)结合,使离子通道开放。目前认为,控制离子通道的开闭存在一种闸门机制(gating mechanism),有些通道是受电刺激而开放的,称电位门控通道(voltage-gated channel),有些是当化学物质与受体结合时才开放的,称化学门控通道(chemically-gated channel)。还有一些通道不受上述机制控制,而是经常开放着的。一般是轴膜富含电位门控通道,树突膜和胞体膜主要是化学门控通道。
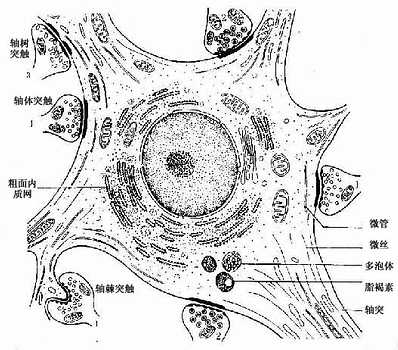
图7-4 多极神经元及其突触超微结构模式图
1.突触扣结内有圆形清亮小泡,内含乙酰胆碱
2、突触扣结内有颗粒型小泡,内含单胺类
3、突触扣结内有扁平清亮小泡,内含甘氨酸等
2.胞体神经元胞体是细胞的营养中心。胞体的中央有一个大而圆的细胞核,核异染色质少,故着色浅,核仁大而明显。胞体的细胞质称核周质(perikaryon),含有较发达的粗面内质网、游离核糖体、微丝、神经丝和微管以及高尔基复合体等(图7-4)。粗面内质网常呈现规则的平行排列,游离核糖体分布于其间,它们在光镜下呈嗜碱性颗粒或小块,称尼氏体(Nissl bodies)。大神经元尤其是运动神经元的尼氏体丰富而粗大,呈斑块状(图7-5);小神经元的尼氏体则较小而少。大神经元胞体内含大量尼氏体和发达的高尔基复合体,表明细胞具有合成蛋白质的旺盛功能。合成的蛋白质包括复制细胞器所需蛋白质和产生神经递质有关的酶等。神经丝(neurofilament)直径约为10nm,是中间丝的一种,常集合成束,微管直径约25nm,它常与神经丝交叉排列成网,并伸入树突和轴突内,构成神经元的细胞骨架(cytoskeleton),参与物质运输。在银染色切片中,神经丝和微管呈棕黑色细丝,又称神经原纤维(neurofibril)(图7-6)。胞体内还含有色素,最常见的是棕黄色的脂褐素(lipofuscin),并随年龄而增多。
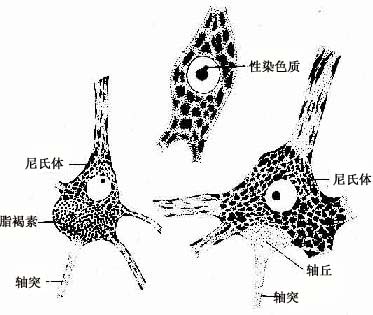
图7-5 神经元胞体光镜结构,示尼氏体
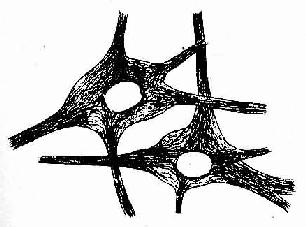
图7-6 神经元银染色,示神经原纤维
某些神经元,如下丘脑具内分泌功能的分泌神经元(secretory neuron),胞体内含直径100~300nm的分泌颗粒,颗粒内含肽类激素(如加压素、催产素等)。
3.树突树突内的结构与核周质基本相似。在树突分支上常见许多棘状的小突起,称树突棘(dendritic spine)。树突棘是神经元之间形成突触的主要部位,电镜下可见树突棘内有2~3层滑面内质网形成的板层,板层间有少量致密物质,称此为棘器(spine apparatus)(图7-7)。树突棘的数量及分布因不同神经元而异,并可随功能而改变。在大脑皮质锥体细胞和小脑皮质蒲肯野细胞的树突上,树突棘数量最多而明显,一个蒲肯野细胞的树突棘可多达10万个以上。树突的功能主要是接受刺激,树突棘和树突使神经元的接受面大为扩大。
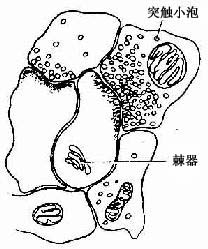
图7-7 树突棘及棘器模式图
4.轴突轴突通常自胞体发出,但也有从主树突干的基部发出。胞体发出轴突的部位常呈圆锥形,称轴丘(axon hillock),光镜下此区无尼氏体,染色淡(图7-5)。轴突的长短不一,短者仅数微米,长者可达一米以上。轴突一般比树突细,全长直径较均一,有侧支呈直角分出。轴突表面的细胞膜称轴膜(axolemma),内含的胞质称轴质(axoplasm)。轴质内有大量微管和神经丝,此外还有微丝、线粒体、滑面内质网和一些小泡等。微管与神经丝均很长,沿轴突长轴平行排列。微丝较短,主要分布于轴膜下,常与轴膜相连。电镜观察轴突冷冻蚀刻标本,可见微丝、微管和神经丝之间均有横桥连接,构成轴质中的网架结构。轴突内无尼氏体和高尔基复合体,故不能合成蛋白质,轴突成分的更新及神经递质全成所需的蛋白质和酶,是在胞体内合成后输送到轴突及其终末的。
轴突的主要功能是传导神经冲动。神经冲动的传导是在轴膜上进行的,轴突起始段轴膜的电兴奋性阈较胞体或树突低得多,故此处常是神经元发生冲动的起始部位。轴突起始段长约15~25μm,电镜下见轴膜较厚,膜下有电子密度致密层。
轴突内的物质运输称轴突输送(axonal transport)。神经元胞体内新合成的微管、微丝和神经丝组成的网架缓慢地移向轴突终末(0.1~0.4mm/天),称此为慢速输送。另外还有一种快速双向的轴突输送(100~400mm/天)。轴膜更新所需的蛋白质、含神经递质的小泡及合成递质所需的酶等,由胞体输向终末,称快速顺向轴突输送。轴突终末代谢产物或由轴突终末摄取的物质(蛋白质、小分子物质或由邻细胞产生的神经营养因子等)逆行输向胞体,称快速逆向轴突输送(图7-8)。某些微生物或毒素(如破伤风毒素、狂犬病毒)进入轴突终末,也可通过逆行性运输迅速侵犯神经元胞体,新近的研究表明,微管在轴突输送中起重要作用,微管与轴质中的动力蛋白(dynein)或激蛋白(kinesin)相互作用,可推动小泡向一定方向移动。此外微丝也与轴突输送作用有关。
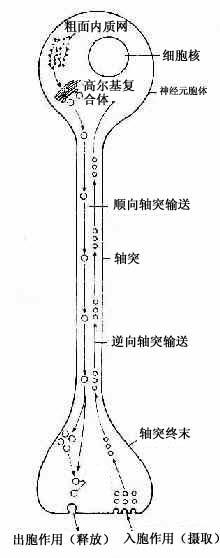
图7-8 双向轴突输送示意图
二、突触
突触(synapse)是神经元传递登记处的重要结构,它是神经元与神经元之间,或神经元与非神经细胞之间的一种特化的细胞连接,通过它的传递作用实现细胞与细胞之间的通讯。在神经元之间的连接中,最常见是一个神经元的轴突终末与另一个神经元的树突、树突棘或胞体连接,分别构成轴-树(axodendritic)、轴-棘(axospinous)、轴-体(axosomatic)突触(图7-4)。此外还有轴-轴(axoaxonal)和树-树(dendrodendritic)突触等。突触可分为化学突触(chemical synapse)和电突触(electrical synapse)两大类。前者是以化学物质(神经递质)作为通讯的媒介,后者是亦即缝隙连接,是以电流(电讯号)传递信息。哺乳动特神经系统以化学突触占大多数,通常所说的突触是指化学突触而言。
突触的结构可分突触前成分(presynaptic element)、突触间隙(synaptic cleft)和突触后成分(postsynaptic element)三部分。突触前、后成分彼此相对的细胞膜分别称为突触前膜和突触后膜(presynaptic and postsynapticmembrane),两者之间在宽约15~30nm的狭窄间隙为突触间隙,内含糖蛋白和一些细丝。突触前成分通常是神经元的轴突终末,呈球状膨大,它们在银染色标本中呈现为棕黑色的环扣状,附着在另一神经元的胞体或树突上,称突触扣结(synaptic bouton)(图7-9)。
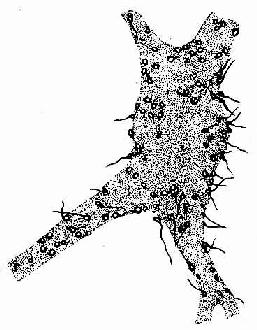
图7-9 脊髓运动神经元银染,示突触扣结
电镜下,突触扣结内含许多突触小泡(synapse vesicle),还有少量线粒体、滑面内质网、微管和微丝等(图7-10,7-11)。突触小泡的大小和形状不一,多为圆形,直径40~60nm,亦有的呈扁平形。突触小泡有的清亮,有的含有致密核芯(颗粒型小泡),大的颗粒型小泡直径可达200nm(图7-4)。突触小泡内含神经递质或神经调质。突触前膜和后膜均比一般细胞膜略厚,这是由于其胞质面附有一些致密物质所致(图7-10)。在突触前膜还有电子密度高的锥形致密突起(dense projection)突入胞质内,突起间容纳突触小泡。突触小泡表面附有突触小泡相关蛋白,称突触素Ⅰ(synapsinⅠ),它使突触小泡集合并附在细胞骨架上。突触前膜上富含电位门控通道,突触后膜上则富含受体及化学门控通道。当神经冲动沿轴膜传至轴突终末时,即触发突触前膜上的电位门控钙通道开放,细胞外的Ca2+进入突触前成分,在ATP的参与下使突触素I发生磷酸化,促使突触小泡移附在突触前膜上,通过出胞作用释放小泡内的神经递质到突触间隙内。其中部分神经递质与突触后膜上相应受体结合,引起与受体偶联的化学门控通道开放,使相应离子进出,从而改变突触后膜两侧离子的分布状况,出现兴奋或抑制性变化,进而影响突触后神经元(或非神经细胞)的活动。使突触后膜发生兴奋的突触称兴奋性突触(excitatory synapse),使突触后膜发生抑制的称抑制性突触(inhibitory synapse)。突触的兴奋或抑制,取决于神经递质及其受体的种类。
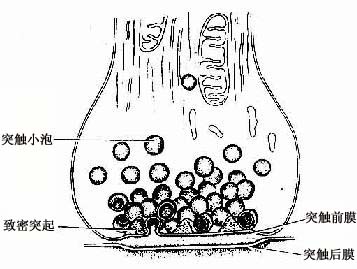
图7-10 化学突触超微结构模式图
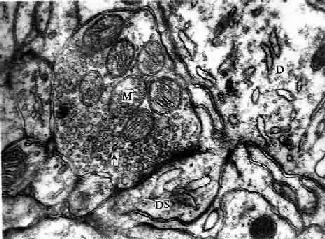
图7-11 豚鼠 小脑电镜像示突触
D树突,DS树突棘,M线粒体,↑突触小泡
(白求恩医科大学尹昕、朱秀雄供图)
一个神经元既可与其他神经元建立许多突触连接,亦可接受来自其他神经元的许多突触信息。一个神经元上突触数目的多少视不同的神经元而有很大差别,例如小脑的颗粒细胞只有几个突触,一个运动神经元要有1万个左右突触,而小脑的蒲肯野细胞树突上的突触就有10万个以上。一个神经元上众多的突触中,有些是兴奋性的,有些则是抑制性的。如果所有兴奋性突触活动的总和超过抑制性突触活动的总和,并足以刺激该神经元的轴突起始段产生动作电位时,则该神经元发生兴奋;反之,则表现为抑制。
根据突触前、后膜胞质面致密物质厚度的差异,可把突触分为Ⅰ、Ⅱ两型。Ⅰ型突触的突触后膜胞质面附有的致密物质较突触前膜的厚,两者不对称,突触间隙也较宽(30nm),故称不对称突触。Ⅱ型突触前、后膜的致密物质少,厚度相近,突触间隙较窄(20nm),称对称突触。有人认为Ⅰ型属兴奋性突触,Ⅱ型属抑制性突触。
神经递质的种类很多,包括:乙酰胆碱(acetylcholine,Ach);单胺类,如去甲肾上腺素(norepinephrine),多巴胺(dopamine,DA)和5-羟色胺(5-hydroxytryptamine,5-HT);氨基酸类,如γ-氨基丁酸(γ-aminobutyric acid GABA)、甘氨酸(glycine)、谷氨酸(glutamic acid)等。新近又发现大量的神经肽(neuropeptide),如P物质(substance P)、脑啡肽(enkephalin)、神经隆压素(neurotensin)、血管活性肠肽(vasoactive intestinal polypeptide,VIP)、胆囊收缩素(cholesystokinin)、加压素(vasopressin)、和下丘脑释放激素(hypothalamic releasing hormones)等约40多种。有些神经肽亦见于胃肠管的内分泌细胞,故总称为脑肠肽(braingut peptide)。这些肽类物质能改变神经元对经典神经递质的反应,起修饰经典神经递质的作用,故称为神经调质(neuromodulator)。不同形态大小的突触小泡所含的神经递质也不同,如圆形清亮小泡多数含乙酰胆碱,小颗粒型小泡含单胺类,大颗粒型小泡往往含神经肽。过去认为一个神经元一般只产生和释放一种神经递质,但近来应用免疫细胞化学法研究发现,某些神经元可产生和释放两种或两种以上的神经递质和(或)神经调质,其中一种往往是经典神经递质(Ach或NE),另一种则是神经肽。神经递质或神经调质共存的生理意义尚待研究。
突触后膜上的受体是一种膜蛋白,它能与相应的神经递质的结合而使突触后膜产生兴奋或抑制。神经递质的种类很多,受体的种类相应也很多。虽然一种受体只与相应的一种神经递质结合,但一种神经递质却可有不止一种受体。如乙酰胆碱受体就有N型(兴奋型)和M型(多数为兴奋型,少数为抑制型),去甲肾上腺素受体亦有α和β两类。所以,突触的兴奋或抑制,不仅取决于神经递质的种类(如γ-氨基丁酸是脑内一种抑制性神经递质),更重要的还取决于受体的类型。同一种神经递质在神经系统的不同部位有兴奋或抑制的不同效应,主要原因是突触后膜上受体类型的不同。突触后膜上的受体可直接与通道蛋白偶联或其本身就是一种通道蛋白,故当神经递质与这种形式的受体结合后使突触后膜产生的兴奋或抑制性变化十分迅速,所以把这种形式的受体称为快速作用受体,如乙酰胆碱N型受体属于快速作用受体。另外亦有慢速作用受体,这种受体一般与G蛋白偶联,再经过细胞内第二信使(环腺苷酸,cAMP)及蛋白磷酸化产生效应,它的作用比前者缓慢,但能把递质-受体相互作用所提供的微弱信号放大数千倍,如去甲肾上腺素β受体属于这种慢速作用受体。
释放到突触间隙的递质分子与突触后膜的受体结合产生生理效应后,很快便被相应的酶灭活(如Ach),或吸收入突触终末内被分解(如NE),以迅速消除该递质的作用,这样才能保证突触传递的灵敏性。递质的分解产物可被重新利用合成新的递质。非肽类递质除在胞体合成外,通常也可在轴突终末内合成,而肽类递质则只能在胞体内合成,释放后亦不能回收。合成的递质分子一般都贮存在突触小泡内。
三、神经胶质细胞
神经胶质细胞或简称胶质细胞(glial cell),广泛分布于中枢和周围神经系统,其数量比神经元的数量大得多,胶质细胞与神经元数目之比约10:1~50:1。胶质细胞与神经元一样具有突起,但其胞突不分树突和轴突,亦没有传导神经冲动的功能。胶质细胞可分几种,各有不同的形态特点,但HE染色只能显示其细胞核,用特殊的金属浸镀技术(银染色)或免疫细胞化学方法可显示细胞的全貌(图7-12)。
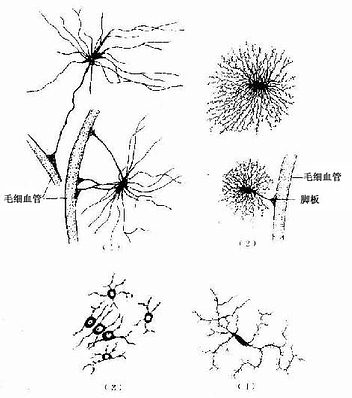
图7-12 中枢神经的几种胶质细胞(银染法)
(1)纤维性星形胶质细胞(2)原浆性星形胶质细胞
(3)少突胶质细胞(4)小胶质细胞
(一)中枢神经系统的胶质细胞
1.星形胶质细胞 星形胶质细胞(astrocyte)是胶质细胞中体积最大的一种,与少突胶质细胞合称为大胶质细胞(macroglia)。细胞呈星形,核圆形或卵圆形,较大,染色较浅(图7-13)。星形胶质细胞可分两种:①纤维性星形胶质细胞(fibrous astrocyte),多分布在白质,细胞的突起细长,分支较少,胞质内含大量胶质丝(glial fiament)。组成胶质丝的蛋白质称胶质原纤维酸性蛋白(glial fibrillary acidicprotein,GFAP),用免疫细胞化学染色技术,能特异性地显示这类细胞。②原浆性星形胶质细胞(protoplasmic astrocyte),多分布在灰质,细胞的突起较短粗,分支较多,胞质内胶质丝较少。星形胶质细胞的突起伸展充填在神经元胞体及其突起之间,起支持和分神经元的作用。有些突起末端形成脚板(end feet),附在毛细血管壁上(图7-12),或附着在脑和脊髓表面形成胶质界膜(glia limitans)(图7-14)。
星形胶质细胞之间的细胞间隙狭窄而迂回曲折,宽约15~20nm,内含组织液,神经元借此进行物质交换(图7-14),星形胶质细胞能吸收细胞间隙的K+,以维持神经元周围环境K+含量的稳定性,它还能摄取和代谢某些神经递质(如γ-氨基丁酸等),调节细胞间隙中神经递质的浓度,有利神经元的活动。在神经系统发育时期,某些星形胶质细胞具有引导神经元迁移的作用,使神经元到达预定区域并与其他细胞建立突触连接。中枢神经系统损伤时,星形胶质细胞增生、肥大、充填缺损的空隙,形成胶质瘢痕(glial scar)。
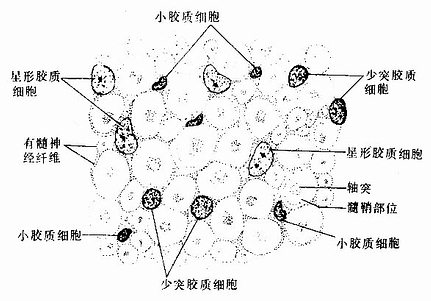
图7-13 中枢神经系各种神经胶质细胞的细胞核及神经纤维横切
(脊髓白质,Nissl法染色)
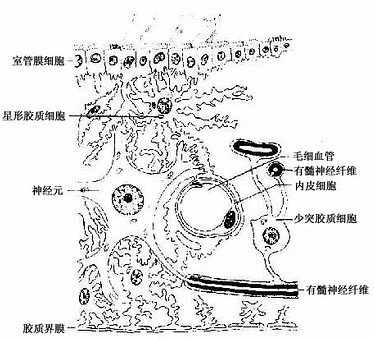
图7-14 中枢神经胶质细胞与神经元和毛细胞血管的关系图解
2.少突胶质细胞 在银染色标本中,少突胶质细胞(oligodendrocyte)的突起较少(图7-12),但用特异性的免疫细胞化学染色,是可见少突胶质细胞的突起并不很少,而且分支也多。少突胶质细胞的胞体较星形胶质细胞的小,核圆,染色较深(图7-13)。胞质内胶质丝很少,但有较多微管和其他细胞器。少突胶质细胞分布在神经元胞体附近和神经纤维周围,它的突起末端扩展成扁平薄膜,包卷神经元的轴突形成髓鞘,所以它是中枢神经系统的髓鞘形成细胞(图7-18)。新近研究认为,少突胶质细胞还有抑制再生神经元突起生长的作用。
3.小胶质细胞 小胶质细胞( microglia)是胶质细胞中最小的一种。胞体细长或椭圆,核小,扁平或三角形,染色深(图7-13)。细胞的突起细长有分支,表面有许多小棘突(图7-12)。小胶质细胞的数量少,约占全部胶质细胞的5%左右。中枢神经系统损伤时,小胶质细胞可转变为巨噬细胞,吞噬细胞碎屑及退化变性的髓鞘。血循环中的单核细胞亦侵入损伤区,转变为巨噬细胞,参与吞噬活动。由于小胶质细胞有吞噬功能,有人认为它来源于血液中的单核细胞,属单核吞噬细胞系统。
4.室管膜细胞 室管膜细胞(ependymal cell)为立方或柱形,分布在脑室及脊髓中央管的腔面,形成单层上皮,称室管膜(ependyma)。室管膜细胞表面有许多微绒毛,有些细胞表面有纤毛(图7-14)。某些地方的室管膜细胞,其基底面有细长的突起伸向深部,称伸长细胞(tanycyte)。
(二)周围神经系统的胶质细胞
1.施万细胞 施万细胞(Schwann cell)是周围神经纤维的鞘细胞,它们排列成串,一个接一个地包裹着周围神经纤维的轴突。在有髓神经纤维,施万细胞形成髓鞘,是周围神经系统的髓鞘形成细胞。施万细胞外表面有一层基膜,在周围神经再生中起重要作用。
2.卫星细胞 卫星细胞(satellite cell)是神经节内包裹神经元胞体的一层扁平或立方形细胞,故又称被囊细胞。细胞核圆或卵圆形,染色较深。细胞外面有一层基膜。
四、神经纤维和神经
(一)神经纤维
神经纤维(nerve fiber)是由神经元的长轴突外包胶质细胞所组成。包裹中枢神经纤维轴突的胶质细胞是少突胶质细胞,包裹周围神经纤维轴突的是施万细胞。根据包裹轴突的胶质细胞是否形成髓鞘(myelin sheath),神经纤维可分有髓神经纤维(myelinated fiber)和无髓神经纤维(unmyelinated nerve fiber)(图7-15)。神经纤维主要构成中枢神经系统的白质和周围神经系统的脑神经、脊神经和植物神经。
1.有髓神经纤维
(1)周围神经系统的有髓神经纤维:这种神经纤维的轴突,除起始段和终末外均包有髓鞘(图7-2,7-3)。髓鞘分成许多节段,各节段间的缩窄部称郎氏结(Ranvier node)。轴突的侧支均自郎氏结处发出。相邻两个郎氏结之间的一段称结间体(internode)。轴突越粗,其髓鞘也越厚,结间体也越长。每一结间体的髓鞘是由一个施万细胞的胞膜融合,并呈同心圆状包卷轴突而形成的,电镜下呈明暗相间的同心状板层(图7-16,7-17)。髓鞘的化学成分主要是类脂和蛋白质,称髓磷脂(myelin)。髓磷脂中类脂含量很高,约占80%,故新鲜髓鞘呈闪亮的白色,但在常规染色标本上,因类脂被溶解,仅见残留的网状蛋白质(图7-15)。若标本用锇酸固定和染色,髓磷脂保存,髓鞘呈黑色,在其纵切面上常见一些漏斗型的斜裂,称施-兰切迹(Schmidt-Lantermann incisure)(图7-15)。
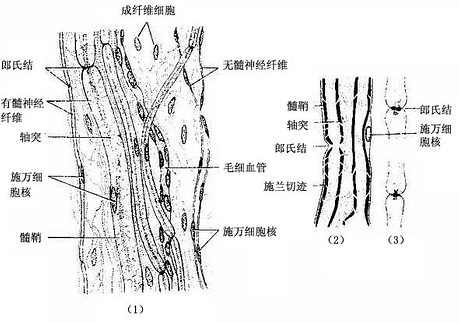
图7-15 周围神经纤维
(1)神经铺片示有髓和无髓神经纤维
(2)锇酸固定染色示髓鞘与施兰切迹
(3)银染法示郎氏结
施万细胞的胞核呈长卵圆形,其长轴与轴突平行,核周有少量胞质。由于施万细胞包在轴突的外面,故又称神经膜细胞(neurilemmal cell),它的外面包有一层基膜。施万细胞最外面的一层胞膜与基膜一起往往又称神经膜(neurilemma),光镜下可见此膜。
髓鞘的形成:在有髓神经纤维发生中,伴随轴突一起生长的施万细胞表面凹陷成一纵沟,轴突位于纵沟内,沟缘的胞膜相贴形成轴突系膜(mesaxon)。轴突系膜不断伸长并反复包卷轴突,把胞质挤至细胞的内、外边缘及两端(即靠近郎氏结处),从而形成许多同心圆的螺旋膜板层,即为髓鞘(图7-16,7-17)。故髓鞘乃成自施万细胞的胞膜,属施万细胞的一部分。施万细胞的胞质除见于细胞的外、内边缘和两端外,还见于髓鞘板层内的施-兰切迹。该切迹构成螺旋形的胞质通道,并与细胞外、内边缘的胞质相通。
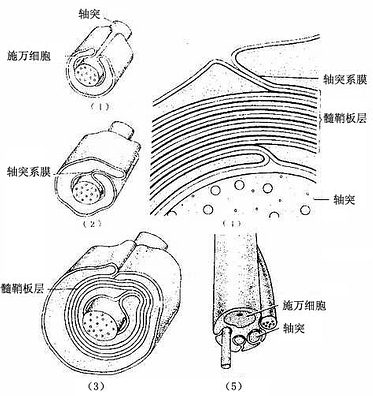
图7-16 周围神经纤维髓鞘形成及鞭超微结构模式图
(1)(2)(3)髓鞘发生过程(4)有髓神经纤维超微结构
(5)无髓神经纤维超微结构

图7-17 人有髓神经纤维髓鞘电镜像×40000(中山医科大学张爱华供图)
(2)中枢神经系统的有髓神经纤维:其结构基本与周围神经系统的有髓神经纤维相同,不同的是它的髓鞘不是施万细胞,而是由少突胶质细胞突起末端的扁平薄膜包卷轴突而形成。一个少突胶质细胞有多个突起可分别包卷多个轴突,其胞体位于神经纤维之间(图7-18)。其次是中枢有髓神经的外表面没有基膜包裹,髓鞘内亦无施-兰切迹。
有髓神经的轴膜兴奋是呈跳跃式传导的,故传导速度快。
有髓神经纤维的髓鞘,因含高浓度类脂而具嫌水性,它不容带离子的水溶液通过而起绝缘作用。有髓神经纤维轴突的轴膜,除轴突起始段和轴突终末外,只有在郎氏结处才暴露于细胞外环境。其余大部分的轴膜均被髓鞘包裹。由于髓鞘的电阻比轴膜高得多,而电容却很低,通过轴突的电流只能使郎氏结处的轴膜去极化而产生兴奋。所以,从轴突起始段产生的神经冲动(动作电位)的传导,是通过郎氏结处的轴膜进行的,即从一个郎氏结跳到下一个郎氏结,呈快速的跳跃式传导。故而,结间体越长,跳跃的距离也越大,传导速度也就越快。
2.无髓神经纤维
(1)周围神经系统的无髓神经纤维:由较细的轴突和包在它外面的施万细胞组成。施万细胞沿着轴突一个接一个地连接成连续的鞘,但不形成髓鞘,故无郎氏结;而且一个施万细胞可包裹许多条轴突(图7-16,7-19)。施万细胞外面亦有基膜。
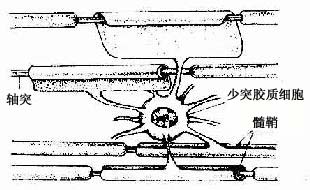
图 7-18 少突胶质细胞与中枢有髓神经纤维关系模式图
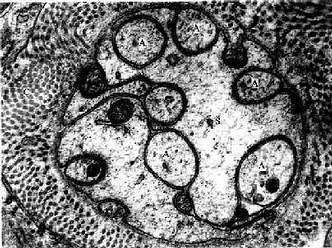
图7-19 大鼠无髓神经纤维横切电镜像×45000
A轴突,S施万细胞,C胶原原纤维
(白求恩医科大学尹昕、朱秀雄教授供图)
(2)中枢神经系统的无髓神经纤维:轴突外面没有任何鞘膜,因此是裸露的轴突,它们与有髓神经纤维混杂在一起。在一些脑区,它们可被星形胶质细胞的突起分隔成束。
无髓神经纤维因无髓鞘和郎区结,电流通过轴膜是沿着轴突连续传导的,故其传导速度比有髓神经纤维慢得多。
(二)神经
周围神经系统的神经纤维集合在起,构成神经(nerve),分布到全身各器官和组织。一条神经内可以只含有感觉(传入)神经纤维或运动(传出)神经纤维,但大多数神经是同时含有感觉、运动和植物神经纤维的。在结构上,多数神经同时含有髓和无髓两种神经纤维。由于有髓神经纤维的髓鞘含髓磷脂,故神经通常呈白色。
包裹在神经外面的致密结缔组织称神经外膜(epineurium)。神经内的神经纤维,又被结缔组织分隔成大小不等的神经纤维束,包裹每束神经纤维的结缔组织称神经束膜(perineurium)(图7-20)。神经束膜的外层是结缔组织,内层则由多层的扁平上皮细胞组成,称神经束膜上皮(perineural epithelium),上皮细胞之间有紧密连接,每层上皮都有基障进入神经内部。神经纤维束内的每条神经纤维又有薄层疏松结缔组织包裹,称神经内膜(endoneurium)。神经内的血管较丰富,神经外膜内的纵行血管发出分支进入神经束膜,进而在神经内膜形成毛细血管网。神经内膜亦含有淋巴管。
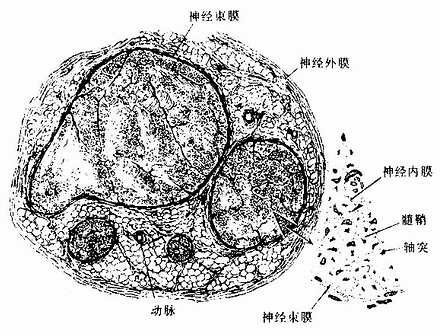
图7-20 坐骨神经横切,示神经外膜、神经束膜与神经内膜
五、神经末梢
周围神经纤维的终末部分终止于全身各种组织或器官内,形成各式各样的神经末梢(nerve ending),按其功能可分感觉神经末梢和运动神经末梢两大类。
(一)感觉神经末梢
感觉神经末梢(sensory nerve ending)是感觉神经元(假单极神经元)周围突的终末部分,该终末与其他结构共同组成感受器。感受器能接受内、外环境的各种刺激,并将刺激转化为神经冲动,传向中枢,产生感觉。感觉神经末梢按其结构可分游离神经末梢和有被囊神经末梢两类。
1.ng)结构较简单。较细的有髓或无髓神经纤维的终末部分失去施万细胞,裸露的轴突末段分成细支,分布在表皮、角膜和毛囊的上皮细胞间,或分布在各型结缔组织内,如骨膜、脑膜、血管外膜、关节囊、肌腱、韧带、筋膜和牙髓等处。此类末梢感受冷、热、轻触和痛的刺激(图7-21,7-3)。
图7-21 表皮内的游离神经末梢
2.有被囊神经末梢 有被囊神经末梢(encapsulated nerve ending)外面均包裹有结缔组织被囊,它们的种类很多,常见的有如下几种:
(1)触觉小体(tactile corpuscle)又称Meissner小体,分布在皮肤真皮乳头内,以手指、足趾的掌侧的皮肤居多,感受触觉,其数量可随年龄增长而减少。触觉小体呈卵圆形,长轴与皮肤表面垂直,外包有结缔组织囊,小体内有许多横列的扁平细胞。有髓神经纤维进入小体时失去髓鞘,轴突分成细支盘绕在扁平细胞间(图7-22)。
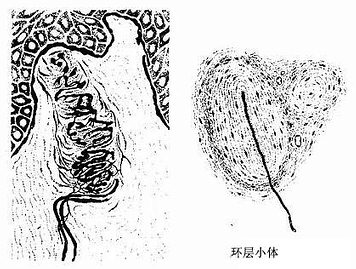
图7-22 有被囊的感觉神经末梢
(2)环层小体(lamellar corpuscle):又称Pacinian小体,体积较大(直径1~4mm),卵圆形或球形,广泛分布在皮下组织、肠系膜、韧带和关节囊等处,感受压觉和振动觉。小体的被囊是由数十层呈同心圆排列的扁平细胞组成,小体中央有一条均质状的圆柱状。有髓神经纤维进入小体失去髓鞘,裸露轴突穿行于小体中央的圆柱体内(图7-22)。
(3)肌梭(muscle spindle):是分布在骨骼肌内的梭形小体,长约1~7mm,外有结缔组织被囊,内含若干条细小的骨骼肌纤维称梭内纤维(intrafusal muscle fiber)。梭内肌纤维的中段肌浆较多,肌原纤维较少,有些肌纤维的细胞核排列成串,有些肌纤维的细胞核聚集在中段而使中段膨大。感觉神经纤维进入肌梭时失去髓鞘,其轴突细支呈环状包绕梭内肌纤维的两端。肌梭是一种本体感受器,主要感受肌纤维的伸缩变化,在调节骨骼肌的活动中起重要作用(图7-23)。
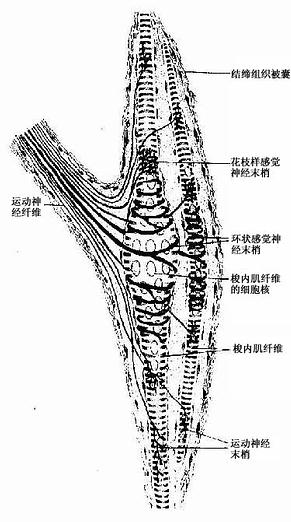
图7-23 肌梭结构模式图
(二)运动神经末梢
运动神经末梢(motor nerve ending)是运动神经元的长轴突分布于肌组织和腺内的终末结构,支配肌纤维的收缩和腺的分泌。神经末梢与邻近组织共同组成效应器(effector)。运动神经末梢又分躯体和内脏运动神经末梢两类。
1.躯体运神经末梢躯体运动神经末梢(somatic motor nerve ending)分布于骨骼肌内。神经元的胞体位于脊髓灰质前角或脑干,轴突很长,离开中枢神经系统后成为躯体传出(运动)神经纤维,其中小部分细有髓神经纤维供应肌梭内的梭内肌纤维,其余大部分粗有髓神经纤维均分布于骨骼肌(梭外肌)。有髓神经纤维抵达骨骼肌时失去髓鞘,其轴突反复分支,每一分支形成葡萄状终末与一条骨骼肌纤维建立突触连接,此连接区域呈椭圆形板状隆起,称运动终板(motor end plate)或神经肌连接(neuromuscular junction)(图7-24)。

图7-24 运动终板(骨骼肌纤维压片,氯化金法)
一条有髓运动神经纤维支配的骨骼肌纤维数目多少不等,少者1~2条,多者可分支支配上千条;而一条骨骼肌纤维通常只有一个轴突分支支配。一个运动神经元的轴突及其分支所支配的全部骨骼肌纤维合称一个运动单位(motor unit)。在电镜下,运动终板处的肌纤维含丰富的肌浆,有较多的细胞核和线粒体,肌纤维表面凹陷成浅糟,突终末嵌入浅糟内(图7-25)。糟底肌膜即突触后膜,它又凹陷成许多深沟和皱褶,使突触后膜的表面积增大,突触后膜上有乙酰胆碱N型受体。轴突终末与肌膜之间在的间隙为突触间隙,与肌膜相对的轴膜是突触前膜,它富含电位门控钙通道。轴突终末内有大量圆形突触小泡,内含神经递质乙酰胆碱。还有许多线粒体和一些微管、微丝等。当神经冲动到达运动终时,轴突终末突触前膜上的电位门控钙通道开放,Ca2+进入轴突终末内,促使突触小泡移附于突触前膜,并藉出胞作用释放其内的乙酰胆碱到突触间隙。大部分乙酰胆碱分子与肌膜(突触前膜)上的乙酰胆碱N型受体结合,引起与受体偶联的化学门控钠通道开放,大量Na+进入肌浆内,使肌膜两侧离子分布发生变化而产生兴奋,从而引起肌纤维的收缩。
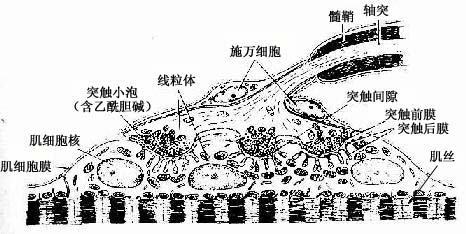
图7-25 运动终板超微结构模图
2.内脏运动神经末梢内脏运动神经末梢(visceral motor nerve ending)分布于内脏及心血平滑肌、心肌和腺上皮细胞等处。内脏运动神经属植物神经系统的一部分,它从中枢到效应器的通路一般由两个神经元组成。第一个神经元称节前神经元(preganglionic neuron),胞体位于脊髓灰质侧角或脑干,轴突称节前纤维。第二个神经元称节后神经元(postganglionic neuron),胞体位于植物神经节可神经丛,轴突组成节后纤维。节前纤维离开中枢进入植物神经节或神经丛,与节后神经元的胞体或树突建立突触连接。节后纤维离开植物神经节或神经丛,分布到内脏及血管的平滑肌、心肌和腺细胞,成为内脏运动神经末梢(图7-26)。这类神经纤维较细,无髓鞘,其轴突终末分支常呈串珠样膨体(varicosity)。它是与效应细胞建立突触的部位。膨体内有许多圆形或颗粒型突触小泡,圆形清亮突触小泡含乙酰胆碱,颗粒型突触小泡含去甲肾上腺素或肽类神经递质。
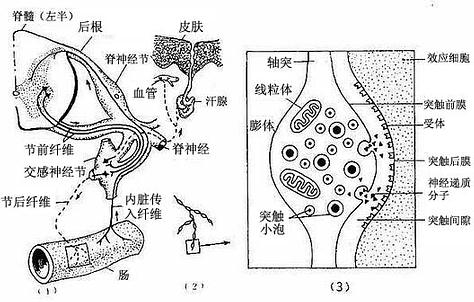
图7-26 内脏运动神经纤维及其末梢
(1)内脏神经分布图解(2)内脏运动神经末梢(3)膨体超微结构图解
根据末梢膨体内突触小泡释放神经递质的不同,可把内脏运动神经纤维分为胆碱能、肾上腺素能和肽能纤维。所有节前纤维都属胆碱能纤维,节后纤维则因交感神经和副交感神经而不同。交感神经的节后纤维是肾上腺素能或肽能纤维,或一种纤维既是肾上腺素能又是肽能的;副交感神经的节后纤维则是胆碱能或肽能纤维,或一种纤维既是胆碱能又是肽能的。与内脏运动神经末梢膨体接触的效应的细胞膜(突触后膜)上有相应的神经递质的不同类型受体,膨体释放的神经递质与不同类型受体结合,可引起效应细胞不同的生理效应。
六、神经纤维的溃变与再生
(一)溃变
神经纤维受损伤如神经被切断后,切断处远侧段的神经纤维全长发生溃变(degeneration),轴突和髓鞘碎裂和溶解。与胞体相连的近侧段则发生逆行性溃变,即轴突和髓鞘的断裂溶解由切断处向胞体方向进行,溃变一般只发展到邻近断端的第一侧支终止。神经元的胞体肿胀,细胞核从中央移到胞体边缘,胞质内尼氏体明显减少,故胞质着色浅淡(图7-27)。
(二)再生
神经元胞体是细胞的营养中心,只有在胞体没有死亡的条件下才有纤维再生(regeneration)的可能。胞体约于损伤后第3周开始恢复,胞质内的尼氏体重新出现,胞体肿胀消失,胞核恢复中央位置。胞体的完全恢复约需3~6个月,恢复中的胞体不断合成新的蛋白质及其他产物输向轴突,使残留的近侧段轴突末端生长出许多新生的轴突支芽(图7-27)。
1.周围神经纤维的再生切断处远侧段的周围神经纤维,虽然其轴突和髓鞘发生溃变,但包裹神经纤维的基膜仍保留呈管状。此时施万细胞大量增生,一面吞噬解体的轴突和髓鞘,一面在基膜管内排列成细胞索,靠近断口处的施万细胞还形成细胞桥把两断端连接起来。从近侧段神经纤维轴突末端长出的轴突支芽,越过此施万细胞桥,进入基膜管内,当其中一支沿着施万细胞索生长并到达原来神经纤维末梢所在处,则再生成功(图7-27)。施万细胞和基膜对轴突的再生起重要的诱导作用。
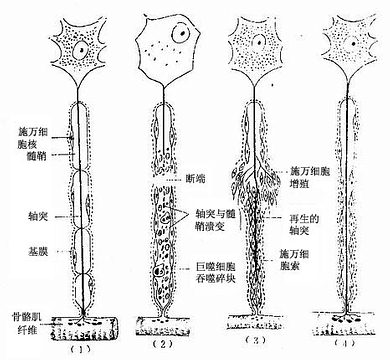
图7-27 周围神经的溃变与再生图解
(1)正常神经纤维,(2)神经纤维断离处及端及近端的一部分髓鞘及轴突溃变(3)施万细胞增生,轴突生长,(4)多余的轴突消失,神经纤维再生完成。
2.中枢神经纤维的再生中枢神经纤维的再生比周围神经困难。神经纤维无施万细胞,亦无基膜包裹。当中枢神经纤维受损伤时,星形胶质细胞增生肥大,在损伤区形成致密的胶质瘢痕,大多数再生轴突支不能越过此胶质瘢痕;即使能越过,也没有如同周围神经纤维那样的基膜管和施万细胞索引导再生轴突到达目的地。所以,中枢神经纤维的损伤常导致脊髓或脑功能的永久性丧失。数十年来不少科学家为研究神经再生进行不懈的努力,近年来已注意到一类能促进神经生长的化学物质称神经营养因子(neurotrophic factor)的作用。同时又根据胚胎神经元容易生长的化学物质称神经营养因子(neurotrophic factor)的作用。同时又根据胚胎神经元容易生长及周围神经能再生的特点,把胚胎脑组织、周围神经或周围神经的组分(如基膜或基膜的化学成分)移植到脑内,以期促进中枢神经再生。
七、神经节、脊髓、大脑皮质和小脑皮质的结构
在中枢神经系统,神经元胞体集中的部分称灰质(gray matter),不含胞体只有神经纤维的部分称白质(white matter)。大脑和小脑的灰质位于脑的表层,故又称皮质(cortex),皮质下是白质。在脑的白质内,神经元胞体集中而成的一些团块称神经核(团)。脊髓的灰质则位于中央,周围是白质。在周围神经系统,神经元胞体集中的部分构成神经节或神经丛。分布在各部位的神经元,它们的形态、大小及突起的长短有很大的差异,其中的长轴突(Golgi型)神经元,其轴突从胞体所在的区域远伸到神经系统的其他部分,或分布到身体的其他组织。
(一)神经节
神经节可服脑脊神经节(cerebrospinal ganglion)和植物神经节(vegetative ganglion)两大类。脑脊神经节位于脊神经后根和某些脑神经干上,植物神经节包括交感和副交感神经节。交感神经节位于脊柱两旁及前方,副交感神经节则位于器官附近或器官内。神经节一般为卵圆形,与周围神经相连,外包结缔组织被膜。节内的神经细胞称节细胞,细胞的胞体被一层扁平的卫星细胞包裹,卫星细胞外面还有一层基膜。除节细胞外,节内还有大量神经纤维以及少量结缔组织和血管。
1.脑脊神经节 属感觉神经节。节细胞是假单极神经元,胞体圆或卵圆形,大小不等,大者直径达100μm以上,小者仅15μm。细胞核圆形位于胞体中央,核仁明显。胞质内的尼氏体细小分散。从胞体发出一个突起,在胞体附近盘曲,然后呈“T”形分支,一支走向中枢(中枢突),另一支(周围突)经脑脊神经分布到外周组织,其末梢形成感受器。卫星细胞包裹着节细胞胞体及其盘曲的突起,在“T”形分支处与施万细胞鞘相连续。节细胞的胞体大多集中在神经节的周缘,并被神经纤维束分隔成群。脑脊神经节内的神经纤维大部分是有髓神经纤维(图7-28)
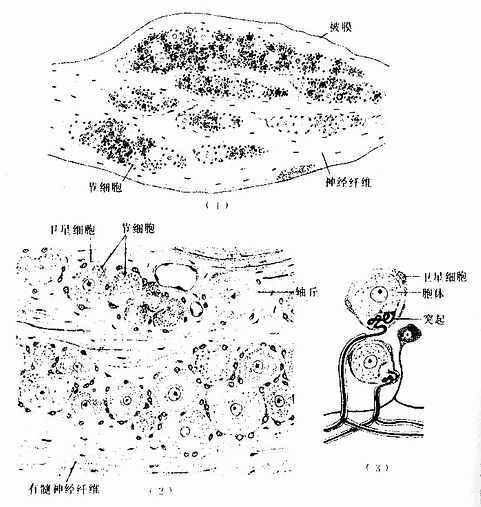
图7-28 脊神经节
(1)低倍 (2)高倍 (3)假单极神经元
2.植物神经节 其中的节细胞是植物神经系统的节后神经元,属多极的运动神经元,胞体一般较感觉神经节的细胞小,散在分布(图7-29)。细胞核常偏位于细胞的一侧,部分细胞有双极,胞质内尼氏体呈颗粒状,均匀分布。卫星细胞数量较少,不完全地包裹节细胞胞体。节内的神经纤维多为髓神经纤维,较分散,其中有节前纤维和节后纤维。节前纤维与节细胞的树突和胞体建立突触,节后纤维离开神经节,其末梢分布到内脏及心血管的平滑肌、心肌和腺上皮细胞,即内脏运动神经末梢。
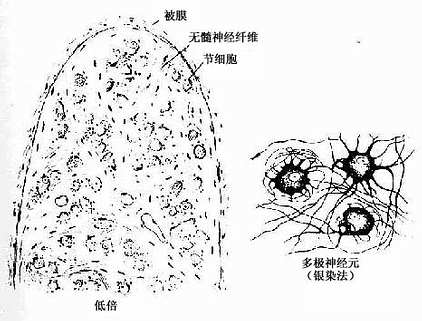
图7-29 交感神经节
交感神经节的节细胞有两种。一种是体积略大的主节细胞(principal ganglion cell),占大多数。大部分主节细胞属肾上腺素能神经元,少数为胆碱能神经元。另一种节细胞数量少,体积也小,常聚集成小群,荧光组织化学染色标本,这些细胞显示强荧光,故称小强荧光细胞(small intensely fluorescenecell,SIF细胞)。SIF细胞释放神经递质多巴胺,它可能是一种中间神经元,其轴突终末与主节细胞建立突触。副交感神经节的节细胞一般属胆碱能神经元。近年来认为,植物神经节除含肾上腺素能和胆碱能神经元外,还存在释放肽类神经递质的肽能神经元。
(二)脊髓灰质
脊髓的灰质居中央,在横切面上呈蝴蝶形(图7-3),分前角、后角和侧角(侧角主要见于胸腰段脊髓)。神经元都是多极型。前角内大多是躯体运动神经元,胞体大小不等。大者称α神经元,其轴突较粗,分布到骨骼肌(梭外肌);小者称γ神经元,其轴突较细,支配梭的梭内肌纤维。还有一种短轴突的小神经元称Ranshaw细胞,其轴突与α神经元的胞体形成突触,可能通过释放甘氨酸,抑制α神经元的活动。侧角内的神经元是交感神经系统的节前神经元,胞体中等大小,其轴突(节前纤维)终止于交感神经节,与节细胞建立突触(图7-26)。前角的躯体运动神经元和侧角的内脏运动神经元都是乙酰胆碱能神经元。后角内的神经元组成较复杂,细胞一般较小,它们主要接受后根纤维(感觉神经元的中枢突)传入的神经冲动,其轴突在白质内形成各种上行纤维束到脑干、小脑和丘脑,所以这类神经元又称为束细胞(tract cell)。此外,脊髓灰质内还遍布许多中间神经元,它们的轴突长短不一,但都离不开脊髓,短轴突与同节段的束细胞和运动神经元联系,长轴突在白质上下穿行至相邻或较远的脊髓节段,终止于同侧或对侧的神经元。
(三)大脑皮质
1.大脑皮质的神经元类型大脑皮质的神经元都是多极神经元,按其细胞的形态分为锥体细胞、颗粒细胞和梭形细胞三大类(图7-30)。
图7-30大脑皮质神经元的形态和分布
(1)锥体细胞(pyramidal cell):数量较多,可分大、中、小三型。胞体形似锥形,尖端发出一条较粗的主树突,伸向皮质表面,沿途发出许多小分支,胞体还向四周发出一些水平走向的树突。轴突自胞体底部发出,长短不一,短者不越出所在皮质范围,长者离开皮质,进入髓质(白质),组成投射纤维(下行至脑干或脊髓)或联合纤维(到同侧或对侧的另一皮质区)。因而,锥体细胞是大脑皮质的主要投射(传出)神经元。
(2)颗粒细胞(granular cell):数目最多。胞体较小,呈颗粒状,包括星形细胞(stellate cell)、水平细胞(horizontal cell)和篮状细胞(basket cell)等几种。以星形细胞最多,它们的轴突多数很短,终止于附近的锥体细胞或梭形细胞。有些星形细胞的轴突较长,上行走向皮质表面,与锥体细胞顶树突或水平细胞相联系。水平细胞的树突和轴突与皮质表面平行分布,与锥体细胞顶树突联系。所以,颗粒细胞是大脑皮质区的局部(中间)神经元,构成皮质内信息传递的复杂微环路。
(3)梭形细胞(fusiform cell):数量较少,大小不一。大梭形细胞也属投射神经元,主要分布在皮质深层,胞体梭形,树突自细胞的上、下两端发出,上端树突多达皮质表面。轴突自下端树突的主干发出,进入髓质,组成投射纤维或联合纤维。
2.大脑皮质的分层 大脑皮质的这些神经元是以分层方式排列的,除大脑的个别区域外,一般可分为6层,从表面至深层的结构如下(图7-31):
图7-31 大脑皮质6层结构
(1)银染法示神经元形态 (2)尼氏染色示6层结构
(3)髓鞘染色示神经纤维的分布
(1)分子层(molecular layer):神经元小而少,主要是水平细胞和星形细胞,还有许多与皮质表面平行的神经纤维。
(2)外颗粒层(external granular layer):主要由许多星形细胞和少量小型锥体细胞构成。
(3)外锥体细胞层(external pyramidal layer):此层较厚,由许多中、小型锥体细胞和星形细胞组成。
(4)内颗粒层(internal granular layer):细胞密集,多数是星形细胞。
(5)内锥体细胞层(internal pyramidal layer):主要由中型和大型锥体细胞组成。在中央前回运动区,此层有巨大锥体细胞,胞体高120μm,宽80μm,称Betz 细胞,其顶树突伸到分子层,轴突下行到脑干和脊髓。
(6)多形细胞层(polymorphic layer):以梭形细胞为主,还有锥体细胞和颗粒细胞。
大脑皮质的1-4层主要接受传入冲动。从丘脑来的特异传入纤维(各种感觉传入的上行纤维)主要进入第4层与星形细胞形成突触,星形细胞的轴突又与其他细胞建立广泛的联系,从而对传入皮质的各种信息进行分析,作了反应。起自大脑半球同侧或对侧的联合传入纤维则进入第2、3层,与锥体细胞形成突触。大脑皮质的传出纤维分投射纤维和联合纤维两种。投射纤维主要起自第5层的锥体细胞和第6层的大梭形细胞,下行至脑干及脊髓。联合纤维起自第3、5、6层的锥体细胞和梭形细胞,分布于皮质的同侧及对侧脑区。皮质的第2、3、4层细胞主要与各层细胞相互联系,构成复杂的神经微环路对信息进行分析、整合和贮存(图7-32)。大脑的高级神经活动可能与其复杂的微环路有密切关系。
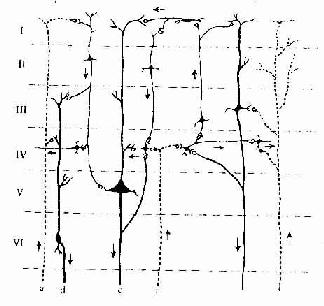
图7-32大脑皮质内微环路简图
a 特异传入纤维,b联合传入纤维,c 投射传出纤维,d联合传出纤维
大脑皮质的6层结构因不同脑区而有差异。例如中央前回(运动同)的第4层不明显,第5层较发达,有巨大锥体细胞(细胞);视皮质则第4层特别发达,第5层的细胞较小。有些学者对大脑皮质进行了组织学普查,根据细胞的排列和类型以及有髓神经纤维的配布型式等的差异,作出了人脑皮质的分区图。不同的学者有不同的分区法,较常用的是Brodmann(1909)的分区法,把大脑皮质分为52区,并以数字表示之。
虽然大脑皮质的神经元是以分层方式排列的,但对大脑皮质结构与功能的研究发现,皮质细胞是呈纵向柱状排列的,称此为垂直柱(vertical column)。垂直柱可能是构成大脑皮质的基本功能单位,如感觉皮质区的一个垂直柱内的神经元。具有相同或近于相同的周围感受野,即这些神经元都对同一类型的周围刺激起反应。同垂直柱贯穿皮质全厚,大小不等,直戏约350~450μm,它包括传入纤维,传出神经元和中间神经元,传入纤维直接或间接通过柱内各层细胞构成复杂的反复回路,然后作用于同的传出神经元。皮质垂直柱内除垂直方向的反复回路外,还可通过星形细胞和锥体细胞的基底树突使兴奋横向扩布,影响更多垂直柱的神经元活动。
(四)小脑皮质
小脑表面有许多平行的横沟,把小脑分隔成许多小叶片。每一叶片表面是一层灰质,即小脑皮质,皮质下为白质(髓质)。小脑皮质从外到内明显地分3层(图7-33)。皮质内的神经元有星形细胞、篮状细胞、蒲肯野细胞(Purkinje cell或称梨状细胞)、颗粒细胞和高尔基细胞(Golgi cell)5种(图7-34)。
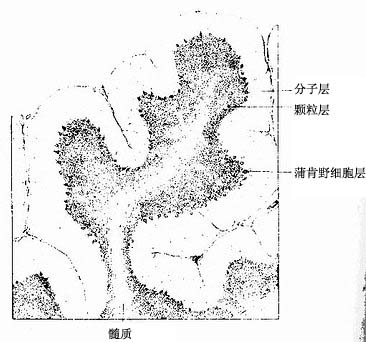
图7-33 小脑切面

图7-34 小脑皮质结构图解
1.分子层 2.蒲肯野细胞层 3.颗粒层
1.分子层此层较厚,神经元较少,主要有两种。一种是小型多突的星形细胞,轴突较短,分布于浅层。另一种是篮状细胞,胞体较大,分布于深层,其轴突较长,与小脑叶片长轴成直角方向并平行于小脑表面走行,沿途发出许多侧支,其末端呈篮状分支包绕蒲肯野细胞的胞体并与之形成突触。
2.蒲肯野细胞层由一层蒲肯野细胞胞体组成。此种细胞是小脑皮质中最大的神经元,胞体呈梨形,从顶端发出2~3条粗的主树突伸向分子层,树突的分支繁多,形如侧柏叶状或扇形,铺展在与小脑叶片长轴垂直的平面上。轴突自胞体底部发出,离开皮质进入髓质,终止于小脑内部的核群。
3.颗粒层 此层由密集的颗粒细胞和一些高尔基细胞组成。颗细胞很小,胞体直径与淋巴细胞近似,有4~5个短树突,树突末端分支如爪状。轴突上行进入分子层呈“T”形分支,与小脑叶片长轴平行,称平行纤维(parallel fiber)。平行纤维穿过一排排蒲肯野细胞的扇形树突,与其树突棘形成突触(图7-35)。一条平行纤维可与400多个蒲肯野细胞建立突触,每个蒲肯野细胞与一条平行纤维之间只有一个突触连接;但一个蒲肯野细胞的扇形树突有20万~30万条平行纤维通过,故一个蒲肯野细胞的树突上共有20万~30万个突触。高尔基细胞的胞体较大,树突分支较多,大部分伸入分子层与平行纤维接触,轴突在颗粒层内呈丛密分支,与颗粒细胞的树突形成突触。
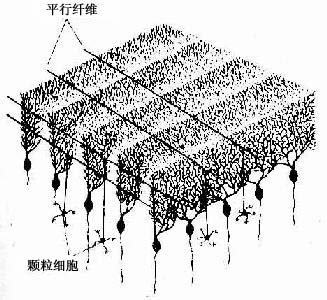
图7-35 蒲肯野细胞的排列模式与平行纤维的关系
小脑的5种神经元中,蒲肯野细胞是唯一的传出神经元。颗粒细胞是谷氨酸能的兴奋性神经元,其他中间神经元都是γ-氨基丁酸(GABA)能的抑制性神经元。小脑的传入纤维有三种:攀缘纤维(climbing fiber)、苔藓纤维(mossy fiber)和去甲肾上腺素能纤维。前两者是兴奋性纤维,后者是抑制性纤维。攀缘纤维主要起源于延髓的下橄榄核,纤维较细,它进入小脑皮质攀附在蒲肯野细胞的树突上与之形成突触。一条攀缘纤维与一个蒲肯野细胞树突所形成的突触可达300多个。故一条攀缘纤维的神经冲动可引起一个蒲肯野细胞强烈兴奋。苔藓纤维起源于脊髓和脑干的核群,纤维较粗,进入小脑皮质后纤维末端分支呈苔状。每一膨大的末端可与许多(约20个)颗粒细胞的树突、高尔基细胞的轴突或近端树突形成复杂的突触群,形似小球,故称小脑小球(cerebellar glomerulus)(图7-36)。一条苔藓纤维的分支可分布于2个或2个以上的叶片内,约可兴奋800多个颗粒细胞,每个颗粒细胞的平行纤维又与400多个蒲肯野细胞接触。这样,一条苔藓纤维可引起几十万个蒲肯野细胞兴奋,所以,攀缘纤维和苔藓纤维把来自小脑外的神经冲动传到小脑皮质,最后都作用于蒲肯野细胞。攀缘纤维直接强烈地兴奋单个蒲肯野细胞,而苔藓纤维则通过颗粒细胞的平行纤维间接兴奋几十万个蒲肯野细胞。另一方面,攀缘纤维的侧支及颗粒细胞的平行纤维还可以与其他抑制性中间神经元(星形细胞、篮细胞和高尔基细胞)形成突触,这些抑制性中间神经元又与肯野细胞形成突触。因此,攀缘纤维的冲动可通过其侧支作用于抑制性中间神经元,从而抑制蒲肯野细胞。同样,苔藓纤维通过颗粒细胞平行纤维兴奋许多蒲肯野细胞的同时,亦可通过与抑制性中间神经元连接,抑制蒲肯野细胞的兴奋。此外,去甲肾上腺素能纤维(来自脑干的蓝斑核)对蒲肯野细胞亦有抑制作用。
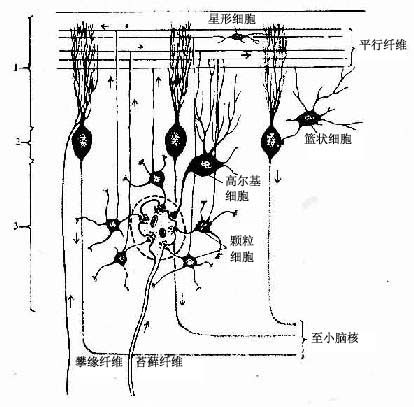
图7-36 小脑皮质神经元与传入纤维的关系
1分子层 2蒲肯野细胞层 3颗粒层
虚线范围代表一个小脑小球
八、脑脊膜和血脑屏障
脑脊膜是包在脑和脊髓外面的结缔组织膜,有三层,由外向内是硬膜(dura mater)、蛛网膜(arachnoid )和软膜(pia mater)。硬膜是较厚而坚韧的致密结缔组织,其内表面有一层间皮细胞覆盖。硬膜与蛛网膜之间有一狭窄的间隙,称硬膜下隙(subdural space),内含少量液体。蛛网膜是由薄层纤细的结缔组织构成,它与软膜之间有较宽大的腔隙称蛛网膜下隙(subarachnoid space)。蛛网膜的结缔组织纤维形成许多小梁与软膜相连,小梁在蛛网膜下隙内分支形成蛛网膜结构。蛛网膜下隙内含脑脊液。软膜是紧贴在脊髓表面的薄层结缔组织,富含血管。在软膜外表面和蛛网膜的外、内表面以及小梁的表面均被覆有单层扁平上皮,软膜的血管供应脑及脊髓。血管进入脑内时,软膜和蛛网膜也随之进入脑内,但软膜并不紧包血管,血管与软膜之间仍有空隙,称血管周隙(perivascular space),与蛛网膜下隙相通,内含脑脊液(图7-37)。当小血管进一步分支形成毛细血管时,软膜组织和血管周隙都消失,毛细血管则由星形胶质细胞突起所包裹(图7-37、7-14)。
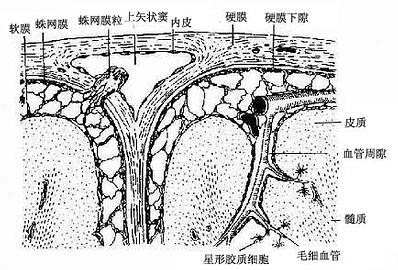
图7-37 大脑冠状切面,示脑膜和血管
脑的毛细血管与身体其他器官的毛细血管不同,它能阻止多种物质进入脑。例如将一种活性染料台盼蓝(trypan blue)注入动物的血内,身体各器官都被染上蓝色,唯独脑组织不着色。因此认为血液与脑组织之间在存在一种血脑屏障(blood-brain barrieer,BBB),限制某些物质进入脑组织。此血脑屏障由脑毛细血管内皮细胞、基膜和神经胶质膜构成。脑的毛细血管属连续型(见循环系统),毛细血管内皮细胞之间以紧密连接封闭,内皮外有基板、周细胞及星形胶质细胞突起的脚板围绕(图7-38)。实验证明,内皮细胞是构成血脑屏障的主要结构,它可阻止多种物质进入脑,但营养物质和代谢产物可顺利通过,以维持神经系统内环境的相对稳定。脑毛细血管内皮细胞的这种生理特性,与细胞膜上存在许多不同类型的转运器(transporter)有关,转运器是细胞膜上的蛋白质,能识别特定分子并转运它们越过血脑屏障。星形胶质细胞有诱导内皮细胞形成屏障特性的作用。
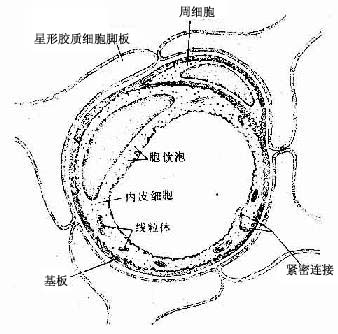
图7-38 脑毛细血管超微结构模式图
九、脉络丛和脑脊液
脉络丛(choroid plexus)见于第Ⅲ、Ⅳ脑室顶和部分侧脑室壁,它是由富含血管的软膜与室管膜直接相贴并突入脑室而成的皱襞状结构,室管膜则成为有分泌功能的脉络丛上皮(图7-39)。脉络丛上皮由一层立方形或矮柱形细胞组成,细胞表面有许多微绒毛,细胞核大而圆,胞质内线粒体很多。细胞侧面之间靠近游离面处有连接复合体。上皮下是基膜,基膜深部是结缔组织。结缔组织内含丰富血管和巨噬细胞。毛细血管属有孔型,内皮细胞上的小孔有薄隔膜封闭。
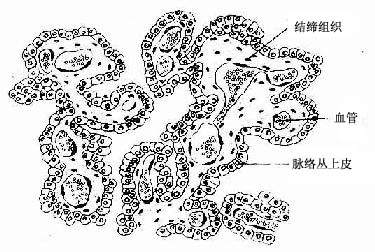
图7-39 脉络丛
脉络丛的主要功能是产生脑脊液(cerebrospinal fluid),脑脊液是由脉络丛上皮细胞分泌的,为无色透明的液体,含蛋白质很少,但有较高浓度的Na+、K+和Cl-,并有少许脱落细胞和淋巴细胞。成年男性约有100ml脑脊液,在脑室、脊髓中央管、蛛网膜下隙和血管周隙。脑脊液通过蛛网膜粒(蛛网膜突入颅静脉窦内的绒毛状突起)吸收入血(图7-37)。脉络丛上皮不断分泌脑脊液,又不断回流入血液,形成脑脊液循环。脉络丛上皮和脉络丛毛细血管内皮共同构成血-脑脊液屏障(blood-cerebrospinal fluidbarrier,BCB),使脑脊液保持稳定的成分而不同于血液。脑脊液有营养和保护脑与脊髓的作用。
第八章 循环系统
循环系统是连续而封闭的管道系统,包括心血管系统和淋巴系统两个部分,心血管系统由心脏、动脉、毛细血管和静脉组成。心脏是输送血液流动的泵,心脏搏出的血液经动脉到毛细血管,毛细血管的管壁薄,血液在此与周围组织进行物质交换;静脉起始端也参与物质交换,但主要是将物质交换后的血流到心脏。淋巴管系统是一个辅助的循环管道,由毛细淋巴管、淋巴管和淋巴导管组成。毛细淋巴管为淋巴管系统的起始部分,位于组织中,进入毛细淋巴管的组织液称淋巴。淋巴流经粗细不等的淋巴管,最后汇合成右淋巴导管和胸导管,导入大静脉。循环系统的一些细胞还具有内分泌功能。
一、血管壁的组成和一般结构
除毛细血管和毛细淋巴管以外,血管壁从管腔面向外一般依次分为内膜、中膜和外膜(图8-1)。血管壁内还有营养血管和神经分布。
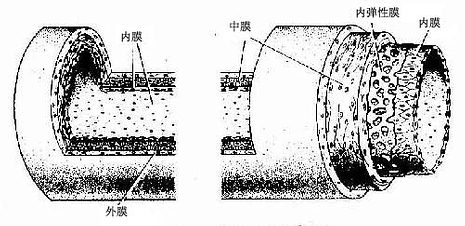
图8-1 血管一般结构模式图
(1)内膜
内膜(tunica intima)是管壁的最内层,由内皮和内皮下层组成,是三层中最薄的一层。
1.内皮为衬贴于血管腔单层扁平上皮。内皮细胞长轴多与血液流动方向一致,细胞核居中,核所在部位略隆起,细胞基底面附着于基板上。电镜观察,可见内皮细胞腔面有稀疏而大小不一的胞质突起,表面覆以厚约30~60nm的细胞衣,相邻细胞间有紧密连接和缝隙连接及10~20nm的间隙。内皮细胞核淡染,以常染色质为主,核仁大而明显。在胞质内有发达的高尔基复合体、粗面内质网和滑面内质网。内皮细胞超微结构的主要特点是胞质中有丰富的吞饮小泡,或称质膜小泡(plasmalemmal vesicle),直径60~70nm(图8-2)。这些小泡是由细胞游离面或基底面的细胞膜内凹形成,然后与细胞膜脱离,经细胞质移向对面,又与细胞膜融合,将小泡内所含物质放出,故小泡有向血管内外输物质的作用,细胞质内还可见成束的微丝和一种外包单位膜的杆状细胞器,长约3μm直径0.1~0.3μm,内有6~26条直径约15nm左右的平行细管,称Weibel-Palade小体(W-P小体)W-P小体是内皮细胞特有的细胞器,一般认为它是合成和储存与凝血有关的第Ⅷ因子相关抗原(factor Ⅷ related antigen, FⅧ)的结构(图8-2)。
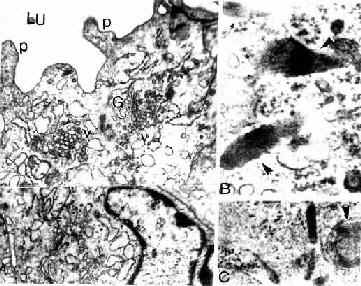
图8-2 人脐静脉内皮细胞电镜像图A示内皮细胞
LU血管腔 ,P胞质突起, G高尔基复合体,V质膜小泡
图B、C示W-P小体纵横切 面(▲)×170000~300000
(第一军医大学何红兵供图)
内皮细胞作为血管的内衬,形成光滑面,便于血液流动。内皮细胞和基板构成通透性屏障,液体、气体和大分子物质可选择性地透过此屏障。微丝收缩功能,5-羟色胺、组胺和缓激肽可刺激微丝收缩,改变细胞间隙的宽度和细胞连接的紧密程度,影响和调节血管的通透性。
血管内皮细胞具有复杂的酶系统,能合成与分泌多种生物活性物质,如除上述F Ⅷ外,还有组织纤维酶原活性物和前列环素、内皮素(有强烈缩血管作用,又称内皮细胞收缩因子),以及具有舒张血管作用的内皮细胞舒张因子。
内皮细胞表面有血管紧张素转换酶,能使血浆中的血管紧张素Ⅰ变为血管紧张素Ⅱ,使血管收缩。内皮细胞还能降解5-羟色胺、组织胺和去甲肾上腺素等。
2.内皮下层 内皮下层(subendothelial layer)是位于内皮和内弹性膜之间的薄层结缔组织,内含少量胶原纤维、弹性纤维,有时有少许纵平行滑肌,有的动脉的内皮下层深面还有一层内弹性膜(internal elastic membrane),由弹性蛋白组成,膜上有许多小孔。在血管横切面上,因血管壁收缩,内弹性膜常呈波浪状(图8-5)。一般以内弹性膜作为动脉内膜与中膜的分界。
(二)中膜
中膜(trnica media)位于内膜和外膜之间,其厚度及组成成分因血管种类而异。大动脉以弹性膜为主,间有少许平滑肌;中动脉主要由平滑肌组成。血管平滑肌纤维较内脏平滑肌纤维细,并常有分支。肌纤维间有中间连接和缝隙连接。许多学者认为,血管平滑肌是成纤维细胞的亚型,在中动脉发育中,平滑肌纤维可产生胶原纤维、弹性纤维和基质。在病理状况下,动脉中膜的平滑肌可移入内膜增生并产生结缔组织,使内膜增厚,是动脉硬化发生的重要病理过程。血管平滑肌可与内皮细胞形成肌内皮连接(myoendothelial junction),平滑肌可借助于这种连接,接受血液或内皮细胞的化学信息。近年研究表明,除已知的肾入球微动脉特化的平滑肌能产生肾素外,其它血管的平滑肌也具有分泌肾素和血管紧张素原的能力,与内皮细胞表面的血管紧张素转换酶共同构成肾外的血管肾素和血管紧张素系统。
中膜的弹性纤维具有使扩张的血管回缩作用,胶原纤维起维持张力作用,具有支持功能。管壁结缔组织中的无定形基质含蛋白多糖,其成分和含水量因血管种类而略有不同。
(三)外膜
外膜(tunica adventitia)由疏松结缔组织组成,其中含螺旋状或纵向分布的弹性纤维和胶原纤维。血管壁的结缔组织细胞以成纤维细胞为主,当血管受损伤时,成纤维细胞具有修复外膜的能力。有的动脉中膜和外膜的交界处,有密集的弹性纤维组成的外弹性膜(external elastic membrane)。
血管是连续的管道,由于各段血管的功能不同,其管壁的组成成分和分布形式也有所不同,有些血管还有一些附加结构,如静脉瓣。
(四)血管壁的营养血管和神经
管径1mm以上的动脉和静脉管壁中,都分布有血管壁的小血管,称营养血管(vasa vasorum)。这些小血管进入外膜后分支成毛细血管,分布到外膜和中膜。内膜一般无血管,其营养由腔内血液直接渗透供给。
特殊染色法可显示包绕在血管壁上的网状神经丛,在血管横切面上,可见神经纤维主要分布于中膜与外膜交界处(图8-3),有的神经伸入中膜平滑肌层。一般而言,动脉神经分布的密度较静脉丰富,以中小动脉最为丰富。血管的神经递质除去甲肾上腺素和乙酰胆碱外,还有多种神经肽,其中以神经肽Y(neuropeptide Y,NPY)、血管活性肠肽(vasoative intestinal peptide,VIP)和降钙素基因相关肽(calcitonin gene relatedpeptide,CGRP)最为丰富,它们有调节血管舒缩的作用。毛细血管是否存在神经分布尚有争议。
图8-3 小动脉的血管周神经丛
a 铺片,乙酰胆碱酯酶组织化学染色
b 血管横切,血管活性肠肽免疫组化染色
二、动脉
(一)大动脉
大动脉(large artery)包括主动脉、无名动脉、颈总动脉、锁骨下动脉、椎动脉和髂总动脉等。大动脉的管壁中有多层弹性膜和大量弹性纤维,平滑肌则较少,故又称弹性动脉(elastic artery)。大动脉管壁结构特点如下(图8-4)。

图8-4 大动脉三层结构(低倍)
1.内膜 有较厚的内皮下层,内皮下层之外为多层弹性膜组成的内弹性膜,由于内弹性膜与中膜的弹性膜相连,故内膜与中膜的分界不清楚。
2.中膜 成人大动脉有40~70层弹性膜,各层弹性膜由弹性纤维相连,弹性膜之间有环形平滑肌和少量胶原纤维和弹性纤维。中膜基质的主要成分为硫酸软骨素。
3.外膜 较薄,由结缔组织构成,没有明显的外弹性膜。外膜逐渐移行为周围的疏松结缔组织。
(二)中动脉
除大动脉外,其余凡在解剖学中有名称的动脉大多属中动脉(medium-sizde artery)。中动脉管壁的平滑肌相当丰富,故又名肌性动脉(muscular artery)。中动脉管壁结构特点如下(图8-5)。
图8-5 中动脉(左)和中静脉(右)
1.内膜 内皮下层较薄,内弹性膜明显。
2.中膜 中动脉的中膜较厚,由10~40层环形排列的平滑肌组成,肌间有一些弹性纤维和胶原纤维。
3.外膜 厚度与中膜相等,多数中动脉的中膜和外膜交界处有明显的外弹性膜。
(三)小动脉
管径1mm以下至0.3mm以上的动脉称为小动脉(small artery)。小动脉包括粗细不等的几级分支,也属肌性动脉。较大的小动脉,内膜有明显的内弹性膜,中膜有几层平滑肌,外膜厚度与中膜相近,一般没有外弹性膜(图8-6)
图8-6 小动脉、小静脉、毛细血管和小淋巴管
(四)微动脉
管径在0.3mm以下的动脉 ,称微动脉(arteriole)。内膜无内弹性膜,中膜由1~2层平滑肌组成,外膜较薄。
(五)动脉管壁结构与功能的关系
心脏规律地舒缩,将血液断续地射入动脉,心脏收缩时大动脉管径扩张,而心脏舒张时,大动脉管径回缩,故动脉血流是连续的。中动脉中膜平滑肌发达,平滑肌的收缩和舒张使血管管径缩小或扩大,要调节分配到身体各部和各器官的血流量。小动脉和微动脉的舒缩,能显著地调节器官和组织的血流量,正常血压的维持在相当大程度上取决于外周阻力,而外周阻力的变化主要在于小动脉和微动脉平滑肌收缩的程度。
(六)血管壁的特殊感受器
血管壁内有一些特殊的感受器,如颈动脉体、颈动脉窦和主动脉体。颈动脉体位于颈总动脉分支处管壁的外面,是直径约2~3mm的不甚明显的扁平小体,主要由排列不规则的许多上皮细胞团索组成,细胞团或索之间有丰富的血窦。电镜下上皮细胞分为两型(图8-7):Ⅰ型细胞聚集成群,胞质内含许多致密核芯小泡,许多神经纤维终止于Ⅰ型细胞的表面;Ⅱ型细胞位于Ⅰ型细胞周围,胞质中颗粒少或无。生理学研究表明,颈动脉体是感受动脉血氧、二氧化碳含量和血液PH值变化的化学感受器,可将该信息传入中枢,对心血管系统和呼吸系统进行调节。主动脉体在结构和功能上与颈动脉体相似。颈动脉窦是颈总动脉分支处的一个膨大部,该处中膜薄,外膜中有许多来源于舌咽神经的形态特殊的感觉神经末梢,能感受因血压上升致血管扩张的刺激,将冲动传入中枢,参与血压调节。
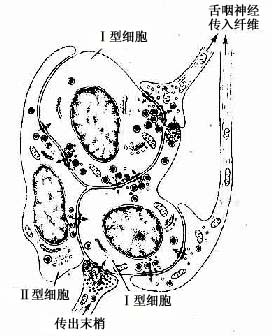
图8-7 大鼠颈动脉体超微结构模式图
(七)动脉的年龄变化
动脉管壁结构的发育到成年时才趋完善。可能由于心脏和动脉始终不停地进行着舒缩活动,似较其它器官易发生损伤和衰老变化,其中尤以主动脉、冠状动脉和基底动脉等的变化较明显。中年时,血管壁中结缔组织成份增多,平滑肌减少,使血管壁硬度渐大。老年时,血管管壁增厚,内膜出现钙化和脂类物质等的沉积,血管壁硬度增大。因此,只有在血壁结构的变化已超越该年龄组血管的变化标准时,方能认为是病理现象。
三、毛细血管
毛细血管(capillary)是管径最细,分布最广的血管。它们分支并互相吻合成网(图8-8)。各器官和组织内毛细血管网的疏密程度差别很大,代谢旺盛的组织和器官如骨骼肌、心肌、肺、肾和许多腺体,毛细血管网很密;代高血压较低的组织如骨、肌腱和韧带等,毛细血管网则较稀疏。

图8-8 人胃粘膜血管铸型扫描电镜像示毛细血管网
(一)毛细血管的结构
毛细血管管径一般为6~8μm,血窦较大,直径右达40μm。毛细血管管壁主要由一层内皮细胞和基膜组成。细的毛细血管横切面由一个内皮细胞围成,较粗的毛细血管由2~3个内皮细胞围成。内皮细胞基膜外有少许结缔组织。在内皮细胞与基膜之间散在有一种扁而有突起的细胞,细胞突起紧贴在内皮细胞基底面,称为周细胞(pericyte)(图8-9,8-10)。周细胞的功能尚不清楚,有人认为它们主要起机械性支持作用;也有人认为它们是未分化的细胞,在血管生长或再生时可分化为平滑肌纤维和成纤维细胞。
图8-9 毛细血管 扫描电镜像示周细胞
P 周细胞胞体 1、2周细胞突起
图8-10 毛细血管电镜像
左图 连续毛细血管,中图 有孔毛细血管,右图毛细血管扫描电镜像示内皮孔
E 内皮细胞,P周细胞,↑内皮细胞孔
(二)毛细血管的分类
光镜下观察,各种组织和器官中的毛细血管结构相似,但在电镜下,根据内皮细胞等的结构特点,可以将毛细血管分为三型。
1.连续毛细血管 连续毛细血管(continuous capillary)的特点为内皮细胞相互连续,细胞间有紧密连接等连接结构,基膜完整,细胞质中有许多吞饮小泡。连续毛细血管分布于结缔组织、肌组织、肺和中枢神经系统等处。肺和中枢神经系统内的毛细血管内皮细胞甚薄,含吞饮小泡较少(图8-10)。
2.有孔毛细血管 有孔毛细血管(fenestrated capillary)的特点是,内皮细胞不含核的部分很薄,有许多贯穿细胞的孔,孔的直径一般为60~80nm(图8-10)。许多器官的毛细血管的孔有隔膜封闭,隔膜厚4~6nm,较一般的细胞膜薄。内皮细胞基底面有连续的基板。此型血管主要存在于胃肠粘膜、某些内分泌腺和肾血管球等处。肾血管球的内皮细胞的孔没有隔膜。
3.血窦 血窦(sinusoid)或称窦状毛细血管(sinusoid capillary),管腔较大,形状不规则,主要分布于肝、脾、骨髓和一些内分泌腺中。血窦内皮细胞之间常有较大的间隙,故又称不连续毛细血管(discontinuous capillary)。不同器官内的血窦结构常有较大差别,某些内分泌腺的血窦,内皮细胞有孔,有连续的基板;有些器官如肝的血窦,内皮细胞有孔,细胞间隙较宽,基板不连续或不存在。脾血窦又不同于一般血窦,其内皮细胞呈杆状,细胞间的间隙也较大。
(三)毛细血管与物质交换
毛细管是血液与周围组织进行物质交换的主要部位。人体毛细血管的总面积很大,体重60kg的人,毛细血管的总面积可达6000m2。毛细血管管壁很薄,并与周围的细胞相距很近,这些特点是进行物质交换的有利条件。
物质透过毛细血管壁的能力称毛细血管通透性(capillary permeability)。毛细血管结构与通透性关系的研究表明,内皮细胞的孔能透过液体和大分子物质,吞饮小泡能输送液体,细胞间隙则因间隙宽度和细胞连接紧密程度的差别,其通透性有所不同。基板能透过较小的分子,但能阻挡一些大分子物质。另外一些物质,如O2、CO2和脂溶性物质等,可直接透过内皮细胞的胞膜和胞质。
四、静脉
静脉由小至大逐级汇合,管径渐增粗,管壁也渐增厚。中静脉及小静脉常与相应的动脉伴行。静脉的数量比动脉多,管径较粗,管腔较大,故容血量较大。与伴行的动脉相比,静脉管壁薄而柔软,弹性也小,故切片标本中的静脉管壁常呈塌陷状,管腔变扁或呈不规则形。
静脉也根据管径的大小分为大静脉、中静脉、小静脉和微静脉。但静脉管壁结构的变异比动脉大,甚至一条静脉的各段也常有较大的差别。静脉管大致也可分内膜、中膜和外膜三层,但三层膜常无明显的界限。静脉壁的平滑肌和弹性组织不及动脉丰富,结缔组织成分较多。
1.微静脉 微静脉(venule)管腔不规则,管径50~200μm,内皮外的平滑肌或有或无,外膜薄。紧接毛细血管的微静脉称毛细血管后微静脉(postcapillary venule),其管壁结构与毛细血管相似,但管径略粗、内皮细胞间的间隙较大,故通透性较大,也有物质交换功能。淋巴组织和淋巴器官内的后微静脉还具有特殊的结构和功能。
2.小静脉 小静脉(small vein)管径达200μm以上,内皮外渐有一层较完整的平滑肌。较大的小静脉的中膜有一至数层平滑肌。外膜也渐变厚(图8-6)。
3.中静脉 除大静脉以外,凡有解剖学名称的静脉都属中静脉(medium-sizde vein)。中静脉管径2~9mm,内膜薄,内弹性膜不发达或不明显。中膜比其相伴行的中动脉薄得多,环形平滑肌分布稀疏.外膜一般比中膜厚,没有外弹性膜,由结缔组织组成,有的中静脉外膜可有纵行平滑肌束(图8-5)。
4.大静脉 大静脉(large vein)管径在10mm以上,上腔静脉、下腔静脉、无名静脉和颈静脉等都属于此类。管壁内膜较薄,中膜很不发达,为几层排列疏松的环形平滑肌,有时甚至没有平滑肌。外膜则较厚,结缔组织内常有较多的纵行平滑肌束(图8-11)。
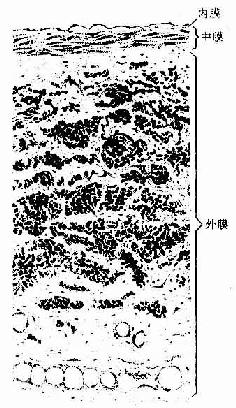
图8-11 大静脉
5.静脉瓣 管径2mm以上的静脉常有瓣膜。瓣膜为两个半月形薄片,彼此相对,根部与内膜相连,其游离缘朝向血流方向。瓣膜由内膜凸入管腔褶叠而成,中心为含弹性纤维的结缔组织,表面覆以内皮,其作用是防止血液逆流。
静脉的功能是将身体各部的血液导回心脏。静脉血回流的动力主要不是依靠管壁本身的收缩,而是靠管道内的压力差。影响静脉压力差的因素很多,如心脏的收缩力、重力和体位、呼吸运动以及静脉周围的肌组织收缩挤压作用等。
五、微循环的血管
微循环(microcirculation)是指由微动脉到微静脉之间的微细血管的血循环。它是血液循环的基本功能单位。人体各部和器官中微循环血管的组成各有特点,但一般都由下述几部分组成(图8-12)。
1.微动脉 由于微动脉管壁平滑肌的收缩活动,微动脉起控制微循环的总闸门作用。
2.毛细血管前微动脉和中间微动脉 微动脉的分支称毛细血管前微动脉(precapillary arteriole)。后者继而分支为中间微动脉(metaarteriole),其管壁平滑肌稀疏分散,已不是完整的一层。
3.真毛细血管中间微动脉分支形成相互吻合的毛细血管网,称真毛细血管(true capillary),即通称的毛细血管。真毛细血管行程迂回曲折,血流甚慢,是进行物质交换的主要部位。在真毛细血管的起点,有少许环形平滑肌组成的毛细血管前括约肌(precapillary sphincter),是调节微循环的的分闸门。
4.直捷通路 直捷通路(thoroughfare channel)是中间微动脉的延伸部分,结构与毛细血管相同,只是管径略粗。在组织处于静息状态时,微循环的血流大部由微动脉经中间微动脉和直捷通路快速入微静脉,只有小部分血液流经真毛细血管。当组织处于功能活跃时,毛细血管前括约肌开放,大部分血液流经真毛细血管网,血液与组织之间进行充分的物质交换。
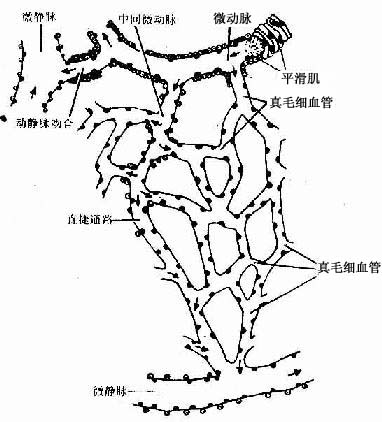
图8-12 微循环血管模式图
5.动静脉吻合 由微动脉发出的侧支直接与微静脉相通的血管。称动静脉吻合(arteriovenous anastomosis)。此段血管的管壁较厚,有发达的纵行平滑肌层和丰富的血管运动神经末梢,动静脉吻合收缩时,血液由微动脉流入毛细血管;动静脉吻合松弛时,微动脉血液经此直接流入微静脉。动静脉吻合主要分布在指、趾、唇和鼻等处的皮肤内及某些器官内,它也是调节局部组织血流量的重要结构。
6.微静脉 已如上述
六、心脏
心脏的壁很厚,主要由心肌构成。由于心脏的规律收缩,血液在血管中环流不息,合身体各部分和器官得到充分的血液供应。
(一)心脏的结构
心脏壁也由三层膜组成,从内向外依次为心内膜、心肌膜和心外膜。
1.心内膜心内膜(endocardium)表面是内皮,与血管的内皮相连。内皮下为内皮下层,其中除结缔组织外,也含有少许平滑肌。皮下层与心肌膜之间是心内膜下层(subendocardial layer),由较疏松的结缔组织组成,其中含血管和神经。心室的心内膜下层还有心脏传导系的分支(图8-13)。
2.心肌膜心肌膜(myocardium)主要由心肌构成,心房的心肌较薄,心室的心肌很厚,左心室的最厚。心肌纤维呈螺旋状排列,大致可分为内纵、中环和外斜三层。心肌纤维多集合成束,肌束间有较多的结缔组织和丰富的毛细血管(图8-13,8-14)。
图8-13 心内膜和心肌膜
图8-14 心肌膜和心外膜
心室和心房的肌纤维结构和功能基本相同,但也各有一些特点。心室的肌纤维较粗较长,直径10~15μm,长约100μm。心房的肌纤维较细较短,直径6~8μm,长20~30μm,横小管很少。电镜下可见有些心房肌纤维含电子密度较大的颗粒,有膜包裹,直径0.3~0.4μm,称心房特殊颗粒(specific atrial granule)。含心房特殊颗粒的肌纤维以右心房较多,左心房较少(图8-15),心室和心脏传导系统的肌纤维内也有少许心房特殊颗粒。这些颗粒中含肽类物质,称心房利钠尿多肽(atrial natriuretic polypeptide),简称心钠素,有很强的利尿、排钠、扩张血管和降血压作用。近年研究还证明,心肌还能分泌其它多种生物活性物质,如与心钠素作用相似的脑钠素、抗心律失常肽和内源性洋地黄素(又称内洋地黄素)。心肌细胞还具有合成肾素和血管紧张素的能力,对促进心肌细胞生长,增强心肌收缩力等有重要作用。
在心房肌和心室肌之间,有由致密结缔组织组成的支持性结构,构成心脏的支架,也是心肌和心瓣膜的附着处,称心骨骼(cardiac skeleton)。心骨骼包括室间隔膜部、纤维三角和纤维环。心房和心室的心肌分别附着于心骨骼,两部分的心肌并不相连。
3.心外膜心外膜(epicardium)是心包膜的脏层,其结构为浆膜(serous membrane),它的表层是间皮,间皮下面是薄层结缔组织,与心肌膜相连(图8-14)。心外膜中含血管和神经,并常有脂肪组织。心包膜壁层衬贴于心包内面,也是浆膜,与心外膜连续。壁层与脏层之间为心包腔,腔内有少量液体,使壁层与脏层湿润光滑,利于心脏搏动。
4.心瓣膜心瓣膜(cardiac value)是心内膜突向心腔而成的薄片状结构。瓣膜表面被覆以内皮,内部为致密结缔组织,与心骨骼的纤维环连接。其功能是阻止血液逆流。
(二)心脏的传导系统
心脏壁内有特殊心肌纤维组成的传导系统,其功能是发生冲动并传导到心脏各部,使心房肌和心室肌按一定的节律收缩。这个系统包括:窦房结、房室结、房室束、位于室间隔两侧的左右房室束分支以及分布到心室乳头肌和心室壁的许多细支(图8-16)。窦房结位于右心房心外膜深部,其余的部分均分布在心内膜下层,由结缔组织把它们和心肌膜隔开。级成这个系统的心肌纤维聚集成结和束,受交感、副交感和肽能神经纤维支配,并有丰富的毛细血管。根据近年的研究,组成心脏传导系统的心肌纤维类型有以下三型细胞。
1.起搏细胞起搏细胞(pacemaker cell)简称P细胞。这种细胞组成窦房结和房室结,细胞较小,呈梭形或多边形,包埋在一团较致密的结缔组织中。胞质内细胞器较少,有少量肌原纤维和吞饮小泡,但含糖原较多。生理学的研究证明,这些细胞是心肌兴奋的起搏点。
2.移行细胞移行细胞(transitional cell)主要存在于窦房结和房室结的周边及房室束,起传导冲动的作用。位于窦房结的移行细胞,有的与心房的心肌纤维相连,将冲动传到心房。但窦房结的冲动如何传到房室结,尚不清楚。移行细胞的结构介于起搏细胞和心肌纤维之间,细胞呈细长形,比心肌纤维细而短,胞质内含肌原纤维较P细胞略多。
3.蒲肯野纤维蒲肯野纤维(Purkinje fiber)或称束细胞。它们组成房室束及其分支。这种细胞比心肌纤维短而宽,细胞中央有1~2个核。胞质中有丰富的线粒体和糖原,肌原纤维较少,位于细胞周边。细胞彼此间有较发达的闰盘相连(图8-17)。生理学的研究证明,此种细胞能快速传导冲动。房室束分支末端的细胞与心室肌纤维相连。将冲动传到心室各处。

图8-15 猴房室结移行细胞电镜像 ×6000
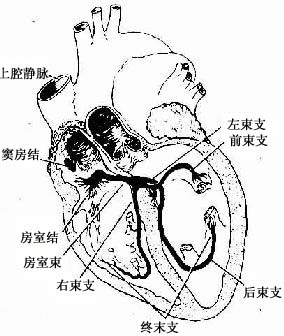
图8-16 心脏传导系统分布模式图
图8-17 人心脏蒲肯野纤维电镜像 ×6000
MF 肌原纤维,M线粒体
七、淋巴管系统
人体除中枢神经系统、软骨、骨髓、胸腺和牙等处没有淋巴管分布,其余的组织和器官大多有淋巴管。
1.毛细淋巴管毛细淋巴管(lymphatic capillary)以盲端起始于组织内,互相吻合成网,然后汇入淋巴管。毛细淋巴管的结构特点是管腔大而不规则,管壁薄,仅由内皮和极薄的结缔组织构成,无周细胞。电镜下,毛细淋巴管内皮细胞间有较间隙,无基膜,故通透性大,大分子物质易进入。
2.淋巴管淋巴管(lymphatic vessel)的结构与静脉相似,但管径大而壁薄,管壁由内皮、少量平滑肌和结缔组织构成,瓣膜较多。
3.淋巴导管淋巴导管(lymphatic duct)结构与大静脉相似,但管壁薄,三层膜分界不明显。
第九章 免疫系统
免疫系统(immune system)是机体保护自身的防御性结构,主要由淋巴器官(胸腺、淋巴结、脾、扁桃体)、其它器官内的淋巴组织和全身各处的淋巴细胞、抗原呈递细胞等组成;广义上也包括血液中其它白细胞及结缔组织中的浆细胞和肥大细胞。构成免疫系统的核心成分是淋巴细胞,它使免疫系统具备识别能力和记忆能力。淋巴细胞经血液和淋巴周游全身,从一处的淋巴器官或淋巴组织至另一处的淋巴器官或淋巴组织,使分散各处的淋巴器官和淋巴组织连成一个功能整体。免疫系统是生物在长期进化中与各种致病因子的不断斗争中逐渐形成的,在个体发育中也需抗原的刺激才能发育完善。免疫系统的功能主要有两方面:①识别和清除侵入机体的微生物、异体细胞或大分子物质(抗原);②监护机体内部的稳定性,清除表面抗原发生变化的细胞(肿瘤细胞和病毒感染的细胞等)。
免疫系统在识别机体自身和非自身的细胞或抗原中有两类细胞表面的结构特别重要:一类是T细胞和B细胞表面的特异性抗原受体;另一类是组织相容性抗原(histocompatibility antigen),编码此类抗原的基因群称主要组织相容性复合体(major histocompatibility complex),简称MHC,故此抗原又称MHC。MHC抗原在不同种动物之间以及同种动物不同个体之间均有所不同,故具有高度的特异性,但一卵性挛生儿及同一个体的所有细胞的MHC抗原则是相同的;因而异体移植的组织或器官均会引起机体的排斥反应。MHC抗原又分为两类:①MHC-Ⅰ类抗原,广泛分布于个体的所有细胞表面;②MHC-Ⅱ类抗原,仅分布于免疫系统的某些细胞表面,有利于细胞之间功能的相互协作,如识别抗原等。
一、淋巴细胞、抗原呈递细胞与免疫
(一)淋巴细胞
淋巴细胞是种类繁多、分工极细、并有不同分化阶段和菜单现的一个细胞群体。各种淋巴细胞的寿命长短不一,如效应性淋巴细胞仅1周左右,而记忆性淋巴细胞可长达数年,甚至终身。各种淋巴细胞的形态相似,不易区分,只有用免疫细胞化学等方法才能予以鉴别。
1.淋巴细胞的主要类群依据表面标志、形态结构和菜单现的不同,一般将淋巴细胞分为三类。
(1)胸腺依赖淋巴细胞(thymus dependent lymphocyte):简称T细胞,是淋巴细胞中数量最多功能复杂的一类。T细胞体积较小,胞质很少,一侧胞质内常有数个溶酶体(图9-1)。胞质呈非特异性酯酶染色阳性,细胞表面有特异性抗原受体。血液中的T细胞占淋巴细胞总数的60%~75%。T细胞一般可分为三个亚群:①辅助性T细胞(helper T cell,TH细胞),占T细胞的65%左右,它的重要标志是表面有CD4抗原(CD是淋巴细胞和其他白细胞表达的表面抗原分化群,即cluster of differentiation简称,1993年国际会议统一命名,现已有CD1~CD78)。TH细胞能识别抗原,分泌多种淋巴因子,它既能辅助B细胞产生体液免疫应答,又能辅助T细胞产生细胞免疫应答,是扩大免疫应答的主要成分,它还具有某些细胞免疫功能。艾滋病(AIDS)病毒可破坏TH细胞,导致患者的免疫系统瘫痪。②抑制性T细胞(suppressor Tcell,TS细胞),占T细胞的10%左右。表面有CD8抗原。TS细胞常在免疫应答的后期增多,它分泌的抑制因子可减弱或抑制免疫应答。③细胞毒性T细胞(cytotoxic T cell,Tc细胞),占T细胞的20%~30%,表面也有CD8抗原。TC细胞能识别结合在MHC-Ⅰ类抗原上的异抗原,在异抗原的刺激下可增殖形成大量效应性TC细胞,能特异性地杀伤靶细胞,是细胞免疫应答的主要成分。
(2)骨髓依赖淋巴细胞(bone marrow dependent lymphocyte):简称B细胞,常较T细胞略大,胞质内溶酶体少见,含少量粗面内质网(图9-1)。细胞表面的标志主要是有许多膜抗体(特异性抗原受体)。血液中B细胞占淋巴细胞总数的10%~15%。B细胞受抗原刺激后增殖分化形成大量浆细胞,分泌抗体,从而清除相应的抗原,此为体液免疫应答。
图9-1 T细胞、B细胞及大颗粒淋巴细胞
小细胞示光镜结构,大细胞示超微结构
(3)大颗粒淋巴细胞(large granular lymphocyte,LGL):LGL常较T、B细胞大,直径约11μm,胞质较丰富,含许多散在的深酶体(图9-1)。血液中LGL约占淋巴细胞的10%,在脾内和腹膜渗出液中较多,淋巴结和骨髓内较少,胸腺内无。LGL的来源未明,寿命约数周,细胞表面无特异性抗原受体,膜上的标志主要是GM1(单核巨噬细胞的标志)和CD8(TC细胞的标志),并常有Fc受体。LGL可分为两种:①杀伤细胞(killer细胞,K细胞),在靶细胞与抗体结合后,K细胞可借Fc受体与抗体的Fc端结合进而杀伤靶细胞。②自然杀伤细胞(nature killer cell,NK细胞),它不需抗体的存在,也不需抗原的刺激即能杀伤某些肿瘤细胞。由于K细胞和NK细胞的形态、分布与表面标志均近似,故它们可能是同一种细胞的不同功能表现。
2.T细胞和B细胞的早期分化T细胞和B细胞分别在胸腺和骨髓内进行早期分化,胎儿期即已开始,出生后继续进行。其特点是形成具有各种特异性抗原受体的淋巴细胞,总共约有105~106种。但每个淋巴细胞表面只有一种抗原受体,这是淋巴细胞能识别特异性抗原的物质基础。早期分化形成大量静息期的处女型T细胞和B细胞,并不断播散到周围淋巴器官和淋巴组织中。
3.免疫应答的三个阶段T细胞和B细胞在免疫应答(immune response)过程中需经过三个阶段,即感应了阶段、增殖分化阶段和效应阶段(图9-2)。
图9-2 免疫应答的三个阶段示意图
(1)感应阶段:即识别抗原的过程,常需数种细胞的协作才能完成。抗原要经过抗原呈递细胞的处理,如巨细胞内吞抗原(细菌等)形成内吞泡,后者与溶酶体融合使抗原初步分解但仍保留其抗原性,继而与MHC-Ⅱ类分子结合并表达于细胞表面,供淋巴细胞识别(图9-3)。同时,巨噬细胞分泌IL-1激活TH细胞,TH细胞分泌IL-2、IL-4、等再激活B细胞,TH细胞和B细胞即发生转化(transformation)。TC细胞识别抗原的机制与上述有所不同,它只能识别与MHC-Ⅰ类分子结合的抗原,并在TH细胞分泌的IL-2的刺激下发生转化。淋巴细胞转化是指由静息期的小淋巴细胞转变成代谢活跃并能进行增殖的大淋巴细胞的过程,此时细胞核增大,染色质变细,核仁明显,胞质增多,胞质内游离核糖体增多而嗜碱性增强,细胞增大至15~20μm,形似幼稚的母细胞,故又称母细胞化(blastoformation)或返幼(rejuvenation)(图9-4)。
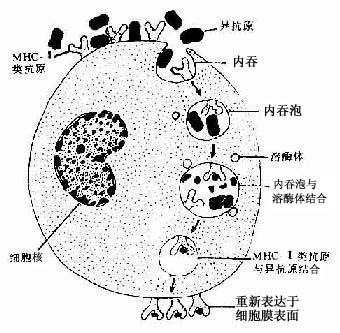
图9-3 抗原呈递细胞处理抗原过程示意图
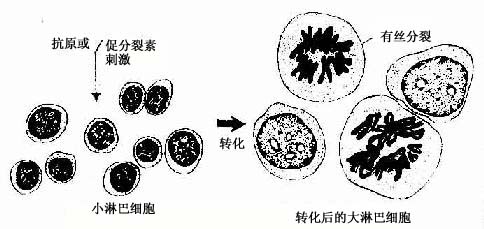
图9-4 淋巴细胞的转化
(2)增殖分化阶段:TH细胞在此阶段起重要的调节作用。它分泌IL-2可刺激自身(TH)和TC细胞发生一系列的分裂和分化;它分泌的IL-4等和干扰素则可刺激B细胞发生一系列的分裂和分化。细胞增殖中,其抗原受体的特异性不变,故称为单株增殖,结果产生两类细胞:①效应细胞(effector cell),是失去分裂能力的终末细胞(end cell),大量效应细胞可增强机体快速清除抗原的能力;②记忆细胞(memory cell),是经过一段分化后再次转入静息期的小淋巴细胞,寿命长,当再次遇到该抗原时能迅速转化增殖形成大量效应细胞,使机长期保持对该抗原的免疫力。预防接种疫苗可使机体产生大量记忆细胞。
(3)效应阶段:效应细胞经血流迁移至病灶附近清除抗原(病原体),在疾病转愈期效应细胞增多。B细胞的效应细胞是浆细胞,寿命约1周,能大量分泌抗体,抗体经血流循环全身,其半衰期为10~20天。抗体能中和抗原的毒性,促使靶细胞溶解,抗原与抗体结合后还易被吞噬细胞吞噬,Th效应细胞是分泌淋巴因子的主要细胞。如巨噬细胞游走抑制因子等聚集巨噬细胞和激活其吞噬和杀菌能力,淋巴毒素能杀伤靶细胞,γ-干扰素可抑制病毒复制及激活NK细胞杀靶细胞等。Tc效应细胞进入病灶与靶细胞抗原结合后,释放穿孔蛋白(perferin),它能嵌入靶细胞膜,在膜上形成中央有孔的聚合体,使细胞外液进入靶细胞而使其膨胀破裂,而Tc效应细胞不受损伤,还能再次杀伤靶细胞,但寿命仅数天。
(二)抗原呈递细胞
抗原呈递细胞(antigen presenting cell)是免疫应答起始阶段的重要辅佐细胞,有多种类型。其中巨噬细胞分布最广,是处理抗原的主要细胞。交错突细胞(interdigitating cell)分布于脾、淋巴结和淋巴组织中的T细胞区,是辅佐细胞免疫应答的主要成分。滤泡树突细胞(follicular dendritic cell)仅分布于淋巴小结的生发中心,能借抗体将大量抗原聚集于细胞突起表面,与选择B细胞高亲和性抗体细胞株的功能有关。郎格汉斯细胞(Langerhans cell)分布于表皮深层,可捕获和处理侵入表皮的抗原,并能离开表皮经淋巴进入淋巴结,转运抗原或转变为交错突细胞。微皱褶细胞(microfold cell)位于回肠集合淋巴小结顶端上皮及扁桃体隐窝上皮中,也有捕获和转递抗原的作用。
二、淋巴组织
含有大量淋巴细胞的组织称为淋巴组织( lymphopid tissue),一般将淋巴组织分为两种:
1.弥散淋巴组织弥散淋巴组织(diffuse lymphoid tissue)以网状细胞和网状纤维为支架,网眼中充满大量淋巴细胞及一些浆细胞、巨噬细胞和肥大细胞等(图9-5)。淋巴细胞无明显的境界,含有T细胞和B细胞,还常有高内皮的毛细血管后微静脉,它是淋巴细胞从血液进入淋巴组织的重要通道。淋巴组织内及其周围有许多毛细淋巴管,淋巴细胞可经此进入淋巴和血液循环,并经毛细血管后微静脉再入淋巴器官或淋巴组织.抗原刺激可使弥散淋巴组织扩大,并出现淋巴小结。
2.淋巴小结淋巴小结(lymphoid nodule)又称淋巴滤泡,是由B细胞密集而成的淋巴组织,边界清楚,呈椭圆形小体。小结中央染色浅,细胞分裂相多,称生发中心(germinal center)。无生发中心的淋巴小结较小,称初级淋巴小结;有生发中心的淋巴小结称次级淋巴小结。次级淋巴小结的形成必需Th细胞的参与,故新生去胸腺动物或艾滋病患者均不能形成次级淋巴小结。在抗原刺激下,淋巴小结增大增多,是体液免疫应答的重要标志,抗原被清除后淋巴小结又渐消失。
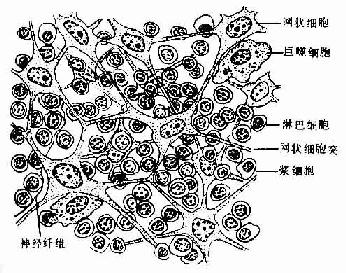
图9-5 淋巴组织模式图
三、淋巴器官
淋巴器官是以淋巴组织为主构成的器官,依据结构和功能的不同分为两类。①中枢淋巴器官(central lymphoid organ):包括胸腺和骨髓,它们是淋巴细胞早期分化的场所。淋巴干细胞在中枢淋巴器官内分裂分化,成为具有特异性抗原受体的细胞。中枢淋巴器官发生较早,出生前已发育完善,能连续不断地向周围淋巴器官及淋巴组织输送处女型淋巴细胞。中枢淋巴器官不受抗原刺激的直接影响。②周围淋巴器官(peripheral lymphoid organ):如淋巴结、脾和扁桃体,它们在机体出生后数月才逐渐发育完善,中枢淋巴器官不断地将淋巴细胞输入周围淋巴器官。周围淋巴器官是进行免疫应答的主要场所,无抗原刺激时其体积相对较小,受抗原刺激后则迅速增大,结构也发生变化,抗原被清除后以又渐恢复原状。
(一)胸腺
1.胸腺的结构胸腺在胚胎早期由鳃沟外胚层和咽囊内胚层的上皮发生而成,故其早期原基是含有外胚层和内胚层的上皮组织;在淋巴干细胞迁入后,渐变为一种特殊的淋巴组织。小儿胸腺为薄片状粉红色软组织,分左右两叶,表面有薄层结缔组织被膜(capsule)。被膜结缔组织成片状伸入胸腺实质形成小叶间隔(interlobualr septum),将胸腺分成许多不完整的小叶。每个小叶分为皮质和髓质两部分。皮质内胸腺细胞密集,故着色较深;髓质含较多的上皮细胞,故着色较浅。小叶髓质常在胸腺深部相互连接(图9-6)。
图9-6 小儿胸腺
(1)皮质(cortex):皮质以上皮细胞为支架,间隙内含有大量胸腺细胞和少量巨噬细胞等(图9-7,9-8)。
图9-7 胸腺内细胞分布模式图
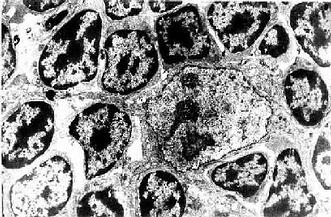
图9-8 大鼠胸腺皮质电镜像 ×7800
(白求恩医科大学尹昕、朱秀雄教授供图)
胸腺上皮细胞:皮质的上皮细胞有被膜下上皮细胞(subcapsular epithelial cell)和星形上皮细胞(stellate epithelial cell)两种。被膜下上皮细胞与结缔组织相邻的一侧呈完整的扁平上皮状,有基膜,相邻细胞间有许多桥粒连接,细胞的另一侧则有一些突起。有的细胞的胞质较丰富,胞质内含有一些内吞的胸腺细胞(图9-7),类似胸腺分离细胞中所见的哺育细胞(nurse cell)。哺育细胞为一大的圆形或椭圆形细胞,胞质内含有数个乃至数十个胸腺细胞,有的还进行有丝分裂,它们是Th细胞的前身。被膜下上皮细胞能分泌胸腺素和胸腺生成素。星形上皮细胞即通常所称的上皮性网状细胞(epithelial reticular cell),细胞多分支状突起,突起间以桥粒相互连接成网,细胞表面标志不同于被膜下上皮细胞,但与胸腺小体上皮细胞的相同。表面具有大量的MHC抗原。此种细胞不分泌激素,其质膜紧贴胸腺细胞,有诱导胸腺细胞发育分化的作用。
胸腺细胞(thymocyte):即T细胞的前身,它们密集于皮质内,占胸腺皮质细胞总数的85%~90%。淋巴干细胞迁入胸腺后,先发育为体积较大的早期胸腺细胞(约占3%)。它们经增殖后成为较小的普通胸腺细胞,其特点为开始出现T细胞抗原受体(TCR),且渐表达CD4和CD8抗原,此种细胞约占胸腺细胞总数的75%,它们对抗原尚无应答能力。普通胸腺细胞正处于被选择期,凡能与机体自身抗原相结合或与自身MHC抗原不相容的胸腺细胞(约占95%)将被灭活或淘汰,少数选定的细胞则继续分化,从而建立符合机制需要的淋巴细胞TCR库。进一步成熟的普通胸腺细胞,其CD4和CD8之中有一种增强,另一种减弱或消失,结果CD4+的细胞约占2/3,CD8+的细胞占1/3。
(2)髓质(medulla):髓质内含大量胸腺上皮细胞和一些成熟胸腺细胞、交错突细胞和巨噬细胞。上皮细胞有两种(图9-7):①髓质上皮细胞(medullary epithelial cell),呈球形或多边形,胞体较大,细胞间以桥粒相连,间隙内有少量胸腺细胞。髓质上皮细胞是分泌胸腺激素的主要细胞。②胸腺小体上皮细胞(thymic corpuscle epithelial cell),它构成胸腺小体(thymic corpuscle),胸腺小体直径30~150μm,散在分布于髓质内,由上皮细胞呈同心圆状包绕排列而成,是胸腺结构的重要特征。小体外周的上皮细胞较幼稚,细胞核明显,细胞可分裂;近小体中心的上皮细胞较成熟,胞质中含有较多的角蛋白,核渐退化;小体中心的上皮细胞则已完全角质化,细胞呈嗜酸性染色,有的已破碎呈均质透明状,中心还常见巨噬细胞或噬酸性粒细胞。胸腺小体上皮细胞不分泌激素,功能未明,但缺乏胸腺小体的胸腺不能培育出T细胞。髓质内的胸腺细胞数量虽少,但均已成熟,并具有免疫应答的能力。髓质内还有少数散在分布的交错突细胞和巨噬细胞,Th细胞常群集于交错突细胞附近。巨噬细胞也参与胸腺内微环境的形成,其分泌物能促进胸腺细胞的分化。
(3)胸腺的血液供应及血胸腺屏障:几条小动脉从胸腺四周穿越被膜进入小叶间隔,在皮质与髓质交界处形成微动脉,并发出许多毛细血管分布于皮质。这些毛细血管又汇入皮髓质交界处的毛细血管后微静脉,其中有部分微静脉是高内皮的,它是胸腺内淋巴细胞进出血流的主要通道。髓质的毛细血管常为有孔型,汇入微静脉后经小叶间隔及被膜出胸腺。据统计,大鼠胸腺静脉血液中的淋巴细胞数量约为动脉血的1.5倍。
实验表明血液内的大分子物质不易进入胸腺皮质内,说明皮质的毛细血管及其周围结构具有屏障作用,称为血-胸腺屏障(blood-thymus barrier)(图9-9)。血-胸腺屏障由下列数层构成:①连续性毛细血管,其内皮细胞间有完整的紧密连接;②内皮基膜;③血管周隙,其中含有巨噬细胞;④上皮基膜;⑤一层连续的上皮细胞。
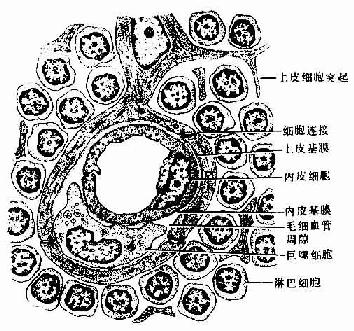
图9-9 血-胸腺屏障结构模式图
近来发现胸腺被膜内的毛细血管是有孔的,血内含有的各种自身抗原分子易经此渗出,进入靠近被膜的胸腺皮质内。这些微量的自身抗原与未成熟的普通胸腺细胞的相应抗原受体结合后,可导致该细胞的灭活或淘汰,从而使胸腺产生的某些T细胞对自身抗原具有免疫耐受性或无应答性。此外;髓质血管的血管周隙较大,其中有多种细胞成分,如T细胞、B细胞、浆细胞、肥大细胞、嗜酸性粒细胞、成纤维细胞和脂肪细胞等;大的血管周隙内还可含有毛细淋巴管,内含较多的淋巴细胞,可能是胸腺输出淋巴细胞的另一条通路。
2.胸腺的功能胸腺是培育和选择T细胞的重要器官。胸腺上皮细胞分泌的胸腺素(thymosin)和胸腺生成素(thymopoietin)均能促进胸腺细胞的分化,巨噬细胞和交错突细胞也参与胸腺内微环境的形成。胸腺培育出的各种处女型T细胞,经血流输送至周围淋巴器官和淋巴组织。
胸腺有明显的年龄性变化。幼儿期的胸腺较大,重约27g,此后缓慢地退化,皮质渐变薄,胸腺细胞数量渐少,皮质和髓质的境界渐不明显,胸腺小体增大,脂肪细胞渐增多。85岁以后的胸腺,皮质已很少。此外,胸腺还是一个易受损害的器官,急性疾病、肿瘤、大剂量照射或大剂量固醇类药物等均可导致胸腺的急剧退化,胸腺细胞大量死亡与空竭;但病愈或消除有害因子后,胸腺的结构可渐恢复。若切除新生小鼠的胸腺,该动物即缺乏T细胞,不能排斥异体移植物;周围淋巴器官及淋巴组织中无次级淋巴小结出现,机体产生抗体的能力也明显下降。若在动物出生后数周再切除胸腺,此时因已有大量处女型T细胞迁至周围淋巴器官和淋巴组织内,已能行使一定的免疫功能,故短期内看不出影响,但机体的免疫力仍会逐渐下降。若给切除胸腺的新生动物移植一片胸腺,则能明显改善该去胸腺动物的免疫缺陷状态。
胸腺内有丰富的神经末梢,它们终止于胸腺细胞之间或上皮细胞及巨噬细胞附近。胸腺细胞表面有多种神经递质的受体,表明神经对胸腺细胞的发育分化有调节作用。
(二)骨髓
红骨髓是造血器官,又是哺乳动物和人培育B细胞的中枢淋巴器官。骨髓的髓细胞中约有10%属于淋巴细胞系,主要为B细胞系的细胞,细胞散在分布,不形成B细胞岛。淋巴干细胞在骨髓的微环境中先形成大的前B细胞(pre-b cell),约经过4~8次分裂成为中等大小的前B细胞,胞质内已开始合成膜抗体分子。细胞再继续分裂变小,成为幼B细胞(immature B cell),细胞膜上已出现膜抗体SIgM。继而再进一步分化成处女型B细胞(virgin B cell),膜上有SIgM和SIgD分子。处女型B细胞经血循环迁至周围淋巴器官骨髓培育B细胞直至终身。骨髓产生的B细胞比胸腺产生的T细胞数量虽较少,但较为恒定,也不因年龄的增长而减少。
(三)淋巴结
淋巴结是哺乳类特有的淋巴器官。人体的淋巴结共约450个,呈豆形,位于淋巴回流的通路上,常成群分布于肺门、腹股沟及腋下等处,是滤过淋巴和产生免疫应答的重要器官。
1.淋巴结的结构淋巴结表面有薄层被膜,数条输入淋巴管(afferent lymphatic vessel)穿过被膜通入被膜下淋巴窦。被膜结缔组织伸入实质形成小梁(trabecula)。淋巴结的一侧凹陷称为门部(hilus)此处有较疏松的结缔组织伸入淋巴结内,血管、神经和输出淋巴管(efferent lymphatic vessel)由此进出淋巴结(图9-10)。从门部分支形成的小梁与从被膜伸入的小梁相互连接,构成淋巴结的粗支架,在此粗的网状支架之间充填着网状组织,构成淋巴结的微细支架。淋巴结分为皮质和髓质两部分(图9―10)。
图9-10 淋巴结
(1)皮质:位于被膜下方,由浅层皮质、副皮质区及皮质淋巴窦构成(图9-11)。
图9-11 淋巴结皮质
浅层皮质(superfacial cortex):为皮质的B细胞区,由薄层的弥散淋巴组织及淋巴小结组成。淋巴小结即在此薄层淋巴组织中发育而成,增大后嵌入深部的副皮质区。当淋巴小结密集时,仅在淋巴小结之间近被膜下淋巴窦处仍有薄层的弥散淋巴组织,也为B细胞区。发育良好的次级淋巴小结的正中切面,可见相当大的生发中心,它可分为暗区和明区两部分(图9-11)。生发中心的顶部及周围有一层密集的小淋巴细胞,以顶部最厚,称为小结帽(cap)(图9-11)。淋巴小结内95%的细胞为B细胞,其余为巨噬细胞、滤泡树突细胞和Th细胞等。生发中心的暗区较小位于生发中心的基部,主要由许多转化的大B细胞组成,细胞的胞质较丰富,嗜碱性强而着色较深。它们经过数次分裂和膜抗体结构突变过程,形成许多中等大小的B细胞。这些B细胞受滤泡树突细胞表面聚集的抗原的选择作用,只有其膜抗体与表面抗原有高度亲和性的细胞能保留继续分裂和分化,其余的则均被淘汰,由明区内的易染体巨噬细胞(tingible-body macrophage)吞噬清除(图9-12)。继续分裂分化的B细胞在明区近帽处形成两类小淋巴细胞:①浆细胞前身,它们随即迁移到髓质,或在其它淋巴器官、淋巴组织或慢性炎症灶处,转变为浆细胞;②B记忆细胞,它们也可迁出淋巴结,并参与淋巴细胞再循环。帽部主要为处女型B细胞,其功能意义未明。
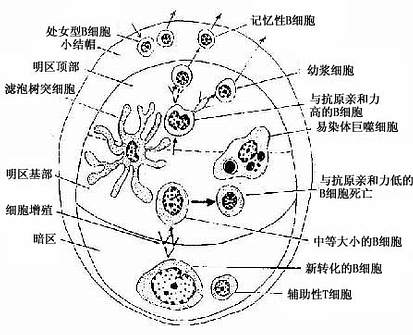
图9-12 淋巴小结的细胞组成及相互关系示意图
副皮质区(paracortex zone):位于皮质的深层,为较大片的弥散淋巴组织,又称深层皮质单位(deep cortex unite),主要由T细胞聚集而成(图9-13)。每个单位与一条输入淋巴管相对应,位于约10数个淋巴小结的深部。整个单位呈半球形,其球面朝向髓质,较平的一面朝向多个淋巴小结。深层皮质单位可分为中央区和周围区。中央区含大量T细胞和一些交错突细胞等,细胞较密集,为胸腺信赖区,新生动物切除胸腺后,此区即呈空竭状。细胞免疫应答时,此区细胞的分裂相增多,并迅速扩大。周围区为包围中央区的一层较稀疏的弥散淋巴组织,含T细胞及B细胞,还有许多高内皮的毛细血管后微静脉,它是血液内淋巴细胞进入淋巴组织的重要通道(图9-14)。血液流经此段时,约有10%的淋巴细胞穿越内皮细胞进入深层皮质单位周围区,再迁移到其它部位。在周围区与髓质邻接处,含有一些小盲淋巴窦(small blind sinus),它们是髓窦的起始部,也是副皮质区淋巴窦的重要通道。
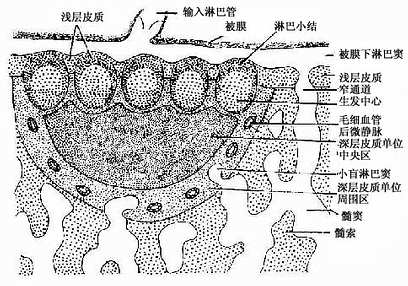
图9-13 淋巴结浅层皮质及深层皮质单位示意图
皮质淋巴窦(cortical sinus):包括被膜下淋巴窦和一些末端常盲端的小梁周窦。被膜下淋巴窦(subcapsular sinus)是包围整个淋巴结实质的大扁囊,其被膜侧有数条输入淋巴管通入。被膜下淋巴窦通过深层皮质单位之间的窄通道与髓窦相通(图9-13)。窦壁有薄的内皮衬里,内皮外有薄层基质、少量网状纤维及一层扁平的网状细胞。淋巴窦内还常有一些呈星状的内皮细胞支撑窦腔,有许多巨噬细胞附着于内皮细胞表面(图9-15)。淋巴在窦内缓慢流动,有利于噬细胞清除异物。若大量抗进入淋巴窦,巨噬细胞即大量增多,淋巴流动更慢。
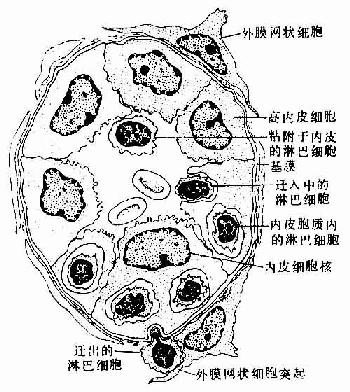
图9-14 淋巴结副皮质区的毛细血管后微静脉模式图
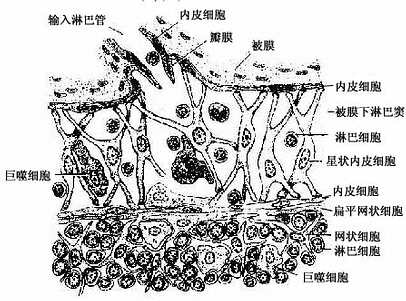
图9-15 被膜下淋巴窦结构模式图
(2)髓质:由髓索及其间的髓窦组成。髓索(medullary cord)是相互连接的索状淋巴组织,索内含B细胞及一些T细胞、浆细胞、肥大细胞及巨噬细胞。髓索中央常有一条扁平内皮的毛细血管后微静脉,是血内淋巴细胞进入髓索的通道。当淋巴回流区有慢性炎症时,淋巴结髓索内的浆细胞明显增多。髓窦(medullary sinus)与皮质淋巴窦的结构相同,但较宽大,腔内的巨噬细胞较多,故有较强的滤作用(图9-16)。
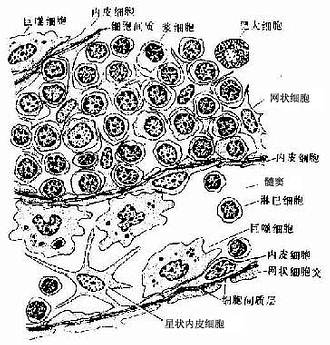
图9-16 淋巴结髓索及髓窦结构模式图
(3)淋巴结内的淋巴通路:淋巴从输入淋巴管进入被膜下淋巴窦,部分淋巴渗入皮质淋巴组织,部分经深层皮质单位之间的窄通道直接流入髓窦,继而汇入输出淋巴管。淋巴流经一个淋巴结一般约需数小时,含抗原愈多则流速愈慢。淋巴经滤过后,其中的细菌等异物即被清除,而输出的淋巴中则含有较多的淋巴细胞和抗体。
2.淋巴细胞再循环周围淋巴器官和淋巴组织内的淋巴细胞可经淋巴管进入血流循环于全身,它们又可通过毛细血管后微静脉再回入淋巴器官或淋巴组织内(图9-17),如此周而复始,使淋巴细胞从一个淋巴器官到另一个淋巴器官,从一处淋巴组织至另一处淋巴组织。这种现象称为淋巴细胞再循环(recirculation of lymphocyte)。除效应性T细胞、幼浆细胞、K细胞和NK细胞以外,大部分淋巴细胞均参与再循环,尤以记忆性T细胞和记忆性B细胞最为活跃。淋巴细胞再循环有利于识别抗原,促进细胞间的协作,使一些具有相关特异性抗原的细胞共同进行免疫应答,并使分散于全身的淋巴细胞成为一个相互关连的有机动性的统一体。参与再循环的淋巴细胞大量位于淋巴器官或淋巴组织内,其总数约为血液中淋巴细胞总数的数十倍,总称为淋巴细胞再循环库。淋巴细胞通过淋巴结再循环一次需18~20小时,通过脾再循环较快,约需2~8小时。一般T细胞的再循环较B细胞快。
图9-17 淋巴细胞再循环示意图
3、淋巴结的功能
(1)过淋巴液:病原体侵入皮下或粘膜后,很容易进入毛细淋巴管回流入淋巴结。当淋巴缓慢地流经淋巴窦时,巨噬细胞可清除其中的异物,如对细菌的清除率可达99%,但对病毒及癌细胞的清除率常很低。清除率常与抗原的性质、毒力、数量以及机体的免疫状态等密切相关。
(2)进行免疫应答:抗原进入淋巴结后,巨噬细胞和交错突细胞可捕获与处理抗原,使相应特异性受体的淋巴细胞发生转化。识别抗原与细胞间协作的部位在浅层皮质与深层皮质交界处。引起体液免疫应答时,淋巴小结增多增大,髓索内浆细胞增多。引起细胞免疫应答时,副皮质区明显扩大,效应性T细胞输出增多。淋巴结内的T细胞约占淋巴细胞总数的75%,B细胞占25%,大颗粒淋巴细胞极少或无,淋巴结内细胞免疫应答和体液免疫应答常同时发生,以那一种为主视抗原性质而定。淋巴结实质内有许多神经末梢,但淋巴小结内尚未发现。淋巴细胞表面有多种神经递质受体,说明神经系统对淋巴结内的免疫应答有一定的调作用。
(四)脾
脾为人体最大的周围淋巴器官,位于血液循环的通路上,有滤过血液和对侵入血内的抗原起免疫应答等功能。
1.脾的结构脾内也含有大量淋巴组织,但其淋巴组织的分布规律与淋巴结不同。脾无皮质髓质之分,而分为白髓、边缘区和红髓三部分;脾内无淋巴窦,但有大量的血窦(图9-18)
图9-18 脾
(1)被膜与小梁:脾的被膜较厚,表面覆有间皮,被膜结缔组织伸入脾内形成许多分支的小梁,它们与门部分支形成的小梁相互连接构成一粗的支架。被膜和小梁内含有许多散在的平滑肌细胞,其收缩可调节脾内的血量,小梁之间的网状组织构成脾淋巴组织的微细支架。
(2)白髓(white pulp):主要由淋巴细胞密集的淋巴组织构成,在新鲜脾的切面上呈分散的灰白色小点状,故称白髓。它又要分为动脉周围淋巴鞘和淋巴小结两部分。
动脉周围淋巴鞘(periarterial lymphatic sheath):是围绕在中央动脉(central antery)周围的厚弥散淋巴组织(图9-18,9-19),由大量T细胞和少量巨噬细胞与交错突细胞等构成。此区相当于淋巴结内的副皮质区,是胸腺依赖区,但无高内皮毛细管后微静脉。中央动脉旁有一条伴行的小淋巴管,它是鞘内T细胞经淋巴迁出脾的重要通道(图9-19)。当发生细胞免疫应答时,动脉周围淋巴鞘内的T细胞分裂增殖,鞘也增厚。
图9-19 脾血液通路模式图
淋巴小结:又称脾小体(splenic corpuscle),结构与淋巴结的淋巴小结相同,主要由大量B细胞构成,发育较大的淋巴小结也呈现生发中心的明区与暗区,帽部朝向红髓(图9-19)。健康人脾内淋巴小结很少。当抗原侵入脾内引起体液免疫应答时,淋巴小结大量增多,它出现于边缘区和动脉周围淋巴鞘之间,使中央动脉常偏向鞘的一侧。
(3)边缘区(marginal zone):位于白髓和红髓交界处,宽约100μm。该区的淋巴细胞较白髓稀疏,但较脾索密集,并混有少量红细胞。此区含有T细胞及B细胞,并含有较多的巨噬细胞。从肌髓或胸腺迁入脾的处女型淋巴细胞常先聚集于此区继续成熟。中央脉侧支分支而成的一些毛细血管,其末端在白髓和边缘区之间膨大形成的小血窦,称为边缘窦(marginal sinus),它是血液以及淋巴细胞进入淋巴组织的重要通道,淋巴细胞也可经此区再迁入动脉周围淋巴鞘、淋巴小结或脾索内。边缘区也是脾内捕获抗原、识别抗原和诱发免疫应答的重要部位,它相当于淋巴结浅层皮质与副皮质的交界处。
(4)红髓(red pulp):约占脾衬质的2/3,分布于被膜下、小梁周围及边缘区外侧,因含有大量血细胞,在新鲜脾切面上呈现红色。红髓由脾索及血窦组成(图9-20)。
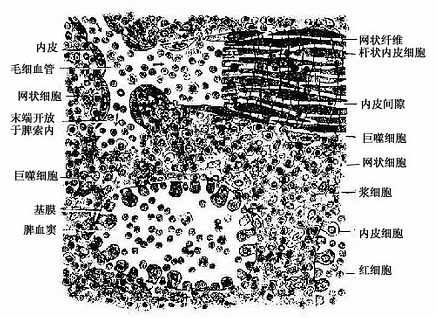
图9-20 脾索与脾血窦模式图
脾索(splenic cord):由富含血细胞的索状淋巴组织构成,脾索在血窦之间相互连接成网,索内含有T细胞、B细胞和浆细胞,以及许多其他血细胞和巨噬细胞,是脾进行滤血的主要场所。脾索内各类细胞的分布并不均匀一致。当中央动脉末端分支进入脾索成为髓微动脉时,其周围有薄层密集的淋巴细胞,在鞘毛细血管周围则有密集的巨噬细胞,至毛细血管末端开放于脾索时含血细胞和巨噬细胞较多,而不含血管的脾索部分则散在的淋巴细胞和浆细胞相对较多。
脾血窦(splenic sinus):是一种静脉性血窦,宽约12~40μm,形态不规则,相互连接成网。窦壁由一层长杆状的内皮细胞平行排列而构成。内皮细胞之间常见许多0.2~0.5μm宽的间隙,脾索内的血细胞可经此穿越进入血窦(图9-21,9-22)。内皮外有不完整的基膜及环行网状纤维围绕,故血窦壁如同一种多孔隙的栏栅状结构。在血窦的横切面上,可见杆状内皮细胞沿血窦壁呈点状排列,较粗大的内皮细胞断面中可见有细胞核,并突入管腔(图9-19)。血窦外侧有较多的巨噬细胞,其突起可通过内皮间隙伸向窦腔。
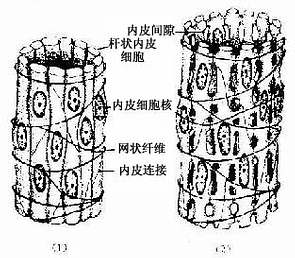
图9-21 脾血窦结构示意图
(1)收缩状态 (2)扩张状态
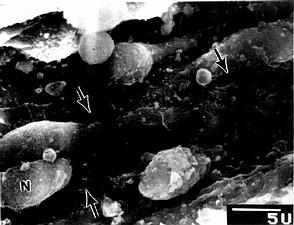
图9-22 大鼠脾血窦扫描电镜像
N内皮细胞核,↑内皮质间隙
2.脾的血液通路脾动脉从脾门入脾后分支进入小梁,称为小梁动脉(trabecular artery)。小梁动脉分支离开小梁进入动脉周围淋巴鞘内,称为中央动脉。中央动脉沿途发出一些小分支形成毛细血管供应白髓,其末端膨大形成边缘窦。中央动脉主干在穿出白髓进入脾索时分支形成一些直行的微动脉,形似笔毛,故称笔毛微动脉(penicillar arteriole)。笔毛微动脉在脾索内可分为三段(图9-19):①髓微动脉(pulp arteriole),内皮外有1~2层平滑肌;②鞘毛细毛管(sheathed capillary),内皮外有一厚的巨噬细胞鞘,但在人不发达;③动脉毛细血管,毛细血管末端的大部扩大成嗽叭状开放于脾索,少数则直接连通于血窦。血窦汇入由扁平内皮细胞构成的髓微静脉(pulp venule),髓微静脉汇入小梁内的小梁静脉(trabecular vein),最后在门部汇成脾静脉出脾。中央动脉旁的淋巴管沿动脉进入小梁,继而在门部汇集成较大的淋巴管出脾,淋巴内含有许多T细胞。脾内大部分血液流经脾的速度较快,约30秒,少量血液的流速较慢,需数分钟至1小时,依据脾功能状态的不同而有变化。
3.脾的神经分布近十数年对免疫系统各器官内的神经分布有突破性进展,发现淋巴组织内有许多神经末梢,淋巴细胞和巨噬细胞表面有多种神经递质受体,从而改变了过去认为神经不直接调节游离细胞的概念。脾神经入脾门后,其分支除分布于血管及小梁平滑肌以外,还有许多神经末梢进入脾实质分布于动脉周围淋巴鞘和边缘区,红髓的脾索内较少见,淋巴小结内则无。电镜下见到,有的神经末鞘与淋巴细胞之间的间隙仅6nm宽,未见突触形成。说明神经对免疫系统的功能活动有直接的调节作用。
4.脾的功能
(1)滤血:脾内滤血的主要部位是脾索和边缘区,此处含大量巨噬细胞,可吞噬清除血液中的病原体和衰老的血细胞。当脾肿大或机能亢进时,红细胞破坏过多,可引起贫血。脾切除后,血内的异形衰老红细胞大量增多。
(2)免疫:侵入血内的病原体,如细菌、疟原虫和血吸虫等,可引起脾内发生免疫应答,脾的体积和内部结构也发生变化。体液免疫应答时,淋巴小结增多增大,脾索内浆细胞增多;细胞免疫应答时则脉周围淋巴鞘显著增厚。脾内的淋巴细胞中T细胞占40%,B细胞占55%,还有一些K细胞和NK细胞等。
(3)造血:胚胎早期的脾有造血功能,但自骨髓开始造血后,脾渐变为一种淋巴器官,在抗原刺激下能产生大量淋巴细胞和浆细胞。但脾内仍含有少量造血干细胞,当机体严重缺血或某些病理状态下,脾可以恢复造血功能。
(4)储血:人脾的储血能力较小,约可储血40ml ,主要储于血窦内。脾肿大时其储血量也增大,当机体需血时,脾内平滑肌的收缩可将所储的血排入血循环,脾随即缩小。
(五)扁桃体
扁桃体位于消化道和呼吸道的交会处,此处的粘膜内含有大量淋巴组织,是经常接触抗原引起局部免疫应答的部位。
1.腭扁桃体呈卵圆形,粘膜一侧表面覆有复层扁平上皮,上皮向固有层内陷入形成10~30个分支的的隐窝(crypt)。隐窝周围的固有层内有大量弥散淋巴组织及淋巴小结(图9-23)。隐窝深部的复层扁平上皮内含有许多T细胞、B细胞、浆细胞和少量巨噬细胞与郎格汉斯细胞,称为上皮浸润部(图9-24)。上皮内还有一些毛细血管后微静脉,是淋巴细胞进出上皮的主要通道。上皮细胞之间还有许多隧道样细胞间通道,浅表的部分通道直接开口于表面,有的通道开口处覆有一个扁平的微皱褶细胞(microfold cell,M cell)。上皮间隙内以T细胞多,这些经常迁移和更换。上皮内的浆细胞常分布在有孔毛细血管附近,有利于分泌的抗体进入血流。
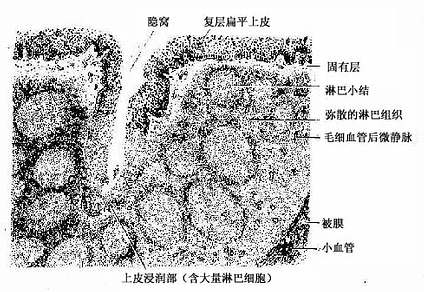
图9-23 腭扁桃体
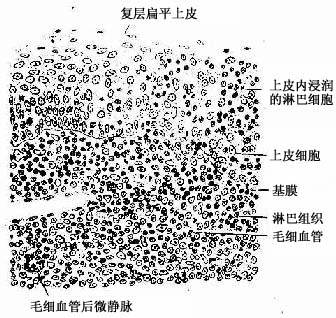
图9-24 腭扁桃体上皮浸润部
小儿的腭扁桃体较发达,其固有层内含有大量弥散淋巴组织及淋巴小结,它们的数量及发育程度与抗原刺激密切相关。扁桃体淋巴组织中的B细胞占淋巴细胞总数的60%,T细胞占385%,还有少量K细胞和NK细胞。弥散淋巴组织中则T细胞较多,也有散在的浆细胞、B细胞和一些毛细血管后微静脉。淋巴小结常较多而大,表明扁桃体与机体的体液免疫功能的关系较密切。固有层内还有一些小淋巴管,淋巴细胞可经此进入淋巴。
2.咽扁桃体咽扁桃体又称腺样体,位于咽的后壁,表面被覆假复层纤毛柱状上皮,无隐窝。粘膜形成一些纵行皱襞,固有层内有许多淋巴组织,上皮内也常见淋巴细胞浸润,浸润部上皮常变为复层扁平上皮。
3.舌扁桃体位于舌根和咽前壁,表面被覆复层扁平上皮,一些较浅的隐窝。上皮内有淋巴细胞浸润部,固有层内含有一些淋巴小结和弥散的淋巴组织,常使舌粘膜向表面隆起呈结节状。
四、单核吞噬细胞系统
当异物或细菌侵入机体,体内各处的吞噬细胞(phagocyte)可吞噬清除异物,这是机体最原始的一种防御方式,至今仍具有重要的意义。Aschoff(1924)将这些吞噬细胞(除粒细胞外)和血液内的单核细胞以及骨髓和淋巴器官内的网状细胞和内皮细胞归纳为一个系统,称为网状内皮系统(reticuloendothelial system,RES),并认为这些细胞的起源、形态和功能是相同的。此后的许多实验发现,网状细胞和内皮细胞在发生来源方面不同于巨噬细胞,又缺乏明显的吞噬功能,也不能转变成吞噬细胞,因此van Furth(1972)建议将此系统的网状细胞和内皮细胞排除,改称为单核吞噬细胞系统(mononuclear phagocytic system,MPS)。该系统包括结缔组织的巨噬细胞、肝的枯否细胞、肺的尘细胞、神经组织的小胶质细胞、骨组织的破骨细胞、表皮的郎格汉斯细胞和淋巴组织内的交错突细胞等。它们均来源于骨髓内的幼单核细胞,幼单核细胞分化为单核细胞进入血流,后者从不同部位穿出血管壁进入其它组织内,分别分化为上述各种细胞。
单核吞噬细胞系统在机体内分布广,细胞数量也很多,其功能意义不仅为吞噬作用,还有许多其他重要功能。如与机体的免疫功能密切相关,在免疫应答的起始阶段,巨噬细胞等能处理抗原和分泌IL-Ⅰ,激活淋巴细胞并促进其分裂与分化;在免疫应答的效应阶段,巨噬细胞等又能集聚于病灶周围,受淋巴因子等的激活作用,成为破坏靶细胞和吞噬细菌的重要成分。巨噬细胞还能分泌数十种重要的活性物质,如补体成分、凝血因子、生长因子、活化因子、激素样物质、酶、细胞抑制物、细胞外基质成分、嘌呤与嘧喧产物、结合蛋白以及单核因子等;但并不是同时分泌这么多的物质,而是在不同场合和不同激活程度,受到不同的刺激下而产生不同的分泌物。巨噬细胞与淋巴细胞、粒细胞、肥大细胞在功能上有相互促进和相互制约的关系。当单核吞噬细胞系统功能失调时,可引致多种疾病。目前尚不能对巨噬细胞确定分型,但巨噬细胞的功能表达可有多种类型,在不同的环境条件下有不同的功能表现。
巨噬细胞的活化是一个渐进的过程。当机体或局部未受到病原体等的刺激时,巨噬细胞等常处于静息状态,胞体较小,细胞器较不发达,几乎不运动,但寿命较长而更新率低。在炎症或其它因子的刺激下,巨噬细胞从静息转向活化,细胞增大,代谢增强,溶酶体增多,细胞的变形运动及吞噬能力均增强。在T细胞分泌的淋巴因子和干扰素的刺激下,巨噬细胞可进一步活化,活化巨噬细胞表面的MHC-Ⅱ类抗原阳性,能处理抗原,促进免疫应答,吞噬能力增强,吞噬速度增快。继而在细菌脂多糖、内毒素和高浓度干扰素的刺激下,激活为超活化巨噬细胞(hyperactivated macrophage),此时已不能处理抗原,但吞噬力更增强,还能释放H2O2、超氧离子和肿瘤坏死因子等活性物质,代谢极活跃,但寿命短,不久即死亡。
第十章 皮肤
皮肤(skin)的面积为1.2-2m2,约占体重的8%,是个面积广大的器官。皮肤由表皮和真皮组成,借皮下组织与深部的组织相连(图10-1)。皮肤内有毛、指(趾)甲、皮脂腺和汗腺,它们是由表皮衍生的皮肤附属器。皮肤直接与外界环境接触,对人体有重要的保护作用,能阻挡异物和病原体侵入,并能防止体内组织液丢失。皮肤内有丰富的感觉神经末梢,能感受外界的多种刺激。此外,皮肤对调节体温也起重要作用。
一、表皮
表皮(epidermis)是皮肤的浅层,由角化的复层扁平上皮构成。人体各部位的表皮厚薄不等,一般厚0.07~0.12mm,手掌和足跖最厚,约0.8~1.5mm。表皮由两类细胞组成:一类是角蛋白形成细胞(keratinocyte),占表皮细胞的绝大多数,它们在分化中合成大量角蛋白,细胞角化并脱落;另一类细胞为非角蛋白形成细胞,数量少,分散存在于角蛋白形成细胞之间,包括黑(色)素细胞、郎格汉斯细胞和梅克尔细胞,它们各有特别的功能,与表皮角化无直接关系。
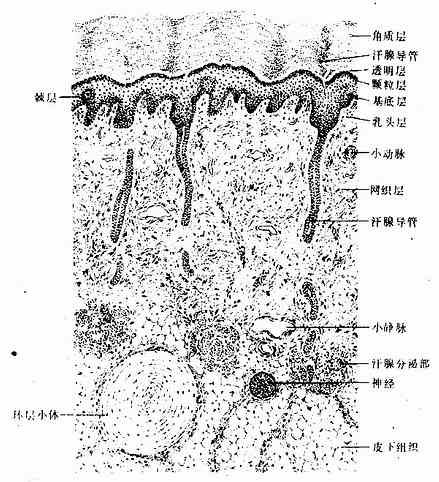
图10-1 手掌皮肤(低倍)
(一)表皮的分层和角化
手掌和足跖的厚表皮的结构较典型,从基底到表面可分为五层。
1.基底层基底层(stratum basale)附着于基膜上,为一层矮柱状或立方形细胞(图10-1,10-2),称基底细胞(basal cell),胞核相对较大,呈圆形,染色较浅,胞质内含丰富的游离核糖体,故在HE染色的标本上呈强嗜碱性,有分散和成束的角蛋白丝(keratin filament),也称张力丝(tonofilament)。细胞的相邻面有桥粒相连,细胞基底面以半桥粒与基膜相连(图10-3)。基底细胞是未分化的幼稚细胞,有活跃的分裂能力。新生的细胞向浅层移动,分化成表皮其余几层的细胞。
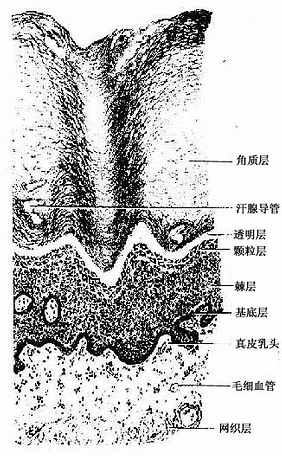
图10-2 足底皮肤(高倍)
2.棘层棘层(stratum spinosum)在基底层上方,一般由4~10层细胞组成。细胞较大,呈多边形。胞核较大,圆形(图10-2)。细胞向四周伸出许多细短的突起,故名棘细胞;相邻细胞的突起由桥粒相连(图10-3)。胞质丰富,也含许多游离核糖体,因而也显嗜碱性。胞质内含许多角蛋白丝,常成束分布,并附着到桥粒上(图10-3)。光镜下能见成束的角蛋白丝,称张力原纤维(tonofibril)。电镜下,可见胞质中有多个卵圆形的颗粒,称板层颗粒(lamellated granule)(图10-3),直径为0.1~0.5μm,有界膜包被,内有明暗相间的平行板层。这种颗粒由高尔基复合体生成,其内容物主要为糖脂和固醇。
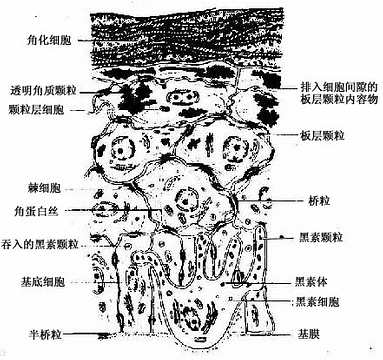
图10-3 角质形成细胞和黑素细胞超微结构模式图
3.颗粒层(stratum granulosum)约由3~5层较扁的梭形细胞组成,位于棘层上方,胞核和细胞器已退化。细胞的主要特点是胞质内含有许多透明角质颗粒(keratohyalin granule),在HE染色的切片上显强嗜碱性,形状不规则,大小不等(图10-2,10-3)。电镜下,颗粒没有界膜包被,呈致密均质状(图10-3)。颗粒的来源不明,主要成分为富有组氨酸的蛋白质。在颗粒层细胞内,角蛋白丝与透明角持颗粒的物质发生化学反应,电镜下可见角蛋白丝伸入颗粒中。颗粒层细胞含板层颗粒多,并常位于胞质周边,与细胞膜贴连,将所含的糖脂等物质释放到细胞间隙内,在细胞外面形成多层膜状结构,构成阻止物质透过表皮的主要屏障。
4.透明层透明层(stratum lucidum)位于颗粒层上方,只在无毛的厚表皮中明显易见。此层由几层更扁的梭形细胞组成,在HE染色的切片上,细胞呈透明均质状,细胞界限不清,被伊红染成红色,胞核和细胞器已消失(图10-2)。细胞的超微结构与角质层细胞相似。
5.角质层角质层(stratum corneum)为表皮的表层,由多层扁平的角化细胞(horny cell)组成。这些细胞干硬,是已完全角化的死细胞,已无胞核和细胞器。在HE染色切片上,细胞呈均质状,轮廓不清,也易被伊红着色(图10-2)。在电镜下,可见胞质中充满密集平行的角蛋白丝,浸埋在均质状的物质中,其中主要为透明角质颗粒所含的富有组氨酸的蛋白质。细胞膜内面附有一层厚约12nm 的不溶性蛋白质,故细胞膜明显增厚而坚固(图10-3)。细胞表面折皱不平,相邻细胞互相嵌合,细胞间隙中充满板层颗粒释放的脂类物质。靠近表面的细胞间的桥粒解体,细胞彼此连接不牢,逐渐脱落,即为日常所称的皮屑。
身体大部分的表皮相当薄,与厚表皮的分层有差别(图10-4)。基底层与厚表皮的相同,棘层的细胞层数少,颗粒层只有2~3层细胞,没有透明层,角质层也薄,只有几层细胞。
表皮由基底层到角质层的结构变化,反映了角蛋白形成细胞增殖、分化、移动和脱落的过程,同时也是细胞逐渐生成角蛋白和角化的过程。表皮角蛋白形成细胞不断脱落和更新,其更新周期约为3~4周。表皮角蛋白形成细胞定期脱落和增殖,使表皮各层得以保持正常的结构和厚度。
表皮是皮肤的重要保护层。角质层细胞干硬,胞质内充满角蛋白,细胞膜增厚,因而角质层的保护作用尤其明显。棘层到角质层的细胞间隙内脂类,构成阻止物质出入的屏障。因此表皮对多种物理和化学性刺激有很强的耐受力,能阻挡异物和病原侵入,并能防止组织液丧失。
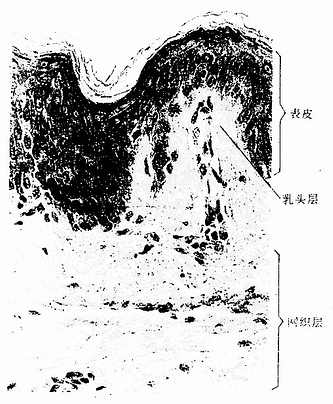
图10-4 人腹部皮肤光镜像 HE×400
(二)非角蛋白形成细胞
1.黑素细胞黑素细胞(melanocyte)是生成黑色素的细胞,由胚胎早期的神经嵴发生,然后迁移到皮肤中。它们大多散在于表皮基底细胞之间,真皮中可有少数,它们在身体各部的数目有明显差别,如前额每平方毫米约有2000个,四肢每平方毫米约有1000个。这种细胞在HE染色的切片上不易辨认;用特殊染色法可显示细胞的全貌,为有多个较长并分支突起的细胞。在电镜下,可见胞质内有丰富的核糖体和粗面内质网,高尔基复合体发达。这种细胞的主要特点是胞质中有多个长圆形的小体,长0.6μm,宽0.2μm,称黑素体(melanosome)(图10-3)。这种小体由高尔基复合体生成,有界膜包被,内含酷氨酸酶,能将酷氨酸转化为黑色素(melanin)。黑素体充满色素后成为黑素颗粒(melanin granule)。黑素颗粒移入突起末端,然后被输送到邻近的基底细胞内,因而基底细胞内常含许多黑素颗粒,而黑素细胞本身却含黑素颗粒少。黑色素为棕黑色物质,是决定皮肤颜色的一个重要因素。由于细胞中黑素颗粒的大小和含量的差别,并由于黑素细胞合成色素的速度不同,决定了不同种族和个体不同部位皮肤颜色的差异。黑色素能吸收和散射紫外线,可保护表皮深层的幼稚细胞不受辐射损伤。

图10-5 人腹部表皮铺片 ATP酶法 ×450
示郎格汉斯细胞
(上海医科大学组织胚胎学教研室供图)
2.郎格汉斯细胞郎格汉斯细胞(Langerhans cell)由胚胎期的骨髓发生,以后迁移到皮肤内,分散在表皮的棘细胞之间。它们在身体各部位的数目不等,每平方毫米约为400~1000个。它们是多突起的细胞,在HE染色的切片上不易辨认。用三磷酸腺苷酶等特殊染色法可见细胞向周围伸出几个较粗的突起,这些突起又分出多个树枝状的细突起。穿插在棘细胞之间(图10-5)。电镜下可见细胞具有以下的特点:①胞核呈弯曲形或分叶形;②胞质密度低,无角蛋白丝和桥粒;③胞质内有特殊形状的伯贝克颗粒(Birbeck granule),有膜包裹,呈盘状或偏囊形,长15~30nm ,宽4nm,一端或两端常有泡,颗粒的切面为杆状或球拍形,内有纵向的致密线(图10-6,10-7),颗粒的意义尚不了解。这种细胞的性质与免疫系统的树突状细胞很相似,能识别、结合和处理侵入皮肤的抗原,并把抗原传送给T细胞,是皮肤免疫功能的重要细胞,在对抗侵入皮肤的病毒和监视表皮癌变细胞方面起重要作用,并在排斥移植的异体组织中起重要作用。
图10-6 郎格汉斯细胞电镜像 ×7800
↑球拍形Birbeck颗粒 M线粒体
(白求恩医科大学尹昕、朱秀雄教授供图)
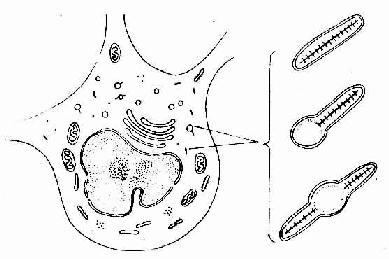
图10-7 郎格汉斯细胞超微结构模式图
左图示郎格汉斯细胞,右图示不同形状的伯贝克颗粒的切面
朗格汉斯细胞大概由单核细胞发生。它们并不是长期固定生存在表皮内,而是不断进行更新,更新率尚未确知。有些细胞受损伤死亡,有些携带抗原移入周围淋巴器官的胸腺依赖区,将抗原传递给T细胞,新生的细胞由血流内的单核细胞发生,也可由表皮内有分裂能力的郎格汉斯细胞增殖补充。
形态、功能和细胞化学等方面的研究表明,郎格汉斯细胞、面纱细胞和交错突细胞是巨噬细胞的一个亚群。这三种细胞都具有较低的吞噬力,都有免疫球蛋白IgG的Fc段受体和补体C3受体,并都有MHCⅡ类抗原和很强的抗原传递能力。此外,有些面纱细胞和交错突细胞也有伯贝克颗粒。这些事实说明,这三种细胞之间有密切的关系。目前认为,郎格汉斯细胞携带抗原进入淋巴管后即转变为面纱细胞,后者进入局部淋巴结胸腺依赖区成为交错突细胞。
3.梅克尔细胞梅克尔细胞(Merkel cell)是一种具短指状突起的细胞,数目很少,每平方厘米约1个,大多存在于毛囊附近的表皮基底细胞之间,在HE染色标本上不辨认,须用特殊染色法显示。电镜下可见细胞的胞核较小。呈不规则形,胞质内有许多有膜的含致密核芯的小泡,直径约80nm,与肾上腺髓质细胞内的分泌颗粒很相似(图10-8)。这种细胞的功能还未完全了解。常见有些细胞的基底面与盘状的感觉神经末梢紧相接触,而且胞质中的小泡也多聚集在细胞基底部,形成类似于突触的结构(图10-8)。由于细胞具有突触样结构以及生理学研究结果,认为这种细胞是感觉细胞,能感受触觉刺激。
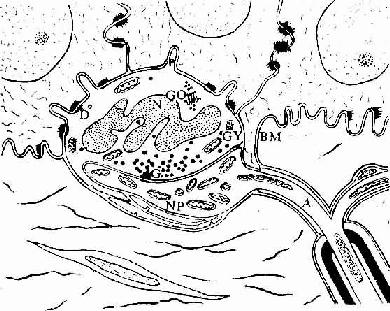
图10-8 梅克尔细胞与神经末梢超微结构模式图
N梅克尔细胞核 P胞质突起 D桥粒 GY糖原GO高尔基复合体
G分泌颗粒 BM基膜 A轴突 NP神经板
梅克尔细胞是起源于胚胎期的原始表皮,还是由神经嵴发生后迁移到表皮,仍有不同的见解。近年的一些研究倾向于认为,梅克尔细胞是在人胚胎8~12周时由原始的表皮细胞发生的。关于梅克尔细胞的生理学意义也提出一些有待解决的问题。由于梅克尔细胞所含的小泡与肾上腺髓质细胞的分泌颗粒很相似,故有人认为梅克尔细胞可能合成儿茶酚胺,是属于APUD细胞系统的一种细胞。但梅克尔细胞是否合成儿茶酚胺,并未得到确实的证据。免疫组织化学的研究显示,在人和某些动物不同部位的梅克尔细胞含有不同的生物活性肽,而且胚胎期和成年时同一部位的细胞所含的肽也常不同,切断动物分布到皮肤的神经后,梅克尔细胞仍能正常生存3个月以上。另外已知,人和某些动物的正常表皮中就存在一些不与神经未梢接触的梅克尔细胞。因此有理由认为。梅克尔细胞可能是一个异质性的细胞群。其中有些细胞可能是感觉细胞,与神经末梢共同构成触觉感受器;其余的细胞也许对表皮细胞增殖和皮肤附属器的发生,或对皮肤内神经纤维的生长起诱导和调节作用。
二、真皮
真皮(dermis)位于表皮下面,由结缔组织组成,与表皮牢固相连。真皮深部与皮下组织接连,但两者之间没有清楚的界限(图10-1,10-4)。身体各部位真皮的厚薄不等,一般厚约1~2mm。真皮又分为乳头层和网织层两层。
1.乳头层 乳头层(papillary layer)为紧邻表皮的薄层结缔组织。胶原纤维和弹性纤维较细密,含细胞较多。此层的结缔组织向表皮底部突出,形成许多嵴状或乳状的凸起,称真皮乳头(dermal papilla)(图10-2,10-4),使表皮与真皮的连接面扩大,有利于两者牢固连接,并便于表皮从真皮的血管获得营养。乳头层毛细血管丰富,有许多游离神经末梢,在手指等触觉灵敏的部位常有触觉小体。
2.网织层 网织层(reticular layer)在乳头层下方,较厚,是真皮的主要组成部分,与乳头层无清楚的分界(图10-2,10-4)。网织层由致蜜结缔组织组成,粗大的胶原纤维束交织成密网,并有许多弹性纤维,使皮肤有较大的韧性和弹性。此层内有许多血管、淋巴管和神经,毛囊、皮脂腺和汗腺也多存在于此层内,并常见环层小体(图10-1)。有的婴儿骶部皮肤真皮中有较多的黑素细胞,使局部皮肤显灰蓝色,称胎斑(mongolian spot)。
三、皮下组织
皮下组织(hypodermis)即解剖学中所称的浅筋膜,由疏松结缔组织和脂肪组织组成(图10-1),一般不认为它是皮肤的组成部分,皮下组织将皮肤与深部的组织连接一起,并使皮肤有一定的可动性。皮下组织的厚度因个体、年龄、性别和部位而有较大的差别。腹部皮下组织中脂肪组织丰富,厚可达3cm以上。眼睑、阴茎和阴囊等部位皮下组织最薄,不含脂肪组织。分布到皮肤的血管、淋巴管和神经由皮下组织中通过,毛囊和汗腺也常延伸到此层组织中。
四、皮肤的附属器
(一)毛
除手掌和足跖等部位外,人体大产分皮肤都长有毛(hair)。毛的粗细和长短不一。头发、胡须和腋毛等较粗较长,并富有黑色素;其余部位的毛细软而短,含色素少。兽类皮肤有极多的毛,对保持体温和防御机械性损害有重要的作用。人类的毛已相当退化,已无上述的作用,但毛囊有丰富的感觉神经末梢,能敏锐地感受触觉等刺激。
1.毛的结构伸在皮肤外面的毛称毛干(hair shaft),长在皮肤内的称毛根(hair root)。毛根包在由皮和结缔组织组成的毛囊(hair follicle)内(图10-9,10-10)。毛根和毛囊的下端合为一体,成为膨大的毛球(hair bulb),毛球底面向内凹陷,容纳毛乳头(图10-10)。毛乳头(hair papilla)是富有血管和神经的结缔组织,毛球是毛和毛囊的生长点,毛乳头对毛的生长起诱导和维持作用。毛和毛囊斜长在皮肤内,在它们与皮肤表面呈钝角的一侧,有一束平滑肌连接毛囊和真皮,称立毛肌(arrector pilli muscle)(图10-9,10-10)。立毛肌受交感神经支配,收缩时使毛竖立。
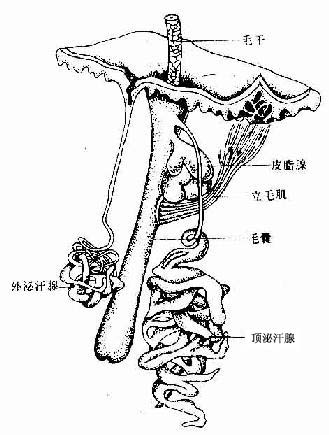
图10-9 皮肤附属器示意图
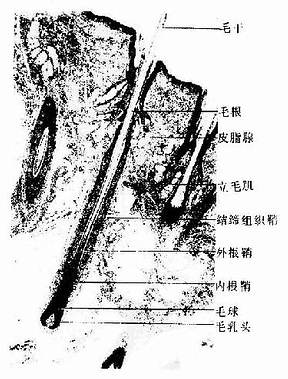
图10-10 人头皮光镜像(低倍) HE
毛干和毛根由排列规则的角化上皮细胞组成,细胞内充满角蛋白并含黑色素。毛囊分内外二层。内层为上皮根鞘,紧包毛根,与表皮相连续,其结构也与表皮相似(图10-10)。外层为结缔组织鞘,由致密结缔组织构成(图10-10)。毛根和上皮根鞘与毛球的细胞相连。毛球的上皮细胞为幼稚细胞,称毛母质。这些细胞分裂活跃,能增殖和分化为毛根和上皮根鞘的细胞。毛的色素由分布在毛母质细胞间的黑素细胞生成,然后将色素输入新生的毛根上皮细胞中。
2.毛的生长和更新毛有一定的生长周期,身体各产位毛的生长周期长短不等。生长期的毛囊长,毛球和毛乳头也大。此时毛母质细胞分裂活跃,使毛生长。由生长期转入退化期,即是换毛的开始。此时毛囊变短,毛球缩小,毛乳聚成一个小团,连在毛球底端,毛母质细胞停止分裂并发生角化,毛与毛球和毛囊连接不牢,故毛易脱落。在下一个生长周期开始时,在毛囊底端形成新的毛球和毛乳头,开始生长新毛。新毛长入原有的毛囊内,将旧毛推出,新毛伸到皮肤外面。
(二)皮脂腺
皮脂腺(sebaceous gland)大多位于毛囊和立毛肌之间,为泡状腺,由一个或几个囊状的腺泡与一个共同的短导管构成(图10-9,10-10)。导管为复层扁平上皮,大多开口于毛囊上段,也有些直接开口在皮肤表面。腺泡周边是一层较小的幼稚细胞,有丰富的细胞器,并有活跃的分裂能力,生成新的腺细胞。新生的腺细胞渐变大,并向腺泡中心移动,胞质中形成越来越多的小脂滴(图10-11)。腺泡中心的细胞更大,呈多边形,胞质内脂滴,细胞核固缩,细胞器消失(图10-11)。最后,腺细胞解体,连同脂滴一起排出,即为皮脂(sebum)。皮脂腺的发育和分泌受性激素的调节,青春期分泌活跃。皮脂是几种脂类的混合物,其作用尚未确实了解,可能有柔润皮肤和杀菌作用。
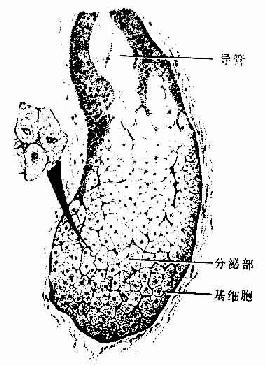
图10-11 皮脂腺
左侧示腺细胞(高倍)
(三)外泌汗腺
外泌汗腺(eccrine sweat gland)又名局泌汗腺,即通常所称的汗腺。它们遍布于全身的皮肤中,但不同部位皮肤内的汗腺数目有明显差别。汗腺是单曲管状腺,分泌部为较粗的管,位于真皮深层和皮下组织中,盘曲成团,管腔小。导管较细而直,开口于皮肤表面(图10-1,10-9)。分泌部由单层锥体形细胞组成,胞核呈圆形,位于细胞近基底部;胞质着色较浅(图10-12)。基膜明显。在腺细胞与基膜之间避孕药肌上皮细胞(myoepithelial cell)(图10-12),它们收缩时能帮助排出分泌物。导管由两层染色较深的立方形细胞组成(图10-12),由真皮深部上行,穿过表皮,开口于皮肤表面的汗孔(图10-1,10-9)。腺细胞分泌的汗液除含大量水分外,还含钠、钾、氯、乳酸盐和尿素。导管能吸收分泌物中的一部分钠和氯。汗液分泌(出汗)是身体散热的主要方式,对调节体温起重要作用。外界湿度高时汗腺分泌旺盛,可散发身体大量的热。
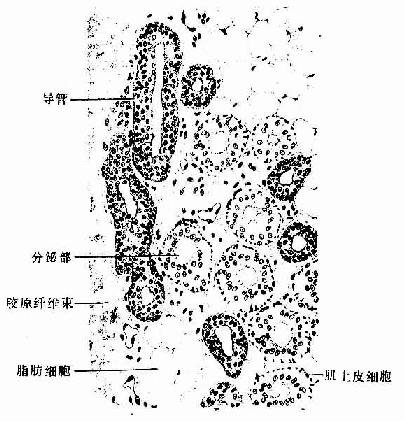
图10-12 外泌汗腺
(四)顶泌汗腺
顶泌汗腺(apocrine sweat gland)主要分布在腋窝、乳晕和阴部等处。这种腺与上述的外泌汗腺不同,是皮肤中的另一种腺。分泌部为粗管,管腔大,也盘曲成团(图10-9)。腺细胞呈立方形或矮柱状,胞核圆形,胞质易被伊红染色,胞质内含许多分泌颗粒和溶酶体。腺细胞与基膜之间也有肌上皮细胞。导管较细而直,也由两层上皮细胞组成,开口于毛囊上段。分泌物为较粘稠的乳状液,含蛋白质、碳水化合物和脂类等,分泌物被细菌分解后产生特别的气味。分泌过盛而致气味过浓时,则发生狐臭。这种腺在性成熟前呈静止状态,青春期后由于受性激素的刺激,分泌活跃,分泌物的作用尚未确知。
(五)指(趾)甲
指(趾)甲(nail)由甲体以及它周围和下面的几部分组织组成。甲体(nail body)是长在指(趾)末节背面的外露部分,为坚硬透明的长方形角质板(图10-13),由多层连接牢固的角化细胞构成,细胞内充满角蛋白丝。甲体下面的组织称甲床(nail bed),由非角化的复层扁平上皮和真皮组成(图10-13)。甲体的近端埋在皮肤所成的深凹内,称甲根(nail root)(图10-13)。甲体两侧嵌在皮肤所成的甲襞(nail fole)内。甲根周围为复层扁平上皮,其基底层细胞分裂活跃,称甲母质(nail matrix),是甲体的生长区。甲母质新生的细胞发生角化,并向甲体方向移动,成为构成甲体的细胞,使甲体生长。指(趾)甲受损或拔除后,如甲母质保留。甲仍能再生。各指(趾)的甲的生长速度并不相同,此外还受年龄、外界湿度和其他因素的影响。
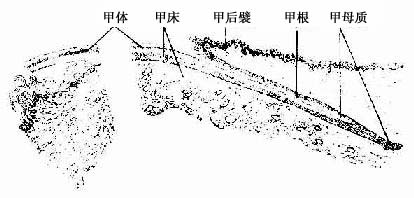
图10-13 指甲纵切面
五、皮肤的再生
皮肤受损伤后,其再生过程和修复时间,因受损的面积和深度而有很大的差别。小而浅的损伤,由于表皮细胞的迁移和增殖,数天就能愈合,也不形成瘢痕。较大而深的损伤,其再生过程则较长。创伤后首先是凝血和止血,并出现炎症反应,众多的中性粒细胞进入局部,清除细菌。随后出现许多巨噬细胞,清除损坏的组织,并释放几种生物活性物质促进成纤维细胞增殖和毛细血管生长,生成肉芽组织。肉芽组织是细嫩的结缔组织,其中有较多的成纤维细胞和巨噬细胞,纤维少,毛细血管丰富。创伤后不久,伤口周围的表皮细胞增殖并迁移到伤面。伤面残留的汗腺和毛囊的上皮也能增殖,形成覆盖伤面的上皮小岛,参与表皮再生。最后伤面全由新生的表皮覆盖,并渐形成正常的表皮。肉芽组织也渐由纤维致密的结缔组织替代。如创伤面积大,常需在伤面移植皮肤,以协助修复。
第十一章 内分泌系统
内分泌系统(endocrine system)是机体的重要调节系统,它与神经系统相辅相成,共同调节机体的生长发育和各种代谢,维持内环境的稳定,并影响行为和控制生殖等。内分泌系统由内分泌腺和分布于其它器官的内分泌细胞组成。内分泌细胞的分泌物称激素(hormone)。大多数内分泌细胞分泌的激素通过血液循环作用于远处的特定细胞,少部分内分泌细胞的分泌物可直接作用于邻近的细胞,称此为旁分泌(paracrine)。内分泌腺的结构特点是:腺细胞排列成索状、团状或围成泡状,不具排送分泌物的导管,毛细血管丰富。
内分泌细胞分泌的激素,按其化学性质分为含氮激素(包括氨基酸衍生物、胺类、肽类和蛋白质类激素)和类固醇激素两大类。分泌含氨激素细胞的超微结构特点是,胞质内含有与合成激素有关的粗面内质网和高尔基复合体,以及有膜包被的分泌颗粒等。分泌类固醇激素细胞的超微结构特点是,胞质内含有与合成类固醇激素有关的丰富的滑面内质网,但不形成分泌颗粒;线粒体较多,其嵴多呈管状;胞质内还有较多的脂滴,其中的胆固醇等为合成激素的原料。
每种激素作用于一定器官或器官内的某类细胞,称为激素的靶器官(target organ)或靶细胞(target cell)。靶细胞具有与相应激素相结合的受体,受体与相应激素结合后产生效应。含氮激素受体位于靶细胞的质膜上,而类固醇激素受体一般位于靶细胞的胞质内。
本章仅叙及甲状腺、甲状旁腺、肾上腺、垂体和松果体等内分泌腺,并简介弥散的神经内分泌系统。存在于其它器官内的内分泌细胞,如胰岛、卵泡、黄体、睾丸间质细胞、胃肠内分泌细胞等,分别在有关章节内叙述。
一、甲状腺
甲状腺分左右两叶,中间以峡部相连。成人甲状腺平均重约25g,女性的甲状腺略重,并在月经期与妊娠期略增大。甲状腺表面包有薄层结缔组织被膜。结缔组织伸入腺实质,将其分成许多大小不等的小叶,每个小叶内含有20~40个甲状腺滤泡和许多滤泡旁细胞(图11-1)
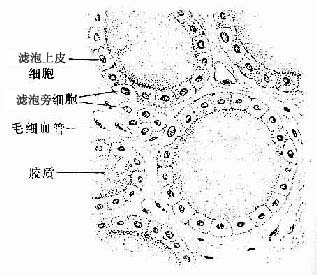
图11-1 甲状腺
(一)滤泡
滤泡(follicle)大小不等,直径0.02~0.9mm,呈圆形、椭圆形或不规则形。滤泡由单层立方的滤泡上皮细胞(follicular epithelial cell)围成,滤泡腔内充满透明的胶质(colloid)。滤泡上皮细胞因功能状态而有形态变化。在功能活跃时,细胞增高呈低柱状,腔内胶质减少;反之,细胞变矮呈扁平状,腔内胶质增多。胶质是滤泡上皮细胞的分泌物,在切片上呈均质状,嗜酸性,它是一种糖蛋白,称甲状腺球蛋白。胶质的边缘常存在不着色的空泡,有人认为是滤泡上皮细胞吞饮胶质滴所致(图11-1)。
电镜下,滤泡上皮细胞游离面有微绒毛,胞质内有较发达的粗面内质网和较多的线粒体,溶酶体散在于胞质内,高尔基复合体位于核上区。细胞顶部胞质内有电子密度中等、体积较小的分泌颗粒(直径150~200nm),还有从滤泡摄入的低电子密度的胶质小泡(直径约1μm)。滤泡上皮基底面有完整的基板,邻近的结缔组织内富含有孔毛细血管和毛细淋巴管(图11-2)
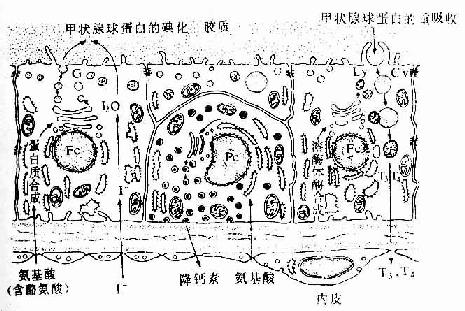
图11-2 甲状腺滤泡上皮细胞(Fc)和滤泡旁细胞(Pc)超微结构及激素合成与分泌模式图
G 分泌颗粒Cv胶质小泡 Ly溶酶体
甲状腺滤泡上皮细胞合成和分泌甲状腺激素(thyroid hormone)。甲状腺激素的形成经过合成、贮存、碘化、重吸收、分解和释放等过程。滤泡上皮细胞从血中摄取氨基酸,在粗面内质网合成甲状腺球蛋白的前体,继而在高尔基复合体加糖并浓缩形成分泌颗粒,再以胞吐方式排放到滤泡腔内贮存。滤泡上皮细胞能从血中摄取I-,它在过氧化物酶的作用下活化,再进入泡腔与甲状腺球蛋白结合成碘化的甲状腺球蛋白。滤泡上皮细胞在腺垂体分泌的促甲状腺激素的作用下,以胞吞方式将滤泡腔内的碘化甲状腺球蛋白再吸收入胞质,成为胶质小泡。胶质小泡与溶酶体融合,小泡内的甲状腺球蛋白被水解酶分解形成大量四碘甲腺原氨酸(T4,即甲状腺素thyroxine)和少量三碘甲腺原氨酸(T3)。T3和T4经细胞基底部释放入毛细血管内(图11-2)。在滤泡上皮细胞附近可见肾上腺素能神经末梢,故细胞的分泌活动也受神经调节。
T3和T4作用于机体的多种细胞,主要功能是促进机体的新陈代谢,提高神经兴奋性,促进生长发育,尤对婴幼儿的骨骼发育和中枢神经系统发育影响很大,小儿甲状腺机能低下,不仅身材矮小,而且脑发育障碍,导致呆小症。
(二)滤泡旁细胞
滤泡旁细胞(parafollicular cell)又称C细胞,位于滤泡之间和滤泡上皮细胞之间(图11-1)。细胞稍大,在HE染色切片中胞质着色略淡,银染法可见胞质内有嗜银颗粒。电镜下,位于滤泡上皮细胞之间的滤泡旁细胞基部附着于基板,顶部被邻近的滤泡上皮细胞覆盖。滤泡旁细胞质内有直径200nm的分泌颗粒,细胞以胞吐方式释放颗粒内的降钙素(图11-2)。降钙素(calcitonin)是一种多肽,能促进成骨细胞的活动,使骨盐沉着于类骨质,并抑制胃肠道和肾小管吸收Ca2+,而使血钙下降。
二、甲状旁腺
甲状旁腺一般有上下两对,位于甲状腺左右叶的背面。成人甲状旁腺呈棕黄色的扁椭圆形,总重约120mg。腺表面包有薄层结组织被膜,腺细胞排列成索团状,其间富含有孔毛细血管及少量结缔组织,还可见散在脂肪细胞,并随年龄增长而增多。腺细胞有主细胞和嗜酸性细胞两种(图11-3)。
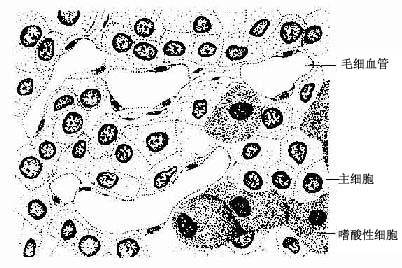
图11-3 甲状旁腺
(一)主细胞
主细胞(chief cell)呈圆形或多边形,核圆,位于细胞中央,HE染色切片中胞质着色浅。电镜下,胞质内含粗面内质网、高尔基复合体和直径200~400nm的分泌颗粒,还有一些糖原和脂滴(图11-4)。细胞分泌颗粒内的甲状旁腺激素(parathyroid hormone)以胞吐方式释放入毛细血管内。甲状旁腺激素是肽类激素,主要功能是作用于骨细胞和破骨细胞,使骨盐溶解,并能促进肠及肾小管吸收钙,从而使血钙升高。在甲状旁腺激素和降钙素的共同调节下,维持着血钙的稳定。
(二)嗜酸性细胞
从青春期前后开始,某些动物和人的甲状旁腺内出现嗜酸性细胞(oxyphil cell),并随年龄而增多,细胞常单个或成群存在于主细胞之间。嗜酸性细胞比主细胞大,核较小,染色较深,胞质内含密集的嗜酸性颗粒,故呈强嗜酸性。电镜下,嗜酸性颗粒乃是线粒体,其它细胞器均不达,糖原和脂滴也少,且无分泌颗粒(图11-4)。此细胞的机能意义不明。
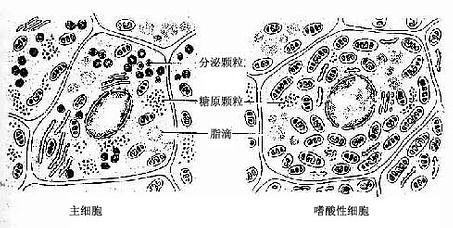
图11-4 甲状旁腺主细胞及嗜酸性细胞超微结构模式图
三、肾上腺
肾上腺位于肾的上方,右侧肾上腺呈扁平三角形,左侧呈半月形。成人的每侧肾上腺重4~5g。肾上腺表面包以结缔组织被膜,少量结缔组织伴随血管和神经伸入腺实质内。肾上腺实质由周边的皮质和中央的髓质两部分构成,两者在发生、结构和功能上均不相同,皮质来自中胚层,髓质来自外胚层。
(一)皮质
皮质约占肾上腺体积的80%~90%,根据皮质细胞的形态结构和排列等特征,可将皮质分为三个带,即球状带、束状带和网状带(图11-5)。
1.球状带球状带(zone glomerulosa)位于被膜下方,较薄,占皮质总体积的15%。细胞呈球状分布,细胞较小,呈矮柱状或锥形,核小染色深,胞质较少,内含少量脂滴。细胞团之间为窦状毛细血管和少量结缔组织(图11-5)。球状带细胞分泌皮质激素(mineralocorticoid),如醛固酮(aldosterone),它能促进肾远曲小管和集合小管重吸收Na+及排出K+,同时刺激胃粘膜、唾液腺和汗腺吸收Na+,使血Na+浓度升高,K+浓度降低,维持血容量。盐皮质激素的产生受肾素-血管紧张素系统的影响,肾球旁细胞分泌的肾素(renin)可使血浆中的血管紧张素原(angiotensinogen),变成血管紧张素(angiotensin),后者可刺激球状带细胞分泌盐皮质激素。
2.束状带束状带(zona fasciculata)是皮质中最厚的部分,占皮质总体积的78%。在人和大多数动物,束状带细胞比皮质其它两带的细胞大,细胞呈多边形,排列成单行或双行细胞索,索间为窦状毛细血管和少量结缔组织。细胞的胞核圆形,较大,着色浅。胞质内含有大量的脂滴,在常规切片标本中,因脂滴被溶解,故染色浅而呈空泡状(图11-5)。束状带细胞分泌糖皮质激素(glucocorticoid),主要为皮质醇(cortisol)和皮质酮(corticosterone),可促使蛋白质及脂肪分解并转变成糖(糖异生),还有降低免疫应答及抗炎症等作用。束状带细胞受腺垂体细胞分泌的促肾上腺皮质激素(ACTH)的调控。
3.网状带网状带(zona reticularis)位于皮质的最内层,占皮质总体积的7%,细胞索相互吻合成网,网间为窦状毛细血管和少量结缔组织。网状带细胞较束状带细胞小,胞核也小,着色较深,胞质内含较多脂褐素和少量脂滴,因而染色较束状带深(图11-5)。网状带细胞主要分泌雄激素,也分泌少量糖皮质激素,故也受促肾上腺皮质激素的调节。另外,网状带和束状带可能还分泌少量雌激素。
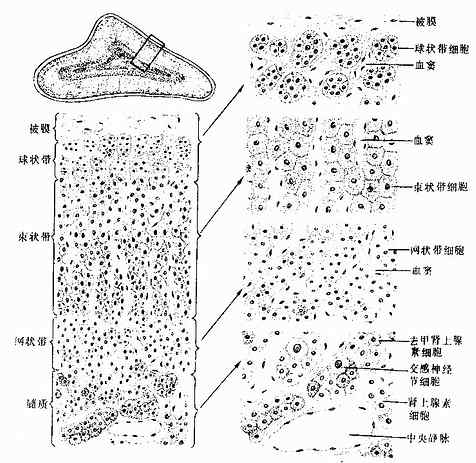
图11-5 肾上腺
肾上腺皮质细胞分泌的激素均属类固醇,都具有分泌类固醇激素细胞的超微结构特点。如肾上腺皮质细胞。特别是束状带细胞胞质内含有丰富的滑面内质网和脂滴,线粒体嵴多呈小管状或小泡状(图11-6)。
图11-6 猴肾上腺皮质束状带细胞电镜像 ×14600
L脂滴,M线粒体
(白求恩医科大学尹昕、朱秀雄教授供图)
(二)髓质
髓质主要由排列成索或团的髓质细胞组成,其间为窦状毛细血管和少量结缔组织。髓质细胞呈多边形,如用含铬盐的固定液固定标本,胞质内呈现出黄褐色的嗜铬颗粒,因而髓质细胞又称为嗜铬细胞(chromaffin cell)。另外,髓质内还有少量交感神经节细胞,胞体较大,散在分布于髓质内(图11-5)。
电镜下,髓质细胞最显着的特征是,胞质内含有许多电子密度高的膜被分泌颗粒,直径150~350nm 。根据颗粒内含物质的差别,髓质细胞分为两种。一种为肾上腺素细胞,颗粒内含肾上腺素(adrenaline),此种细胞数量多,约占人肾上腺髓质细胞的80%以上(图11-7)。另一种为去甲肾上腺素细胞,颗粒内含去甲肾上腺素(noradrenaline)。肾上腺素和去甲肾上腺素为儿茶酚胺类物质。此外,两种细胞的颗粒内尚含ATP及嗜铬颗粒蛋白,它们与肾上腺素或去甲肾上腺素组成复合物贮存在颗粒内。髓质细胞可与交感神经节前纤维形成突触,节前纤维末梢释放之酰胆碱作用髓质细胞,引起髓质细胞分泌颗粒释放肾上腺素或去甲肾上腺素入血。肾上腺素使心率加快、心脏和骨骼肌的血管扩张;去甲肾上腺素使血压增高,心脏、脑和骨骼肌内的血流加速。
图11-7 大鼠肾上腺髓质肾上腺素细胞×10000
(白求恩医科大学尹昕、朱秀雄教授供图)
(三)肾上腺的血管分布
肾上腺动脉进入被膜后,分支形成动脉性血管丛,其中大部分分支进入皮质,形成窦状毛细血管网,并与髓质毛细血管通连。少数小动脉分支穿过皮质直接进入髓质,形成窦状毛细血管。髓质内的小静脉汇合成一条中央静脉,经肾上腺静脉出肾上腺(图11-8)。因而肾上腺的大部分血液是经过皮质到达髓质的,血液中含有皮质激素,其中的糖皮质激素可增强肾上腺素细胞内N-甲基移酶的活性,使去甲肾上腺素甲基化为肾上腺素。由此可见,肾上腺皮质对髓质细胞的激素生成有很大的影响。
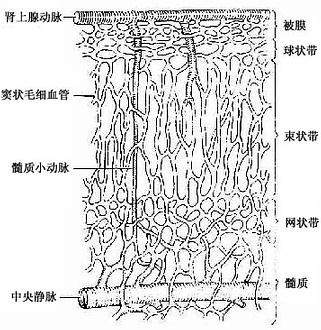
图11-8 肾上腺的血管分布
四、垂体
垂体位于蝶鞍垂体窝内,体积约0.5cm×1cm×1cm,重约0.5g.垂体由腺垂体和神经垂体两部份组成,表面包以结缔组织被膜。腺垂体来自胚胎口凹的外胚层上皮,神经垂体由间脑底部的神经外胚层向腹侧突出的神经垂体芽发育而成。神经垂体分为神经部和漏斗两部分,漏斗与下丘脑相连。腺垂体分为远侧部、中间部及结节部三部分。远侧部最大,中间部位于远侧部和神经部之间,结节部围在漏斗周围(图11-9)。远侧部又称前叶,神经部和中间部合称后叶。
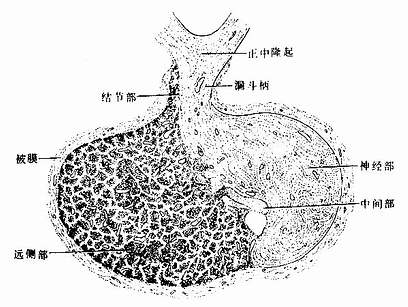
图11-9 垂体(矢状切面)
(一)腺垂体
1.远侧部远侧部(pars distalis)的腺细胞排列成团索状,少数围成小滤泡,细胞间具有丰富的窦状毛细血管和少量结缔组织。在HE染色切片中,依据腺细胞着色的差异,可将其分为嗜色细胞和嫌色细胞两大类。嗜色细胞(chromophil cell)又分为嗜酸性细胞和嗜碱性细胞两种(图11-10)。应用电镜免疫细胞化学技术,可观察到各种腺细胞均具有分泌蛋白类激素细胞的结构特点,而各类腺细胞胞质内颗粒的形态结构、数量及所含激素的性质存在差异,可以此区分各种分泌不同激素的细胞,并以所分泌的激素来命名。
(1)嗜酸性细胞:数量较多,呈圆形或椭圆形,直径14~19mμ胞质内含嗜酸性颗粒,一般较嗜碱性细胞的颗粒大(图11-10)。嗜酸性细胞分两种:①生长激素细胞,(somatotroph,STh cell)数量较多,电镜下见胞质内含大量电子密度高的分泌颗粒,直径350-~400nm(图11-11)。此细胞合成和释放的生长激素(growth hormone ,GH;或somatotropin)能促进体内多种代谢过程,尤能刺激骺软骨生长,使骨增长。在幼年时期,生长激素分泌不足可致垂体侏儒症,分泌过多引起巨人症,成人则发生肢端肥大症。②催乳激素细胞(mammotroph,prolactin cell),男女两性的垂体均有此种细胞,但在女性较多。在正常生理情况下,胞质内分泌颗粒的直径小于200nm;而在妊娠和哺乳期,分泌颗粒的直径可增大至600nm 以上,颗粒呈椭圆形或不规则形(图11-11),细胞数量也增多并增大。此细胞分泌的催乳激素(mammotropin或prolactin)能促进乳腺发育和乳汁分泌。
(2)嗜碱性细胞:数量较嗜酸性细胞少,呈椭圆形或多边形,直径15~25μm,胞质内含嗜碱性颗粒(图11-10)。颗粒内含糖蛋白类激素,PAS反应呈阳性,嗜碱性细胞分三种:①促甲状腺激素细胞(thyrotroph,TSh cell),呈多角形,颗粒较小,直径100~150nm(图11-11),分布在胞质边缘。此细胞分泌的促甲状腺激素(thyrotropin或thyroid stimulating hormone,TSH)能促进甲状腺激素的合成和释放。②促性腺激素细胞(gonadotroph),细胞大,呈圆形或椭圆形,胞质内颗粒大小中等,直径250~400nm(图11-11)。该细胞分泌卵泡刺激素(follicle stimulating hormone,FSH)和黄体生成素(luteinizing hormone,LH)。应用电镜免疫细胞化学技术,发现上述两种激素共同存在于同一细胞的分泌颗粒内。卵泡刺激素在女性促进卵泡的发育,在男性则刺激生精小管的支持细胞合成雄激素结合蛋白,以促进精子的发生。黄体生成素在女性促进排卵和黄体形成,在男性则刺激睾丸间质细胞分泌雄激素,故又称间质细胞刺激素(interstitial cell stimulatinghormone ,ICSH)③促肾上腺皮质激素细胞(corticotroph,ACTh cell),呈多角形,胞质内的分泌颗粒大,直径400~550nm(图11-11)。此细胞分泌促肾上腺皮质激素(adrenocorticotropin,ACTH)和促脂素(lipotropin或lipotrophic hormone,LPH)。前者促进肾上腺皮质分泌糖皮质激素,后者作用于脂肪细胞,使其产生脂肪酸。

图11-10腺垂体远侧部及中间部
(3)嫌色细胞(chromophobe cell):细胞数量多,体积小,呈圆形或多角形,胞质少,着色浅,细胞界限不清楚(图11-10)。电镜下,部分嫌色细胞胞质内含少量分泌颗粒,因此认为这些细胞可能是脱颗粒的嗜色细胞,或是处于形成嗜色细胞的初期阶段。其余大多数嫌色细胞具有长的分支突起(图11-11),突起伸入腺细胞之间起支持作用。
图11-11 大鼠腺垂体远侧部腺细胞 电镜像×5000
S生长激素细胞,M催乳激素细胞 T促甲状腺激素细胞,
G促性腺激素细胞 A促肾上腺皮质激素细胞,C嫌色细胞
2.中间部人的中间部(pars intermedia)只占垂体的2%左右,是一个退化的部位,由嫌色细胞和嗜碱性细胞组成,这些细胞的功能尚不清楚。另外,还有一些由立方上皮细胞围成的大小不等的滤泡,泡腔内含有胶质(图11-10)。鱼类和两棲类中间部分能分泌黑素细胞刺激素(melanocyte stimulating hormone,MSH),係吲哚胺类物质,可使皮肤黑素细胞的黑素颗粒向突起内扩散,体色变黑。
3.结节部结节部(pars teberalis)包围着神经垂体的漏斗,在漏斗的前方较厚,后方较薄或缺如。此部含有很丰富的纵形毛细血管,腺细胞呈索状纵向排列于血管之间,细胞较小,主要是嫌色细胞,其间有少数嗜酸性和嗜碱性细胞。此处的嗜碱性细胞分泌促性腺激素(FSH和LH)。
4.腺垂体的血管分布腺垂体主要由大脑基底动脉发出的垂体上动脉供应。垂体上动脉从结节部上端进入神经垂体的漏斗,在该处形成袢样的窦状毛细血管网,称第一级毛细血管网。这些毛细血管网下行到结节部汇集形成数条垂体门微静脉,它们下行进入远侧部,再度形成窦状毛细血管网,称第二级毛细血管网。垂体门微静脉及其两端的毛细血管网共同构成垂体门脉系统(hypophyseal portal system)。远侧部的毛细血管最后汇集成小静脉注入垂体周围的静脉窦(图11-12)。这是30年代确立的经典垂体血流模式“自上而下”的概念,阐明了下丘脑控制垂体功能的基本机制。此后又通过新技术的应用和研究,对垂体的血流模式提出了新见解,认为远侧部的血液可输入神经垂体的漏斗,然后经毛细血管回流入下丘脑;也可流入神经部,再逆向流入漏斗,然后再循环到远侧部或下丘脑,构成整个垂体血流在垂体内的循环流动。
5.下丘脑与腺垂体的关系下丘脑神前区和结节区(弓状核等)的一些神经元具有内分泌功能,称为神经内分泌细胞,细胞的轴突伸至垂体漏斗。细胞合成的多种激素经轴突释放入漏斗处的第一级毛细血管网内,继而经垂体门微静脉输至远侧部的第二级毛细血管网。这些激素分别调节远侧部各种腺细胞的分泌活动(图11-12)。其中对腺细胞分泌起促进作用的激素,称释放激素(releasing hormone,RH)。对腺细胞起抑制作用起抑制作用的激素,则称为释放抑制激素(release inhibiting hormone,RIH)目前已知的释放激素有:生长激素释放激素(GRH)、催乳激素释放激素(PRH)、促甲状腺激素放激素(TRH)、促性腺激素释放激素(GnRH)、促肾上腺皮质激素释放激素(CRH)及黑素细胞刺激素释放激素(MSRH)等。释放抑制激素有:生长激素释放抑制激素(或称生长抑素,SOM)、催乳激素释放抑制激素(PIH)和黑素细胞刺激素释放抑制激素(MSIH)等。由此可见,下丘脑通过所产生的释放激素和释放抑制激素,经垂体门脉系统,调节腺垂体内各种细胞的分泌活动;因而,将此称为下丘脑腺垂体系。反之,腺垂体产生的各种激素又可通过垂体血液环流,到达下丘脑,反馈影响其功能活动。
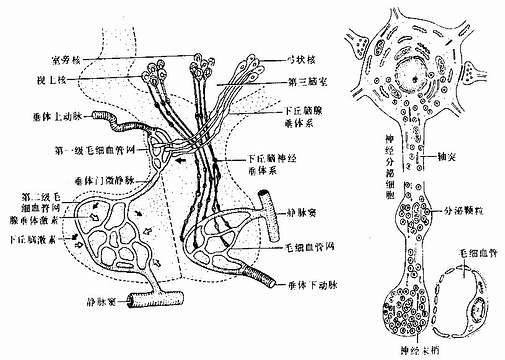
图11-12 垂体的血管分布及其与下丘脑的关系
6.腺垂体的神经支配传统认为,垂体前叶仅有少量自主神经纤维,支配前叶内血管的舒缩;而腺细胞的分泌活动则主要受下丘脑各种激素的调节,并无神经的直接支配。近几年来,国外学者(Friedman 和Payette)分别在大鼠、小鼠及蝙蝠垂体前叶发现5-羟色胺神经纤维;我国学者(鞠躬等)采用光镜及电镜免疫组织化学技术,也发现人、猴、狗、大鼠垂体前叶均有肽能神经纤维分布,纤维内含的肽类有P物质(SP)、降钙素基因相关肽(CGRP)、甘丙肽(GAL)、生长抑素(SOM)等,并发现含SP的神经纤维与各类腺细胞直接接触,电镜下发现,含SP和CGRP纤维与生长激素细胞和促肾上腺皮质激素细胞形成典型的突触(图11-13)。
图11-13 大鼠腺垂体远侧部免疫电镜像 ×60000
示P物质神经末梢(SP)与促肾上腺皮质细胞(A)形成突触(↑)
(第四军医大学鞠躬教授供图)
前叶内肽能神经纤维的起源还不清楚,究竟是来自下丘脑或周围神经系统,还是两者兼有,尚未确定。前叶内肽能神经纤维的发现及其功能的研究,有可能修正目前对垂体前叶分泌功能调节的认识,即前叶腺细胞除接受体液调节外,还可能直接受神经的支配。
(二)神经垂体及其与下丘脑的关系
神经垂体与下丘脑直接相连,因此两者是结构和功能的统一体。神经垂体主要由无髓神经纤维和神经胶质细胞组成,并含有较丰富的窦状毛细血管和少量网状纤维。下丘脑前区的两个神经核团称神上核和室旁核,核团内含有大型神经内分泌细胞,其轴突经漏斗直抵神经部,是神经部无髓神经纤维的主要来源(图11-12)。
神上核和室旁核的大型神经内分泌细胞除具有一般神经元的结构外,胞体内还含有许多直径为100~200nm的分泌颗粒,分泌颗粒沿细胞的轴突运输到神经部,轴突沿途呈串珠状膨大,膨大部(称膨体)内可见分泌颗粒聚集(图11-12)。光镜下可见神经部内有大小不等的嗜酸性团块,称赫令体(Herring body)即为轴突内分泌颗粒大量聚集所成的结构(图11-14)。神经部内的胶质细胞又称垂体细胞(pituicyte),细胞的形状和大小不一。电镜下可见垂体细胞具有支持和营养神经纤维的作用。垂体细胞还可能分泌一些化学物质以调节神经纤维的活动的激素的释放。
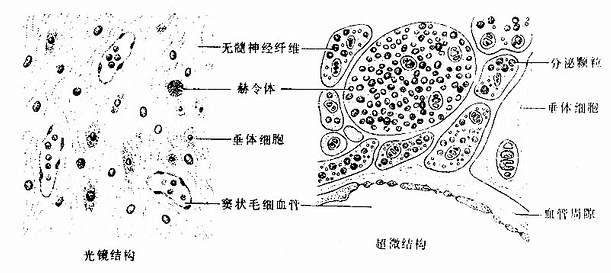
图11-14 垂体神经部结构模式图
视上核和室旁核的大型神经内分泌细胞合成抗利尿素(antidiuretic hormone,ADH)和催产素(oxytocin)。抗利尿素的主要作用是促进肾远曲小管和集合管重吸收水,使尿量减少;抗利尿素分泌若超过生理剂量,可导致小动脉平滑肌收缩,血压升高,故又称加压素形成的分泌颗粒有加压素和催产素,分泌颗粒沿轴突运送到神经部储存,进而释放入窦状毛细管内(图11-12)。因此,下丘脑与神经垂体是一个整体,两者之间的神经纤维构成下丘脑神经垂体束。
神经部的血管主要来自左右颈内动脉发出的垂体下动脉,血管进入神经部分支成为窦状毛细管网。部分毛细血管血液经垂体下静脉汇入海绵窦(图11-12)。部分毛细血管血液逆向流入漏斗,然后从漏斗再循环到远侧部或下丘脑。
(三)下丘脑和腺垂体与其它内分泌腺的相互关系
在正常状态下,各类激素的分泌量是相对稳定的。内分泌腺活动的稳定性,除受神经系统的调节控制外,某些内分泌腺之间的相互协调也起重要作用,其中下丘脑和腺垂体与其它几种内分泌腺之间的相互调节尤为重要。下丘脑的各种神经内分泌细胞分泌的释放激素或释放抑制激素,调节腺垂体相应腺细胞的分泌活动,腺垂体分泌的各种激素又调节相应靶细胞的分泌和其它功能活动。另一方面,靶细胞的分泌物或某种物质(如血糖、血钙等)的浓度变化,反过来又可影响腺垂体和下丘脑的分泌活动,这种调节称为反馈。通过正、负反馈调节以维持机体内环境的相对稳定和正常生理活动。例如,下丘脑的神经内分泌细胞分泌促甲状腺激素释放激素,促进腺垂体远侧部的促甲状腺激素细胞分泌促甲状腺激素,后者又促进甲状腺滤泡上皮细胞合成和分泌甲状腺激素。当血液甲状腺激素达到一定水平时,则引起负反馈作用,抑制下丘脑或腺垂体相应激素的分泌,这样又使甲状腺的分泌功能和血液中的甲状腺激素水平下降。当激素下降到一定水平时,再以正反馈调节使激素分泌增多(图11-15)。
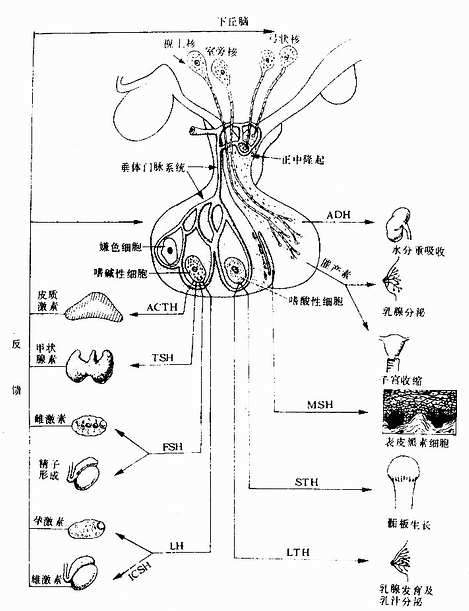
图11-15 下丘脑与垂体的激素对靶器官作用示意图
五、松果体
松果体又称脑上腺,呈扁圆锥形,以细柄连于第三脑室顶。松果体表面包以软膜,软膜结缔组织伴随血管伸入腺实质,将实质分为许多小叶,小叶内主要由松果体细胞、神经胶质细胞和无髓神经纤维等组成。
松果体细胞(pinealocyte)与神经内分泌细胞类似,在HE染色片中,胞体呈圆形或不规则形,核大,胞质少,弱嗜碱性。在银染色切片中,可见细胞具有突起,短而细的突起终止在邻近细胞之间,长而粗的突起多终止在血管周间隙(图11-16)。电镜下,松果体细胞内线粒体和游离核糖体较多,高尔基复合体较发达,可见少量滑面内质网和粗面内质网;胞质内还常见小圆形分泌颗粒,颗粒内含有细胞合成的褪黑激素(melatonin)。此外,胞质尚有一种称为突触带(synaptic ribbon)的结构,它由电子致密的杆状体的周围的许多小泡组成(图11-17)。在低等动物,松果体作为光感受器,松果体细胞的突触带为突触前成分的组成部分;但在哺乳动物,则见突触小带分布于相邻松果体细胞相互接触处,或松果体细胞与细胞外间隙或脑脊液相接触的部位。因此,哺乳动物突触带系突触前成分的提法不能成立。突触带可能与化学介质的运输和释放有关。
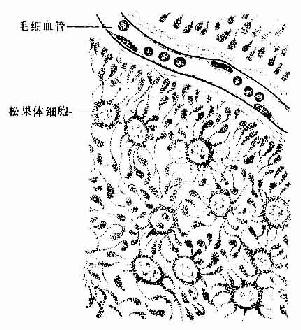
图11-16 银染法示松果体细胞模式图
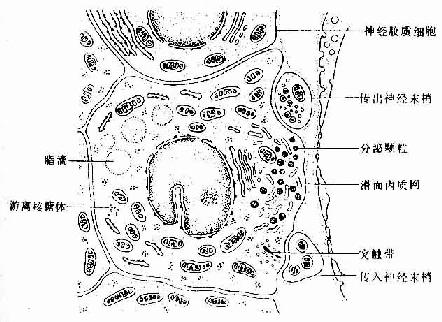
图11-17 松果体超微结构模式图
神经胶质细胞位于松果体细胞之间,胞体较小,核小着色深。在成人的松果体内常见脑砂(brain sand),它是松果体细胞分泌物经钙化而成的同心圆结构,其意义不明。
松果体细胞分泌褪黑激素。在两棲类,褪黑激素的作用与黑素细胞刺激素相拮抗,可使皮肤褪色。在哺乳动物,褪黑激素具有抑制生殖腺发育的效应,主要是通过抑制垂体促性腺激素而间接影响生殖腺的活动。近年研究报道,褪黑激素的合成分泌不足,可能会引起睡眠紊乱、情感障碍、肿瘤发生等。经予外源性褪黑激素,可见其具有抗紧张、抗高血压、抗衰老、抗肿瘤、增强免疫力和促进睡眠等效应。白天日照时,松果体几乎停止分泌活动,至夜间才分泌褪黑激素。故生物体能依外界的日照变化,有节奏地控制松果体的功能活动。哺乳动物松果体昼夜节奏性变化是受视交叉背侧的视交叉上核的调节;反之,松果体也影响神交叉上核的昼夜节奏变化。
松果体除接受颈上交感神经节的神经支配外,还可能受其它来源的神经支配。
六、弥散神经内分泌系统
除上述内分泌腺外,机体许多其他器官还存在大量散在的内分泌细胞,这些细胞分泌的多种激素样物质在调节机体生理活动中起十分重要的作用。Pearse(1966)根据这些内分泌细胞都能合成和分泌胺(amine),而且细胞是通过摄取胺前体(氨基酸)经脱羧后产生胺的,故将这些细胞统称为摄取胺前体脱羧细胞(amine precursor uptake anddecarboxylation cell, APUD细胞)。
随着APUD细胞研究的不断深入,发现许多APUD细胞不仅产生胺,而且还产生肽,有的细胞则只产生肽;并且随着APUD细胞类型和分布的不断扩展,发现神经系统内的许多神经元也合成和分泌与APUD细胞相同的胺和(或)肽类物质。因此学者们提出,将这些具有分泌功能的神经元(称分泌性神经元,secretory neuron)和APUD细胞统称为弥散神经内分泌系统(diffuse neuroendocrine system,DNES)。故而DNES是在APUD基础上的进一步发展和扩充,它把神经系统和内分泌系统两大调节系统统一起来构成一个整体,共同完成调节的和控制机体生理活动的动态平衡。
DNES的组成,至今已知有40多种细胞,分中枢和周围两大部分。中枢部分包括下丘脑-垂体轴的细胞和松果体细胞,如前述的下丘脑结节区和前区的弓状核、视上核、室旁核等分泌性神经元,以及腺垂体远侧部和中间部的内分泌细胞等。周围部包括分布在胃、肠、胰、呼吸道、排尿管道和生殖管道内的内分泌细胞,以及甲状腺的滤泡旁细胞、甲状旁腺细胞、肾上腺髓质等的嗜铬细胞、交感神经节的小强荧光细胞、颈动脉体细胞、血管内皮细胞、胎盘内分泌细胞和部分心肌细胞与平滑肌细胞等。迷些细胞产生的胺类物质如儿茶酚胺、多巴胺、5-羟色胺、去甲肾上腺素、褪黑激素、组胺等;肽类物质种类更多,如:下丘脑的释放抑制激素、释放抑制激素、加压素和催产素,腺垂体的前述各种激素,以及诸多内分泌的细胞分泌的胃泌素、P物质、生长抑素、蛙皮素、促胰液素、胆囊收缩素、神经降压素、高血糖素、胰岛素、脑啡肽、血管活性肠肽、甲状旁腺激素、降钙素、肾素、血管紧张素、心钠素、内皮素等。
第十二章 消化管
消化系统由消化管与消化腺组成,主要功能是对食物进行物理性和化学性消化,将大分子物质分解为小分子的氨基酸、单糖、甘油酯等。吸收后供机体生长和代谢的需要。消化管是从口腔至肛门的连续性管道,依次分为口腔、咽、食管、胃、小肠和大肠。这些器官的管壁结构具有某些共同的分层规律,又各具有与其功能相适应的特点。
一、消化管的一般结构
消化管(除口腔与咽外)自内向外均分为粘膜、粘膜下层、肌层与外膜四层(图12-1)。
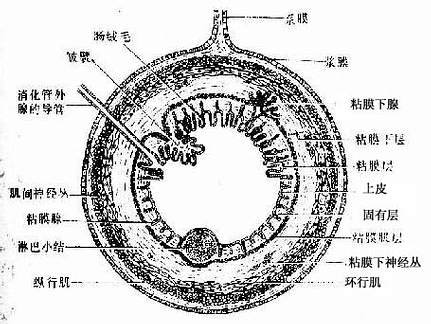
图12-1 消化管一般结构模式图
(一)粘膜
粘膜(tunica mucosa)由上皮、固有层和粘膜肌组成,是消化管各段结构差异最大、功能最重要的部分。
1.上皮 上皮的类型依部位而异。消化管的两端(口腔、咽、食管及肛门)为复层扁平上皮,以保护功能为主;其余部分均为单层柱状上皮,以消化吸收功能为主。上皮与管壁内的腺体相连。
2.固有层 固有层(lamina propria )为疏松结缔组织,含细胞和纤维较多,并有丰富的血管和淋巴管。胃肠固有层内还富含腺体或淋巴组织。
3.粘膜肌层 粘膜肌层(muscularis mucosa)为薄层平滑肌,其收缩可使粘膜活动,促进固有层内的腺体分泌物排出和血液运行,利于物质吸收。
(二)粘膜下层
粘膜下层(tela submucosa)由疏松结缔组织组成,内含较大的血管与淋巴管。在食管及十二指肠的粘膜下层内分别有食管腺与十二指肠膜。粘膜下层中还有粘膜下神经丛,由多极神经元与无髓神经纤维构成,可调节粘膜肌的收缩和腺体的分泌。在食管、胃和小肠等部位的粘膜与粘膜下层共同向管腔内突起,形成皱襞(plica)。
(三)肌层
除食管上段与肛门处的肌层(tunica muscularis)为骨骼肌外,其余大部均为平滑肌。肌层一般分为内环行、外纵行两层,其间有肌间神经丛,结构与粘膜下神经丛相似,可调节肌层的运动。
(四)外膜
外膜(tunica adventitia)由薄层结缔组织构成者称纤维膜(fibrosa),主要分布于食管和大肠末段,与周围组织无明显界限。由薄层结缔组织与间皮共同构成者称浆膜(serosa),见于腹膜内位的胃、大部分小肠与大肠,其表面光滑,利于胃肠活动。
二、口腔
(一)口腔粘膜的一般结构
口腔粘膜只有上皮和固有层,无粘膜肌。上皮为复层扁平,仅在硬腭部出现角化。固有层结缔组织突向上皮形成乳头,其内富有毛细血管,故新鲜粘膜呈红色。乳头及上皮内有许多感觉神经末梢。固有层中尚有粘液性和浆液性的小唾液腺。固有层下连骨骼肌(于唇、颊等处)或骨(于硬腭)。
(二)舌
舌由表面的粘膜和深部的舌肌组成。舌肌由纵行、横行及垂直走行的骨骼肌纤维束交织构成。粘膜由复层扁平上皮与固有层组成。粘膜由复层扁平上皮与固有层组成。舌根部粘膜内有许多淋巴小结,构成舌扁桃体。舌背部粘膜形成许多乳头状隆起,称舌乳头(lingual papillae),可分为四种。
1.丝状乳头 丝状乳头(filiform papillae)数目最多,遍布于舌背各处。乳头呈圆锥形,尖端略向咽部倾斜,浅层上皮细胞角化脱落,外观白色,称舌苔(图12-2)。
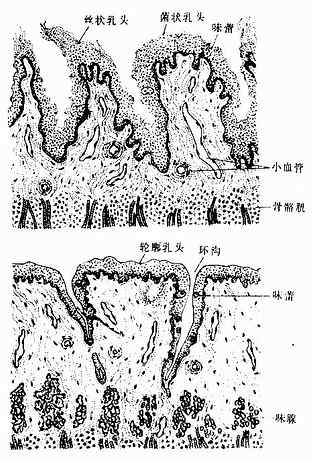
2.菌状乳头 菌状乳头
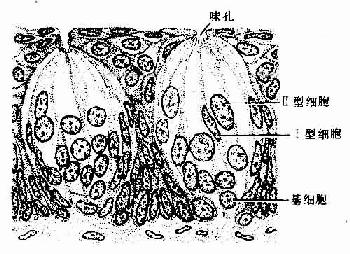
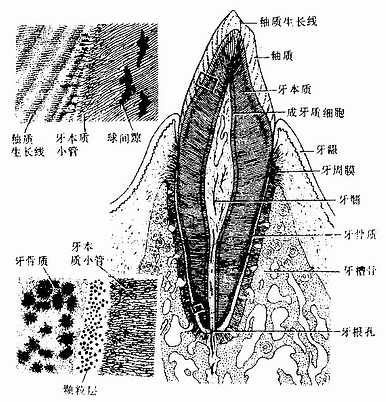
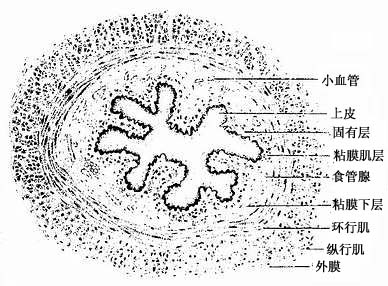
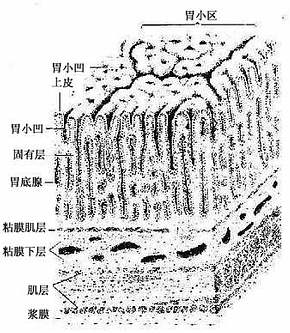
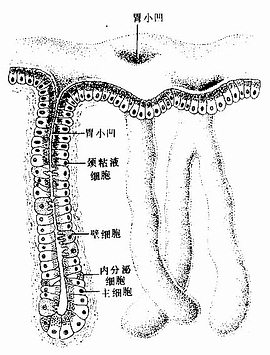
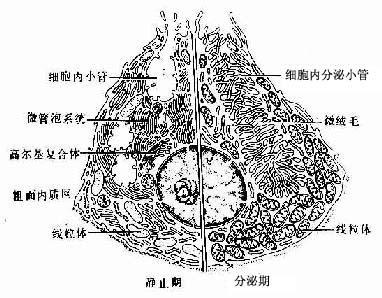
2在碳酸酐酶作用下与H2O结合形成H2CO3;H2CO3解离为H+和HCO3-,H+被主动运输至分泌小管,而HCO3-与血液中的CL-次换;CL-也被运输入分泌小管,与H+结合成盐酸(图12-11)。盐酸能激活胃蛋白酶原,使之成为胃蛋白酶,对蛋白质进行初步分解;盐酸还有杀菌作用。人的壁细胞还分泌内因子(intrinsic factor),这种糖蛋白在胃腔内与食物中的维生素B12结合成复合物,使 B12在肠管内不被酶分解,并能促进回肠吸收B12入血,供红细胞生成所需。如内因子缺乏,维生素B12吸收障碍,可导致恶性贫血。
颈粘液细胞(nedk mucous cell):数量很少,位于腺颈部,多呈楔形夹于其它细胞间。核多呈扁平形,居细胞基底,核上方有很多粘原颗粒,HE染色浅淡,故常不易与主细胞相区分,其分泌物为含酸性粘多糖的可溶性粘液。
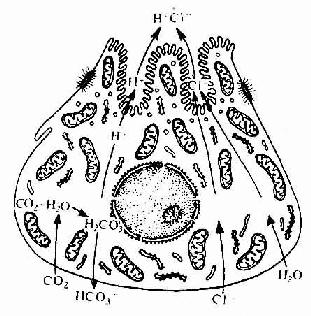
图12-11 壁细胞合成盐酸示意图
内分泌和细胞:见后述。
主细胞和壁细胞的寿命为200余天,衰老的细胞在胃底腺底部脱落,新增殖的细胞从颈部向底部缓慢迁移。由于在颈部尚未发现典型的未分化细胞,故目前一般认为颈粘液细胞可分化为其它胃底腺细胞;主细胞自身也具有一定的分裂能力。
(2)贲门腺(cardiac gland):分布于近贲门处宽5~30mm的狭窄区域,为分支管状的粘液腺,可有少量壁细胞。
(3)幽门腺(phloric gland):分布于幽门部宽4~5cm的区域,此区胃小凹甚深。幽门腺为分支较多而弯曲的管状粘液腺,内有较多内分泌细胞。
3.粘膜肌层由内环行与外纵行两层平滑肌组成。内环肌的部分细胞伸入固有层腺体之间,其收缩有助于腺分泌物的排出。
胃粘膜的自我保护机制:胃液含高浓度盐酸,PH值为2,腐蚀力极强,胃蛋白酶能分解蛋白质,而胃粘膜却不受破坏,这主要是由于胃粘膜表面存在粘液-碳酸氢盐屏障(mucous-HCO3-barrier)。胃上皮表面覆盖的粘液层厚0.25~0.5mm ,主要由不可溶性粘液凝胶(mucingel)构成,并含大量HCO3-,后者部分由表面粘液细胞产生,部分来自壁细胞(图12-12)。凝胶层将上皮与胃蛋白酶相隔离,并减缓H+向粘膜方向的弥散;HCO-3可中和H+,形成H2CO3,后者被胃上皮细胞的碳酸酐酶迅速分解为H2O和CO2。此外,胃上皮细胞的快速更新也使胃能及时修复损伤。
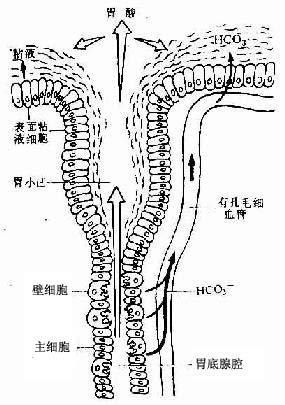
图12-12 胃粘液-碳酸氢盐屏障示意图
(二)粘膜下层
为疏松结缔组织,内含较粗的血管、淋巴管和神经,尚可见成群的脂肪细胞。
(三)肌层
较厚,一般由内斜行、中环行及外纵行三层平滑肌构成。环形肌在贲门和幽门部增厚,分别形成贲门括约肌和幽门括约肌。
(四)外膜
为浆膜。
六、小肠
小肠是消化和吸收的主要部位,分为十二指肠、空肠和回肠,各具某些结构特点。
(一)粘膜
小肠腔面的环行皱襞从距幽门约5cm处开始出现,在十二指肠末段和空肠头段极发达,向下逐渐减少和变矮,至肠中段以下基本消失。粘膜表面还有许多细小的肠绒毛(intestinal villus),是由上皮和固有层向肠腔突起而成,长0.5~1.5mm,形状不一,以十二指肠和空肠头段最发达(图12-13,12-14)。绒毛于十二指肠呈叶状,于空肠如指状,于回肠则细而短(图12-15)。环行皱襞和绒毛使小肠表面积扩大20~30倍,总面积达20m2左右。绒毛根部的上皮下隐至固有层形成管状的小肠腺(small intestinal gland),又称肠隐窝(intestinal crypt),故小肠腺与绒毛的上皮是连续的,小肠腺直接开口于肠腔。
图12-13 大鼠十二指肠绒毛扫描电镜像×230
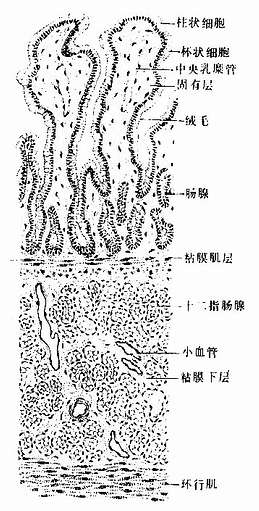
图12-14 十二指肠(横切)
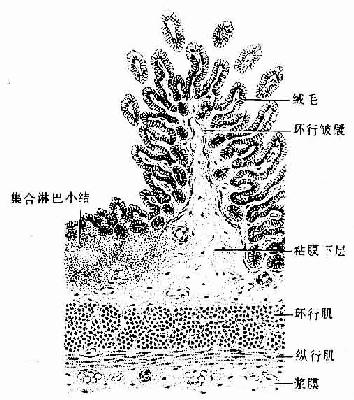
图12-15 回肠(纵切)
1.上皮为单层柱状。绒毛部上皮由吸收细胞、杯状细胞和少量内分泌细胞组成;小肠腺上皮除上述细胞外,还有潘氏细胞和未分化细胞。
(1)吸收细胞(absorptive cell):最多,呈高柱状,核椭圆形,位于细胞基部。绒毛表面的吸收细胞游离面在光镜下可见明显的纹状缘,电镜观察表明它是由密集而规则排列的微绒毛构成(图12-16)。每个吸收细胞约有微绒毛1000根,每根长1~1.4μm ,粗约80nm ,使细胞游离面面积扩大约20倍。小肠腺的吸收细胞的微绒毛较少而短,故纹状缘薄。微绒毛表面尚有一层厚0.1~0.5μm的细胞衣,它是吸收细胞产生的糖蛋白,内有参与消化碳水化合物和蛋白质的双糖酶和肽酶,并吸附有胰蛋白酶、胰淀粉酶等,故细胞衣是消化吸收的重要部位。微绒毛内有纵行微丝束,它们下延汇入细胞顶部的终末网(图12-17)。吸收细胞胞质内有丰富的线粒体和滑面内质网。滑面内质网膜含有的酶可将细胞吸收的甘油-酯与脂肪酸合成甘油三酯,后者与胆固醇、磷脂及β-脂蛋白结合后,于高尔基复合体形成乳糜微粒,然后在细胞侧面释出,这是脂肪吸收与转运的方式。相邻细胞顶部之间有紧密连接、中间连接等构成的连接复合体,可阻止肠腔内物质由细胞间隙进入组织,保证选择性吸收的进行(图12-17)。

图12-16 小鼠小肠吸收细胞电镜像 ×9900
Mv微绒毛,N细胞核
图12-17 小肠吸收细胞
f脂肪 TW终末网 S滑面内质网 G高尔基复合体
C乳糜微粒B基膜 CL中央乳糜管
(2)杯状细胞(goblet cell): 散在于吸收细胞间,分泌粘液,有润滑和保护作用,从十二指肠至回肠末端,杯状细胞逐渐增多。
(3)潘氏细胞(Paneth cell):是小肠腺的特征性细胞,位于腺底部,常三五成群。细胞呈锥体形,胞质顶部充满粗大嗜酸性颗粒,内含溶菌酶等,具有一定的灭菌作用(图12-18)。
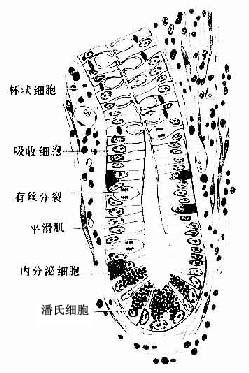
图12-18 小肠腺模式图
(4)内分泌细胞(见后述)。
(5)未分化细胞(undifferentiated cell):位于小肠腺下半部,散在于其它细胞之间。胞体较小,呈柱状,胞质嗜碱性。细胞不断增殖、分化、向上迁移,以补充绒毛顶端脱落的吸收细胞和杯状细胞。绒毛上皮细胞的更新周期为2~4天。一般认为,内分泌细胞和潘氏细胞亦来源于未分化细胞。
2.固有层在细密的结缔组织中除有大量小肠腺外,还有丰富的游走细胞,如淋巴细胞、浆细胞、巨噬细胞,嗜酸性粒细胞等。绒毛中轴的固有层结缔组织内有1~2条纵行毛细淋巴管,称中央乳糜管(central lacteal),它的起始部为盲端,向下穿过粘膜肌进入粘膜下层形成淋巴管丛。中央乳糜管管腔较大,内皮细胞间隙宽,无基膜,故通透性大。吸收细胞释出的乳糜微粒入中央乳糜管输出。此管周围有丰富的有孔毛细血管网,肠上皮吸收的氨基酸、单糖等水溶性物质主要经此入血。绒毛内还有少量来自粘膜肌的平滑肌纤维,可使绒毛收缩,利于物质吸收和淋巴与血液的运行。
固有层中除有大量分散的淋巴细胞外,尚有淋巴小结。在十二指肠和空肠多为孤立淋巴小结,在回肠多为若干淋巴小结聚集形成的集合淋巴小结,它们可穿过粘膜肌抵达粘膜下层(图12-15;见后述)。
3.粘膜肌层由内环行与外纵行两层平滑肌组成。
(二)粘膜下层
为疏松结缔组织,含较多血管和淋巴管。十二指肠的粘膜下层内有十二指肠腺(duodenal gland),为复管泡状的粘液腺,其导管穿过粘膜肌开口于小肠腺底部(图12-14)。此腺分泌碱性粘液(pH8.2~9.3),可保护十二指肠粘膜免受酸性胃液的侵蚀。最近研究表明,人十二指肠腺尚分泌尿抑胃素(urogasterone),释入肠腔,具有抑制胃酸分泌和刺激小肠上皮细胞增殖的作用。
(三)肌层
由内环行与外纵行两层平滑肌组成。
(四)外膜
除十二指肠后壁为纤维膜外,小肠其余部分均为浆膜。
七、大肠
大肠分为盲肠(附阑尾)、结肠和直肠,主要功能是吸收水分和电解质,将食特残渣形成粪便。大肠粘膜不形成环行皱襞与绒毛,故表面平滑;但在结肠袋之间的横沟处,结肠壁内面有半月形皱襞。
(一)盲肠与结肠
1.粘膜上皮是单层柱状,由柱状细胞和杯状细胞组成,后者数量明显多于小肠。固有层内有大量由上皮下陷而成的大肠腺(亦称肠隐窝),呈长单管状,除含柱状细胞、杯状细胞外,尚有少量未分化细胞和内分泌细胞,无潘氏细胞。固有层内有散在的孤立淋巴小结。粘膜肌层同小肠(图12-19)。
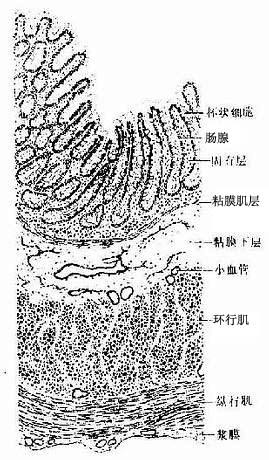
图12-19 结肠(纵切)
2.粘膜下层在疏松结缔组织内有较大的血管和淋巴管,有成群的脂肪细胞。
3.肌层为内环行与外纵行两层平滑肌组成。内环行肌较规则,外纵行肌局部增厚形成三条结肠带,带间的纵行肌很薄。
4.外膜在盲肠、横结肠、乙状结肠为浆膜;在升结肠与降结肠的前壁为浆膜,后壁为纤维膜。外膜结缔组织中常有脂肪细胞集聚构成的肠脂垂。
(二)阑尾
阑尾的管腔小而不规则,大肠腺短而少。固有层内有极丰富的淋巴组织,形成许多淋巴小结,并突入粘膜下层,致使粘膜肌很不完整。肌层很薄,外覆浆膜(图12-20)
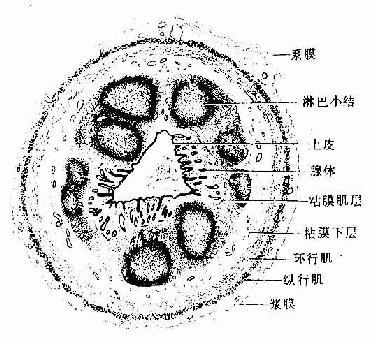
图12-20 阑尾(横切)
(三)直肠
在齿状线以上的直肠粘膜结构与结肠相似。在齿状线处,单层柱状上皮骤变为未角化的复层扁平上皮,大肠腺与粘膜肌消失(图12-21)。痔环以下为角化的复层扁平上皮,近肛门处有环肛腺(顶泌汗腺)。粘膜下层的结缔组织中有丰富的静脉丛,如静脉瘀血扩张则形成痔。肌层为内环行、外纵形两层平滑肌、内环行肌在直肠下段的肛管处增厚形成肛门内括约肌。近肛门处,外纵行肌周围有骨骼肌形成的肛门外括约肌。外膜于直肠上1/3段的大部,中1/3段的前壁为浆膜,其余部分为纤维膜。
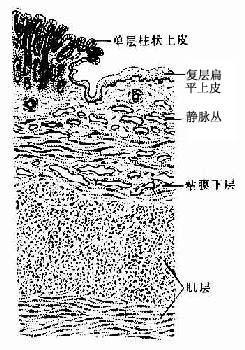
图12-21 直肠齿状线部
八、消化管的淋巴组织及其免疫功能
消化管与机体外环境相通连,各种细菌、病毒、寄生虫卵等有害抗原物质不可避免地随饮食进入。它们大多被胃酸和消化酶所破坏,其余或以原形排出体外,或受到消化管淋巴组织的免疫抵御。消化管淋巴组织又称肠相关淋巴组织(gut- associated lymphoid tissue),包括粘膜淋巴小结(尤以咽、回肠与阑尾处发达),固有层中弥散分布的淋巴细胞、浆细胞、巨噬细胞,上皮内的淋巴细胞等成分。消化管淋巴组织能接受消化管内的抗原刺激,并主要通过产生和向消化管腔分泌免疫球蛋白作为应答。
在肠集合淋巴小结处,局部粘膜向肠腔呈圆顶状隆起,无绒毛和小肠腺。此部位上皮内有散在的小结相关上皮细胞(follicular associated cell),因其游离面有一些微皱褶与短小的绒毛,故又称微皱褶细胞(microfold cell,M细胞)。M细胞基底面质膜内陷形成一较大的穹窿状凹腔,凹腔内含有一至多个淋巴细胞。M细胞下方的基膜多不完整,淋巴细胞易通过。M细胞在光镜下难分辨,只能根据其基底部是否包含淋巴细胞来推断。电镜下可见M细胞胞质很少,但有较多线粒体和丰富的囊泡。这些囊泡被认为是M细胞转运抗原物质的形式。M细胞可摄取肠腔内的抗原物质,并将其传递给下方的淋巴细胞。后者进入粘膜淋巴小结与肠系膜淋巴结内分化增殖,然后经淋细胞再循环途经大部分返回肠粘膜,并转变为浆细胞。浆细胞除产生少量免疫球蛋白G(IgG)进入循环系统外,主要产生免疫球蛋白A(IgA)。IgA能与吸收细胞基底面和侧面膜中的一种称为分泌片(sectetory piece)的镶嵌糖蛋白相结合,形成分泌性IgA(secretory IgA,sIgA)。sIgA被吸收细胞内吞入胞质,继而释入肠腔(图12-22)。sIgA可特异性地与抗原结合,从而抑制细菌增殖,中和病毒,降低抗原物质与上皮细胞的粘着与进入,保护肠粘膜。部分增殖的淋巴细胞还可经血流至其它器官如呼吸道粘膜、女性生殖道粘膜和乳腺等,发挥相似的免疫作用,使消化管免疫成为全身免疫的一部分。
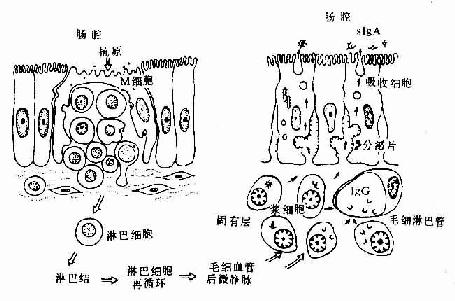
图12-22 消化管粘膜的免疫功能示意图
九、胃肠的内分泌细胞
在胃、小肠与大肠的上皮与腺体中散在着种类繁多的内分泌细胞,其中尤以胃幽门部和十二指肠上段为多。由于胃肠道粘膜的面积巨大,这些细胞的总量超过其它内分泌腺腺细胞的总和。因此,在某种意义上,胃肠是体内最大、最复杂的内分泌器官。它们分泌的多种激素统称胃肠激素(gut hormone),一方面协调胃肠道自身的运动和分泌功能,也参与调节其它器官的活动。
图12-23 小鼠肠腺内的APUD细胞 ×13200
↑基膜 (上海医科大学电镜室供图)
胃肠内分泌细胞大多单个地夹于其它上皮细胞之间,呈不甚规则的圆锥形。基底部附于基膜,并有基底侧突与邻近细胞相接触。胞质中含一些粗面内质网与高尔基复合体。细胞最显著的形态特点是底部胞质中含大量分泌颗粒,故又称基底颗粒细胞(basal granular cell)(图12-23)。分泌颗粒的大小、形状与电子密度依细胞类型而异。绝大部分细胞具有面向管腔的游离面,称开放型,游离面上有微绒毛伸出。此型细胞对管腔食物的刺激和pH变化等化学信息有较强的感受性,从而引起其内分泌活动的变化。少数细胞的顶部被相邻细胞覆盖而未露出腔面,称封闭型,主要受胃肠运动的机械刺激或其它激素的调节而改变其内分泌状态(图12-24)。分泌颗粒中含肽和(或)胺类激素,大多在细胞基底面释入固有层中的毛细血管,经血循环运送并作用于靶细胞;少数激素被释放后可直接作用于邻近细胞,以旁分泌方式调节靶细胞的生理功能。在HE染色切片上,胃肠内分泌细胞不易辩认;用铬或银盐浸染,少数种类的细胞可因其分泌颗粒具嗜铬性、嗜银性或亲银性而被显示。目前主要用免疫组织化学方法来显示这些细胞。
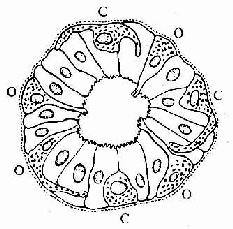
图12-24 消化管内分泌细胞模式图
示开放型(O)与封闭型(C)内分泌细胞
表12-1 胃肠内分泌细胞
| 细胞名称 | 分 布 部 位 | 分 泌 物 | |
| 胃 | 肠 | ||
| D | 胃底、幽门 | 空肠、回肠、结肠 | 生长抑素(somatostatin) |
| D1 | 胃底、幽门 | 空肠、回肠、结肠 | 血管活性肠肽(vasoactive intestinal peptide VIP) |
| EC | 胃底、幽门 | 空肠、回肠、结肠 | 5-羟色胺(5-hydroxytryptamine,5-HT)、P物质(substance P) |
| ECL | 胃底 | 组胺(histamine) | |
| G | 幽门 | 十二指肠 | 胃泌素(gastrin) |
| I | 十二指肠、空肠 | 胆囊收缩素-促胰酶素(cholecystokinin-pancreozymin,CCK-PZ) | |
| K | 空肠、回肠 | 抑胃多肽(gastric inhibitory polypeptide,GIP) | |
| L | 空肠、回肠、结肠 | 肠高血糖素(enteroglucagon) | |
| M | 空肠、回肠 | 胃肠动素(motilin) | |
| N | 回肠 | 神经降压素(neurotensin) | |
| P | 胃底、幽门 | 空肠 | 蛙皮素(bombesin) |
| PP | 胃底、幽门 | 结肠 | 胰多肽(pancreatic polypeptide) |
| S | 十二指肠、空肠 | 促胰液素(secretin) | |
目前已知 余种胃肠内分泌细胞(表12-1),其中研究得比较清楚的有:①EC细胞,数量最多,分布广泛,在胃与空肠尤其丰富。分泌的5-羟色胺可刺激平滑肌收缩,与肠的运动有关,,尚可抑制胃酸分泌,扩张血管。②ECL细胞,仅分布于胃底腺,释放的组胺主要作用于邻近的壁细胞,刺激盐酸分泌。③G细胞,主要分布于胃幽门部,分泌的胃泌素对壁细胞的泌酸功能有强烈的刺激作用。④I细胞,多见于十二指肠和空肠,产生的激素兼有促进胰外分泌部的胰酶分泌和胆囊收缩的作用,故称为胆囊收缩素-促胰酶素。⑤S细胞,亦主要分布于十二指肠和空肠,产生的促胰液素可刺激胰导管上皮细胞分泌水和碳酸氢盐,导致胰液分泌量剧增,此外还能与G细胞相拮抗,抑制胃泌素的释放和胃酸的分泌
十、消化管的血管、淋巴管和神经
(一)血管
供应胃肠的血管多走行于系膜内,动脉穿过肌层,在粘膜下层形成动脉丛。胃和大肠的粘膜下动脉丛发出许多小支进入固有层内,在腺体之间形成毛细血管网,后者汇集成粘膜下静脉丛。静脉伴同动脉穿过肌层离开管壁。小肠的粘膜下动脉丛发出两种分支,一种在肠腺间形成毛细血管网,另一种在绒毛内,紧贴上皮下方形成毛细血管网;两者均汇入粘膜下静脉丛(图12-25)。
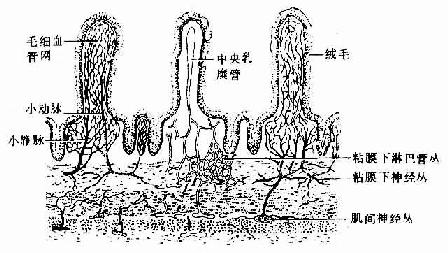
图12-25 消化管的血管、淋巴管与神经分布模式图
(二)淋巴管
胃肠粘膜固有层的腺体间有毛细淋巴管网,淋巴小结周围也有密集的淋巴管网,小肠绒毛内还有中央乳糜管。它们均汇合穿过粘膜肌层,进入粘膜下层形成淋巴管丛。淋巴管伴同血管穿过肌层离开管壁(图12-25)。
(三)神经
支配食管与胃肠的神经由三部分构成:①主要来源于交感神经节与腹腔神经节的节后纤维构成的交感神经;②迷走神经的节前纤维;③由肌间神经丛和粘膜下神经丛内的107~108个神经元及其神经纤维构成的“肠神经系统”(enteric nervce system)。交感神经与迷走神经主要伴随系膜血管进入消化管。前者直接终止于肌层与血管,后者则与肠神经系统中的运动神经元形成突触。切除交感和迷走神经后,动物的消化功能仍能进行,表明肠神经系统具有高度自主性。神经丛由神经节与无髓神经纤维构成,每个神经节含3~50个或更多的神经元。这些神经元可大致分为两型,即中间神经元与运动神经元。后者的轴突止于肌层平滑肌、粘膜肌或腺体。按所含神经递质进行分类,则有胆碱能神经元,5-羟色胺能神经元、肽能神经元等。所有神经元借神经纤维相互连接为功能统一的网络(图12-22)
第十三章 消化腺
消化腺包括分布于消化管壁内的许多小消化腺(如口腔粘膜小唾液腺、胃腺、肠腺等)和构成器官的大消化腺(唾液腺、胰腺和肝)。大消化腺是实质性器官,外包以结缔组织被膜,被膜的结缔组织伸入腺内,将腺分隔为若干叶和(或)小叶,血管、淋巴管和神经也随同进入腺内。腺分实质和间质两部分。由腺细胞组成的腺泡以及腺的导管为实质;被膜和叶间与小叶间结缔组织为间质。
大消化腺的分泌物经导管排入消化管,对食物行使化学消化作用;此外,有的腺还有内分泌或其他重要功能。
一、大唾液腺
大唾液腺有腮腺、下颌下腺、舌下腺三对,它们的导管开口于口腔。
(一)唾液腺的一般结构
唾液腺为复管泡状腺,被膜较薄,腺实质分为许多小叶,由分支的导管及末端的腺泡组成。
1.腺泡腺泡(alveoli)呈泡状或管泡状,由单层立方或锥形腺细胞组成,为腺的分泌部。腺细胞与基膜之间以及部分导管上皮与基膜之间有肌上皮细胞,细胞扁平,有突起,胞质内含有肌动蛋白微丝。肌上皮细胞的收缩有助于腺泡分泌物排出。腺泡分浆液性、粘液性和混合性三种类型(图13-1)。
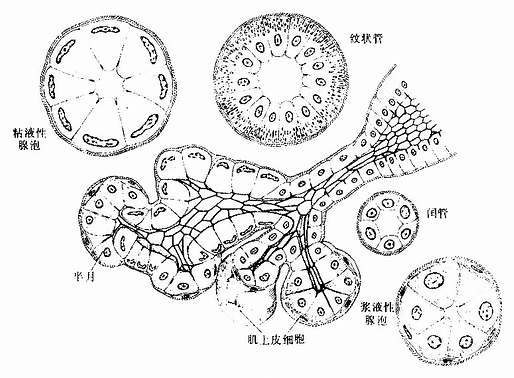
图13-1 唾液腺腺泡与导管结构模式图
(1)浆液性腺泡(serous alveolus):由浆液性腺细胞组成。在HE染色切片中,胞质染色较深。基部胞质嗜碱性较强,电镜下可见此处有较多粗面内质网和核糖体。核圆形,位于基部。顶部胞质内有较多嗜伊红的分泌颗粒(酶原颗粒,zymogen granule)浆液性腺泡分泌物较稀薄,含唾液淀粉酶。
(2)粘液性腺泡(mucous alveolus):由粘液性腺细胞组成。在HE染色切片中,胞质着色较浅,分泌颗粒不能显示。细胞核扁圆形,居细胞底部。电镜下则可见顶部胞质内有粗大的分泌颗粒(粘原颗粒,mucinogen granule)。粘液性腺泡的分泌物较粘稠,主要为粘液(糖蛋白)。
(3)混合性腺泡(mixed alveolus):由浆液性腺细胞和粘液性腺细胞共同组成。常见的形式是,腺泡主要由粘液性腺细胞组成,几个浆液性腺细胞位于腺泡的底部或附于腺泡的末端,在切片中呈半月形排列,故称半月(demilune)。半月的分泌物可经粘液性细胞间的小管释入腺泡腔内。
2.导管导管是反复分支的上皮性管道,是腺的排泄部,末端与腺泡相连。唾液腺导管可分为以下几段(图13-1)。
(1)闰管(intercalated duct):直接与腺泡相连,管径细,管壁为单层立方或单层扁平上皮。
(2)纹状管(striated duct):或称分泌管(secretory duct),与闰管相连接,管径相,管壁为单层高柱状上皮,核位居细胞顶部,胞质嗜酸性。细胞基部可见垂直纵纹,电镜下为质膜内褶和纵行排列的线粒体,此种结构使细胞基部表面积增大,便于细胞与组织液间进行水和电解质的转运。纹状管上皮细胞能主动吸收分泌物中的Na+,将k+排入管腔,并可重吸收或排出水,故可调节唾液中的电解质含量和唾液量。
(3)小叶间导管和总导管:纹状管汇合形成小叶间导管,行于小叶间结缔组织内。小叶间导管较粗,管壁为假复层柱状上皮。小叶间导管逐级汇合并增粗,最后形成一条或几条总导管开口于口腔,导管近口腔开口处渐为复层扁平上皮,与口腔上皮相连续。
(二)三种唾液腺的结构特点
1.腮腺为纯浆液性腺,闰管长,纹状管较短。分泌物含唾液淀粉酶多,粘液少。
2.下颌下腺为混合腺,浆液性腺泡多,粘液性和混合性腺泡少。闰管短,纹状管发达。分泌物含唾液演粉酶较少,粘液较多(图13-2)。
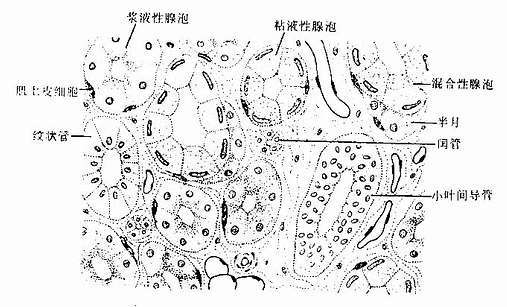
图13-2 下颌下腺
3.舌下腺为混合腺,以粘液性和混合性腺泡为主,半月较多,无闰管,纹状管也较短。分泌物以粘液为主。
(三)唾液
唾液的70%由下颌下腺分泌,25%由腮腺分泌,5%由舌下腺分泌。唾液中的水和粘液起润滑口腔作用,唾液淀粉酶可分解食物中的淀粉。唾液中还含有溶菌酶。唾液腺间质内有淋巴细胞和浆细胞,浆细胞分泌的IgA与腺细胞产生的蛋白质分泌片结合,形成分泌性IgA,随唾液排入口腔,具有免疫作用。
(四)下颌下腺分泌的生物活性多肽
近20年来,陆续从鼠等动物及人的下颌下腺发现或分离撮出近30种生物活性多肽,有的已被提纯,其分子结构也已清楚。这些多肽物质或直接分泌入血,或随唾液进入消化道再由胃肠吸收入血,对多种组织和细胞的生理活动起重要调节作用。根据多肽的不同化学性质和生理作用,可将它们分为四大类:①促细胞生长与分化的因子,如神经生长因子(NGF),表皮生长因子(EGF),内皮生长刺激因子(EGSF)、红细胞生成素(EPO)、骨髓克隆刺激因子(CSF)等。②内环境稳定因子,如肾素(renin)、激肽释放酶(kallikrein,kk)、生长抑素、胰岛素和高血糖素样物质等。③消化酶,如淀粉酶、酸性磷酸酶、核糖核酸酶等。④细胞内调节因子,如酯肽酶等。有的多肽物质已制成商品试剂,如从小鼠下颌下腺提纯的EGF和NGF广泛用于实验研究。
小鼠和大鼠出生后随着性发育成熟,下颌下腺纹状管逐渐增粗、增长和弯曲,上皮细胞顶部胞质内出现许多分泌颗粒。由导管上皮演变成的这种分泌细胞,称为颗粒曲管细胞(granular convoluted tubulecell,GCT细胞)(图13-3)。现已证实,鼠和其他一些啮齿动物下颌下腺分泌的多种生物活性多肽,主要定位于GCT细胞的分泌颗粒内;人和其他哺乳动物的下颌下腺无GCT细胞,多肽可能由纹状管或其他导管的上皮细胞产生。
小鼠下颌下腺GCT细胞的发育分化有明显的性别差异,雄鼠至性成熟时(生后60天)GCT发育快,小管长而弯曲,分支多,雌鼠的GCT则相对发育较差。雄鼠GCT细胞内的分泌颗粒及产生的多肽也较雌鼠的多。若将新生雄鼠阉割,或给雌鼠以雄激素,GCT细胞的性差则消失,表明小鼠下颌下腺GCT细胞的发育是依赖雄激素的。此外,甲状腺素和肾上腺皮质激素对GCT的发育与分化也有促进作用。
图 13-3 大鼠下颌下腺颗粒曲管细胞×400
A 表皮生长因子(EGF)免疫组织化学法显示阳性颗粒曲管细胞
B 半薄切片甲苯胺蓝染色示颗粒曲管细胞内的分泌颗粒(↑)
(上海医科大学赵培林教授供图)
二、胰腺
胰腺表面覆以薄层结缔组织被膜,结缔组织伸入腺内将实质分隔为许多小叶,但人胰腺小叶分界不明显。腺实质由外分泌部和内分泌部两部分组成。外分泌部分泌胰液,含有多种消化酶,经导管排入十二指肠,在食物消化中起重要作用。内分泌部是散在于外分泌部之间的细胞团,称胰岛,它分泌的激素进入血液或淋巴,主要参与调节碳水化合物的代谢(图13-4)。
图13-4 人胰腺 HE×400
(一)外分泌部
外分泌部为浆液性复管泡状腺。小叶间结缔组织中有导管、血管、淋巴管和神经。
1.腺泡腺细胞呈锥体形,细胞底部位于基膜上,基膜与腺细胞之间无肌上皮细胞。腺细胞具有合成蛋白质的结构特点,基部胞质内含有丰富的粗面内质网和核糖体,故在HE切片上,此处胞质呈嗜碱性。细胞核圆形,位近基底部。细胞合成的蛋白质(酶的前体),经高尔基复合体组装于分泌颗粒(酶原颗粒)内。颗粒聚集于细胞顶部(图13-5),其数量因细胞功能状态不同而异,饥饿时细胞内分泌颗粒增多;进食后细胞释放分泌物,颗粒减少。

图13-5 小鼠胰腺细胞电镜像×12000
S分泌颗粒,RER粗面内质网,M线粒体,Lu腺腔,TJ紧密连接
(上海医科大学电镜室供图)
胰腺腺泡腔面还可见一些较小的扁平或立方形细胞,称泡心细胞(centroacinar cell),细胞质染色淡,核圆形或卵圆形。泡心细胞是延伸入腺泡腔内的闰管上皮细胞(图13-6)。
图13-6 胰腺腺泡模式图
示泡心细胞与闰管
2.导管腺泡以泡心细胞与闰管相连,胰腺的闰管长,无纹状管,闰管逐渐汇合形成小叶内导管。小叶内导管在小叶间结缔组织内汇合成小叶间导管,后者再汇合成一条主导管,贯穿胰腺全长,在胰头部与胆总管汇合,开口于十二指肠乳头。闰管腔小,为单层扁平或立方上皮,细胞结构与泡心细胞相同。从小叶内导管至主导管,管腔渐增大,单层立方皮逐渐变为单层柱状,主导管为单层高柱状上皮,上皮内可见杯状细胞。
3.胰液胰液为碱性液体,Na+、K+、Ca2+、Mg2+、HCO-3、HPO42+等,其中以碳酸氢盐含量最高,胰液中的多种消化酶由腺泡细胞分泌,如胰蛋白酶、胰糜蛋白酶、多肽酶、胰淀粉酶、胰脂肪酶、胆固醇脂酶、DNA酶、RNA酶等,它们分别消化食物中的各种营养成分。腺泡细胞分泌的酶有的是以酶原形式排出,如胰蛋白酶原和胰糜蛋白酶原,它们排入小肠后被肠肽酶激活成为有活性酶。腺细胞还分泌一种胰蛋白酶抑制因子,能防止胰蛋白酶原在胰腺内致活,若这种内在机制失调或某些致病因素使胰蛋白酶原在胰腺内激活,可致胰腺组织分解破坏,导致急性胰腺炎。
胰腺的分泌受神经和体液的调节。交感和副交感神经随血管进入胰腺,其末梢分布于腺泡,副交感神经兴奋促进胰酶分泌,交感神经兴奋使分泌减少。消化管内分泌细胞分泌的某些激素也参与对胰腺分泌的调节,如促胰液素主要作用于小导管上皮细胞,使其分泌大量水和碳酸氢盐,胰液量增多;胆囊收缩素-促胰酶素可促进腺泡细胞分泌大量消化酶,但胰液量不增多;胃泌素也有促进胰酶分泌作用。
(二)内分泌部
胰岛(pancreas islet)是由内分泌细胞组成的细胞团,分布于腺泡之间在(图13-4)。成人胰腺约100万个胰岛,约占胰腺体积的1.5%左右,胰尾部的胰岛较多。胰岛大小不一,小的仅由10多个细胞组成,大的有数百个细胞,也可见单个细胞散在于腺泡之间,胰岛细胞呈团索状分布,细胞间有丰富的有孔型毛细血管,细胞释放激素入血。人胰岛主要有A、B、D、PP四种细胞,某些动物的胰岛内还有D1细胞、C细胞等,细胞之间有紧密连接和缝隙连接。HE染色切片中不易区分各种细胞,一些特殊染色法可显示A、B、D三种细胞。近年多用电镜和免疫细胞化学法区分和研究胰岛各种细胞(图13-7,13-8)。
1.A细胞约占胰岛细胞总数的20%,细胞体积较大,多分布在胰岛周边部(图13-7)。电镜下可见A细胞内的分泌颗粒较大,呈圆形或卵圆形,颗粒内的致密核芯常偏于一侧,膜与核芯之间在可见一新月形的帽样间隙,内含密度较低的无定形物(图13-8)。A细胞分泌高血糖素(glucagon),故又称高血糖素细胞。高血糖是小分子多肽,它的作用是促进肝细胞内的糖原分解为葡萄糖,并抑制糖原合成,故使血糖升高。
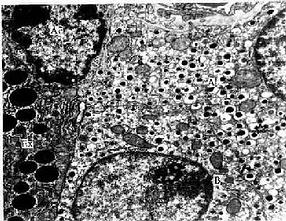
图13-8
2.B细胞数量较多,约占胰岛细胞总数的70%,主要位于胰岛的中央部(图13-7)。B细胞内的分泌颗粒大小不一,其结构因动物种属而异,人和鼠等的B细胞颗粒内常见杆状或不规则形晶状致密核芯,核芯与膜之间有较宽的清亮间隙(图13-8)。B细胞分泌胰岛素(insulin),故又称胰岛素细胞。胰岛素是含51个氨基酸的多肽,主要作用是促进细胞吸收血液内的葡萄糖作为细胞代谢的主要能量来源,同时也促进肝细胞将葡萄糖合成糖原或转化为脂肪。故胰岛素的作用与高血糖素相反,可使血溏降低。这两种激素的协同作用,使血糖水平保持稳定。若胰岛素的作用与高血糖素相反,可使血糖降低。这两种激素的协同作用,使血糖水平保持稳定。若胰岛发生病变,B细胞退化,胰岛素分泌不足,可致血溏升高,并从尿中排出,即为糖尿病。胰岛B细胞肿瘤或细胞功能亢进,则胰岛素分泌过多,可导致低血糖症。
3.D细胞数量少,约占胰岛细胞总数的5%,D细胞散在于A、B细胞之间,并与A、B细胞紧密相贴(图13-7)细胞间有缝隙连接。D细胞内的分泌颗粒较大,圆形或卵圆形,内容物呈细颗粒状,电子密度低。D细胞分泌生长抑素(somato statin),它以旁分泌方式或经缝隙连接直接作用于邻近的A细胞、B细胞或PP细胞,抑制这些细胞的分泌功能。生长抑素也可进入血循环对其他细胞功能起调节作用。
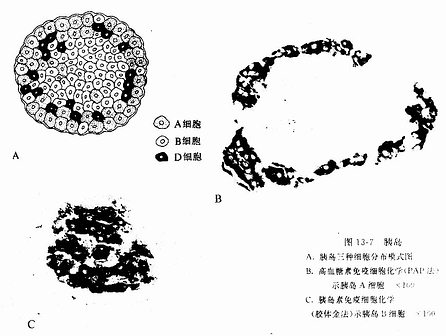
图13-7 胰岛
A.胰岛三种细胞分布模式图
B.高血糖素免疫细胞化学(PAP法)示胰岛A细胞 ×100
C胰岛素免疫细胞化学(胶体金法)示胰岛B细胞 ×100
4.PP细胞数量很少,除存在于胰岛内,还可见于外分泌部的导管上皮内及腺泡细胞间,胞质内也有分泌颗粒。PP细胞分泌胰多肽(pancreatic polypeptide),它有抑制胃肠运动和胰液分泌以及胆囊收缩的作用。
除以上几种细胞外,某些动物的胰岛内还发现有分泌血管活性肠肽(VIP)的D1细胞,分泌胃泌素的G细胞。有的低等脊椎动物胰岛内还存在一种无分泌颗粒的细胞,称为C细胞,它是一种未分化细胞,可分化为A、B、D等细胞。胰岛细胞中除B细胞外,其他几种细胞也见于胃肠粘膜内,它们的结构也相似,都合成和分泌肽类或胺类物质,故认为胰岛细胞也属APUD系统,并将胃、肠、胰这些性质类似的内分泌细胞归纳称为胃肠胰内分泌系统(gastro-entero-pancreatic endocrinesystem),简称GEP系统。
胰岛内分泌功能也受神经系统的调节,胰岛内可见交感和副交感神经末梢。交感神经兴奋,促进A细胞分泌,使血糖升高;副交感神经兴奋,促使B细胞分泌,使血糖降低。
三、肝
肝是人体最大的腺,它产生的胆汁经胆管输入十二指肠,参与脂类物质的消化,故通常将肝列为消化腺。但肝的结构和功能与其他消化腺有很大不同,例如:肝细胞的排列分布特殊,不形成类似胰腺和唾液腺的腺泡;肝内有丰富的血窦,肝动脉血以及由胃肠、胰、脾的静脉汇合而成的门静脉血均输入肝血窦内;肝细胞既产生胆汁排入胆管,又合成多种蛋白质和脂类物质直接分泌入血;由胃肠吸收的物质除脂质外全部经门静脉输入肝内,在肝细胞内进行合成、分解、转化、贮存。因此,肝又是进行物质代谢的重要器官。此外,肝内还有大量巨噬细胞,它能清除从胃肠进入机体的微生物等有害物。
肝表面覆以致密结缔组织被膜,并富含弹性纤维,被膜表面大部有浆膜覆盖。肝门处的结缔组织随门静脉、肝动脉和肝管的分支伸入肝实质,将实质分隔成许多肝小叶。
(一)肝小叶
肝小叶(hepatic lobule)是肝的基本结构单位,呈多角棱柱体,长约2nm,宽约1mm ,成人肝约有50万~100万个肝小叶(图13-9)。小叶之间以少量结缔组织分隔,有的动物(如猪)的肝小叶分界明显,而人的肝小叶间结缔组织很少,相邻肝小叶常连成一片,分界不清(图13-10)。肝小叶中央有一条沿其长轴走行的中央静脉(central vein),中央静脉周围是大致呈放射状排列的肝细胞和肝血窦。
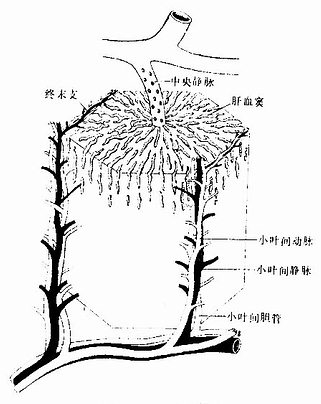
图13-9 肝小叶模式图
图13-10 肝小叶横切图
正常肝内的结缔组织仅占肝体积的4%左右,主要分布在肝小叶之间,肝小叶则占肝体积96%。肝细胞是构成肝小叶的主要成分,约占肝小叶体积的75%。肝细胞以中央静脉为中心单行排列成板状,称为肝板(hepatic plate)。肝板凹凸不平,大致呈放射状,相邻肝板吻合连接,形成迷路样结构。肝板之羊为肝血窦,血窦经肝板上的孔互相通连,形成网状管道(图13-11)。在切片中,肝板的断面呈索状,称肝索(hepatic cord)(图13-12)。肝细胞相邻面的质膜局部凹陷,形成微细的小管,称胆小管,胆小管在肝板内也相互连接成网(图13-11)。
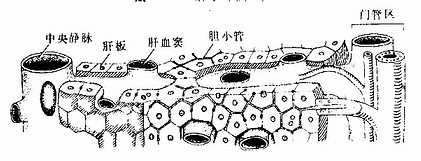
图13-11 肝板、肝血窦与胆小管关系模式图
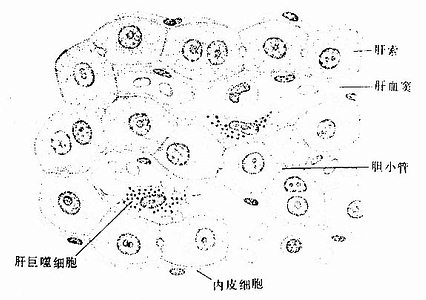
图13-12 肝索与肝血窦
1.肝细胞肝细胞(hepatocyte)体积较大,直径20~30μm,呈多面体形。肝细胞有三种不同的功能面:血窦面、细胞连接面和胆小管面。血窦面和胆小管面有发达的微绒毛,使细胞表面积增大。相邻肝细胞之间的连接面有紧密连接、桥粒和缝隙连接等结构(图13-13)。
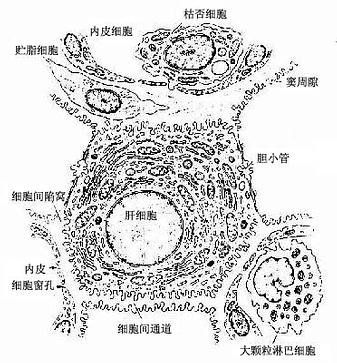
图13-13 肝细胞、肝血窦、窦周隙及胆小管的关系图解

图13-14 大鼠肝细胞电镜像 ×16100
N细胞核,RER粗面内质网,M线粒体,G高尔基复合体,Ly溶酶体,BC胆小管
(上海医科大学电镜室供图)
肝细胞核大而圆,居中央,常染色质丰富丰色浅,核膜清楚,核仁1至数个。部分肝细胞(约25%)有双核,有的肝细胞的核体积较大,为多倍体核。肝细胞核DNA含量分析,正常成体肝细胞以四倍体核占多数,约占肝细胞总数的70%左右,还有少量八倍体肝细胞。一般认为,双核肝细胞和多倍体肝细胞的功能比较活跃。肝细胞是一种高度分化并具有多种功能的细胞,胞质内各种细胞器丰富而发达,并含有糖原,脂滴等内涵物(图13-14)。细胞器和内涵物的含量与分布常因细胞的功能状况或饮食变化而变动。在HE染色切片中,肝细胞质呈嗜酸性,并含有散在的嗜碱性物质,它是由粗面内质网组成的结构。
线粒体:每个肝细胞约有2000个左右,遍布于胞质内,为肝细胞的功能活动不断提供能量。
粗面内质网(RER):成群分布于胞质内,是肝细胞合成多种蛋白质的基地。血浆中的白蛋白、纤维蛋白原、凝血酶原、脂蛋白、补体蛋白以及许多载体蛋白等都是在RER的核糖体上合成。然后经内质网池转移到高尔基复合体,组装形成运输小泡或直接经胞质的基质,从血窦面排出。
滑面内质网(SER):广泛分布于胞质内,SER膜上有多种酶系分布,如氧化还原酶、水解酶、转移酶、合成酶等。肝细胞摄取的各种有机物可在SER进行连续的合成、分解、结合和转化等反应,故肝细胞SER有多种功能,如胆汁合成和胆红素、脂类与激素的代谢以及生物转化等。胆汁中的重要成分胆酸,是在SER的酶作用下由胆固醇转变而成。肝细胞从血液中摄取的脂肪酸,是在SER的酶作用下由胆固醇转变而成。肝细胞从血液中摄取的胆红素,在SER上的葡萄糖酸转移酶的作用下转变为水溶性的结合胆红素,经胆汁排出。肝细胞摄取的脂肪酸,在SER上再度酯化为甘油三脂,并与蛋白质结合形成极低密度脂蛋白(VLDL)。多种激素尤其是类固醇激素的灭活,也是在SER上进行的。机体代谢过程中产生的某些有毒产物或从肠道吸收入肝的有害物质(药物、腐败产物等),经SER的酶氧化、还原、水解、结合等生物转化作用,使其毒性减弱或水溶性增强而易于排泄。若经常服用某些药物(如巴比妥等),可促使肝细胞的SER增生,酶活性增强,机体对这些药物的耐受性也增强。
高尔基复合体:每个肝细胞约有50个。高尔基复合体参与肝细胞的分泌活动,RER合成的蛋白质转移到高尔基复合体进行加工或贮存,然后经运输小泡由血窦面排出。肝细胞近胆小管处的高尔基复合体尤为发达,与胆小管面质膜的更新及胆汁的排泌有关。
溶酶体:数量和大小不一。肝细胞吞饮的物质、退化的细胞或细胞内过剩物质常与溶酶体融合,被水解酶消化分解,或滞留在溶酶体内。溶酶体的这种作用,对肝细胞结构的不断更新和细胞正常功能的维持十分重要。
过氧化物酶体(微体):为圆形小体,大不不一,人肝细胞微体呈均质状结构,有的动物(鼠)肝细胞微体有致密核芯。微体内主要含过氧化氢酶和过氧化物酶,它们可将细胞代谢产生的过氧化氢还原为水,以消除过氧化氢对细胞的毒性作用。微体内还有黄嘌呤氧氧化酶等,它们能将核酸的代谢产物嘌呤氧化为尿酸,由尿中排出。鼠肝细胞微体内的核芯含尿酸氧化酶,人肝细胞微体内无核芯,也不含尿酸氧化酶。
内涵物:肝细胞内有糖原、脂滴、色素等内涵物,它们的含量因机体的生理和病理状况的不同而异。进食后糖原增多,饥饿时糖原减少。正常肝细胞内脂滴少,肝病时脂滴多。肝细胞胞质的色素有胆红素、含铁血黄素、脂褐素等,它们也可以贮存在溶酶体内,脂褐素的含量随机体年龄的增长而增多。
2.肝血窦肝血窦(hepatic sinusoid)位于肝板之间,互相吻合成网状管道。血窦腔大而不规则,血液从肝小叶的周边经血窦流向中央,汇入中央静脉。血窦壁由内皮细胞组成,窦腔内有定居于肝内的巨噬细胞和大颗粒淋巴细胞。
内皮细胞:内皮细胞是构成肝血窦壁的主要成分,细胞扁而薄,含核的部分凸向窦腔。扁薄的胞质有许多大小不等的窗孔,小者直径0.1μm,大者直径达1~2μm,小窗孔常聚集成群,形成筛样结构,孔上无隔膜(图13-15)。胞质内细胞器较少,但吞饮小泡较多。内皮外无基膜,伏见散在的网状纤维(图13-13)。内皮细胞间常有0.1~0.5μm宽的间隙。因此肝血窦通透性大,血浆中除乳糜微粒外,其他大分子物质均可自由通过,肝细胞产生的脂蛋白等也可通过血窦壁进入血窦,这有利于肝细胞摄取血浆物质和排泌其分泌产物。
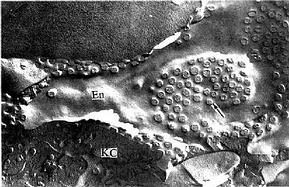
图13-15豚鼠肝冷冻蚀刻复型电镜像 示血窦内皮细胞孔(↑)
En内皮细胞,KC枯否细胞
(河北医学院王仲涛教授供图)
肝巨噬细胞:又称枯否细胞(Kupffer cell),是定居在肝内的巨噬细胞。细胞形态不规则,有许多板状或丝状伪足,细胞表面有许多皱褶和微绒毛,并有较厚的糖衣。细胞常以其伪足附于内皮细胞上或穿过内皮细胞窗孔或细胞间隙伸入窦周隙内(图13-16)。胞质内溶酶体甚多,并常见吞噬体和残余体。肝巨噬细胞来自血液单核细胞,是体内固定型巨噬细胞中最大的细胞群体。肝巨噬细胞具有变形运动和活跃的吞饮与吞噬能力,构成机体一道重要防线,尤其在吞噬清除从胃肠进入门静脉的细菌、病毒和异物方面起关键作用。肝巨噬细胞还可监视、抑制和杀伤体内的肿瘤细胞,尤其是肝癌细胞,并能吞噬和清除衰老、破碎的红细胞和血小板等。此外,肝巨噬细胞还有处理和传递抗原、诱导T细胞增殖及参与调节机体免疫应答等作用。
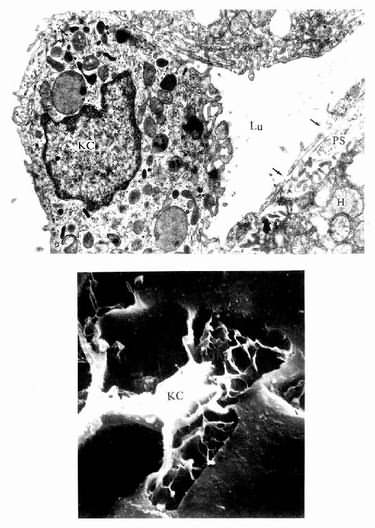
图13-16 肝巨噬细胞(KC)电镜像
上图 大鼠肝 ×24000(上海医科大学电镜室供图)
Lu血窦腔,H肝细胞,PS窦周隙,↑内皮细胞孔
下图足月胎儿冷冻割断扫描电镜像
(河北医学院吴淑兰教授供图)
大颗粒淋巴细胞:肝内的大颗粒淋巴细胞(large granular lymphocyte,,简称LGL),是近10年来被确认的,最初称为pit细胞,并被误认为是一种内分泌细胞,以后的研究证实它是一种对肿瘤细胞等有自然杀伤作用的大颗粒淋巴细胞。LGL一般较牢固地附着在内皮细胞或枯否细胞表面,在门静脉高压灌注时,LGL可游离下来。细胞近圆形,表面有短小突起,细胞核较大,一侧有齿状凹陷,偏居于细胞一侧,核膜下染色质致密。在核凹陷处胞质内有高尔基复合体和中心体,一侧胞质内有少量线粒体及一些圆形或椭圆形的膜包颗粒,直径0.3~0.6μm,颗粒具溶酶体性质(图13-13),LGL具有NK细胞活性和表面标志,它对肿瘤细胞和病毒感染的肝细胞有直接杀伤作用。因此认为,LGL也是构成肝防御屏障的重要组成部分。
3.窦周隙和贮脂细胞血窦内皮细胞与肝细胞之间有宽约0.4μm的狭小间隙,称窦周隙(perisinusoidal space)或Disse隙(图13-13,13-16)。血窦内的血浆成分经内皮细胞窗孔进入窦周隙,故窦周隙内充满血浆,肝细胞血窦面的微绒毛伸入窦周隙,浸于血浆之中。肝小叶的窦周隙也是互相通连网状通道。它是肝细胞与血液之间进行物质交换的场所。扫描电镜观察,有的肝细胞相邻面之间有贯通的细胞间通道,并与窦周隙相通,表面也有许多微绒毛,使肝细胞有更广大的表面与血浆进行物质交换(图13-13)
窦周隙内有散在的网状纤维,起支持血窦内皮的作用;还有一种散在的细胞称贮脂细胞(fat-storing cell)或称Ito细胞,细胞形态不规则,有突起,附于内皮细胞外表面及肝细胞表面。细胞周围常见网状纤维(图13-13)。HE染色切片中不易辨认贮脂细胞,用氯化金浸染或免疫细胞化学可显示。电镜下,贮脂细胞的结构特征是胞质内含有许多大小不一的脂滴,粗面内质网和高尔基复合体也较发达(图13-17)。实验证明,贮脂细胞的脂滴内含有维生素A,当给动物以大量维生素A后,贮脂细胞数及其脂滴显著增多,细胞体积增大,脂滴内贮有维生素A。贮脂细胞还有产生胶原的功能,在肝纤维化病变中,贮脂细胞增多,结构类似于成纤维细胞,并产生大量网状纤维。故认为贮脂细胞是一种特殊的成纤维细胞,它在肝正常微环境中,细胞内形成脂滴,以摄取和贮存维生素A功能为主,而合成胶原功能表达受抑制;在病理状况下,贮脂细胞增多并转化为成纤维细胞,合成胶原的功能增强,与肝纤维增生性病变的发生有关。
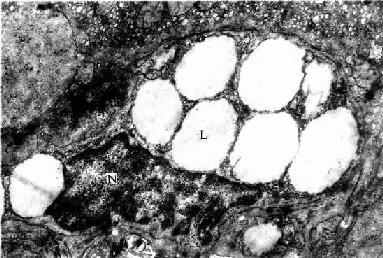
图13-17 人肝贮脂细胞电镜像 ×16000
N贮脂细胞核,L脂滴
(上海医科大学电镜室供图)
4.胆小管胆小管(bile canaliculi)是相邻两个肝细胞之间局部胞凹陷形成的微细管道,直径0.5~1.0μm,用银染法或ATP酶组化染色法可清楚显示。它们在肝板内连接成网格状管道(图13-18),电镜下观察,胆小管腔面有肝细胞形成的微绒毛突入腔内,胆小管周围的肝细胞膜形成紧密连接、桥粒等连接复合体封闭胆小管(图13-13,13-19,13-20)。正常情况下,肝细胞分泌的胆汁排入胆小管,胆汁不会从胆小管溢出至窦周隙;当肝细胞发生变性、坏死或胆道堵塞内压增大时,胆小管的正常结构被破坏,胆汁则溢入窦周隙,进而进入血窦,出现黄疸。
图13-18 兔肝硝酸银浸染示胆小管 ×320
CV 中央静脉
(二)肝门管区
从肝门进出的门静脉、肝动脉和肝管,在肝内反复分支,伴行于小叶间结缔组织内(图13-9)。在肝切片中,肝小叶周围的角缘处,可见较多的结缔组织,其中含有上述三种伴行管道的断面,称为门管区(portal area)。每个肝小叶的周围一般有3~4个门管区,门管区内主要有小叶间静脉、小叶间动脉和小叶间胆管,此外还有淋巴管和神经纤维(图13-21)。
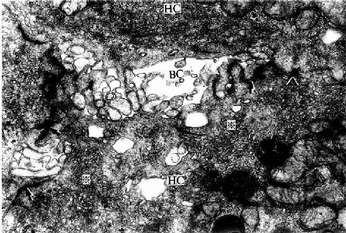
图13-19 大鼠肝电镜像示胆小管 ×30000
BC胆小管,HC肝细胞,↑紧密连接,(![]() )桥粒,
)桥粒,
※高尔基复合体
(上海医科大学电镜室供图)
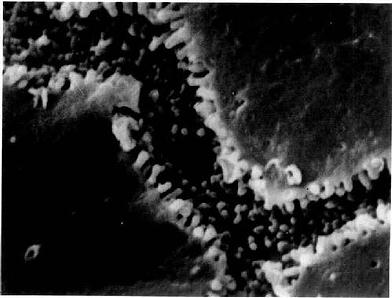
图13-20 大鼠肝冷冻割断扫描电镜像示胆小管
(河北医学院应国华教授供图)
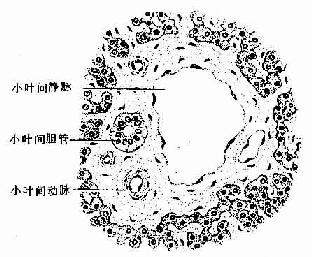
图13-21 肝门管区
小叶间静脉:是门静脉的分支,管腔较大而不规则,壁薄,内皮外仅有少量散在的平滑肌。
小叶间动脉:是肝动脉的分支,管径较细,腔较小,管壁相对较厚,内皮外有几层环行平滑肌。
小叶间胆管:是肝管的分支,管壁由单层立方或低柱状上皮构成。
(三)肝内血液循环
进入肝的血管有门静脉和肝动脉,故肝的血供丰富。门静脉是肝的功能血管,将从胃肠吸收的物质输入肝内。门静脉在肝门处分为左右两支,分别进入肝左、右叶,继而在肝小叶间反复分支,形成小叶间静脉。小叶间静脉分出小支,称终末门微静脉(terminal portal venule),行于相邻两个肝小叶之间。终末门微静脉的分支与血窦相连,将门静脉血输入肝小叶内。肝动脉血富含氧,是肝的营养血管。肝动脉的分支与门静脉的分支伴行,依次分为小叶间动脉和终末肝微动脉(terminal hepatic arteriole),最后也通入血窦。小叶间动脉还分出小支,供应被膜、间质和胆管。因此,肝血窦内含有门静脉和肝动脉的混合血液。肝血窦的血液,从小叶周边流向中央,汇入中央静脉。中央静脉的内皮外无平滑肌,仅有少量结缔组织。若干中央静脉汇合成小叶下静脉,它单独行于小叶间结缔组织内,管径较大,壁较厚。小叶下静脉进而汇合成2~3支肝静,出肝后入下腔静脉。
(四)肝内胆汁排出途径
胆小管内的胆汁从肝小叶的中央流向周边。胆小管于小叶边缘处汇集成若干短小的管道,称闰管或Hering管。闰管较细,上皮由立方细胞组成,细胞着色浅,胞质内的细胞器较少。闰管与小叶间胆管相连,小叶间胆管向肝门方向汇集,最后形成左、右肝管出肝。
(五)肝的淋巴和神经
肝产生大量淋巴,胸导管内的淋巴有25%~50%来自肝。肝淋巴管分布于被膜内和小叶间管道周围。肝小叶内无淋巴管。肝的淋巴主要来自窦周隙的血浆。窦周隙的血浆从小叶中央流向周边,在小叶边缘沿血管周围间隙流至小叶间结缔组织内,继而被吸收入淋巴管,形成淋巴,故肝淋巴富含蛋白质。当肝细胞坏死或胆道阻塞时,胆汁溢入窦周隙,肝淋巴也含胆汁成分。
交感和副交感神经纤维随血管入肝并分支,在门管区的血管周形成神经丛,神经末梢穿入管壁内终止于平滑肌细胞,调节血管的舒缩及肝内血流量。在某些动物还发现部分肾上腺素能神经纤维穿入肝小叶,行于窦周隙内,其终末附于肝细胞和贮脂细胞上,可能参与调节这些细胞的功能活动。此外,肝内也有感觉神经末梢,主要分布在被膜和小叶间结缔组织内,司痛觉。
(六)门管小叶和肝腺泡
以中央静脉为中心的肝小叶称为经典肝小叶(classic lobule),它作为肝的基本结构单位至今仍习惯应用。此外,还有门管小叶和肝腺泡两种肝结构单位的概念(图13-22)。
图13-22 肝小叶、门管小叶与肝腺泡的关系图解
1.门管小叶有人认为肝结构单位也应与一般外分泌腺一样以导管为中心,门管小叶(portal lobule)是以门管区内的胆管为中心的三角形柱状体,三个角缘处为相邻肝小叶的中央静脉(图13-22)。门管小叶内的胆汁从周边流向中央,汇入小叶中央的胆管(即前述的小叶间胆管)。故门管小叶的概念是强调肝的外分泌性质。
2.肝腺泡肝腺泡(hepatic acinus)是肝结构单位的一种较新的概念。肝细胞是行使肝功能的主要成分。肝细胞的代谢活动与肝内血循环关系密切。肝腺泡是应用肝血管灌注法,根据肝细胞与肝内微循环血流的关系而建立的。肝腺泡的体积较小,立体形态似橄榄,平面呈卵圆形。它以门管区血管发出的终末门微静脉和终末肝微动脉及胆管分支为中轴,两端以邻近的两个中央静脉为界(图13-22)。故一个肝腺泡是由相邻两个肝小叶各1/6部分组成的,其体积约为肝小叶的1/3。每个肝腺泡接受一个终末血管(门静脉系和肝动脉系)的血供,因而它是以微循环为基础的肝最小结构单位。
肝腺泡内的血流从中轴单向性地流向两端的中央静脉,根据血流方向及肝细胞获得血供的先后优劣的微环境差异,将肝腺泡分为三个带(图13-22):①近中轴血管的部分为Ⅰ带,肝细胞优先获得富于氧和营养成分的血供,细胞代谢活跃,再生能力强;②Ⅰ带的外侧为Ⅱ带,肝细胞营养条件次于Ⅰ带;③近中央静脉的腺泡两端部分为Ⅲ带,肝细胞营养条件较差,细胞再生能力也较弱,易受药物和有毒物质的损害。不良、酒精中毒、药物中毒或病毒性肝炎时,常首先起Ⅲ带肝细胞变性坏死。肝腺泡概念与肝的病理变化有关,故有一定实际意义。
(七)肝细胞的异质性
近些年通过肝细胞超威结构形态计量和生物化学的深入研究,证明肝小叶内的肝细胞有结构和功能的梯度差异。这种差异主要取决于肝小叶内血流动力以及氧和营养供应的差别,即肝细胞所处的微环境的差异。自肝腺泡的概念被肯定后,肝细胞异质性问题也渐被证实并受到重视。如大鼠肝腺泡Ⅰ带肝细胞的线粒体总体积比Ⅲ带的大,Ⅲ带肝细胞的滑面内质网总面积较Ⅰ带大,Ⅰ带肝细胞的吞饮活动较Ⅲ带的强等。各带肝细胞还表现一定生化功能的异质性,如物质的摄取、合成和代谢以及生物转化和胆汗分泌等方面。肝细胞从血窦摄取物质一般是从肝腺泡Ⅰ带至Ⅲ带递减。Ⅰ带肝细胞以糖原合成和葡萄糖产生为主,Ⅲ带肝细胞则以葡萄糖的利用为主。巴比妥诱导后的细胞色素P450反应主要在Ⅲ带肝细胞,Ⅲ带肝细胞中的葡萄糖醛酸转移酶活性也较Ⅰ带高5倍,而硫化结合反应的酶活性则Ⅰ带肝细胞较明显。Ⅰ带和Ⅱ带肝细胞主要参与胆酸的转运和分泌胆盐依赖性胆汁;Ⅲ带肝细胞则主要分泌不依赖胆盐的胆汗,胆盐的转运作用较弱。Ⅰ带和Ⅱ带肝细胞分泌的胆汁量较Ⅲ带的多。
除肝细胞的异质外,肝腺泡内的其他成分也表现一定的差异。如肝腺泡Ⅰ带的血窦窄而弯曲,表面积与腔容积之比较大,内皮细胞的窗孔也较大,故便于物质交换;Ⅲ带的血窦较直而宽,内皮细胞的窗孔小,血流易入中央静脉。肝腺泡Ⅰ带内的枯否细胞体积较大,数量较多,占肝内枯否细胞总数的43%,常首先摄进入肝血窦中的内源性或外源性异物;肝腺泡Ⅱ带和Ⅲ带内的枯否细胞数较少。肝腺泡Ⅰ带的贮脂细胞较多,细胞内含脂滴多;Ⅲ带的贮脂细胞较少,含脂滴也少。
(八)肝的再生
正常成体的肝细胞是一种长寿命细胞,极少见分裂相。但在肝受损害后,尤其在肝部分切除后,残余肝细胞迅速出现快速活跃的分裂增殖,并呈现明显的规律性。如大鼠肝被切除3/4后15~18小时,即以四倍体肝细胞为主启动增殖周期,术后24小时出现S期和G2期高峰,术后36小时出现分裂高峰。术后2天内大多数肝细胞均至少分裂一次,此后肝细胞继续分裂增殖,直至术后5~7天肝恢复正常体积,肝细胞分裂也停止。肝病患者施行大部或部分肝切除后也有再生能力,但因病变情况而异,一般可在半年内恢复正常肝体积,肝具有如此强大的再生潜能,其机理虽已有许多研究,但迄今还不完全清楚。目前已知,肝再生受肝内外诸多因子的调控,包括肝细胞增殖刺激因子、肝细胞增殖抑制因子和激素类辅助因子三大类。肝细胞增殖刺激因子有数种,如表皮生长因子(EGF)、转化生长因子α(TGFα,肝大部切除后不久由新生肝细胞产生)、肝刺激物质(HSS,由再生肝产生)、肝细胞生长因子(HGF,由肺、肾、血小板等及受损害的肝产生)等。肝细胞增殖抑制因子也有几种,如转化生长因子β(TGFβ,由血小板和肝血窦内皮细胞等产生)、肝抑素(hepatic chalone),由正常肝细胞产生)等。激素类辅助因子,如胰岛素、高血糖素、生长激素等。在肝受损害或部分切除后,肝外和(或)肝内产生这些因子的量发生变化。它们通过肝细胞相应的受体作用于肝细胞,使肝细胞膜结构和代谢活动发生变化,启动和促进或抑制肝细胞的增殖。尽管上述因子的作用机理及其相互关系还不完全清楚,但它们协同调节和控制肝再生过程的事实已基本肯定。
四、胆囊与胆管
(一)胆囊
胆囊分底、体、颈三部,颈部连胆囊管。胆囊壁由粘膜、肌层和外膜三层组成。粘膜有发达的皱襞。胆囊收缩排空时,皱襞高大而分支;胆囊充盈时,皱臂减少变矮。粘膜上皮为单层柱状。细胞游离面有许多微绒毛,胞质内线粒体和粗面内质网较发达,顶部胞质内可见少量粘液颗粒。固有层为薄层结缔组织,有较丰富的血管、淋巴管和弹性纤维。皱壁之间的上皮常向固有层内延伸,形成深陷的粘膜窦。类似粘液腺,可分泌粘液。肌层较薄,肌纤维排列不甚规则,有环行、斜行、纵行等。外膜较厚,为疏松结缔组织,含血管、淋巴管和神经等,外膜表面大部覆以浆膜(图13-23)
图13-23 胆囊
胆囊管的粘膜有许多螺旋形皱襞,粘膜的单层柱状上皮内散在少量杯状细胞。固有层内有粘液腺,肌层较厚,以环行为主。
胆囊的功能是贮存和浓缩胆汁。肝产生的胆汁经肝管排出,一般先在胆囊内贮存,胆囊腔的容积约40~70ml。上皮细胞吸收胆汁中的水和无机盐(主要是Na+),经细胞侧面的质膜转运至上皮细胞间隙内,间隙的宽度可因吸收液体的量而变化,吸收的水和无机盐通过基膜进入固有层的血管和淋巴管内。胆囊的收缩排空受激素的调节,进食后尤其在高脂肪食物后,小肠内分泌细胞分泌胆囊收缩素,经血流至胆囊,刺激胆囊肌层收缩,排出胆汗。
(二)胆管
近肝门处的胆管壁渐有平滑肌。胆管与胆总管的管壁较厚,由粘膜、肌层和外膜组成。胆总管粘膜的上皮为单层柱状,有杯状细胞,固有层内有粘液腺。肌层平滑肌呈斜行和纵行肌束,较分散。外膜为疏松结缔组织。胆总管的下端与胰管汇合之前,环行平滑肌增厚,形成发达的胆总管括约肌(或称Boyden括约肌)。胆总管与胰管汇合穿入十二指肠壁,局部扩大形成肝胰壶腹(或称Vater壶腹),此处的环行平滑肌增厚,形成壶腹括约肌(或称Oddi括约肌)。这些括约肌的舒缩作用,控制胆汗和胰液的排出。胆总管括约肌的收缩,可阻止胆汁流出,使胆汁贮入胆囊;进食后,胆总管括约肌和壶腹括约肌松弛,胆汁输入十二指肠。倘若壶腹括约肌收缩过强,可使胆汁逆流入胰腺,引起胰腺炎。
第十四章 呼吸系统
呼吸系统包括鼻、咽、喉、气管、支气管和肺等器官。从气管至肺内的肺泡,是连续而反复分支的管道系统。吸呼系统可分为导气部和呼吸部。导气部从鼻腔开始直至肺内的终末细支气管,无气体交换功能,但具有保持气道畅通和净化吸入空气的重要作用。鼻还有嗅觉功能,鼻和喉等又与发音有关。呼吸部是从肺内的呼吸细支气管开始直至终端的肺泡,这部分管道都有肺泡,行使气体交换功能。此外,肺还参与机体多种物质的合成和代谢功能 。
一、鼻腔
鼻以软骨和骨构成支架,表面的皮肤较厚,皮脂腺和汗腺较发达。为痤疮和疖的好发部位。鼻腔内面覆以粘膜,粘膜下方为软骨、骨或骨骼肌。鼻粘膜分前庭部、呼吸部和嗅部三部分。
(一)前庭部
前庭部(vestibular region)是邻近外鼻孔的部分。粘膜表面为复层扁平皮上皮,近外鼻孔处为角化型上皮,其余为未角化上皮。固有层为致密结缔组织。近外鼻孔的粘膜含鼻毛和皮脂腺,鼻毛无立毛肌。可阻挡胃吸入空气中的大尘粒。近呼吸部的粘膜固有层内有少量混合腺及弥散淋巴组织。
(二)呼吸部
呼吸部(respiratory region)的面积较大,占鼻粘膜的大部,包括下鼻甲、中鼻甲、鼻道及鼻中隔中下份等粘膜。生活状态的粘膜呈淡红色,表面为假复层纤毛柱状上皮,杯状细胞较多(图14-1)。上皮纤毛向咽部快速摆动,将粘液及粘着的尘粒推向咽部而被咳出。固有层结缔组织内有较多粘液腺、浆液腺和混合腺,分泌物经导管排入鼻腔,与上皮内杯状细胞分泌物共同形成一层粘覆于纤毛上。呼吸部粘膜的血液供应较丰富,并有丰富的静脉丛,中、下鼻甲处尤多,使粘膜形成许多小隆起。静脉丛管壁薄,腔大似窦状,它们随动静脉吻合的开放和关闭而有周期性充血变化,通过散热和渗出,对吸入空气起加温和湿润作用,患鼻炎时,静脉丛异常充血,粘膜肿胀,分泌物增多,鼻道变窄。固有层内淋巴组织较多,还可见嗜酸性粒细胞、嗜碱性粒细胞和肥大细胞,患过敏性鼻炎时,鼻分泌物中可见此类细胞。
图14-1 人鼻呼吸部粘膜HE × 100
Ep假复层纤毛柱状上皮 G腺泡 V小静脉
(三)嗅部
嗅部(olfactory region)粘膜面积小,位于上鼻甲和相对的鼻中隔上份及鼻腔顶部,人两侧嗅粘膜的总面积约2cm2,某些动物的嗅粘膜面积大,如狗为100cm2。活体的嗅粘膜呈棕黄色,与淡红色的呼吸部分界明显.嗅粘膜表面的嗅上皮为假复层柱状上皮,无纤毛细胞和杯状细胞,由支持细胞、基细胞和嗅细胞组成(图14-2)。
1.支持细胞 细胞呈高柱状,顶部宽大,基部较细,游离面有许多微绒毛。核卵圆开,位于细胞上部,胞质内含有黄色色素颗粒。支持细胞分隔嗅细胞,使每个嗅细胞为一个功能单位,两者之间形成连接复合体,起支持和保护嗅细胞的作用。
2.基细胞 细胞呈圆形或锥形,位于上皮深部。细胞有细小突起,伸于上皮内其他细胞之间。基细胞有分裂和分化能力,能分化为支持细胞和嗅细胞。
3.嗅细胞 嗅细胞(olfactory cell)呈细长梭形,是一种双极神经元,它是唯一的一种存在于上皮内的感觉神经元。嗅细胞分散于支持细胞之间,人约有107个,狗有2.2×108。嗅细胞分胞体、树突和轴突三部分,含核的胞体部位于上皮的中部。顶部的树突呈细棒状,伸向上皮表面,突起末端膨胀大呈球状,称嗅泡(olfactory vesicle),从嗅泡伸出10~30根纤毛,称嗅毛(olfactory cilia)。嗅毛较长,向一侧倾倒,平铺在上皮表面,埋于较厚的浆液层内。嗅毛的结构不同于动纤毛,基内的微管无动力臂,故嗅毛无摆动性。胞体基部伸出细长轴突,穿过基膜,在固有层内由施万细胞包裹,形成无髓神经纤维,组成嗅神经(图14-2)。嗅神经穿过颅骨筛板,与嗅球内的神经元树突构成突触。嗅毛为嗅觉感受器,可能具有不同的受体,分别接受不同化学物质的刺激,使嗅细胞产生冲动,传入中枢,产生嗅觉。
嗅粘膜固有层为薄层结缔组织,与深部骨膜相连。固有层内的血管较丰富,并有许多浆液性嗅腺。嗅腺腺泡分泌的浆液经导管排至上皮表面,可溶解吸入空气中的化学物质,刺激嗅毛。浆液的不断分泌,又可清洗上皮表面,保持嗅细胞感受刺激的敏锐性。
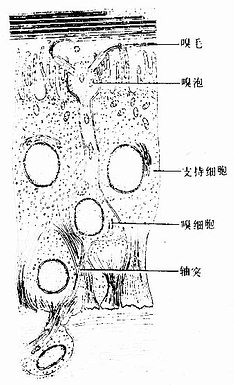
图14-2 嗅粘膜上皮细胞超微结构模式图
二、喉
喉以软骨为支架,软骨之间借韧带、肌肉或关节相连,会厌表面覆以粘膜,内部为会厌软骨(弹性软骨)。会厌舌面及喉面上份的粘膜上皮为复层扁平,有味蕾,喉面基部为假复层纤毛柱状上皮。固有层为疏松结缔组织,弹性纤维较丰富,并有混合腺和淋巴组织。固有层深部与会厌软骨的软骨膜相连。
喉侧壁粘膜形成上、下两对皱襞,分别为室襞和声襞。上、下皱襞之间为喉室(图14-3)。室襞粘膜表面为假复层纤毛柱状上皮,有杯状细胞,固有层和粘膜下层为疏松结缔组织,内有丰富的混合腺和淋巴组织。喉室的粘膜与粘膜下层的结构与室襞相似。声襞又称声带,游离缘为膜部,较薄,基部为软骨部。膜部粘膜表面为复层扁平上皮,固有层较厚,浅部为疏松结缔组织,炎症时易发生水肿;深部为致密结缔组织,富含与表面平行排列的弹性纤维,构成声韧带。固有层内无腺体,血管也较少,下方骼肌纤维构成的声带肌。声带振动主要在膜部。软骨部粘膜表面为假复层纤毛柱状上皮,粘膜下层内有混合腺,外膜有软骨和骨骼肌。
图14-3 喉纵切面
三、气管和支气管
(一)气管
气管管壁分粘膜、粘膜下层和外膜三层(图14-4)。

图14-4 人气管 HE×100
1.粘膜表面为假复层纤毛柱状上皮,由纤毛细胞、杯状细胞、基细胞、刷细胞和弥散的神经内分泌细胞等组成(图14-5).纤毛细胞呈柱状,游离面有纤毛,每个细胞约有300根,核卵圆形,位于细胞中部。纤毛向咽侧呈快速摆动,将粘液及附于其上的尘粒,细菌等异物推向咽部被咳出,故纤毛细胞有净化吸入空气的重要作用(图14-6)。杯状细胞也甚多,其结构与肠道上皮的杯状细胞相似,顶部胞质内含大量粘原颗粒,细胞分泌的粘蛋白(mucin)是一种大分子糖蛋白,它与管壁内腺体的分泌物在上皮表面共同构成一道粘液性屏障,粘附吸入空气中的异物,溶解吸入的SO2、CO等有害气体,随粘液咳出。基细胞呈锥形,位于上皮深部,是一种未分化的细胞,有增殖和分化能力,可分化形成前述两种细胞。
图14-5 气管上皮超微结构模式图
图14-6 大鼠气管上皮扫描电镜像
Ci纤毛(白求恩医科大学组织胚胎学教研室供图)
刷细胞(brush cell)呈柱状,游离面有许多排列整齐的微绒毛,形如刷状。刷细胞的功能尚不清楚,可能有一定吸收作用。细胞顶部可见基粒,因此认为它可能是一种未成熟的纤毛细胞。有的刷细胞基部可见与传入纤维构成的突触,故它还可能有感受刺激的功能。气管及其以下分支的导气部管壁上皮内还有弥散的神经内分泌细胞,细胞呈锥体形,散在于上皮深部,胞质内有许多致密核心颗粒,故又称小颗粒细胞(small granule cell)。免疫细胞化学研究证明,细胞内含有多种胺类或肽类物质,如5-羟色胺、蛙皮素、降钙素、脑啡肽等,分泌物可能通过旁分泌作用,或经血液循环,参与调节呼吸道血管平滑肌的收缩和腺的分泌。
固有层结缔组织中的弹性纤维较多,使管壁具有一定弹性。固有层内也常见淋巴组织,它与消化管管壁内的淋巴组织一样,也有免疫性防御功能。浆细胞分泌的IgA与上皮细胞产生的分泌片结合形成分泌性IgA,释放入管腔内,可抑制细菌繁殖和病毒复制,减弱内毒素的有害作用。
2.粘膜下层为疏松结缔组织,与固有层和外膜无明显分界。粘膜下层除有血管、淋巴管和神经外,还有较多混合性腺。
3.外膜为疏松结缔组织,较厚,主要有16~20个“C”形透明软骨环构成管壁支架,软骨环之间以弹性纤维组成的膜状韧带连接,使气管保持通畅并有一定弹性。软骨环的缺口朝向气管后壁,缺口处有弹性纤维组成的韧带和平滑肌束。咳嗽反射时平滑肌收缩,使气管腔缩小,有助于清除痰液。
(二)支气管
支气管管壁结构和功能与气管相似。气管分为左、右气管后,管径变细,管壁变薄,三层分界更不明显。支气管壁内的软骨环较少,形态也渐不规则,或环绕成环行,或体积变小呈不规则软骨片;平滑肌则逐渐增多,螺旋形排列,肌肉收缩有利于分泌物排出。
气管和支气管反复感染或受有害气体(如长期吸等)刺激,粘膜可发生慢性炎症病变。如纤毛细胞减少,纤毛运动减弱,杯状细胞增多,分泌旺盛;腺体也增生肥大,分泌增强,粘液糖蛋白成分也发生变化。以致呼吸道净化吸入空气的功能减弱,免疫性防御功能也受损害。病变严重者,假复层纤毛柱状上皮转变为复层扁平上皮,称为上皮化生。
四、肺
肺表面覆以浆膜(胸膜脏层),表面为间皮,深部为结缔组织。肺组织分实质和间质两部分,实质即肺内支气管的各级分支及其终端的大量肺泡,间质为结缔组织及血管、淋巴管和神经等。人的支气管(第1级)至肿泡约有24级分支。支气管经肺门入肺,分为叶支气管(第2级),右肺3支,左肺2支。叶支气管分为段支气管(第3~4级),左、右肺各10支。段支气管反复分支为小支气管(第5~10级)继而再分支为细支气管(第11~13级),细支气管又分支为终末细支气管(第14~16级)。从叶支气管至终末细支气管为肺内的导气部。终末细支气管以下的分支为肺的呼吸部,包括呼吸细支气管(第17~19级)、肺泡管(第20~22级)、肺泡囊(第23级)和肺泡(第24级)。支气管以下的这种分支管道,称支气管树(bronchial tree)。
每个细支气管连同它的分支至肺泡,组成一个肺小叶(pulmonary lobule)。肺小叶呈锥体形,尖向肺门,底向肺表面,小叶间为结缔组织间隔。胎儿肺小叶分界清楚,成人肺小叶分界不明显。但在肺表面仍可见小叶底部轮廓,直径约1~2.5cm,每叶肺约50~80个肺小叶。肺小叶是肺的结构单位,炎症仅累及若干肺小叶时为小叶性肺叶。
(一)肺导气部
肺导气部随分支而管径渐小,管壁渐薄,管壁结构也逐渐变化。
1.叶支气管至小支气管
管壁结构与支气管基本相似,但管径渐细,管壁渐薄,至小支气管的内径为2~3mm。管壁三层分界也渐不明显,其结构的主要变化是:①上皮均为假复层纤毛柱状,也含有前述几种细胞,但上皮薄,杯状细胞渐少;②腺体逐渐减少;③软骨呈不规则片状,并逐渐减少;④平滑肌相对增多,从分散排列渐成环形肌束环绕管壁(图14-7)。
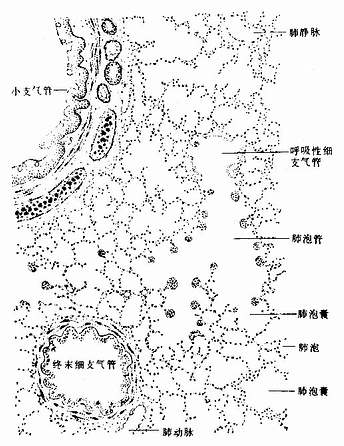
图14-7 肺
2.细支气管和终末细支气管细支气管(bronchiole)内径约1mm ,上皮由假复层纤毛柱状渐变为单层纤毛柱状,也含有前述各种细胞,但杯状细胞减少或消失。腺和软骨也很少或消失,环行平滑肌则更明显,粘膜常形成皱襞。细支气管分支形成终末细支气管(terminal bronchiole),内径约0.5mm,上皮为单层柱状,无杯状细胞;腺和软骨均消失;环行平滑肌则更明显,形成完整的环行层,粘膜皱襞也明显(图14-7,14-8)。终末细支气管上皮内除少量纤毛细胞外,大部为无纤毛的柱状分泌细胞(称Clara细胞),细胞顶部呈圆顶状凸向管腔,顶部胞质内含分泌颗粒(图14-9)。一般认为分泌细胞的分泌物中含蛋白水解酶,可分解管腔内的粘液,利于排出;细胞内还含有较多的氧化酶系,可对吸收的毒物或某些药物进行生物转化,使其毒性减弱或便于排出。细支气管和终末细支气管的环行平滑肌,在植物神经的支配下收缩或舒张,以调节进出肺泡的气流量。正常情况下吸气时平滑肌松弛,管腔扩大;呼气末时,平滑肌收缩,管腔变小。在支气管哮喘等病理情况下,平滑肌发生痉挛性收缩,以致呼吸困难。
图14-8 人肺终末细支气管 HE ×400
TB终末细支气管 PA肺动脉分支 AI肺泡
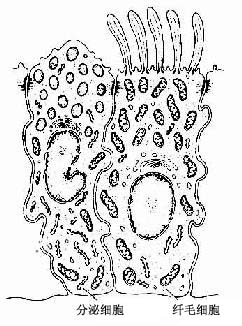
图14-9 终末细支气管上皮细胞超微结构模式图
在叶支气管至细支气管的上皮内,常见神经内分泌细胞成群分布,5~10个细胞平行排列成卵圆形小体,尤多见于管道的分支处,称神经上皮小体(neuroepithelial body ,NEB),小体位于基膜上,顶端隆起突入管腔,或被其他上皮细胞覆盖。神经上皮小体的细胞分泌5-羟色胺、蛙皮素、生长抑素等胺类或肽类物质,通过旁分泌或血液循环,调节血管平滑肌舒缩,调整肺的通气,也参与调节腺体分泌和邻近上皮细胞的分泌与代谢活动。
(二)肺呼吸部
1.呼吸细支气管呼吸细支气管(respiratory bronchiole)是终末细支气管的分支,每个终末细支气管分出2支或2支以上呼吸细支气管。它是肺导气部和呼吸部之间的过渡性管道,管壁结构与终末细支气管相似。上皮为单层立方,也有纤毛细胞和分泌细胞;上皮下结缔组织内有少量环行平滑肌。呼吸细支气管不同于终末细支气管的是管壁上有肺泡相接,在肺泡开口处,单层立方上皮移行为肺泡的单层扁平上皮(图14-7,14-10)。从呼吸细支气管开始具有气体交换功能。
2.肺泡管肺泡管(alveolar duct)是呼吸细支气管的分支,每个呼吸细支气管分支形成2~3个或更多个肺泡管。它是由许多肺泡组成,故其自身的管壁结构很少,仅存在于相邻肺泡开口之间,此处常膨大突入管腔,表面为单层立方或扁平上皮,上皮下为薄层结缔组织和少量平滑肌,肌纤维环行围绕于肺泡开口处,故在切片中可见相邻肺泡之间的隔(肺泡隔)末端呈结节状膨大(图14-7,14-10)。

图14-10 人肺示呼吸部 HE ×400
RB呼吸细支气管 AD肺泡管 AS肺泡囊 AI肺泡
3.肺泡囊肺泡囊(alveolar sac)与肺泡管连续,,每个肺泡管分支形成2~3个肺泡囊。它的结构与肺泡管相似,也由许多肺泡围成,故肺泡囊是许多肺泡共同开口而成的囊腔。肺泡囊的相邻肺泡之间为薄层结缔组织隔(肺泡隔),在肺泡开口处无环行平滑肌,故在切片中的肺泡隔末端无结节状膨大(图14-7,14-10)。
4.肺泡肺泡(pulmonary alveoli)是支气管树的终末部分,是构成肺的主要结构。肺泡为半球形小囊,开口于呼吸细支气管、肺泡管或肺泡囊,是肺进行气体交换的场所。肺泡壁很薄,表面覆以单层肺泡上皮,有基膜。相邻肺泡紧密相贴,仅隔以薄层结缔组织,称肺泡隔(图14-11)。成人每侧肺约有3亿~4亿个肺泡,总面积70~80m2。
(1)肺泡上皮:由Ⅰ型和Ⅱ型两种细胞组成(图14-11)。
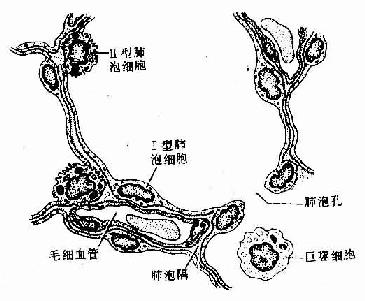
图14-11 肺泡与肺泡隔
Ⅰ型肺泡细胞(type Ⅰalveolar cell):细胞扁平,表面较光滑,含核部分略厚,其他部分很薄,厚约0.2μm,光镜下难辨认,电镜下清晰(图14-11,14-12)。Ⅰ型细胞数量较Ⅱ型细胞少,但宽大而扁薄,覆盖肺泡表面的绝大部分,参与构成气血屏障。相邻Ⅰ型细胞之间或Ⅰ型与Ⅱ型细胞之间有紧密连接。胞质内细胞器甚少,但吞饮小泡甚多,细胞以吞饮方式吞入吸入空气中的微小尘粒和上皮表面的表面活性物质,转运至间质内经淋巴转运和消除。Ⅰ型细胞无增殖能力,损伤后由Ⅱ型细胞增殖分化补充。
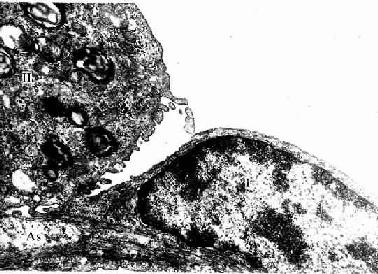
图14-12 猴肺泡电镜像 ×20800
Ⅰ Ⅰ型肺泡细胞,Ⅱ Ⅱ型肺泡细胞,Cap毛细血管 As肺泡隔
(白求恩医科大学尹昕、朱秀雄教授供图)
Ⅱ型肺泡细胞(type Ⅱalveolar cell):细胞较小,圆形或立方形,散在嵌于Ⅰ型细胞之间,细胞数量较Ⅰ型细胞多,但仅覆盖肺泡表面的一小部分。Ⅱ型细胞是一种分泌细胞,光镜观察下,核圆形,胞质着色浅,呈泡沫状,细胞略凸向肺泡腔(图14-11)。电镜下可见,细胞表面有短小微绒毛,胞质内除富含线粒体、粗面内质网、高尔基复合体和溶酶体外,还有许多分泌颗粒。颗粒大小不一,直径0.1~1μm ,电子密度高,内含同心圆或平行排列的板层结构,故称嗜锇性板层小体(osmiophilic multilamellar body)(图14-12)。免疫细胞化学和放射自显影证明,分泌颗粒内含磷脂、蛋白质和糖胺多糖等成分,由内质网合成的蛋白质在高尔基复合体内糖化,继而被组装在分泌颗粒内并与脂质结合(图14-13)。细胞以胞吐方式将颗粒内容物排出(图14-14),分泌物中的磷脂(主要是二棕榈酰卵磷脂)等成分在肺泡上皮表面铺展成一层薄膜,称表面活性物质(surfactant)。该物质在肺泡上皮表面与气体之间,形成的界面,有降低肺泡表面张力的作用,使肺泡回缩力降,减少吸气阻力,使吸气大为省力。此外,吸气末时肺泡扩大,表面活性物质分布稀薄,肺泡表面张力增大,回缩力增强,防止肺泡过于膨大;呼气末时肺泡缩小,表面活性物质相对浓厚,表面张力减小,肺泡回缩力减小,避免肺泡萎缩。故表面活性物质对稳定肺泡直径起重要作用。表面活性物质由Ⅱ型细胞不断产生,经Ⅰ型细胞吞饮转运或经呼吸道排出,保持不断的更新。Ⅱ型细胞还有分裂增殖并转化为Ⅰ型细胞的功能。
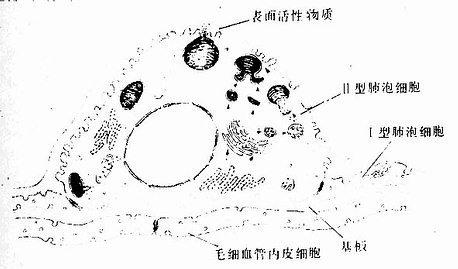
图14-13 Ⅱ型肺泡细胞超微结构模式图
↑示嗜锇性板层小体形成过程
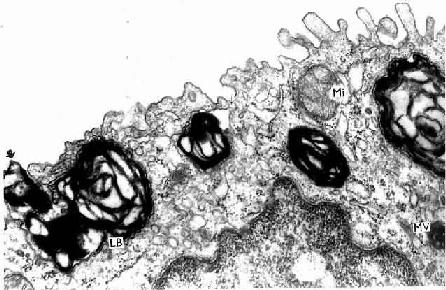
图14-14 人肺泡Ⅱ型细胞电镜像 ×42000
LB板层小体,Mi线粒体,MV多泡体,↑分泌
倘若早产儿或新生儿因先天缺陷而致肺表面活性物质产生不足或缺如,可使肺泡表面张力增大,扩张困难,导致新生儿呼吸窘迫症,患儿还因血氧不足,肺毛细血管通透性增大,血浆蛋白质漏出,在肺泡上皮表面沉积形成一层透明膜样物质,也影响肺泡的扩张和气体交换,故也称新生儿透明膜病。
(2)肺泡隔( alveolar septum):相邻肺泡之间的薄层结缔组织构成肺泡隔,属肺的间质。肺泡隔内含密集的毛细血管网,毛细血管为连续型,内皮甚薄,无孔,胞质内含较多吞饮小泡。隔的厚薄不一,弹性纤维较丰富,也有少量胶原纤维和网状纤维,并有成纤维细胞、巨噬细胞、浆细胞和肥大细胞等以及淋巴管和神经纤维。隔内丰富的弹性纤维有助于保持肺泡的弹性,老年人弹性纤维退化,炎症等病变也可破坏弹性纤维,使肺泡弹性减弱,肺泡渐扩大,导致肺气肿,肺换气功能减低。隔内的毛细血管大多紧贴肺泡上皮,上皮基膜与内皮基膜相互融合;有的部位的肺泡上皮与毛细管内有少量结缔组织(图14-15)。
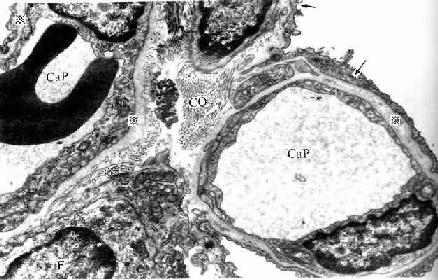
图14-15 人肺泡隔电镜像 ×13500
Cap毛细血管,F成纤维细胞,
CO胶原原纤维,※基膜,↑Ⅰ型肺泡细胞
(上海医科大学电镜室供图)
(3)肺泡孔(alveolar pore):相邻肺泡之间有小孔相通、直径10~15μm(图14-11,14-16),一个肺泡可有一个或数个肺泡孔。它是沟通相邻肺泡的孔道,可均衡肺泡内气体的含量,在某个终末细支气管或呼吸细支气管阻塞时,肺泡孔起侧支通气作用,防止肺泡萎缩。但在肺感染时,病菌也可通过肺泡孔扩散,使炎症蔓延。
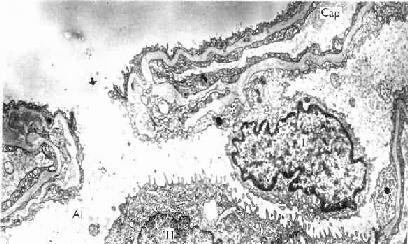
图14-16 人肺电镜像示肺泡孔 ×9000
A:肺泡腔,Ⅰ、Ⅱ肺泡上皮细胞(上海医科大学电镜室供图)
Cap毛细血管
(4)气血屏障(blood-air barrier):肺泡内气体与血液内气体分子交换所通过的结构称气血屏障。它由以下结构组成:肺泡表面液体层、Ⅰ型肺泡细胞与基膜、薄层结缔组织、毛细血管基膜与内皮。有的部位的肺泡上皮与血管内皮之间无结缔组织,两层基膜直接相贴而融合(图14-15)。气血屏障很薄,总厚度约0.5μm。间质性肺炎时,肺泡隔结缔组织水肿,炎症细胞浸润,以致肺气体交换功能障碍。
(三)肺间质和肺巨噬细胞
肺内的结缔组织及其中的血管、淋巴管和神经构成肺间质。结缔组织主要分布在支气管各级分支管道的周围,血管等行于其中,管道愈细,周围的结缔组织愈少,至肺泡,仅有少量结缔组织构成肺泡隔。肺间质的组成与一般疏松结缔组织相同,但弹性纤维较发达,巨噬细胞也较多。
肺巨噬细胞(pulmonary macrophage)由单核细胞分化而来,广泛分布在肺间质内,在细支气管以下的管道周围和肺泡隔内较多。有的巨噬细胞游走入肺泡腔内,称肺泡巨噬细胞(alveolar macrophage)。肺巨噬细胞的吞噬、免疫和分泌作用都十分活跃,有重要防御功能。吸入空气中的尘粒、细菌等异物进入肺泡和肺间质,多被巨噬细胞吞噬清除,故细胞胞质内常见尘粒、细菌等物进入肺泡和肺间质,多被巨噬细胞吞噬清除,故细胞胞质内常见尘粒、次级溶酶体及吞噬体等。胞质内含大量尘粒的肺巨噬细胞又称尘细胞(dust cell)。肺巨噬细胞还可吞噬衰老的红细胞,在心力衰竭患者出现肺瘀血时,大量红细胞从毛细血管溢出,被巨噬细胞吞噬,胞质内含许多血红蛋白的分解产物含铁血黄素颗粒,此种肺巨噬细胞又称心力衰竭细胞(heart failure cell)。吞噬异物的巨噬细胞,有的从肺泡腔经呼吸道粘液流动和纤毛运动而被咳出,有的进入肺淋巴管随淋巴进入肺淋巴结内。
(四)肺的血管、淋巴管和神经
1.肺的血管肺有两组血循环管道,即肺循环和支气管循环。
(1)肺循环:肺循环是肺的功能性血循环。肺动脉为弹性动脉,它从肺门入肺后不断分支,与支气管的各级分支伴行,直至肺泡隔内形成密集的毛血管网(图14-17)。在肺泡处进行气体交换后,毛细血管汇集成小静脉,行于肺小叶间结缔组织内而不与肺动脉的分支伴行。小静脉汇集成较大的静脉后,才与支气管分支及肺动脉分伴行,最后在肺门入汇合成两条肺静脉出肺。
图14-17兔肺血管灌注示肺动脉分支及肺泡隔毛细血管网 ×400
↓肺动脉分支
(2)支气管循环:支气管循环是肺的营养性血循环。支气管动脉起自胸主动或肋间动脉,有数条,管径较细,为肌性动脉。支气管动脉沿途在肺导气部和呼吸细支气管管壁内,以及肺动脉、肺静脉管壁内和肺结缔组织内分支形成毛细血管,其内皮为有孔型,给肺组织提供营养.支气管也有终末支参与形成肺泡壁内的毛细血管网。上述毛细血管部分汇入肺静脉,部分汇集形成支气管静脉,与支气管伴行,由肺门出肺。支气管动脉还分支供应肺胸膜和肺淋巴结。
2.肺的淋巴管肺的淋巴管有浅丛和深丛两组。浅丛分布在肺胸膜内,淋巴丛汇合形成几支较大的淋巴管,将淋巴输入肺门淋结。深丛分布在肺支气管树的管壁内和肺泡隔内以及肺血管的周围,最后也汇合成几支淋巴管,将淋巴输入肺门淋巴结。
3.肺的神经肺的传出神经纤维(交感神经和副交感神经)和传入神经纤维在肺门形成丛(肺丛),神经纤维随支气管分支和血管分支入肺。传出神经末梢分布在支气管树平滑肌、血管平滑肌和腺体,交感神经纤维为肾上腺素能神经,兴奋时使支气管平滑肌松弛,血管平滑肌收缩,腺体分泌减少;副交感神经纤维为胆碱能神经,兴奋时使支气管平滑肌收缩,血管平滑肌松弛,腺体分泌增强。传入神经纤维末梢分布于支气管树管壁粘膜内及肺泡上皮,纤维出肺后行于迷走神经内,将肺内的刺激传入脑呼吸中枢。
(五)肺的代谢功能
前已述及,肺除有气体交换能外,支气管树上皮内还有弥散的神经内分泌细胞。近些年的研究还发现肺内进行着诸多物质代谢和转化作用,尤其表现在肺血管内皮细胞。全身血液均通过肺循环血管,故肺血管内皮细胞的代谢作用对机体的影响很大。内皮细胞游离面有血管紧张素转换酶,可将血液中血管紧张素Ⅰ转化为血管紧张素Ⅱ,后者的缩血管作用较前者强50倍。肺循环血内的血管紧张素Ⅰ绝大部分被转化为血管紧张素Ⅱ,它作用于中枢神经,通过交感神经的作用使体循环的小动脉收缩,升高血压。肺血管内皮细胞还含有缓激肽酶,可分解灭活血液中的缓激肽(它作用于神经系统使血管扩张),由此也使血管紧张,血压升高。肺内皮细胞内含有单胺氧化酶,细胞摄取血液中的5-羟色胺、去甲肾上腺素等,经此酶的作用而被分解灭活,肺是体内5-羟色胺灭活的主要场所。肺是产生和降解前列腺素(prostaglandin,PG)的重要器官,肺血管内皮细胞既能合成前裂腺素(PGE、PGF),又含有分解前列腺素的酶。PGE可使支气管平滑肌松弛,管腔扩大;PGF2α则使支气管平滑肌收缩,管腔缩小,还可使肿血管平滑肌收缩。肺间质结缔组织内的肥大细胞甚多,在变态反应疾病时,肥大细胞释放大量组胺等物质,可致支气管平滑肌收缩,粘膜水肿,腺体分泌粘液增多,发生支气管哮喘。
第十五章 泌尿系统
泌尿系统包括肾、输尿管、膀胱和尿道等器官。肾是泌尿器官,其余为贮尿和排尿器官。
一、肾
肾是人体最主要的排泄器官,它以尿形成的方式排除体内的代谢废物,同时对人体的水盐代谢和离子平衡起调节作用,以维持机体内环境理化性质的相对稳定,此外,肾还有分泌多种生物活性物质的功能。
肾形似蚕豆,内缘中部凹陷为肾门,输尿管、血管、神经和淋巴管经此出入。肾表面包以致密结缔组织构成的被膜,称肾纤维膜,正 常新鲜肾的被膜易剥离,在肾病时此膜易与肾实质粘连而不易剥离。肾实质分为皮质和髓质。新鲜肾的冠状剖面上,皮质呈红竭色,颗粒状,髓质由10余个肾锥体(renal pyramid)组成,肾锥体呈浅红色条纹状(图15-1)。锥体尖端钝圆,突入肾小盏内,称肾乳头,乳头管开口于此处,尿液由此排至肾小盏内。肾锥体的底与皮质相连接,从肾锥体底呈辐谢状伸入皮质的条纹称髓放线(medullary ray),位于髓放线之间的肾皮质称皮质迷路(cortical labyrinty)。每个髓放线及其周围的皮质迷路组成一个肾小叶,皮质迷路中央部分为小叶间,其中有小叶间动脉和静脉穿行。一个肾锥体与相连的皮质组成肾叶,但成人的肾叶分界不清,胎儿和婴儿肾表面可见肾叶轮廓。位于肾锥体之间的皮质部分,称为肾柱(图15-1)。
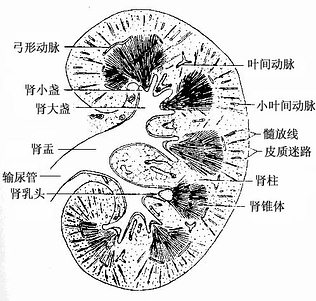
图15-1 肾冠状剖面模式图
肾实质由大量泌尿小管组成,其间有少量结缔组织、血管和神经等构成肾间质。泌尿小管(uriniferous tubule)是由单层上皮构成的管道,包括肾小管和集合小管系两部分。肾小管是长而不分支的弯曲管道。每条肾小管起始端膨大内陷成双层的囊(肾小囊),并与血管球共同构成肾小体,肾小管的末端与集合小管相接。每个肾小体和一条与它相连的肾小管是尿液形成的结构和功能单位,称肾单位。泌尿小管各段在肾实质内的分布是有规律的,肾小体和蟠曲走行的肾小管位于皮质迷路和肾柱内,肾小管的直行部分与集合小管系共同位于肾锥体和髓放线内(表15-1)。
表15-1 泌尿小管组成和各段的位置
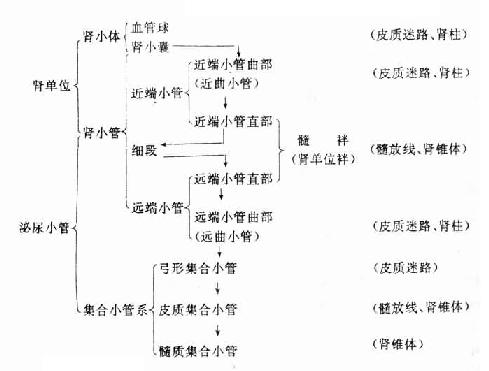
(一)肾单位
肾单位( nephron)是肾成尿液的结构和功能单位,由肾小体和肾小管两部分组成,每个肾约100万个以上的肾单位,它与集合小管系共同行使泌尿功能。
肾小体位于皮质迷路和肾柱内,一端与肾小管相连。肾小管的起始段在肾小体附近蟠曲走行,称近端小管曲部或近曲小管,继而离开皮质迷路入髓放线,从髓放线直行向下进入肾锥体,称近端小管直部。随后管径骤然变细,称为细段。细段之后管径又骤然增粗,并返折向上走行于肾锥体和髓放线内,称为远端小管直部。近端小管直部、细段和远端小管直部三者构成“U”形的袢,称为髓袢(medullary loop),又称Henle袢或肾单位袢(nephron loop)。髓袢由皮质向髓质方向下行的一段称降支,而由髓质向皮质方向上行的一段称升支。髓袢长短不一,长者可达乳头部,短者只存在于髓放线中。远端小管直部离开髓放线后,在皮质迷路内蟠曲走行于原肾小体附近,称为远端小管曲部(或称远曲小管),最后汇入集合小管系(图15-2)。
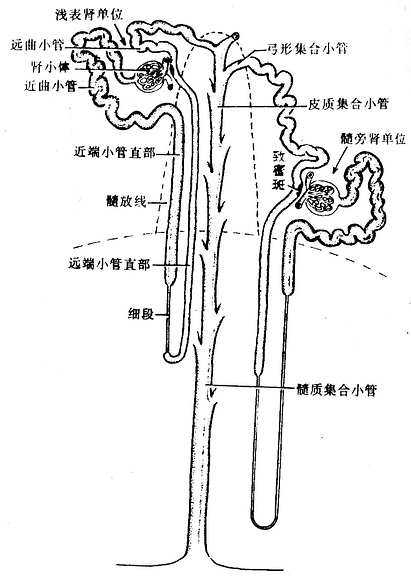
图15-2 肾单位和集合小管系模式图
根据肾小体在皮质中深浅位置不同,可将肾单位分为浅表肾单位和髓旁肾单位两种(图15-2)。浅表肾单位(superfacial nephron)又称皮质肾单位(cortical nephron),其肾小体位于皮质浅部,肾小体体积较小,髓袢和细段均较短。浅表肾单位数量多,约占肾单位总数的85%,肾小体体积较大,髓袢和细段均较长。髓旁肾单位数量较少,约占肾单位总数的15%,对尿液浓缩具有重要的生理意义。
1.肾小体肾小体(renal corpuscle)似球形,故又称肾小球,直径约200μm,由肾小囊和血管球组成(图15-3,15-4)。肾小体有两端或谓两极,微动脉出入的一端称血管极,另一端在血管极的对侧,肾小囊与近端小管相连接称尿极。
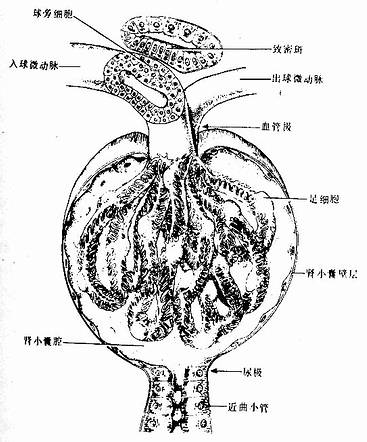
图15-3 肾小体与球旁复合体立体模式图
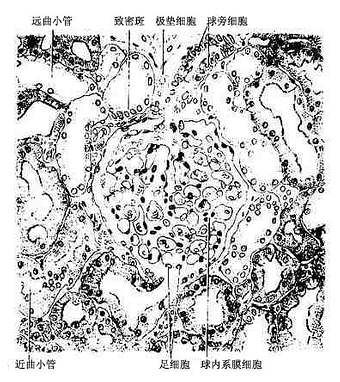
图15-4 肾皮质(高倍)
(1)血管球(glomerulus):是包在肾小囊中的一团蟠曲的毛细血管(图15-3,15-4)。一条入球微动脉从血管极处突入肾小囊内,分成4~5支,每支再分支形成网状毛细血管袢,每个血管袢之间在有血管系膜支持,毛细血管继而又汇成一条出球微动脉,从血管极处离开肾小囊。因此,血管球是一种动脉性毛细血管网。由于入球微动脉管径较出球微动脉粗,故血管球内的血压较一般毛细血管的高,当血液流经血管球时大量水和小分子物质易于滤出管壁而入肾小囊内。电镜下,血管球毛细血管为有孔型(图15-5,15-6),孔径50~100nm ,有利于滤过功能。在内皮细胞的腔面覆有一层带负电荷的富含唾液酸的糖蛋白(细胞衣),对血液中的物质有选择性通透作用。内皮外面大都有基膜,但在面向血管系膜一侧的内皮则无基膜,此处的内皮细胞与系膜直接接触(图15-5)。
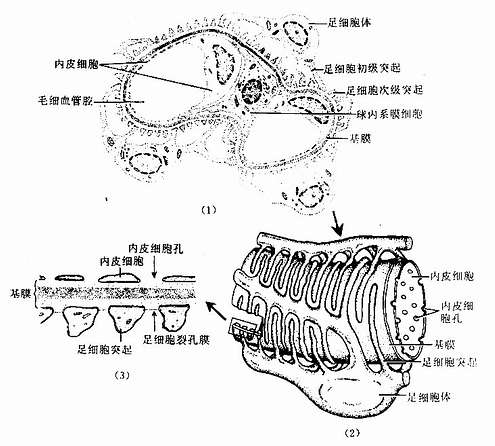
图15-5 肾血管球毛细血管、基膜和足细胞超微结构模式图
(1)切面图 (2)立体示意图 (3)滤过屏障示意图
血管系膜(mesangium)又称球内系膜(intraglomerular mesangium),位于血管球毛细血管之间,邻接毛细血管内皮或基膜,主要由系膜细胞和系膜基质组成(图15-5)。系膜细胞(mesangial cell)形态不规则,细胞突起可伸至内皮与基膜之间,或经内皮细胞之间伸入毛细血管腔内,细胞核较小,染色较深,胞质内有较发达的粗面内质网、高尔基复合体、溶酶体和吞噬泡等,有时还可见有少量分泌颗粒;胞体和突起内有微管、微丝和中间丝。目前认为系膜细胞来源于平滑肌细胞。系膜细胞能合成基膜和系膜基质的成分,还可吞噬和降解沉积在基膜上的免疫复合物,以维持基膜的通透性。并参与基膜的更新和修复。细胞的收缩活动可调节毛细血管的管径以影响血管球内血流量。系膜细胞还可分泌肾素和酶等生物活性物质,可能与血管球内血流量的局部调节有关。正常情况下的系膜细胞更新缓慢,但在病理情况下(如肾炎时),细胞增生活跃,吞噬和清除作用也增强。系膜基质填充在系细胞之间,在血管球内起支持和通透作用。血管系膜内还可少量巨噬细胞。
(2)肾小囊(renal capsule)又称Bowman囊,是肾小管起始部膨大凹陷而成的双层囊,似杯状,囊内有血管球(图15-3,15-4)。肾小囊外层(或称肾小囊壁层)为单层扁平上皮,在肾小体的尿极处与近端小管上皮相连续,在血管极处反折为肾小囊内层(或称肾小囊脏层),两层上皮之间的狭窄腔隙称肾小囊腔,与近曲小管腔相通。内层细有胞形态特殊,有许多大小不等的突起,称为足细胞(podocyte)(图15-5,15-6)。足细胞体积较大,胞体凸向肾小囊腔,核染色较浅,胞质内有丰富的细胞器,在扫描电镜下,可见从胞体伸出几个大的初级突起,继而再分成许多指状的次级突起,相邻的次级突起相互穿插成指状相嵌,形成栅栏状,紧贴在毛细血管基膜外面(图15-7)。突起之间有直径约25nm的裂隙,称裂孔(slit pore),孔上覆盖一层厚4-6nm的裂孔膜(slit membrane)(图15-5)。突起内含较多微丝,微丝收缩可使突起活动而改变裂孔的宽度。足细胞表面也覆有一层富含唾液酸的糖蛋白。
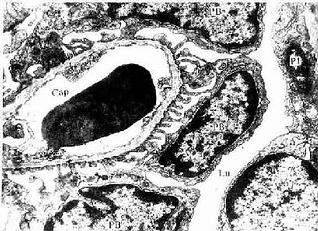
图15-6 肾小体电镜像 ×14500
PB足细胞体,PI肾小囊壁层,Lu肾小囊腔,Cap毛细血管
(白求恩医科大学尹昕、朱秀雄教授供图)
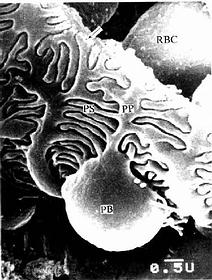
图15-7 兔肾小体扫描电镜像 示足细胞
PB足细胞体,PP初级突起,PS次级突起,RBC红细胞,
↑基膜(河北医学院电镜供图)
(3)血管球基膜(glomerular basement membrane):血管球基膜较厚(成人的基膜厚约330nm),位于足细胞次级突起与毛细血管内皮细胞之间或足细胞次级突起与血管系膜之间,光镜下基膜为均质状,PAS反应阳性。电镜下可见基膜分三层,中层较厚而致密,内、外层较薄而稀疏(图15-5,15-6)。基膜内主要含有Ⅳ型胶原蛋白、蛋白多糖和层粘连蛋白(laminin),形成以Ⅳ型胶原蛋白为骨架的分子筛(图15-8),骨架上附有的糖胺多糖是以带负电荷的硫酸肝素为主,故基膜对滤液中的大分子物质有选择性通透作用。
肾小体类似一个滤过器,以滤过方式形成滤液。当血液流经血管球毛细血管时,管内血压较高,血浆内部分物质经有孔内皮、基膜和足细胞裂孔膜滤入肾小囊腔。这三层结构称为滤过膜(filtration membrane),或称滤过屏障(filtration barrier)(图15-5,15-6,15-8)。滤入肾小囊腔的滤液称原尿,原尿除不含大分子的蛋白质外,其成分与血浆相似。滤过膜的三层结构分别对血浆成分具有选择性通透作用。
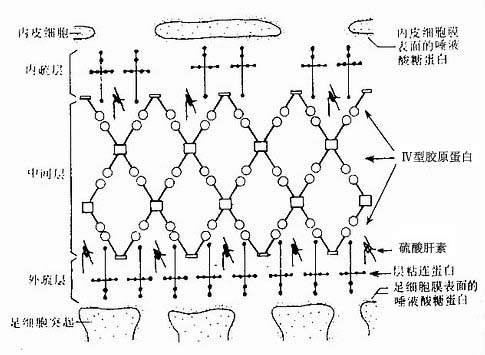
图15-8 血管球基膜结构示意图
一般情况下,分子量7万以下的物质可通过滤过膜,如葡萄糖、多肽、尿素、电解质和水等;而大分子物质则不能通过或被选择性通透,这取决于被通透物质的大小、电荷性质和分子形状等因素。如分子量为69kD的白蛋白可少量滤过,而分子量在150~200kD的免疫球蛋白阻滞在基膜内而不能通过。毛细血管内皮表面和足细胞表面均含有带负电荷的唾液酸糖蛋白,基膜内还有带负电荷的硫酸肝素(图15-8)。这些负电荷的成分可排斥血浆内带负电荷的物质通过滤过膜,这对防止血浆蛋白质滤出具有重要的生理意义。一些肾病患者的肾滤过膜内这些带负电荷糖蛋白的丧失,可能是导致蛋白尿的原因之一。另外,被通透物质的分子形状也可影响它的通透性,如椭圆形的蛋白分子比球形的蛋白分子易通过滤过膜,此乃因前者有可能以其较小的半径处通过滤过膜孔隙。
在成人,一昼夜两肾可形成原尿约180L(每分钟125ml )。若滤过膜受损害,则血浆大分子蛋白质甚至血细胞均可通过滤过膜漏出,出现蛋白尿或血尿。当系膜细胞清除了基膜内沉积物,内皮细胞和足细胞再建新的基膜后,滤过膜功能又可恢复。
2.肾小管肾小管(renal tubule)是由单层上皮细胞围成的小管,上皮外方为基膜及少量结缔组织。肾小管分为近端小管、细段和远端小管三部分,近端小管与肾小囊相连,远端小管连接集合小管。肾小管有重吸收原尿中的某些成分和排泌等作用。
(1)近端小管(proximal tubule):是肾小管中最长最粗的一段,管径50~60μm ,长约14mm,,约占肾小管总长的一半。近端小管分曲部和直部两段。
近端小管曲部:简称近曲小管(proximal convoluted tubule),位于皮质内,起于肾小体尿极,迂曲蟠行于肾小体附近(图15-2,15-9)。生理情况下,原尿不断进入近曲小管内,故管腔呈扩张状态,若因血流受阻等病变而致原尿生成减少时,管腔缩小甚至闭合。曲部管壁上皮细胞为立方形或锥体形,胞体较大,细胞分界不清,胞质嗜酸性,胞核呈球形,位于近基部。上皮细胞腔面有紧密排列的刷状缘,细胞基部有纵纹(图15-4,15-9)。电镜下可见刷状缘由大量密集而排列整齐的微绒毛组成(图15-9,15-10),每μm2约有150根,使细胞游离面的表面积大为扩大(两肾近曲小管表面积总计可达50~60m2)。刷状缘处有丰富的碱性磷酸酶和ATP酶等,此酶与细胞的重吸收功能有关。微绒毛基部之间细胞膜内陷形成顶小管和顶小泡(图15-9,15-10),若从血管内注入示踪物――辣根过氧化酶,可迅速滤入原尿,继而出现在近端小管上皮细胞的顶小管和顶小泡内,这提示小管上皮细胞可以胞饮方式重吸收原尿内的蛋白质等较大分子物质。上皮细胞的侧面有许多侧突(图15-10),相邻细胞的侧突相互嵌合,或伸入相邻细胞质膜内褶的空隙内,两者构成广泛的弯曲复杂的细胞间迷路,故光镜下细胞分界不清。细胞基部胞膜内陷成发达的质膜内褶,内褶之间有许多纵向排列的杆状线粒体(图15-9,15-10),形成光镜下的纵纹,侧突和质膜内褶使细胞侧面及基面与间质之间的物质交换面积增大。在细胞基部的质膜上有丰富的Na+、K+、ATP酶(钠泵),可将细胞内钠离子泵入细胞间质。
图15-9 泌尿小管各段上皮细胞结构模式图
近端小管直部:是曲部的延续,直行于髓放线和锥体内,其结构与曲部基本相似,但上皮细胞较矮,微绒毛、侧突和质膜内褶等不如曲部发达(图15-9)。

15-10近曲小管上皮细胞超微结构立体模式图
近端小管的上述结构特点使其具有良好的吸收功能,它是原尿重吸收的主要场所,原尿中几乎全部葡萄糖、氨基酸和蛋白质以及大部分水、离子和尿素等均在此重吸收。此外,近端小管还向腔内分泌氢离子、氨、肌酐和马尿酸等,还能转运和排出血液中的酚红和青霉素等药物。临床利用马尿酸或酚红排泄试验,来检测近端小管的功能状态。
(2)细段(thin segment ):位于髓放线和肾锥体内。浅表肾单位的细段较短,主要位于髓袢降支,髓旁肾单位细段长,由降支再返折上行,又参与构成升支。细段管径细,直径10~15μm,管壁为单层扁平上皮(图15-9,15-11),细胞含核部分突向管腔,胞质着色较浅,无刷状缘。电镜下,上皮细胞游离面有少量短微绒毛,基底面有少量内褶。细段上皮甚薄,有利水和离子通透。
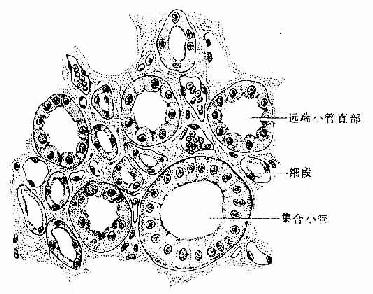
图15-11 肾髓质(高倍)
(3)远端小管(distal tubule):包括远端小管直部和曲部。管腔较大而规则,管壁上皮细胞呈立方形,细胞体积较近端小管的小,着色浅,细胞分界较清楚,核位于中央,游离面无刷状缘,基部纵纹较明显(图15-4,15-11)。
远端小管直部:经锥体和髓放线上行至皮质,是髓袢升支的重要组成部分。管径约30μm,长约9mm.电镜下,细胞表面有少量短而小的微绒毛,基部质膜内褶发达,长的内褶可伸达细胞顶部,质膜的内褶间的线粒体细长(图15-9,15-12),基部质膜上有丰富的Na+、K+-ATP酶,能主动向间质转运Na+,细胞膜还可能有一种呈凝状不通透水的酸性糖蛋白,致使水不能通过,因此造成从肾锥体底至肾乳头的间质内的渗透压逐步增高,有利于集合小系对水的重吸收。
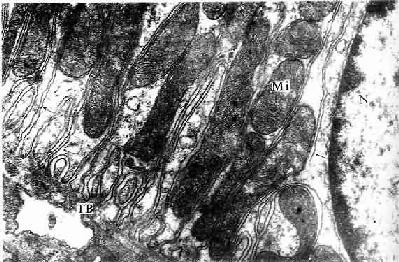
图15-12 小鼠肾远端小管上皮细胞基部电镜像×20000
TB小管基膜,Mi线粒体,N细胞核,↑质膜内褶
(白求恩医科大学尹昕、朱秀雄教授供图)
远端小管曲部:简称远曲小管(distal convoluted tubule)位于皮质内,直径35~45μm,长4.6~5.2mm,其超微结构与直部相似,但质膜内褶和线粒体不如直部发达(图15-9)。远曲小管是离子交换的重要部位,细胞有吸收水、Na+和排出K+、H+、NH3等作用,对维持体液的酸碱平衡起重要作用。肾上腺皮质分泌的醛固酮能促进此段重吸收Na+,排出K+,垂体后叶抗利尿激素能促进此段对水的重吸收,使尿液浓缩,尿量减少。
(二)集合小管系
集合小管系(collecting tubule system )全长20~38mm ,可分为弓形集合小管、皮质集合小管三段(图15-2)。弓形集合小管很短,位于皮质迷路内,一端连接远曲小管,呈弧形弯入髓放线,与皮质集合小管相连。皮质集合小管沿髓放线直行向下达肾锥体,髓质集合小管在肾锥体内下行至肾锥体乳头,改称乳头管,开口于肾小盏。集合小管下行时沿途有许多远端小管曲部汇入。集合小管系的管径由细(直径40μm)逐渐变粗(直径200~300μm),随管径的增粗,管壁上皮由单层立方逐渐增高为单层柱状(图15-11),至乳头管处成为高柱状上皮。集合小管上皮细胞胞质色淡而明亮,细胞分界清楚,核圆形,位于中央,着色较深。细胞超微结构比远端小管简单,细胞器少,细胞离面亦有少量短微绒毛,也可见少量侧突和短小的质膜内褶(图15-9)。但也有部分细胞的细胞器较多,胞质内有碳酸酐酶,它与细胞分泌H+或HCO3-的功能有关。集合小管能进一步重吸收水和交换离子,使原尿进一步浓缩,并与远端小管曲部一样也受醛固酮和抗利尿激素的调节。
综上所述,肾小体形成的滤液,经过肾小管和段和集合小管后,原尿中绝大部分水、营养物质和无机盐等又被重吸收入血,部分离子也在此进行交换;小管上皮细胞还分泌排出机体部分代谢产物。滤液经远曲小管和集合小管时又进一步浓缩,最终形成终尿经乳头管排入肾小盏,其量为每天1~2升,仅占肾小体滤液的1%左右。因此,肾在泌尿过程中不仅排出了机体的代谢产物,而且对维持机体水盐平衡和内环境的稳定起重要作用。
(三)球旁复合体
球旁复合体(juxtaglomerular complex)也称肾小球旁器(juxtaglomerular apparatus)由球旁细胞、致密斑和球外系膜细胞组成。它位于肾小体的血管极处,大致呈三角形,致密斑为三角形的底,入球微脉和出球微动脉分别形成三角形的两个侧边,球外系膜细胞则位三角区的中心(图15-3,15-13)。
1.球旁细胞入球微动脉行至近肾小体血管极处,其血管壁中膜的平滑肌细胞转变为上皮样细胞,称为球旁细胞(juxtaglomerular cell)(图15-13)。细胞体积较大,呈立方形,核大而圆,胞质呈弱嗜碱性,胞质内有丰富的分泌颗粒,颗粒呈PAS反应阳性。电镜下,细胞内肌丝少,粗面内质网和核糖体多,高尔基复合体发达,颗粒大小不等,多数呈均质状,用免疫组织化学法证明颗粒内含有肾素(renin)。在球旁细胞和内皮细胞之间无内弹性膜和基膜相隔,故其分泌物易释放入血,促使血管收缩,血压升高。
肾素是一种蛋白水解酶,它能使血浆中的血管紧张素原变成血管紧张素Ⅰ。后者在血管内皮细胞分泌的转换酶作用下转变为血管紧张素Ⅱ。两者均可使血管平滑肌收缩,血压升高,增强肾小体滤过作用,血管紧张素Ⅱ的作用较血管紧张素Ⅰ更强。肾素还可以促进肾上腺皮质分泌醛固酮,促进肾远曲小管和集合小管吸收Na+和排出K+,同时伴有水的进一步重吸收,导致血容量增大,血压升高。此外,球旁细胞还可能生成促红细胞生成因子,但亦有实验认为促红细胞生成因子存在于足细胞内或毛细血管内皮细胞内,故促红细胞生成因子的肾内形成部位尚待进一步证实。球旁细胞主要分布在入球微动脉壁中,但也可出现于出球微动脉壁内,尤其在肾素生成增强时,细胞内颗粒也明显增多,球旁细胞数量增多,甚至可出现在小叶间动脉等处。近年研究发现,体内其他脏器和组织亦能产生肾素。
2.致密斑远端小管直部靠近肾小体侧的上皮细胞增高,变窄,形成一个椭圆形斑,称致密斑(macula densa)。细胞呈高柱状,胞质色浅,核椭圆形,排列紧密,位近细胞顶部(图15-3,15-13)。致密斑基膜常不完整,细胞基部有细小而分支的突起,并可与邻近细胞的突起镶嵌,故与邻近细胞关系密切。致密斑细胞间有细胞间隙,细胞表面缺乏酸性糖蛋白,故致密斑是髓袢升支中唯一能通透水的上皮区,使之成为传递“信息”的场所。因此,致密斑可视为一种离子感受器,能敏锐地感受远端小管内滤液的Na+浓度变化。当滤液内Na+浓度降低时,致密斑细胞将“信息”传递给球旁细胞和球外系膜细胞,促进球旁细胞分泌肾素,增强远端小管储Na+排K+作用。
3.球外系膜细胞球外系膜细胞(extraglonerular mesangial cell)又称极垫细胞(polar cushion cell)。是位于血管极三角区内的一群细胞,细胞形态结构与球内系膜细胞相似,并与球内系膜相延续(图15-13)。球外系膜细胞与球旁细胞、球内系膜细胞之间有缝隙连接,因此认为它在球旁复合体功能活动中,可能起“信息”传递作用。
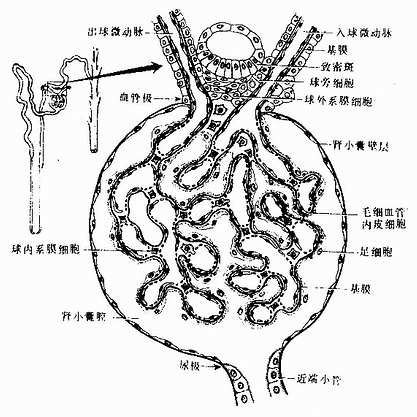
图15-13 肾小体和球旁复合体模式图
(四)肾间质
肾泌尿小管之间的少量结缔组织为肾间质。皮质内的结缔组织少,愈接近肾乳头结缔组织愈多。肾间质中除一般结缔组织成分外,尚有一种特殊的细胞,称为间质细胞(interstitial cell)。细胞呈星形,有较长突起,胞质内除含较多的细胞器外,还有许多嗜锇颗粒。间质细胞具有分泌前列腺素和形成间质内的纤维和基质的功能,细胞突起内微丝的收缩作用,可促进肾间质血管内的血液流动。
(五)肾的血管、淋巴管和神经
1.肾的血管肾脉直接由腹主动脉分出,经肾门入肾后分为数支叶间动脉,在肾柱内上行至皮质与髓质交界处,横行分支为弓形动脉。弓形动脉分出若干小叶间动脉,呈放射状走行于皮质迷路内(图15-14)。直达被膜下形成毛细血管网。小叶间动脉沿途向两侧分出许多入球微动脉进入肾小体,形成血管球。再汇合成出球微动脉。浅表肾单位的出球微动脉离开肾小体后,又分支形成球后毛细血管网,分布在肾小管周围。毛细血管网依次汇合成小叶间静脉,弓形静脉和叶间静脉,它们与相应动脉伴行,最后形成肾静脉出肾。髓旁肾单位的出球微动脉不仅形成球后毛细血管网,而且还发出若干直小动脉直行降入髓质,而后在髓质的不同深度,又返折直行上升为直小静脉,构成“U”形直血管袢,与肾单位袢伴行(图15-14),故血管袢与肾单位袢的功能关系密切(表15-2)。
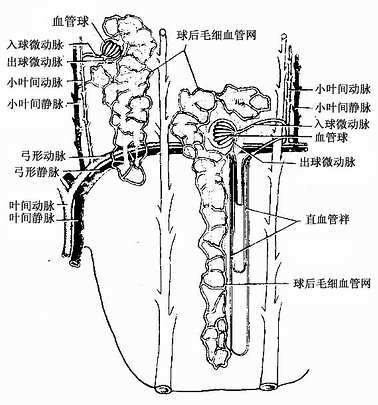
15-14 肾血液循环模式图
表15-2 肾的血循环
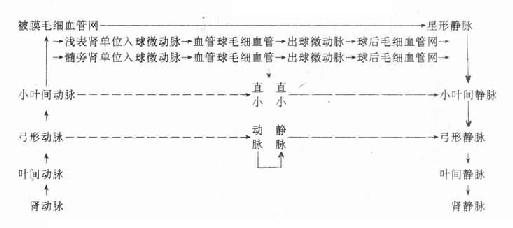
肾血液循环与肾的泌尿功能密切相关,其特点是①肾动脉直接起于腹主动脉,短而粗,血流量大,约占心输出量的1/4,即每4~5分钟人体内的血液全部流经肾内而被滤过。②肾小体血管球的毛细血管两端皆为微动脉,入球微动脉管径比出球微动脉粗,使血管球内血流量大,血压高,有利于滤过。出球微动脉的平滑肌收缩可主动调节血管球内的血压。③肾内血管通路中出现两次毛细血管,即血管球毛细血管和球后毛细血管网,由于血流经血管球时大量水份被滤出,因此分布在肾小管周围的球后毛细血管内血液的胶体渗透压甚高,有利于肾小管上皮细胞重吸收的物质进入血流。④髓质内直小血管袢与髓袢伴行,有利于肾小管和集合小管的重吸收和尿液浓缩。⑤肾内不同区域的血流不同,皮质血流量大,流速快,髓质血流量小,仅占肾血流量的10%,流速亦慢。在急性肾功能衰竭时常由于小叶间动脉发生痉挛收缩,致使皮质浅部供血减少甚至中断,大量血液流经髓质直小血管袢短路循环,致使浅表肾单位的肾小体滤过功能严重低下,甚致缺血性坏死,患者出现少尿,甚至无尿等急性肾功能衰竭症状。
2.肾的淋巴管和神经肾有两组淋巴丛,即肾内淋巴丛和被膜淋巴丛。肾内的毛细淋巴管分布在肾小体和肾小管周围,沿血管逐级汇成小叶间、弓形和叶间淋巴管,经肾门淋巴管出肾。被膜内的毛细淋巴管,汇合而成淋巴管,或与肾内淋巴丛吻合,或汇入邻近器官的淋巴管。
肾的神经来自肾丛,包括交感神经和副交感神经,神经纤维伴随肾脉入肾,分布于肾血管、肾间质和球旁复合体。
(六)肾的其他功能
肾能分泌多种生物活性物质,这些物质对机体生理活动起重要的调节作用。前已述及的肾素-血管紧张素系统,对维持机体正常血及离子交换有重要调节作用。肾皮质内的肾小管上皮可产生激肽释放酶,集合小管上皮能产生激肽。激肽释放酶能促使激肽的形成,激肽有利尿、利钾作用,并能使小动脉舒张,增加肾血流量。肾内的激肽释放酶-激肽系统与肾素-血管紧张素系统及肾间质细胞分泌的前列腺素,三者生理作用有相互关联的复杂关系。肾内产生的红细胞生成因子,能使血液中的红细胞生成素原转变为红细胞生成素,加速红细胞生成。肾还有活化维生素D3及灭活甲状旁腺素、胃泌素和胰岛素等作用。
二、排尿管道
肾产生的终尿经肾盏、肾盂、输尿管、膀胱及尿道等排尿管道排至体外。排尿管道各部分的组织结构基本相似,均由粘膜、肌层和外膜构成。
(一)肾盏和肾盂
肾盏的上皮与乳管上皮相移行,是由2~3层细胞组成的变移上皮。上皮外面有少量结缔组织和平滑肌。肾盂的变移上皮略厚,肌层已可分为内纵、外环两层平滑肌。
(二)输尿管
粘膜形成多条纵行皱襞,管腔呈星形(图15-15)。变移上皮较厚,有4~5层细胞,扩张时可变为2~3层,固有层为结缔组织。输尿管上2/3段的肌层为内纵、外环两层平滑肌,下1/3段肌层增厚。为内纵、中环和外纵三层。输尿管斜穿膀胱壁,开口处粘膜折叠成瓣。当膀胱充盈时,输尿管壁和瓣膜受压封闭,可防止尿液返流。输尿管外膜为疏松结缔组织,与周围结缔组织相移行。
图15-15 人输尿管 HE×100
(上海医科大学组织胚胎学教研室供图)
(三)膀胱
膀胱粘膜形成许多皱襞,仅膀胱三角处的粘膜平滑。膀胱充盈时,皱襞减少或消失。粘膜上皮为变移上皮。膀胱空虚时上皮厚约8~10细胞,表层细胞大,呈矩形;膀胱充盈时上皮变薄,仅3~4层细胞。细胞也变扁。电镜下,表层细胞游离面胞膜有内褶和囊泡,膀胱充盈时内褶可展开拉平。细胞近游离面的胞质较为浓密,可防止膀胱内尿液的侵蚀。固有层含较多的胶原纤维和弹性纤维。肌层厚,由内纵、中环和外纵三层平滑肌组成,各层肌纤维相互交错,分界不清。中层环行肌在尿道内口处增厚为括约肌。外膜多为疏松结缔组织,仅膀胱顶部为浆膜。
第十六章 男性生殖系统
男性生殖系统由睾丸、生殖管道、附属腺及外生殖器组成。睾丸能产生精子,分泌雄激素。附睾、输精管、射精管和尿道是运输精子的生殖管道,附睾还有暂时贮存精子和促进精子成熟的作用。附属腺包括前列腺、精囊和尿道球腺,它们的分泌物称精浆,连同精子构成精液。
一、睾丸
睾丸表面覆以浆膜,即鞘膜脏层,深部为致密结组织构成的白膜(tunica albuginea),白膜在睾丸后缘增厚形成睾丸纵隔(mediastinum testis)。纵隔的结缔组织呈放谢状伸入睾丸实质,将睾丸实质分成约250个锥体形小叶,每个小叶内有1~4条弯曲细长的生精小管,生精小管在近睾丸纵隔处为短而直的直精小管。直精小管进入睾丸纵隔相互吻合形成睾丸网。生精小管之间的疏松结缔组织称睾丸间质(图16-1)。
图16-1 睾丸与附睾模式图
(一)生精小管
成人的生精小管(seminiferous tubule)长30~70cm,直径150~250μm,中央为管腔,壁厚60~80μm,主要由生精上皮(spermatogenic epithelium)构成。生精上皮由支持细胞和5~8层生精细胞(spermatogenic cell)组成。上皮下的基膜明显,基膜外侧有胶原纤维和一些梭形的肌样细胞(myoid cell)。肌样细胞收缩时有助于精子的排出(图16-2)。
图16-2 人生精小管扫描电镜像 ×180
Lu生精小管管腔 SE生精上皮IT间质
1.生精细胞包括精原细胞、初级精母细胞、次级精母细胞、精子细胞和精子。在青春期前,生精小管管腔很小或缺如,管壁中只有支持细胞和精原细胞。自青春期开始,在垂体促性腺激素的作用下,生精细胞不断增殖分化,形成精子,生精小管壁内可见不同发育阶段的生精细胞(图16-3;16-4)。从精原细胞至形成精子的过程称精子发生(spermatogenesis)。
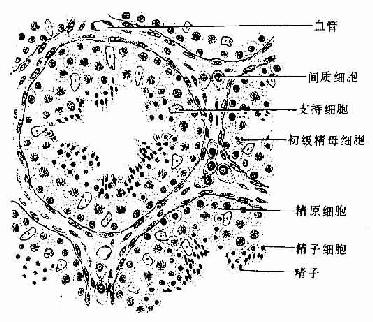
图16-3 生精小管与睾丸间质
图16-4 人生精小管 半薄切片 甲苯胺蓝-派若宁染色×320
A A型精原细胞 ,B B型精原细胞,PS 初级精母细胞,
Sp 精子细胞,Se 支持细胞,Lu管腔
(1)精原细胞:精原细胞(spermatogonium)紧贴生精上皮基膜,圆形或椭圆形,直径约12μm,胞质内除核糖体外,细胞器不发达。精原细胞分A、B两型(图16-5)。A型精原细胞的核呈椭圆形,核染色质深染,核中央常见淡染的小泡;或核染色质细密,有1~2个核仁附在核膜上。A型精原细胞是生精细胞中的干细胞,经过不断地分裂增殖,一部分A型精原细胞继续作为干细胞。另一部分分化为B型精原细胞。B型精原细胞核圆形,核膜上附有较粗的染色质颗粒,核仁位于中央,B型精原细胞经过数次分裂后,分化为初级精母细胞。

图16-5 人生精小管上皮 半薄切片 甲苯胺蓝-派若宁染色× 520
A A型精原细胞, B B型精原细胞,PS 初级精母细胞,
Sp 精子细胞,RB残余胞质Se 支持细胞
(2)初级精母细胞:初级精母细胞(primary spermatocyte)位于精原细胞近腔侧,体积较大,直径约18μm,核大而圆,染色体核型为46,XY。细胞经过DNA复制后(4n,DNA),进行第一次成熟分裂,形成2个次级精母细胞。由于第一次成熟分裂的分裂前期历时较长,所以在生精小管的切面中常可见到处于不同增殖阶段的初级精母细胞(图16-5)。
(3)次级精母细胞:次级精母细胞(secondary spermatocyte)位置靠近管腔,直径约12μm,核圆形,染色较深,染色体核型为23,X或23,Y(2n,DNA)。每条染色体由2条染色单体组成,通过着丝粒相连。次级精母胞不进行DNA复制,即进入第二次成熟分裂,染色体的着丝粒分开,染色单体分离,移向细胞两极,形成两个精子细胞,精子细胞的染色体核型为23,X或23,Y(1n DNA)。由于次级精母细胞存在时间短,故在生精小管切面中不易见到。
成熟分裂又称减数分裂(meiosis),只发生在生殖细胞。成熟分裂的特点是:①成熟分裂后的生殖细胞,染色体数目减半,由二倍体的细胞变成了单倍体细胞,受精(两性生殖细胞结合)后,合子(受精卵)又重新获得与亲代细胞相同的染色体数,保证了物种染色体数的恒定;②在第一次成熟分裂的前期,同源染色体发生联会和交叉,进行遗传基因的交换,从而使配子(精子或卵子)具有不同的基因组合(图16-6)。在成熟分裂过程中,若同源染色体不分裂或基因交换发生差错,将导致配子染色体数目及遗传构成异常,异常的配子受精后,将导致子代畸形。
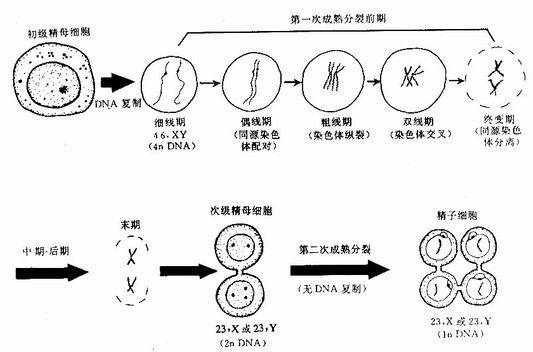
图16-6 生殖细胞成熟分裂示意图
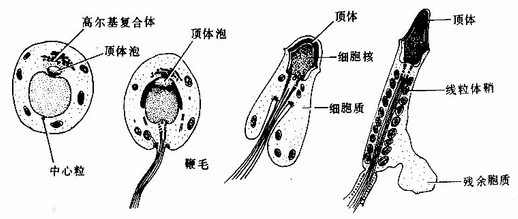
图16-7 精子形成模式图
(4)精子细胞:精子细胞(spermatid)位近管腔,直径约8μm,核圆,染色质致密。精子细胞是单倍体,细胞不再分裂,它经过复杂的变化,由圆形逐渐分化转变为蝌蚪形的精子,这个过程称精子形成(spermiogenesis)(图16-7)。精子形成的主要变化是:①细胞核染色质极度浓缩,核变长并移向细胞的一侧,构成精子的头部;②高尔基复合体形成顶体泡,逐渐增大,凹陷为双层帽状覆盖在核的头端,成为顶体(acrosome);③中心粒迁移到细胞核的尾侧(顶体的相对侧),发出轴丝,随着轴丝逐渐增长,精子细胞变长,形成尾部(或称鞭毛);④线粒体从细胞周边汇聚于轴丝近段的周围,盘绕成螺旋形的线粒体鞘;⑤在细胞核、顶体和轴丝的表面仅覆有细胞膜和薄层细胞质,多余的细胞质逐渐汇集于尾侧,形成残余胞质,最后脱落。
(5)精子:精子(spermatozoon)形似蝌蚪,长约60μm ,分头、尾两部(图16-8)。头部正面观呈卵圆形,侧面观呈梨形。头内主要有一个染色质高度浓缩的细胞核,核的前2/3有顶体覆盖。顶体内含多种水解酶,如顶体蛋白酶、透明质酸酶、酸性磷酸酶等。在受精时,精子释放顶体酶,分解卵子外周的放射冠与透明带,进入卵内。尾部是精子的运动装置,可分为颈段、中段、主段和末段四部分。颈段短,其内主要是中心粒,由中心粒发出9+2排列的微管,构成鞭毛中心的轴丝。在中段,轴丝外侧有9根纵行外周致密纤维,外侧再包有一圈线粒体鞘,为鞭毛摆动提供能量,使精子得以快速向前运动。主段最长,轴丝外周无线粒体鞘,代之以纤维鞘。末段短,仅有轴丝。
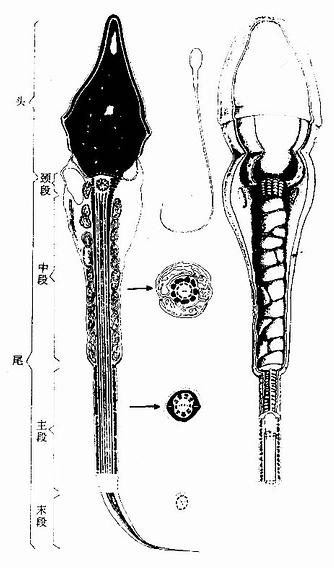
图16-8 精子超微结构模式图
中图示尾部横断面,右图示立体结构
从精原细胞发育为精子,在人约需64±4.5天。一个精原细胞增殖分化所产生的各级生精细胞,细胞质并未完全分开,细胞间始终有细胞质桥相连,形成一个同步发育的细胞群。在生精小管的不同节段,精子的发生是不同步的,后一节段比前一节段的精子发生稍晚,故生精小管可以一批接一批地持续不断地产生精子。故在睾丸组织切片中,可见生精小管的不同断面具有不同发育阶段生精细胞的组合(图16-5)
增殖活跃的生精细胞易受多种物理化学因素的影响,如射线、微波、高温、药物、毒素、性激素及维生素等。如隐睾患者,睾丸位于腹腔或腹股沟管内,因湿度偏高,影响精子发生。服用生棉子油(内含棉酚)或服用雷公藤,可造成精子发生障碍。目前正在研究某些安全有效的抑制精子发生的因素,以期应用于男性抗生育。
2.支持细胞支持细胞(sustentacular cell)又称Sertoli细胞。在光镜下,支持细胞轮廓不清,核常呈不规则形,核染色质稀疏,染色汪和,核仁明显。电镜观察下,支持细胞呈不规则锥体形,基部紧贴基膜,顶部伸达管腔,侧面和腔面有许多不规则凹陷,其内镶嵌着各级生精细胞(图16-9)。胞质内高尔基复和合体较发达,有丰富的粗面内质网、滑面内质网、线粒体、溶酶体和糖原颗粒,并有许多微丝和微管。相邻支持细胞侧面近基部的胞膜形成紧密连接,将生精上皮分成基底室(basal compartment)和近腔室(abluminal compartment)两部分。基底室位于生精上皮基膜和支持细胞紧密连接之间,内有精原细胞;近腔室位于紧密连接上方,与生精小管管腔相通,内有精母细胞、精子细胞和精子。生精小管与血液之间,存在着血-生精小管屏障(blood-seminiferous tubule barrier),其组成包括间质的血管内皮及其基膜、结缔组织、生精上皮基膜和支持细胞紧密连接。紧密连接是构成血-生精小管屏障的主要结构。
支持细胞有多方面的功能。它对生精细胞起支持和营养作用,其微丝和微管的收缩可使不断成熟的生精细胞向腔面移动,并促使精子释放入管腔。精子形成过程中脱落下来的残余胞质,可被支持细胞吞噬和消化。支持细胞分泌的少量液体有助于精子的运送,分泌物中含有一种抑制素(inhibin),它可抑制垂体前叶合成和分泌FSH。支持细胞在FSH和雄激素结合蛋白(androgen binding protein ,ABP),ABP可与雄激素结合,以保持生精小管内雄激素的水平,促进精子发生。支持细胞紧密连接参与构成的血-生精小管屏障,可阻止某些物质进出生精上皮,形成并维持有利于精子发生的微环境,还能防止精子抗原物质逸出到生精小管外而发生自体免疫反应。
图16-9 生精细胞与支持细胞
左图:各级生精细胞与支持细胞关系示意图
右图:支持细胞紧密连接电镜像 ×3600
硝酸鑭灌注固定,Sg精原细胞(位于基底室内)↑支持细胞间的紧密连接
(二)睾丸间质
生精小管之间的睾丸间质为疏松结缔组织,富含血管和淋巴管。间质内除有通常的结缔组织细胞外,还有一种间质细胞(interstitial cell),又Leydig称细胞,细胞成群分布,体积较大,圆形或多边形,核圆居中,胞质嗜酸性较强,具有分泌类固醇激素细胞的超威结构特点(图16-10)。间质细胞分泌的雄激素(androgen)有促进精子发生、促进男性生殖器官的发育与分化以及维持第二性征和性功能等作用。
图16-10 大鼠睾丸间质细胞电镜像 ×10800
M线粒体,粗面内质网;Li脂滴;ER内质网
(三)直精小管和睾丸网
生精小管近睾丸纵隔处变成短而直的管道,管径较细,为直精小管(tubulus rectus),管壁上皮为单层立方或矮柱状,无生精细胞。直精小管进入睾丸纵隔内分支吻合成网状的管道,为睾丸网(rete testis),由单层立方上皮组成,管腔大而不规则。生精小管产生的精子经直精小管和睾丸网出睾丸(图16-11)。
图16-11 生精小管、直精小管和睾丸网关系模式图
(四)睾丸功能的内分泌调节
下丘脑的神经内分泌细胞分泌促性腺释放激素(GnRH),可促进腺垂体远侧部的促性腺激素细胞分泌卵刺激素(FSH)和黄体生成素(LH)。在男性,FSH促进支持细胞合成ABP;LH又称间质细胞刺激素(ICSH),可刺激间质细胞合成和分泌雄激素。ABP可与雄激素结合,从而保持生精小管含有高浓度的雄激素,促进精子发生。支持细胞分泌的抑制素和间质细胞分泌的雄激素,又可反馈抑制下丘脑GnRH和腺垂体FSH及LH的分泌(图16-12)。在正常情况下,各种激素的分泌量是相对恒定的,其中某一种激素分泌量升高或下降,或某一种激素的相应受体改变,将影响精子发生,并致第二性征改变及性功能障碍。
二、生殖管道
(一)附睾
附睾分头、体和尾三部分,头部主要由输出小管组成,体部和尾部由附睾管组成。
1.输出小管 输出小管(efferent duct)是与睾丸网连接的8~12根弯曲小管,构成附睾头的大部,其远端与附睾管相连。输出小管上皮由高柱状细胞及低柱状细胞相间排列构成,故管腔不规则(图16-13)。
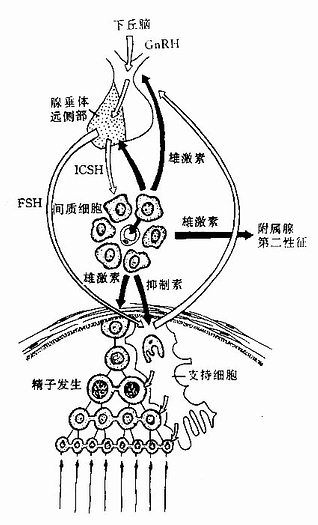
图16-12 睾丸功能内分泌调节示意图
2.附睾管 附睾管(epididymal duct)为一条长4~6m并极度蟠曲的管道,近端与输出小管相连,远端与输精管相连。附睾管的上皮由高柱状细胞和基细胞组成,管腔规则,腔内精子和分泌物(图16-13)。
图16-13 输出小管和附睾管
从附睾的头部、体部至尾部,管道上皮细胞的种类亦有不同。电镜观察下,可见附睾头部上皮中的高柱状细胞胞质深染,核长,位于细胞近腔面,游离面有纤毛伸入管腔。低柱状细胞核靠近基部,核仁明显,胞质中含大量溶酶体及大小不等的吞饮小泡,多位于核的近腔面,细胞游离面常凸向管腔,并有少量微绒毛(图16-14)。高柱状细胞有分泌功能,低柱状细胞有消化和吸收腔内物质的作用。体部及尾部的高柱状细胞表面有成簇排列的粗而长的的微绒毛(又称静纤毛stereocilium),胞质中富含线粒体和粗面内质网,数个高尔基复合体位于核上方,还可见较多有膜包裹的致密颗粒及泡样结构,细胞有分泌和吸收功能。
图16-14 人附睾输出小管电镜像 ×1150
P纤毛柱状细胞,C无纤毛柱状细胞,Ci纤毛
附睾管的上皮基膜外侧有薄层平滑肌围绕,并从管道的头端至尾端逐渐增厚,肌层的收缩有助于管腔内的精子向输精管方向缓慢移动。管壁外为富含血管的疏松结缔组织。
生精小管产生的精子经直精小管、睾丸网进入附睾。精子在附睾内停留8~17天,并经历一系列成熟变化,才能获得运动能力,达到功能上的成熟。这不仅依赖于雄激素的存在,而且与附睾上皮细胞分泌的肉毒碱、甘油磷酸胆碱和唾液酸等密切相关。附睾的功能异常也会影响精子的成熟,导致不育。
(二)输精管
输精管是壁厚腔小的肌性管道,管壁由粘膜、肌层和外膜三层组成。粘膜表面为较薄的假复层柱状上皮,固有层结缔组织中弹性纤维丰富。肌层厚,由内纵、中环、外纵行排列的平滑肌纤维组成。在射精时,肌层作强力收缩,将精子快速排出(图16-15)
图16-15 人输精管 HE ×100
(上海医科大学组织胚胎学教研室供图)
三、附属腺
附属腺和生殖管道的分泌物以及精子共同组成精液(semen)。每次射精射出3~5ml 精液,每ml精液含1亿~2亿个精子;若每ml 的精子数低于400万个,常可导致不育症。
1.前列腺前列腺呈粟形,于尿道起始段。腺的被膜与支架组织均由富含弹性纤维和平滑肌的结缔组织组成。腺实质主要由30~50个复管泡腺组成,有15~30条导管开口于尿道精阜的两侧。腺实质可分三个带:尿道周带(又称粘膜腺),最小,位于尿道粘膜内;内带(又称粘膜下腺),位于粘膜下层;外带(又称主腺),构成前列腺的大部(图16-16)。腺分泌部由单层立方、单层柱状及假复层柱状上皮构成,故腺腔很不规则。腔内可见分泌物浓缩形成的圆形嗜酸性板层状小体,称前列腺凝固体(prostatic concretion),它 随年龄的增长而增多,甚至钙化形成前列腺结石(图16-16)。至青春期,前列腺在雄激素的刺激下分泌增强,分泌物为稀薄的乳白色液体,富含酸性磷酸酶和纤维蛋白溶酶,还有柠檬酸和锌等物质。老年时,雄激素分泌减少,腺组织逐渐萎缩。但某些老年人的前列腺增生肥大,压迫尿道,造成排尿困难,此时分泌物中的锌含量增多。慢性前列腺炎易出现纤维蛋白溶酶异常继而引起精液不液化,影响精子的运动及受精能力。前列腺癌主要发生在腺的外带,此时分泌物中的酸性磷酸酶含量增多,而锌的含量下降。
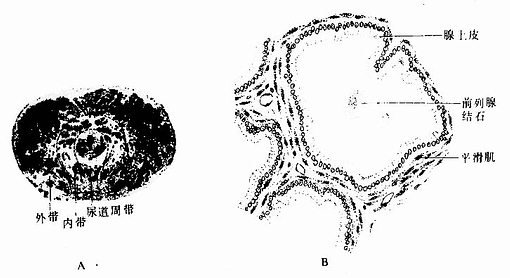
图16-16 前列腺
A 人前列腺横断面示前列腺分部 HE× 2.5 B前列腺分泌部模式图
2.精囊精囊是一对蟠曲的囊状器官。粘膜向腔内突起形成高大的皱襞,皱襞又彼此融合,将囊腔分隔为许多彼此通连的小腔,大大增加了粘膜的分泌表面积。粘膜表面是假复层柱状上皮,胞质内含有许多分泌颗粒和黄色的脂色素。粘膜外有薄的平滑肌层和结缔组织外膜。在雄激素刺激下。精囊分泌弱碱性的淡黄色液体,内含果糖、前列腺素等成分。果糖为精子的运动提供能量。
3.尿道球腺尿道球腺是一对豌豆状的复管泡状腺。上皮为单层立方或单层柱状,上皮细胞内富含粘原颗粒。腺体分泌的粘液于射精前排出,以润滑尿道。腺的间质中有平滑肌和骨骼肌纤维。
四、阴茎
阴茎主要由两阴茎海绵体和一个尿道海绵体构成,尿道行于尿道海绵体内(图16-17)。阴茎外表被覆以活动度较大的皮肤。海绵体主要由勃起组织构成,外包以致密结缔组织组成的坚韧白膜。勃起组织是以具有大量不规则的血窦为特征的海绵状组织,血窦彼此通连,血窦之间是富含平滑肌纤维的结缔组织小梁。阴茎深动脉的分支螺旋动脉穿行于小梁中,与血窦通连。静脉多位于海绵体周边部白膜下方。白膜结构坚韧,具有限制海绵体及其内的血窦过分扩张的作用。一般情况下,流入血窦的血液很少,血窦呈裂隙状,海绵体软。当大量血液流入血窦,血窦充血而胀大,白膜下的静脉受压,血液回流一时受阻,海绵体变硬,阴茎勃起。
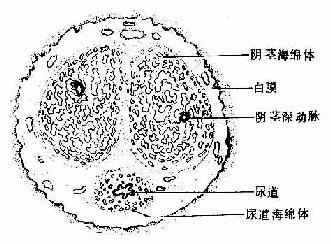
图16-17 阴茎横断面
第十七章 女性生殖系统
女性生殖系统包括卵巢、输卵管、子宫、阴道和外生殖器。乳腺也列入本章叙述。卵巢产生卵细胞和分泌性激素;输卵管输送卵细胞,也是卵受精的场所;子宫是孕育胎儿的器官。女性生殖器官有明显的年龄变化,10岁以前生殖器官生长迟缓,10岁后逐渐发育生长,至青春期(13~18岁),生殖器官迅速发育成熟,卵巢开始排卵并分泌性激素,子宫内膜出现周期性变化,乳房增大,性成熟,具有生育能力。更年期(45~55岁)的卵巢功能逐渐减退,生殖器官日趋萎缩。绝经期以后,卵巢退变,结缔组织增生,不再排卵。
一、卵巢
卵巢表面覆盖一层单层扁平或立方的表面上皮,上皮下方为薄层致密结缔组织构成的白膜。卵巢的外周部分称皮质,中央为髓质。皮质较厚,含有不同发育阶段的卵泡以及黄体和退变的闭锁卵泡等,卵泡间的结缔组织富有网状纤维和梭形基质细胞。髓质由疏松结缔组织构成,与皮质无明显分界,含有许多血管和淋巴管等。近卵巢门处有少量平滑肌束及门细胞(图17-1)。
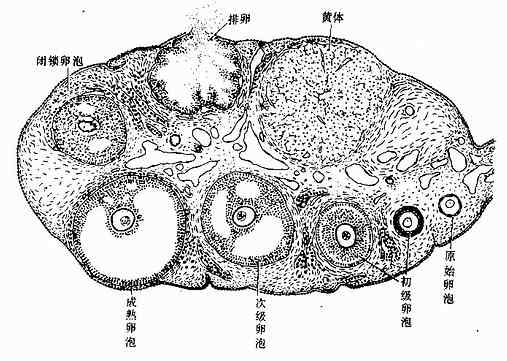
图17-1 卵巢
(一)卵泡的发育与成熟
新生儿两侧卵巢有70万~200万个原始卵泡,青春期约有4万个,至40~50岁时仅剩几百个。在胎儿及儿童期可偶见少量卵泡生长,但都不能发育成熟。从青春期至绝经期30~40年生育时期,卵巢在垂体周期性分泌的促性腺激素的影响下,每隔28天左右有1个卵泡发育成熟并排出1个卵细胞,左右卵巢交替排卵。一生中约排卵400余个,其余卵泡均于不同年龄先后退化为闭锁卵泡。
卵泡由卵母细胞(oocyte)和卵泡细胞(follicular cell)组成。卵泡发育是个连续的生长过程,其结构发生一系列变化,一般可分为原始卵泡、初级卵泡、次级卵泡和成熟卵泡四个阶段。初级卵泡和次级卵泡又合称为生长卵泡。
1.原始卵泡原始卵泡(primordial follicle)位于皮质浅部,体积小,数量多(图17-2)。卵泡中央有一个初级卵母细胞(primary oocyte),周围为单层扁平的卵泡细胞(又称颗粒细胞)。初级卵母细胞圆形,较大,直径约40μm ,核大而圆,染色质细疏,着色浅,核仁大而明显,胞质嗜酸性。电镜下观察,胞质内除含有一般细胞器外,核周处有层状排列的滑面内质网(称环层板),并可见内质网与核膜相连,这可能与核和胞质间物质传递有关。初级卵母细胞是在胚胎时期由卵原细胞分裂分化液组成,随即进入第一次成熟分裂,并长期停滞于分裂前期(12~50年不等),直至排卵前才完成第一次成熟分裂。卵泡细胞较小,扁平形,细胞与外周结缔组织之间有薄层基膜。卵泡细胞具有支持和营养卵母细胞的作用,卵泡细胞与卵母细胞之间有许多缝隙连接。
2.初级卵泡初级卵泡(primary follicle)由原始卵泡发育形成。此时期的初级卵母细胞体积增大,卵泡细胞由单层扁平变为立方形或柱状,随之细胞增殖成多层(5~6层)。在排列紧密的卵泡细胞间开始出现考尔-爱克斯诺小体(call-Exner body),其数量随卵泡的生长而增多(图17-2)。小体为圆形囊泡,腔面是一层基膜,周围紧密排列的卵泡细胞,腔内含有卵泡细胞分泌的物质,参与卵泡液的形成。卵巢颗粒细胞肿瘤与考尔-爱克斯诺小体的分化有关,在初级卵泡早期,卵母细胞和卵泡细胞之间出现一层含糖蛋白的嗜酸性膜,称为透明带(zona pellucida),它是卵泡细胞和初级卵母细胞共同分泌形成的。电镜下可见初级卵母细胞的微绒毛和卵泡细胞的突起伸入透明带(图17-3,17-4),卵泡细胞的长突起可穿越透明带与卵母细胞膜接触。在卵泡细胞与卵母细胞之间或卵泡细胞之间有许多缝隙连接。这些结构有利于卵泡细胞将营养物质输送给卵母细胞以及细胞间离子、激素和小分子物质的交换,沟通信息,协调功能。此外,在受精过程中,透明带对精子与卵细胞间的相互识别和特异性结合具有重要意义。随着初级卵泡的体积增大,卵泡渐向卵巢皮质深部移动。卵泡周的结缔组织梭形细胞逐渐密集形成卵泡膜,它与卵泡细胞之间隔以基膜。
图17-2 人卵巢HE ×160
A原始卵泡(↑) B初级卵泡 ↑示透明带
C次级卵泡 ↑示考尔- 爱克斯诺小体,左上角为该小体的高倍像
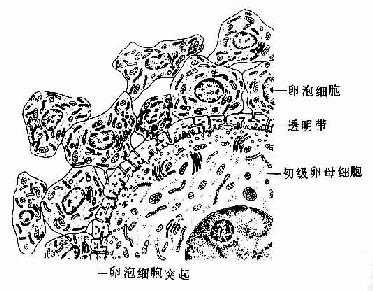
图17-3 初级卵泡超微结构模式图
图17-4 大鼠卵泡电镜像 ×10500PO初级卵母细胞,
Z透明带,FC卵泡细胞(白求恩医科大学尹昕、朱秀雄教授供图)
3.次级卵泡初级卵继续生长成为次级卵泡(secondary follicle),卵泡体积更大,卵泡细胞增至6~12层,细胞间出现一些不规则的腔隙,并逐渐合并成一个半月形的腔,称为卵泡腔(follicullar antrum),腔内充满卵泡液(图17-2)。卵泡液是由卵泡细胞分泌和卵泡膜血管渗出液组成,卵泡液除含有一般营养成分外,还有卵泡分泌的类固醇激素和多种生物活性物质,对卵泡的发育成熟有重要影响。随着卵泡液的增多及卵泡腔扩大,卵母细胞居于卵泡的一侧,并与其周围的颗粒细胞一起突向卵泡腔,形成卵丘(cumulus oophorus)。此时初级卵母细胞直径可达125~150/μm。紧贴透明带的一层柱状卵泡细胞呈放射状排列,称放射冠(corona radiata)。分布在卵泡腔周边的卵泡细胞较小,构成卵泡壁,称为颗粒层(stratum granulosum)。在卵泡生长过程中,卵泡膜分化为内、外两层。内膜层(theca interna)含有较多的多边形或梭形的膜细胞(theca cell)及丰富的毛细血管,膜细胞具有分泌类固醇激素的结构特征。外膜层(theca externa)主要由结缔组织构成,胶原纤维较多,并含有平滑肌纤维。具有卵泡腔的次级卵泡和成熟卵泡又称为囊状卵泡。
4.成熟卵泡成熟卵泡(mature follicle)是卵泡发育的最后阶段。卵泡体积很大,直径可达20mm,并向卵巢表面突出(图17-1,17-5)。成熟卵泡的卵泡腔很大,颗粒层甚薄,颗粒细胞也不再增殖。此时的初级卵母细胞又恢复成熟分裂,在排卵前36~48小时完成第一次成熟分裂。产生1个次级卵母细胞(secondary oocyte)和1个很小的第一极体(first polar body)。第一极体位于次级卵母细胞和透明带之间的卵周间隙(perivitelline space)内。次级卵母细胞随即进入第二次成熟分裂,停止于分裂中期。人每个月经周期,可有若干个原始卵泡生长发育,通常只有1个卵泡发育成熟并排卵。

图17-5 猫卵巢内的近成熟卵泡 HE×160
传统认为,人原始卵泡发育至成熟排卵是在1个月经周期的增生期内完成(约10~15天)。近些年对某些动物和人卵泡生长发育的研究揭示,卵泡生长速度较慢,1个原始卵泡发育至成熟排卵,并非在1个月经周期内完成,而是跨几个周期才能完成。在1个周期内,卵巢虽然有若干不同发育状况的卵泡,但其中只有1个卵泡发育至一定大小时才可在垂体促性腺激素的作用下,于月经周期增生期内迅速生长成熟并排卵。Gougen观察手术切除的人卵巢,研究卵泡生长至排卵所需的时间,观察卵泡膜内层细胞的分化,并结合颗粒细胞数量的增长,将有膜细胞的卵泡生长分为8个等级,且以体外培养颗粒细胞分裂周期的时间为参数,计算卵泡生长每个等级所需的时间。分级情况如下(图17-6):初级卵泡进入第一级是在黄体期开始时,约经25天在第2个月经周期的卵泡期转入第2级,此时卵泡腔出现;约经20天黄体期末转入第3级,此时期的颗粒细胞分裂增殖较明显;又经15天,于第3个月经周期,转入第4级;再经10天,在黄体期末转入第5级;此后相继转入第6,7,8级,其间各相隔5天,此阶段的健康卵泡数很少。健康的7级和8级卵泡仅见于第4个月经周期的卵泡期中期和晚期。
从初级卵泡后期至成熟排卵约需85天(图17-6)。从小囊状卵泡发育至排卵约需2个月。

图17-6 人卵泡生长过程中卵泡膜分化与颗粒细胞数的增长
卵泡发育过程中还有内分泌功能,主要分泌雌激素。雌激素是颗粒细胞和膜细胞在FSH和LH的作用下协同合成的。膜细胞合成的雄激素透过基膜进入颗粒细胞,在芳香化酶系的作用下雄激素转变为雌激素,这是雌激素合成的主要方式,称此为“两细胞学说”(图17-7)。合成的雌激素小部分进入卵泡腔,大部分释放入血,调节子宫内膜等靶细胞的生长分化。
图17-7 颗粒细胞与膜细胞协同合成雌激素示意图
(二)排卵
成熟卵泡破裂,卵母细胞自卵巢排出的过程称为排卵(ovulation)。排卵时间约在月经周期的第14天。在排卵前,垂体释放LH量骤增,使卵泡发生一系列变化。卵泡液增多,突向卵巢表面的卵泡壁、白膜和表面上皮均变薄,局部缺血,形成圆形透明的卵泡小斑(follicular stigma)(图17-8)。排卵时,卵丘与卵泡壁分离,小斑处的结缔组织被胶原酶和透明质酸酶解聚,LH促进颗粒细胞合成的前列腺素使卵泡膜外层的平滑肌收缩,导致小斑破裂。卵母细胞及其外周的透明带和放射冠细胞随卵泡液从卵巢排出,经腹膜腔进入输卵管。卵排出后若在24小时内不受精,次级卵母细胞即退化;若与精子相遇受精,次级卵母细胞即完成第二次成熟分裂,形成1个成熟的卵细胞(ovum)和1个第二极体(secondary polar body)。卵母细胞经过两次成熟分裂,卵细胞的染色体减半,从二倍体细胞(46,XX)变为单倍体细胞(23,X)。
图17-8 成熟卵泡排卵模式图
(三)黄体的形成和功能
成熟卵泡排卵后,残留在卵巢内的卵泡壁塌陷,卵泡膜内的血管和结缔组织伸入颗粒层。在LH的作用下。卵泡壁的细胞体积增大,分化为一个体积很大并富含血管的内分泌细胞团,新鲜时呈黄色,称为黄体(corpus luteum)(图17-1)。颗粒细胞分化为粒黄体细胞(granular lutein cell),膜细胞分化为膜黄体细胞(theca lutein cell)。粒黄体细胞较大,呈多角形,染色较浅,数量多;膜黄体细胞较小,圆形或多角形,染色较深,数量少,分布于黄体的周边部(图17-9)。这两种细胞具有分泌类固醇激素细胞的结构特征,细胞内有丰富的滑面内质网和管状嵴的线粒体,还有脂滴和黄色脂色素。黄体的主要功能是分泌孕激素和一些雌激素,前者由粒黄体细胞分泌,后者主要由两种细胞协同分泌。
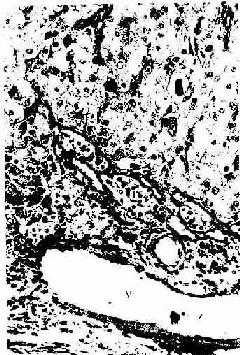
图17-9 人卵巢黄体细胞 HE×400
G粒黄体细胞 T膜黄体细胞V血管
黄体的发育因卵细胞是否受精而差别甚大。卵细胞若未受精,黄体仅维持2周,称月经黄体(corpus luteum of menstruation),黄体细胞迅速变小和退化,渐被结缔组织取代,称为白体(corpus albicans)。卵细胞若受精,黄体在胎盘分泌的人绒毛膜促性腺激素(HCG)的作用下继续发育增大,直径可达4~5cm ,称妊娠黄体(corpus luteum of pregnancy)。妊娠黄体可保持6个月,以后也退化为白体。妊娠黄体的粒黄体细胞还分泌松弛素(relaxin),它可使妊娠子宫平滑肌松弛,以维持妊娠。
(四)卵泡闭锁与间质腺
卵巢的绝大部分卵泡不能发育成熟,它们在卵泡发育的各阶段逐渐退化,退化的卵泡称为闭锁卵泡(atresic follicle)(图17-1,17-5)。卵泡闭锁时形态结构的变化与卵母的大小相关。原始卵泡退化时,卵泡细胞首先出现核固缩,细胞形态不规则。卵泡细胞变小且分散,两种细胞随后均自溶消失。初级卵泡和早期次级卵泡的退化与原始卵泡相似,但退化的卵泡内可见残留的透明带,卵泡腔内常见中性粒细胞和巨噬细胞。晚期次级卵泡的闭锁变化较特殊,卵泡塌陷,卵泡膜的血管和结缔组织伸入颗粒层及卵丘,膜细胞一度增大,形成多边形上皮样细胞,胞质中充满脂滴,形似黄体细胞,并被结缔组织和血管分隔成分散的细胞团索,称为间质腺(interstitial gland)。成人卵巢间质腺细胞数量少,且散在分布于基质中;猫及啮齿动物卵巢的间质腺较多,有分泌雌激素的功能。
(五)门细胞
门细胞(hilus cell)位于卵巢门近系膜处,则一些较大的上皮样细胞,细胞结构与睾丸间质细胞类似,胞质内富含胆固醇和脂色素等。妊娠期和绝经期的门细胞较明显,有分泌雄激素的功能。倘若门细胞增生或发生肿瘤时,患者常伴有男性化症状。
二、输卵管
输卵管主要分漏斗部、壶腹部、峡部和子宫部,管壁均由粘膜、肌层和浆膜三层组成。
粘膜形成许多纵行而分支的皱襞,壶腹部的皱襞最发达,高而多分支,故管腔不规则(图17-10);至子宫部的皱襞渐减少。粘膜上皮为单层柱状。由纤毛细胞和分泌细胞组成(图17-11)。纤毛细胞以漏斗部和壶腹部最多,至峡部和子宫部逐渐减少,纤毛向子宫方向摆动,使卵移向子宫并阻止病菌进入腹膜腔.分泌细胞表面有微绒毛,顶部胞质内有分泌颗粒,其分泌物构成输卵管液。输卵管上皮细胞在卵巢雌激素和孕激素的作用下,随月经周期而有变化。雌激素促进输卵管上皮细胞的生长的功能活动,在子宫内膜增生晚期(排卵前)。纤毛细胞变成高柱状,纤毛增多,分泌细胞顶部充满分泌颗粒,功能旺盛。至分泌晚期,两种细胞均变矮,分泌细胞的分泌颗粒排空,纤毛细胞的纤毛也减少。在月经期和妊娠期,上皮细胞矮小。粘膜固有层为薄层细密的结缔组织,并有少量散在的平滑肌。
肌层以峡部最厚,由内环行和外纵行两层平滑肌组成。壶腹部肌层较薄,环行肌明显,纵行肌散在分布。输卵管浆膜由间皮和富含血管的疏松结缔组织组成。
图17-10 人输卵管壶腹部 HE × 83
图17-11 输卵管上皮
三、子宫
子宫为肌性器官,腔窄壁厚,分底部、体部、颈部三部分。体部和底部的子宫壁由外向内分为外膜、肌层和内膜(又称粘膜)(图17-12)。
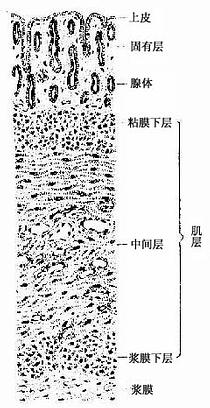
图17-12 子宫壁
(一)子宫壁的组织结构
1.外膜子宫外膜(perimetrium)于底部和体部为浆膜,其余部分纤维膜。
2.肌层子宫肌层(myometrium)甚厚,由成束或成片的平滑肌组成,肌束间以结缔组织分隔。肌层分层不明显,各层肌纤维互相交织,自内向外大致可分为粘膜下层、中间层和浆膜下层。粘膜下层和浆膜下层主要为纵行平滑肌束,中间层较厚,分内环行的外纵行肌,富含血管。成年妇女子宫平滑肌纤维长约50μm,妊娠时肌纤维显着增长,可长达500μm以上,肌纤维可分裂增殖,结缔组织中未分化的间充质细胞也可分化为肌纤维,使肌层增厚。分娩后,部分肌纤维恢复正常大小,部分肌纤维退化消失,增大的子宫恢复原状。子宫平滑肌的收缩受激素的调节,其收缩活动有助于精子向输卵管运送及经血排出和胎儿娩出。
3.内膜子宫内膜(endometrium)由单层柱状上皮和固有层组成。内膜表面的上皮向固有层内深陷形成许多管状的子宫腺,其末端近肌层处常有分支。表面上皮与腺上皮结构相似,均由分泌细胞和少量纤毛细胞构成,但分布于子宫功能层的腺上皮细胞对卵巢激素反应敏感而有周期性变化,固有层较厚,血管较丰富,并有大量分化较低的梭形或星状细胞,称为基质细胞(stroma cell)。
子宫底部和体部的内膜可分为功能层(functional layer)和基底层(basal layer)两层。功能层位于浅部,较厚,自青春期起在卵巢激素的作用下发生周期性剥脱和出血。妊娠时,胚泡植入功能层并在其中生长发育。基底层较薄,位于内膜深部与肌层相邻,此层无周期性脱落变化,有修复内膜的功能。
子宫动脉的分支经外膜穿入子宫肌层,在中间层内形成弓形动脉。从弓形动脉发出许多放射状分支,垂直穿入内膜,在内膜与肌层交界处,每条小动脉发出一小而直的分支称基底动脉,分布于内膜基底层,它不受性激素的影响。小动脉主干从内膜基底层一直延伸至功能层浅部,呈螺旋状走行,称螺旋动脉(图17-13)。螺旋动脉在内膜浅部形成毛细血管网,毛细血管汇入小静脉,穿越肌层,汇合成子宫静脉。螺旋动脉对卵巢激素的作用很敏感。
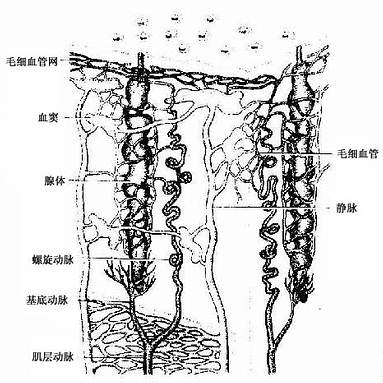
图17 -13 子宫内膜血管与腺模式图
(二)子宫内膜周期性变化
自青春期起,在卵巢分泌的雌激素和孕激素的周期性作用下,子宫底部和体部的功能层内膜出现周期性变化,每28天左右发生一次内膜脱与出血及修复和增生,称为月经周期(menstrual cycle)。每个月经周期是从月经第1天起至下次月经来前一天止。内膜周期性变化一般分为三期,即月经期、增生期和分泌期(图17-14)。
图17-14 子宫内膜周期性变化示意图
1.月经期月经期(menstrual phase)为周期第1~4天。由于卵巢内的黄体退化,雌激素和孕激素分泌量骤然下降,子宫内膜功能层的螺旋动脉发生持续性收缩,内膜缺血,组织坏死。螺旋动脉在收缩之后,又突然短暂地扩张,血液溢入结缔组织,最终突破退变坏死的内膜表层,流入子宫腔,从阴道排出,即为经血。退变及坏死的内膜呈小块状剥脱,直至功能层深部。月经期的持续时间一般为3~5天,因个体而差异并受环境变化的影响。在月经终止前,内膜基底层子宫腺残端的细胞迅速分裂增生,并铺展在脱落的内膜表面,内膜修复而进入增生期。
2.增生期增生期(proliferation phase)又称卵泡期(follicular phase),为周期的第5~14天。此时期的卵巢内有若干卵泡生长,在卵泡分泌的雌激素作用下,子宫内膜发生增生性变化。在月经终止前,子宫内膜已修复,增生早期的子宫腺短直而细,数量较少。在整个增生期内的上皮细胞与基质细胞不断分裂增殖,子宫腺细胞对激素的反应也较强,雌激素使腺上皮逐渐生长与分化(图17-15)。至增生晚期(第11~14天),内膜增厚达1~3mm,子宫腺也增多,并不断增长和弯曲,上皮细胞分化成熟,胞质中糖原积聚,腺腔扩大。螺旋动脉也增长并弯曲。至增生期未,卵巢内的成熟卵泡排卵,子宫内膜由增生期转入分泌期。
图17-15 人子宫内膜增生期
HE×320 ↓子宫腺
3.分泌期分泌期(secretory phase)又称黄体期(luteal phase)。此时卵巢已排卵,黄体形成。子宫内膜在黄体分泌的雌激素和孕激素,尤其是孕激素的作用下继续增厚,于分泌早期(排卵后2天),子宫腺更弯曲,腔也变大,腺细胞核下区出现大量糖原聚积,细胞核则移至细胞顶部。在HE染色切片中,糖原被溶解,构成光镜下所见的核下空泡(图17-16)。随后,腺细胞核下区糖原渐转移至细胞顶部即核上区,并以顶浆分泌方式排入腺腔,腺腔内可见含糖原的嗜酸性分泌物(图17-17)。腺细胞分泌活动于周期第21天达高峰。腺细胞排泌后,细胞低矮,腺腔扩大呈锯齿状(图17-14)。此时期的固有层内组织液增多,内膜水肿,螺旋动脉增长并更弯曲,伸至内膜表层。于分泌晚期,基质细胞增生并分化形成两种细胞。一种为前蜕膜细胞(predecidual cell),细胞体积大而圆,胞质中含有糖原及脂滴;于妊娠期,前蜕膜细胞在妊娠黄体分泌的孕激素影响下,继续发育增大,成为蜕膜细胞。另一种细胞为内膜颗粒细胞,细胞体积较小,圆形,胞质内含有颗粒,细胞分泌松弛素。至分泌晚期,内膜可厚达5mm。卵若受精,内膜继续增厚;卵若未受精,卵巢内的月经黄体退变,孕激素和雌激素水平下降,内膜脱落又转入月经期。
绝经后,卵巢功能退化,激素分泌停止,子宫内膜萎缩变薄,仅残留稀少而细小的腺体。

图17-16 人子宫内膜分泌早期的子宫腺HE×400 ↑示腺细胞核下空泡
图17-17人子宫内膜分泌早期子宫腺电镜像 ×6000
↑腺细胞核下糖原斑,(![]() )顶浆分泌
)顶浆分泌
(三)子宫颈
子宫颈为子宫下端较窄的圆柱体,长约3cm,突入阴道的部分称为宫颈道部,在阴道穹窿以上的部分称阴道上部。子宫颈管腔细窄呈梭形,子宫颈壁由外向内分为外膜、肌层和粘膜。外膜是结缔组织构成的纤维膜,肌层由平滑肌及含有丰富弹性纤维的结缔组织组成,平滑肌数量从宫颈上端至下端逐渐减少。子宫颈粘膜由单层柱状上皮及固有层组成。子宫颈管前、后壁粘膜分别形成一条纵襞,从纵襞向外又伸出许多斜行皱臂,皱臂之间的裂隙形成腺样隐窝。粘膜上皮由分泌细胞、纤毛细胞及储备细胞(reserve cell)构成。宫颈粘膜无周期性脱落,但上皮细胞的活动受卵巢激素的调节。分泌细胞数量较多,胞质中充满粘原颗粒,雌激素促使细胞分泌增多,分泌物为稀薄粘液,有利于精子通过。孕激素使细胞分泌减少,分泌物粘稠呈凝胶状,形成阻止精子及微生物进入子宫的屏障。纤毛细胞数量较少,纤毛向阴道方向摆动,以助分泌物排出。储备细胞小,位于柱状细胞与基膜之间,散在分布,细胞分化较低,在上皮受损伤时有增殖修复功能。子宫颈慢性炎症时,储备细胞增殖化生为复层扁平上皮,在增生过程中也可发生癌变.在宫颈外口处,单层柱状上皮移行为复层扁平上皮,两种上皮分界清晰,交界处是宫颈癌好发部位.
子宫颈阴道部的复层扁平上皮与阴道上皮相似,细胞内含丰富的糖原。在性激素周期的影响下,上皮细胞的结构和功能可略有变化。
绝经后,宫颈变小,质硬,粘膜萎缩,腺样隐窝减少,分泌功能低下。
(四)卵巢和子宫内膜周期性变化的神经内分泌调节
女性生殖器官的周期性变化,主要在神经系统调控下受下丘脑、脑垂体和卵巢的激素的调节,称此为下丘脑-垂体-卵巢轴(图17-18).下丘脑弓状核等神经内分泌细胞分泌促性腺激素释放激素(G nRH),促使腺垂体分泌FSH和LH,LH的合成与释放受GnRH的严格控制,FSH的分泌还受其他因素的影响。FSH刺激卵泡的生长和成熟,并分泌雌激素(雌二醇),在FSH的协同作用下促成排卵及黄体形成。
月经来潮时,血液内的FSH开始略有升高;在卵泡发育早期,FSH维持较低水平,随着卵泡的生长,雌激素分泌量逐渐增高,子宫内膜呈增生期变化。约在排卵前2天,血液内雌激素含量达高峰,高水平的雌激素和GnRH的作用促使垂体分泌大量LH,出现排卵前LH释放高峰;与此同时血液内FSH也增高,但峰值比LH低。雌激素可增强促性腺激素细胞对GnRH的反应性,并促使其合成的激素大量释放,排卵常发生于LH高峰后24小时左右。排卵后,卵泡壁LH的作用下形成黄体,分泌大量孕激素(孕酮)和一些雌激素,子宫内膜在这两种激素作用下呈分泌期变化。血液内高水平的孕激素和雌激素还对下丘脑和垂体起负反馈作用,分别掏LH和FSH的分泌。当黄体缺乏LH的支持作用,即逐渐退化,孕激素和雌激素水平下降,子宫内膜遂发生退变和剥脱。
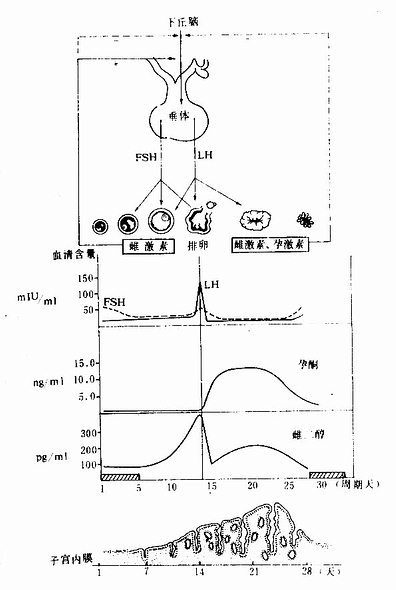
图17-18下丘脑、垂体、卵巢内分泌与子宫
内膜周期变化的关系
四、阴道
阴道壁由粘膜、肌层和外膜组成。阴道粘膜形成许多横形皱襞,粘膜上皮为非角化型复层扁平上皮,较厚,一般情况下表层细胞虽含透明角质颗粒,但不出现角化(图17-19)。在阴道脱垂病人,局部上皮可出现角化。阴道上皮的脱落与更新及其一定的周期性变化受卵巢激素的影响,雌激素促使阴道上皮增厚,并使细胞合成大量糖原。在月经周期增生晚期阴道上皮最厚。在子宫内膜分泌晚期雌激素水平下降时,阴道上皮细胞脱落明显,上皮变薄。临床可通过阴道上皮脱落细胞的涂片观察,了解卵巢内分泌功能状态。脱落细胞中除阴道上皮细胞外,还有子宫颈及子宫内膜的脱落细胞,故阴道涂片检查也是诊断生殖道肿瘤的一种方法。阴道上皮细胞脱落后,细胞内糖原被阴道内的乳酸杆菌分解为乳酸,使阴道分泌物保持酸性,有一定的抗菌作用。绝经后阻道粘膜萎缩,上皮变薄,脱落细胞少,阴道液pH值上升,细菌易繁殖而导致阴道炎。粘膜固有层的浅层是较致密的结缔组织,含有丰富的毛细血管和弹性纤维,深层有丰富的静脉丛。

图17 -19 成人阴道粘膜 HE×160
阴道肌层为平滑肌,较薄弱,肌束呈螺旋状,交错成格子状排列,其间的结缔组织中弹性纤维较丰富。阴道肌层的这种结构特点使阴道壁易于扩大。阴道外口有骨骼肌构成的环行括约肌,称尿道阴道括约肌。外膜为富于弹性纤维的致密结缔组织。
五、乳腺
乳腺于青春期开始发育,其结构随年龄和生理状况的变化而异。妊娠期和授乳期的乳腺分泌乳汁,称活动期乳腺。无分泌功能的乳腺,称静止期乳腺。
(一)乳腺的一般结构
乳腺被结缔组织分隔为15~25个叶,每个叶又分为若干小叶,每个小叶是一个复管泡状腺。腺泡上皮为单层立方或柱状,在上皮细胞和基膜间有肌上皮细胞。导管包括小叶内导管、上间导管和总导管。小叶内导管多为单层柱状或立方上皮,小叶间导管为复层柱状上皮,总导管又称输乳管,开口于乳头,管壁为复层扁平上皮,下乳头表皮相续。
(二)静止期乳腺
静止期乳腺是指未孕女性的乳腺,腺体不发达,仅见少量导管和小的腺泡,脂肪组织和结缔组织丰富(图17-20)。在排卵后,腺泡和导管略有增生。。
图17-20 静止期乳腺
(三)活动期乳腺
妊娠期在雌激素和孕激素的作用下,乳腺的小导管和腺泡迅速增生,腺泡增大,上皮为单层柱状或立方细胞,结缔组织和脂肪组织相应减少。至妊娠后期,在垂体分泌的催乳激素的影响下,腺泡开始分泌。乳腺为顶浆分泌腺,分泌物中含有脂滴、乳蛋白、乳呼抗体等,称为初乳。初乳内还有吞噬脂肪的巨噬细胞,称初乳小体(图17-21)。
图17-21 妊娠期乳腺左上示的初乳中的脂滴和初乳小体
哺乳期乳腺结构与妊娠期乳腺相似,但腺体发育更好,腺泡腔增大。腺泡处于不同的分泌时期,有的腺泡呈分泌前期,腺细胞呈高柱状;有的腺泡处于分泌后期,朱细胞呈立方形或扁平形,腺腔充满乳汁(图17-21)。腺细胞内富含粗面内质网和线粒体等,呈分泌状态的腺细胞内有许多分泌颗粒和脂滴(图17-22)。
图17-22 哺乳期乳腺腺细胞超微结构模式图
断乳后,催乳激素水平下降,乳腺停止分泌,腺组织逐渐萎缩,结缔组织和脂肪组织增多,乳腺又转入静止期。绝经后,体内雌激素及孕激素水平下降,乳腺组织萎缩退化,脂肪也减少。
第十八章 眼和耳
一、眼
眼是视觉器官,由接受光刺激的眼球及起辅助作用的眼睑、眼外肌和泪器等附器官组成。眼球近似圆球体,其外壳称眼球壁,从外至内可分为三层:①.纤维膜,主要为致密结缔组织;②血管膜,为含大量血管和色素细胞的疏松结缔组织;③视网膜,为神经组织,是脑的外延部分。从眼球前部至后部、纤维膜分为角膜与巩膜、血管膜分为虹膜基质、睫状体基质与脉络膜,视网膜分为盲部与视部。盲部包括虹膜上皮和睫状体上皮。眼球内容物有房水、晶状体和玻璃体,均无色透明,与角膜一起组成眼球的屈光介质(图18-1)。
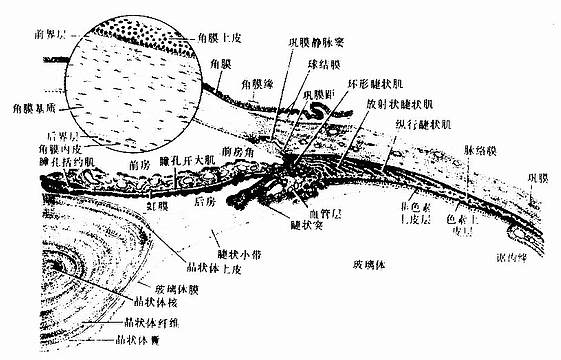
图18-1 眼球前半部切面
(一)眼球壁
1.角膜角膜(cornea)呈透明的圆盘状,略向前方突出,边缘与巩膜相连。角膜层次分明、从前至后共分5层(图18-1,18-2)。
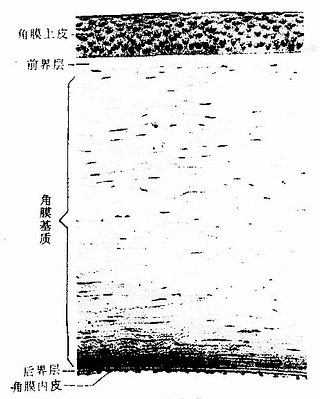
图18-2 人眼球的角膜 HE×200
(1)角膜上皮(corneal epithelium):为未角化的复层扁平上皮,细胞排列整齐,有5~6层。表层细胞游离面有许多短小的突起,浸浴在泪液膜中。上皮基部平坦,基底层细胞常见分裂像,表明角膜上皮更新较快,并有较强的再生能力。上皮内有丰富的游离神经末梢,因此感觉十分敏锐。角膜边缘的上皮渐增厚,基部凹凸不平,与球结膜的复层扁平上皮相延续(图18-1)。
(2)前界层(anterior limiting lamina ):为无细胞的均质层,厚约10-~16μm,含胶原原纤维和基质。
(3)角膜基质(corneal stroma)约占整个角膜厚度的9/10,由大量与表面平行的胶原板层组成。每一板层含大量平行排列的胶原原纤维,纤维直径一致,约35nm;胶原原纤维之间充填糖胺多糖等成分。相邻板层的原纤维排列呈互相垂直的关系,板层之间的狭窄间隙中有扁平并具有细长分支突起的成纤维细胞(图18-3)。角膜基质不含血管,其营养由房水和角膜缘的血管供应。上述角膜基质结构特点是角膜透明的重要因素。

图18-3 角膜基质
左图 豚鼠角膜基质电镜像示胶原板层×40000(白求恩医科大学尹昕、朱秀雄教授供图)
右图 角膜基质结构立体模式图
(4)后界层(posterior limiting lamina):亦为一透明的均质膜,较前界层薄,也由胶原原纤维和基质组成。后界层由角膜内皮分泌形成,随年龄增长而增厚。
(5)角膜内皮(corneal endothelium):为单层扁平上皮。上皮细胞具有合成和分泌蛋白质的超微结构特点,胞质内还含有大量的线粒体和吞饮小泡,表明具有活跃的物质转运功能。
2.巩膜巩膜(sclera)呈瓷白色,质地坚硬,由大量粗大的胶原纤维交织而成,内含少量血管、神经、成纤维细胞及色素细胞。
巩膜与角膜交界的移动处称角膜缘(corneal limbus),角膜缘内侧部的巩膜静脉窦和小梁网是房水循环的重要结构(图18-1,18-4)。巩膜静脉窦(sinus venosus sclerae)是一环形管道,管壁由内皮、不连续的基膜和薄层结缔组织构成。腔内充满房水;小梁网(trabecular meshwork)由角膜基质纤维、后界膜和角膜内皮向后扩展而成,覆盖在巩膜静脉窦的内侧,小梁的轴心为胶原纤维,表面覆以内皮细胞,小梁之间为小间隙(trabecular space)。在巩膜静脉窦内侧,巩膜组织略向前突,称巩膜距(scleral spur)。
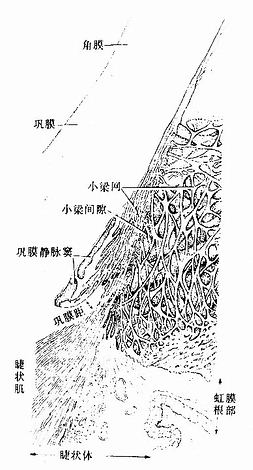
图18-4 巩膜静脉窦与小梁网结构立体模式图
3.虹膜虹膜(iris)位于角膜后方,为一环板状薄膜,中央为瞳孔(pupil)。虹膜与角膜之间的腔隙称前房,虹膜与玻璃体之间的腔隙称后房,两者通过瞳孔相沟通。虹膜的根部与睫状体相连,与角膜缘所夹之角称前房角(图18-1)。虹膜由虹膜基质和虹膜上皮两部分组成(图18-5)。虹膜基质(iris stroma)为含有大量色素细胞与血管的疏松结缔组织,在虹膜前表面,扁平的成纤维细胞和色素细胞较多,形成不连续的前缘层(anterior border layer)。基质中的色素细胞呈星形或圆形,胞质中含大量的色素颗粒。不同人种,甚至不同个体的色素颗粒的形状、密度和分布有一定的差异。虹膜上皮属视网膜盲部,由两层色素细胞组成。前层已特化为肌上皮细胞,其中近瞳孔缘的肌纤维呈环形排列,称瞳孔括约肌,受副交感神经支配,收缩时使瞳孔缩小;在括约肌外侧呈放射状排列的肌纤维为瞳孔开大肌,受交感神经支配,收缩时使瞳孔开大。后层细胞较大,呈立方形,胞质内充满色素颗粒。
图18-5 人眼球的虹膜 HE×200
4.睫状体睫状体(ciliary body)位于虹膜与脉络膜之间,前段肥厚并伸出放射状的睫状突,后段渐平坦,终止于锯齿缘。睫状体由睫状肌、基质与上皮组成(图18-1)。睫状肌为平滑肌,密集分布于睫状体的外2/3区域。肌纤维的排列有三种方向:外侧的纵行纤维紧靠巩膜走行,前端附于巩膜距,后端附于脉络膜;中间的放射状纤维前端也附于巩膜距,后端则呈放射状伸入睫状体内;内侧为环形纤维。基质为富含血管和色素细胞的结缔组织,主要分布在睫状体内侧份和睫状突中,睫状肌纤维之间也有少量基质分布。睫状体上皮也属视网膜盲部,由两层细胞组成。外层为立方形的色素细胞,内有粗大的色素颗粒;内层为立方形或矮柱状的非色素细胞,内质网和高尔基复合体较发达,能合成胶原蛋白,分泌房水。
睫状突与晶状体之间通过细丝状的睫状小带(ciliary zonule)相连(图18-1)。它们是由许多直径为11~12nm 的管状微原纤维借蛋白多糖粘合、包被而成。当微原纤维聚集紧密时,可见9nm 的周期横纹;松散时,横纹的周期则不规则。睫状小带的化学成分是非胶原性酸性蛋白,含有多量的唾液酸岩藻糖,可被弹性蛋白酶α-胰凝乳蛋白酶消化,而不能被胶原酶消化。睫状肌收缩时,睫状小带松弛;反之,则紧张,借此使晶状体的位置和曲度发生改变,从而对视力进行调节。
5.脉络膜脉络膜(choroid)为血管膜的后2/3部分,填充在巩膜与视网膜之间,是含血管和色素细胞的疏松结缔组织(图18-6)。脉络膜的最内层称玻璃膜,是由纤维和基质组成的薄层均质透明膜。脉络膜毛细血管供应视网膜外1/3的营养。
6.视网膜视网膜(retina)通常指能感光的视部而言,它与盲部交界处呈锯齿状,称锯齿缘(ora serrata)。视网膜分为色素上皮层和神经部。
色素上皮层(pigment epithelium):是视网膜的最外层,为单层矮柱状上皮(图18-6,18-7),细胞之间有紧密连接、中间连接和缝隙连接等,具有屏障作用。细胞基底紧附于玻璃膜,基部质膜有发达的质膜内褶。细胞顶部与视细胞相接触,并有大量胞质突起伸入视细胞之间,但两者之间并无牢固的连接结构;所以,视网膜脱离常发生在这两者之间。色素上皮细胞的主要特点是胞质内含有大量粗大的圆形或卵圆形黑素颗粒,可防止强光对视细胞的损害。色素上皮细胞的另一特点是胞质内含有吞噬体,直径1.5~2μm,吞噬体内常见被吞入的视细胞膜盘。色素上皮细胞还能储存维生素A,参与视紫红质的形成。
视网膜神经部的构成类似大脑皮层的层状结构(图18-6),从外至内分三个核层:外核层、内核层和节细胞层。视网膜神经元从功能上可分为三类:一类是感光细胞,即视细胞,胞体位于外核层;另一类为联络神经元,包括双极细胞、水平细胞、无长突细胞和网间细胞,胞体位于内核层;节细胞为投射神经元,其胞体构成节细胞层。外核层与内核层之间及内核层与节细胞层之间是由神经元突起构成的外网层和内网层。
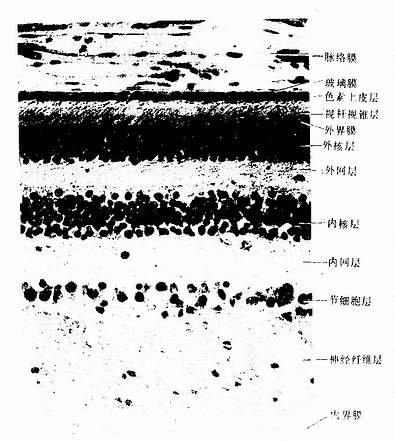
图18-6 人眼球的脉络膜与视网膜 HE×320
(1)感光细胞(photoreceptor cell):又称视细胞(visual cell),细胞的胞体构成外核层,由胞体向内、外两侧分别伸出内突和外突。视细胞分视杆细胞和视锥细胞两种。前者的外突呈杆状(视杆),后者的外突呈锥状(视锥)(图18-7),故而得名。视杆与视锥垂直伸向色素上皮,构成视杆视锥层。
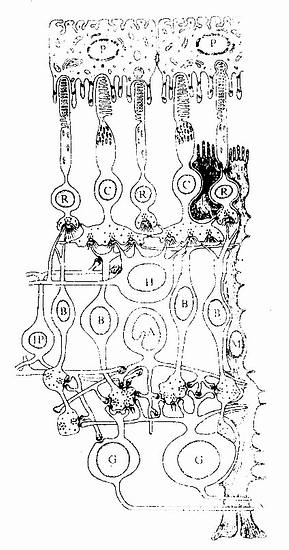
图18-7 视网膜超微结构模式图
P色素上皮细胞 R视杆细胞 C视锥细胞H水平细胞
B双极细胞 A无长突细胞 IP网间细胞 G节细胞 N神经纤维,m Müller细胞
视杆细胞(rod cell):视杆细胞的胞体位于外核层的内侧份,细胞核较小,染色较深。视杆分内节与外节两段,内节是合成蛋白质的部位,含丰富的线粒体、粗面内质网和高尔基复合体;外节为感光部位,含有许多平行排列的膜盘,它们是由外节基部一侧的胞膜内陷,与胞膜分离后形成的独立膜盘(图18-8,18-9)。外节顶部衰老的膜盘不断脱落,并被色素上皮细胞吞噬。膜盘上镶嵌的感光物质称视紫红质(rhodopsin),感弱光。视紫红质由11-顺视黄醛(11-cisretinae)和视蛋白(opsin)组成,维生素A是合成11-顺视黄醛的原料。因此,当人体维生素A不足时,视紫红质缺乏,导致弱光视力减退即为夜盲。视杆细胞的内突伸入外网层,内突末端膨大呈小球状,与双极细胞和水平细胞形成突触(图18-7)。
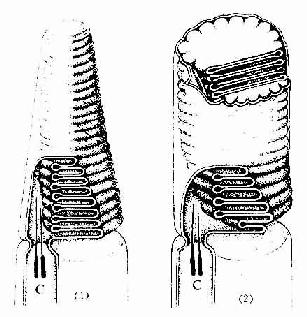
图18 -8 视细胞外节超微结构模式图
(1)视锥细胞外节 (2)视杆细胞外节
C连接纤毛
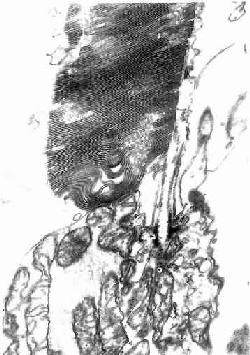
图18-9 人视杆细胞外突电镜像 ×30000
示膜盘和内节↑ 基体,其上方为纤毛微管
(上海医科大学电镜室供图)
视锥细胞(cone cell):细胞形态与视杆细胞近似。视锥细胞胞体位于外核层的外侧份,细胞核较大,染色较浅。视锥也分内节和外节。外节的膜盘大多与细胞膜不分离,顶部膜盘也不脱落(图18-8),膜盘上嵌有能感受强光和色觉的视色素,由内节不断合成和补充。人和绝大多数哺乳动物有三种视锥细胞,分别有红敏色素、蓝;蓝敏色素和绿敏色素,也由11-顺视黄醛和视蛋白组成,但视蛋白的结构与视杆细胞的不同。如缺少感红光(或绿光)的视锥细胞,则不能分辨红(或绿)色,为红(或绿)色盲。视锥细胞的内突末端膨大呈足状,可与一个或多个双极细胞的树突以及水平细胞形成突触(图18-7)。
人的一只眼球内约有12000万个视杆细胞和700万个视锥细胞。在黄斑中央凹处只有视锥细胞,无视杆细胞,在中央凹的边缘才开始有视杆细胞,再向外,视杆细胞逐渐增多,视锥细胞则逐渐减少。
(2)双极细胞(bipolar cell):是连接视细胞和节细胞的纵向联络神经元,胞体位于内核层。外侧的树突伸入外网层,与视细胞内侧突形成突触;内侧的轴突伸入内网层,与节细胞的树突形成突触(图18-7)。双极细胞可分两类:一类为侏儒双极细胞(midget bipolar cell),其树突只与一个视锥细胞形成突触,其轴突也只与一个节细胞的树突建立突触;另一类双极细胞的树突可与多个视锥细胞或视杆细胞形成突触(图18-7)。
(3)节细胞(ganglion cell):是长轴突的多极神经元。胞体较大,直径10~30μm,位于节细胞层,多排列成单行。树突伸入内网层,与双极细胞、无长突细胞和网间细胞形成突触。轴突构成视神经纤维层,并向眼有球后极汇集形成视神经穿出眼球。节细胞也分两类:一类为胞体较小的侏儒节细胞(midget ganglion cell),只接受单一的视锥细胞和双极细胞的信息,这种一对一的通路能精确地传导礼觉;另一类为胞体较大的弥散节细胞(diffuse ganglion cell),与多个双极细胞形成突触联系(图18-7)
(4)水平细胞(horizontal cell)、无长突细胞(amacrine cell)和网间细胞(interplexiform cell)(图18-7):这三种细胞均为中间神经元,参与局部环路的组成。水平细胞的胞体位于内核层的外侧份,发出许多水平走向的分支伸入外网层的内侧份,与视杆细胞、双极细胞及网间细胞形成突触。相邻的水平细胞之间有缝隙连接。无长突细胞的胞体较双极细胞大,呈烧瓶形,在内核层的内侧份排成2~3行,其突起兼有树突和轴突的特点,在内网层内与双极细胞的轴突、节细胞及网间细胞的突起形成突触。网间细胞数量较少,胞体位于无长突细胞之间,突起在内、外网状层中广泛伸展,与无长突细胞和水平细胞形成突触。网间细胞主要是从内网层接受信息,传送至外网层,因此是视网膜内视觉信息,传送至外网层,因此是视网膜内视觉信息传递的一条离心性反馈调节通路。
视网膜的神经递质:视网膜内的化学性突触释放神经递质和神调质,神经递质包括兴奋性和抑制性两类。视细胞和双极细胞放的兴奋性递质,主要是酸性氨基酸(L-谷氨酸,L-天冬氨酸)。水平细胞放抑制性递质r-氨基丁酸(GABA)。无长突细胞既有胆碱能型,又有GABa 能型,此外,还有单胺类和肽类递质。网间细胞的递质主要是多巴胺。
视网膜内的胶质细胞主要是放射状胶质细胞(radial neuroglia cell),又称米勒细胞(Müller cell)。细胞长而不规则,突起为叶片状,分布于神经元之间,胞体位于内核层,细胞外侧突末端常膨大分叉,在神经纤维层内表面相互连接成内界膜(图18-7)。放射状胶质细胞具有营养、支持、绝缘和保护作用。视网膜内还有一些星形胶质细胞、少突胶质细胞和小胶质细胞等。
光镜观察眼球HE染色切片,视网膜自外向内可分10层:①色素上皮层;②视杆视锥层(layer of rods and cones),由视杆和视锥组成,故又称感光层;③外界膜(outer limiting membrane),由Müller细胞外侧端之间的连接复合体形成;④外核层(outer nuclear layer),由两种视细胞含核的胞体部组成;⑤外网层(outer plexiform layer),由视细胞的内侧突和双极细胞的树突以及水平细胞的突起组成;⑥内核层(inner nuclear layer),由双极细胞、水平细胞、无长突细胞、网间细胞以及Müller细胞的胞体共同组成;⑦内网层(inner plexiform layer),由双极细胞的轴突与节细胞的树突、以及无长突细胞和网间细胞的突起组成;⑧节细胞层(layer of ganglion cells),由节细胞的胞体组成;⑨视神经纤维层(layer of optic fibers),由节细胞的轴突组成;⑩内界膜(inner limiting membrane)由Müller细胞内侧端相互连接而成(图18-6)。
黄斑和视神经乳头:视网膜后极部有一浅黄色区域,称黄斑(macula lutea),其中央有一小凹称中央凹(central fovea)。中央凹视网膜最薄,此处除色素上皮外,有视锥细胞,且与双级细胞和节细胞形成一对一的通路,此处的双极细胞和节细胞均斜向外周排列,光线直接落在中央凹的视锥细胞上,是视觉最敏感区域(图18-10)。视神经穿出眼球的部分,称视神经乳头(papilla of optic nerve)。此处缺乏视细胞,故又称盲点。视神经乳头位于黄斑的鼻侧,直径约1.5mm,视网膜中央动脉和静脉由此进出眼球(图18-11)。
图18-10 人眼球视网膜的黄斑与中央凹 HE×125

图18-11 人眼球视网膜的视神经乳头HE×125
(二)眼球内容物
1.晶状体晶状体(lens)是一个具有弹性的双凸透明体,主要由上皮细胞构成。晶状体外包薄层均质的晶状体囊(lens capsule),由增厚的基膜及胶原原纤维组成。晶状体的前表面有一层立方形的晶状体上皮(lens epithelium),晶状体赤道部的上皮细胞保持分裂能力,渐变为长柱状的晶状体纤维(lens fiber),并移向中心。位于浅层的晶状体纤维构成晶状体的皮质,纤维与表面平行,成环层状排列,有的纤维内仍可见细胞核。中心部位的纤维构成晶状体核,纤维内充满均质状的蛋白质,细胞核消失(图18-1)。晶状体内无血管和神经,营养由房水供给。老年人晶状体的弹性减弱,透明度往往降低,甚至混浊,为老年性白内障。
2.玻璃体玻璃体(vitreous body)位于晶状体和视网膜之间,中央有一个从晶状体后极至视神经乳头的透明管(hyaloid canal ),是胚胎时期玻璃体动脉的遗迹。玻璃体为无色透明的胶状物,其中水分占99%,还含有透明质酸、玻璃蛋白及胶原原纤维等。玻璃体内还有一些透明细胞(hyalocyte),胞质内含有空泡和颗粒。玻璃体流失后不能再生,由房水填充。
3.房水房水(aqueous humor)充盈于眼房内,为含少量蛋白质的透明液体。房水是由睫状体血管内的血液渗透及非色素上皮细胞分泌而成的。房水从后房经瞳孔至前房,继而沿前房角经小梁网间隙输入巩膜静脉窦,最终从静脉导出,房水的产生和排出保持动态平衡,使眼压维持正常,并有营养晶状体和角膜等作用。若房水回流受阻,眼球内压增高,则导致青光眼。
(三)眼附属器官
1.眼睑眼睑(eyelid)覆盖于眼球前方,有保护作用。眼睑由前向后分为五层(图18-12)。
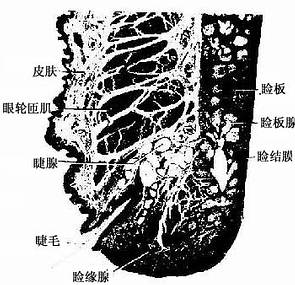
图18-12 人的眼睑 HE×5
(1)皮肤:薄而柔软。睑缘有2~3列睫毛,睫毛根部的皮脂腺称睑缘腺,又称Zeis腺。睑缘处还有一种腺腔较大的汗腺称睫腺,又称Moll腺,开口于睫毛毛囊或睑缘。
(2)皮下组织:为薄层疏松结缔组织。
(3)肌层:主要为骨骼肌,包括眼轮匝肌和提上睑肌。在上睑板上部还有由平滑肌组成的睑肌。
(4)睑板:由致密结缔组织构成,质如软骨,是眼睑的支架。睑板内有许多平行排列的分支管泡状皮脂腺,称睑板腺(tarsal gland),导管开口于睑缘,分泌物有润滑睑缘和保护角膜的作用。
(5)睑结膜:为薄层粘膜。粘膜上皮为复层柱状,有杯状细胞,上皮下固有层为薄层结缔组织。睑结膜反折覆盖于巩膜表面称球结膜。
2.泪腺泪腺(lacrimal gland)是浆液性复管状腺,被结缔组织分隔成腺小叶。腺上皮为单层立方或柱状,胞质内有分泌颗粒。腺上皮外有基膜和肌上皮细胞。泪腺分泌的泪液经导管排至结膜上穹窿部,有润滑和清洁角膜的作用。
二、耳
耳由外耳、中耳和内耳三部分组成。外耳和中耳传导声波,内耳感受位觉和听觉。
(一)外耳
外耳包括耳廓、外耳道和鼓膜。耳廓由弹性软骨和薄层皮肤组成。外耳道的外侧段为软骨部,内侧段为骨部,表面覆以薄层皮肤,软骨部的皮肤内有大汗腺,称耵聍腺(ceruminous gland),腺体的分泌物称耵聍。皮下组织很少,深部与软骨和骨紧密相贴。鼓膜(tympanic membrane)为半透明的薄膜,分隔外耳道与中耳鼓室。鼓膜外表面为复层扁平上皮,与外耳道表皮延续;内表面为单层立方上皮,与鼓室粘膜上皮延续;中间是薄层结缔组织。
(二)中耳
中耳包括鼓室与咽鼓管(图18-13)。鼓室腔面和听小骨表面均覆盖有薄层粘膜,由单层立方上皮和薄层结缔组织组成。咽鼓管近鼓室段的粘膜上皮为单层柱状;近鼻咽段的上皮为假复层纤毛柱状,纤毛向咽部摆动。固有层结缔组织内含混合腺。
图 18-13中耳与内耳模式图示骨迷路、膜迷路和感受器
(三)内耳
内耳位于颞骨岩部内,由套叠的两组管道组成,因其走向弯曲,结构复杂,故称迷路(labyrinth)。外部的为骨迷路,套在骨迷路内的为膜迷路(图18-13)。膜迷路腔内充满的液体称内淋巴,膜迷路与骨迷路之间的腔隙内充满外淋巴。内、外淋巴互不交通,有营养内耳和传递声波的作用。
1.骨迷路 从后至前分为半规管、前庭和耳蜗三个部分(图18-13)。半规管有三个,位于后外侧,相互间呈垂直关系,每个半规管与前相连处各形成一个膨大的壶腹。耳蜗位于前内侧,外形如蜗牛壳,人的骨蜗管围绕蜗轴盘旋两周半(图18-13,18-14)。骨蜗管被其内的膜管横隔为上下两部分,上方的称前庭阶,下方的称鼓室阶,两者在蜗顶处经蜗孔沟通,鼓室阶底部与鼓室之间有一圆窗,被薄膜封闭。前庭位于中部,为一膨大的腔,连接半规管和前庭阶。前庭与鼓室之间的卵圆窗由镫骨底板封闭。骨迷路内的外淋巴可能是骨膜内的毛细血管血液经渗透而来,也可能来自珠网膜下腔内的脑脊液。
2.膜迷路 也相应地分为膜半规管、膜前庭(椭圆囊和球囊)和膜蜗管三部分,管腔相互连通(图18-13)。膜半规管、椭圆囊和球囊的管壁粘膜一般由单层扁平上皮与上皮下的薄层结缔组织构成,但在壶腹、椭圆囊外侧壁和球囊前壁的粘膜局部增厚呈嵴突状或斑块状,分别称壶腹嵴、椭圆囊斑和球囊斑,均为位觉感受器。人的膜蜗管也围绕蜗轴盘旋两周半,切面呈三角形(图18-14,18-15)。膜蜗管的顶壁为前庭膜,膜的中间是薄层结缔组织,两面均覆盖单层扁平上皮。膜蜗管的外侧壁上皮为复层柱状,因上皮含有血管故称血管纹(stria vascularis),内淋巴由此处分泌而来。血管纹下方为增厚的骨膜,称螺旋韧带(spiral ligament)。膜蜗管的底壁由内侧的骨螺旋板(osseous spiral lamina)和外侧的膜螺旋板(membranous spiral lamina)构成。骨螺旋板是蜗轴骨组织向外侧延伸而成,其起始部骨膜增厚并突入膜蜗管形成螺旋缘(spiral limbus)。膜螺旋板又称基底膜,内侧与骨螺旋板相连,外侧与螺旋韧带相连。膜蜗管底壁的上皮增厚形成螺旋器,为听觉感受器(图18-15)。
图18-14 人耳蜗垂直切面模式图
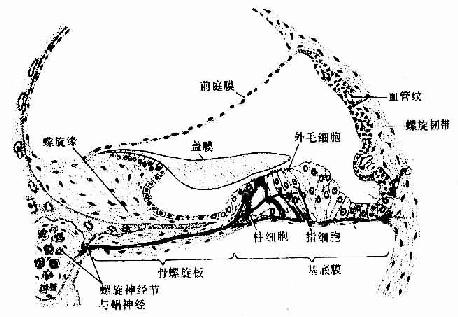
图18-15 膜蜗管与螺旋器
(1)壶腹嵴(crista ampullaris):局部粘膜增厚呈嵴状突入壶腹内,表面覆以高柱状上皮,内含支持细胞和毛细胞(图18-16,18-18)。支持细胞游离面有微绒毛,胞质顶部有分泌颗粒。毛细胞(hair cell)呈烧瓶状,位于地嵴顶部的支持细胞之间,顶部有许多静纤毛,静纤毛一侧有一根较长的动纤毛(kinocilium),纤毛伸入圆顶状的壶腹帽(cupula)内。壶腹帽由支持细胞分泌形成,主要为糖蛋白。前庭神经中的传入纤维末梢分布于毛细胞的基部。壶腹嵴感受头部旋转运动开始和终止时的刺激。由于3个半规管互相垂直排列,当头部作任何方向旋转,在其开始和停止时均能导致半规管内淋巴位移,发生壶腹帽的倾倒。从而刺激毛细胞,兴奋通过前庭神经传入脑。
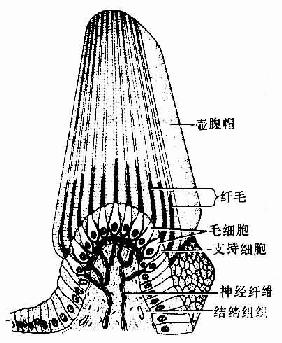
图18-16 壶腹脊结构模式图
(2)椭圆囊斑(macula utriculi)和球囊斑(macula sacculi):斑的形态较壶腹嵴平坦,表面上皮的结构与壶腹嵴相似,但毛细胞的毛较短,斑顶覆盖的胶质膜称位砂膜,膜表面的位砂为碳酸钙结晶(图18-17)。斑接受直线运动开始和终止时的刺激,以及头处于静止时的位觉。由于两个斑的位置互成直角,位砂的比重大于内淋巴,故无论头处于任何位置,位砂膜都可受地心的引力的作用而刺激毛细胞。毛细胞感受的刺激也经前庭神经传入纤维传入脑(图18-18)。
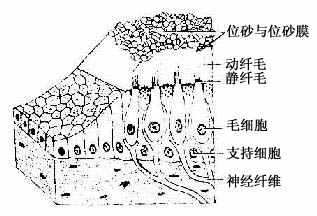
图18-17 斑结构模式图
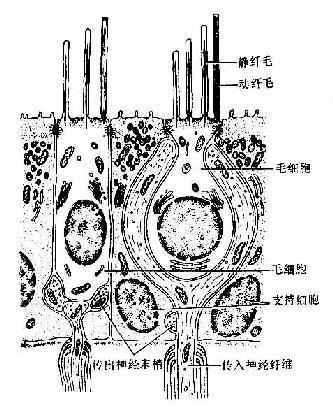
图18-18 位觉感受器超微结构模式图
(3)螺旋器(spiral organ):又称Corti器,坐落在膜蜗管的基底膜上。螺旋器由支持细胞和毛细胞组成(图18-15,18-19)。
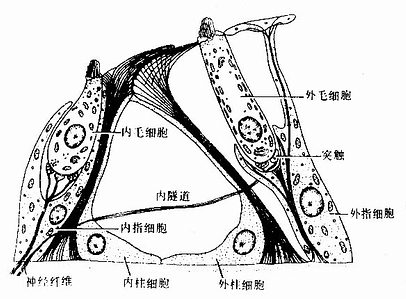
图18-19 螺旋器毛细胞与支持细胞关系模式图
(上海医科大学 周国民)
支持细胞:支持细胞的种类较多,主要有柱细胞和指细胞。①柱细胞(pillar cell):排列为内、外两行,分别为内柱细胞和外柱细胞,细胞的基部较宽,并列于基底膜上;胞体中部细而长,彼此分离围成一个三角形的内隧道(inner tunnel),细胞顶部彼此嵌合(图18-19)。柱细胞的胞质内含有丰富的张力原纤维,起支持作用。②指细胞(phalangeal cell):也分内指细胞和外指细胞。内指细胞有一列,外指细胞有3~5列,分别位于内、外柱细胞的内侧和外侧。指细胞呈长柱形,基部也位于基底膜上,顶部伸出一个指状突起。指细胞有支托毛细胞的作用。
毛细胞:毛细胞分内毛细胞(inner hair cell)和外毛细胞(outer hair cell),分别座落在内,外指细胞的胞体上(图18-19)。内毛细胞约3500个,排成一列;外毛细胞约20000个,排成3~4列。毛细胞顶部有许多静纤毛,呈“V”或“W”形排列(图18-20)。螺旋缘表面的上皮细胞分泌形成胶质性的盖膜(tectorial membrane),覆盖在螺旋器的上方。盖膜由胶样基质和细纤维组成,其中胶样基质含硫酸粘多糖和蛋白质等。
图18-20 豚鼠螺旋器顶部扫描电镜像×1500
示三排外毛细胞的静纤毛 ↑外毛细胞基部,*外指细胞及其突起
(白求恩医科大学尹昕、朱秀雄教授供图)
基底膜中除有血管和神经外,还含有从蜗轴向外呈放射状排列的胶原样细丝,称听弦(auditory string),人约有20000根。从蜗底至蜗顶,听弦长度逐渐增长;因此,近蜗底部基底膜的共振频率高,越至蜗顶部,共振频率越低。螺旋器是听觉感受器,由外耳道传入的声波使鼓膜振动,并经听小骨传至卵圆窗,引起前庭阶外淋巴振动,继而使前庭膜和膜蜗管的内淋巴也发生振动。前庭阶外淋巴的振动也经孔传到鼓室阶,使基底膜发生共振。基底膜的振动使盖膜与毛细胞的静纤毛接触,毛细胞兴奋,冲动经耳蜗神经传至中枢。
胚胎学
第十九章 胚胎学绪论
一、胚胎学的研究内容
胚胎学(embryology)是研究个体发生和生长及其发育机理的科学,其研究内容包括生殖细胞形成、受精、胚胎发育、胚胎与母体的关系、先天性畸形等。人体胚胎学(human embryology)则是研究人胚胎的发育过程。机体出生后,许多器官的结构和功能还远未发育完善,还要历经相当长时期的生长发育方能成熟。然后逐渐老化衰退。这一过程可分为婴儿期、儿童期、少年期、青年期、成年期和老年期。研究出生前和出生后生命全进程的科学则称人体发育学(development of human)。
胚胎学包括以下几个主要分支学科。①描述胚胎学(descriptive embryology):主要应用组织学与与解剖学方法(包括光镜、电镜等技术)研究胚胎发育的形态演变及其规律,是胚胎学的基础内容。②比较胚胎学(comparative embryology):以比较不同种系动物(包括人类)的胚胎发育为研究内容。为探讨生物演变和进化过程及其内在联系提供依据,并有助于更深地理解人体的发育。③实验胚胎学(experimental embryology):对胚胎或体外培养的胚胎组织给予化学或物理等因素作用,观察其对胚胎发育的影响,以研究胚胎发育的内在规律与机理。④化学胚胎学(chemical embryology):主要应用化学与生物化学技术提示胚胎生长发育中诸多化学物质的质与量的变化及代谢过程。⑤分子胚胎学(molecular embryology):用分子生物学方法探索胚胎细胞分化过程中基因表达的时间顺序、空间分布与调控因素,以及细胞间的相互关系,以更深入地阐明胚胎发育的机理。⑥畸形学(teratology):在胚胎发育过程中,由于遗传因素或环境有害因素的影响,可导致形成异常胚胎,即先天性畸形。畸形学旨在研究各种先天性畸形发生的原因、过程、机理和预防措施。本篇以人体发生的描述胚胎学为主要内容,并适当介绍重要的先天性畸形及实验胚胎学研究的成果。
人胚胎在母体子宫中发育经历38周(约266天),可分为三个时期:①从受精到第2周末二胚层且不盘出现为胚前期(preembryohic period);②从第3周至第8周末为胚期(embryonic period),于此期末,胚(embryo)的各器官、系统与外形发育初具雏形;③从第9周至出生为胎期(fetal period),此期内的胎儿(fetus)逐渐长大,各器官、系统继续发育成形,部分器官出现一定的功能活动。此外,从第26周胎儿至出生后4周的新生儿发育阶段被称为围生期(perinatal stage)。此时期的母体与胎儿及新生儿的保健医学称围生医学。它是近年兴起的一门应用学科。
二、胚胎学的意义
胚胎学作为研究人和动物个体发生的科学,对于以科学唯物主义观点理解生命的发生与演变,以及个体与环境的联系,具有极重要的理论意义。在医学科学中,人体胚胎学与细胞学、组织学、遗传学、病理学、分子生物学等基础学科联系密切。为妇产科学、男性学、生殖工程学、儿科学、矫形外科学、肿瘤科学等临床学科提供了必要的基础知识,也是计划生育与优生学赖以发展的学科之一。
从一个细胞(受精卵)发育为5~7×1012个细胞构成的足月胎儿的过程中,胚胎的每一部分都在发生复杂的动态变化,这种变化于前8周尤为急剧。因此,学习者既要了解某一时期胚胎的立体形态(三维结构),也要掌握在不同时期这些结构的来源与演变过程,即胚胎的时间与空间的结构变化。这不仅对学好胚胎学十分必要,而且对建立科学的思维方法也很有裨益。
三、胚胎学发展简史
古希腊学者亚里士多德(Aristotle,公元前384~322)最早对胚胎发育进行过观察,他推测人胚胎来源于月经血与精液的混合,并对鸡胚的发育做过一些较为正确的描述。1651年,英国学者哈维(W.Harvey 1578~1658)发表《论动物的生殖》,记述了多种鸟类与哺乳动物胚胎的生长发育,提出“一切生命皆来自卵”的假设。显微镜问世后,荷兰学者Leeuwenhoek(1632~1723)与Graaf(1641~1673)分别发现精子与卵泡,意大利学者Malpighi(1628~1694)观察到鸡胚的体节、神经管与卵黄血管,他们主张“预成论”学说,认为在精子或卵内存在初具成体形状的幼小胚胎,它逐渐发育长大为成体。18世纪中叶,德国学者Wolff(1733~1794)指出,早期胚胎中没有预先存在的结构,胚胎的四肢和器官是经历了由简单到复杂的渐变过程而形成的,因而提出了“渐成论”。1828年,爱沙尼亚学者Baer(1792~1876)发表《论动物的进化》一书,报告了多种哺乳动物及人卵的发现;他观察到人和各种脊椎动物的早期胚胎极为相似,随着发育的进行才逐渐出现纲、目、科、属、种的特征(此规律被称为Baer定律)。他认为,不同动物胚胎的比较比成体的比较能更清晰地证明动物间的亲缘关系。Baer的研究成果彻底否定了“预成论”,并创立了比较胚胎学。1855年,德国学者Remark(1815~1865)根据Wolff与Baer的一些报告及自己的观察,提出胚胎发育的三胚层学说,这是描述胚胎学起始的重要标志。1859年,英国学者达尔文(C.R.Darwin,1809~1882)在《物种起源》中对定律给予强有力的支持,指出不同动物胚胎早期的相似表明物种起源的共同性,后期的相异则是由于各种动物所处外界环境的不同所引起。至19世纪60年代,德国学者Müller(1821~1897)与Haeckel(1834~1919)进一步提出“个体发生是种系发生的重演”的学说,简称“重演律”。这一学说大体上是事实,但由于胚胎发育期短暂,不可能重演全部祖先的进化过程,如哺乳动物胚中可见一以类假鱼的鳃裂,但未发展为鳃。
自19世纪末,人们开始控讨胚胎发育的机理。德国学者Spemann(1869~1941)应用显微操作技术对两栖动物胚进行了分离、切割、移植、重组等实验。如移植的视杯可导致体表外胚层形成晶状体;移植原口背唇至另一胚胎,使之产生了第二胚胎等。根据这些结果,Spemann提出了诱导学说,认为胚胎的某些组织(诱导者)能对邻近的组织(反应者)的分化起诱导作用。这些实验与理论奠立了实验胚胎学。其他著名学说还有细胞分化决定、胚区定位、胚胎场与梯度等。为了探索诱导物的性质,一些学者应用化学与生物化学技术研究胚胎发育过程中细胞与组织内的化学物质变化、新阵代谢特点、能量消长变化等,以及它们与胚胎形态演变的关系。英国学者Needham(又名李约瑟,1900~)总结了这方面的研究成果,于1931年发表《化学胚胎学》一书。
本世纪50年代,随着DNA结构的阐明和中心法则的确立,诞生了分子生物学。人们开始用分子生物学的观点和方法研究胚胎发生过程中遗传基因表达的时空顺序和调控机理,遂形成分子胚胎学。分子胚胎学与实验胚胎学、细胞生物学、分子遗传学等学科互相渗透,发展建立了发育生物学(Developmental Biology),主要研究胚胎发育的遗传物质基础、胚胎细胞和组织的分子构成和生理生化及形态表型如何以遗传为基础进行演变、来源于亲代的基因库如何在发育过程中按一定时空顺序予以表达、基因型和表型间的因果关系等。发育生物学已成为现代生命科学的重要基础学科。
我国的胚胎学研究是于本世纪20年代开始的。朱洗(1899~1962)、童第周(1902~1979)、张汇泉(1899~1986)等学者在胚胎学的研究与教学中均卓有贡献。朱洗对受精的研究,童第周对卵质与核的关系、胚胎轴性、胚层间相互作用的研究,张汇泉对畸形学的研究,都开创和推动了我国胚胎学的发展。
第二十章 人体胚胎学总论
人体胚胎学总论或称人体早期发生,是指从受精至第八周末的发育时期,即胚前期和胚期。此时期的胚胎发育变化甚大,并易受内、外环境因素的影响。人体胚胎学总论的内容包括:生殖细胞和受精,卵裂和胚泡形成,植入和胚层形成,胚体形成和胚层分化,胎膜和胎盘。本章还简述各期胚胎的外形特征和胚胎龄的推算、多胎和联胎,以及胚胎发育的某些机理。
一、生殖细胞和受精
(一)生殖细胞
生殖细胞(germ cell)又称起配子(gamete),包括精子和卵子,均为单倍体细胞,即仅有23条染色钵,其中一条是性染色体。它们的发生概况见图20-1(详见第16、17章)。
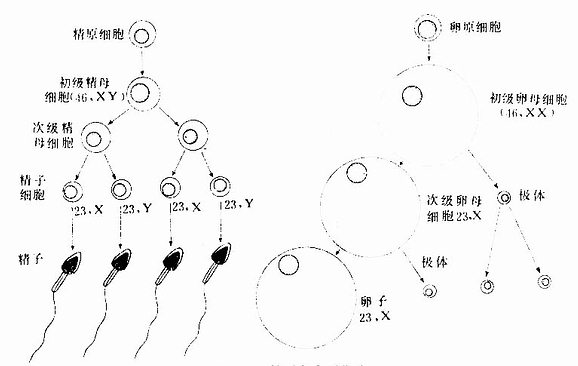
图20-1 精子与卵子发生
1.精子的获能 精子中的半数含Y染色体(23,Y),半数含X染色体(23,X)。射出的精子虽有运动能力,却无穿过卵子周围放射冠和透明带的能力。这是由于精子头的外表有一层能阻止顶体酶释放的糖蛋白。精子在子宫和输卵管中运行过程中,该糖蛋白被女性生殖管道分泌物中的酶降解,从而获得受精能力,此现象称获能(capacitation)。精子在女性生殖管道内的受精能力一般可维持1天。
2.卵子的成熟 从卵巢排出的卵子处于第二次成熟分裂的中期,并随输卵管伞的液流进入输卵管,在受精时才完成第二次成熟分裂。若未受精,于排卵后12~24小时退化。
(二)受精
受精(fertilization)是精子穿入卵子形成受精卵的过程,它始于精子细胞膜与卵子细胞膜的接触,终于两者细胞核的融合。受精一般发生在输卵管壶腹部。应用避孕套、输卵管粘堵或输精管结扎等措施,可以阻止精子与卵子相遇,从而阻止受精。
当获能的精子与卵子相遇时,它首先与卵子周围的放射冠接触。这时精子顶体的前膜即与表面的细胞膜融合,继而破裂形成许多小孔,顶体内含的酶(酸性水解酶)逐渐释放出来。精子顶体的这种变化为顶体反应(acrosome reaction)(图20-2)。释放的顶体酶先解离放射冠的卵泡细胞,继而分解透明带,形成一个精子穿过的通道,精子则与卵子直接接触,是受精的开始。
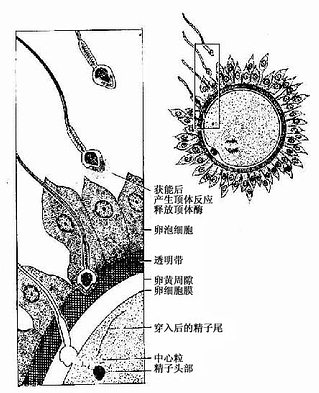
图20-2 精子顶体反应与受精
受精开始时,精子头侧面的细胞膜与卵细胞膜融合,随即精子的细胞核和细胞质进入卵内(图20-2)。精子进入卵子后,卵子浅层细胞质内的皮质颗粒立即释放溶酶体酶样物质,使透明带结构发生变化,称为透明带反应,从而阻止其它精子穿越透明带。在极少的情况下,两个精子同时进入卵子形成三倍体细胞的胚胎,此种胚胎均流产或出生后很快死亡。精子入卵后,卵子迅速完成第二次成熟分裂。此时精子和卵子的细胞核分别称为雄原核(male pronucleus)和雌原核(female pronucleus)。两个原核逐渐在细胞中部靠拢,核膜随即消失,染色体混合,形成二倍体的受精卵(fertilized ovum),又称合子(zygote)(图20-3)。
受精的意义在于:①受精使卵子的缓慢代射转入代谢旺盛,从而启动细胞不断地分裂;②精子与卵子的结合,恢复了二倍体,维持物种的稳定性;③受精决定性别,带有Y染色体的精子与卵子结合发育为男性,带有X染色体的精子与卵子结合则发育为女性;④受精卵的染色体来自父母双方,加之生殖细胞在成熟分裂时曾发生染色体联合和片断交换,使遗传物质重新组合,使新个体具有与亲代不完全相同的性状。
受精后,母体血浆内很快出现一种免疫抑制物,称早期妊娠因子(early pregnancy factor),它是目前检查早期妊娠的一种指征。
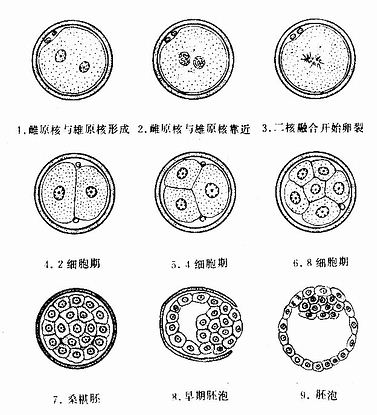
图20-3 卵裂和胚泡形成(第1周)
二、卵裂和胚泡形成
受精卵由输卵管向子宫运行中,不断进行细胞分裂,此过程称卵裂(cleavage)。卵裂产生的细胞称卵裂球(blastomere)。随着卵裂球数目的增加,细胞逐渐变小,到第3天时形成一个12~16个卵裂球组成的实心胚,称桑椹胚(morula)(图20-3,20-4)。
桑椹胚的细胞继续分裂,细胞间逐渐出现小的腔隙,它们最后汇合成一个大腔,桑椹胚转变为中空的胚泡。胚泡(blastocyst,又称囊胚)于受精的第4天形成并进入子宫腔。胚泡外表为一层扁平细胞。称滋养层(trophoblast),中心的腔称胚泡腔(blastocoele),腔内一侧的一群细胞,称内细胞群(inner cell mass)。胚泡逐渐长大,透明带变薄而消失,胚泡得以与子宫内膜接触,植入开始(图20-3,20-4)。
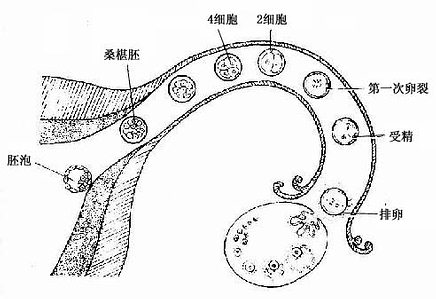
图20-4 排卵、受精与卵裂过程
三、植入和胚层形成
此阶段的主要变化是:胚泡植入子宫内膜,获得进一步发育的适宜环境和充足的营养供应;内细胞群分化为由内、中、外三个胚层构成的胚盘,它是人体各器官和组织的原基;胎膜与胎盘也渐形成和发育。
(一)植入
胚泡逐渐埋入子宫内膜的过程称植入(implantation),又称着床(imbed)。植入约于受精后第5~6天起始,第11~12天完成。植入时,内细胞群侧的滋养层先与子宫内膜接触,并分泌蛋白酶消化与其接触的内膜组织,胚泡则沿着被消化组织的缺口逐渐埋入内膜功能层。在植入过程中,与内膜接触的滋养层细胞迅速增殖,滋养层增厚,并分化为内、外两层。外层细胞间的细胞界线消失,称合体滋养层(syncytiotrophoblast);内层由单层立方细胞组成,称细胞滋养层(cytotrophoblast)。后者的细胞通过细胞分裂使细胞数目不断增多,并补充合体滋养层。胚泡全部植入子宫内膜后,缺口修复,植入完成。这时整个滋养层均分化为两层,合体滋养层内出现腔隙,期内含有母体血液(图20-5)。
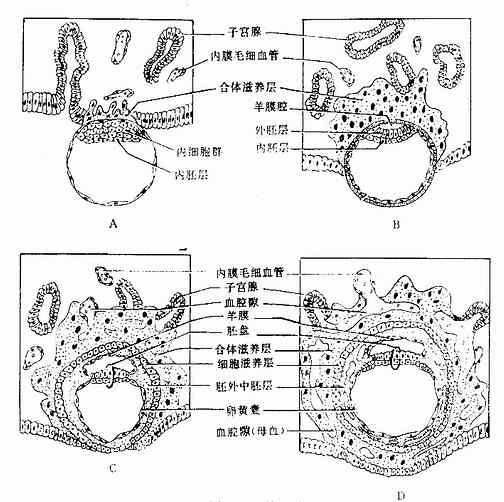
图20-5 植入过程
A.植入早期(第7天)B.第8天 C.植入后期(第9天) D.植入完成(第12天)
植入时的子宫内膜处于分泌期,植入后血液供应更丰富,腺体分泌更旺盛,基质细胞变肥大,富含糖原和脂滴,内膜进一步增厚。子宫内膜的这些变化称蜕膜反应,此时的子宫内膜称蜕膜(decidua)。根据蜕膜与胚的位置关系,将其分为三部分:①基蜕膜(decidua basalis),是位居胚深部的蜕膜;②包蜕膜(decidua capsularis),是覆盖在胚宫腔侧的蜕膜;③壁蜕膜(decidua parietalis),是子宫其余部份的蜕膜(图20-6)。
图20-6 胚胎与子宫蜕膜的关系 E 胚胎
胚泡的植入部位通常在子宫体和底部,最多见于后壁。若植入位于近子宫颈处,在此形成胎盘,称前置胎盘(placenta previa),分娩时胎盘可堵塞产道,导致胎儿娩出困难。若植入在子宫以外部位,称宫外孕(ectopic pregnancy),常发生在输卵管,偶见于子宫濶韧带、肠系膜,甚至卵巢表面等处(图20-7)。宫外孕胚胎多早期死亡。
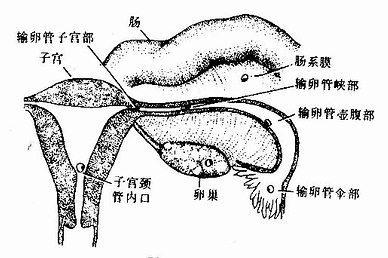
图20-7 异位植入
胚泡的植入是以母体性激素的正常分泌使子宫内膜保持在分泌期为基础的,透明带消失和胚泡适时进入宫腔是植入的条件。若母体内分泌紊乱或内分泌受药物干扰,子宫内膜周期性变化则与胚泡的发育不同步,子宫内膜有炎症或有避孕环等导物,均可阻碍胚泡的植入。
人卵体外受精(fertilization in vitro,VIF)技术建立于1969年。用IVF技术获得的受精卵在体外发育到桑椹胚或早期胚泡,再移植到子宫内的技术称胚胎移植(embryo transfer,ET)。应用IVF和ET技术于1978年诞生了第一例“试管婴儿”(test tube baby),我国大陆于1988年春天诞生了首例“试管婴儿”。IVF和ET技术的开展,可以解决因输卵管堵塞而不能怀孕妇女的生育问题。目前,体外受精获得的早期人胚,经冷冻保存后再移植入子宫的胚胎也获得成活。
(二)胚层形成
在第二周胚泡植入时,内细胞群的细胞也增殖分化,逐渐形成一个圆盘状的胚盘(embryonic disc),此时的胚盘由内、外两个胚层。外胚层(ectoderm)为邻近滋养层的一层柱状细胞,内胚层(endoderm)是位居胚泡腔侧的一层立方细胞,两层紧贴在一起(图20-5)。继之,在外胚层的近滋养层侧出现一个腔,为羊膜腔,腔壁为羊膜。羊膜与外胚层的周缘续连,故外胚层构成羊膜腔的底。内胚层的周缘向下延伸形成另一个囊,即卵黄囊,故内胚层构成卵黄囊的顶。羊膜腔的底(外胚层)和卵黄囊的顶(内胚层)紧相贴连构成的胚盘是人体的原基。滋养层、羊膜腔和卵黄囊则是提供营养和起保护作用的附属结构。此时期的胚泡腔内出现松散分布的胚外中胚层细胞。它们先充填于整个胚泡腔(图20-5)。继而细胞间出现腔隙,腔隙逐渐汇合增大,在胚外中胚层内形成一个大腔,称胚外体腔。胚外中胚层则分别附着于滋养层内面及卵黄囊和羊膜的外面,羊膜腔顶壁尾侧与滋养层之间的胚外中胚层将两者连接起来。称体蒂(body stalk)(图20-8)。
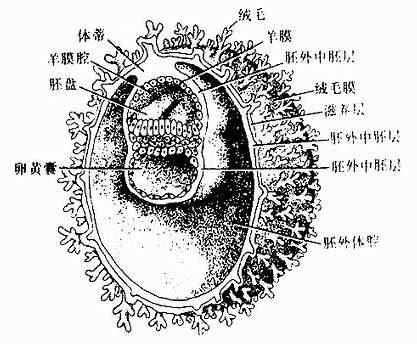
图20-8 第3周初胚的剖面
至第3周初,胚盘外层细胞增殖,在胚盘外胚层尾侧正中线上形成一条增厚区,称原条。原条(primitive streak)的头端略膨大,为原结(primitive node)(图20-9)。原条的出现,胚盘即可区分出头尾端和左右侧。继而在原条的中线出现浅沟,原结的中心出现浅凹,分别称原沟和原凹。原条深面的细胞则逐渐迁移到内外胚层之间,形成松散的间充质。原条两侧的间充质细胞继续向侧方扩展,形成胚内中胚层(intraembryonic mesoderm),它在胚盘边缘与胚外中胚层续连。从原结向头侧迁移的间充质细胞,形成一条单独的细胞索,称脊索(notochord),它在早期胚胎起一定支架作用(图20-9,20-10)。脊索向头端生长,原条则相对缩短,最终消失。若原条细胞残留,在人体骶尾部可分化形成由多种组织构成的畸胎瘤。
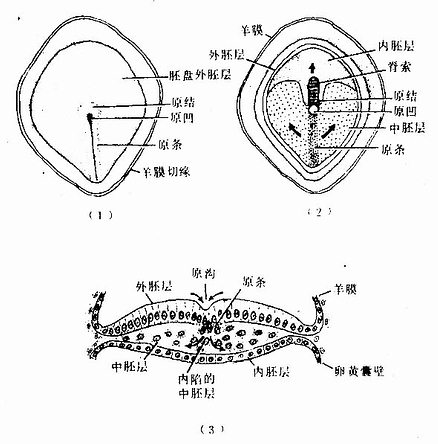
图20-9 第16天胚盘示原条、中胚层和脊索的形成
(1)胚盘背面观(2)切除外胚层,示中胚层和脊索(3)通过原条的胚盘横切,示中胚层形成
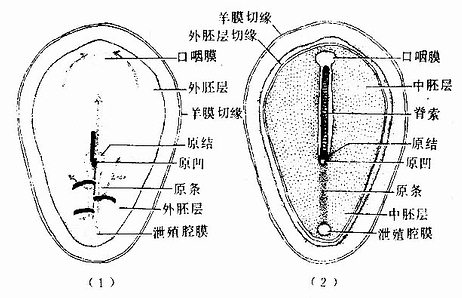
图20-10 第18天胚盘
(1)胚盘背面观,示中胚层的形成和细胞迁移方向 (2)切去外胚层,示中胚层及脊索
四、胚体形成的胚层分化
从第4周初至第8周末的发育过程,胚胎不仅初具人形,而且胚盘的三胚层分化发育,建成各器官系统的雏形;胎膜和胎盘也于此时期发育形成。此时期的胚胎发育对环境因素的作用十分敏感,某些有害因素(病毒、药物等)易通过母体影响胚胎发育,导致发生某些严重的先天性畸形。
(一)胚体形
随着胚层的分化,扁平形胚盘逐渐变为圆柱形的胚体。这是通过胚盘边缘向腹侧卷折形成头褶、尾褶和左右侧褶而实现的,也与羊膜腔和卵黄囊的演变有关。胚盘卷折主要是由于各部份生长速度的差异所引起。如胚盘中部的生长速度快于边缘部,外胚层的生长速度又快于内胚层,致使外胚层包于胚体外表,内胚层卷到胚体内,胚体凸到羊膜腔内,胚盘头尾方向的生速度快于左右方向的生长,头侧的生长速度又快于尾侧,因而胚盘卷折为头大尾小的圆柱形胚体,胚盘边缘则卷折到胚体腹侧。随着胚的进一步发育,胚体腹侧的边缘逐渐靠近,最终在胚体腹侧形成圆索状的原始脐带,与绒毛膜相连(图20-11)。
圆柱形胚体形成的结果:胚体凸入羊膜腔的羊水内;体蒂和卵黄囊连于胚体腹侧脐处,外包羊膜,形成原始脐带;口咽膜和泄殖腔膜分别转到胚体头和尾的腹侧;外胚层包于胚体外表;内胚层卷折到胚体内,形成头尾方向的原始消化管,管中份的腹侧借缩窄的卵黄蒂与卵黄囊通连,管头端由口咽膜封闭,尾端由泄殖腔膜封闭。至第8周末,胚体外表已可见眼、耳和鼻的原基及发育中的四肢,初具人形(图20-11)。
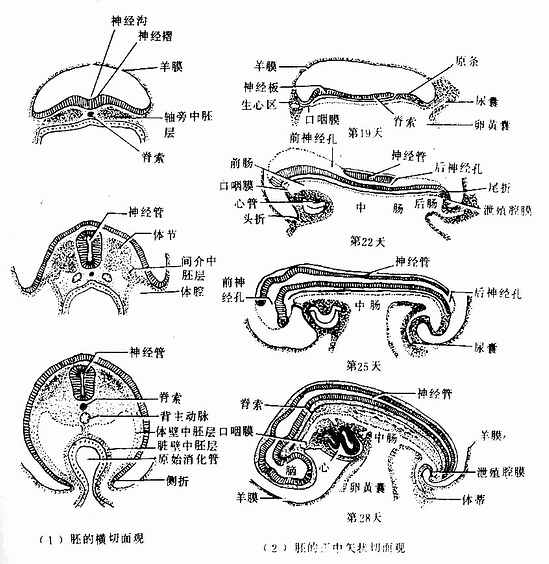
图20-11 胚体形成和胚层分化
(二)胚层分化
胚体形成的同时,三个胚层也逐渐分化形成各器官的原基。
1.外胚层的分化 脊索形成后,诱导其背侧中线的外胚层增厚呈板状,称神经板(neural plate)。神经板随脊索的生长而增长,且头侧宽于尾侧。继而神经板中央沿长轴下隐形成神经沟(neural groove),沟两侧边缘隆起称神经褶(neural fold),两侧神经褶在神经沟中段靠拢并愈合,愈合向两端延伸,使神经沟封闭为神经管(neural tube)。神经管两侧的表面外胚层在管的背侧靠拢并愈合,使神经管位居于表面外胚层的深面(图20-11)。神经管将分化为中枢神经系统以及松果体、神经垂体和视网膜等。在神经褶愈合过程中,它的一些细胞迁移到神经管背侧成一条纵行细胞索,继而分裂为两条分别位于神经管的背外侧,称神经嵴(neural crest),它将分化为周围神经系统及肾上腺髓质等结构。位于体表的表面外胚层,将分化为皮肤的表皮及其附属器,以及牙釉质、角膜上皮、晶状体、内耳膜迷路、腺垂体、口腔和鼻腔与肛门的上皮等。
2.中胚层的分化 中胚层在脊索两旁从内侧向外侧依次分化为轴旁中胚层、间介中胚层和侧中胚层(图20-11)。分散存在的中胚层细胞,称间充质,分化为结缔组织以及血管、肌组织等。脊索则大部份退化消失,仅在椎间内残留为髓核。
(1)轴旁中胚层(paraxial mesoderm):紧邻脊索两侧的中胚层细胞迅速增殖,形成一对纵行的细胞索,即轴旁中胚层。它随即裂为块状细胞团,称体节(somite)。体节左右成对,从颈部向尾依次形成,随胚龄的增长而增多,故可根据体节的数量推算早期胚龄。第5周时,体节全部形成,共约42~44对。体节将分化为皮肤的真皮、大部份中轴骨骼(如脊柱、肋骨)及骨骼肌。
(2)间介中胚层(intermediate mesoderm):位于轴旁中胚层与侧中胚层之间,分化为泌尿生殖系统的主要器官。
(3)侧中胚层(lateral mesoderm):是中胚层最外侧的部份,两侧的侧中胚层在口咽膜的头侧汇合为生心区。随着胚体的形成,生心区移到胚体原始消化管的腹侧,口咽膜的尾侧,分化形成心脏。侧中胚层迅速裂为两层。与外胚层邻近的一层,称体壁中胚层(parietall mesoderm),将分化为体壁(包括肢体)的骨骼、肌肉、血管和结缔组织;与内胚层邻近的一层,称脏壁中胚层(visceral mesoderm),覆盖于原始消化管外面,将分化为消化和呼吸系统的肌组织、血管和结缔组织等。两层之间的腔为原始体腔,最初呈马蹿铁形,继而从头端到尾端分化为心包腔、胸膜腔和腹膜腔。
3.内胚层的分化在胚体形成的同时,内胚层卷折形成原始消化管。原始消化管将分化为消化管、消化腺、呼吸道和肺的上皮组织,以及中耳、甲状腺、甲状旁腺、胸腺、膀胱和阴道等的上皮组织。
五、胎膜和胎盘
胎膜和胎盘是对胚胎起保护、营养、呼吸和排泄等作用的附属结构,有的还有一定的内分泌功能。胎儿娩出后,胎膜、胎盘与子宫蜕膜一并排出,总称衣胞。
(一)胎膜
胎膜(fetal membrane)包括绒毛膜、羊膜、卵黄囊、原囊和脐带(图20-12)。
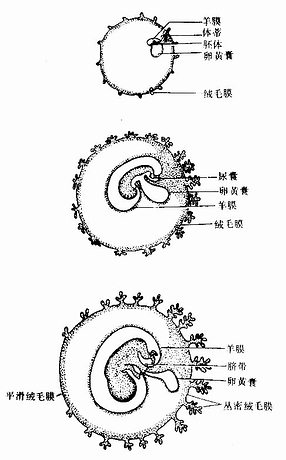
图20-12 胎膜与胚胎
1.绒毛膜 绒毛膜(chorion)由滋养层和衬于其内面的胚外中胚层组成。植入完成后,滋养层已分化为合体滋养层和细胞滋养层两层,继之细胞滋养层的细胞局部增殖,形成许多伸入合体滋养层内的隆起,这时,表面有许多突起的滋养层和内面的胚外中胚层合称为绒毛膜。绒毛膜包在胚胎及其它附属结构的最外面,直接与子宫培膜接触,膜的外表有大量绒毛(villi)。绒毛的发育使绒毛膜与子宫蜕膜接触面增大,利于胚胎与母体间的物质交换。第2周末的绒毛仅由外表的合体滋养层和内部的细胞滋养层构成,称初级绒毛干。第3周时,胚外中胚层逐渐伸入绒毛干内,改称次级绒毛干。此后,绒毛干内的间充质分化为结缔组织和血管,形成三级绒毛干。绒毛干进而发出分支,形成许多细小的绒毛。同时,绒毛干末端的细胞滋养层细胞增殖,穿出合体滋养层。伸抵蜕膜组织,将绒毛干固着于蜕膜上。这些穿出的细胞滋养层细胞还沿蜕膜扩展,彼此连接,形成一层细胞滋养层壳,使绒毛膜与子宫蜕膜牢固连接(图20-13)。绒毛干之间的间隙,称绒毛间隙(intervillous space)。绒毛间隙内充以从子宫螺旋动脉来的母体血。胚胎藉绒毛汲取母血中的营养物质并排出代谢产物。
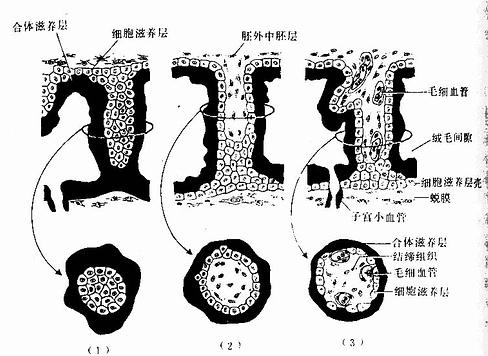
图20-13 绒毛干的分化发育
上图为绒毛干纵断面,下图为绒毛干横断面
(1)初级绒毛干 (2)次级绒毛干 (3)三级绒毛干
胚胎早期,整个绒毛膜表面的绒毛均匀分布。之后,由于包蜕膜侧的血供匮乏,绒毛逐渐退化、消失,形成表面无绒毛的平滑绒毛膜(smooth chorion)。基蜕膜侧血供充足,该处绒毛反复分支,生长茂密,称丛密绒毛膜(villous chorion)(图20-12),它与基蜕膜组成胎盘。丛密绒毛膜内的血管通过脐带与胚体内的血管连通。此后,随着胎的发育增长及羊膜腔的不断扩大,羊膜、平滑绒毛膜和包蜕膜进上步凸向子宫腔,最终与壁蜕膜愈合,子宫腔逐渐消失(图20-14)。
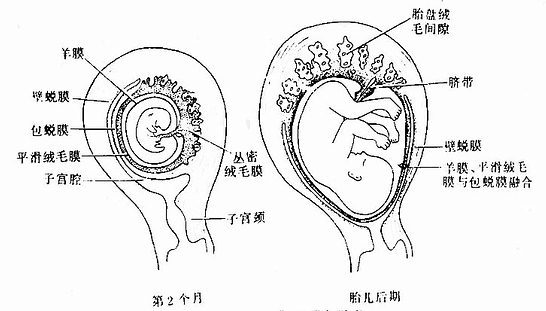
图20-14 胎膜、蜕膜与胎盘
绒毛膜为早期胚胎发育提供和氧气,从密绒毛膜参与组成胎盘。在绒毛膜发育过程中,若血管未通连,胚胎可因缺乏营养而发育迟缓或死亡。若绒毛膜发生病变,如滋养层细胞过度增生、绒毛内结缔组织变性水肿(水泡状胎块)、滋养层细胞癌变(绒毛膜上皮癌)等,不仅严重影响胚胎的发育,还危及母体健康。
2.羊膜 羊膜(amnion)为半透明薄膜,羊膜腔内充满羊水(amniotic fluid),胚胎在羊水中生长发育(图20-12,20-14)。羊膜最初附着于胚盘的边缘,随着胚体形成、羊膜腔扩大和胚体凸入羊膜腔内,羊膜遂在胚胎的腹侧包裹在体蒂表面,形成原始脐带。羊膜腔的扩大逐渐使羊膜与绒毛膜相贴,胚外体腔消失。羊水呈弱碱性,含有脱落的上皮细胞和一些胎儿的代谢产物。羊水主要由羊膜不断分泌产生,又不断地被羊膜吸收和被胎儿吞饮,故羊水是不断更新的。羊膜和羊水在胚胎发育中起重要的保护作用,如胚胎在羊水中可较自由的活动,有利于骨骼肌的正常发育,并防止胚胎局部粘连或受外力的压迫与震荡。临产时,羊水还具扩张宫颈冲洗产道的作用。随着胚胎的长大,羊水也相应增多,分娩时约有1000~15000ml。羊水过少(500ml以下),易发生羊膜与胎儿粘连。影响正常发育,羊水过多(2000ml以上),也可影响胎儿正常发育。羊水含量不正常,还与某些先天性畸形有关,如胎儿无肾或尿道闭锁可致羊水过少,胎儿消化道闭锁或神经管封闭不全可致羊水过多,穿刺抽取羊水,进行细胞染色体检查或测定羊水中某些物质的含量,可以早期诊断某些先天性异常。
3.卵黄囊 卵黄囊(yolk sac)位于原始消化管腹侧(图20-11,20-12)。鸟类胚胎的卵黄很发达,囊内贮有大量卵黄,为胚胎发育提供营养。人胚胎的卵黄囊内没有卵黄,卵黄囊不发达,它的出现也是种系发生和进化的反映。人胚胎卵黄囊被包入脐带后,与原始消化管相连的卵黄蒂于第6周闭锁,卵黄囊也逐渐退化,但人类的造血干细胞和原始生殖细胞却分别来自卵黄囊的胚外中胚层和内胚层。
4.尿囊 尿囊(allantois)是从卵黄囊尾侧向体蒂内伸出的一个盲管,随着胚体的形成而开口于原始消化管尾段的腹侧,即与后来的膀胱通连。尿囊闭锁后形成膀胱至脐的脐正中韧带。鸟类胚胎的尿囊发达,具气体交换和储存代谢废物的功能。人胚胎的气体交换和废物排泄由胎盘完成,尿囊仅为遗跡性器官,但其壁的胚外中胚层形成脐血管。
5.脐带 脐带(umbilical cord)是连于胚胎脐部与胎盘间的索状结构。脐带外被羊膜,内含体蒂分化的粘液性结缔组织。结缔组织内除有闭锁的卵黄蒂和尿囊外,还有脐动脉和脐静脉。脐血管的一端与胚胎血管相连。另一端与胎盘绒毛血管续连。脐动脉有两条,将胚胎血液运送至胎盘绒毛内,在此,绒毛毛细血管内的胚胎血与绒毛间隙内的母血进行物质交换。脐静脉仅有一条,将胎盘绒毛汇集的血液送回胚胎。胎儿出生时,脐带长40~60cm ,粗1.5~2cm,透过脐带表面的羊膜,可见内部盘曲缠绕的脐血管。脐带过短,胎儿娩出时易引起胎盘过早剥离,造成出血过多;脐带过长,易缠绕胎儿肢体或颈部,可致局部发育不良,甚致胎儿窒息死亡。
(二)胎盘
1.胎盘的结构 胎盘(placenta)是由胎儿的丛密绒毛膜与母体的基蜕膜共同组成的圆盘形结构(图20-14,20-15)。足月胎儿的胎盘重约500g,直径15~20cm,中央厚,周边薄,平均厚约2.5cm。胎盘的胎儿面光滑,表面覆有羊膜,脐带附于中央或稍偏,透过羊膜可见呈放射状走行的脐血管分支。胎盘的母体面粗糙,为剥离后的基蜕膜,可见15~30个由浅沟分隔的胎盘小叶(cytoledon)。
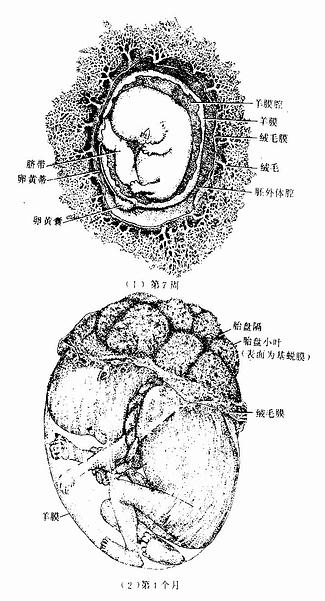
图20-15 胚胎与胎盘
在胎盘垂直切面上,可见羊膜下方为绒毛膜的结缔组织,脐血管的分支行于其中。绒毛膜发出约40~60根绒毛干。绒毛干又发出许多细小绒毛,干的末端以细胞滋养层壳固着于基蜕膜上。脐血管的分支沿绒毛干进入绒毛内,形成毛细血管。绒毛干之间为绒毛间隙,由基蜕膜构成的短隔伸入间隙内,称胎盘隔(placental septum)。胎盘隔将绒毛干分隔到胎盘小叶内,每个小叶含1~4根绒毛干。子宫螺旋动脉与子宫静脉开口于绒毛间隙,故绒毛间隙内充以母体血液,绒毛浸在母血中(图20-16,彩图)。
2、胎盘的血液循环和胎盘膜 胎盘内有母体和胎儿两套血液循环,两者的血液在各自的封闭管道内循环,互不相混,但可进行物质交换。母体动脉血从子宫螺旋动脉流入绒毛间隙,在此与绒毛内毛细血管的胎儿血进行物质交换后,由子宫静脉回流入母体。胎儿的静脉血经脐动脉及其分支流入绒毛毛细血管,与绒毛间隙内的母体血进行物质交换后,成为动脉血,又经脐静脉回流到胎儿(图20-16)。
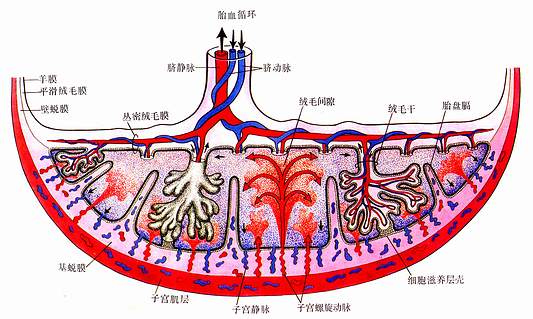
图20-16 胎盘的结构与血循环模式图
箭头示血流方向,红色示富含营养与O2的血,黑色示含代谢废物与CO2的血
胎儿血与母体血在胎盘内进行物质交换所通过的结构,称胎盘膜(placental membrane)或胎盘屏障(placental barrier)。早期胎盘膜由合体滋养层、细胞滋养层和基膜、薄层绒毛结缔组织及毛细血管内皮和基膜组成。发育后期,由于细胞滋养层在许多部位消失以及合体滋养层在一些部位仅为一薄层胞质,故胎盘膜变薄,胎血与母血间仅隔以绒毛毛细血管内皮和薄层合体滋养层及两者的基膜,更有利于胎血与母血间的物质交换。
3.胎盘的功能
(1)物质交换:进行物质交换是胎盘的主要功能,胎儿通过胎盘从母血中获得营养和O2,排出代谢产物和CO2。因此胎盘具有相当于出生后小肠、肺和肾的功能(见图20-17)。由于某些药物、病毒和激素可以透过胎盘膜影响胎儿,故孕妇用药需慎重。
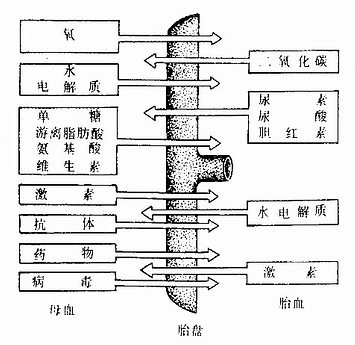
图20-17 母体与胎儿之间物质交换图解
(2)内分泌功能:胎盘的合体滋养层能分泌数种激素,对维持妊娠起重要作用。主要为:①绒毛膜促性腺激素(human chorionic gonadotropin,HCG),其作用与黄体生成素类似,能促进母体黄体的生长发育,以维持妊娠,HCG在妊娠第2周开始分泌,第8周达高峰,以后逐渐下降;②绒毛膜促乳腺生长激素(human chorionic somatomammotropin,HCS),能促使母体乳腺生长发育,HCS于妊娠第2月开始分泌,第8月达高峰,直到分娩;③孕激素和雌激素,于妊娠第4月开始分泌,以后逐渐增多。母体的黄体退化后,胎盘的这两种激素起着继续维持妊娠的作用。
六、胚胎各期外形特征和胚胎龄的推算
临床常以月经龄推算胚胎龄,即从孕妇末次月经的第一天算起,至胎儿娩出共约40周。胚胎学者则常用受精龄,即从受精之日为起点推算胚胎龄,受精一般发生在末次月经第一天之后的2周左右,故从受精到胎儿娩出约经38周。但由于妇女的月经周期常受环境变化的影响,故胚胎龄的推算难免有误差。
胚胎学研究工作者所获得的人胚胎标本,大多缺乏产妇月经时间的准确记录。胚胎学家根据大量胚胎标本的观察研究,总结归纳出各期胚胎的外形特征和长度,以作为推算胚胎龄的依据。如第1~3周,主要根据胚的发育状况和胚盘的结构;第4~5周,常利用体节数及鳃弓与眼耳鼻等始基的出现情况;第6~8周,则依据四肢与颜面的发育特征(表20-1)。胎龄的推算,主要根据颜面、皮肤、毛发、四肢、外生殖器等的发育状况,并参照身长,足长和体重等(表20-2)。
表20-1 胚的外形特征与长度
| 胚龄(周) | 外形特征 | 长度(mm) |
| 1 | 受精、卵裂、胚泡形成,开始植入 | |
| 2 | 圆形两胚层胚盘,植入完成,绒毛膜形成 | 0.1~0.4(GL) |
| 3 | 梨形三胚层胚盘,神经板和神经褶出现,体节初现 | 0.5~1.5(GL) |
| 4 | 胚体渐形成,神经管形成,体节3-~29对,鳃弓1~2对,眼鼻耳始基初现,脐带与胎盘形成 | 1.5~5.0(CR) |
| 5 | 胚体屈向腹侧,鳃弓5对,肢芽出现,手板明显,体节30~40对 | 4~8(CR) |
| 6 | 肢芽分为两节,足板明显,视网膜出现色素,耳廓突出现 | 7~12(CR) |
| 7 | 手足板相继出现指趾初形,体节不见,颜面形成,乳腺嵴出现 | 10~21(CR) |
| 8 | 手指足趾明显,指趾出现分节,眼睑开放,尿生殖膜和肛膜先后破裂,外阴可见,性别不分,脐疝明显 | 19~35(CR) |
此表主要参照Jirasek(1983)
表20-2 胎儿外形主要特征及身长、足长与体重
| 胎龄(周) | 外形特征 | 身长(CRL,mm) | 足长(mm) | 体重(g) |
| 9 | 眼睑闭合,外阴性别不可辨 | 50 | 7 | 8 |
| 10 | 肠袢退回腹腔,指甲开始发生 | 61 | 9 | 14 |
| 12 | 外阴可辨性别,颈明显 | 87 | 14 | 45 |
| 14 | 头竖直,下肢发育好,趾甲开始发生 | 120 | 20(22.0) | 110 |
| 16 | 耳竖起 | 140 | 27(26.3) | 200 |
| 18 | 胎脂出现 | 160 | 33(32.9) | 320 |
| 20 | 头与躯干出现胎毛 | 190 | 39(37.9) | 460 |
| 22 | 皮肤红、皱 | 210 | 45(43.2) | 630 |
| 24 | 指甲全出现,胎体瘦 | 230 | 50(49.8) | 820 |
| 26 | 眼睑部分打开,睫毛出现 | 250 | 55(54.0) | 1000 |
| 28 | 眼重新打开,头发出现,皮肤略皱 | 270 | 59(61.9) | 1300 |
| 30 | 趾甲全出现 ,胎体平滑,睾丸开始下降 | 280 | 63(63.4) | 1700 |
| 32 | 指甲平齐指尖,皮肤浅红光滑 | 300 | 68(67.4) | 2100 |
| 36 | 胎体丰满,胎毛基本消失,趾甲平齐趾尖,肢体弯曲 | 340 | 79(73.4) | 2900 |
| 38 | 胸部发育好,乳腺略隆起,睾丸位阴囊或腹股沟管,指甲超过指尖 | 360 | 83(77.1) | 3400 |
注:足长括弧内数据是应用B超测国人妊娠胎儿足长所得均数,其它数据均参照Moore(1988)年接测量胎儿结果
胚胎长度的测量标准有三种:①最长值(greatest length,GL),多用于测量第1~3周的胚;②顶臀长(crown-rumplength,CRL),又称坐高,用于测量第4周及以后的胚胎;③顶跟长(crown-heal length,CHL),又称立高,常用于测量胎儿(图20-18)。用B超测定孕妇体内胚胎的顶臀长等与直接测量胚胎标本的数据很接近,故应用B超测量是一个值得开展的工作。
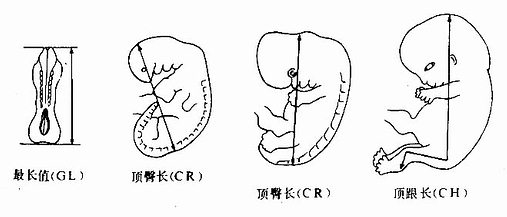
图20-18 胚胎长度测量
七、双胎、多胎和联胎
(一)双胎
双胎(twins)又称孪生,双胎的发生率约占新生儿的1%。双胎有两种。
1.双卵孪生一次排出两个卵子分别受精后发育为双卵孪生(dizygotic twins),占双胎的大多数。它们有各自的胎膜与胎盘,性别相同或不同,相貌和生理特性的差异如同一般兄弟姐妹,仅是同龄而已。
2.单卵孪生由一个受精卵发育为两个胚胎,故此种双胎儿的遗传基因完全一样。它们的性别一致,而且相貌和生理特征也极相似。单卵孪生(monozygotic twins)可以是:①一个胚泡内出现两个内细胞群,各发育为一个胚胎,这类孪生儿有各自的羊膜,但共有一个绒毛膜与胎盘;②胚盘上出现两个原条与脊索;诱导形成两个神经管,发育为两个胚胎,这类挛生儿同位于一个羊膜腔内,也共有一个绒毛膜与胎盘;③卵裂球分离为两团,它们各自发育为一个完整的胚,但人的卵裂球围以透明带,卵裂球分离的可能性较小(图20-19)。
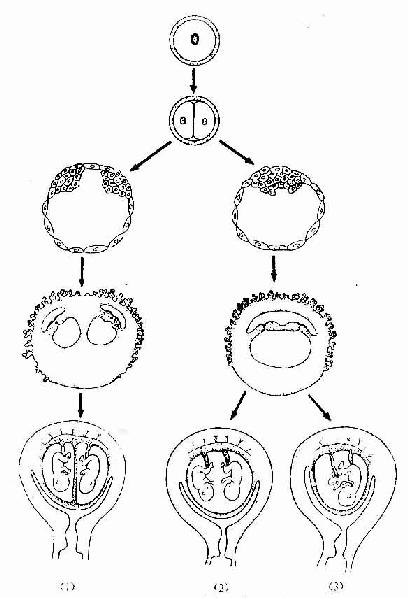
图20-19 单卵孪生和联胎
(1)一个胚泡内出现两个内细胞群;(2)一个胚盘形成两个原条;(3)单卵双胎联体畸胎
(二)多胎
一次娩出两个以上新生儿为多胎(multiple birth)。多胎的原因可以是单卵性、多卵性或混合性,常为混合性多胎。多胎发生率低,三胎约万分之一,四胎约百万分之一;四胎以上更为罕见,多不易存活。
(三)联体双胎
在单卵孪生中,当一个胚盘出现两个原条并分别发育为两个胚胎时,若两原条靠得较近,胚体形成时发生局部联接,称联体双胎(conjoined twins)。联体双胎有对称型和不对称型两类。对称型指两个胚胎一大一小,小者常发育不全,形成寄生胎或胎中胎(图20-20)
图20-20 联胎的类型
八、胚胎发育中的某些机理
从受精卵发育为一个新个体历经复杂的演变过程,包括细胞增殖、死亡、分化、识别、迁移和菜单达,以及组织和器官的形成等。这些变化具严密规律,具有精细的时间顺序和空间关系。来自同一受精卵的细胞,它们的基因结构是相同的,胚胎发育变化中,细胞基因的表达起决定作用,并受内外环境因素的影响。胚胎发育机理是现代发育生物学中重大的研究课题。
(一)细胞分化
细胞分化(cell differentiation)是指幼稚细胞发育为具有某些特殊结构和功能的过程。如桑椹胚分化为内细胞群和滋养层两类不同的细胞。内细胞群又分化为三个胚层,三个胚层再分化形成各种组织。又如,造血干细胞先分化为各种造血相祖细胞,后者再分化为不同的血细胞;骨原细胞分化为成骨细胞或软骨细胞;精原细胞分化为精子等。这是广义的分化概念,它包括形态结构和功能的成熟过程。狭义的或更严格的分化概念,是指原始的或尚未定向的细胞不可逆地转变为某种定向细胞的时刻,它称之为决定(determination)。细胞的决定发生在它的形态结构变化之前,它的主要标志是能合成某种特殊蛋白质(如酶、受体等),故可以用测定蛋白质、受体或酶等技术研究细胞的分化。
不同种属动物,其早期胚胎细胞出现决定的时间不同。如无脊椎动物的卵裂球已经决定,故一部分卵裂球不能发育为完整的个体;而哺乳类的卵裂球尚未决定,其一部分卵裂球也可发育为一个完整的胚胎。如人桑椹胚若被分隔成两团细胞,它们各自可发育为一个胎儿(单卵孪生)。
(二)形态发生
组织和器官的形态发生(morphogenesis)是通过细胞的形态变化和运动、细胞的识别和粘着、细胞增殖和死亡等过程而实现的。
1.细胞形态变化和运动胚胎的形态发生多与细胞层的铺展、卷折、陷入、隆起和细胞迁移有关,而这又与细胞内微丝、微管配布引起的细胞形态变化和细胞外基质大分子物质的浓度有关。如外胚层在形成神经板、神经沟和神经管的过程中,细胞内微管先沿其两极平行纵向排列,细胞则沿纵轴伸长形成神经板,继而微丝平行排列于细胞顶端,细胞该端变窄,神经板逐渐下陷形成神经沟与神经管(图20-21)。体外培养的细胞向一个方向运动时,细胞则伸长,胞质内的微管也沿伸长和运的方向纵行排列,细胞前缘的细胞膜呈波浪状前行运动,也是与膜下大量微丝的参与相关的。基质大分子物质如纤维粘连蛋白(fibronectin)、层粘连蛋白(laminin)、胶原、糖胺多糖等也参与细胞的运动,它们可能通过细胞膜的蛋白受体与胞质内微丝连接,从而调节微丝、微管的排列方向而引起运动。细胞通过这种方式识别这些物质的浓度梯度,从而调整运动的方向。
图20-21神经管形成过程细胞形状与微丝、微管配布变化的关系
(1)外胚层细胞呈立方形,微丝和微管任意分布
(2)细胞变长,微管平行于长轴排列,形成神经板
(3)细胞顶部缩窄,微丝与表面平行分布,形成神经管
2.细胞识别和粘着胚胎发育中,同类或相关细胞能彼此识别,经过迁移能按一定的模式类聚和粘着在一起,构成组织。近年认为,这是由于细胞膜上的糖蛋白受体与相关细胞细胞衣内的糖链结合的结果。
3.细胞增殖和死亡胚胎时期的细胞增殖十分旺盛,其调控机制,尚不完全清楚。已知与多种刺激相应细胞增殖的化学因子有关,如生长激素、性激素、神经生长因子、表皮生长因子、血细胞生长因子、成纤维细胞生长因子、血细胞发生的多种集落刺激因子等。许多组织的细胞还产生抑素,可抑制自身的增殖。细胞内cAMP浓度下降时,细胞分裂加快,反之减慢。
胚胎发生中广泛存在细胞定时死亡现象,称程序性细胞死亡(apoptosis)。它是器官正常发生的重要因素,唯其机制不明。如人胚的尾芽和鳃的定期消失;早期手和足都形似桨板,在预定指或趾之间的细胞死亡后,才能形成指或趾。又如循环系统发生过程中的某段动脉或静脉的定时退化、女性中肾管的定期退化、男性中肾旁管的定期消失等都属此例。
(三)胚胎组织的相互影响
在胚胎的细胞分化和形态发生中,组织或细胞之间常是互以对方为条件而相互影响的。当相互作用的一方导致另一方的发育发生变化时,称此现象为诱导(induction)。诱导的实例甚多,如脊索诱导其背侧的外胚层发生神经管;眼发生中的视泡诱导表面外胚层发生晶状体;肢芽中胚层诱导表面外胚层形成顶嵴,后者决定肢体的形态发育。还有多层次诱导现象,如视泡诱导形成晶状体,后者再诱导表面外胚层和邻近的间充质形成角膜。相互诱导作用的事例如在是肾的发生中,输尿管芽诱导生后肾组织形成肾小管,生后肾组织又诱导输尿管芽分支形成集合小管。诱导作用具有严格的组织特异性和发育时期的限制,若过程受到干扰,改变原有的时空关系,就可能发生先天性畸形。关于诱导作用的机理,虽有不少实验研究,但迄今仍无明确结论。
第二十一章 颜面、颈和四肢的发生
人胚第4周时,胚盘已向腹侧卷折成为柱状胚体。前神经孔逐渐闭合,神经管头端迅速膨大形成脑泡(脑的原基)。脑泡腹侧的间充质局部增生,使胚体部外观呈较大的圆形隆起,称额鼻隆起(frontonasal prominence)。同时,口咽膜尾侧的原始心脏发育长大并隆起,称心隆起(heart prominence)(图21-1)。
图21-1 第4周人胚头部
A腹面观; B侧面观;C矢状切面;1~4示鳃弓
一、鳃器的发生
人胚第4周和第5周,伴随额鼻隆起与心隆起的出现,头部两则的间充质增生,渐次形成左右对称、背腹方向的6对柱状隆起,称鳃弓(bronchial arch)。相邻鳃弓之间的5对条形凹陷为鳃沟(bronchial groove)。人的前4对鳃弓明显,第5对出现不久即消失,第6对很小,不甚明显。在鳃弓发生的同时,原始消化管头段(原始咽)侧壁内胚层向外膨出,形成左右5对囊状结构,称咽囊(pharyngeal pouch),它们分别与5对鳃沟相对应,二者之间隔以薄层的鳃膜(bronchial membrane)(图21-2)
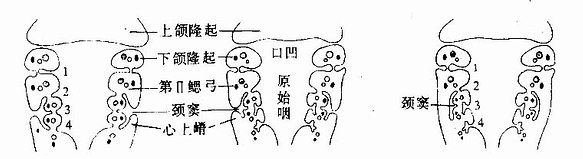
图21-2 第5~6周人胚头部冠状切面
示鳃器及颈部形成,1~4示咽囊
鳃弓、鳃沟、鳃膜与咽囊统称鳃器(bronchial apparatus)。鱼类和两栖类幼体的鳃器演化为具有呼吸功能的鳃等器官。人胚的鳃器存在时间短暂,鳃弓将参与颜面与颈的形成,其间充质分化为肌组织、软骨与骨;咽囊内胚层则是多种重要器官的发生原基(见第22章)。人胚早期鳃器的出现是人个体发生重演种系发生的现象,也是生物进化与人类起源的佐证之一。
二、颜面的形成
第一鳃弓出现后,其腹侧部分迅速分叉方两支,分别称为上颌隆起(maxillary prominence)与下颌隆起(mandibular prominence)。左、右下颌隆起很快在胚腹侧中线愈合,将口咽膜与心隆起隔开。此时正面观察胚体部,其颜面是由额鼻隆起、左右上颌隆起、已愈合的左右下颌隆起及这5个隆起包围的一宽大凹陷――口凹(stomodeum)构成的(图21-3)。口凹即原始口腔,它的底是口咽膜,此膜将口册与原始咽分隔开。口咽膜于第4周中破裂,原始口腔便与原始咽相通。
颜面形成与鼻的发生密切相关。在额鼻隆起的下缘两侧,局部外胚层组织增生变厚,成左右一对鼻板(nasal placode)。继而鼻板中央向深部凹陷为鼻窝(nasal pit),其下缘以一条细沟与口凹相通。鼻窝周缘部的间充质增生而隆起。鼻窝内侧的隆起称内侧鼻隆起(median nasal prominence) ,外侧的称外侧鼻隆起(lateral nasal prominence),早期的两个隆起是相互相连续的(图21-3)。
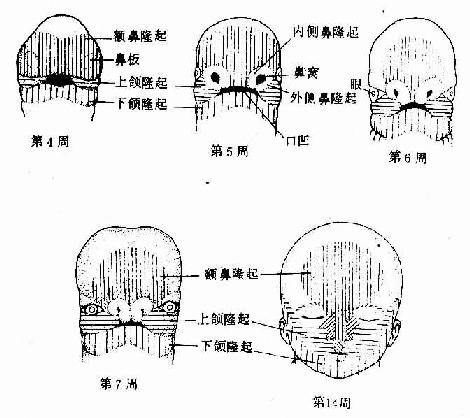
图21-3 颜面形成过程
颜面的演化是从两侧向正中方向发展的。继左右下颌隆起的愈合(将发育形成下颌与下唇),左右上颌隆起也向中线生长;与此同时,两侧的鼻窝亦彼此靠拢,左右内侧鼻隆起渐愈合,并向下方迁移而与上颌隆起愈合。这样,鼻窝与口凹被分隔开。内侧鼻隆起将发育形成包括人中在内的上唇正中部分,上颌隆起发育形成上唇的外侧部分以及上颌。当内侧鼻隆起向下迁移时,额鼻隆起的下部正中组织呈嵴状增生,形成鼻梁和鼻尖,其上部则发育为前额。外侧鼻隆起参与组成鼻外侧壁与鼻翼。随着鼻梁、鼻尖等鼻外部结构的形成,原来向前方开口的鼻窝逐渐转向下方,即为外鼻孔。鼻窝向深部扩大形成原始鼻腔。起初,原始鼻腔与原始口腔之间隔以很薄的口鼻膜(oronasal membrane),该膜破裂后,原始鼻腔便与原始口相通。
原始口腔的开口(亦称原口)起初很宽大,随着两侧上、下颌隆起向中线会拢和上、下唇的形成,同侧上、下颌隆起的分叉处向中线方向生长,形成颊,口裂因此变小。眼的发生最初是在额鼻隆起的腹外侧,两眼相距较远。以后随着脑与颅的迅速增大以及上颌与鼻的形成,两眼逐渐向中线靠近,并处于同一平面。外耳道由第1鳃沟演变而成,鳃沟周围的间充质增生形成耳廓。外耳的位置原本很低,后来随着下颌与颈的发育而被推向后上方(眼与耳的发生详见第26章)。至第2个月末,胚胎颜面初具人貌。
三、腭的发生与口腔、鼻腔的分隔
腭起源于正中腭突与外侧腭突两部分,从第5周开始发生,至第12周完成(图21-4)。
1.正中腭突左右内侧鼻隆起愈合后,向原始口腔内长出一个短小的突起,即为正中腭突(median palatine process)。它演化为腭前部的一小部分。
2.外侧腭突上颌隆起向原始口腔内长出的左右一对扁平突起,即为外侧腭突(lateral palatine process)。外侧腭突起初是在舌的两侧斜向下方,以后随着口腔的扩大及舌变扁和位置下降,左右外侧腭突逐渐在舌的上方呈水平方向生长,并在中线愈合,形成腭的大部。其前缘与正中腭突会拢愈合,两者正中交会处残留一小孔即切齿孔。以后,腭前部间充质骨化为硬腭,后部则为软腭。软腭后缘正中部组织增生并向后方突出,即为悬雍垂。
腭的形成将原始口腔与原始鼻腔再次分隔,成为永久的口腔与鼻腔、鼻腔在腭的后缘与咽相通,该部位即为后鼻孔。伴随腭的形成,额鼻隆起的下部在形成鼻梁与鼻尖的同时,还向原始鼻腔内长出板状的鼻中隔,它向下垂直生长,最终与腭在中线愈合,鼻腔即被一分为二。鼻腔外侧壁还发生三个嵴状皱襞,分别形成上、中、下三个鼻甲(图21-4)。
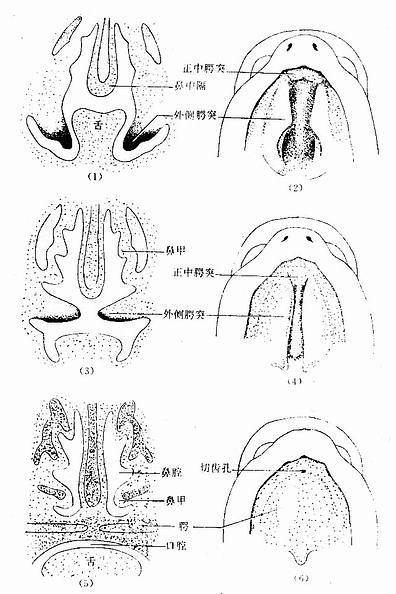
图21-4 腭的发生及口腔与鼻腔的分隔
(1)、(3)、(5)冠状切面 (2)、(4)、(6)口腔顶部观
四、牙的发生
牙的釉质来源于外胚层,其它部分成自中胚层。人胚第6周时,口凹边缘的外胚层组织增生,沿上、下颌形成“U”形的牙板(dental lamina)。牙板向深部中胚层内生长,在上、下颌内先后各形成10个圆形突起,称牙蕾(tooth bud)。牙蕾发育增大,底部内陷为帽状的造釉器(enamel organ),为乳牙的原基(图21-5)
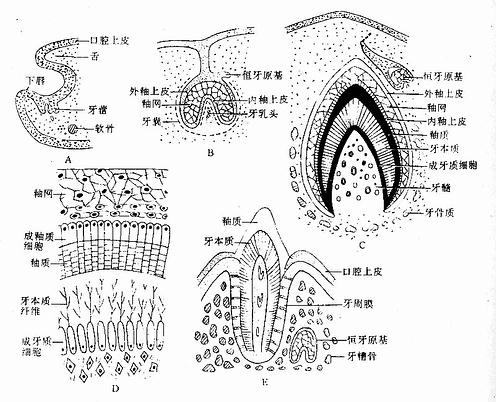
图21-5 牙的发生
A 第8周 B第10周 C第24周 D第24周 E 生后10个月
1.釉质的形成 , 造釉器分化为三部分:①外层为单层立方或扁平细胞组成的外釉上皮;②内层为单层柱状细胞组成的内釉上皮,该柱状细胞称为成釉质细胞(ameblast);③内、外釉上皮之间为有突起的星状细胞组成的釉网(enamel reticulum)。成釉质细胞具有造釉质作用,细胞不断分泌基质,基质钙化后形成釉柱。釉质的形成是从牙冠尖部开始,逐渐向牙颈部扩展。随着釉质增厚,成釉质细胞渐向浅部迁移,最后与外釉上皮相贴,共同组成牙小皮(dental cuticle),覆于牙釉质表面,釉网则退化消失。婴儿出牙时,牙小皮随之消失。
2.牙本质的形成 帽状造釉器凹陷内的间充质称牙乳头(dental papilla)。靠近内釉上皮的间充质细胞分化为一层柱状的成牙质细胞。该细胞在其与内釉上皮相邻面有突起,并在此不断分泌基质,基质钙后即为牙本质。随着牙本质的增厚,成牙质细胞胞体渐向深部迁移。其突起则增长,存留于牙本质小管内,称为牙本质纤维。牙乳头的其余部分分化为牙髓。
3.牙骨质的形成造釉器和牙乳头周围的间充质先形成结缔组织的牙囊(dental sac),然后分化为牙骨质和牙周膜。
在乳牙原基发生的同时,牙板还形成恒牙原基,其体积小,分化发育晚。恒牙的形成过程与乳牙相同。
五、颈的形成
颈是由第2、3、4、6鳃弓与心上嵴发育而成。左、右第2鳃弓生长迅速,它们向中线生长而愈合;向头端生长,将它下颌隆起之间的第1鳃沟演化的外耳推向侧上方;向尾侧延伸而越过第3、4、6鳃弓,覆盖在它们表面。心上嵴(epicardial ridge)是心隆起上缘的间充质增生而向胚体头端长出的嵴状隆起。当第2鳃弓与心上嵴愈合后,在它们与下方3个较小鳃弓之间的间隙称颈窦(cervical sinus)(图21-2)。颈窦不久闭锁消失。由于鳃弓与心上嵴的生长、食管和气管的伸长以及心脏位置下降,颈逐渐延长成形。

图21-2 第5~6周人胚头部冠状切面 示鳃器及颈部形成,1~4示咽囊
六、肢体的发生
(一)肢体发生过程
人胚第4周末,胚体左右外侧体壁上先后出现两对小隆起,即上肢芽与下肢芽(anterior and posterior limb bud),它们由深部增殖的中胚层组织和表面外胚层(图21-6)。肢芽逐渐增长变粗,先后出现近端和远端两个收缩环,将每一肢芽分为三段。上肢芽被分为臂、前臂和手,下肢芽被分为大腿、小腿和足。肢体中轴的间充质先形成软骨。继而以软骨内成骨方式形成骨,周围的间充质分化形成肢体的肌群,脊神经向肢体内长入。随着肢体的伸长和关节形成,肢体由最初的向前外侧伸直方位转向体壁弯屈。肢体的手和足起初为扁平的桨板状,而后其远端各出现四条纵行凹沟,手板与足板遂呈蹼状;至第7~8周,蹼膜消失,手指和足趾形成(图21-7)。
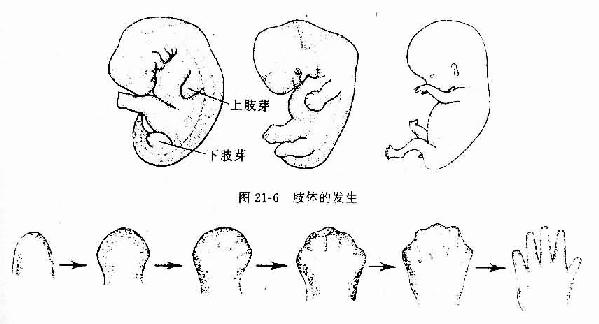
图21-7 手的形态演变
(二)肢体发生机理的研究
肢体发生于体表,便于实验观察。近年应用鸡胚与两栖类胚胎及幼体进行肢体发生机理的实验研究,获得了一些有意义的结果,对其它器官发生也有普遍的理论价值。
1.胚胎场现象 若将早期肢芽挖除,其周围组织仍能长出一个正常肢芽;距原肢芽越近的组织发生新肢芽的能力越强,反之则弱。若切除肢芽的1/2或3/4,余部仍能发育为正常肢体。若把一肢芽的中胚层组织控出,填入另一肢芽内,使后者具有双倍的肢芽中胚层,该肢芽仍仅发育为一正常肢体。这些实验结果表明,胚体可形成肢芽的范围比预定发生肢芽的部位要广 。这种能发育形成某种结构的组织场地,称为该结构的胚胎场(embryonic field)。实验还揭示,胚胎场内的细胞有识别自身所在的位置,并调整自身增殖与分化的能力。眼、耳、心脏等的发生也存在胚胎场。
2.胚层间相互作用 早期肢芽的顶部外胚层细胞增殖形成一厚带状结构,称顶外胚层嵴,简称顶嵴(图21-8)。实验证明,顶嵴 是在其下方的中胚层诱导下形成的。如将肢芽中胚层组织移植到胚体体壁其它区域的外胚层下,该外胚层形成顶嵴,进而发育为肢体。如将前肢芽的中胚层挖除,把后肢芽中胚层移入其中,则本应形成前肢的肢芽发育为后肢;反之亦然。这表明肢芽中胚层既诱导顶嵴形成,也决定肢体的形态发育。但顶嵴对肢体的进一步发育也有重要作用,如切去肢芽顶嵴,代之以非肢芽外胚层,则肢芽生长停止。有一种无翼突变鸡种,若在其胚体侧壁局部外胚层下植入正常鸡胚肢芽中胚层,仍无顶嵴出现,不能形成翼,说明局部外胚层对中胚层诱导的反应性是肢芽形成的另一必要因素。顶嵴对肢体远端结构的形成亦起决定作用,如将一个顶嵴移到另一肢芽顶嵴旁边,该肢体最终出现两个远端结构。以上实验表明,肢体的发育形成是中胚层和外胚层相互作用的结果(图21-8)。
图21-8 肢芽发生示意图
七、颜面、颈和四肢的常见畸形
1.唇裂唇裂(cleft lip)是最常 一种颜面畸形,多因上颌隆起与同侧的内侧鼻隆起末愈合所致,故裂沟位于人中外侧。唇裂多为单侧,也可见双侧者。如左、右内侧鼻隆起未愈合或两侧下颌隆起未愈合,可分别导致上唇或下唇的正中唇裂,但均少见。如内侧鼻隆起发育不良导致人中缺损,则出现正中宽大唇裂。唇裂可伴有牙槽突裂和腭裂(图21-9,21-10)。
图21-9 颜面畸形
图21-10 腭裂
(1)双侧前腭裂合并唇裂 (2)正中腭裂(3)腭裂合并单侧唇裂
2.腭裂腭裂(cleft palate)也较常见,呈现多种类型。有因正中腭突与外侧腭突未愈合而致的前腭裂(单侧或双侧,常伴发唇裂);有因左、右外侧腭突未愈合而致正中腭裂;还有两者复合的完全腭裂(图21-10)。
3.面斜裂面斜裂(oblique facial cleft)位于眼内眦与口角之间,是因上颌隆起与同侧外侧鼻隆起未愈合所致(图21-9)。
4.颈囊和颈瘘颈窦若未完全闭锁消失,出生后若干年其上皮分化为粘液性腺上皮,分泌物聚集并使窦腔扩大成为囊肿,即颈囊(cervical cyst)。颈囊多位于下颌角下方和胸锁孔突肌的前缘。如颈囊开放于体表或与咽相通,即为颈瘘(cervical fistula),粘液可从瘘管排出。
5.肢体畸形种类甚多,可发生在肢体的上、中、下各段。一类是肢体缺如,包括横向和纵向肢体缺如。前者即先天性短肢,如无臂、无手、无指等、下肢亦然。纵向肢体缺如有上肢桡侧或尺侧缺如,下肢胫侧或腓侧缺如。还有海豹样手或足畸形,表现为手或足长在短小的肢体上,或直接长在躯干上。另一类是肢体分化障碍,如某块肌或肌群缺如、关节发育不良、骨畸形、骨融合、多指(趾)、并指(趾)畸形等。此外,马蹄内翻足(即足底内翻)亦较常见。
第二十二章 消化系统和呼吸系统的发生
消化系统和呼吸系统有着相同的胚层来源,其大多数器官都由原始消化管分化而成。
人胚发育至第3周末,三胚层胚盘的周边向腹侧卷折,头端形成头褶,尾端形成尾褶,两侧形成侧褶,致使胚体由盘状变成柱状。内胚层与脏壁中胚层位居胚体内,形成一条纵行的管道,称原始消化管(primitive gut)。原始消化管的中份腹侧与卵黄囊通连,称中肠(midgut);原始消化管的头侧份的尾侧份分别称前肠(foregut)和后肠(hindgut)。前肠的头端膨大成原始咽,与口凹相对处被口咽膜封闭;后肠的尾端膨大成泄殖腔,其腹侧与肛凹相对处有泄殖腔膜封闭。口咽膜和泄殖腔膜分别于第4周和第8周破裂消失。致使原始消化管的头尾两端与外界相通。随着胚体和原肠的增长,卵黄囊相对变小,卵黄囊与中肠的连接部逐渐变细,形成卵黄蒂(vitelline stalk)(图22-1)。
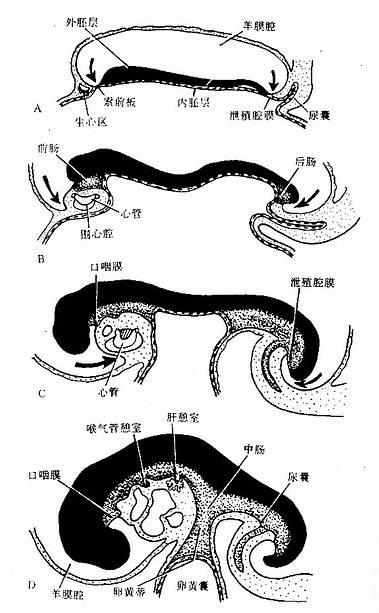
图22-1 原始消化管的形成和分段
A 18~19天胚 B 22天胚 C 25天胚 D28天胚
随着胚胎的发育,前肠分化成为咽、食管、胃和十二指肠的上段;还衍化出呼吸系统的原基。从十二指肠中段至横结肠的右2/3部,由中肠分化而成;从横结肠的左1/3至肛管上段,由后肠分化而来(图22-2)。
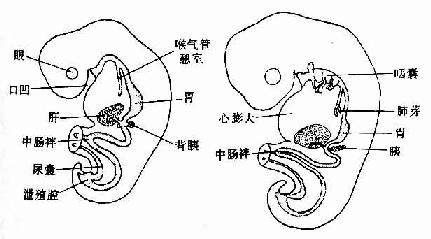
图22-2 原始消化管的早期演变
一、消化系统的发生
消化系统由消化管和消化腺组成,其上皮成分大部来自内胚层,其结缔组织和肌肉组织均由中有胚层分化而成。甲状腺、甲状旁腺、胸腺等器官虽然不属于消化系统,但其原基也来自原始消化管内胚层。舌的上皮也来自原始消化管内胚层。
(一)咽囊的演变
原始咽为前肠头端的一个膨大部,呈左右宽、背腹扁、头端粗、尾端细的漏斗状。在其侧有5对囊状突起,称咽囊,分别与其外侧的5对鳃沟相对,随着胚胎的发育,各对咽囊也先后发生重要的分化和演变。
第1对咽囊的外侧份膨大,形成中耳鼓室,其顶部的鳃膜分化为鼓膜,鼓膜外侧为第一鳃沟形成的外耳道。该咽囊的内侧份伸长,演化为咽鼓管(图22-3)。
第2对咽囊的外侧份退化,内侧份残留的浅窝演
■[此处缺少一些内容]■
第5对咽囊很小,形成一细胞团,称后鳃体(ultimobranchial body)。后鳃体的部分细胞迁入甲状腺原基,分化为甲状腺内的滤泡旁细胞。也有人认为,滤泡旁细胞来自神经嵴的外胚层细胞,并非来自后鳃体的内胚层细胞。
(二)甲状腺的发生
胚胎第4周初 ,在原始咽底壁正中线相当于第2、3对鳃弓的平面上,上皮细胞增生,形成一伸向尾侧的盲管,即甲状腺原基,称甲状舌管(thyroglossal duct)。此盲管沿颈部正中线下伸至未来气管前方,末端向两侧膨大,形成左右两个甲状腺侧叶(图22-3)。甲状舌管的上段退化消失,其起始段的开口仍残留一浅凹,称盲孔(foramen caecum)。如果甲状舌管的上段退化不全,残留部分可形成囊肿。胚胎第11周时,甲状腺原基中出现滤泡,第13周初甲状腺开始出现分泌活动。
(三)舌的发生
胚胎第4周末,左右两下颌隆起的内侧面细胞增生,形成3个隆起,头侧左右一对隆起较大,称侧舌隆起(lateral lingualswelling),尾侧一个隆起较小位居中线,称奇结节(tuberculum impar)。左右侧舌隆起迅速增大,并在中线愈合,形成舌体。奇结节生长缓慢,形成盲孔前方舌体的一部分。第2、3、4对鳃弓腹侧端之间的间充质增生,形成一凸向咽腔的隆起,称联合突(copula)。联合突的前部发育为舌根,后部发育为会厌。舌根与舌体的愈合线为一条“V”形界沟(图22-4)。故舌的表面上皮来自咽壁内胚层,舌内的结缔组织来自原始咽周围的间充质,舌肌则主要由头端体节的生肌节细胞迁移分化而成。
图22-4 舌的发生
(四)食管和胃的发生
食管由原始咽尾侧的一段原始消化管分化而来。胚胎第4周时,食管很短。随着颈的出现和心、肺的下降,食管也迅速增长,其表面上皮增生,由单层变为复层,致使管腔变窄,甚至闭锁。随着胚胎的发育,过度增生的上皮退化吸收,管腔重新出现,上皮仍保持为复层。上皮周围的间充质分化为食管壁的结缔组织和肌组织。
胚胎发育至第4周,在前肠尾端出现一前后略凸、左右稍扁的梭形膨大,这就是胃的原基。起初,胃原基紧靠原始横隔下方,其背系膜短,腹系膜长。之后,随着咽和食管的伸长,胃也向尾侧移动,其背侧缘生长迅速,形成胃大弯;腹侧缘生长缓慢,形成胃小弯。胃大弯的头端膨出,形成胃底。由于胃背系发育为突向左侧的网膜囊,致使胃大弯由背侧转向左侧,胃小弯由腹侧转向右侧,使胃沿胚体纵轴向右旋转90度。由于肝的增大,胃的头端被推向左侧;由于十二指肠的固定,胃的尾端被固定于腹后壁上。结果,胃由原来的垂直方位变成了由左上至右下的斜行方位(图22-5)。
图22-5 胃的发生
(五)肠的发生
胚胎第4周时,随着胃原基的出现,肠管的端被确定,肠起初为一条与胚体长轴平行的直管,肠的头侧部(即十二指肠),由于其背系膜与腹后壁融合而被固定,其它部分的背系膜则随着肠管的生长而增长。肠的腹系膜很早即全部退化消失。由于肠的增长速度远比胚体快,致使肠管形成一凸向腹侧的“U”形弯曲,称中肠袢(midgut loop)(图22-6)。肠袢顶部与卵黄蒂通连,肠系膜上动脉走行于肠袢系膜的中轴部位。肠袢与卵黄蒂相连的头侧段为肠袢的头支,尾侧段为肠袢尾支。
胚胎第6周,肠袢生长迅速,腹腔容积相对变小,加之肝和中肾的增大,致使肠袢进入脐带内的胚外体腔(即脐腔,umbilical coelom),形成胚胎性的生理性脐疝。肠袢在脐腔中继续增长的同时,以肠系膜上动脉为轴心作逆时针方向旋转90度,致使肠袢由矢状方向转向水平方向,即头支从胚体头侧至吞侧,尾支从尾侧转至左侧,并出现一囊状突起,为盲肠始基。胚胎第10周时,由于中肾萎缩、肝生长减缓和腹腔的增大,肠袢开始从脐腔退回腹腔,脐腔随之闭锁。在肠袢退回腹腔时,头支在先,尾支在后,并且逆时针方向再旋转180度,使头支转至左侧,尾支转至右侧。肠袢通过增长、定向旋转和退腹腔,为建立正常的解剖方位和毗邻关系奠定了基础。在肠袢退回腹腔的初期。空肠和回肠位居腹腔中部;盲肠位置较高,在肝的下方;结肠前段横过十二指肠腹侧,后段被推向左侧,成为降结肠。之后,盲肠从肝下方下降至右髂窝,升结肠随之形成,盲肠始基的远侧份萎缩退化,形成阑尾。降结肠尾段移向中线。形成乙状结肠(图22-6)。
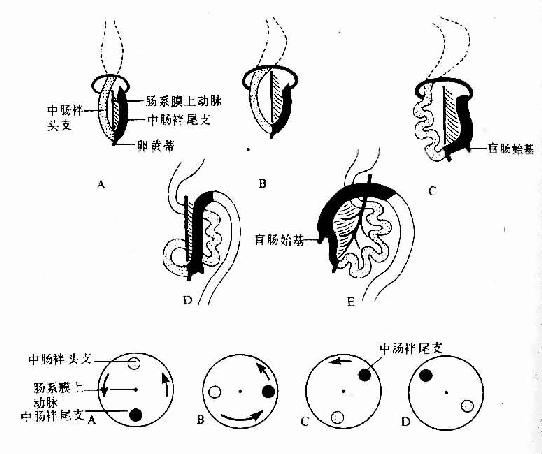
图22-6 肠的发生示中肠的旋转
直肠和肛管是泄殖腔分隔、分化的产物。泄殖腔(cloaca)是后肠末端的膨大部分,腹侧与尿囊相连,尾端由泄殖腔膜封闭。胚胎第6~7周,尿囊起始部分与后肠之间的间充质增生,形成一镰刀状隔膜突入泄殖腔内,称尿直肠隔(urorectal septum)。此隔迅速增长,并与泄殖腔膜相连,于是泄殖腔被分隔为背腹两份。腹侧份称尿生殖窦(urogenital sinus),主要分化为膀胱和尿道;背侧份为原始直肠,分化为直肠和肛管上段(图22-7)。泄殖腔膜也被分为背腹两分,腹侧份称尿生殖膜(urogenital membrane),背侧份称肛膜(anal membrane)。肛膜外周为一浅凹,称肛凹或原肛(proectoduem)。肛膜破裂吸收后,消化管尾端与外界相通,肛凹加深,并演变为肛管的下段。肛管上段的上皮来自内胚层,下段的上皮来自外胚层,两者之间的分界线称齿状线。尿生殖窦的分化详见第二十三章泌尿系统和生殖系统的发生。
图22-7 泄殖腔的分隔↑示尿直肠隔
(六)肝和胆的发生
胚胎发育至第4周初,前肠末端腹侧壁的上皮增生,形成一个向外突出的囊状突起,称肝憩室(hepatic diverticulum),是肝与胆的始基。肝憩室迅速增大,很快长入原始横隔,其末端膨大,并分为头、尾两支(图22-8)。头支较大且生长迅速,其上皮细胞增殖,形成许多细胞索并分支吻合,是为肝索。肝索上下叠加,形成肝板。肝板围绕中央静脉呈放射状排列,形成肝小叶。肝板最初由2~3层肝细胞组成,胎儿后期逐渐变为单层肝细胞。胚胎第2个月,肝细胞之间形成胆小管,内胚层上皮也相继形成肝内胆管。原始横隔中的间充质分化为肝内结缔组织和肝被膜。
胚胎肝的功能上分活跃。第3个月,肝细胞开始分泌胆汁,并开始生物转化等功能。第6周时,造血干细胞从卵黄囊壁迁入肝,并开始造血,主要产生红细胞。也可产生部分粒细胞和巨核细胞。第6个月后,肝内造血组织逐渐减少,出生前肝基本停止造血。应用分离的胎肝造血干细胞可治疗几种血液病。胎肝很早就开始合成和分泌白蛋白等多种血浆蛋白质,还合成大量甲胎蛋白(α-fetal protein, αFP)。第6个月前,几科所有的胎肝细胞都能合成甲胎蛋白,此后逐渐减少。出生后很快停止合成甲胎蛋白。
肝憩室的尾支发育为胆囊和胆囊管,肝憩室的根产则发育为总胆管。由于上皮的过度增生,胆囊管和总胆管的管腔曾一度消失。随着腔内上皮细胞的退化吸收,管腔重新出现。最初,总胆管开口于十二指肠的腹侧壁,随着十二指肠的转位及右侧壁的发育快于左侧壁,致使总胆管的开逐渐移至十二指肠的背内侧,并与胰腺导管合并共同开口于十二指肠(图22-8)
图22-8 肝、胆道及胰的发生
(七)胰腺的发生
胰腺来源于两个原基,即背胰芽(dorsalpancreatic bud)和腹胰芽(ventral pancreatic bud)。胚胎第4周末,在前肠末端腹侧靠近肝憩室的尾缘,内胚层上皮增生,形成腹胰芽。背胰芽由腹胰芽对侧的上皮增生而成,位置稍高,体积略大(图22-8)。背、腹两个胰芽的上皮细胞不断增生并反复分支,其末端形成腺泡,与腺泡相连的各级分支形成各级导管,于是由背、腹两个胰芽分化成了背胰(dorsal pancreas)和腹胰(ventral pancreas)。在背胰和腹胰的中轴线上均有一条贯穿腺体全长的总导管,分别称背胰管和腹胰管。由于胃和十二指肠方位的变化和肠壁的不均等生长,致使腹胰和腹胰管的开口转至背侧,并与背胰融合,形成一个单一的胰腺(图22-8)。腹胰构成胰头的下份,背胰构成胰头上份、胰体和胰尾。腹胰管与背胰管远侧段通连,形成胰腺的主胰导管,它与总胆管汇合后共同开口于十二指肠乳头。背胰管的近侧段或退化或形成副胰导管,开口于十二指肠副乳头。
在胰腺原基的分化过程中,上皮细胞索中的部分细胞脱离细胞索,形成孤立存在的细胞团,由此分化为胰岛,并于第5个月开始分泌胰岛素等。
(八)消化系统的常见畸形
1.甲状舌管囊肿连接舌与甲状腺的甲状舌管通常都会全部退化消失。如果未完全退化,残存部分便形成小的囊肿,并可随吞咽活动而上下移动,即称甲状舌管囊肿(thyroglossal cyst)。如果甲状舌管全部残存,便可在舌与甲状腺之间有一条细管相连。
2.消化管闭锁或狭窄在消化管的发生过程中,管壁上皮细胞在一定时期过度增生,致使消化管某部的管腔闭锁或狭窄。之后,过度增生的细胞发生程序性死亡,上皮变薄,狭窄或闭锁的管腔随之恢复正常。如果过度增生的上皮不发生程序性死亡,上皮不再变薄,就会形成消化管某段的闭锁或狭窄。常见于食管和十二指肠(图22-9)。
图22-9 消化管狭窄或闭锁
3.回肠憩室 又称麦克尔憩室(Meckels 'diverticulum),是距回盲部40~50cm处回肠壁上的一个小的囊状突起,有的在其顶端尚有一纤维索连于脐(图22-10)。这种畸形是由于卵黄蒂退化不全引起的。患者多无症状,但在感染时可出现腹痛等病症,偶尔可引起肠梗阻。
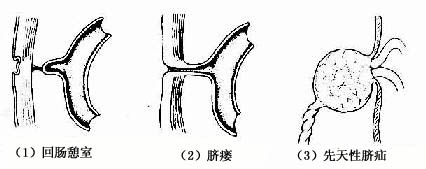
图22-10 肠管先天性畸形
(1)回肠憩室 (2)脐瘘 (3)先天性脐疝
4.脐瘘 脐瘘(umbilical fistula)是由于卵黄蒂未退化,以致在肠与脐之间残存一瘘管(图22-10)。当腹压增高时,粪便可通过瘘管从脐部溢出。
5.先天性脐疝 先天性脐疝(congenital umbilical hernia)是由于脐腔未能闭锁所致(图22-10)。在胎儿出生脐带剪断后,脐部仍留有一腔与腹腔相通。当腹内压增高时,肠管便从脐部膨出,甚至造成嵌顿疝。
6.先天性无神经节性巨结肠 先天性无神经节性巨结肠(congenitalaganglionical megacolon)又称Hirschsprung病,多见于乙状结肠。由于神经嵴细胞未能迁至该处肠壁中,致使壁内副交感神经节细胞缺如,肠壁收缩无力,肠腔内容物不能很好地排出,因而肠管扩大。
7.不通肛 肛门闭锁不通称不通肛(imperforate anus)。有时是由于肛膜未破所致,有时因肛凹未能与直肠末端相通引起,肛管上皮过度增生后未能再度吸收也可引起此种畸形。这种畸形常常伴有直肠阴道瘘或直肠尿道瘘(图22-11)。
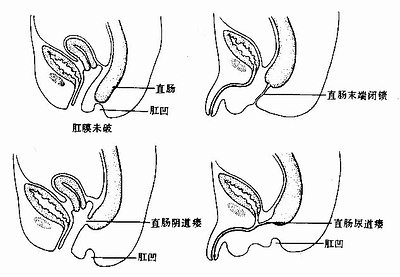
图22-11 不通肛
8.肠袢转位异常 当肠袢从脐腔退回腹腔时,应发生逆时针方向旋转180度。如果未发生旋转,或转位不全,或反向转位,就会形成各种各样的消化管异位,并且常常伴有肝、脾、胰、甚至心、肺的异位。
9.胆管闭锁 在肝、胆的发生中,肝内外形成连贯的胆汁排放管道。如果肝内胆管不通,称肝内胆管闭锁(intrahepatic biliary atresia);如果肝外胆管不通,称肝外胆管闭锁(extrahepatic biliary atresia)。由于胆汁不能排放,便出现先天性新生儿阻塞性黄疸。
10.环状胰 由于腹胰移位及背腹两胰融合过程的异常,形成一环形胰腺,环绕十二指肠。环状胰(anular pancreas)可压迫十二指肠和总胆管,甚至引起十二指肠梗阻。
消化系统除上述常见畸形外,还有一些少见或罕见畸形,如腹裂、双胆囊、无胆囊、肝下盲肠、肝下阑尾、肝囊肿等。
二、呼吸系统的发生
(一)喉、气管和肺的发生
除鼻腔上皮来自表面外胚层外,呼吸系统其他部分的上皮均由原始消化管内胚层分化而来。
胚胎第4周时,原始咽的尾端底壁正中出现一纵行浅沟,称喉气管沟(laryngotracheal groove)(图22-12)。此沟逐渐加深,并从其尾端开始愈合,愈合过程向头端推移,最后形成一个长形盲囊,称气管憩室(laryngotracheal diverticulum),是喉、气管、支气管和肺的原基(图22-12)。喉气管憩室位于食管的腹侧,两者之间的间充质隔称气管食管隔(tracheoesophageal septum)(图22-12)。
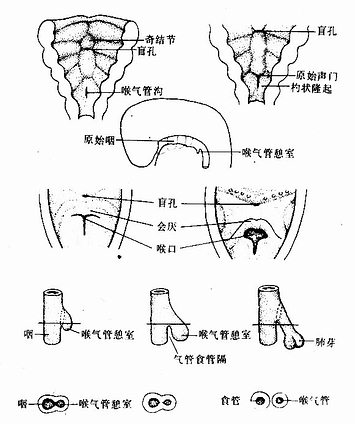
图22-12 喉气管憩室的发生和演化
喉气管憩室的上端开口于咽的部分发育为喉,其余部分发育为气管。憩室的末端膨大并分成左右两支,称肺芽(lung bud),是支气管和肺的原基。肺芽迅速生长并成树状分支。左肺芽分为两支,右肺芽分为三支,分别形成左肺和右肺的肺叶支气管。至第2个月末,肺叶支气管分支形成肺段支气管,左肺8~9支,右肺10支(图22-13)。第6个月时,分支达17级左右,最终出现了终末细支气管和有气体交换功能的呼吸细支气管、肺泡管和肺泡囊。至第7个月,肺泡数量增多,肺泡上皮除Ⅰ型细胞外,还出现了有分泌功能的Ⅱ型细胞,并开始分泌表面活性物质。此时,肺内血液循环完善,肺泡壁上有密集的毛细血管,故在此时早产的胎儿可进行正常的呼吸功能。喉气管憩室和肺芽周围的间充质分化为喉、气管和各级支气管壁的结缔组织、软骨和平滑肌,并分化为肺内间质中的结缔组织。
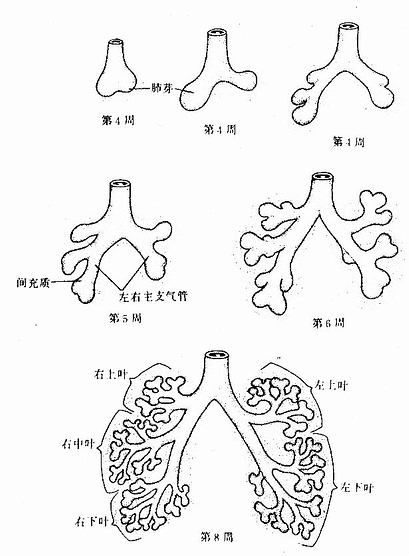
图22-13 肺的发生
早期的肺内间质较多,肺泡较少,至胎儿后期,间质逐渐减少,肺泡逐渐增多。出生后,随着呼吸的开始,空气进入肺泡,开始气体交换过程,Ⅱ型细胞分泌的表面性物质增多,降低了肺泡表面的表面张力,使肺泡得以适度的扩张和回缩。从新生儿至幼儿期,肺仍继续发育,肺泡的数量仍在不断增多。
(二)呼吸系统的常见畸形
1.喉气管狭窄或闭锁 在喉气管的发生过程中,上皮细胞一度增生过度,致使管腔闭锁或狭窄。之后,过度增生的上皮退变吸收,使管腔恢复通畅。如果过度增生的上皮不退变吸收,就会出现管腔狭窄,甚至闭锁。
2.气管食管瘘 由喉气管沟发育为喉气管憩室的过程中,如果气管食管隔发育不良,气管与食管的分隔不完全,两者间有瘘管相连,即称气管食管瘘(tracheoesophageal fistula)。在瘘管开口的上方或下方,常伴有不同形式的食管闭锁(图22-14)。
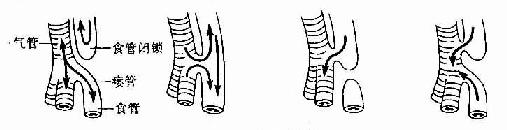
图22-14 气管食管瘘
3.透明膜病 由于肺泡Ⅱ型细胞分化不良,不能分泌表面活性物质,致使肺泡表面张力增大,胎儿出生后肺泡不能随呼吸运动而扩张。显微镜检查显示,肺泡萎陷,间质水肿,肺泡上皮表面覆盖一层血浆蛋白膜,称为透明膜病(hyaline membrane disease)
呼吸系统的先天畸形还有单侧肺不发生(unilateral pulmonary agenesis)、异位肺叶(ectopic lung lobe)、先天性肺肿囊肿(congenital pulmonary cyst)、肺膨胀不全(atelectasis)等。
第二十三章 泌尿系统和生殖系统的发生
泌尿系统和生殖系统在发生上关系密切,它们的主要器官肾及生殖腺均起源于间介中胚层,胚胎期的中肾逐渐衍化为男性的生殖管道。出生后,两系统的解剖关系亦极为密切,男性尿道具有排尿及排精的双重功能,女性尿道及阴道则共同开口于阴道前庭。
胚胎发育第4周,随胚体侧褶的形成,间介中胚层逐渐向腹侧移动,并与体节分离,形成左、右两条纵行的索状结构,称生肾索(nephrogenic cord)。第4周末,生肾索体积不断增大,从胚体后壁突向体腔,在背主动脉两侧形成左右对称的一对纵行隆起,称尿生殖嵴(urogenital ridge),它是肾、生殖腺及生殖管道发生的原基(图23-1)。
图23-1 生肾索与尿生殖嵴的形成(第4周人胚横切)
尿生殖嵴进一步发育,中部出现一条纵沟,将其分成内、外两部分。外侧部分较长而粗,为中肾嵴(mesonephric ridge);内侧部分较短而细,为生殖腺嵴(gonadial ridge)(图23-2)。
图23-2 中肾嵴与生殖腺嵴发生(腹面观)
一、泌尿系统的发生
(一)肾和输尿管的发生
人胚肾的发生可分为三个阶段,即从胚体颈部向盆部相继出现的前肾、中肾和后肾。
1.前肾前肾(pronephros)发生最早,人胚第4周初,位于颈部第7~14体节的外侧,生肾索的头端部分形成数条横行细胞索(前肾小管),其内侧端开口于胚内体腔,外侧端均向尾部延伸,并互相连接成一条纵行的前肾管(pronephric duct)。前肾在人类无功能意义,于第4周末即退化,但前肾管的大部分保留,向尾部继续延伸,成为中肾管(图23-3)。
图23-3 第5周人胚前、中、后肾的发育
2.中肾中肾(mesonephros)发生于第4周末。继前肾之后,位于第14~28体节外侧的中肾嵴内,从头至尾相继发生许多横行小管,称中肾小管(mesonephric tubule)。两侧中肾小管共约80对,每个体节相应位置有2~3条。中肾小管呈“S”形弯曲,其内侧端膨大并凹陷成肾小囊,内有从背主动脉分支而来的毛细血管球,即肾小球,两者共同组成肾小体;中肾小管外侧端与向尾延伸的前肾管相吻合,于是前肾管改称为中肾管(mesonephric duct ,又称管Wolff)。中肾管尾端通入泄殖腔(图23-3)。在人类,中肾可能有短暂的功能活动,直至后肾形成。至第2个月末,中肾大部分退化,仅留下中肾管及尾端小部分中肾小管。后者在男性形成生殖管道的一部分,在女性则仅残留一小部分,成为附件。
3.后肾后肾(metanephros)发育为成体的永久肾。人胚第5周初,当中肾仍在发育中,后肾即开始形成。第11~12周,后肾开始产生尿液,其功能持续于整个胎儿期。尿液排入羊膜腔,组成羊水的主要成分。由于胚胎的代谢产物主要由胎盘排泄,故胎儿期肾的排泄功能极微。后肾起源于生后肾基和输尿管芽两个不同的部分,但均源于中胚层。
(1)输尿管芽:输尿管芽(ureteric bud)是中肾管末端近泄殖腔处向背外侧长出的一个盲管。它向胚体背、颅侧方向延伸,长入中肾嵴尾端的中胚层组织中。输尿管芽反复分支达12级以上,逐渐演变为输尿管、肾盂、肾盏和集合小管。输尿管芽的起始两级分支扩大合并为肾盂,第3~4级分支扩大为肾盏,其余的分支为集合小管。集合小管的末端呈“T”形分支,它的弓形盲端诱导邻近的生后肾原基分化为肾单位(图23-4)。
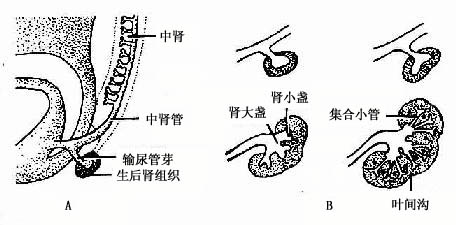
图23-4 后肾的发生
A第5周人胚尾部侧面观 B第5~8周人胚后肾的发育
(2)生后肾原基:生后肾原基(metanephrogenic blastema)是中肾嵴尾端的中胚层组织受输尿管芽的诱导而产生的。中肾嵴的细胞密集并呈帽状包围在尿管芽的末端,即成为生后肾原基。生后肾原基的外周部分演变为肾的被膜,内侧部分形成多个细胞团,附于弓形集合小管末端两侧方。这些上皮细胞团逐渐分化成“S”形弯曲的后肾小管,一端与弓形集合小管的盲端相连,另一端膨大凹陷形成肾小囊,并与伸入囊内的毛细血管球组成肾小体。“S”形小管逐渐增长,分化成肾小管各段,与肾小体共同组成肾单位。每个远端小管曲部与一个弓形集合小管相连接,继而内腔相通连。近髓肾单位发生较早,随着集合小管末端不断向皮质浅层生长并分支,陆续诱导生后肾原基形成浅表肾单位(图23-5)。
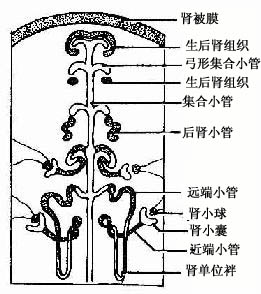
图23-5 集合小管与肾单位的发生
由于后肾发生于中肾嵴尾侧,故肾的原始位置较低。随着胚胎腹部生长和输尿管芽的伸展,肾逐渐上升至腰部。
(二)膀胱和尿道的发生
在人胚第4~7周时,尿直肠隔将泄殖腔分隔为背侧的直肠和腹侧的尿生殖窦两个部分。尿生殖窦又分为三段:①上段较大,发育为膀胱,它的顶端与尿囊相接,在胎儿出生前从脐到膀胱顶的尿囊退化成纤维索,称脐中韧带。左、右中肾管分别开口于膀胱。随着膀胱的扩大,输尿管起始部以下的一段中肾管也扩大并渐并入膀胱,成为其背壁的一部分,于是输尿管与中肾管即分别开口于膀胱。②尿生殖窦的中段颇为狭窄,保持管状,在女性形成尿道,在男性成为尿道的前列腺部和膜部。由于肾向头侧迁移及中肾管继续向下生长等因素的影响,使输尿管开口移向外上方,而中肾管的开口在男性下移至尿道前列腺部;在女性,其通入尿道的部位将退化。③下段在男性形成尿道海绵体部,女性则扩大成阴道前庭(图23-6)。
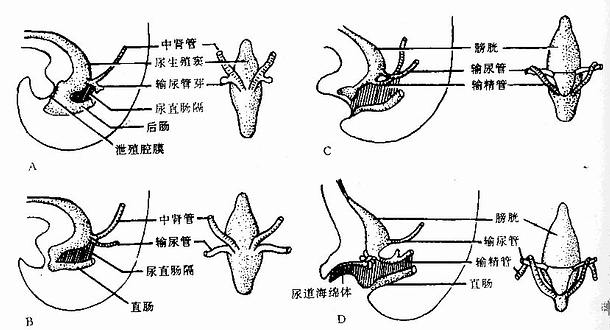
图23-6 泄殖腔的分隔及中肾管和输尿管的位置改变(男性) (人胚第5-8周)
(三)泌尿系统的常见畸形
泌尿系统的畸形较为多见,人群中约有3%~4%的人有肾或输尿管的先天性畸形。
1.多囊肾多囊肾(polycystic kidney)是一种常见畸形。由于集合小管与远端小管未接通,使肾小管内尿液积聚,肾出现许多大小不等的囊肿(常见于皮质),致使正常肾组织受压而萎缩,造成肾功能障碍(图23-7)。
2.异位肾凡肾在上升过程中受阻,使出生后肾未达到正常位置者,均称为异位肾(ectopic kidney),常见位于骨盆内。单纯异位肾的发生率约为1/800(图23-7)
3.马蹄肾 马蹄肾(horseshoe kidney)是由于两肾的下端异常融合而形成一个马蹄形的大肾,其成因为肾上升时被肠系膜下动脉根部所阻而致。发生率约1/600,男与女的比例为2:1(图23-7)。
4.双输尿管双输尿管(double ureter)是由于输尿管芽过早分支所致。按其分支的程度不同,可诱导出各种畸形,如分支不完全形成肾输尿管分支及分隔肾,若分支完全则成为双输尿管。
5.脐尿瘘膀胱顶端与脐之间的脐尿管未闭锁,出生后尿液可从脐部漏出,脐尿瘘(urachal fistula)。若仅部分脐尿管残留并扩张,则形成脐尿管囊肿(urachal cyst)(图23-7)。
6.膀胱外翻在尿生殖窦与表面外胚层之间没有间充质长入,因此在前腹壁无肌肉覆盖膀胱,致使薄的表皮和膀胱前壁破,膀胱粘膜外露,称为膀胱外翻(extrophy of bladder)。该畸形发生率约为1/40000~1/50000,多见于男性。
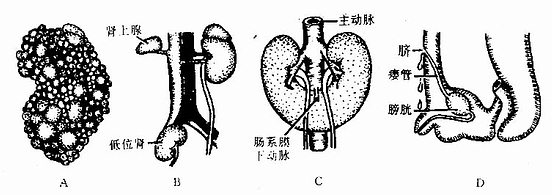
图23-7 泌尿系统先天性畸形
A多囊肾 B低位肾C马蹄肾 D脐尿瘘
二、生殖系统的发生
胚胎的遗传性别虽决定于受精时与卵子结合的精子种类(23,X或23,Y),但直到胚胎第7周,生殖腺才开始有性别的形态学特征。在胚胎早期,男性和女性的生殖系统是相似的,称为生殖器官未分化期。胚胎的外生殖器则要到第9周才能辨认性别,因此,生殖系统(包括生殖腺、生殖管道及外生殖器)在发生中均可分为性未分化和性分化两个阶段。
(一)睾丸和卵巢的发生
生殖腺来自体腔上皮、下皮下方的间充质及原始生殖细胞三个不同的部分。
1.未分化性腺的发生人胚第5周时,左、右中肾嵴内侧的表面上皮下方间充质细胞增殖,形成一对纵行的生殖腺嵴(图23-2)。不久,生殖腺嵴的表面上皮向其下方的间充质生出许多不的细胞索,称初级性索(primary sex cord)。胚胎第4周时,位于卵黄囊后壁近尿囊处有许多源于内胚层的大圆形细胞,称原始生殖细胞(primodial germ cell)。它们于第6周经背侧肠系膜陆续向生殖腺嵴迁移,约在1周内迁移完成,原始生殖细胞进入初级性索内(图23-8)。
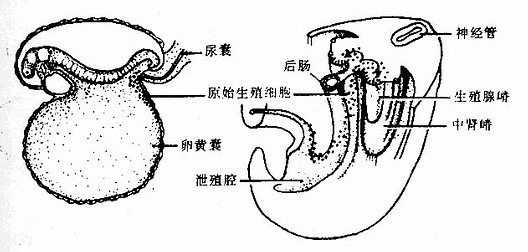
图23-8 原始生殖细胞及其迁移示意图
2.睾丸的发生原始生殖腺有向卵巢方向分化的自然趋势。若原始生殖细胞及生殖腺嵴细胞膜表面均具有组织相容性Y抗原(histocompatibility Y antigen H-Y抗原)时,原始生殖腺才向睾丸方向发育。一般情况下,性染色体为XY的体细胞胞膜上有H-Y抗原,而性染色体为XX的体细胞胞膜上则无H-Y抗原,故具有Y性染色体的体细胞,对未分化生殖腺向睾丸方向分化起决定性作用。目前认为,编码H-Y抗原的基因位于Y染色体的短臂近着丝点的部位。人胚第7周,在H-Y抗原的影响下,初级性索增殖,并与表面上皮分离,向生殖腺嵴深部生长,分化为细长弯曲的袢状生精小管,其末端下互连接形成睾丸网。第8周时,表面上皮下方的间充形成一层白膜,分散在生精小管之间的间充质细胞分化为睾丸间质细胞,并分泌雄激素。在人胚14~18周,间质细胞占睾丸体积一半以上,随后数目迅即下降,出生后睾丸内几乎见不到间质细胞,直至青春期才重现。胚胎时期的生精小管为实心细胞索,内含两类细胞,即由初级性索分化来的支持细胞和原始生殖细胞分化的精原细胞。生精小管的这种结构状态持续至青春期前(图23-9)。
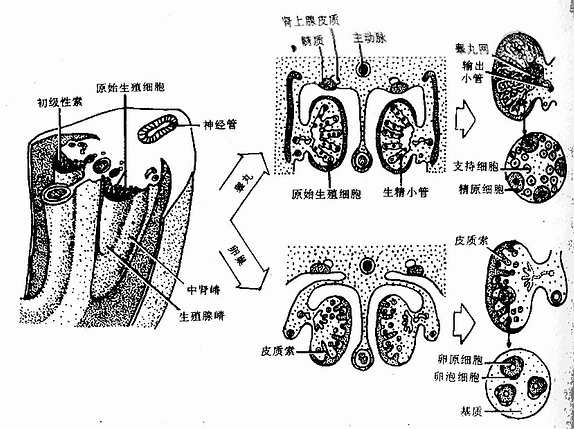
图23-9 睾丸与卵巢的分化
3.卵巢的发生若体细胞和原始生殖细胞的膜上无H-Y抗原,则未分化性腺自然向卵巢方向分化。卵巢的形成比睾丸晚。人胚第10周后,初级性索向深部生长,在该处形成不完善的卵巢网。随后,初级性索与卵巢网都退化,被血管和基质所替代。成为卵巢髓质。此后,生殖腺表面上皮又形成新的细胞索,称次级性索(secondary sex cord)或皮质索(cortical cord),它们较短,分散于皮质内。约在人胚第16周时,皮质索断裂成许多孤立的细胞团,即为原始卵泡。原始卵泡的中央是一个由原始生殖细胞分化来的卵原细胞,周围是一层由皮质索细胞分化来的小而扁平的卵泡细胞。卵泡之间的间充质组成卵巢基质(图23-9)。胚胎时期的卵原细胞可分裂增生,并分化为初级卵母细胞。足月胎儿的卵巢内约有100万个初级卵泡,尽管在母体促腺激素的刺激下,有部分卵泡可生长发育,但它们很快退化,而大多数的初级卵泡一直持续至青春期前。
4.睾丸和卵巢的下降生殖腺最初位于后腹壁的上方,在其尾侧有一条由中胚层形成的索状结构,称引带(gubernaculum),它的末端与阴唇阴囊隆起相连,随着胚体长大,引带相对缩短,导致生殖腺的下降。第3个月时,生殖腺已位于盆腔,卵巢即停留在骨盆缘下方,睾丸则继续下降,于第7~8个月时抵达阴囊。当睾刃下降通过腹股沟管时,腹膜形成鞘突包于睾丸的周围,随同睾丸进入阴囊,鞘突成为鞘膜腔。然后,鞘膜腔与腹膜腔之间的通道逐渐封闭(图23-10)。
图23-10 睾丸下降
(二)生殖管道的发生和演变
1.未分化期人胚第6周时,男女两性胚胎都具有两套生殖管,即中肾管和中肾旁管(paramesonephric duct,又称Müller管)。中肾旁管由体腔上皮内陷卷褶而成,上段位于中肾管的外侧,两者相互平行;中段弯向内侧,越过中肾管的腹面,到达中肾管的内侧;下段的左、右中肾旁管在中线合并。中肾旁管上端呈漏斗形开口于腹腔,下端是盲端,突入尿生殖窦的背侧壁,在窦腔内形成一隆起,称窦结节(sinus tubercle,,又称Müller结节)。中肾管开口于窦结节的两侧(图23-11)。
图23-11 女性生殖管道的演变A第3个月 B卵巢下降后
2.女性生殖管道的分化若生殖腺分化为卵巢,因缺乏睾丸间质细胞分泌雄激素的作用,中肾管逐渐退化;同时,因缺乏睾丸支持细胞分泌的抗中肾旁管激素的抑制作用,中肾旁管则充分发育。中肾旁上段和中段分化形成输卵管;两侧的下段在中央愈合形成子宫及阴道穹隆部。阴道的其余部分则由尿生殖窦后壁的窦结节增生而成的阴道板形成。阴道板起初为实心结构,在胚胎第5个月时,演变成管道,,内端与子宫相通,外端与尿生殖窦腔之间有处女膜相隔(图23-11,23-12)。

图23-12 子宫和阴道的形成
3.男性生殖管道的分化若生殖腺分化为睾丸,间质细胞分泌的雄激素促进中肾管发育,同时支持细胞产生的抗中肾旁管激素抑制中肾旁管的发育,使其逐渐退化。雄激素促使与睾丸相邻的十几条中肾小管发育为附睾的输出小管,中肾管头端增长弯曲成附睾管,中段变直形成输精管,尾端成为射精管的精囊(图23-13)。
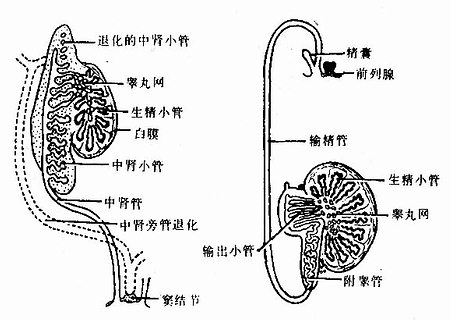
图23-13 男性生殖管道的演变
A第3个月 B睾丸下降后
(三)外生殖器的发生
1.未分化期人胚第9周前,外生殖器不能分辨性别。第5周初,尿生殖膜的头侧形成一隆起,称生殖结节(genital tubercle)。尿生殖膜的两侧各有两条隆起,内侧的较小,为尿生殖褶(urogenital fold),外侧的较大,为阴唇阴囊隆起(labio-scrotal swelling)。尿生殖褶之间的册陷为尿道沟,沟底覆有尿生殖膜。第7周时,尿生殖膜破裂。
2.生殖结节伸长殂成阴茎,两侧的尿生殖褶沿阴茎的腹侧面,从后向前合并成管,形成尿道海绵体部。左右阴唇阴囊隆起移向尾侧,并相互靠拢,在中线处愈合成阴囊(图23-14)。
3.女性外生殖器分化因无雄激素的作用,外生殖器自然向女性分化。生殖结节略增大,形成阴蒂。两侧的尿生殖褶不合并,形成小阴唇。左右阴唇阴囊隆起在阴蒂前方愈合,形成阴阜,后方愈合形成阴唇后连合,大部分不愈合成为大阴唇。尿道沟扩展,并与尿生殖窦下段共同形成阴道前庭(图23-14)。
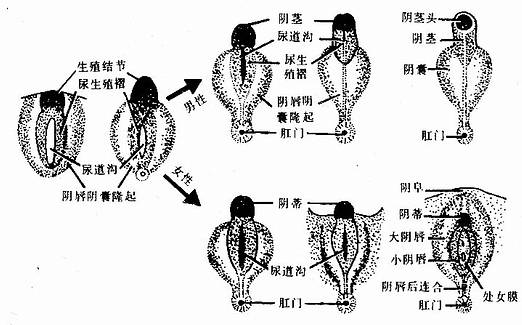
图23-14 男、女外生殖器的发育
(四)生殖系统的常见畸形
1.陷睾睾丸未下降至阴囊而停留在腹腔或腹股沟等处 ,称隐睾(crytorchidism)(图23-15)。据统计,约有30%的早产儿及3%的新生儿睾丸未降入阴囊,其中大部分在一岁未可降入阴囊,仍有约1%为单侧或双侧隐睾。因腹腔温度高于阻囊,故隐睾会影响精子发生,双侧隐睾可造成不育。
2.先天性腹股沟疝先天性腹股沟疝(congenital inguinal hernia)多见于男性。若腹腔与鞘突间的通道没有闭合,当腹压增大时,部分肠袢可突入鞘膜腔,形成先天性腹股沟疝(图23-15)。
3.双子宫双子宫(double uterus)是因左右中肾旁管的下段未愈合所致。较常见的是上半部未全愈合,形成双角子宫。若同时伴有阴道纵隔,则为双子宫双阴道(图23-15)。
4.阴道闭锁阴道闭锁(viginal atresia)或因窦结节未形成阴道板,或因阴道板未形成管腔。有的为处女膜未穿通,外观不见阴道。
5.尿道下裂因左右尿生殖褶未能在正中愈合,造成阴茎腹侧面有尿道开口,称尿道下裂(hypospadias),发病率约为1‰~3.3‰(图23-15)。
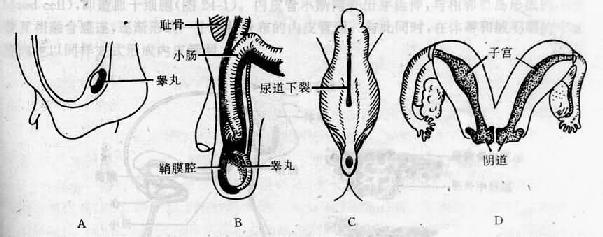
图23-15 生殖系统先天性畸形
A隐睾 B先天性腹股沟疝 C尿道下裂 D双子宫双阴道
6.两性畸形两性畸形(hemaphroditism)又称半阴阳,是因性分化异常导致不同程度的性别畸形,患者的外生殖器常男女分辨不清。按生殖腺结构不同。两性畸形可分为两类:①真两性畸形,极为罕见,患者体内同时有睾丸及卵巢,性染色体属嵌合型,即具有46,xy和46,xx两种染色体组型,第二性征可呈男性或女性,但外生殖器男女分辨不清。②假两假畸形,患者体内只有一种生殖腺,按所含睾丸或卵巢的不同,又可区分为男性假两性畸形和女性假两性畸形。前者虽具睾丸,但外生殖器似女性,染色体组型为46,xy,主要由于雄激素分泌不足所致;后者具有卵巢,但外生殖器似男性,染色体组型为46,xx,由于雄激素分泌过多所致,常见为先天性男性化肾上腺增生症,肾上腺皮质分泌过多雄激素,使外生殖器男性化。
7.睾丸女性化综合征睾丸女性化综合征(testicular feminization syndrome)患者虽有睾丸,也能分泌雄激素,染色体组型为46,xy,但因体细胞和中肾细胞缺乏雄激素受体,使中肾管未能发育为男性生殖管道,外生殖器也未向男性方向分化,而睾丸支持细胞产生的抗中肾旁管管激素仍能抑制中肾旁管的发育,故输卵管与子宫也未能发育,患者外阴呈女性,且具有女性第二性征。
第二十四章 心血管系统的发生
心血管系统是胚胎发生中功能活动最早的系统,约在第3周末开始血液循环,使胚胎很早即能有效地获得养料和排除废物。心血管系统是由中胚层分化而来,首先形成的是原始心血管系统,在此基础上再经过生长、合并、新生和萎缩等改建过程而完善。这种复杂的变化过程受何因素控制,目前仍不很清楚,但与遗传和局部血流动力学如血流速度与方向及血流压力等有一定关系。
一、原始心血管系统的建立
人胚胎第15~16天左右,在卵黄囊壁的胚外中胚层内首先出现许多血岛(blood island),它是间充质细胞密集而成的细胞团。血岛中央的游离细胞分化成为原始血细胞(primitive blood cell),即造血干细胞(图24-1)。内皮管不断向外出芽延伸,与相邻血岛形成的内皮管互相融合通连,逐渐形成一个丛状分布的内皮管网。与此同时,在体蒂和绒毛膜的中胚层内也以同样方式形成内皮管网。
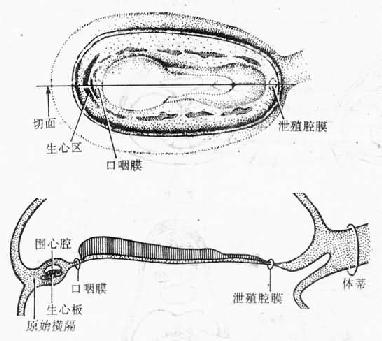
图24-1 血岛和血管形成
约在胚胎第18~20天左右,胚体各处的间充质内出现裂隙,裂隙周围的间充质细胞变扁,围成内皮管,它们也以出芽方式与邻近的内皮管融合通连,逐渐形成胚体内的内皮管网。
第3周末,胚外和胚内的内皮管网经过体蒂彼此沟通。起初形成的是一个弥散的内皮管网,分布于胚体内外的间充质中。此后,其中有的内皮管因相互融合及血液汇流而增粗,有的则因血流减少而萎缩或消失。这样便逐渐形成原始心血管系统(primitive cardiovascular system)并开始血液循环(图24-2)。这时的血管在结构上还分不出动脉和静脉,但可以根据它们将来的归属以及与心脏发生的关系而命名,以后在内皮管周围的间充质细胞密集,逐渐分化形成中膜和外膜,并显示出动脉和静脉的结构。
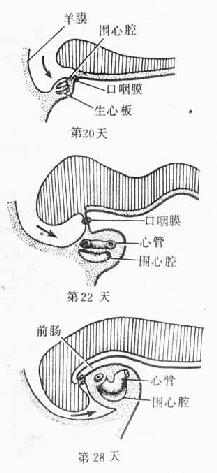
图24-2 原始心血管系统模式图(第4周)
原始心血管系统左右对称,组成该系统的血管包括:
心管:一对,位于前肠腹侧。胚胎发育至第4周时,左右心管合并为一条。
动脉: 背主动脉(dorsal aorta)1对,位于原始肠管的背侧。以后从咽至尾端的左、右背主动脉合并成为一条,沿途发出许多分支。从腹侧发出数对卵黄动脉(vitelline artery),分布于卵黄囊,还有一对脐动脉(umbilical artery)经体蒂分布于绒毛膜。从背侧发出许多成对的节间动脉,从两侧还发出其它一些分支。在胚胎头端还有6对弓动脉(aortic arch),分别穿行于相应的鳃弓内,连接背主动脉与心管头端膨大的动脉囊。
静脉:前主静脉(anterior cardinal vein)1对,收集上半身的血液。后主静脉(posterior cardinal vein)一对,收集下半身的血液。两侧的前、后主静脉分别汇合成左、右总主静脉(common cardinal vein),分别开口于心管尾端静脉窦的左、右角。卵黄静脉(vitelline vein)和脐静脉(umbilical vein)各1对,分别来自卵黄囊和绒毛膜,均回流于静脉窦。
二、心脏的发生
心脏发生于生心区。生心区是指胚盘前缘脊索前板(口咽膜)前面的中胚层,此区前方的中胚层为原始横隔(图24-3)。

图24-3 原始心脏的发生
(一)原始心脏的形成
人胚第18~19天,生心区的中胚层内出现围心腔(pericardiac coelom),围心腔腹侧的中胚层(即脏层)细胞密集,形成前后纵行、左右并例的一对长索,称生心板(cardiogenic plate),板的中央变空,逐渐形成一对心管(cadiac tube)。由于出现头褶,胚体头端向腹侧卷屈,原来位于口咽膜头侧的心管和围心腔便转到咽的腹侧,原来在围心腔腹侧的心管则转至它的背侧(图24-4)。当胚体发生侧褶时,一对并列的心管逐渐向中线靠拢,并从头端向尾端融合为一条。与此同时,心管与周围的间充质一起在心包腔(即围心腔)的背侧渐渐陷入,于是在心管的背侧出现了心背系膜(dorsal mesocardium),将心管悬连于心包腔的背侧壁。心背系膜的中部很快退化消失,形成一个左右交通的孔道,即心包横窦(图24-5)。心背系膜仅在心管的头、尾端存留。当心管融合和陷入心包腔时,其周围的间充质逐渐密集,形成一层厚的心肌外套层(myoepicardial mantle),将来分化成为心肌膜和心外膜。内皮和心肌外套层之间的组织为较疏松的胶样结缔组织,称心胶质(cardiac jelly),将来参与组成心内膜。

图24-4 原始心脏的位置变化 (人胚头部纵切)
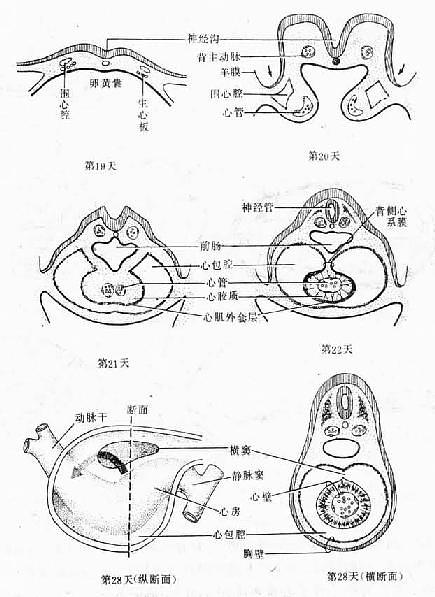
图24-5 原始心脏的发生
(二)心脏外形的建立
心管的头端与动脉连接,尾端与静脉相连,两端连接固定在心包上。心管各段因生长速度不同,首先出现三个膨大,由头端向尾端依次称心球(bulbus cordis)、心室和心房。以后在心房的尾端又出现一个膨大,称静脉窦(sinus venosus)。心房和静脉窦早期位于原始横隔内。静脉窦分为左、右两角。左、右总主静脉、脐静脉和卵黄静脉分别通入两角(图24-6)。心球的远侧份较细长,称动脉干(truncus arteriosus)。动脉干前端连接动脉囊(aorticsac),动脉囊为弓动脉的起始部。
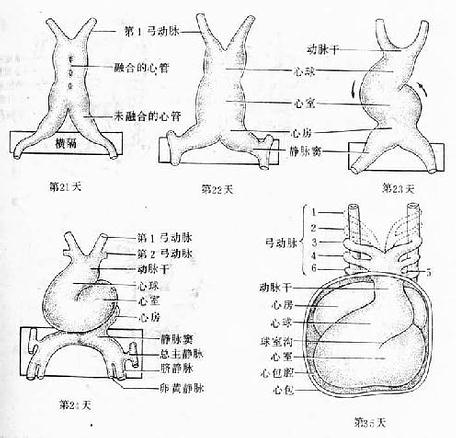
图24-6 心脏外形的建立
在心管发生过程中,由于其两端固定在心包上,而游离部(即心球和心室部)的生长速度度又远较心包腔扩展的速度快,因而心球和心室形成“U”形弯曲,称球室襻(bulboventricular loop),凸面向右、前和尾侧(图24-6)。不久,心房渐渐离开原始横隔,位置逐渐移至心室头端背侧,并稍偏左。相继静脉窦也从原始横隔内游离出来,位于心房的背面尾侧,以窦房孔与心房通连。此时的心脏外形呈“S”形弯曲,而心房受前面的心球和后面的食管限制,故向左、右方向扩展,结果便膨出于动脉干的两侧(图24-6)。心房扩大,房室沟加深,房室之间遂形成狭窄的房室管(atrioventricular canal )。心球则可分为三段:远侧段细长,为动脉干;中段较膨大,为心动脉球(bulbus arteriosus cordis);近侧段被心室吸收,成为原始右心室。原来的心室成为原始左心室,左、右心室之间的表面出现室间沟。至此,心脏已初具成体心脏的外形,但内部仍未完全分隔。
(三)心脏内部的分隔
胚胎发育到第5周初,心脏外形的建立虽已基本完成,但内部的左右分隔仍不完全,并继续进行,约在第5周末才告完成。心脏各部的分隔是同时进行的。
1.房室管的分隔心房与心室之间原是以狭窄的房室管通连的。此后,房室管背侧壁和腹侧壁的心内膜下组织增生,各形成一个隆起,分别称为背、腹心内膜垫(endocardiac cushion)。两个心内膜垫彼此对向生长,互相融合,便将房室管分隔左、右房室孔(图24-7)。围绕房室孔的间充质局部增生并向腔内隆起,逐渐形成房室瓣,右侧为三尖瓣,左侧为二尖瓣。
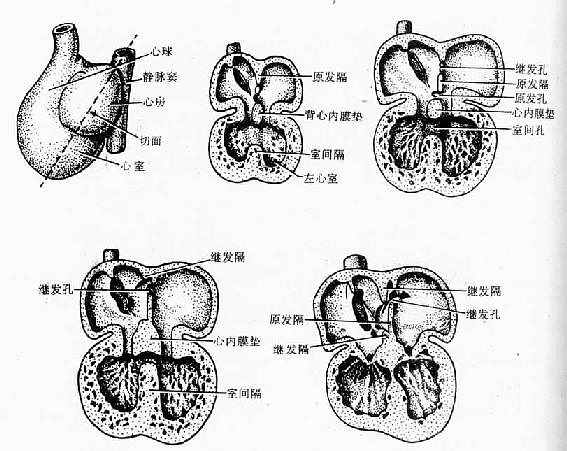
图24-7 房室管、心房及心室的分隔
2.原始心房的分隔胚胎发育至第4周末,在原始心房顶部背侧壁的中央出现一个薄的半月形矢状隔,称原发隔(septum primum)或第1房间隔。此隔沿心房背侧及腹侧壁渐向心内膜垫方向生长,在其游离缘和心内膜垫之间暂留的通道,称原发孔(foramen primum)或第Ⅰ房间孔。此孔逐渐变小,最后由心内膜垫组织向上凸起,并与原发隔游离缘融合而封闭。在原发孔闭合之前,原发隔上部的中央变薄而穿孔,若干个小孔融合成一个大孔,称继发孔(foramen secundum)或第Ⅱ房间孔。原始心房被分成左、右两部分,但两者之间仍有继发孔交通(图24-7)。
第5周末,在原发隔的右侧,从心房顶端腹侧壁再长出一个弓形或半月形的隔,称继发隔(septum secundum)或第Ⅱ房间隔。此隔较厚,渐向心内膜垫生长,下缘呈弧形,当其前、后缘与心内膜垫接触时,下方留有一个卵圆形的孔,称卵圆孔(foramen ovale)。卵圆孔的位置比原发隔上的继发孔稍低,两孔呈交错重叠。原发隔很薄,上部贴于左心房顶的部分逐渐消失,其余部分在继发隔的左侧盖于卵圆孔,称卵圆孔瓣(valve of foramen ovale)。出生前,由于卵圆孔瓣的存在,当心房舒张时,只允许右心房的血液流入左心房,反之则不能。出生后,肺循环开始,左心房压力增大,致使两个隔紧贴并逐渐愈合形成一个完整的隔,卵圆孔关闭,左、右心房完全分隔。
3.静脉窦的演变和永久性左、右心房的形成静脉窦位于原始心房尾端的背面,分为左、右两个角,各与左、右总主静脉、脐静脉和卵黄静脉通连。原来的两个角是对称的,以后由于汇入左、右角的血管演变不同,大量血液流入右角,右角遂逐渐变大,窦房孔也渐渐移向右侧;而左角则渐萎缩变小,其远侧段成为左房斜静脉的根部,近侧段成为冠状窦。
汇入静脉窦血管的变化如下(图24-8):左、右卵黄静脉的尾段分支吻合,发育形成门静脉,左卵黄静脉头段消失,右卵黄静脉头段则形成下腔静脉头段。右脐静脉以及肝和静脉窦之间的左脐静脉退化消失,从脐至肝的一段左脐静脉则一直保留至出生,并与脐带内的脐静脉通连,将从胎盘回流的血液经肝内形成的静脉导管直接导入下腔静脉,继而流入静脉窦右角。在左、右前主静脉之间形成一吻合支,它从左至右呈斜行走向,左前主静脉血液经此吻合支流入右前主静脉。吻合支成为左头臂静脉,右前主静脉的近侧段和右总主静脉成为上腔静脉。因此,体循环的血液均汇流入静脉窦右角。
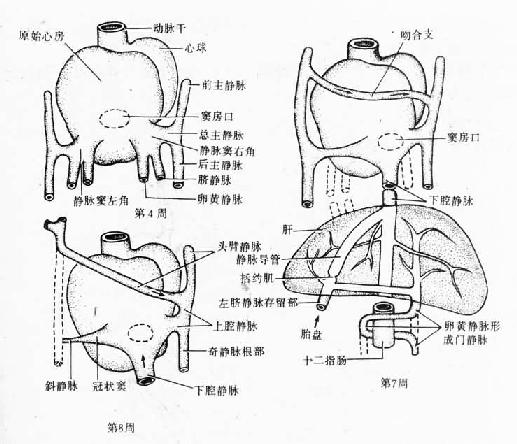
图24-8 静脉窦及其相连静脉的演变(背面观)
胚胎发育第7~8周,原始心房扩展很快,以致静脉窦右角被吸收并入右心房,成为房久性右心房的光滑部,原始右心房则成为右心耳。原始左心房最初只有单独一条肺静脉在原发隔的左侧通入,此静脉分出左、右属支,各支再分为两支。当原始心房扩展时,肺静脉根部及其左、右属支逐渐被吸收并入左心房,结果有4条肺静脉直接开口于左心房。由肺静脉参与形成的部分为永久性左心房的光滑部,原始左心房则成为左心耳。
4.原始心室的分隔心室壁组织向上凸起形成一个较厚的半月形肌性嵴,称室间隔肌部(muscular part of interventricularseptum)(图24-7)。此隔不断向心内膜垫方向伸展,上缘凹陷,它与心内垫之间留有一孔,称室间孔(interventricular foramen),使左、右心室相通。胚胎发育第7周末,由于心动脉球内部形成左、右球嵴,对向生长融合,同时向下延伸,分别与肌性隔的前缘和后缘融合,如此关闭了室间孔上部的大部分;室间孔其余部分则由心内膜垫的组织所封闭(图24-9)。这们便形成了室间隔的膜部。室间孔封闭后,肺动脉干与右心室相通,主动脉与左心室相通。
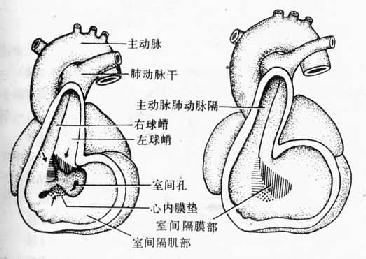
图24-9 室间隔膜部的形成及室间孔封闭
5.动脉干与心动脉球的分隔胚胎发育第5周,心球远段的动脉干和心动脉球内膜下组织局部增厚,形成一对向下延伸的螺旋状纵嵴,称左、右球嵴(bulbar ridge)。以后左、右球嵴在中线融合,便形成螺旋状走行的隔,称主肺动脉隔(aortico-pulmonary septum),将动脉干和心动脉球分隔成肺动脉干和升主动脉(图24-10)。因为主肺动脉隔呈螺旋状,故肺动脉干成扭曲状围绕升主动脉。当主动脉和肺动脉分隔完成时,主动脉通连第4对弓动脉,肺动脉干通连第6对弓动脉。
主动脉和肺动脉起始处的内膜下组织增厚,各形成三个隆起,并逐渐改变形状成为薄的半月瓣。
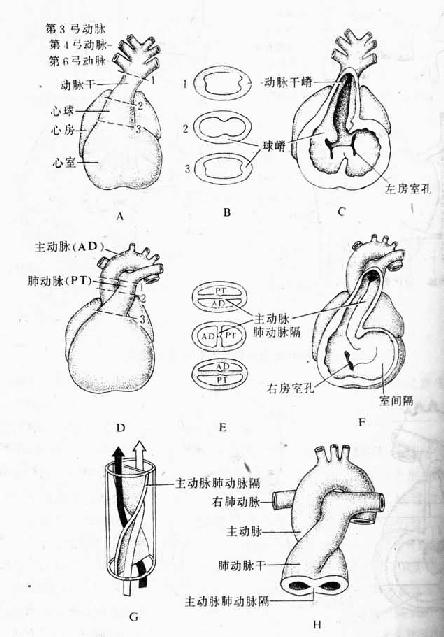
图24-10 动脉干和心动脉球的分隔(第5~6周)
三、弓动脉的演变
弓动脉先后共发生6对,都从动脉囊发出,分别走行各对鳃弓内,绕过前肠的外侧,通连于同侧的背主动脉(图24-11)。6对弓动脉并不同时存在,常常在后一对出现时,前一对已退化消失或发生演变,各对弓动脉的演变结果如下(图24-11):
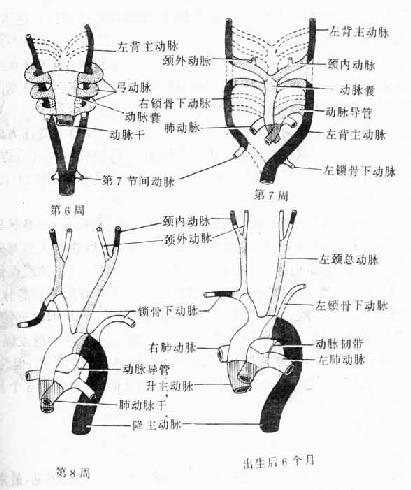
图24-11 动脉干、动脉囊、弓动脉和背主动脉的演变
第1对弓动脉:在第3对弓动脉形成时便退化消失。
第2对弓动脉:继第4对弓动脉形成和增大之后退化。但与第2对弓动脉相连的头侧背主动脉并不消失。
第3对弓动脉:左、右第3弓动脉各发出一个分支,即左、右颈外动脉。以颈外动脉起始点为界,第3弓动脉被分成近侧段和远侧段,近侧段成为颈总动脉,远侧段及与其相延续的背主动脉共同形成颈内动脉。
第4对弓动脉:左、右侧变化不同。左侧第4弓动脉和动脉囊左半共同形成主动脉弓,左侧背主动脉背侧发出的第7节间动脉形成左锁骨下动脉。右侧第4弓动脉及与其相连的尾侧背主动脉和右侧第7节间动脉共同组成右锁骨下动脉。右侧第7节间脉起点至左、右背主动脉汇合处之间的一段背主动脉消失。动脉囊右半形成头臂干。两侧第3和第4弓动脉之间的一段背主动脉消失。
第5对弓动脉:发育不完全,很快消失。
第6对弓动脉:左、右第6弓动脉各发出一分支到肺芽。两侧的分支分别与同侧第6弓动脉的近侧段共同形成左、右肺动脉。右第6弓动脉的远侧段消失;左第6弓动脉的远侧段保留,连接于左肺动脉与主动脉弓之间,即动脉导管(ductus arteriosus)。随着动脉干的分隔,肺动脉与肺动脉干通连。
四、胎儿血液循环和出生后血液循环的变化
(一)胎儿血液循环途径
脐静脉从胎盘经脐带至胎儿肝。脐静脉血富含氧和营养,大部分血液经静脉导管直接注入下腔静脉,小部分经肝血窦入下腔静脉。下腔静脉还收集由下肢和盆、腹腔器官来的静脉血,下腔静脉将混合血(主要是含氧高和丰富的血)送入右心房。从下腔静脉导入右心房的血液,少量与上腔静脉来的血液混合,大部分血液通过卵圆孔进入左心房,与由肺静脉来的少量血液混合后进入左心室。左心室的血液大部分经主动脉弓及其三大分支分布到头、颈和上肢,以充分供应胎儿头部发育所需的营养和氧;小部分血液流入降主动脉。从头、颈部及上肢回流的静脉血经上腔静脉进入右心房,与下腔静脉来的小部分血液混合后经右心室进入肺动脉。胎儿肺无呼吸功能,故肺动脉血仅小部分(5%~10%)入肺,再由肺静脉回流到左心房。肺动脉大部分血液(90%以上)经动脉导管注入降主动脉。降主动脉血液除经分支分布到盆、腹腔器官和下肢外,还经脐动脉将血液运送到胎盘,在胎盘与母体血液进行气体和物质交换后,再由脐静脉送往胎儿体内(图24-12,彩图)。
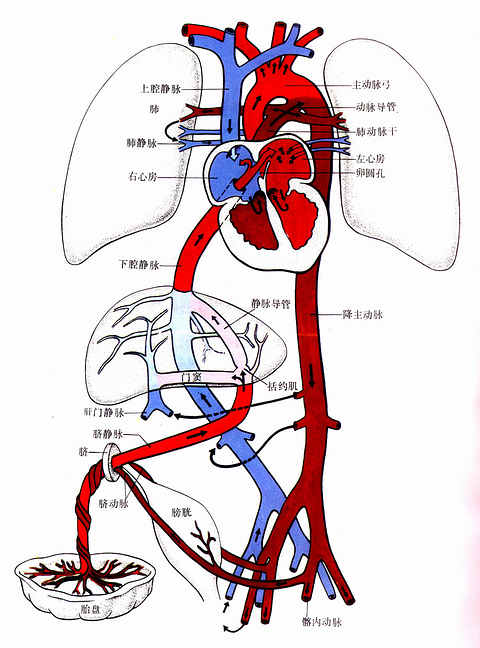
图23-12 胎儿血液循环经路
(二)胎儿出生后血液循环的变化
胎儿出生后,胎盘血循环中断。新生儿肺开始呼吸活动。动脉导管、静脉导管和脐血管均废用,血液循环遂发生一系列改变。主要变化如下:①脐静脉(腹腔内的部分)闭锁,成为由脐部至肝的肝圆韧带;②脐动脉大部分闭锁成为脐外侧韧带,仅近侧段保留成为膀胱上动脉;③肝的静脉导管闭锁成为静脉韧带,从门静脉的左支经肝到下腔静脉;④出生后脐静脉闭锁,从下腔静脉注入右心房的血液减少,右心房压力降低,同时肺开始呼吸,大量血液由肺静脉回流进入左心房,左心房压力增高,于是卵圆孔瓣紧贴于继发隔,使卵圆孔关闭。出生后约一年左右,卵圆孔瓣方与继发隔完全融合,达到解剖关闭,但约有25%的人卵圆孔未达到完全的解剖关闭;⑤动脉导管闭锁成为动脉韧带,出生后3个月左右成为解剖关闭。
五、心血系统的常见畸形
心血管系统发生过程的变化较大,因而先天性畸形的发生也较多见,最常见的有以下几种。
1.房间隔缺损房间隔缺损(atrial septal defect)最常见的为卵圆孔未闭,可因下列原因产生:①卵圆孔瓣出现许多穿孔;②原发隔在形成继发孔时过度吸收,形成短的卵圆孔瓣,不能完全遮盖卵圆孔;③继发隔发育不全,形成异常大的卵圆孔,正常发育的原发隔形成卵圆孔瓣未能完全关闭卵圆孔;④原发隔过度吸收,同时继发隔又形成大的卵圆孔,导致更大的房间隔缺损(图24-13)。此外,心内膜垫发育不全,原发隔不能与其融合,也可造成房间隔缺损。
图24-13 房间隔缺损(右面观)
2.室间隔缺损室间隔缺损(ventricular septal defect)有室间隔膜性缺损和室间隔肌性缺损两种情况。膜性室间隔缺损较为常见,是由于心内膜垫组织扩展时不能与球嵴和室间隔肌部融合所致。肌性室间隔缺损较为少见,是由于心内膜垫组织扩展时不能与球嵴和室间隔肌部融合所致。肌性室间隔缺损较为少见,是由于肌性隔形成时心肌膜组织过度吸收所造成,可出现在肌性隔的各个部位,呈单发性或多发性。
3.动脉干分隔异常
(1)主动脉和肺动脉错位:主动脉和肺动脉发生中相互错位,以致主动脉位于肺动脉的前面,由右心室发出,肺动脉干则由左心室发出。此种畸形发生的原因是在动脉干和心动脉球分隔时,主肺动脉隔不呈螺旋方向,而成直隔的原故。常伴有隔缺损或动脉导管开放,使肺循环和体循环之间出现多处直接交通(图24-14)。
图24-14 主动脉和肺动脉错位
(2)主动脉或肺动脉狭窄:由于动脉干分隔时不均等,以致形成一侧动脉粗大,另一侧动脉狭小,即肺动脉或主动脉狭窄。此时的主肺动脉隔常不与室间隔成一直线生长,因而还易造成室间隔膜部缺损,较大的动脉(主动脉或肺动脉)骑跨在膜的缺损部。
(3)肺动脉狭窄(或右心室出口处狭窄)、室间隔缺损、主动脉骑跨和右心室肥大:又称为法洛四联症(tetralogy of Fallot)(图24-15)。这种畸形发生的主要原因是动脉干分隔不均,致使肺动脉狭窄和室间隔缺损,肺动脉狭窄造成右心室肥大,粗大的主动脉向右侧偏移而骑跨在室间隔缺损处。
图24-15 法洛四联症
4.动脉导管未闭此种畸形多见于女性,约为男性的2~3倍。发生原因可能是由于出生后的动脉导管壁肌组织不能收缩所致。
第二十五章 神经系统的发生
神经系统起源于神经外胚层,由神经管和神嵴分化而成。本章主要叙述脑、脊髓、神经节和周围神经的发生,同时还叙述与神经系统发生密切相关的垂体和松果体的发生。
一、神经管和神经嵴的发生和早期分化
人胚第3周初,在脊索的诱导下,出现了由神经外胚层构成的神经板。随着脊索的延长,神经板也逐渐长大并形成神经沟。在相当于枕部体节的平面上,神经沟首先愈合成管,愈合过程向头、尾两端进展,最后在头尾两端各有一开口,分别称前神经孔(anterior neuropore)和后神经孔(posterior neuropore)。胚胎第25天左右,前神经孔闭合,第27天左右,后神经孔闭合,完整的神经管形成(图25-1)。神经管的前段膨大,衍化为脑;后段较细,衍化为脑;后段较细,衍化为脊髓。
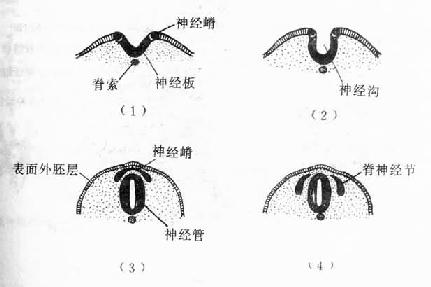
图25-1 神经管和神经嵴的发生
在由神经沟愈合为神经管的过程中,神经沟边缘与表面外胚层相延续的一部分神经外胚层细胞游离出来,形成左右两条与神经管平行的细胞索,位于表面外胚层的下方,神经管的背外侧,称神经嵴(neural crest)(图25-1)。神经嵴分化为周围神经系统的神经节和神经胶质细胞、肾上腺髓质的嗜铬细胞、黑色素细胞、滤泡旁细胞、颈动脉体Ⅰ型细胞等。另外,神经嵴头段的部分细胞还可变为间充质细胞,并由此分化为头颈部的部分骨、软骨、肌肉及结缔组织。因此,这部分神经嵴组织又称为中外胚层(mesoectoderm)。
神经板由单层柱状上皮构成,称神经上皮(neuroepithelium)。当神经管形成后,管壁变为假复层柱状上皮,上皮的基膜较厚,称外界膜(external limiting membrane)。神经上皮细胞不断分裂增殖,部分细胞迁至神经上皮的外周,成为成神经细胞(neuroblast)。之后,神经上皮细胞又分化出成神经胶质细胞(glioblast),也迁至神经上皮的外周。于是,在神经上皮的外周由成神经细胞和成胶质细胞构成一层新细胞层,称套层(mantle layer)。原来的神经上皮停止分化,变成一层立方形矮柱状细胞,称室管膜层(ependymal layer)。套层的成神经细胞起初为圆球形,很快长出突起,突起逐渐增长并伸至套层外周,形成一层新的结构,称边缘层(marginal layer)(图25-2)。随着成神经细胞的分化,套层中的成胶质细胞也分化为星形胶质细胞和少突胶质细胞,并有部分细胞进入边缘层。
成神经细胞属分裂后细胞,一般不再分裂增殖,起初为圆形,称无极成神经细胞(apolar neuroblast),以后发生两个突起,成为双极成神经细胞(bipolar neuroblast)。双极成神经细胞朝向神经管腔一侧的突起退化消失,成为单极成神经细胞(unipolar neuroblast);伸向边缘层的一个突起迅速增长,形成原始轴突。单极成神经细胞内侧端又形成若干短突起,成为原始树突,于是成为多极成神经细胞(multipolar neuroblast)(图25-2,25-3)。
图25-2 神经管上皮的早期分化
在神经元的发生过程中,最初生成的神经细胞的数目远比以后存留的数目多,那些未能与靶细胞或靶组织建立连接的神经元都在一定时间死亡。这说明神经元的存活与其靶细胞或靶组织密切相关。近年来的研究发现,神经细胞的存活及其突起的发生主要受靶细胞和靶组织产生的神经营养因子的调控,如神经生长因子(NGF)、成纤维细胞生长因子(FGF)、表皮生长因子(EGF)、类胰岛素生长因子(IGF)等。大量神经元的生理性死亡,与这些细胞不能获得靶细胞或靶组织释放的这类神经营养因子密切相关。
胶质细胞的发生晚于神经细胞。成胶质细胞首先分化为各类胶质细胞的前体细胞,即成星形胶质细胞(astroblast)和成少突胶质细胞(oligodendroblast)。然后,成星形胶质细胞分化为原浆性和纤维性星形胶质细胞,成少突胶质细胞分化为少突胶质细胞。最近有人在体外培养的研究中发现,两种星形胶质细胞分别由两种不同的前体细胞分化而来,少突胶质细胞与纤维性星形胶质细胞来自同一种前体细胞。也有人提出,少突胶质细胞并非来自神经上皮细胞,而是来自神经管周围的间充质。对于小胶质细胞的起源问题,至今尚有争议,有人认为这种胶质细胞来源于神经管周围的间充质细胞。更多人认为来源于血液中的单核细胞(图25-3)。神经胶质细胞始终保持分裂增殖能力。
图25-3 神经上皮细胞的分化
二、脊髓的发生
神经管的下段分化为脊髓,其管腔演化为脊髓中央管,套层分化为脊髓的灰质,边缘层分化为白质。神经管的两侧壁由于套层中成神经细胞和成胶质细胞的增生而迅速增厚,腹侧部增厚形成左右两个基板(basal plate),背侧部增厚形成左右两个翼板(alar plate)。神经管的顶壁和底壁都薄而窄,分别形成顶板(roof plate)和底板(floor plate)。由于基板和翼板的增厚,在神经管的内表面出现了左右两条纵沟,称界沟(sulcus limitans)(图25-4)。
由于成神经细胞和成胶质细胞的增多,左右两基板向腹侧突出,致使在两者之间形成了一条纵行的深沟,位居脊髓的腹侧正中,称前正中裂。同样,左右两翼板也增大,但主要是向内侧推移并在中线愈合,致使神经管的背侧份消失。左右两翼板在中线的融合处形成一隔膜,称后正中隔。基板形成脊髓灰质的前角(或前柱),其中的成神经细胞分化为躯体运动神经元。翼板形成脊髓灰质后角(或后柱),其中的神经细胞分化为中间神经元。若干成神经细胞聚集于基板和翼板之间,形成脊髓侧角(成侧柱),其内的成神经细胞分化为内脏传出神经元(图25-4)。至此,神经管的尾端分化成脊髓,神经管周围的间充质分化成脊膜。
图25-4 脊髓的形态发生
胚胎第3个月之前,脊髓与脊柱等长,其下端可达脊柱的尾骨。第3个月后,由于脊柱增长比脊髓快,脊柱逐渐超越脊髓向尾端延伸,脊髓的位置相对上移。至出生前,脊髓下端与第3腰椎平齐,仅以终丝与尾骨相连。由于节段分布的脊神经均在胚胎早期形成,并从相应节段的椎间孔穿出,当脊髓位置相对上移后,脊髓颈段以下的脊神经根便越来越斜向尾侧,至腰、骶和尾段的脊神经根则在椎管内垂直下行,与终丝共同组成马尾(图25-5)。
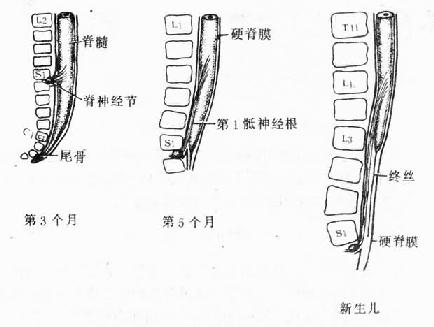
图25-5 脊髓发育与脊柱的关系
三、脑的发生
脑起源于神经管的头段,其形态发生和组织分化过程尽管与脊髓有一些相同或相似之处,但比脊髓更为复杂。
1.脑泡的形成和演变胚胎第4周末,神经管头段形成三个膨大,即脑泡(brain vesicle),由前向后分别为前脑泡、中脑泡和菱脑泡。至第5周时,前脑泡的头端向两侧膨大,形成左右两个端脑(telencephalon),以后演变为大脑两半球,而前脑泡的尾端则形成间脑。中脑泡变化不大,演变为中脑,萎脑泡演变为头侧的后脑(metencephalon)和尾侧的末脑(myelencephalon),后脑演变为脑桥和小脑,末脑演变为延髓(图25-6)。
随着脑泡的形成和演变,神经管的管腔也演变为各部位的脑室。前脑泡的腔演变为左右两个侧脑室和间脑中的第三脑室;中脑泡的腔很小,形成狭窄的中脑导水管;菱脑泡的腔演变为宽大的第四脑室(图25-6)。
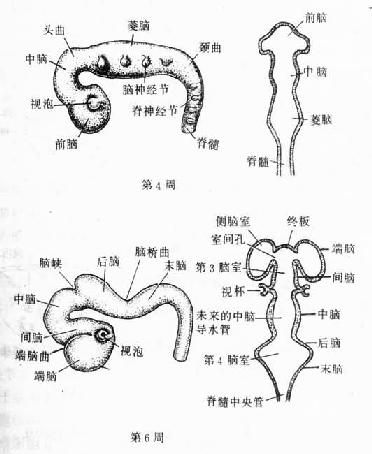
图25-6 脑泡的发生及演变(侧面观及冠状切面观)
在脑泡的形成和演变过程中,同时出现了几个不同方向的弯曲。首先出现的是凸向背侧的颈曲(cervical flexure)和头曲(cephalic flexure)。前者位于脑与脊髓之间,后者位于中脑部,故又称中脑曲。之后,在脑桥和端脑处又出现了两个凸向腹侧的弯曲,分别称脑桥曲和端脑曲(图25-6)。
脑壁的演化与脊髓相似,其侧壁上的神经上皮细胞增生并向侧迁移,分化为成神经细胞和成胶质细胞,形成套层。由于套层的增厚,使侧壁分成了翼板和基板。端脑和间脑的侧壁大部分形成翼板,基板甚小。端脑套层中的大部分都迁至外表面,形成大脑皮质;少部分细胞聚集成团,形成神经核。中脑、后脑和末脑中的套层细胞多聚集成细胞团或细胞柱,形成各种神经核。翼板中的神经核多为感觉中继核,基板中的神经核多为运动核(图25-7)。
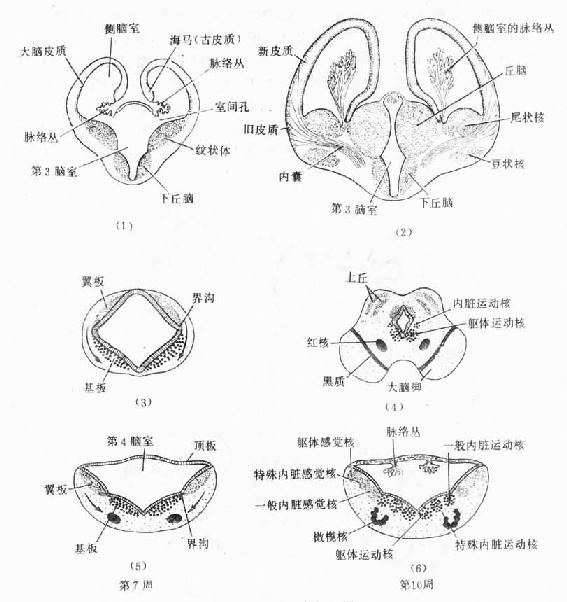
图25-7 脑的各部分化
(1)(2)间脑和端脑的分化 (3)(4)中脑的分化(5)(6)末脑的分化
2.大脑皮质的组织发生大脑皮质由端脑套层的成神经细胞迁移和分化而成。大脑皮质的种系发生分三个阶段,最早出现的是原皮质,继之出现旧皮质,最晚出现的是新皮质。人类大脑皮质的发生过程重演了皮质的种系发生。海马和齿状回是最早出现的皮质结构,相当于种系发生中的原皮质(archicortex),与嗅觉传导有关。胚胎第7周时,在纹状体的外侧,大量成神经细胞聚集并分化,形成梨状皮质(pyriform cortex),相当于种系发生中的旧皮质(paleocortex),也与嗅觉传导有关。旧皮质出现不久,神经上皮细胞分裂增殖、分批分期地迁至表层并分化为神经细胞,形成了新皮质(neocortex),这是大脑皮质中出现最晚、面积最大的部分。由于成神经细胞分批分期地产生和迁移,因而皮质中的神经细胞呈层状排列。越早产生和迁移的细胞,其位置越深,越晚产生和迁移的细胞,其位置越表浅,即越靠近皮质表层。胎儿出生时,新皮质已形成6层结构。古皮质和旧皮质的分层无一定规律性,有的分层不明显,有的分为三层。
3.小脑皮质的组织发生小脑起源于后脑翼板背侧部的菱唇(rhombic lip)。左右两菱唇在中线融合,形成小脑板(cerebellar plate),这就是小脑的始基。胚胎第12周时,小脑板的两外侧部膨大,形成小脑半球;板的中部变细,形成小脑蚓。之后,由一条横裂从小脑蚓分出了小结,从小脑半球分出了绒球(图25-8)。由绒球和小结组成的绒球小结叶是小脑种系发生中最早出现的部分,故称原小脑(archicerebellum),仍然保持着与前庭系统的联系。
起初,小脑板由神经上皮、套层和边缘层组成。之后,神经上皮细胞增殖并通过套层迁至小脑板的外表面,形成了外颗粒层(external granular layer)。这层细胞仍然保持分裂增殖的能力,在小脑表面形成一个细胞增殖区,使小脑表面迅速扩大并产生皱褶,形成小脑叶片。至第6个月,外颗粒层细胞开始分化出不同的细胞类型,部分细胞向内迁移,分化为颗粒细胞,位居蒲肯野细胞层深面,构成内颗粒层。套层的外层成神经细胞分化为蒲肯野细胞和高尔基细胞。构成蒲肯野细胞层;内层的成神经细胞则聚集成团,分化为小脑白质中的核团,如齿状核。外颗粒层因大量细胞迁出而变得较少,这些细胞分化为篮状细胞和星形细胞,形成了小脑皮质的分子层,原来的内颗粒层则改称颗粒层(图25-8)。
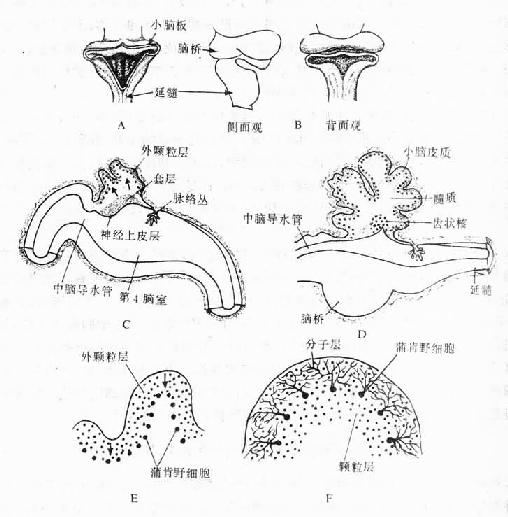
图25-8 小脑的发生
A 第8周胚胎的中脑和菱脑背面观第4脑室顶已切除
B 第4个月的中脑和菱脑侧面观和背面观
C 图A的矢状切面 D图B的矢状切面
E 胚胎期小脑皮质 F出生后小脑皮质
四、神经节和周围神经的发生
1.神经节的发生神经节起源于神经嵴。神经嵴细胞向两侧迁移,分列于神经管的背外侧并聚集成细胞团,分化为脑神经节和脊神经节。这些神经节均属感觉神经节。神经嵴细胞首先化化为成神经细胞和卫星细胞,再由成神经细胞分化为感觉神经细胞。成神经细胞最先长出两个突起,成为双极神经元,由于细胞体各面的不均等生长,使两个突起的起始部逐渐靠拢,最后合二为一,于是双极神元变成假单极神经元。卫星细胞是一种神经胶质细胞,包绕在神经元胞体的周围。神经节周围的间充质分化为结缔组织的被膜,包绕整个神经节。
位于胸段的神经嵴,有部分细胞迁至背主动脉的背外铡,形成两列节段性排列的神经节,即交感神经节。这些神经节借纵行的神经纤维彼此相连,形成两条纵行的交感链。节内的部分细胞迁至主动脉腹侧,形成主动脉前交感神经节。节中的神经嵴细胞首先分化为交感成神经细胞(sympathetic neuroblast),再由此分化为多极的交感神经节细胞。节中的另一部分神经嵴细胞分化为卫星细胞。交感神经节的外周也有由间充质分化来的结缔组织被膜(图25-9)。
副交感神经节的起源问题尚有争议。有人认为副交感神经节中的神经细胞来自中枢神经系统的原基即神经管,也有人认为来源于脑神经节中的成神经细胞。
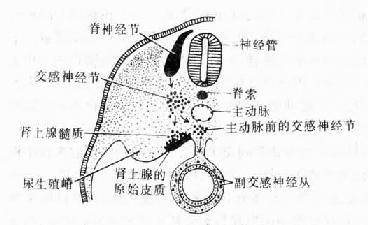
图25-9 交感神经节及肾上腺髓质的发生
2.周围神经的发生周围神经由感觉神经纤维和运动神经纤维构成,神经纤维由神经细胞的突起和施万细胞构成。感觉神经纤维中的突起是感觉神经节细胞的周围突;躯体运动神经纤维中的突起是脑干及脊髓灰质前角运动神经元的轴突;内脏运动神经的节前纤维中的突起是脊髓灰质侧角和脑干内脏运动核中神经元的轴突,节后纤维则是植物神经节节细胞的轴突。施万细胞由神经嵴细胞分化而成,并与发生中的轴突或周围突同步增殖和迁移。施万细胞与突起相贴处凹陷,形成一条深沟,沟内包埋着轴突。当沟完全包绕轴突时,施万细胞与轴突间形成一扁系膜。在有髓神经纤维,此系膜不断增长并不断环绕轴突,于是在轴突外周形成了由多层细胞膜环绕而成的髓鞘。在无髓神经纤维,一个施万细胞与多条轴突相贴,并形成多条深沟包绕轴突,也形成扁平系膜,但系膜不环绕,故不形成髓鞘。
五、垂体的松果体的发生
1.垂体的发生垂体是由两个截然不同的原基共同发育而成的。腺垂体来自拉特克囊(Rathke pouch),神经垂体来自神经垂体芽(neurohypophyseal bud)(图25-10)。
图25-10 垂体的发生
胚胎发育至第3周,口凹顶的外胚层上皮向背侧下陷,形成一囊状突起,称拉特克囊。稍后,间脑的底部神经外胚层向腹侧突出,形成一漏斗状突起,称神经垂体芽。拉特克囊和神经垂体芽逐渐增长并相互接近。至第2月末,拉特克囊的根部退化消失,其远端长大并与神经垂体芽相贴。之后,囊的前壁迅速增大,形成垂体前叶。从垂体前叶向上长出一结节状突起并包绕漏斗柄,形成垂体的结节部。囊的后壁生长缓慢,形成垂体的中间部。囊腔大部消失,只残留一小的裂隙。神经垂体芽的远端膨大,形成神经垂体;其起始部变细,形成漏斗柄。腺垂体中分化出多种腺细胞,神经垂体主要由神经纤维和神经胶质细胞构成。
2.松果体的发生胚胎第7周,间脑顶部向背侧突出。形成一囊状突起,是为松果体原基。囊壁细胞增生,囊腔消失,形成一实质性松果样器官,即松果体。其中的松果体细胞和神经胶质细胞均由神经上皮分化而来。
六、神经系统的常见畸形
1.神经管缺陷这是由于神经管闭合不全所引起的一类先天畸形,主要表现是脑和脊髓的异常,并常伴有颅骨和脊柱的异常。
正常情况下,胚胎第4周末神经管应完全闭合。如果失去了脊索的诱导作用或受到环境致畸因子的影响,神经沟就不能正常地闭合为神经管。如果头侧的神经沟末闭,就会形成无脑畸形(anencephaly);如果尾侧的神经沟未闭,就会形成脊髓裂(myeloschisis)。无脑畸形常伴有颅顶骨发育不全,称露脑(exencephaly);脊髓裂常伴有相应节段的脊柱裂(spina bifida)(图25-11)。脊柱裂可发生于脊柱各段,最常见于腰骶部。脊柱裂的发生程度不同,轻者少数几个椎弓未在背侧中线愈合,留有一小的裂隙,脊髓、脊膜和神经根均正常,称隐性脊柱裂(spina bifida occulta)。患者的局部皮肤表面常有一小撮毛发。多无任何症状。严重的脊柱裂可为大范围的椎弓未发育,伴有脊髓裂,表面皮肤裂开,神经组织暴露于外。中度的脊柱裂比较多见,在患处常形成一个大小不等的皮肤囊袋。如果囊袋中只有脊膜和脑脊液,称脊膜膨出(meningocele);如果囊中既有脊膜和脑脊液,又有脊髓和神经根,则称脊髓脊膜膨出(meningocele)。由于颅骨的发育不全,也可出现脑膜膨出和脑膜脑膨出(meningoencephalocele),多发生于枕部,枕骨鳞未发生,缺口常与枕骨大孔相通连。如果脑室也随之膨出,称积水性脑膜脑膨出(meningohydroencephalocele)(图25-12)。
图25-11 神经系统的几种畸形
图25-12 几种脑部畸形
A脑膜膨出 B脑膜脑膨出C积水性脑膜脑膨出
2.脑积水脑积水(hydrocephalus)是一种比较多见的先天畸形,多由脑室系统发育障碍、脑脊液生成和吸收失去平衡所致,以中脑导水管和室间孔狭窄或闭锁最常见。由于脑脊液不能正常流通循环,致使脑室中积满液体或在蛛网膜下腔中积存大量液体,前者称脑内脑积水(internal hydrocephalus),后者称脑外脑积水(external hydrocephalus),其临床特征主要是颅脑增大,颅骨变薄,颅缝变宽。
第二十六章 眼和耳的发生
一、眼的发生
(一)眼球的发生
胚胎第4周,前脑两侧突出左、右两个视泡(optic vesicle)。视泡远端膨大,贴近体表外胚层,并凹陷形成双层杯状结构,称视杯(optic cup)。视泡近端变细,称视柄(optic stalk),与前脑分化成的间脑相连。与此同时,体表外胚层在视泡的诱导下增厚,形成晶状体板(lens placode)。随后晶状体板凹陷入视杯内,渐与体表外胚层脱离,发育成晶状体泡(lens vesicle)(图26-1)。在视杯内与晶状体泡之间,视杯周围及其与体表外胚层之间充填间充质。眼的各部分就是由视杯与视柄、晶状体泡及它们周围的间充质进一步发育形成的。
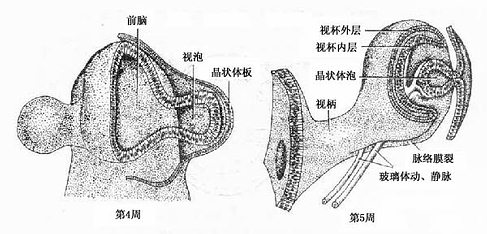
图26-1 视杯与晶状体的发生
1.视网膜和视神经的发生视杯分为内、外两层。外层分化为视网膜色素上皮层;内层增厚,结构与脑泡壁类似,以后分化形成视杆细胞、视锥细胞、双极细胞和节细胞等。两层之间的视泡腔变窄,最后消失,于是两层直接相贴,构成视网膜视部。视杯口边缘部,内层上皮不增厚,与外层分化的色素上皮相贴,并在晶状体泡与角膜之间的间充质内延伸,形成视网膜的睫状体部与虹膜部。睫状体部内层上皮分化为非色素上皮,虹膜内层上皮分化为色素上皮。虹膜的外层色素上皮层还分化出虹膜的平滑肌,即瞳孔括约肌和瞳孔开大肌。
胚胎第5周,视杯及视柄下方向内凹陷,形成一条纵沟,称脉络膜裂(choroid fissure)。脉络膜裂内含间充质和玻璃体动、静脉,为玻璃体和晶状体的发育提供营养。玻璃体动脉还发出分支营养视网膜。脉络膜裂于胚胎第7周封闭。玻璃体动、静脉穿经玻璃体的一段退化,并遗留一残迹称玻璃体管(图26-2)。近段成为视网膜中央动、静脉。视柄与视杯相连,也分内、外两层,两层之间夹一腔腺。随着视网膜的发育分化,节细胞的轴突向视柄内层聚集,视柄内层逐渐增厚,并与外层融合,两层之间的腔隙消失。视柄演变为视神经(图26-3)。
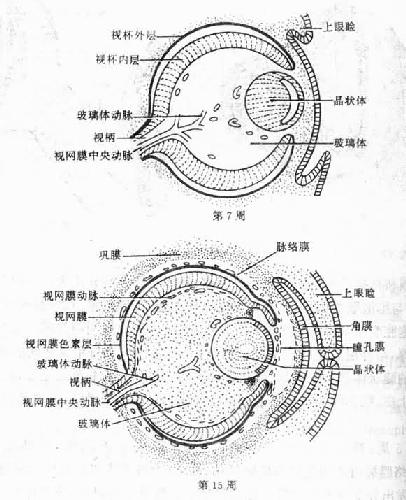
图26-2 眼球与眼睑的发生
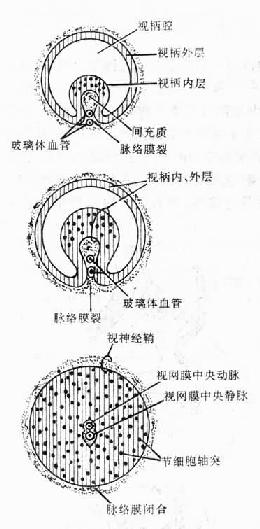
图26-3 视柄横切示视神经的发生
2.晶状体、角膜和眼房的发生晶状体由晶状体泡演变而成。最初晶状体泡由单层上皮组成(图26-1)。前壁细胞立方形,分化为晶状体上皮;后壁细胞高柱状,并逐渐向前壁方向伸长,形成晶状体纤维,泡腔逐渐缩小,直至消失,晶状体变为实体的结构(图26-2)。此后,晶状体赤道区的上皮细胞不断增生、变长,形成新的晶状体纤维。原有的晶状体纤维及其胞核逐渐退化形成晶状体核。新的晶状体纤维逐层添加到晶状体核的周围,晶状体及晶状体核逐渐增大。此时程持续终身,但随年龄的增长速度减慢,故晶状体核可区分成胚胎核、胎儿核、婴儿核及成人核等。
在晶状体泡的诱导下,与其相对的体表外胚层分化为角膜上皮。在晶状体泡与角膜上皮之间充填的间充质内出现一个腔膜,即前房。角膜上皮后面的间充质分化为角膜其余各层。晶状体前面的间充质形成一层膜,周边部厚,以后形成虹膜的基质;中央部薄,封闭视杯口,称为瞳孔膜(pupillary membrane)。虹膜与睫状体形成后,虹膜、睫状体与晶状体之间形成后房。出生前瞳孔膜被吸收而消失,前、后房经瞳孔相连通(图26-2)。
3.血管膜和巩膜的发生视杯周围的间充质分为内、外两层。内层富含血管和色素细胞,分化成眼球壁的血管膜。血管膜的大部分贴在视网膜外面,即为脉络膜;贴在视杯口边缘部的间充质则分化为虹膜基质和睫状体的主体。视杯周围间充质的外层较致密,分化为巩膜。脉络膜与巩膜分别与视神经周围的软脑膜和硬脑膜相连续(图26-2)。
(二)眼睑和泪腺的发生
胚胎第7周时,眼球前方与角膜上皮毗的体表外胚层形成上、下两个皱褶,分别为上、下眼睑。反折到眼睑内面的体表外胚层分化为复层柱状的结膜上皮,与角膜上皮相延续。眼睑外面的体表外胚层则分化为表皮。皱褶内的间充质则分化为眼睑的其它结构。第10周时,上、下眼睑的边缘互相融合(图26-2),至第7或第8个月时才重新张开。
泪腺由体表外胚层上皮下陷形成。泪腺的发育较晚,出生后6周才具分泌泪液的功能。
(三)眼的常见畸形
1.虹膜缺损若脉络膜裂在虹膜处未完全闭合,造成虹膜下方缺损,致使圆形的瞳孔呈钥匙孔样,称虹膜缺损(coloboma of iridis)(图26-4)。此种畸形严重者可延伸到睫状体,视网膜和视神经,并常伴有眼的其它异常。
图26-4 虹膜缺损与瞳孔膜存留
2.瞳孔膜存留若覆盖在晶状体前面的瞳孔膜在出生前吸收不完全,致使在晶状体前方保留着残存的结缔组织网,称瞳孔膜存留(persistent pupillary membrane)(图26-4),出生后可随年龄增长而逐渐吸收。若残存的瞳孔膜影响视力,可手术剔除。
3.先天性白内障出生前晶状体即不透明,为先天性白内障(congenital cataract)多为遗传性,也可由于妊娠早期感染风疹病毒而引起。
4.先天性青光眼巩膜静脉窦发育异常或缺失,致使房水回流受阻,眼压增高,眼球膨大,最后导致视网膜损伤而失明,为先天性青光眼(congenital glaucoma)。基因突变或母亲妊娠早期感染风疹是产生此畸形的主要原因。
5.眼的其它畸形若两侧视泡在中线合并,则产生独眼畸形(cyclopia),仅在正中部有一个眼,眼的上方常有一管状鼻。倘若视泡未发生或视泡发育受阻则产生无眼或小眼畸形。
二、耳的发生
1.内耳的发生胚胎第4周时,菱脑两则的体表外胚层在萎脑的诱导下增厚,继之向下方间充质内陷,最后与体表外胚层分离,形成一个囊状的听泡(otic vesicle)(图26-5)。听泡初为梨形,以后向背腹方向延伸增大,分为背侧的前庭囊和腹侧的耳蜗囊,并在背端内侧长出一小囊管,为内淋巴管。前庭囊形成三个半规管和椭圆管的上皮;耳蜗囊形成球囊和耳蜗管的上皮。这样听泡及其周围的间充质便演变为内耳膜迷路(图26-6)。胚胎第3个月时,膜迷路周围的间充质分化成一个软骨囊,包绕膜迷路。约在胚胎第5个月时,软骨囊骨化成骨迷路。于是膜迷路就完全被套在骨迷内,两者间仅隔以狭窄的外淋巴间隙。
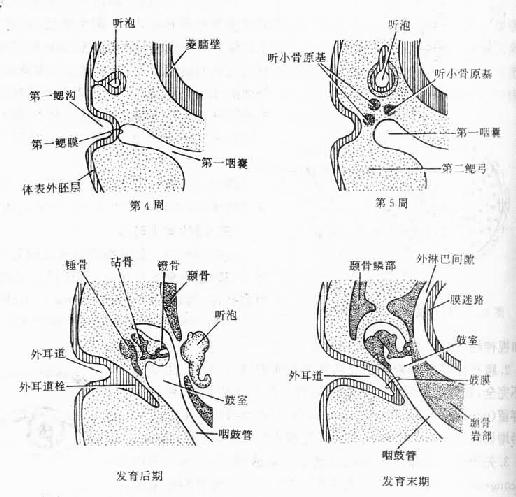
图26-5 耳的发生
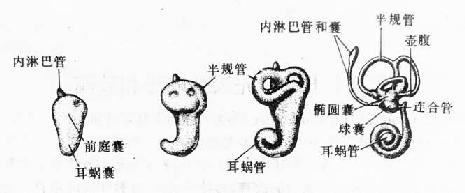
图26-6 听泡的发育(第5~8周)
2.中耳的发生胚胎第9周时,第1咽囊向背外侧扩伸,远侧盲端膨大成鼓室,近端细窄形成鼓管。鼓室内胚层与第1鳃沟底的外胚层相贴,分别形成鼓膜内、外上皮,两者之间的间充质形成鼓膜的结缔组织(图26-5)。鼓室周围的间充质分化成三块听小骨,听小骨渐突入鼓室内(图26-5)。
3.外耳的发生外耳道由第1鳃沟演变形成。胚胎第2个月末,第1鳃沟向内深陷,形成漏斗状管道,以后演变成外耳道外侧段。管道的底部外胚层细胞增生成一上皮细胞板,称外耳道栓(meatal plug )。胚胎第7个月时,外耳道栓内部细胞退化吸收,形成管腔,成为外耳道的内侧段(图26-5)。
胚胎第6周时,第1鳃沟周围的间充质增生,形成6个结节状隆起,称耳丘(auricular hillock)。后来这些耳丘围绕外耳道口合并,演变成耳廓(图26-7)。
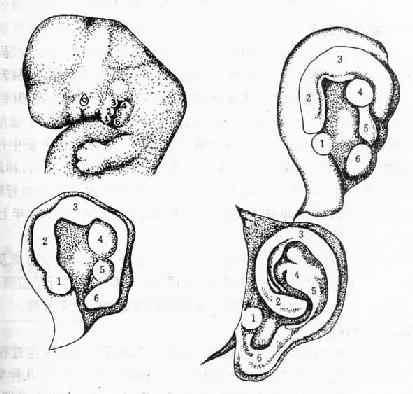
图26-7 耳廓的发生
1~6示耳丘6个结节状隆起的发生与演变
4.耳的常见畸形最常见的是先天性耳聋(congenital deafness)和耳廓畸形。内、中、外耳的发育异常均可导致先天性耳聋,如外耳道闭锁(外耳道栓细胞未吸收);中耳鼓室闭锁或听小骨发生异常,造成听骨链僵直;内耳骨迷路、膜迷路发育异常等。先天性耳聋大多是遗传因素引起,但有些是由于致畸因素的干拢,如妊娠早期感染风疹病毒,导致螺旋器损伤;妊娠后期强噪音对胎儿听力的损伤。
第二十七章 先天性畸形和致畸
先天性畸形(congenital malformation)是由于胚胎发育紊乱而出现的形态结构异常。研究先天畸形的科学称畸形学(teratology),是胚胎学的一个重要分支。
近些年来,随着现代工业发展和环境污染的加重,先天畸形的发生率有上升趋势。同时,由于生活水平的提高和医疗条件的改善,感染性疾病、营养性疾病和老年性疾病的发病率和死亡率明显下降。因此,先天畸形便成了危害人类健康的严重疾患,受到世界各国的高度重视。近年对先天畸形进行了广泛的监测和病因学调查,并开展了深入的实验研究,取得长足的进展。
一、先天畸形的发生概况和分类
(一)先天畸形的发生概况
Kennedy(1967)综合分析了世界各国近2000万新生儿的畸形发生壮况,结果显示:根据医院出生记录统计的畸形儿发生率为1.26%,根据儿科医生查体结果统计出的畸形儿发生率为4.5%,其中美国的畸形儿发生率最高,为8.76%;德国最低,为2.2%。1966年世界卫生组织对16个国家25个妇幼保健中心的421781例产妇进行了规范化统计,结果显示:416695例产妇为单产,5086例为双产或多产,共产出426932个新生儿,其中畸形儿7385例,占总数的1.73%。在出现的各种畸形中,四肢畸形占26%,神经管畸形占17%,尿生殖系统畸形占14%,颜面畸形占9%,消化系统畸形占8%,心血管畸形占4%,多发畸形占22%。据报道,1965年日本新生儿的畸形发生率为6%,1984年上升为14%,20年内增长了1倍多。
从1986年10月至1987年9月,我国卫生部组织由华西医科大学负责及29个省市自治区945所医院和妇幼保健院参加,对全国1243284例围产儿进行了监测,结果显示:畸形儿的发生率为1.3%,其中以神经管畸形和唇腭裂畸形的出现率最高。
(二)先天畸形的分类
1958年至1982年,Willis、Grag和Moore根据先天畸形的胚胎发生过程,先后提出了大致相同的畸形分类方法。根据这种分类方法,先天畸形可分为以下几种类型。
整胚发育畸形:多由严重遗传缺陷引起,大都不能形成完整的胚胎并早期死亡吸收或自然流产。
胚胎局部发育畸形:由胚胎局部发育紊乱引起,涉及范围并非一个器官,而是多个器官。例如头面发育不全(ethmocephalus)、并肢畸形(sirenomelus)等。
器官和器官局部畸形:由某一器官不发生或发育不全所致,例如双侧或单侧肺不发生、室间隔膜部缺损等。
组织分化不良性畸形:这类畸形的发生时间较晚且肉眼不易识别。例如骨发育不全(osteogenesisimperfecta)、克汀病(cretinism)、巨结肠(Hirschsprumgdisease)等。
发育过度性畸形:由器官或器官的一部分增生过度所致,例如在房间隔形成期间第二隔生长过度而引起的卵圆孔闭合或狭窄、多指(趾)畸形等。
吸收不全性畸形:在胚胎发育过程中,有些结构全部吸收或部分吸收,如果吸收不全,就会出现畸形。例如蹼状指(趾)、不通肛、食管闭锁等。
超数和异位发生性畸形:由于器官原基超数发生或发生于异常部位而引起,如多孔乳腺、异位乳腺、双肾盂双输尿管等。
发育滞留性畸形:器官发育中途停止,器官呈中间状态。例如双角子宫、隐睾、骨盆肾、气管食管瘘等。
重复畸形:重复畸形(double malformation)是由于单卵孪生的两个胎儿未能完全分离,致使胎儿整体或部分结构不同程度地重复出现。这是人类最早认识和描述的一种畸形。
寄生畸形:寄生畸形(parasitic malformation)又称寄生胎(parasit)。单卵孪生的两个胎儿发育速度相差甚大,致使小者附属在大者的某一部位。
世界卫生组织(WHO)在疾病的国际分类中,根据先天畸形的发生部位进行分类,并对各种畸形编排了分类代码。目前世界各国对先天畸形的调查统计大都采用这种分类方法,并根据本国的具体情况略加修改补充。其中12种先天畸形是世界各国常规监测的对象,是国际学术和资料交流中的代表性畸形(表27-1)。在我国的出生缺陷监测中,以这12种先天畸形为基础,并根据我国的具体情况增加了多见或比较多见的9种畸形;其中尿道上裂和尿道下裂合为一类,上肢和下肢短肢畸形也合为一类,共19种(表27-2)。
表27-1 国际常规监测的12种先天畸形
| 先天畸形 | 国际分类编码 | 先天畸形 | 国际分类编码 |
| 无脑儿 | 740 | 直肠及肛门闭锁 | 751.2 |
| 脊柱裂 | 741 | 尿道下裂 | 752.2 |
| 脑积水 | 742 | 短肢畸形-上肢 | 755.2 |
| 腭裂 | 749.0 | 短肢畸形-下肢 | 755.3 |
| 全部唇裂 | 749.1~749.2 | 先天性髋关节脱位 | 755.6 |
| 食管闭锁及狭窄 | 750.2 | 唐氏综合征 | 759.3 |
表27-2 我国监测的19种先天畸形
| 先天畸形 | 国际分类编码 | 先天畸形 | 国际分类编码 |
| 无脑儿 | 740 | 短肢畸形(上、下肢) | 755.2~755.3 |
| 脊柱裂 | 741 | 先天性髋关节脱位 | 755.6 |
| 脑积水 | 742 | 畸形足 | 754 |
| 腭裂 | 749.0 | 多指与并指(趾) | 755.0~755.1 |
| 全部唇裂 | 749.1~749.2 | 血管瘤(73cm) | 620 |
| 先天性心血管病 | 746~747 | 色素痣(73cm) | 757.1 |
| 食管闭锁及狭窄 | 750.2 | 唐氏综合征 | 759.3 |
| 直肠及肛门闭锁 | 751.2 | 幽门肥大 | 750.1 |
| 内脏外翻 | 606 | 膈疝 | 603 |
| 尿道上、下裂 | 752.2~752.3 |
二、先天畸形的发生原因
先天畸形的发生原因不外遗传因素、环境因素和两者的相互作用。Wilson(1972)综合分析了5次国际出生缺陷讨论会的资料,发现遗传因素引起的出生缺陷占25%,环境因素占10%,遗传因素与环境因素相互作用和原因不明者占65%。
(一)遗传因素与先天畸形
遗传因素引起的先天畸形包括亲代畸形的血缘传和配子或胚体细胞的染色体畸变及基因突变。
染色体畸变包括染色体数目的异常和染色体结构异常。染色体数目减少可引起先天畸形,常见于单体型。常染色体的单体型胚胎几乎不能存活,性染色体的单体型胚胎约有97%死亡,3%成活,但有畸形,如先天性卵巢发育不全即Turner综合征(45,xo)。染色体数目的增多也可引起畸形,多见于三体型(trisomy),如21号染色体的三体可引起先天愚型即Down综合征,18号染色体的三体可引起Edward综合征,13号染色体三体可引起Patau综合征,性染色体三体(47,xxy)可引起先天性睾丸发育不全(即Klinefelter综合征)。染色体的结构畸变也可引起畸形,如5号染色体短臂末端断裂缺失可引起猫叫综合征。基因突变的发生次数尽管比染色体畸变多,但多不引起畸形,故因基因突变引起的畸形远比染色体畸变引起的畸形少,主要有软骨发育不全、肾上腺大、小头畸形、无虹膜、多囊肾、皮肤松垂症,睾丸女性化综合征。
(二)环境因素与先天畸形
环境因素的致畸作用早在本世纪40年代就已被确认,能引起先天畸形的环境因素统为致畸因子(teratogen)。影响胚胎发育的环境有三个方面,即母体周围的外环境、母体的内环境和胚体周围的微环境。这三个层次的环境中引起胚胎畸形的因素均称为环境致畸因子。外环境中的致畸因子有的可穿过内环境和微环境直接作用于胚体,有的则通过改变内环境和微环境而间接作用于胚体。环境致畸因子主要有五类,即生物性致畸因子、物理性致畸因子、致畸性药物、致畸性化学物质和其它致畸因子。
1.生特性致畸因子有些致畸微生物可穿过胎盘屏障直接作用于胚体,有些则作用于母体和胎盘,引起母体发热、缺氧、脱水、酸中毒等,或干扰胎盘的转运功能,破坏胎盘屏障,从而间接地影响胚胎发育。目前已经确定对人类胚胎有致畸作用的生物因子有:风疹病毒、巨细胞病毒、单纯疱疹病毒、弓形体、梅毒螺旋体等。还有一些病毒,如流行性腮腺炎病毒、流感病毒等,对动物有明显的致畸作用,但对人类有无致畸作用尚未确定。
2.物理性致畸因子目前已确认的对人类有致畸作用的物理因子有射线、机械性压迫和损伤等。另外,高温、严寒、微波等在动物确有致畸作用,但对人类的致畸作用尚证据不足。
3.致畸性药物本世纪60年代“反应停事件”后,药物致畸作用引起人们的普遍重视,并对药物进行严格的致畸检测。反应停又名酞胺哌喧酮,60年代在欧洲曾广泛用于治疗妊娠呕吐,结果引起大量残肢畸形儿的出生,酿成了所谓所谓反应停事件。
多数抗肿瘤药物有明显的致畸作用,如氨基喋呤可引起无脑、小头及四肢畸形;白血福恩、苯丁酸氮芥、环磷酰胺、6-巯基嘌呤等均能引起多种畸形。某些抗生素也有致畸作用。如孕期大剂量服用四环素可引起胎儿牙釉质发育不全,大剂量应用链霉素可引起先天性耳聋,大剂量应用新生霉素可引起先天性白内障和短指畸形等。某些抗惊厥药物,如唑烷、乙内酰脲、三甲双酮;某些治疗精神病的药物,如酚噻嗪、嗅化锂、安非他明;某些抗凝血药,如苄丙酮香豆素、肝素;某些激素,如性激素,均有不同程度的致畸作用,可引起多种畸形,有些药物在动物实验中有明显的致畸作用,但对人类有无致畸作用尚需进一步证实,如苯妥英钠,可的松等。
4.致畸性化学物质在工业:“三废”、农药、食品添加剂和防腐剂中,含有一些有致畸作用的化学物质。目前已经确认对人类有致畸作用的化学物质有:某些多环芳香碳氢化合物,某些亚硝基化合物,某些烷基和苯类化合物,某些农药如敌枯双,某些重金属如铅、砷、镉、汞等。有些化学物质对动物有明显的致畸作用,但对人类胚胎的致畸作用尚待进一步证实。
5.其它致畸因子汹酒、大量吸烟、缺氧、严重营养不良等均有致畸作用。孕期过量饮酒可引起多种畸形,称胎儿酒精综合征(fetal alcohol syndrome),其主要表现是发育迟缓、小头、小眼、短眼裂、眼距小等。吸烟的致畸作用越来越受到人们的重视。流行病学调查显示,吸烟者所生的新生儿平均体重明显低于不吸烟者,且吸烟越多其新生儿的体重越轻。第天吸烟不足10支的孕妇,其胎儿出现畸形的危险性增加90%。吸烟引起胎儿畸形主要是由于尼古丁使胎盘血管收缩,胎儿缺血,CO进入胎儿血液并使胎儿缺氧。另外,吸烟所产生的其它有害物质,如氰酸盐,也可影响胎儿的正常发育、吸烟不仅引起胎儿先天畸形,严重者可导致胎儿死亡和流产。
(三)环境因素与遗传因素在畸形中的相互作用
在畸形的发生中,环境因素与遗传因素的相互作用是非常明显的,这不仅表现在环境致畸因子通过引起染色体畸变和基因突变而导致先天畸形,而且更表现在胚肿的遗传特性,即基因型决定和影响胚胎对致畸因子的易感程度。流行病学调查显示,在同一地区同一自然条件下,同时怀孕的孕妇在一次风疹流行中都受到了感染,但其新生儿有的出现畸形,有的却完全正常。出现这种情况的原因在于,每个胚胎对风疹病毒的易感性不同。决定这种易感性的主要因素是胚体结构和生化特性,而这种结构和生化特性取决于胚体的遗传特性。对致畸因子的种间差异更是如此,如可的松对小白鼠有明显的致畸作用(主要引起腭裂),但对猪、猴等则几乎无致畸作用。人类和其它灵长类动物对反应停非常敏感,可引起残肢畸形,但对灵长目之外的其它哺乳动物几乎无致畸作用。
在环境因素与遗传因素相互作用引起的先天畸形中,衡量遗传因素所起作用的指标称遗传度。某种畸形的遗传度越高,说明遗传因素在该畸形发生中的作用越大。例如先天性心脏畸形的遗传度为35%,先天性巨结肠的遗传度为80%,脊柱裂为60%,无脑儿为60%,先天性髋关节脱位为70%,腭裂为76%,先天性幽门狭窄为75%。
三、胚胎的致畸敏感期
发育中的胚胎受到致畸作用后,是否发生畸形和发生什么样的畸形,不仅决定于致畸因子的性质和胚胎的遗传特性,而且决定于胚胎受到致畸因子作用时所处的发育阶段。胚胎发育是一个连续的过程,但也有着一定的阶段性,处于不同发育阶段的胚胎对致畸作用的敏感程度也不同。受到致畸作用最易发生畸形的发育阶段称为致畸敏感期(susceptible period)。
胚前期是指受精后的前两周,此期的胚胎受到致畸作用后容易发生损害。但较少发生畸形。因为此时的胚胎细胞的分化程度极低,如果致畸作用强,胚胎即死亡;如果致畸作用弱,少数细胞受损死亡,多数细胞可以代偿调整。
胚期是指受精后第3周至第8周,此期胚胎细胞增生、分化活跃,胚体形态发生复杂变化,最易受到致畸因子的干扰而发生器官形态结构畸形。所以,胚期是最易发生畸形的致畸敏感期。由于胚胎各器官的分化发生时间不同,其致畸敏感期不同(图27-1)。
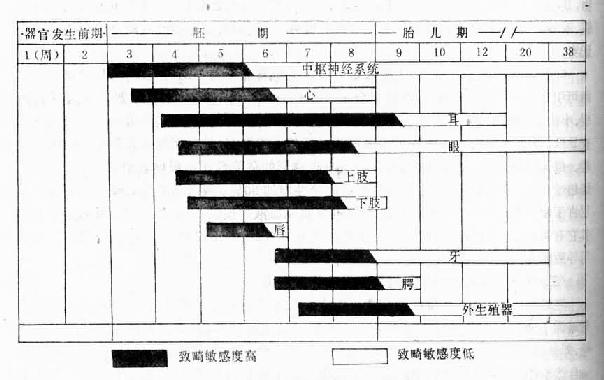
图27-1 人胚胎主要器官的致畸敏感期
胎儿期是胚胎发育最长的一个时期,起自第9周,直至分娩,此期胎儿生长发育快,各器官进行组织分化和功能分化,受致畸作用后也会发生畸形,但多属组织结构和功能缺陷,一般不出现器官形态畸形。所以,胎儿期不属致畸敏感期。
另外,不同致畸因子对胚胎的致畸敏感期也不同。例如风疹病毒的致畸敏感期为受精后第1个月,畸形发生率为50%;第2个月便降为22%,第3个月只有6%~8%。反应停的致畸敏感期为受精后21~40天内。
四、先天畸形的预防、宫内诊断和宫内治疗
1.先天畸形的预防正如前述,遗传因素是引起先天畸形的重要因素。尽管并非所有遗传因素引起的畸形都能遗传给后代,但可遗传性畸形的发生率仍然很高。因此,采用遗传学方法预防遗传性畸形是畸形预防中的一个重要方面。遗传工程和基因工程的兴起为传性畸形的根治展示了美好前景,但目前防止遗传性畸形的主要措施是预防,遗传咨询是达到这一目的重要措施。
做好孕期保健是防止环境致畸的根本措施。在怀孕期间,特别是妊娠前8周,要尽量预防感染,特别是要防止风疹病毒、弓形体、单纯疱疹病毒、巨细胞病毒和梅毒螺旋体的感染。据测定,我国育龄期妇女风疹病毒的感染率高达50%左右,预防感染的最好方法是接种风疹疫苗。弓形体在人群和动物中的感染率都很高,除搞好环境卫生和饮食卫生以防止感染外,还应在孕前作血清学检查。如果检查结果显示未感染过弓形体,应该进行免疫注射后再怀孕。如果孕期感染了弓形体,就应中止妊娠。单纯疱疹病毒的传播主要是通过皮肤和粘膜的直接接触,故比较容易预防。巨细胞病毒的致畸率高,传播途径多,感染率高,较难预防,免疫注射是最好的预防方法。
孕期谨慎用药是防止药物致畸的根本途径。孕期特别是孕早期决不可滥用药物,如果必须应用致畸性药物,应中止妊娠。
戒烟戒酒是预防胎儿畸形的一个重要方面。孕期大量吸烟,轻者可致胎儿发育迟缓,重者可引起严重畸形,甚至死亡、流产。被动吸烟的危害并不亚于主动吸烟,应引起重视。孕期汹酒,酒精可通过胎盘迅速进入胎儿体内,胎儿血液中的酒精浓度与母血中的浓度相近,胎儿肝又缺少酒精脱氢酶,故滞留时间长,危害甚大。
孕期特别是孕早期应避免和减少射线的照射,包括X射线α、β和γ射线。细胞对射线的敏感程度与细胞的增殖力成正比。与细胞的分化程度成反比。因此,胚体细胞对射线的敏感度比成体细胞高得多,对母体无害剂量的照射就可能危及胎儿。
2.先天畸形的宫内诊断如果说防止畸形的发生是一级预防,防止严重畸形儿的出生就是二级预防。二级预防是一级预防的必要补充,因为完全防止畸形的发生几乎是不可能的。随着医学的发展,越来越多的畸形可以在出生前作出明确诊断,有些畸形还可进行宫内治疗。
曾生育过严重畸形儿的孕妇,多次发生自然流产、死胎、死产的孕妇,孕早期服用过致畸药物或有过致畸感染或接触过较多射线,长期处于污染环境及羊水过多或过少的孕妇,均应进行宫内诊断。目前宫内诊断的主要方法有:
(1)羊膜囊穿刺(amniocentesis):羊水中不仅含有胎儿的排泄物、分泌物和多种酶,还含有从胎儿皮肤和粘膜脱落下来的上皮细胞。因此,羊水的化学分析可以准确地反映胎儿的代谢状况,羊水细胞的染色体分析能够准确地反映胎儿的遗传状况。羊膜囊穿刺在妊娠15~17周最适宜,抽取10~15ml羊水,离心沉降后分别进行生化分析和染色体分析。有严重的尤其是开放性神经管缺陷时,羊水中出现乙酰胆碱酯酶同工酶,甲胎蛋白的含量可比正常高出数十倍。染色体异常引起的先天畸形,如Down综合征和Turner 综合征等,可通过染色体分析确定。测定羊水中17-羟孕酮的含量可诊断肾上腺上腺性征综合征。测定羊水中甲状腺素和促甲状腺素的含量,可以诊断甲状腺发育异常。
(2)绒毛膜检查:绒毛膜细胞与胚体细胞同源,有着相同的染色体组型。因此,可以通过绒毛膜活检(chorionic villi biopsy,CVB)诊断胚胎的染色体异常。这种检查可在妊娠第8周进行,达到早期诊断。
(3)胎儿镜检查:胎儿镜是用光导纤维制成的一种内窥镜,在妊娠第15~20周使用最好。通过胎儿镜可直接观察胎儿外部结构有无异常,并可采取胎儿血液、皮肤等样本做进一步检查。还可直接给胎儿注射药物或输血。
(4)B型超声波检查:是一种简便易行且安全可靠的宫内诊断方法,可在荧光屏上清楚地看到胎儿的影像,不仅能诊断胎儿外部畸形,还可诊断某些内脏畸形。
(5)羊水和胎儿造影及X线检查:将水溶性造影剂注入羊膜腔,便可在X线荧屏上观察胎儿的大小和外部畸形。如果将某种脂溶性造影剂注入羊膜腔,使其吸附于胎儿体表,便可在X线下清楚地观察胎儿的外部畸形。
3.先天畸形的宫内治疗近年宫内诊断的研究进展很快,已经能对多种畸形作出准确的宫内诊断,但能进行宫内治疗的畸形还很有限。非手术性治疗开展较早,如小剂量可的松治疗胎儿肾上腺性征综合征(andrenogenital syndrome),甲状腺素治疗胎儿甲状腺机能低下引起的发育紊乱。进展较快并能迅速收效的宫内治疗方法是宫内手术。宫内诊断和宫内手术已经成为一个专门学科,称胎儿外科学(fetal surgery)。LiLey(1963)用宫内胎儿输血方法治疗胎儿水肿并取得成功,是首例宫内手术治疗。80年代初。开展胎儿颅脑穿刺手术治疗胎儿脑积水取得成功,以后又开展脑室-羊膜腔沟通术(Ventriculoamniotic shunt)治疗阻塞性脑积水,也取得成功。还有人用这种改道方法治疗胎儿肾积水。据1984年国际胎儿外科统计资料显示,脑积水和肾积水宫内手术治疗的存活率分别为44.2%和82.3%。近来,用宫内胎儿胸腔穿刺治疗乳糜胸取得了成功。动物实验研究,膈疝、脐疝、腹壁裂和轻度脊柱裂等畸形均可做宫内手术治疗。
主要阅读书目和期刊
参考书:
1.成令忠,主编.组织学.北京:人民卫生出版 ,1993
2.成令忠,主编.组织学与胚胎学进展续集.北京:人民卫生出版社,1989
3.何泽涌,主编.组织学与胚胎学进展.北京:人民卫生出版社,1987
4.何泽涌,主译.人体发生学一面向临床的胚胎学.北京:人民卫生出版社,1982
5. 中国人胚胎发育时序和畸胎预防. 上海:上海医科大学出版社1993
6.李肇春,李和,主编. 组织学与胚胎学习题与题角汇编. 武汉:湖北科学技术出版社,1993
7.杜卓民,主编. 实用组织学技术 . 北京:人民卫生出版社,1982
8.陈啸梅,等主编. 组织化学手册. 北京:人民卫生出版社,1982
9.宗铁生,主编.人体胚胎学. 北京:科学出版社,1987
10.杨景山,主编 . 医学细胞化学与细胞生物技术 . 北京:北京医科大学、中国协和医科大学联合出版社,1990
11.张汇泉,主编 . 人体畸形 . 北京:人发卫生出版社,1986
12.杭振镳,蔡文琴,主编.电子显微镜技术在临床学上的应用. 重庆 重庆出版社,1988
13.苏慧慈,主编. 原位杂交. 北京:中国科学技术出版社,1994
14.蔡文琴 ,王伯云,主编 .实用免疫细胞细胞化学与核酸分子杂交技术. 成都:四川省科技出版社,1994
15中国医学百科全书 .组织学与胚胎学. 1988;医学史1987
16.SuHuici(苏慧慈)(ed).A Textbook ofHistology.China Science and Technology Press,Beijing,China,1993
17.AlbertaB,et al(eds).Molecular Biology of the Cell.2 nd ed ,New york;GerlandPublication,Inc,1989
18.CormackDH(ed).Ham/s Histology.9 th ed.Philadelphia,San Mateo; Appleton and Lange,1989
19.FawcettDW(ed).A Textbook of Histology.11 th ed,Philadelphia;W.B.Saunders,1986
20.GenerserF(ed).Texbook of Histology.1 sted,Philadelphia,London,Toronto;W.B.Saunders,1986
21.JunqueiraLC.,et al (eds).Basic Histology.6 th ed,San Mateo;Appleton and Lange,1989
22.MooreKL(ed).The Developing Human .2 th ed,Philadelphia,London,Toronto;W.B.Saunders,1977
23.WeissL(ed).Cell and Tissue Biology.6 th ed,Baltimore;Urban and Schwarzenberg,1988
期刊:
1.解剖学报 中国解剖学会出版
2.解剖学杂志 中国解剖学会出版
3.中国组织化学与细胞化学杂志 中国解剖学会出版
4.神经解剖学杂志 中国解剖学会出版
5.中国解剖科学进展 中国解剖学会出版
6.生理科学进展 中国生理学会出版
