第一节 急性呼吸衰竭的诊治
当人体的气体交换发生严重障碍不能维持正常的氧合功能,不能排出代谢所产生的二氧化碳时,即为呼吸衰竭。它表现为严重的低氧血症伴或不伴有高碳酸血症。因此呼吸衰竭是一种功能失常的病理生理学过程,并非是一种独立的疾病。可以引起呼吸衰竭的疾病很多,而呼吸衰竭常能危及患者的生命,从事急诊医学专业的医务人员应当熟悉它的临床表现以便及时诊断,正确救治。由于呼吸衰竭并没有显着特征性的症状或体征,它的诊断很大程度要依靠动脉血液气体分析测定。一般来说,当一成年人,位于海平面,呼吸空气,在静息状态下,若动脉血氧分压(PaO2)低于8.0kPa(60mmHg),二氧化碳分压(PaCO2)正常或低于正常时即为低氧血症型或Ⅰ型呼吸衰竭;若PaO2小于8.0kPa,PaCO2大于或等于6.67kPa(50mmHg)时即为高碳酸血症型或Ⅱ型呼吸衰竭。
呼吸衰竭又因起病的急缓,分为急性或慢性呼吸衰竭。急性呼吸衰竭在数秒或数小时内迅速发生。呼吸功能障碍在数日或更长时间内缓慢发展,机体内相应产生一系列代偿性的代谢改变如血碳酸氢盐增高等即为慢性呼吸衰竭。本章只介绍急性呼吸衰竭的诊治要点。但也应注意到在实际临床工作中,经常会遇到在慢性呼吸衰竭的基础上,由某些激发因素,又发生急性呼吸衰竭。
一、急性呼吸衰竭的病理生理学改变
呼吸衰竭的病理生理学基础在于气体交换的障碍,包括四个主要环节(参阅第3章)。
(一)肺泡通气不足 指单位时间内新鲜空气到达肺泡的气量减少。由于每分钟肺泡通气量(![]() A)的下降,引起PaCO2升高,高碳酸血症。同时,根据肺泡气公式
A)的下降,引起PaCO2升高,高碳酸血症。同时,根据肺泡气公式
| PAO2= | (PB-PH2O)·FiO2- | PaCO2 |
| R |
(PAO2,PB和PH2O分别表示肺泡气氧分压,大气压和水蒸气压力,FiO2代表吸入气氧分数,R代表呼吸交换比值)。由已测得的PaCO2值,就可推算出理论的肺泡气氧分压值。如PaCO2为9.33kPa(70mmHg),PB为101.08kPa(760mmHg),37℃时PH2O为6.25kPa(47mmHg),R一般为0.8,则PAO2理论值为7.18kPa(54mmHg)。假若PaCO2的升高单纯因![]() A下降引起,不存在影响气体交换肺关质病变的因素,也就是说肺泡气与动脉血的氧分压差(PA-aO2)在正常范围,一般为0.4~0.7kPa(3~5mmHg),均在1.33kPa(10mmHg)以内。所以当PaCO2为9.33kPa(70mmHg)时,PAO2为7.18kPa(54mmHg),动脉血氧分压应当在6.67kPa(50mmHg)左右,也就是高碳酸血症型的呼吸衰竭。
A下降引起,不存在影响气体交换肺关质病变的因素,也就是说肺泡气与动脉血的氧分压差(PA-aO2)在正常范围,一般为0.4~0.7kPa(3~5mmHg),均在1.33kPa(10mmHg)以内。所以当PaCO2为9.33kPa(70mmHg)时,PAO2为7.18kPa(54mmHg),动脉血氧分压应当在6.67kPa(50mmHg)左右,也就是高碳酸血症型的呼吸衰竭。
又如当测得的PaO2的下降明显超过理论上因肺泡通气不足所引起的结果时,譬如上述患者实测得PaO2为4.0kPa(30mmHg),则应考虑存着除肺泡通气不足以外的其他病理生理学变化。在实际临床工作中,单纯因肺泡通气不足引起呼吸衰竭不多见。
(二)通气/血流灌流(![]() /
/![]() )失调 是引起低氧血症最常见的病理生理学改变,是因肺内通气与血流灌注不均所决定(参见第3章)。经West JB等人滴注6种不同可溶性气体,然后测定呼出气与血液中的浓度,显示了正常人不同体质、不同年龄
)失调 是引起低氧血症最常见的病理生理学改变,是因肺内通气与血流灌注不均所决定(参见第3章)。经West JB等人滴注6种不同可溶性气体,然后测定呼出气与血液中的浓度,显示了正常人不同体质、不同年龄![]() /
/![]() 的不同表现,也在某些肺部疾病患者中证实了
的不同表现,也在某些肺部疾病患者中证实了![]() /
/![]() 失调的存在(图23-1)。
失调的存在(图23-1)。
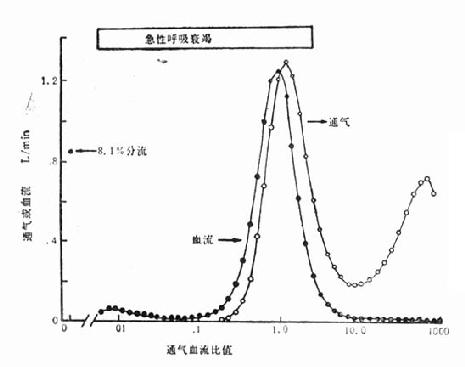
图23-1 通气/血流灌注失调
图23-2 提高吸入氧浓度不能纠正因通气/血流比例失调所致低氧血症
(三)肺内分流量增加 在某些疾病引起的呼吸衰竭如肺水肿、成人呼吸窘迫综合征(ARDS)中,![]() s的增加是构成低氧血症的主要因素。
s的增加是构成低氧血症的主要因素。
![]() s/
s/![]() T增加与
T增加与![]() /
/![]() 失调引起的低氧血症有些不同特点。QS/QT增加时PaO2可明显降低,但不伴有PaCO2的升高,甚至因过度通气反而降低,等到病程晚期二氧化碳蓄积方始出现。另外用提高吸入氧气浓度的办法(氧疗)不能有效地纠正此种低氧血症(图23-2)。
失调引起的低氧血症有些不同特点。QS/QT增加时PaO2可明显降低,但不伴有PaCO2的升高,甚至因过度通气反而降低,等到病程晚期二氧化碳蓄积方始出现。另外用提高吸入氧气浓度的办法(氧疗)不能有效地纠正此种低氧血症(图23-2)。
(四)弥散功能障碍 已如前述,由于人体弥散功能的储备巨大,虽是发生呼吸衰竭病生理改变的原因之一,但常需与其他三种主要的病理生理学变化同时发生,参与作用使低氧血症出现。
总之,不同的疾病发生呼吸衰竭的途径不全相同,经常是一种以上的病理生理学改变的综合作用。
二、急性呼吸衰竭的病因
可以引起低氧血症和高碳酸血症的疾病很多,多数是呼吸系统的疾患,但也常因肺外其他系统疾病引起。
(一)各种导致气道阻塞的疾病 急性病毒或细菌性感染,或烧伤等物理化学性因子所引起的粘膜充血、水肿,造成上气道(指隆突以上至鼻的呼吸道)急性梗阻。导物阻塞也是一项可以引起急性呼吸衰竭的原因。
(二)引起肺实质浸润的疾患 感染性因子引起的肺炎是此类病中主要疾患。误吸胃内容物,淹溺或化学毒性物质以及某些药物也可引起严重肺实质炎症而发生急性呼吸衰竭。
(三)肺水肿 ①各种严重心脏病、心力衰竭引起的心源性肺水肿。②非心源性肺水肿,有人称之为通透性肺水肿(permeability pulmonaryedema),如急性高山病,复张性肺水肿。成人呼吸窘迫综合征(ARDS)为此种肺水肿的代表。此类疾病可造成严重低氧血症。
(四)肺血管疾患 肺血栓栓塞是可引起急性呼吸衰竭的一种重要病因。
(五)胸壁胸膜疾患 如胸壁外伤、自发性气胸或创伤性气胸、大量胸腔积液等均有可能引起急性呼吸衰竭。
(六)神经肌肉系统疾患 即便司气体交换的肺本身并无病变,因神经或肌肉系统疾病造成肺泡通气不足也可发生呼吸衰竭。如安眠药物或一氧化碳中毒,呼吸中枢抑制。或颅脑损伤、脑炎、脊髓外伤使呼吸肌麻痹或呼吸衰竭。也可因多发性神经炎、脊髓灰白质炎等周围神经性病变,或因多发生肌炎、重症肌无力等肌肉系统疾病,造成肺泡通气不足而呼吸衰竭。
三、急性呼吸衰竭的临床表现
因低氧血症和高碳酸血症所引起的症状和体征是急性呼吸衰竭时最主要的临床表现。由于造成呼吸衰竭的基础病因不同,各种基础疾病的临床表现自然十分重要,需要注意。
(一)低氧血症 神经与心肌组织对缺氧均十分敏感,低氧血症时常出现中枢神经系统和心血管系统功能异常的临床征象。如判断力障碍、运动功能失常、烦躁不安等中枢神经系统症状。缺氧严重时,可表现为谵妄,癫痫样抽搐,意志丧失以致昏迷、死亡。在心、血管方面常表现为心率增快、血压升高。缺氧严重时则可出现各种类型的心律紊乱,进而心率变缓,周围循环衰竭,四肢厥冷,甚至心脏停搏。
肺泡缺氧时,肺血管收缩,肺动脉压升高,使肺循环阻力增加,右心负荷增加,乃是低氧血症时血流动力学的一项重要变化。
缺氧患者的呼吸系统表现也是一项重要的临床征象。患者表现为呼吸困难,呼吸频率可增速,鼻翼煽动,辅助呼吸肌肉运动增强,呼吸节律紊乱,失去正常规则的节律。缺氧严重,中枢神经和心血管系统功能严重障碍时,呼吸可变浅、变慢,以至呼吸停止。
当PaO2低于6.67kPa(50mmHg)时,患者口唇粘膜、甲床部位出现紫绀。但因患者血红蛋白含量、皮肤色素和心功能状态等因素影响以及受观察者鉴定能力的限制,紫绀虽是一项可靠的低氧血症的体征但不够敏感。
(二)高碳酸血症 由于急性呼吸衰竭时,二氧化碳的蓄积不但程度严重而且发生时间短促,因此产生严重的中枢神经系统和心血管功能障碍。临床表现为头痛,反应迟钝,嗜睡,以至神志不清,昏迷。扑翼样震颤也是二氧化碳蓄积的一项体征。二氧化碳蓄积引起的心血管系统的临床表现因血管扩张或收缩程度而异。如多汗,球结膜充血水肿,颈静脉充盈,周围血压下降等。
(三)其他重要脏器的功能障碍 严重的缺氧和二氧化碳蓄积可以影响或加重肝、肾或胃肠功能障碍。临床上将出现黄疸、肝功能异常;尿中可出现蛋白、血细胞或管型,血液中尿素氮、肝酐含量增高;也可能出现呕血、黑便等由应激性溃疡造成的消化道出血等。
实际上,急性呼吸衰竭常与其他重要脏器的功能同时或先后出现,近来乃有多脏器功能衰竭(MOF)的概念出现,并引起临床工作者尤其是从事急救医学工作者的重视。
(四)引起呼吸衰竭基础疾患的临床症状与体征 这些基础疾患的特征常与上述低氧血症和高碳酸血症的临床表现同时并存。如感染时的畏寒、高热,肺炎时的咳嗽、胸痛等。应当及时辨认,以便采取针对性的治疗措施。
(五)水、电解质和酸碱平衡的失调 因严重低氧血症和高碳酸血症几乎均伴随着酸碱状态的失常。如缺氧而通气过度可发生急性呼吸性碱中毒;急性二氧化碳潴留可表现为呼吸性酸中毒。严重缺氧时无氧代谢引起乳酸堆积,肾脏功能障碍使酸性物质不能排出体外,二者均可导致代谢性酸中毒。代谢性和呼吸性酸碱失衡又可同时存在,表现为混合性酸碱失衡(参见第7章)。
与酸碱平衡失调的同时,将会发生体液和电解质的代谢障碍。在诊断和处理急性呼吸衰竭时均应予以足够的重视。
四、急性呼吸衰竭的诊断
一般说来,对存在着可能发生急性呼吸衰竭基础病因的患者,如胸部外伤或手术后、严重肺部感染或重症革兰阴性杆菌败血症患者等,当密切注意其呼吸、循环和中枢神经系统的表现,及时做出呼吸衰竭的诊断是可能的。但对某些急性呼吸衰竭早期的患者或低氧血症、二氧化碳蓄积程度不十分严重时,单依据上述临床表现做出诊断有一定困难。动脉血气分析的结果直接提供动脉血氧和二氧化碳分压水平,可作为诊断呼吸衰竭的直接依据。因此,不能否认血气分析在呼吸衰竭诊断上的重要地位。
应当强调的是不但要诊断呼吸衰竭的存在与否,尚需要判断呼吸衰竭的性质,是急性呼吸衰竭还是慢性呼吸衰竭基础上的急性加重,更应当判别产生呼吸衰竭的病理生理学过程,明确为Ⅰ型或Ⅱ型呼吸衰竭,以利采取恰当的抢救措施。
在诊断和紧急处置的过程中,应当尽快鉴定产生呼吸衰竭的基础病因,否则有可能患者经氧疗或机械通气后因得到足够的通气量维持氧和二氧化碳分压在相对正常的水平,若基础病因未被发现与去除,仍不能脱离再次发生呼吸衰竭的威胁。
五、急性呼吸衰竭的处理
急性呼吸衰竭是需要急抢救的急症。对它的处理要求迅速、果断。数小时或更短时间的犹豫、观望或拖延,可以造成脑、肾、心、肝等重要脏器因严重缺氧发生不可逆性的损害。同时,及时、合宜的抢救和处置才有可能为去除或治疗诱发呼吸衰竭的基础病因争取到必要的时间。
(一)保证呼吸道通畅 通畅的呼吸道是进行各种呼吸支持治疗的必要条件。在重症急性呼吸衰竭尤其是意识不清的患者,咽部肌肉失去正常的肌肉张力,软组织松弛。舌根后倒均可阻塞上呼吸道(上气道系指自气管隆突以上的呼吸道包括鼻、咽、喉、正气管)。呼吸道粘膜水肿、充血、痰液壅滞,以及胃内容物误吸或异物吸入都可以成为急性呼衰的原因或使呼衰加重。保证呼吸道的畅通才能保证正常通气,所以是急性呼吸衰竭处理的第一步。
1.正确的体位 立即使患者头部取侧卧位,颈部后仰,抬起下颌。此种体位可以解除部分患者上气道的梗阻。
2.有效的气管内负压吸引 以负压吸引清除堵塞于呼吸道内的分泌物,血液或误吸的呕吐物,淹溺时的淡、海水等,有时即可立即解除梗阻,改善通气。
无论是直接吸引或是经人工气道(见下节)吸引均需注意操作技术。尽量避免损伤气管粘膜,在气道内一次负压吸引时间不宜超过10~15s,以免引起低氧血症、心律紊乱或肺不张等因负压吸引造成的合并症。
吸引前短时间给病人吸高浓度氧,吸引管不要太粗,吸引后立即重新通气。操作者的无菌技术,和每次吸引时均换用新灭菌后的吸引管,或者使用一次性吸引管等是防止发生下呼吸道感染的措施。
3.建立人工气道 当以上两种措施仍不能使呼吸道通畅时,则需建立人工气道。所谓人工气道就是用一导管直接插入气管,于是吸入气就不经鼻咽等上气道直接抵达下气道和肺泡。为了解除上气道的梗阻,保护无正常咽喉反射患者不致误吸,为了充分有效的气管内吸引或为了提供机械通气时必要的通道等目的乃建立人工气道。其方法或将鼻咽导管由口放入可使后倒的舌根不再堵塞气道,但因导管远端恰位于咽部可引起咽反射而恶心、呕吐甚至误吸。除意识不清患者一般均不能耐受,因此不宜久用。并且此种鼻咽管不能用以进行机械通气,临床上常用的人工气道为气管插管和气管造口术后置入气管导管两种。
气管插管有经口和经鼻插管两种。前者藉喉镜直视下经声门插入气管,容易成功,较为安全。后者分盲插或借喉镜、纤维支气管镜等的帮助,经鼻沿后鼻道插入气管。与经口插管比较需要一定的技巧,但经鼻插管容易固定,负压吸引较为满意,与机械通气等装置衔接比较可靠,给患者带来的不适也较经口者轻,神志清醒患者常也能耐受。唯需注意勿压伤鼻翼组织或堵塞咽鼓管、鼻窦开口等,造成急性中耳炎或鼻窦炎等合并症。
当有经验的耳鼻喉科或外科医师从容不迫操作时,气管造口术引起合并症的发生率可以很低。但实际上由于病情或其他条件的限制,手术死亡率达0.9%~5.1%。即时合并症有出血、气胸、空气栓塞、皮下及纵隔气肿等。24~48h后的后期并发症有感染、出血等。气管狭窄则是晚期并发症。与气管插管相比,经气管造口置入气管导管这种人工气道完全不通过鼻或咽部等上气道,固定最为稳定为靠,患者的耐受最好。因此,估计患者病情短期内不会被纠正,需要人工气道时间较久者可采用此种方法。
近年来已有许多组织相容性较理想的高分子材料制成的导管与插管,为密封气道用的气囊也有低压、大容量的气囊问世,鼻插管可保留的时间也在延长。具体对人工气道方法的选择,各单位常有不同意见,应当根据病情的需要,手术医生和护理条件的可能,以及人工气道的材料性能来考虑。肯定在3日(72h)以内可以拔管时,应选用鼻或口插管,需要超过3周(21天)时当行气管造口置入气管导管,3~21日之间的情况则当酌情灵活掌握。
使用人工气道后,气道的正常防御机制被破坏,细菌可直接进入下呼吸道;声门由于插管或因气流根本不通过声门而影响咳嗽动作的完成,不能正常排痰,必须依赖气管负压吸引来清除气道内的分泌物;由于不能发音,失去语言交通的功能,影响患者的心理精神状态;再加上人工气道本身存在着可能发生的并发症。因此人工气道的建立常是抢救急性呼吸衰竭所不可少的,但必须充分认识其弊端,慎重选择,尽力避免可能的并发症,及时撤管。
4.气道湿化 无论是经过患者自身气道或通过人工气道进行氧化治疗或机械通气,均必须充分注意到呼吸道粘膜的湿化。因为过分干燥的气体长期吸入将损伤呼吸道上皮细胞和支气管表面的粘液层,使痰液不易排出,细菌容易侵入,容易发生呼吸道或肺部感染。
保证患者足够液体摄入是保持呼吸道湿化最有效的措施。目前已有多种提供气道湿化用的温化器或雾化器装置,可以直接使用或与机械通气机连接应用。
湿化是否充分最好的标志,就是观察痰液是否容易咳出或吸出。应用温化装置后应当记录每日通过湿化器消耗的液体量,以免湿化过量。
(二)氧气治疗 简称氧疗,是纠正低氧血症的一种有效措施。由于氧气也是一种治疗用药,使用时应当选择适宜的给药方法,了解机体对氧的摄取与代谢以及它在体内的分布,注意氧可能产生的毒性作用。
由于高浓度(>21%)氧的吸入可以使肺泡气氧分压提高。若因PAO2降低造成低氧血症或主因![]() /
/![]() 失调引起的PaO2下降,氧疗可以改善。氧疗可以治疗低氧血症,降低呼吸功和减少心血管系统低氧血症。
失调引起的PaO2下降,氧疗可以改善。氧疗可以治疗低氧血症,降低呼吸功和减少心血管系统低氧血症。
氧疗的设备、方法,注意事项等请参阅第27章。
(三)机械通气 近20余年来,随着敏感的传感器和专用的微处理机及微电脑等高技术的推广,使机械通气机性能日益完善,再加对呼吸生理学认识和深入和血液气体分析技术的应用,使呼吸衰竭的治疗效果显著提高,也是急诊医学领域中一项重要进展。
1.机械通气的目的 保证适合患者代谢所需的肺泡通气量和纠正低氧血症及改善氧运送是机械通气机(此名较人工呼吸器更恰当,故在本文中均用机械通气机一名)的主要用途。
2.通气机的类型 过去曾被临床应用的负压通气机(铁肺)已很少使用。目前应用最为广泛的通气机属于气道正压通气机类型。它又因机器开始送气进入吸气相的方法,提供送气气源方式和使吸气相终结的方法各异而有不同类型。习惯上,以吸气相终止的方法来区分比较容易理解,也就是可分为容量转换型、压力转换型、时间转换型和流量转换型等。当一事先预置的吸入气潮气量送入机体时,吸气相终止,机器立即转入呼气相,此种通气机即称为容量转换型通气机。若按预置压力转换吸气相,或按预置时间、预置流量转换者即相应称为压力、时间或流量转换型。现在设计师们更将容量、时间、压力等条件按要求结合起来设计出更新类型的通气机。
晚近10余年来,又出现了一种高频通气机,包括高频喷射通气、高频正压通气和高频震动三种,机器设置、通气原理和机体反应都和习惯常用的正压通气不同,尚待进一步观察与研究,方可评价它的实用意义和价值。
3.通气型式 虽然通气机类型不同,通气型式基本上不外以下几种(图27-1)。
(1)控制或控制/辅助通气(CMV、AMV):通气机控制患者的呼吸频率、潮气量或每分钟通气量,呼吸时比也由通气机设定,以上参数不受患者的动力或反应所变动,此即为控制式通气(CMV)。通气频率越慢(如少于12次/min),气道内均压较低,对静脉回流影响也少。潮气量决定着吸入气的肺内分布和肺泡通气量,也就是决定着二氧化碳的排出。医师们通过通气机控制着患者的有效通气量、呼吸时比、呼吸频率,也就是掌握着患者的通气型式。
当患者的自发呼吸,产生一基线以下的吸气压力(触发压力),通气机即按医师设置的要求开始吸气相,一旦患者自发的呼吸频率过低或不能产生足够的吸气负压,机器自动进入控制式通气,此即为控制/辅助式通气(CMV/AMV)。
(2)间歇指令通气(IMV)和同步间歇指令通气(SIMV):采用此种通气方式时,患者一方面接受通气机按预定时间间隔给予的间歇正压通气,一方面患者自己可以通过通气机管路进行自发呼吸,与通气机气流并不发生阻抗,而所吸入的气体是经通气机提供的经适宜温化、湿化和饱含氧气的气体,此为间歇指令通气(IMV)。通气机按需给以间断通气,为达到此目的,在通气机的管路中需设有持续气流系统。
当患者一方面可以通过通气机自发呼吸,不与通气机的间歇正压通气发生阻抗,而且预置的由通气机提供的正压送气均与患者的自发吸气相同步,即为同步间歇指令通气(SIMV)。这需要在通路中设有按需找开的活瓣,保证按需气流系统才能完成。与持续气流系统相较,患者所需承受或进行的呼吸功较大,以致有的患者在病情的一定时期不能接受SIMV通气方式。
(3)呼气末正压通气(PEEP)和持续气道内正压通气(CPAP):通气机呼出管路增有设施,使呼气期末保持高于大气压力。当患者自发呼吸,通过装置使呼气末处于正压,此时吸气期气道内也同时为正压,于是整个呼吸周期气道内均为正压通气。
PEEP的通气方式在抢救呼吸衰竭中已为临床广泛接受,尤其是在抢救成人呼吸窘迫综合征患者时,因其确能提高患者已经十分降低的功能残气量,使肺内分流量得以降低,部分病人可以吸入低于60%浓度的氧气就可以提高PaO2到能维持组织氧合代谢的需要而得以存活。至于呼气末正压以多少为合适,也就是最佳PEEP,就要兼顾动脉血氧分压和PEEP对血流动力学的干扰及气压伤等几个方面来考虑了。
4.全部呼吸支持(FVS)与部分呼吸支持(PVS)CMV或AMV等均为由通气机提供了患者通气所需的能量,患者不用再作任何呼吸功。IMV和SIMV最初应用于临床时曾只做为一种撤离通气机的方式,近年来有学者认为只有IMV和SIMV两种通气型式可以由通气机补足患者自己进行通气作功不足时所需的能量,也就是后两种通气型式具有部分通气支持的特点。PVS具有FVS所不具备的优越性,更符合于生理状态。这些新概念的提出值得在日后工作中进一步观察与验证。
绝大部分患者在呼吸衰竭的最初几个小时,全部呼吸支持(FVS)可使病情迅速稳定,提供进行病因、病情诊断的足够时间,和得以确定合适的治疗方案。一旦获得足够生理学数据的佐证,当患者已能耐受部分通气支时(PVS)时,则宜尽早有计划、逐步地降低通气机提供正压通气的频率,进入PVS。下一步就是判断撤退通气机的时机。
5.使用通气机的适应证和撤机 当患者呼吸骤停,或发生急性通气性呼吸衰竭,二氧化碳急骤升高,严重低氧血症,经过一般给氧治疗仍不能纠正等均应视为机械通气的绝对适应证。当各种原因使患者需要依靠通气支持以减轻心、肺功能、纠正已经发生或即将发生的呼吸衰竭,也具有应用通气机的指征。不但要了解诱发呼吸衰竭的原因疾病,同时更需了解该种疾病影响呼吸病理生理的严重程度,才能据之作出是否应当使用通气机的判断。不同的参考书籍列举出许多具体肺功能参数作为用应用通气机的指标,诸如肺活量低于15ml/kg,呼吸频率超过35次/min,最大吸气峰压低于-1.96kPa(-20cmH2O),以及PaCO2、PaO2、pH等最高或最低限度等等。实际上,这些具体数据均不能作为绝对性依据,必需结合患者的具体病情来考虑,有时甚至不得不考虑到医疗、护理、监护力量等因素才能使通气机的应用合理。
撤机同样应当选择合宜时机。尽早撤机已是公认的原则,但撤机的最佳时机不由医、患者主观意愿决定,应当根据诱发患者发生呼吸衰竭的原因是否得到适当控制,心肺功能和呼吸肌肌力是否恢复到能够支持代谢所需等作出科学客观的判断。一般认为当肺活量恢复到10~15ml/kg,吸气压达到-1.96kPa(-20cmH2O),在吸入气氧分数(FiO2)小于0.4时PaO2能超过8.0kPa(60mmHg),PaCO2低于6.67kPa(50mmHg)即达到撤机条件。同样,绝对数值仍为参考依据,患者的个体性必需重视,而患者的信心,医护人员的经验,医、患间的密切配合也是很重要的。
撤机可通过上述IMV通气型式合用T形管技术达到,患者通过T形管呼吸,同时逐渐延长停用呼吸机时间,最后完全撤机。撤机过程是一有计划、需密切观察的过程。一旦出现需要重新连机的征象则应及时恢复。一般使用通气机时间越久,撤机中遇到困难可能会越多。
6.使用通气机的并发症 通气机均需通过人工气道连接,因此人工气道的并发症亦为使用通气机过程中可能发生的合并症。此外,气压伤和循环系统血流动力学的影响是通气机使用中应注意防止的两项重要合并症。
当气道内压过高时,可引起气胸、纵隔气肿等气压伤。胸腔内压过高,影响回心血量,干扰心室顺应性,使心排血量降低,均可增加已经十分危重的患者的病情。在应用较大潮气量行CMV或较高PEEP时必需小心观察与防止。
7.使用通气机时的床边监测 除必要的血流动力学参数外,通气机是否按计划正常运转,患者气道内压力变化,肺及总顺应性改变,气道阻力等机械力学方面的变化也应做为监测内容。定时血气分析的数据,或通过经皮电极连续监测得到的氧和二氧化碳分压等数据,可作为气体交换的指标,都是不可缺少的监测项目。最为直观重要的依然是患者血压、脉搏、一般状况、神志状态、呼吸型式等。
总之,机械通气在呼吸衰竭治疗中的应用,提高了呼吸衰竭抢救的成功率。另一方面,也提高了呼吸衰竭危重患者对医护条件的要求。
(四)心血管系统功能的监测与改善 低氧血症和二氧化碳潴留本身会影响心脏功能,常与呼吸衰竭并存的心血管疾患也将增加呼吸衰竭治疗的困难。在治疗急性呼吸衰竭过程中,应当注意观察各项心血管系统功能的指标。如有条件,对危重患者应采用漂浮导管了解心排血量、右心室压力、肺动脉压力、肺毛细血管楔压和肺循环阻力,并可直接测定混合静脉血氧和二氧化碳浓度。
经氧疗或机械通气后,低氧血症仍不能纠正时,可用以上数据分析除呼吸功能障碍以外是否还存在着心功能不全、心排血量不足。混合静脉血氧分压(PVO2)可提供组织供氧状况,帮助了解氧运送的状况。
如此可以更适宜地调整通气机的各项指标,必要时也当配合给予强心、利尿剂。
(五)肾、脑、肝功能和水电解质,酸碱平衡的维持 脑水肿的预防与治疗,肾血流量的维持以及肝功能和各种电解质、酸碱平衡的维持都是不可忽视的重要环节。
(六)病因治疗 引起急性呼吸衰竭的病因很多,治疗各异。例如重症肺炎时抗生素的应用,哮喘持续状态时支气管解痉剂和肾上腺皮质激素的合理使用,均各具特殊性。需强调指出,必需充分重视治疗和去除诱发急性呼吸衰竭的基础病因。
第二节 成人呼吸窘迫综合征(ARDS)
成人呼吸窘迫综合征,以下简称ARDS,是急性呼吸衰竭的一种,由于它的发病率较高且病死率一直高达50%左右而受到人们的重视。从1967年美Ashbaugh等首次提出此名称,20年来围绕此病征开展了大量的临床和实验室研究,至今仍未能阐清它的发病机制,在急诊医学中亦占有重要位置。
一、简史
早在40年代就有关于“创伤后湿肺”的报道,描述在严重创伤后发生的急性呼吸衰竭;1950年又有作者以“充血性肺不张”的名称诊断类似病征;60年代以来,由于创伤和失血性休克等治疗条件的改善,急性呼吸衰竭的重要性渐又突出,“休克肺”的诊治问题再次被重视。至1967年美Ashbaugh等人首次报道平民创伤后的急性呼吸衰竭,提出临床表现与新生儿呼吸窘迫综合征颇多相似之处,当时认为表现活性物质代谢和功能失常是病征的主要病因,提出了成人呼吸窘迫综合征(ARDS)这一名称。经历了20年发病机制方面的研究,虽然已知表面活性物质的失常在此病征中的作用与新生儿呼吸窘迫综合征中并不相同,但ARDS这一病名已为较多学者所接受,取代了众多各种类似的名称。
ARDS指的是一组严重的临床综合征,其特征是进行性加重的呼吸困难,一般常用的给氧方法难以纠正的低氧血症,X线胸片示双肺弥漫性浸润阴影。可引起本病征的病因很多,患病率较高,1976年美国约有150000名患者,1982年美费城某医学中心本病占该院危重住院患者的5%,在美克拉雷多州三个医院的本病征高危因素患者(指休克、败血症、外伤等)993人中发现ARDS 88例。国内虽无准确发病率的调查报告,但有关本病征较大数目的病例报道日多。而病死率虽经20年的努力仍高达50%左右,故一般均认为它是重危患者致命的重要病因。
二、ARDS的病因
多种致病因子或直接作用于肺,或作用于远离肺的组织,造成肺组织的急性损伤引起相同的临床征候。
(一)直接作用于肺的致病原因 如创伤、误吸、毒物吸入、各种病原体引起的严重肺部感染和放射性损伤等。
(二)间接原因 如败血症、休克、肺外创伤、药物中毒、输血、坏死性胰腺炎、体外循环等。
三、ARDS的病理形态学和病理生理学改变
ARDS的组织形态学改变可分为三期。渗出期(于发病后24~96h)特点是间质和肺泡内水肿、毛细血管充血,间质内红、白细胞浸润。Ⅰ型肺泡上皮细胞呈不同程度退行性变,甚至坏死脱落,裸露出基底膜。于严重上皮细胞损伤处,特别在呼吸性细支气管和肺泡管处可见到透明膜形成。血管内皮细胞变化相对较轻。微血管中常见到由白细胞、血小板、纤维蛋白形成的微血栓。病变严重处呈现出血坏死区。增生期(发病第3~10天)Ⅱ型肺泡上皮细胞增生,覆盖肺泡表面,间质因白细胞、成纤维细胞浸润和纤维组织增生而变厚,毛细血管减少,肺泡塌陷。纤维化期(自发病第7~10天开始)特点为肺泡间隔和透明膜处纤维组织沉积和纤维化,并渐发展至全肺。
急性期肺组织外观充血、水肿、出血、实变。因此,病理形态学的表现并无特异性,实际上反映了严重广泛的肺组织损伤的共同性变化。
由于本病征最关键性的变化是肺泡上皮和血管内皮细胞受损,使肺泡毛细血管膜通透性增加,蛋白含量高的水肿液渗漏入肺泡间隔和肺泡腔内。于是肺的顺应性下降,肺变硬。同时Ⅱ型肺泡上皮细胞损伤,肺泡表面活性物质生成障碍,使肺泡表面张力降低,肺泡变得不稳定,容易塌陷,产生微小肺不张,肺顺应性进一步下降,以致功能残气量下降,肺弹性回力增加,肺组织更易萎陷。此时,存在大面积的低/![]() 区,肺内分流量显著增加,出现严重的低氧血症。如前所述,此种呼吸衰竭用提高吸入气氧浓度的措施不能纠正,严重时,传统的间歇正压通气方式(CMV)也不能改善。
区,肺内分流量显著增加,出现严重的低氧血症。如前所述,此种呼吸衰竭用提高吸入气氧浓度的措施不能纠正,严重时,传统的间歇正压通气方式(CMV)也不能改善。
四、ARDS的临床表现
(一)起病 一般多在原发致病因子(如休克、创伤等)发生后,经过一短暂的相对稳定期(也被称为潜伏期,约24~48h)出现下述呼吸困难等症状,但也有时起病急骤、迅即出现严重呼吸衰竭者(即暴发型),也有时起病较缓渐者。潜伏期发生的原因可能与表面活性物质的代谢或与白细胞的动员有关。
(二)临床特征 患者表现严重的呼吸困难,呼吸频率增速可达30~50次/min。鼻翼煽动,辅助呼吸肌运动增强。口唇、甲床明显紫绀。肺部体征常不如症状明显,呼吸音增强,有时可闻及哮鸣音或少量湿性啰音。胸部X线早期只表现纹理增深,常迅速出现以侧弥漫性浸润性阴影。
呼吸功能检查可发现每分钟通气量明显增加,可超过20L/min。肺静态总顺应性可降至153~408ml/kPa(15~40ml/cmH2O)。功能残气量显著下降。
动脉血氧分压降低,吸入气氧浓度大于50%(FiO2>0.5)时,PaO2仍低于8.0kPa(60mmHg),PaCO2可正常或降低,至疾病晚期方增高。PA-aO2显著增加,当FiO2=1.0时,PaO2低于46.7kPa(350mmHg)。计算QS/QT常超过30%,或PaO2/PAO2≤0.2。
以漂浮导管进行血流动力学监测时,肺毛细血管楔压(PCWP)≤2.13kPa(160mmHg)是一项重要诊断指标,但当合并左心功能不全或应用呼气末正压通气(PEEP)治疗时,应当注意它们对PCWP测量结果的影响。
五、诊断
目前各临床单位对ARDS的诊断标准虽不尽相同,一般不外从以下诸方面考虑:即严重的低氧血症需依赖机械通气的支持,胸片示双肺弥漫性浸润性阴影,静态肺顺应性≤510kPa(50ml/cmH2O),PaO2/PAO2≤0.2和PCWP≤2.13kPa(16mmHg)。当患者能够满足以上指标时虽能得到较肯定的诊断,但病情均已发展到重笃阶段,病死率甚高。即使近十几年来随着机械通气方式的改进,ARDS患者藉机械通气的帮助,虽有时能使PaO2保持在6.67kPa(50mmHg)以上,可保证必要的氧合功能,但仍常因心血管、肾、脑或肝等脏器同时或相继出现功能衰竭而最终归于不治。加以最近有些学者提出多系统器官衰竭(MSOF或MOF)的概念,认为MSOF与ARDS具有共同的病理生理学变化,肺常是第一个出现衰竭的器官。因此对临床工作者提出早期诊断的要求,以便及时诊治,提高ARDS或MSCF的存活率。事实上,已有学者对存在发生ARDS高危因素的患者如重症肺炎、感染中毒性休克病人中进行前瞻性监测,及时检出ARDS患者,以期改善本病征的预后。但仍然需要寻找—可靠、为临床实用的早期诊断指标,这一要求的实现有赖于对ARDS发病机制的继续深入研究,一旦了解肺泡毛细血管膜通透性改变的机制,有可能寻求到早期诊断的指标,同时也就有可能有针对性地提高治疗效果。
目前,对肺灌洗液的临床测定,某些物质如血管紧张素转换酶,纤维连接蛋白,人白细胞弹性蛋白酶,纤维蛋白降解产物碎片等测定的观察,均是在寻找能够作为早期诊断的标帜物,迄今尚未有理想的发现,仍是临床研究工作者继续努力的目标。
六、ARDS的发病机制
虽然公认肺泡毛细血管膜通透性改变,形成非心源性肺水肿是本病征发病的中心。但究竟如何产生通透性改变,由哪些环节介导发生此变化等问题,虽经大量实验室和临床研究仍未阐明。多数学者接受的假说是中性多形核白细胞(PMN)最可能是主要负责的、介导细胞。
(一)白细胞及其发生损伤的机制 在ARDS患者肺内,支气管肺泡灌洗液中均发现有较多PMN隔离或存在;在实验动物中若以内毒素或其他各种微栓造成肺泡毛细血管膜通透性增加时均可见到周围血中PMN一过性减少,而肺内有大量PMN隔离在微血管中;若以去除白细胞动物进行类似实验时,肺水肿较轻;离体培养的内皮细胞也显示白细胞对它的损伤作用,均支持PMN可能是介导肺损伤的主要介导细胞。白细胞释放氧自由基和弹性蛋白酶可以起破坏作用,损伤肺组织。白细胞中其他物质如前列腺素类物质,以及白细胞和其他炎性细胞间相互作用也可能与产生肺损伤有关。
但白细胞减少的患者仍可发生ARDS,在人体中直接说明白细胞损伤的证据还不够充分。目前一方面均肯定PMN在ARDS发病中可能存在的重要作用,但也有可能它不是唯一的介导细胞,对巨噬细胞、淋巴细胞的作用也在研究之中。
(二)血小板、血液凝集和纤维蛋白溶解在发病中的作用 ARDS患者的肺微血管中常发现血小板凝集与微栓存在;弥散性血管内凝血(DIC)患者是发生ARDS的高危因素;急性呼吸衰竭患者经血管造影可见肺血管中有血栓栓塞发生;实验动物中纤维蛋白、纤维降解产物(FDP)都是形成肺泡毛细血管膜损伤的必要条件,以纤维蛋白裂解产物碎片D输入家兔中,动物出现呼吸困难,PaO2下降;血小板激活因子(PAF)又有使PMN在肺内隔离的作用。
凝血与纤溶在ARDS发病过程中的作用是十分值得重视的。
(三)前列腺素和其他生物活性物质的作用 肺也是产生、灭活前列腺素类物质的场所。在实验动物因内毒素诱发的肺损伤中,已证实早期肺动脉高压期有TXA2和PGI2的升高。对含蛋白水肿液在肺泡内,间质中渗漏认为与脂氧化酶代谢产物白三烯类物质(LTCLTD)等有关。
七、治疗
1986年以来已有临床上以PGE1治疗ARDS得到效果的报道。至于其他生物活性物质如血管紧张素转换酶、纤维连结蛋白、调节肽类物质的研究均在进行中。
由于ARDS的发病学仍未阐明,无论在诊断或治疗上都存在相当困难。目前对ARDS的治疗基本上属于支持疗法,尽力维持必要的氧合功能,和保证足够的心排血量以维持脑、肾、肝等脏器的功能。
(一)机械通气 合理、适时的应用机械通气,可能是使ARDS由早期严重病死率降至目前50%左右的主要原因之一。若间歇正压通气仍不能使PaO2维持在6.67kPa(50mmHg)以上时,则应采用呼气末正压通气(PEEP)。在密切观察下,调整呼气末正压至最佳PEEP即能使QS/QT降至最小,心排出量最大,PaO2维持在最佳时的最低呼气末压。使用PEEP时要注意观察气道内压力,及心排血量,以减少气压伤和影响回心血量的不利作用。
(二)体液控制 由于输入液体不当时,可继续渗漏入肺间质而使肺水肿加重,故一般均采取严格观察液体的出入量,使之控制在尽力减少输入量,以使肺血管内液量尽可能最小,但同时需保证足够的左室充盈以维持心排血量。在有条件单位则可用漂浮导管取得必要的血流动力参数以指导治疗。不然,则需严格细致观察尿量作为参数。
(三)原发病的治疗 是至为重要的治疗原则。
(四)其他药物治疗 经过多中心治疗观察对大剂量皮质激素治疗基本持否定态度,认为弊多于利,应在有应用皮质激素的具体适应证情况下再应用。皮质激素对ARDS本身并无肯定的治疗效果。
应用甲氰咪呱等组胺受体拮抗剂以预防因应激性溃疡产生的消化道出血。
抗生素则视感染情况针对性使用。
若存在支气管痉挛时可使用解痉剂。
八、预后
ARDS是一预后差、病情凶恶的疾病,虽经20年努力病死率仍高达50%左右。大多数患者若存活,多不留有肺功能慢性损伤,但亦有因ARDS修复后形成间质纤维化的报道。
(朱元珏)
参考文献
[1] ZapolWM & Falke KL,Acute/Respiratory Failure 1985 Marcel Dekker Inc.,New York
[2]ATS Symposium,Summaries and Topics,ARDS Mechamism of injury and newapproach to therapy,Am Rev Respir Kis,1986;134:825
[3]Kirby RR & Taylor RW:Respiratory Failure,Year Book Med Publisher Inc.1986,Chicago
[4]朱元珏等:家兔急性肺损伤中前列腺素类物质的作用中华医学杂志,1987;67:456
