一、同位素的选择
同位素有稳定性和放射性两种。放射性同位素可利用其衰变时放出的放射线进行测量,这种测量较灵敏而方便,故多用放射性同位素。标记抗原,常用的放射性同位素有3H、14C、131I和125I等。在使用上各有其优缺点,可根据所进行的放射免疫分析的类型特点,标记物制备和供应情况以及实验室设备条件等作适当的选择(表8-1)。大多数抗原分子中都含有C、H等原子,所以用14C或3H标记不改变抗原的结构及其免疫学活性,且14C、3H半衰期长,所标记的抗原长时间放置后仍可使用,这都是其优点。14C或3H标记的不足之处是操作较繁琐,并难以获得高比放射性的标记物;3H及14C放出的都是弱β射线,需用较昂贵的液体闪烁计数器方能获得较高效率的测量,且测定操作也较麻烦。但某些抗原用放射性碘标记容易丧失免疫化学或生物学活性者,则仍以采用3H或14C标记物为佳。
表8-1 标记抗原常用的放射性同位素及其性质
| 放射性元素 | 半衰期 | 射线种类及能量(百万电子伏特) | |
| β | γ | ||
| 14C | 5720年 | 0.155 | - |
| 3H | 12.5年 | 0.0189 | - |
| 125I | 60天 | - | 0.035 |
| 131I | 8.05天 | 0.608,0.335,0.250 | 0.364,0.637,0.722 |
大多数抗原分子中是不含碘的,引入碘原子就改变了抗原的分子结构,往往容易损伤抗原的免疫化学活性;且放射性碘的半衰期较短,标记物放置后因衰变使放射性降低,因而需要经常制备标记物或要求能定期提供放射性碘标记都能适用,放射性碘放出γ—射线,用一般晶体闪烁计数器就能获得较高效率而精确的测量,测量操作也很简单。由于这些突出的优点,目前在放射免疫分析中,使用放射性碘标记物最多。
从应用角度来看,131I和125I又各有其优缺点,可根据实验的要求、仪器的条件和放射性碘制剂的规格等条件合理选用。但相对而言,125I有较多的优点,一是半衰期适中,允许标记化合物的商品化及贮存应用一段时间;二是它只发射28keV能量的X射线和35keV能量的γ射线,而无β粒子,因而辐射自分解少,标记化合物有足够的稳定性。放射性碘适用于放射免疫分析许多对象(包括蛋白质、肽类、固醇类、核酸类以及环型核苷酸衍生物等)的标记,且操作简单,一般实验室都不难做到。
二、蛋白质与多肽激素的放射性碘标记
要制备高比度、高纯度与免疫化学活性好的标记物,首先要有高纯度、良好免疫活性的抗原。用作放射标记加网免疫分析的特异性,所以若用纯度不高的抗原作标记,则标记后必须采取适当的步骤除去杂质,以获得高纯度的标记物。标记对象的纯化应尽量采用温和的方法,否则在纯化操作中已受潜在性损伤的蛋白质(这时表面上活性可能还是良好的),再经标记反应时所受的损伤,活性就会显着降低,影响以后的放射分析结果。有了好的纯抗原,还要采用适当方法加以标记,尽量获取高比放射性、而又能保持良好的特异免疫化学活性的标记物。这些都是放射免疫分析能取得高特异性和高灵敏度的关键问题。
多肽激素与蛋白质多用碘标记,最常用的是125I。碘化反应的基本过程如下:通过氧化剂的作用,使碘化物(125I-)氧化成的碘分子(125I2),再与多肽激素、蛋白质分子中的酪氨酸残基发生碘化作用。所以不管采用哪一种放射性碘标记法,标记的化合物内部必须有碘原子可结合的基团,即结构上要含有酪胺基或组织胺残基。凡蛋白质、肽类等抗原,在结构上含有上述基团的可直接用放射性碘进行标记。如不含上述基团的,放射性碘无法标记,必须在这些化合物的结构上连接上述基团后才能进行碘标记。
因此影响蛋白质、多肽碘化效率的因素,主要决定于蛋白质、多肽分子中酪氨酸残基的数量及它们在分子结构中暴露的程度;此外,碘化物的用量、反应条件(pH、温度、反应时间等)及所用氧化剂的性质等也有影响。
常用的标记方法有:
(一)氯胺T法
氯胺T法标记效率高、重复性好、试剂便宜易得,是目前使用最多的碘标记方法。
1.原理 氯氨—T(Chloramine--T)是一种温和的氧化剂,在水溶液中产生次氯酸,可使碘阴离子氧化成碘分子。这活性碘可取代肽链上酪氨酸苯环上羟基位的一个或两个氢,使之成为含有放射性碘化酪氨酸的多肽链。

2.方法 以125I—AVP的制备为例。
(1)碘化反应:AVP5μg+0.5mol/lPB50μl(pH7.5)+1251800μCi,混合后,加入新配置的Ch—t 30μg/15μl(0.05mol/l PB, pH7.5)。迅速振荡混匀,室温下反应40s。
(2)终止碘化反应:加入还原剂偏重亚硫酸钠40μg/20μl(0.05mol/l PB, pH7.5),以终止碘化反应。
(3)Bio—Gel P2层析纯化:将碘化反应混合液注入Bio—Gel P2柱,用0.1n HAC溶液洗脱,分部收集,每2min收集一管,共收集60管。
(4)放射性测量:测定各收集管的放射性,出现两个峰,第一峰为125I—AVP,第二峰为游离碘盐峰。第一个峰中计算最高的几管,留下备用。
为了解标记抗原的质量,每次碘标记后应计算出碘的利用率,标记上多少放射性碘,以及每微克抗原结合上多少放射性碘。
(5)标记抗原的贮存:经纯化与检查后的标记物、加入1/8体积的异丙醇,分成若干小份,置于铅罐中,在-20℃以下的冰箱中贮存备用,应避免反复冻融。标记抗原在贮存中是不稳定的,这是因为:一是脱碘,标记的碘从原来位置上脱落,变成游离碘;二是蛋白损伤、变性,成为聚合大分子或断键成小分子碎片。由于上述原因,使B/F明显降低,标准曲线斜率变小,以致不能使用,故需分离纯化,其方法是用SephadexG100长柱(40~80cm )过柱,洗脱后出现3个峰。第1个峰分子量大,是蛋白变性的聚合的大分子,尚保留部分抗原决定簇,免疫活性弱;第2个峰是纯抗原的蛋白峰,免疫活性好;第3个峰是游离125I或小分子碎片,不具备免疫活性。收集到的第2个纯抗原蛋白峰,免疫活性好;第3个峰是游离125I或小分子碎片,不具备免疫活性。收集到的第2个纯抗原蛋白峰,其性能类似于新鲜标记的抗原。分离纯化的方法解决了标记抗原的贮存、长期使用问题,特别对来之不易的抗原更显得重要。
2.注意事项
(1)放射性碘源的选用:无载体的131I或125I均可用于碘化标记,但应尽量选用新鲜的、比放射强度高的、含还原剂量少的放射性碘源。碘源的比放射强度最好≥50~100mCi/ml,至少也要>30mCi/ml,否则加入碘源的容量要增加,随着带入碘源中含有的还原剂(为放射性碘源运输保存所需加入)量也增加,这将会显著降低碘利用率及标记蛋白比放射强度。放置较久和放射性碘源,一方面因衰变致比放射强度降低,另一方面因水的辐射化学产物增多(主要是131I源),都会降低标记时的碘利用率。放射性碘源含还原剂(如Na2S2O5等)量多时,会抵消氯胺T的作用,降低碘利用率,甚至导致标记完全失败。放射性碘源要用无载体的,标记所用全部用具和试剂必须不含碘;只要有极少量的碘的污染,非放射性碘就会稀释放射性碘,使放射性碘利用率显著降低。为了便于放射性防护和除污染,以及减少射线对蛋白质分子的损伤,标记投入的放射碘量不宜过大,一般以<5mCi为宜。
(2)放射性碘与多肽、蛋白质用量的比例:这比例对标记结果的影响很大。如上述原因,一般标记时放射性投入量不宜过多,示踪实验室中常规每次只用1~2mCi,因而放射性碘与多肽、蛋白质用量的比值主要靠标记时投入的多肽、蛋白质用量来控制。当投入的放射碘量一定时,多肽、蛋白质用量多(即I/多肽、蛋白质比值低),能获得高碘利用率,但所得标记蛋白比放射强度低;相反多肽、蛋白质用量少(即I/多肽、蛋白质比值高),则碘利用率降低,但所得标记多肽、蛋白比放射性随此比值变化都有较大的变动;而当此比值<1后,则碘利用率再下降的幅率较小,标记多肽、蛋白比放射性也不会再增加多少。
(3)氯胺T与偏重亚硫酸钠的用量及碘化反应时间:氧化碘化标记法中,会导致失活的最主要原因是氧化还原。氯胺T是氧化剂,早期用氯胺T法作碘化标记时氯胺T用量都比较大,或碘化反应时间较长,结果导致蛋白质结构和活性的严重损伤。氯胺T用量大,或长时间进行碘化反应,结果并不能使碘利用率和标记多肽、蛋白质比放射强度提高多少,反而使标记多肽、蛋白活性下降。当用不含还原剂或还原剂很少的放射性碘源时,试以各种蛋白质(包括白蛋白、球蛋白、ACTH、胰岛素等)作微量标记,当氯胺T用量为20μg/0.1ml反应液、0~20。C反应20s,碘利用率都已接近或达到最大峰,再加大氯胺T用量和延长反应时间是没有必要的。随放射性碘源中还原剂增多,氯胺T用量也应增加,以达到预期的碘利用率,但决不应盲目加大氯胺T用量和延长碘化反应时间(通常反应时间不要超过1min),否则会导致标记多肽、蛋白质严重失活,不能用于实验。当然,减少氯胺T用量要在了解放射性碘源还原剂含量的基础上,否则碘源中还原剂量较多,双盲目减少氯胺T用量,就会使标记失败。一般用125I标记时,氯胺T用量要适当加大。加入氯胺T后必须迅速混匀,以防标记不均匀。氯胺T与偏重亚硫酸钠溶液要新配制的。
氯胺T用量减少了,Na2S2O5用量也就可以随之减少。为保证按时终止碘化反应,实验时加入Na2S2O5一般都是过量的。氯胺T用量大时,加入Na2S2O5的剩余量也就会随之增加,这就可能加重某些对还原剂敏感的蛋白质或多肽生物活性的损伤。为此,Na2S2O5用量也不应过多。只要药品没有变质、试剂是新配的,以重量计算Na2S2O5加入量与氯胺T相同就足以保证终止碘化反应(按反应克分子浓度计算,Na2S2O5/氯胺T重量比约0.4),不要盲目加大用量,并应迅速将标记多肽、蛋白质从反应液中分离出来,以尽量减少多肽、蛋白质活性的损伤。
某些蛋白质或多肽对氯胺T较敏感,还可进一步减少氯胺T用量、缩短碘化反应时间、降低反应温度,以保护蛋白质的活性。这对一些较容易丧失活性蛋白质或多肽的碘标记十分重要。
(4)碘化反应体积:系指加入Na2S2O5终止反应前液体的总量。碘化反应体积愈小,局部反应物浓度愈高,所得碘利用率和标记多肽、蛋白比放射强度就愈高。所以,标记应采用比放射标记效果。当反应液量少(<0.2~0.3ml)时,反应体积对碘利用率和标记多肽、蛋白质比放射强度的高低影响较大;当反应液量大(>0.5~1.0ml)时则影响较小。微量氯胺T法放射碘标记时,一般多控制碘化反应体积<100μl。
(5)碘化反应温度:温度升高,碘化反应速度加快,碘利用率有所增加。但总的来看,反应温度的影响不很大,一般从0℃到20℃碘利用率相差不过百分之几,故一般在室温下进行标记操作就可能获得重复性好的结果。有些蛋白质或肽类极易丧失活性,则可在0℃进行碘化反应。
(6)碘化反应的pH值:受氧化剂氧化生成的活性碘,对多肽链的酪氨酸基苯环羟基邻位的碘化作用,最适pH是7.3~7.8之间。当pH变化时,碘化位置也会发生变化,例如pH值较高时,组氧酸的咪唑环也可被碘化;当pH4~5时,活性碘能迅速氧化色氨酸基生成羟基吲哚,导致肽链断裂。这些都会影响蛋白质或多肽的放射性碘化反应,或引起降解或失活。因此作放射性碘化标记时,除放射性碘源外,所有的试剂都应用适当的缓冲液配制,保证碘化反应在最佳pH条件下进行。
(7)微量蛋白质或多肽的吸附损失:界面的吸附损失,在使用大量蛋白质或多肽类时是可以忽略的,但作微量法标记时投入的蛋白质或多肽类只在微克甚至毫克甚至毫微克水平,界面吸附导致的损失就不能忽略。例如制备131I—ACTH时,所用ACTH浓度低到50Pg/ml时,因表面吸附可损失10%~30%,甚至高达75%。改变pH、加入非特异性载体蛋白、或使用聚苯乙烯、聚乙烯容器时,能减少吸附,但不能完全消除。一般残留在反应管和滴管上的放射性为投入总放射性的2%~8%、残留在层析柱上折占5%~10%。残留量随标记蛋白比放射性强度而直线增减,残留者几乎全部都是标记蛋白。由此可见,微量蛋白质或多肽受吸附而损失的量是不容忽略的。由于微量蛋白质、多肽会被显著吸附而丢失,所以标记时投入蛋白质、多肽量过微(如<2μg)也是不适宜的,否则标记蛋白质、多肽的收回率会太低,并在计算上会造成较大的误差。
(8)不同蛋白质、多肽碘化标记的差别:由于不同的蛋白质和多肽分子中含有的酪氨酸数目不同,而且其空间结构也不相同,分子中的酪按酸残基有的容易发生碘化反应,有的就不容易碘化,因此同样条件下进行碘化标记,不同蛋白质或多肽对碘的利用率是不相同的。不同蛋白质经碘化标记后生物活性受损的情况也各不相同。例如ACTH、促性腺激素释放激素(GRH)、促黄体激素释放激素(LRH)等多肽,碘化标记后容易丧失激素活性或与受体结合的活性;而AFP及人绒毛膜促性腺激素(HCG)等的碘化标记,则较容易保存良好的免疫化学活性。
尽管不同多肽、蛋白度的碘化标记结果有所差别,但上述讨论的因素对不同多肽、蛋白质碘化标记的影响有共同的规律。掌握了这些因素,就容易成功地获得合格的标记物。
不同多肽、蛋白质的分子量大小、理化性质各不相同,放射碘化标记反应后,可根据具体情况采取不同的方法将标记蛋白质(或多肽)与未反应的游离放射性碘及受损伤的标记物分开,常用的方法有凝胶过滤、离子交换层析、吸附层析、各种电泳法等。
(二)乳过氧化物酶法(LPO)
本法反应温和,对抗原、抗体免疫活性影响小,已被广泛应用。缺点是标记率较低,一般为20~40%。
1.原理此法是利用乳过氧化物酶(Lactoperoxidase)有促进微量过氧化氢对125I-的氧化作用,生成125I+,并标记在多肽、蛋白质酪氨酸分子上。
2.方法以标记蛋白质抗原为例。
(1)反应液组成:蛋白质2~5μg溶于磷酸缓冲液10~25μl中,加入Na125i 1m Ci(10μl)、乳过氧化物酶溶液25ng(10μl)、H2O2200ng(10μl);
(2)在室温保温7min;
(3)加入H2O2200ng(10μl);
(4)过7min再加入H2O2(3μl);
(5)保温7min后,加入0.5ml、10mmol/L巯基乙醇以停止反应;
(6)10min后加入NaI载体溶液1ml ;
(7)按常规方法分离纯化。
3.注意事项
(1)LPO质量好坏,可直接影响标记率,LPO应在使用前新鲜配制,以防酶活性降低。
(2)LPO用量应小于总蛋白质用量的1%,以减少酶自身碘化而带入的放化杂质。
(3)碘化反应速率分析表明,酶的催化速度很快。
(4)碘化反应在pH4.0~8.5较宽范围内均可进行,最适pH值应依据蛋白质本身性质而定。
(5)H2O2应保持低浓度,如高于0.1mmol/L,对酶的活性将有抑制作用。
(三)Iodogen碘化法
此法具有标记率高、反应体积小(3ml水平)、可用低浓度的125I原料、对多肽激素和蛋白质的免疫活性损失小、稳定等优点,系常规的碘化方法之一。
1.原理 用Iodogen为氧化剂,对蛋白质和多肽抗原进行碘化标记,把125I直接引进分子中的酪氨酸残基上。标记过程中被标记样品不与Iodogen混合,标记后取出样品即停止反应,不使用任何还原剂。
2.方法
(1)标记之前,先把Iodogen溶于有机溶剂,涂于管底,并使之干燥。
(2)标记时,将蛋白质溶液10~20μg/10μl(0.5mol/L,pH7.5PB)置于反应管中,反应管置于冰浴中。碘化时,125I与蛋白质克分子之比例为1~1.2。反应时间在温和的连续的搅拌下可达10min,从反应管中转移出反应混合液,使其反应停止。反应液转移到含有200μl0.01mol/L、pH7.2PB和0.15mol/L NaCl溶液中,层析分离前再放置5min,使其未标记的碘离子还原成分子碘,以避免在带有缓冲液的柱中使白蛋白碘化。
3.注意事项
(1)涂有Iodogen的反应管,有氮气中密封,并贮存在-20℃条件下,至少可用3个月。打开管,使用时间很短。
(2)碘化反应时间,7min时标记率达最高,10min时略有减少。PH6.0~8.5时,标记率最高。
(3)Iodogen与蛋白质的比率是标记率的函数。最大的标记率是1克分子的Iodogen与8克分子或再多量之比。
(四)酰化试剂(Bolton和Hunter试剂)法
1.原理这个方法用酰化剂3--(4-羟苯基)丙酸—N琥珀酰胺酯(Bolton—Hunter试剂)做连接试剂,将125I标记在羟苯基的2,5位置上,再将琥珀酰胺酯水解,通过一个酰氨键将3--(4—羟基—5—125I—苯基)接在蛋白或多肽的末端氨基上。
2.方法125I—Bolton—Hunter试剂可用氯胺T法自行制备,出已有该试剂的苯溶液作为商品出售。使用时取一定量的标记酯(μmol 蛋白用3~5μmol标记酯),用氮气吹除苯,投入欲标记蛋白5~10μg及缓冲液10~50μl,pH8.0~8.5为宜,在冰浴中反应15~30min后,加入多量氨基酸(如甘氨酸),使过量标记酯消耗掉以终止反应。
此法避免了蛋白质与氧化剂的接触,又避免了与放射性碘原子的直接接触,可防止碘源中有害物质对蛋白质的损伤,适用于标记缺乏酪氨酸的蛋白质或酪氨酸在活性中心,引入碘原子后会引起蛋白质的失活。其缺点是标记技术比较复杂,需要接触较多的放射性,经二步反应,碘标记率比较低。一般认为此法不宜标记短肽,而适于分子量大于1万的蛋白质。
三、放射性标记化合物的纯化与鉴定
(一)纯化标记化合物的常用方法
不论使用何种制备方法,要获得合格的标记化合物,都必须将反应物经过仔细的分离、纯化。另外,一些标记化合物,经过一定时间的存放后,往往会出现不纯物,而需再纯化。如碘标记生长激素(125--HGH),在刚标记的第2天,从Sephadex G-100过滤谱上可见,几乎所有的碘化HGH都集中在峰II;保存1个月后,峰II组份减少,峰I和峰III成分明显增加,峰I是集聚的标记生长激素,而峰III是不具有免疫活性的放射性化学杂质(图8--3)。
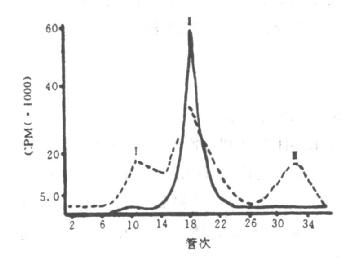
图8-3125I—HGH的SephadexG-100过滤谱
实线:新鲜制备的125I—HGH 虚线:保存1个月的125I—HGH
标记化合物的纯化方法,除制备比活度低而化学量又较多的标记物可用重结晶、蒸馏、萃取等常规方法外,一般需用微量分离技术,较方便的是层析法、离子交换法、凝胶过滤及高效液相层析法等。现以碘标记蛋白为例,说明以上各种方法的适用情况。
1.凝胶过滤法常用的是SephadexG系列,也有Biogel—P系列。分离标记蛋白与无机碘时,通常用Sephadex G—25或G—50,然后用G—100进一步纯化。
2.离子交换法一般是制成离子交换层析柱,用于分离纯化短肽标记物。
3.透析法 能将标记蛋白与小分子化合物很好地分离。
4.电泳法可用来分离单碘化、多碘化及已受损伤的蛋白质。
5.亲和层析法利用蛋白质与其特异抗体或受体的结合来分离、纯化标记蛋白质。此法特异性强,保持生物活性好,但操作较复杂。
6.高效液相层析法此法最大优点是分离效果好、快速,但需特殊设备。
7.伴刀豆球蛋白A(ConA)吸附法ConA是一种植物凝集素,对糖蛋白有良好吸附能力,因此适于分离标记糖蛋白。吸附的标记糖蛋白可用含0.2mol/L甲基α-吡喃葡萄糖苷的PBS洗脱。
(二)标记化合物的主要质量指标
作为示踪剂及分析试剂的标记化合物,应具有比一般非标记化合物更高的质量要求。标记化合物的质量指标包括:放射性核纯度、放射化学纯度、放射性比活度、生物活性和免疫活性以及标记位置和定量分布情况等。
1.放射性核纯度及其检查方法
(1)放射性核纯芳可用下式表示:
放射性核纯度(%)=所需放射性核素的活度/样品的总放射性活度×100
(2)放射性核纯度的检查方法:每一种核素都有它的特征,即物理半衰期及射线能量,故可通过半衰期及射线能量的测定来鉴别所需放射性核的纯度。
①测定半衰期法:如短半衰期放射性核素,一般可采用时间跟踪法,每隔一定时间测量放射性一次,共测3~5个半衰期,以每次测得的放射性计数为纵座标,时间为横座标,在半对数纸上作图,并通过分析,可求出该放射性核素的纯度。
②测定射线能量法:利用每一放射性核素的特征射线谱来检查放射性核纯度。γ发射体可用γ能谱仪,如检测57Co和58Co的核纯度:纯β-发射体可用液闪仪,调节 道宽及淬火校正后,对如3H、14C、32P的核纯度进行测量;而β、γ混杂垓素,则用吸收法测量,如99mrTc中母体杂质99mMo的含量测量,是通过适当厚度的铅屏蔽,将99mTc 发射的能量为141ke V的γ射线减弱后,测定99Mo发射的能量为739Kev的γ射线。
2.放射化学纯度及放化纯度鉴定
(1)放射化学纯度:放射性核素标记化合物都是以一定的化学形态存在的,所以:
放射化学纯度(%)特定化学形态的放射性活度/样品总放射性活度×100
放射化学纯度受制备方法及原料的化学纯度、产物存放条件等影响,一般放化纯度控制在95%以上。
(2)放射化学纯度的测定方法:原则是高效的化学分离与灵敏的放射性测量相结合。常用下列方法:
①放射层析法,又称放射色谱法:本法是利用色谱技术使混合物中各组份分离,然后测定各组份的放射性活度。它具有选择性高、分离效果好、操作简便等优点,在放化纯度鉴定中是一种重要的分析方法。最常用的是放射性纸层析法和放射性薄层层析法。
②放射性高效液相层析法:它对分离纯化标记化合物及鉴定标记化合物的放化纯度都有很大潜力,具有分析速度快、分离效率高、适用范围广等特点(几乎80%的有机化合物均可应用)。关键是要选择合适的固定相和流动相,使产品与杂质分离。在流动相中,被分析物各组份的浓度变化可用紫外或荧光检测器检测,而其放射性活度,可同时由放射性探测仪测定。放射性活度测定最简单的一种办法,是将洗脱液分部收集,然后在γ仪或液闪仪上进行测量;另一种较理想的是连续测量,在洗脱液流通池外包围一个固体闪烁探头,进行γ计数或在流通池前加一个三通混合室,用另一个泵混入闪烁液,测定软β射线。可以与紫外控测器的扫描图,同步描绘出放射性的分布图。
③放射性核素反稀释法:取一定量(W1)已测定比活度(SO)的标记化合物(约0.1~10mg),用>1000倍化学量(W2)的纯载体稀释,充分混匀后反复纯化到比活度恒定不变(Sp),此标记化合物的放化纯度值应为:
![]()
有时该值>100%时,往往是由于所用载体化学纯度不够。因本法操作要求严格,一般不作常规放化纯度鉴定用。
3.化学纯度及化学量的测定标记化合物中的非放射性化学杂质虽一般不会对示踪结果带来直接干扰,然而这种杂质的含量越多对标记化合物在使用、存放过程中分解、变性的影响就越大。此外,也已发现某些标记化合物的化学杂质会给使用带来直接影响。如用氚标记类固醇作放射免疫分析试剂,其中的化学杂质会影响标记抗原与抗体的结合率,使分析灵敏度降低。因此,对标记化合物的化学杂质含量,同样必须加以控制。
要制得化学纯度的标记化合物,最好是对可能产生的杂质加以防止。这要在冷试验中解决。因为冷试验所得产品是非放射性的,其化学纯度可用常规方法,如溶点、沸点测定,NMR、红外、紫外谱分析等手段加以鉴定,得到合格产品后,再按同样方法及条件进行标记制备。
对于标记化合物的化学含量,则必需在标记反应及一定纯化步骤后进行,由于需要高比活度的标记化合物,往往样品的放射性很强,而化学量极微(如某氘标记化合物,分子量为300,每分子上标记2个氘原子,氘的同位素活度为99.8%,则理论上每25mCi(925MBq)的化学量还不足(130μg),所以需用微量分析法才能测定其含量。一般而言,各种常规微量分析技术均可应用。目前大多用紫外分光、荧光光度等进行含量测定。
4.放射性比活度及其测定
(1)放射性比活度简称比活度,过去也称比放射性。
比活度=放射性活度/单位化学量
(2)比活度的理论值计算:每种放射性核素有一个比活度理论值,取决于该核素的半衰期和衰变常数。若N是1毫克原子(1mA)的总原子数,衰变常数λ(单位时间衰变的%),则
![]()
任何元素每1mA的原子数都相同,等于阿伏加德罗常数,即6.023×1020个,故
![]()
若T1/2min为单位,则上式的活度单位为dpm/mA,进行单位换算后为:
![]()
根据上式,可计算出每种放射性核素比活度的理论值(常用放射性核素的比活度理论值见表8-2)。如果标记化合物每分子接上一个放射性核素原子,则以上原论值亦为该标记化合物的比活度(每毫摩尔的活度)理论值。
表8-2 一些常用放射性核素的比活度理论值
(亦即每分子一接一个该放射性核素原子的标记化合物的经活度理论值)
| 放射性核素 | 半衰期 | 比活度理论值(每mA或mmol的活度) |
| 14C | 5730年 | 0.0624 Ci (2.3 GBq) |
| 3H | 12.33年 | 29.0 Ci(1073 GBq) |
| 45Ca | 165天 | 793 Ci (29.3 TBq) |
| 75Se | 118.5天 | 1100 Ci(40.7 TBq) |
| 35S | 87.4天 | 1494 Ci (55.2 TBq) |
| 125I | 60.2天 | 2196 Ci(80.3 TBq) |
| 131I | 8.04天 | 16240 Ci (600 TBq) |
(3)放射性比活度测定方法
①直接测定计算法:将标记产品经分离纯化后,配成合适的溶液,测定每毫升的放射性活度(如mCi/ml)及含量(μg/ml)从而计算其比活度。对于高经活度的标记物,化学含量甚低,一般需用光谱法,如紫外分光光度法测定其含量。
②层析扫描面积计算法:一般应用纸层析或薄层层析,将反应结果尚未分离的反应液点样、展层,然后在扫描仪上描绘放射性分布图,根据描绘的面积来进行计算,如图8-4。
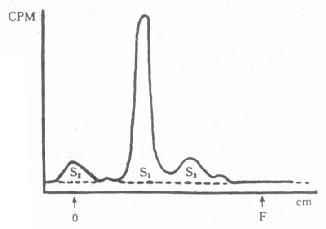
图8-4 放射层析扫描面积计算比活度示意图
1为标记物峰面积:
S2S3为杂质峰及放射性原料峰面积
先计算标记率:![]()
放射性比活度的计算:若投入的待标记物重量为W,且100%转化为标记物,则比活度=A·Y/W,其中A为投入的总放射性。
如果层析扫描仪有紫外监测器和放射性活度计数率仪可同步测定扫描,则直接可给出比活度。
③自身取代计算法:这是间接测定标记物比活度的方法。所测定的标记物,需是分离纯化后可用于RIA或RRA标记试剂。
方法的原理是:作一条常规的RIA(或RRA)标准曲线,另作一条不加非标记标准品,只加抗体和不同量标记试剂的自身取代曲线。两者用同一种抗体,且抗体用量完全相同。若反应平衡后测定结合部分的放射性,掏算成所加总放射性(注意:对标准曲线总说总放射性各管相同,对自身取代曲线来说各管不同,需分别换算)的百分数,即结合率B。由于两条曲线所用抗体的质和量严格相同,标记物与非标记标准品与抗体亲和力也相同,故B的大小就完全取决于各管中标记物和非标记标准品的总量。亦即若从两标准曲线上取一点相同的B,则
(标记物+标准品)标准曲线=(标记物)自身取代曲线
故由此便可直接计算标记试剂的化学含量并进一步求得比活度。为求准确度高,可取我点B求出平均比活度。
用自身取代法测定标记化合物的比活度,只适用于RIA的标记抗原及受体的标记配基。使用时应注意:①标记物与未标记物对抗体(受体)的亲和力应相同;②非特异性结合应较小,且计算时应扣除;③制备标准曲线与自身取代曲线时,操作步骤应相同,特别是B与F分离的条件要一致。
5.生物活性、免疫活性测定
(10)生物活性、免疫活性测定的重要性:放射性标记化合物作为示踪剂用于生物体内的示踪研究,或作为分析试剂用于生物活性物质分析,都要求标记化合物不改变其原有的生物活性和免疫活性。当给化物引入放射性原子,即使“同位素标记”大多需经过原子交换或化学反应及分离纯化等物理化学处理,有可能造成光学构型及立体构型的改变而使标记物改变性质。“非同位素标记”,如蛋白质分子中引入碘原子,则更易引起蛋白质失活、变性。故测定放射性标记化合物的生物活性和免疫活性,对保证使用效果十分必要。
(2)生物活性和免疫活性测定的要求:需根据使用要求而定,因为同一标记物其生物活性的变化与免疫活性的变化不一定相关;同一标记激素,其与受体结合能力的改变与抗体结合能力的改变也不一定平行。
(3)测定方法:测定标记蛋白质或多肽的生物活性和免疫活性常用的方法有下述几种:
①物理化学方法:可用电泳法、吸附法及凝胶过滤法等物理化学方法来测定标记蛋白质的结构改变情况,如标记后受损全伤的蛋白质在电泳时泳动性减少,碘化受损的多肽激素在血红蛋白涂碳上的吸附性质也有改变,而蛋白质变性聚合时大分子聚合体将在凝胶过滤时不停留在凝胶柱上。这些测定虽较快速方便,但对标记物的生物活性和免疫活性的严格判定来说,还是很不够的。
②特异结合试验:根据放射性标记化合物用于放射免疫分析等不同要求,分别与其相应抗体或受体进行特异性结合试验。以放射免疫分析试剂为例,测定其免疫活性的方法是:先观察标记物与抗体的结合率,如果结合率高,说明抗原的免疫活性较好。进一步观察标记抗原与非标记对抗体亲合力是否一致,做法之一是用不同稀释度的抗体,分别与标记抗原及与标记抗原加非标记抗原的混合物进行特异结合,其中混合物抗原总浓度要和单独使用放射性抗原的浓度相同。如单独使用标记抗原1.0ng,而混合抗原的总浓度亦为1.0ng,其中标记抗原为0.1ng,非标记抗原为0.9ng,比较两者的结合率,如果基本相同,说明标记抗原保持其原来的亲和力,在标记等操作过程中未受到明显损伤。如图8-5中,A线与B线基本平行;如果标记抗原免疫活性已有降低,则如C线所示。
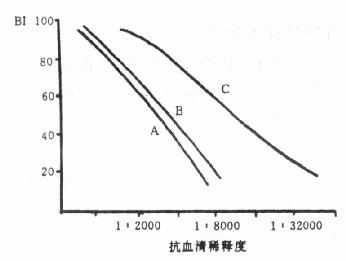
图8-5 标记蛋白的免疫活性测定
A;为标记抗原与血清的滴度曲线B:为非标记抗原(加入少量标记抗原)的滴度曲线;C:与A相同,但标记抗原免疫活性已有降低
③生物特性测定:如125I—纤维蛋白原,可用凝血酶测定其可凝能力,与非标记物相比,视是否有改变。使用何种生物特性测定,根据标记物的生物性质而定。另外,上述特异性结合试验,如果受体作异结合剂,也是检验用作RRA或RBA分析试剂的标记物生物活性情况的有效方
