(一)形态与结构
1.大球形颗粒:亦称Dane颗粒,它是一种由一个囊膜和一个含有DNA分子的核衣壳组成的病毒颗粒,直径约42nm。核衣壳为20面体对称结构。游离的核衣壳只能在肝细胞核内观察到。血中Dane颗粒浓度以急性肝炎潜伏期后期为最高,在疾病起始后则迅速下降。 Dane颗粒表面含有HBsAg ,核心中还含有双股有缺口的DNA链和依赖DNA的DNA多聚酶。目前认为Dane颗粒即完整的HBV(图26-1)。
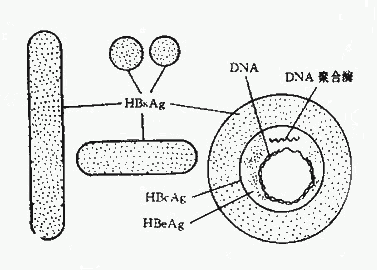
图26-1 HBV病毒颗粒图示
HBV DNA的两链长短不一,长链(L)完整,为负链,长度恒定,约3200个核苷酸。短链(S)为正链,长度可变,约为长链长度的50~100%,链的增生按5′-3′顺序进行。在不同分子中短链3′端的位置是可变的,而短链和长链的5′端位置固定点为粘性末端,通过250~300个核苷酸碱基配对,以维持DNA分子的环状结构。在粘性末端两侧,两链5′端各有一个由11个bp组成的直接重复序列(Direct repeat DR)-5′TTCACCTCTCC,该DR位于第1824个核苷酸者称DR1,位于第1590个核苷酸者称DR2,在病毒复制中起作用。
2.小形球颗粒:直径约22nm的小球形颗粒是HBV感染后血液中最多见的一种。它由HBsAg,即病毒的囊膜组成。化学组成为脂蛋白,可按其特有的密度与正常血清蛋白部分分离。在此颗粒中未检出达DNA多聚酶活性。目前认为HBV的小颗粒不是HBV,可能是它感染肝细胞时合成过剩的囊膜而游离于血循环中。
3.管形颗粒:直径约22nm,长度可在100~700nm之间。实际上它是一串聚合起来的小颗粒,但同样具有HBsAg的抗原性。
(二)基因结构
目前,已可从感染HBV病人的血清中及感染肝脏提纯的病毒核心中分离出环状双股DNA,从而确定HBV属DNA病毒。
研究Dane颗粒DNA结构发现,DNA分子含有约3,200个核苷酸。它包括两个链;一个长度固定的负链和另一长度不定的正链。由于DNA生物合成是在多聚酶作用DNA引物生长末端3′-OH与加入的脱氧核苷酸的5'-磷酸基形成磷酸二脂键完成的,因此,链的增生按5'-3'顺序进行,而且加到链上的每种脱氧核苷酸是按模板DNA的碱基配对互补规律进行,长链在1,800或1,818核苷酸附近有一个制品。短链的5'-末端通过长达250-300个核苷酸的碱基配对而维持分子的环状结构。DNA多聚酶作用不断延长短链3′端以修补缺口。缺口可能与HBV的DNA在感染细胞内的整合有关。
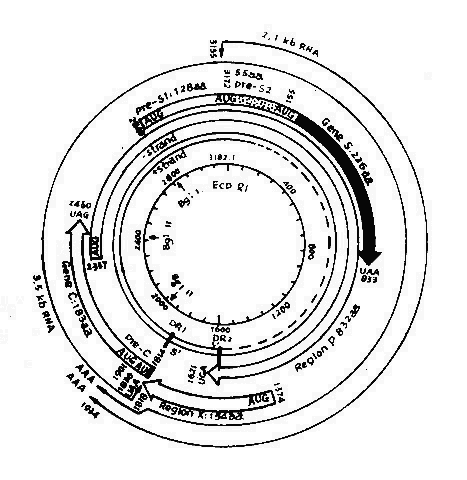
图26-2 HBV病毒基因图示
目前,由于克隆化DNA完整核苷酸已经确定,现已证实HBsAg和HBcAg都是由Dane颗粒的DNA所编码,并且二类基因存在同一DNA分子上。有人比较病毒基因编码能力和病毒多少,发现HBv DNA负链能编码全部已知的HBV蛋白质,而其正链开放读码区,不能编码病毒蛋白。
HBV DNA负链有四个开放区,分别称为S、C、P及X(图26-2),能编码全部已知的HBV蛋白质。S区可分为二部分,S基因和前S基因。S基因(核苷酸155~833)能编码主要表面蛋白。S基因之前是一个能编码163个氨基酸(2,848-154)的前S基因,编码Pre S1和Pre S2蛋白。C区基因包括前C基因和C基因,分别编码HBeAg和HBcAg。P区最长,约占基因组75%以上,编码病毒体DNA多聚酶。X区(核苷酸1,374~1,835)可能编码有154个氨基酸的碱性多肽,长链的裂口位于此区。
(三)HBV的抗原组成
1.HBsAg:HBsAg是由HBV的基因组所特定的,为上述三种形态的颗粒所共有。
HBsAg 抗原活性属于高浮力密度范围内的脂蛋白类。用CsCl密度梯度离心,表面抗原(小颗粒和管状颗粒)平均密度为1.20g/cm2。Dane颗粒的密度略高,为1.25g/cm2。纯化的22nm颗粒的平均沉降系数为33-54S,分子量约为24-2.5×106。
纯化的HBsAg 含有类脂质、糖类、脂质、蛋白质及糖蛋白。它由8种多肽组成,定名为P1至P8。其中至少有二种或三种多肽过碘酸Schiff试验阳性,提示存在糖类结构。用紫外分光光度计检查提取的HBsAg,显示有典型的蛋白吸收光谱。蛋白占总量的70~90%以上,广义的HBsAg 由三种蛋白组成:(1)主要表面蛋白(S蛋白,小分子HBsAg),由S基因编码的226个氨基酸组成。(2)中分子蛋白(中分子HBsAg),由前S2、S基因编码,在S蛋白226个氨基酸的N端附加一个含55个氨基酸的Pre S2蛋白组成,共281个氨基酸。(3)大分子蛋白(大分子HBsAg),由S,前S1和前S2基因编码,在中分子蛋白281个氨基酸的N端附加一个含119个氨基酸的PreS1蛋白组成,共400个氨基酸。
S蛋白即狭义HBsAg,是HBV囊膜的主要表面抗原的主要成份,包括糖基化的GP27和非糖基化的P24两种形式,以二硫键相连形成二聚体,代表HBsAg的结构单位,具备完整的抗原性。如二聚体解离,则HBsAg抗原性将会明显下降。
HBsAg 能刺激机体产生相应抗体—抗HBS,它是HBV的中和抗体,具有免疫保护作用,HBsAg的检出是HBV感染的标志之一。
前S蛋白2(Pre S2),的C端HBsAg端相连,Pre S2暴露于HBV囊膜外层,具有多聚人血清白蛋白 (Polymenized Human SerumAlbumin,PHSA)的受体(PHSA-R),能与PH-SA结合。由于肝细胞表面也有PHSA-R,HBV能通过血循环中存在的PHSA的介导,吸附到肝细胞表面,最后经胞饮作用进入肝细胞内。如病人血清中检出Pre S2,表示HBV在肝细胞中复制。PreS2有良好的免疫原性,能刺激机体产生相应抗体—抗Pre S2。此抗体出现于急性感染恢复早期,比抗HBs出现早而维持时间与抗HBs一样。抗PreS2具有中和作用,可作为机体康复的指标之一。
Pre S1有较强免疫原性,并能增强Pre S2和HBsAg 的免疫原性;Pre S1刺激机体产生相应抗体—Pre S1。该抗体有lgM和lgG两种,其中抗Pre S1在HBV感染潜伏期,也就是在抗HBV~lgM出现前已产生,故可作为HBV早期感染的特异性指标。而抗Pre S1 lgG出现稍晚,在体内维持时间较长,具有中和作用。
HBsAg对一些促进变性的化合物,如乙醚、1:1氯仿一尿素、十二烷基硫酸钠、吐温30以及各种蛋白水解酶都很稳定。HBsAg在酸性下孵育几小时仍很稳定。在碱性下,冷冻融化不能使其灭活。表面的类脂质可能对于一些主要由蛋白组成的抗原决定簇起保护作用。
HBsAg具有几种特异性抗原组分,包括各亚型共同抗原特异决定族a,和二组互相排斥的亚型决定簇d/y和 w/r。HBsAg的主要亚型有adr、adw、ayr及ayw4种。欧美各国adr、为主,我国汉族以adr居多中区地区及我国少数民族地区以ayw为主(西藏、新疆、内蒙等)。
2.HBcAg:HBcAg存在于Dane颗粒的核心和乙型肝炎患者的肝细胞核内。HBcAg一般从HBcAg阳性尸检肝或实验感染的黑猩猩肝脏提取。在乙型肝炎的急性期、恢复期和HBcAg携带者中常可测出抗~HBc。此抗体对病毒无中和作用。体内如发现HBcAg或抗~HBc表示HBV在肝内持续复制。
3.HBeAg:有关e抗原的本质还不十分清楚,但多数认为它是潜藏存在于Dane颗粒的核心部分。到目前为止,尚未在HbsAg阴性的血清中出现过。HBeAg是一种溶性抗原。抗原已知有三种亚型:e1,e2及e3。由于HBeAg与DNA多聚酶在血液中的消长相符,故HBcAg的存在可作为体内有HBV复制及血清具有传染性的一种标记,血中HBsAg滴度越高,HBeAg的检出率亦愈高。有些病人可出出现HBe抗体,可能也是一种有保护作用的抗体。
(四)HBV的培养
HBV的组织培养尚未成功。虽然近年来发展了从人胚肝获得的分化脓细胞初代培养、制备半连续人肝细胞系和诊断性肝穿刺培养的成人胚组织的方法,但应用各种肝组织在体外培养HBV仍很困难。尽管用各种细胞和器官分离HBV的大胆尝试,获得一些“肝炎待定”病毒,但难以使其在组织培养中连续传代,因而还没有一个被公认是HBV。近来用提取HBv DNA进行传染及通过细胞融合来拯救病毒的途径发离HBV,仍未得到公认的结果。
南非学者(1976)报道了从一个HBsAg阳性原发性肝癌组织建立的细胞系(PLC/PRF/5)中找到HBsAg的复制。此细胞系的主要特点是能产生HBsAg 逐日上升。104/日细胞可产生500ng HBsAg ,免疫电镜显示大多数为22nm的颗粒,均为圆形,略有亚微结构。其抗原性与免疫性均与血液中的HBsAg相同。未见有Dane颗粒及管形。目前,此细胞系已用于体外研究病毒基因组表达的有用模型。
黑猩猩是HBV的易感动物,狨猴虽可感染但不如前者敏感。国外用黑猩猩研究HBV的发病机理,检测自动免疫、被动免疫的效果以及HBV疫苗的安全性。但黑猩猩的来源短缺,难以广泛应用。
(五)抵抗力
HBV对外界的抵抗力较强。对低温、干燥、紫外线和一般化学消毒剂均耐受。乙肝病毒的传染性和HBsAg的抗原性在对外界抵抗力方面完全一致。二者在37℃活性能维持7天,在-20℃可保存20年,100℃加热10分钟可使HBV失去传染病,但仍可保持表面抗原活性。HBV对0.5%过氧乙酸、5%氯酸钠和3%漂白粉敏感,可用它们来消毒。
