免疫荧显微技术的基本原理是:使荧光抗体与标本切片中组织或细胞表面的抗原进行反应,洗涤除去游离的荧光抗体后,于荧光显微镜下观察,在黑暗背景上可见明亮的特异荧光。
(一)标本的制作
荧光显微技术主要靠观察切片标本上荧光抗体的染色结果作为抗原的鉴定和定位。因此标本制作的好坏直接影响到检测的结果。在制作标本过程中应力求保持抗原的完整性,并在染色、洗涤和封埋过程中不发生溶解和变性,也不扩散至临近细胞或组织间隙中去。标本切片要求尽量薄些,以利抗原抗体接触和镜检。标本中干扰抗原抗体反应的物质要充分洗去,有传染性的标本要注意安全。
常见的临床标本主要有组织、细胞和细菌三大类。按不同标本可制作涂片、印片或切片。组织材料可制备成石蜡切片或冷冻切片。石蜡切片因操作烦琐,结果不稳定,非特异反应强等已少应用。组织标本也可制成印片,方法是用洗净的玻片轻压组织切面,使玻片粘上1~2层组织细胞。细胞或细菌可制成涂片,涂片应薄而均匀。涂片或印片制成后应迅速吹干、封装。置-10℃保存或立即使用。
(二)荧光抗体染色
于已固定的标本上滴加经适当稀释的荧光抗体。置湿盒内,在一定温度下温育一定时间,一般可用25~37℃30min,不耐热抗原的检测则以4℃过夜为宜。用PBS充分洗涤,干燥。
(三)荧光显微镜检查
经荧光抗体染色的标本,需要在荧光显微镜下观察。最好在染色当天即作镜检,以防荧光消退,影响结果。
荧光显微镜检查应在通风良好的暗室内进行。首先要选择好光源或滤光片。滤光片的正确选择是获得良好荧光观察效果的重要条件。在光源前面的一组激发滤光片,其作用是提供合适的激发光。激发滤光片有两种。MG为紫外光滤片,只允许波长275~400nm的紫外光通过,最大透光度在365nm;BG为蓝紫外光滤片,只允许波长325~500nm的蓝外光通过,最大透光度为410nm。靠近目镜的一组阻挡滤光片(又称吸收滤光片或抑制滤光片)的作用是滤除激发光,只允许荧光通过。透光范围为410~650nm,代号有OG(橙黄色)和GG(淡绿黄色)两种。观察FITC标记物可选用激发滤光片BG12,配以吸收滤光片OG4或GG9。观察RB200标记物时,可选用BG12与OG5配合。
(四)实验的类型
1.直接法用特异荧光抗体直接滴加于标本上,使之与抗原发生特异性结合(图17-1)。本法操作简便,特异性高,非特异荧光染色因素少;缺点是敏感度偏低,每检查一种抗原需制备相应的特异荧光抗体。
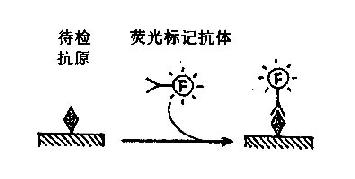
图17-1 直接免疫荧光法原理示意图
2.间接法可用于检测抗原和抗体,原理见图17-2。本法有两种抗体相继作用,第一抗体为针对抗原的特异抗体,第二抗体(荧光抗体)为针对第一抗体的抗抗体。本法灵敏度高,而且在不同抗原的检测中只需应用一种荧光抗体。
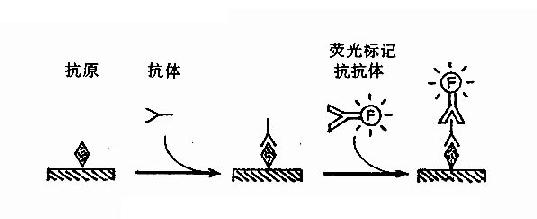
图17-2 间接免疫荧光法原理示意图
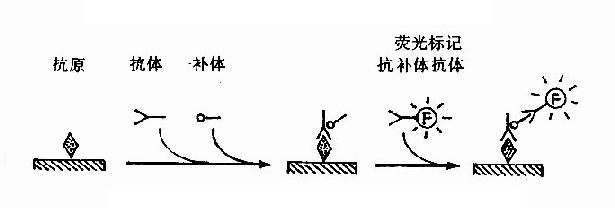
图17-3 补体结合免疫荧光法原理示意图
3.补体结合法本法是间接法的第一步抗原抗体反应时加入补体(多用豚鼠补体),再用荧光标记的抗补体抗体进行示踪(图17-3)。本法敏感度高,且只需一种抗体。但易出现非特异性染色,加之补体不稳定,每次需采新鲜豚鼠血清,操作复杂。因此较少应用。
4.标记法本法用FITC及罗丹明分别标记不同的抗体,而对同一标本作荧光染色。在有两种相应抗原存在时,可同时见到橙红和黄绿两种荧光色泽。
