分子生物学绪论
一、分子生物学的基本含义
分子生物学是从分子水平研究生命本质为目的的一门新兴边缘学科,它以核酸和蛋白质等生物大分子的结构及其在遗传信息和细胞信息传递中的作用为研究对象,是当前生命科学中发展最快并正与其它学科广泛交叉与渗透的重要前沿领域。分子生物学的发展为人类认识生命现象带来了前所未有的机会,也为人类利用和改造生物创造了极为广泛的前景。
所谓在分子水平上研究生命的本质主要是指对遗传、生殖、生长和发育等生命基本特征的分子机理的阐明,从而利用和改造生物奠定理论基础和提供新的手段。这里的分子水平指的是那些携带遗传信息的核酸和在遗传信息传递及细胞内、细胞间通讯过程中发挥着重要作用的蛋白质等生物大分子。这些生物大分子均具有较大的分子量,由简单的小分子核苷酸或氨基酸排列组合以蕴藏各种信息,并且具有复杂的空间结构以形成精确的相互作用系统,由此构成生物的多样化和生物个体精确的生长发育和代谢调节控制系统。简明这些复杂的结构及结构与功能的关系是分子生物学的主要任务。
二、分子生物学的主要研究内容
分子生物学主要包含以下三部分研究内容:
1 核酸的分子生物学
核酸的分子生物学研究核酸的结构及其功能。由于核酸的主要作用是携带和传递信息,因此分子遗传学(moleculargenetics)是其主要组成部分。由于50年代以来的迅速发展。该领域已形成了比较完整的理论体系和研究技术,是目前分子生物学内容最丰富的一个领域。研究内容包括核/基因组的结构、遗传信息的复制、转录与翻译,核酸存储的信息修复与突变,基因表达调控和基因工程技术的发展和应用等。遗传信息传递的中心法则(centraldogma)是其理论体系的核心。
2 蛋白质的分子生物学
蛋白质的分子生物学研究执行各种生命功能的主要大分子——蛋白质的结构与功能。尽管人类对蛋白质的研究比对核酸研究的历史要长得多,但由于其研究难度较大,与核酸分子生物学相比发展较慢。近年来虽然在认识蛋白质的结构及其与功能关系方面取得了一些进展,但是对其基本规律的认识尚缺乏突破性的进展。
3 细胞信号转导的分子生物学
细胞信号转导的分子生物学研究细胞内、细胞间信息传递的分子基础。构成生物体的每一个细胞的分裂与分化及其各种功能的完成均依赖于外界环境所赋予的各种指示信号。在外源信号的刺激下,细胞可以将这些信号转变为一系列生物化学变化,例如蛋白质构象的转变、蛋白分子的磷酸化心脏蛋白与蛋白相互作用的变化等,从而使其增殖、分化及分泌状态等发生改变以适应内外环境的需要。信号转导研究的目标是简明这些变化的分子机理,明确每一种信号转导与传递的途径及参与该途径的所有分子的作用和调节方式以及认识各种途径间的网络控制系统。信号转导机理的研究在理论和技术方面与上述核酸及蛋白质分子有着紧密的联系,是当前分子生物学发展最迅速的领域之一。
三、分子生物学与其他学科的关系
分子生物学是由生物化学、生物物理学、遗传学、微生物学、细胞学、以纛信息科学等多学科相互渗透、综合融会而产生并发展起来的,凝聚了不同专长的科学家的共同努力。它虽产生于上述各个学科,但已形成它独特的理论体系和研究手段,成为一个独立的学科。
生物化学与分子生物学关系最为密切。两者同在我国教委和科委颁布的一个二级学科中,称为“生物化学与分子生物学”,但两者还是区别的。生物化学是从化学角度研究生命现象的科学,它着重研究生物体内各种生物分子的结构、转变与新陈代谢。传统生物化学的中心内容是代谢,包括糖、脂类、氨基酸、核苷酸、以及能量代谢等与生理功能的联系。分子生物学则着重阐明生命的本质——主要研究生物大分子核酸与蛋白质的结构与功能、生命信息的传递和调控。《国际生物化学学会》和《中国生物化学学会》现昀已改名为《国际生物化学与分子生物学学会》和《中国生物化学与分子生物学学会》。
细胞生物学与分子生物学关系也十分密切。传统的细胞生物学主要研究细胞和亚细胞器的形态、结构与功能。细胞作为生物体基本的构成单位是由许多分子组成的复杂体系,光学显微镜和电子显微镜下所见到的规则结构是各种分子有序结合而形成的。探讨组成细胞的分子结构比单纯观察大体结构能更加深入认识细胞的结构与功能,因此现代细胞生物学的发展越来越多地应用分子生物学的理论和方法。分子生物学则是从研究各个生物大分子的结构入手,但各个分子不能孤立发挥作用,生命绝非组成万分的随意加和或混合,分子生物学还需要进一步研究各生物分子间的高层次组织和相互作用,尤其是细胞整体反应的分子机理。这在某种程度上是向细胞生物学的靠拢。分子细胞学或细胞分子生物学就因此而产生,成为人们认识生命的基础。
由于分子生物学涉及认识生命的本质,它也就自然广泛的渗透到医学各学科领域中,成为现代医学重要的基础。在医学各个学科中,包括生理学、微生理学、免疫学、病理学、药理学以及临床各学科分子生物学都正在广泛地形成交叉与渗透,形成了一些交叉学科,如分子免疫学、分子病毒学、分子病理学和分子药理学等,大大促进了医学的发展。
四、分子生物学发展简史
分子生物学的发展大致可分为三个阶段。
(一)准备和酝酿阶段
19世纪后期到20世纪50年代初,是现代分子生物学诞生的准备和酝酿阶段。在这一阶段产生了两点对生命本质的认识上的重大突破。
确定了蛋白质是生命的主要物质基础。
19世纪末Buchner兄弟证明酵母无细胞提取液能使糖发酵产生酒精,第一次提出酶(enzyme)的名称,酶是生物催化剂。20世纪20-40年代提纯和结晶了一些酶(包括尿素酶、胃蛋白酶、胰蛋白酶、共同酶、细胞色素C、肌动蛋白等),证明酶的本质是蛋白质。随后陆续发现生命的许多基本现象(物质代谢、能量代谢、消化、呼吸、运动等)都与酶和蛋白质相联系,可以用提纯的酶或蛋白质在体外实验中重复出来。在此期间对蛋白质结构的认识也有较大的进步。1902年EmilFisher证明蛋白质结构是多肽;40年代末,Sanger创立二硝基氟苯(DNFB)法、Edman发展异硫氰酸苯酯法分析肽链N端氨基酸;1953年Sanger和Thompson完成了第一个多肽分子——胰岛素A链和B链的氨基酸全序列分析。由于结晶X-线衍射分析技术的发展,1950年Pauling和Corey提出了α-角蛋白的α-螺旋结构模型。所以在这阶段对蛋白质一级结构和空间结构都有了认识。
确定了生物遗传的物质是DNA。
虽然1868年F.Miescher就发现了核素(nuclein),但是在此后的半个多世纪中并未引起重视。20世纪20-30年代已确认了自然界有DNA和RNA两类核酸,并阐明了核苷酸的组成。由于当时对核苷酸和碱基的定量分析不够精确,得出DNA中A、G、C、T含量是大致相等的结果,因而间长期认为DNA结构只有“四核苷酸”单位的重复,不具有多样性,不能携带更多的信息,当时对携带遗传信息的侯选分子更多的是考虑蛋白质。40年代以后的实验事实使人们对核酸的功能和结构两方面的认识都有了长足的进步。1944年O.T.Avery等证明了肺炎球菌转化因子是DNA;1952年S.Furbery等的X-线衍射分析阐明了核苷酸并非平面的空间构像,提出了DNA是螺旋结构;1948-1953年Chargaff等用新的层析和电泳技术分析组成DNA的碱基和核苷酸量,积累了大量的数据,提出了DNA碱基组成A=T、G=C的Chargaff规则,为碱基酸对的DNA结构认识打下了基础。
(二)现代分子生物学的建立和发展阶段
这一阶段是从50年代初到70年代初,以1953年Watson和Crick提出的DNA双螺旋结构模型作为现代分子生物学诞生的里程碑开创了分子遗传学基本理论建立和发展的黄金。DNA双螺旋发现的最深刻意义在于:确立了核酸作为信息分子的结构基础;提出碱基配对是核酸复制、遗传信息传递的基本方式;从而最后确定了核酸是遗传的物质基础,为认识核酸与蛋白质的关系及其生命中的作用打下了最重要的基础。在些期间的主要进展包括:
遗传信息传递中心法则的建立。
在发现DNA双螺旋结构同时,Watson和Crick就提出DNA复制的可能模型。其后在1956年A.Kornbery首先发现DNA聚合酶;1958年Meselson及Stahl同位素标记和超速离心分离实验为DNA半保留模型提出了证明;1968年Okazaki(冈畸)提出DNA不连续复制模型;1972年证实了DNA复制开始需要RNA作为引物;70年代初获得DNA拓扑异构酶,并对真核DNA聚合酶特性做了分析研究;这些都逐渐完善了对DNA复制机理的认识。
在研究DNA复制将遗传信息传给子代的同时,提出了RNA在遗传信息传到蛋白质过程中起着中介作用的假说。1958年Weiss及Hurwitz等发现依赖于DNA的RNA聚合酶;1961年Hall和Spiege-lman用RNA-DNA杂增色证明mRNA与DNA序列互补;逐步阐明了RNA转录合成的机理。
在此同时认识到蛋白质是接受RNA的遗传信息而合成的。50年代初Zamecnik等在形态学和分离的亚细胞组分实验中已发现微粒体(microsome)是细胞内蛋白质合成的部位;1957年Hoagland、Zamecnik及Stephenson等分离出tRNA并对它们在合成蛋白质中转运氨基酸的功能提出了假设;1961年Brenner及Gross等观察了在蛋白质合成过程中mRNA与核糖体的结合;1965年Holley首次测出了酵母丙氨酸tRNA的一级结构;特别是在60年代Nirenberg、Ochoa以及Khorana等几组科学家的共同努力破译了RNA上编码合成蛋白质的遗传密码,随后研究表明这套遗传密码在生物界具有通用性,从而认识了蛋白质翻译合成的基本过程。
上述重要发现共同建立了以中心法则为基础的分子遗传学基本理论体系。1970年Temin和Baltimore又同时从鸡肉瘤病毒颗粒中发现以RNA为模板合成DNA的反转录酶,又进一步补充和完善了遗传信息传递的中心法则。
对蛋白质结构与功能的进一步认识。
1956-58年anfinsen和White根据对酶蛋白的变性和复性实验,提出蛋白质的三维空间结构是由其氨基酸序列来确定的。1958年Ingram证明正常的血红蛋白与镰刀状细胞溶血症病人的血红蛋白之间,亚基的肽链上仅有一个氨基酸残基的差别,使人们对蛋白质一级结构影响功能有了深刻的印象。与此同时,对蛋白质研究的手段也有改进,1969年Weber开始应用SDS-聚丙烯酰胺凝胶电泳测定蛋白质分子量;60年代先后分析得血红蛋白、核糖核酸酶A等一批蛋白质的一级结构;1973年氨基酸序列自动测定仪问世。中国科学家在1965年人工合成了牛胰岛素;在1973年用1.8AX-线衍射分析法测定了牛胰岛素的空间结构,为认识蛋白质的结构做出了重要贡献。
(三)初步认识生命本质并开始改造生命的深入发展阶段
70年代后,以基因工程技术的出现作为新的里程碑,标志着人类涂认识生命本质并能主动改造生命的新时期开始。其间的重大成就包括:
1 重组DNA技术的建立和发展
分子生物学理论和技术发展的积累使得基因工程技术的出现成为必然。1967-1970年R.Yuan和H.O.Smith等发现的限制性核酸内切酶为基因工程提供了有力的工具;1972年Bery等将SV-40病毒DNA与噬菌体P22DNA在体外重组成功,转化大肠杆菌,使本来在真核功能中合成的蛋白质能在细菌中合成,打破了种属界限;1977年Boyer等首先将人工合成的生长激素释放抑制因子14肽的基因重组入质粒,成功地在大肠杆菌中合成得到这14肽;1978年Itakura(板仓)等使人生长激素191肽在大肠杆菌中表达成功;1979年美国基因技术公司用人工合成的人胰岛素基因重组转入大肠杆菌中合成人胰岛素。至今我国已有人干扰素、人白介素2、人集落刺激因子、重组人乙型肝炎病毒为疫苗、基因工程幼畜腹泻疫苗等多种基因工程药物和疫苗进入生产或临床试用,世界上还有几百种基因工程药物及其它基因工程产品在研制中,成为当今农业和医药业发展的重要方向,将对医学和工农业发展作出新贡献。
转基因动植物和基因剔除植物的成功是基因工程技术发展的结果。1982年Palmiter等将克隆的生长激素基因导入小鼠受精卵细胞核内,培育得到比原小鼠个体大几倍的”巨鼠“,激起了人们创造优良品家畜的热情。我国水生生物研究所将生长激素基因转入鱼受精卵,得到的转基因鱼的生长显著加快、个体增大;转基因猪也正在研制中。用转基因动物还能获取治疗人类疾病的重要蛋白质,导入了凝血因子IX基因的转基因绵羊分泌的乳汁中含有丰富的凝血因子IX,能有效地用于血友病的治疗。在转基因植物方面,1994年能比普通西红柿保鲜时间更长的转基因西红柿投放市场。1996年转基因玉米、转基因大豆相继投入商品生产,美国最早研制得到抗虫棉花,我国科学家将自己发现的蛋白酶抑制剂基因转入棉花获得抗棉铃虫的棉花株。到1996年全世界已有25万公顷土地种植转基因植物。
基因诊断与基因治疗是基因工程在医学领域发展的一个重要方面。1991年美国向一患先天性免疫缺陷病(遗传性腺苷脱氨酶ADA基因缺陷)的女孩体内导入重组的ADA基因。获得成功。我国也在1994年用导入人凝血因子IX基因的方法成功治疗了乙型血友病的患者。在我国用作基因诊断的试剂盒已有近百种之多。基因诊断和基因治疗正在发展之中。
这时期基因工程的迅速进步得益于许多分子生物学新技术的不断涌现。包括:核酸的化学合成从手工发展到全自动合成。1975-1977年Sanger、Maxam和Gilbert先后发明了三种DNA序列的快速测定法;90年代全自动核酸序列测定仪的问世;1985年Cetus公司Mullis等发明的聚合酶链式反应(PCR)的特定核酸序列扩增技术,更以其高灵敏度和特异性被广泛应用、对分子生物学的发展起到重大的推动作用。
2 基因组研究的发展
目前分子生物学已经从研究单个基因发展到研究生物整个基因组的结构与功能。1977年Sanger测定了ΦX174-DNA全部5375个核苷酸的序列;1978年fiers等测出SV-40DNA全部5224对碱基序列;80年代λ噬菌体DNA合部48502碱基对的序列全部测出;一些小的病毒包括乙型肝炎病毒、艾滋病毒等基因组的全序列也陆续被测定;196提底许多科学家共同努力测出了大肠杆菌基因组DNA的全序列长4×106碱基对。测定整个生物基因组核酸的全序列无疑对理解这一生物的生命信息及其功能有极大的意义。1990年人类基因组计划(HumanGenomeProjiect)开始实施,这是生命科学领域有史以来全球性最庞大的研究计划,将在2005年时测定出人基因组全部DNA3×109碱基对的序列、确定人类约5-10万个基因的一级结构,这将使人类能够更好掌握自己的命运。
3 单克隆抗体及基因工程抗体的建立和发展
1975年Kohler和Milstein首次用B淋巴细胞杂交瘤技术制备出单克隆以来,人们利用这一细胞工程技术研制出多种单克隆抗体,为许多疾病的诊断和治疗提供有有效的手段。80年代以后随着基因工程抗体技术相继出现的单域抗体、单链抗体、嵌合抗体、重构抗体、双功能抗体等为广泛和有效的应用单克隆抗体提供了广阔的前景。
4 基因表达调控机理
分子遗传学基本理论建立者Jacob和Monod最早提出的操纵元学说打开了人类认识基因表达调控的窗口,在分子遗传学基本理论建立的60年代,人们主要认识原核生物基因表达调控的一些规律,70年代以后才逐渐认识了真核基因组结构和调控的复杂性。1977年最先发现猴SV40病毒和腺病毒中编码蛋白质的基因序列是不连续的,这种基因内部的间隔区(内含子)在真核基因组中是普遍存在的,揭开了认识真核基因组结构和调控的序幕。1981年Cech等发现四膜虫rRNA的自我剪接,从而发现核(ribozyme)。80-90年代,使人们逐步认识到真核基因的顺式调控元件与反式转录因子、参与蛋白南间的分子识别与相互作用是基因表达调控根本所在。
5 细胞信号转导机理研究成为新的前沿领域
细胞信号转导机理的研究可以追述至50年代。Sutherland1957年发现cDNA、1965年提出第二信使学说,是人们认识受体介导和细胞信号转导的第一个里程碑。1977年Ross等用重组实验证实G蛋白的存在和功能,将G蛋白与腺苷酸环化酶的作用相联系起来,深化了对G蛋白偶联信号转导途径的认识。70年代中期以后,癌基因和抑癌基因的发现、蛋白酪氨酸激酶的发现及其结构与功能的深入研究、各种受体蛋白基历的克隆和结构功能的探索等,使近10年来细胞信号转导的研究更有了长足的进步。目前,对于某些细胞中的一些信号转导途径已经有了初步的认识,尤其是在免疫活性细胞对抗原的识别及其活化信号的传递途径方面和细胞增殖控制方面等形成了一些基本的概念,当然要达到最终目标还需相当长时间的努力。
以上简要介绍了分子生物学的发展过程,可以看到在近半个世纪中它是生命科学范围发展最为迅速的一个前沿领域,推动着整个生命科学的发展。至今分子生物学仍在迅速发展中,新成果、新技术不断涌现,这也从另一方面说明分子生物学发展还处在初级阶段。分子生物学已建立的基本规律给人们认识生命的本质拽出了光明的前景,分子生物学的历史还短,积累的资料还不够,例如:在地球上千姿百态的生物携带庞大的生命信息,迄今人类所了解的只是极少的一部位,还未认识核酸、蛋白质组成生命的许多基本规律;又如即使到2005年我们已经获得人类基因组DNa 3×109bp的全序列,确定了人的5-10万个基因的一级结构,但是要彻底搞清楚这些基因产物的功能、调控、基因间的相互关系和协调,要理解80%以上不为蛋白质编码的序列的作用等等,都还要经历漫长的研究道路。可以说分子生物学的发展前景光辉灿烂,道路还会艰难曲折。
第一章 蛋白质化学(Chemistry of Protein)
蛋白质(Protein)是生物体的基本组成成份。在人体内蛋白质的含量很多,约占人体固体成分的45%,它的分布很广,几乎所有的器官组织都含蛋白质,并且它又与所有的生命活动密切联系。例如,机体新陈代谢过程中的一系列化学反应几乎都依赖于生物催化剂-酶的作用,而本科的质就是蛋白质;调节物质代谢的激素有许多也是蛋白质或它的衍生物;其它诸如肌肉的收缩,血液的凝固,免疫功能,组织修复以及生长、繁殖等主要功能无一不与蛋白质相关。近代分子生物学的研究表明,蛋白质在遗传信息的控制、细胞膜的通透性、神经冲动的发生和传导以及高等动物的记忆等方面都起着重要的作用。
第一节 蛋白质分子的组成
一、蛋白质的元素组成
单纯蛋白质的元素组成为碳50~55%、氢6%~7%、氧19%~24%、氮13%~19%,除此之外还有硫0~4%。有的蛋白质含有磷、碘。少数含铁、铜、锌、锰、钴、钼等金属元素。
各种蛋白质的含氮量很接近,平均为16%。由于体内组织的主要含氮物是蛋白质,因此,只要测定生物样品中的氮含量,就可以按下式推算出蛋白质大致含量。
每克样品中含氮克数×6.25×100=100克样品中蛋白质含量(克%)
二、蛋白质的基本组成单位——氨基酸
蛋白质可以受酸、碱或酶的作用而水解。例如,一种单纯蛋白质用6N盐酸在真空下110℃水解约16小时,可达到完全水解(酸水解的条件下,色氨酸、酪氨酸易被破坏)。利用层析等手段分析水解液,就可证明组成蛋白质分子的基本单位是氨基酸。构成天然蛋白质的氨基酸共20种。
这些氨基酸为L-α-氨基酸(L-α-amino acid),其结构通式如下:
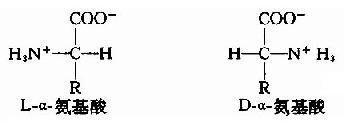
生物界中也发现一些D系氨基酸,主要存在于某些抗菌素以及个别植物的生物碱中。
三、氨基酸的分类
组成蛋白质的氨基酸按其α-碳原子上侧链R的结构分为20种,20种氨基酸按R的结构和极性的不同有以下两种分类方法。
(一)根据R的结构不同分类(见表1-1):
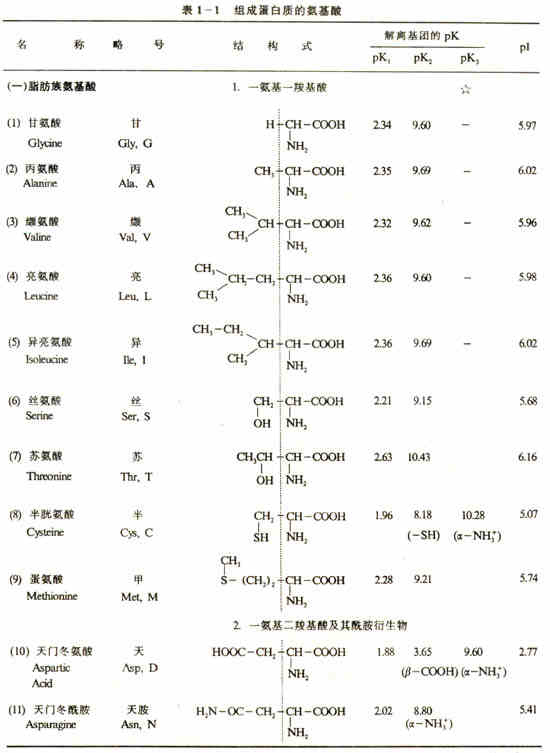
接上表
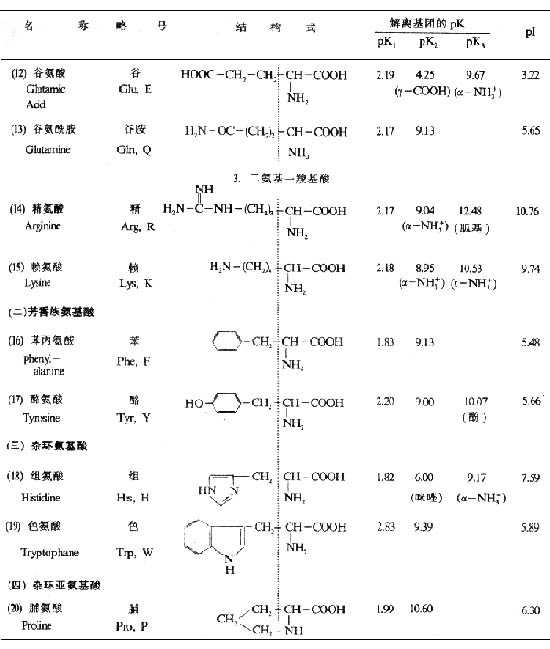
1.脂肪族氨基酸(包括棸被鶙羧基酸、一氨基二羧基酸、二氨基-羧基酸)。
2.芳香族氨基酸。
3.杂环族氨基酸。
4.杂环亚氨基酸。
(二)根据侧链R的极性不同分为非极性和极性氨基酸
氨基酸的R基团不带电荷或极性极微弱的属于非极性中性氨基酸,如:甘氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸、蛋氨酸、苯丙氨酸、色氨酸、脯氨酸。它们的R基团具有疏水性。
氨基酸的R基团带电荷或有极性的属于极性氨基酸,它们又可分为:
(1)极性中性氨基酸:R基团有极性,但不解离,或仅极弱地解离,它们的R基团有亲水性。如:丝氨酸、苏氨酸、半胱氨酸、酪氨酸、谷氨酰胺、天门冬酰胺。
(2)酸性氨基酸:R基团有极性,且解离,在中性溶液中显酸性,亲水性强。如天门冬氨酸、谷氨酸。
(3)碱性氨基酸:R基团有极性,且解离,在中性溶液中显碱性,亲水性强。如组氨酸、赖氨酸、精氨酸。
这20种氨基酸都有各自的遗传密码,它们是生物合成蛋白质的构件,无种属差异。在体内,一些特殊蛋白质分子中还含有其它氨基酸,如甲状腺球蛋白中碘代酪氨酸,胶原蛋白中的羟脯氨酸及羟赖氨酸,某些蛋白质分子中的胱氨酸等,它们都是在蛋白质生物合成之后(或合成过程中),相应的氨基酸残基被修饰形成的。还有的是在物质代谢过程中产生,如鸟氨酸(由精氨酸转变来的等,这些氨基酸在生物体内都没有相应的遗传密码。
第二节 蛋白质分子中氨基酸的连接方式
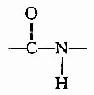
在蛋白质分子中,氨基酸之间是以肽键(peptide bond)相连的。肽键就是一个氨基酸的α-羧基与另一个氨基酸的α-氨基脱水缩合形成的键。
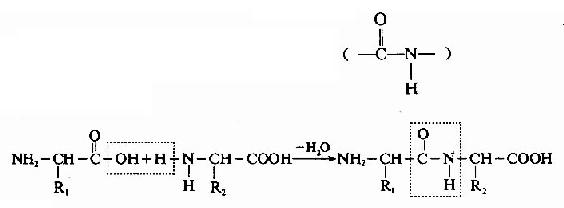
氨基酸之间通过肽键联结起来的化合物称为肽(peptide)。两个氨基酸形成的肽叫二肽,三个氨基酸形成的肽叫三肽……,十个氨基酸形成的肽叫十肽,一般将十肽以下称为寡肽(oligopeptide),以上者称多肽(polypeptide)或称多肽链。
组成多肽链的氨基酸在相互结合时,失去了一分子水,因此把多肽中的氨基酸单位称为氨基酸残基(amino acid residue)。
在多肽链中,肽链的一端保留着一个α-氨基,另一端保留一个α-羧基,带α-氨基的末端称氨基末端(N端);带α-羧基的末端称羧基末端(C端)。书写多肽链时可用略号,N端写于左侧,用H做标帜,C端于右侧用桹H表示。肽详细命名时为××酰××酰……××酸。

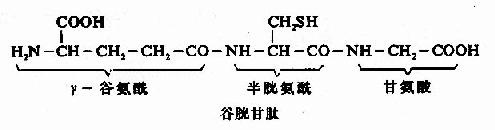
例如谷胱甘肽是由谷氨酸、半胱氨酸和甘氨酸三个氨基酸所组成的三肽,全名是γ-谷氨酰半胱氨酰甘氨酸,简称谷胱甘肽(glutachione,简写GSH)。其中N末端的谷氨酸是通过γ-羧基与半胱氨酸的氨基相连,这是一个例外。
第三节 蛋白质的结构及其功能
蛋白质为生物高分子物质之一,具有三维空间结构,因而执行复杂的生物学功能。蛋白质结构与功能之间的关系非常密切。在研究中,一般将蛋白质分子的结构分为一级结构与空间结构两类。
一、蛋白质的一级结构
蛋白质的一级结构(primarystructure)就是蛋白质多肽链中氨基酸残基的排列顺序(sequence),也是蛋白质最基本的结构。它是由基因上遗传密码的排列顺序所决定的。各种氨基酸按遗传密码的顺序,通过肽键连接起来,成为多肽链,故肽键是蛋白质结构中的主键。
迄今已有约一千种左右蛋白质的一级结构被研究确定,如胰岛素,胰核糖核酸酶、胰蛋白酶等。
蛋白质的一级结构决定了蛋白质的二级、三级等高级结构,成百亿的天然蛋白质各有其特殊的生物学活性,决定每一种蛋白质的生物学活性的结构特点,首先在于其肽链的氨基酸序列,由于组成蛋白质的20种氨基酸各具特殊的侧链,侧链基团的理化性质和空间排布各不相同,当它们按照不同的序列关系组合时,就可形成多种多样的空间结构和不同生物学活性的蛋白质分子。
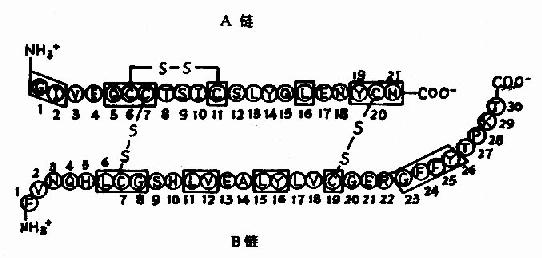
图1-1 胰岛素的一级结构
二、蛋白质的空间结构
蛋白质分子的多肽链并非呈线形伸展,而是折叠和盘曲构成特有的比较稳定的空间结构。蛋白质的生物学活性和理化性质主要决定于空间结构的完整,因此仅仅测定蛋白质分子的氨基酸组成和它们的排列顺序并不能完全了解蛋白质分子的生物学活性和理化性质。例如球状蛋白质(多见于血浆中的白蛋白、球蛋白、血红蛋白和酶等)和纤维状蛋白质(角蛋白、胶原蛋白、肌凝蛋白、纤维蛋白等),前者溶于水,后者不溶于水,显而易见,此种性质不能仅用蛋白质的一级结构的氨基酸排列顺序来解释。
蛋白质的空间结构就是指蛋白质的二级、三级和四级结构。
(一)蛋白质的二级结构
蛋白质的二级结构(secondarystructure)是指多肽链中主链原子的局部空间排布即构象,不涉及侧链部分的构象。
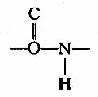
1.肽键平面(或称酰胺平面,amide plane)。
Pauling等人对一些简单的肽及氨基酸的酰胺等进行了X线衍射分析,得出图1-2所示结构,从一个肽键的周围来看,得知:
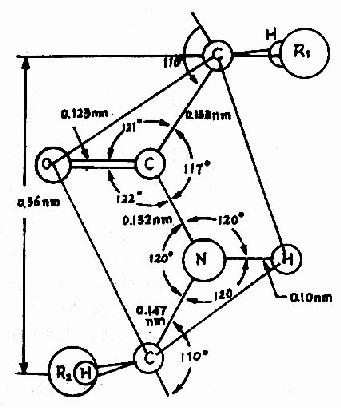
图1-2 肽键平面示意图
(1) 中的C-N键长0.132nm,比相邻的N-C单键(0.147nm)短,而较一般C=N双键(0.128nm)长,可见,肽键中-C-N-键的性质介于单、双键之间,具有部分双键的性质,因而不能旋转,这就将固定在一个平面之内。
中的C-N键长0.132nm,比相邻的N-C单键(0.147nm)短,而较一般C=N双键(0.128nm)长,可见,肽键中-C-N-键的性质介于单、双键之间,具有部分双键的性质,因而不能旋转,这就将固定在一个平面之内。
(2) 肽键的C及N周围三个键角之和均为360°,说明都处于一个平面上,也就是说
肽键的C及N周围三个键角之和均为360°,说明都处于一个平面上,也就是说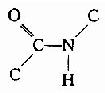 六个原子基本上同处于一个平面,这就是肽键平面。肽链中能够旋转的只有α碳原子所形成的单键,此单键的旋转决定两个肽键平面的位置关系,于是肽键平面成为肽链盘曲折叠的基本单位。
六个原子基本上同处于一个平面,这就是肽键平面。肽链中能够旋转的只有α碳原子所形成的单键,此单键的旋转决定两个肽键平面的位置关系,于是肽键平面成为肽链盘曲折叠的基本单位。
(3) 肽键中的C-N既具有双键性质,就会有顺反不同的立体异构,已证实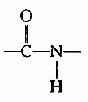 处于反位(见图1-3)。
处于反位(见图1-3)。
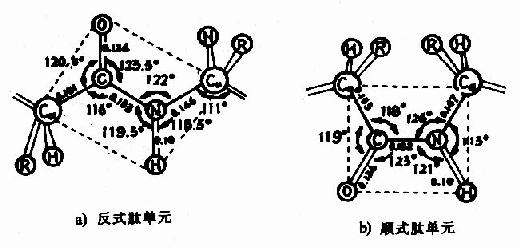
图1-3 反式肽单元和顺式肽单元
2.蛋白质主链构象的结构单元
1)α-螺旋Pauling等人对α-角蛋白(α-keratin)进行了X线衍射分析,从衍射图中看到有0.5~0.55nm的重复单位,故推测蛋白质分子中有重复性结构,并认为这种重复性结构为α-螺旋(α-helix)见图1-4。
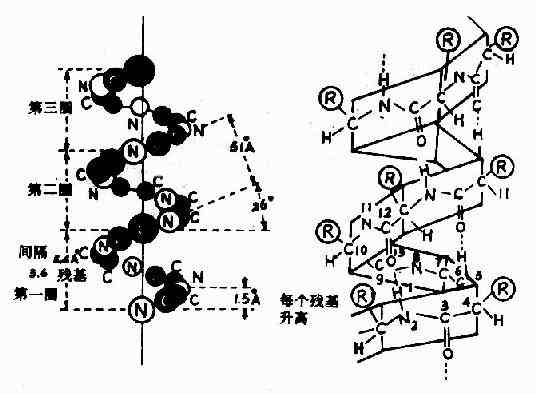
图1-4 蛋白质分子的α-螺旋
α-螺旋的结构特点如下:
(1)多个肽键平面通过α-碳原子旋转,相互之间紧密盘曲成稳固的右手螺旋。
(2)主链呈螺旋上升,每3.6个氨基酸残基上升一圈,相当于0.54nm,这与X线衍射图符合。
(3)相邻两圈螺旋之间借肽键中C=O和H桸形成许多链内氢健,即每一个氨基酸残基中的NH和前面相隔三个残基的C=O之间形成氢键,这是稳定α-螺旋的主要键。
(4)肽链中氨基酸侧链R,分布在螺旋外侧,其形状、大小及电荷影响α-螺旋的形成。酸性或碱性氨基酸集中的区域,由于同电荷相斥,不利于α-螺旋形成;较大的R(如苯丙氨酸、色氨酸、异亮氨酸)集中的区域,也妨碍α-螺旋形成;脯氨酸因其α-碳原子位于五元环上,不易扭转,加之它是亚氨基酸,不易形成氢键,故不易形成上述α-螺旋;甘氨酸的R基为H,空间占位很小,也会影响该处螺旋的稳定。
2)β-片层结构Astbury等人曾对β-角蛋白进行X线衍射分析,发现具有0.7nm的重复单位。如将毛发α-角蛋白在湿热条件下拉伸,可拉长到原长二倍,这种α-螺旋的X线衍射图可改变为与β-角蛋白类似的衍射图。说明β-角蛋白中的结构和α-螺旋拉长伸展后结构相同。两段以上的这种折叠成锯齿状的肽链,通过氢键相连而平行成片层状的结构称为β-片层(β-pleatedsheet)结构或称β-折迭(图1-5)。
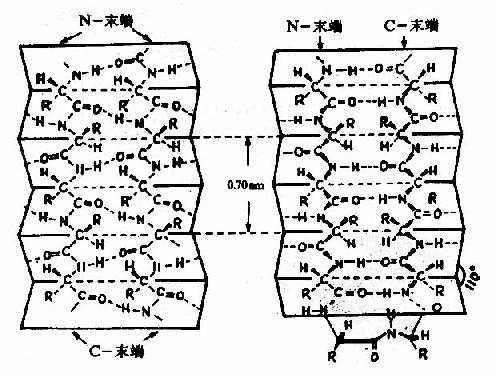
图1-5 蛋白质分子中的β-片层结构
左:顺向平行 右:逆向平行
β-片层结构特点是:
①是肽链相当伸展的结构,肽链平面之间折叠成锯齿状,相邻肽键平面间呈110°角。氨基酸残基的R侧链伸出在锯齿的上方或下方。
②依靠两条肽链或一条肽链内的两段肽链间的C=O与H梄形成氢键,使构象稳定。
③两段肽链可以是平行的,也可以是反平行的。即前者两条链从“N端”到“C端”是同方向的,后者是反方向的。β-片层结构的形式十分多样,正、反平行能相互交替。
④平行的β-片层结构中,两个残基的间距为0.65nm;反平行的β-片层结构,则间距为0.7nm。
3)β-转角
蛋白质分子中,肽链经常会出现180°的回折,在这种回折角处的构象就是β-转角(β-turn或β-bend)。β-转角中,第一个氨基酸残基的C=O与第四个残基的N桯形成氢键,从而使结构稳定(图1-6)。
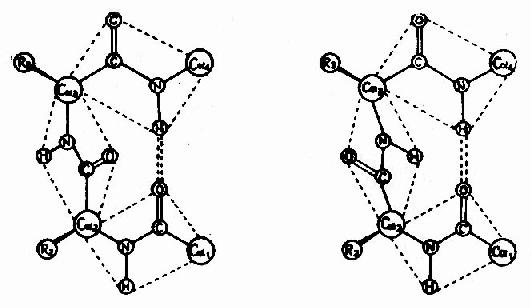
图1-6 蛋白质分子中的β-转角
4)无规卷曲
没有确定规律性的部分肽链构象,肽链中肽键平面不规则排列,属于松散的无规卷曲(random coil)。
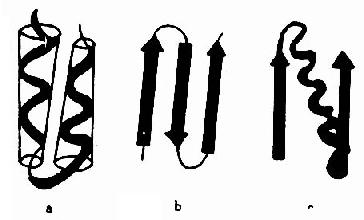
图1-7 蛋白质的超二级结构示意
a.αα组合 b.βββ组合 c.βαβ组合
(二)超二级结构和结构域
超二级结构(supersecondarystructure)是指在多肽链内顺序上相互邻近的二级结构常常在空间折叠中靠近,彼此相互作用,形成规则的二级结构聚集体。目前发现的超二级结构有三种基本形式:α螺旋组合(αα);β折叠组合(βββ)和α螺旋β折叠组合(βαβ)(图1-7),其中以βαβ组合最为常见。它们可直接作为三级结构的“建筑块”或结构域的组成单位,是蛋白质构象中二级结构与三级结构之间的一个层次,故称超二级结构。
结构域(domain)也是蛋白质构象中二级结构与三级结构之间的一个层次。在较大的蛋白质分子中,由于多肽链上相邻的超二级结构紧密联系,形成二个或多个在空间上可以明显区别它与蛋白质亚基结构的区别。一般每个结构域约由100-200个氨基酸残基组成,各有独特的空间构象,并承担不同的生物学功能。如免疫球蛋白(IgG)由12个结构域组成,其中两个轻链上各有2个,两个重链上各有4个;补体结合部位与抗原结合部位处于不同的结构域。一个蛋白质分子中的几个结构域有的相同,有的不同;而不同蛋白质分子之间肽链中的各结构域也可以相同。如乳酸脱氢酶、3-磷酸甘油醛脱氢酶、苹果酸脱氢酶等均属以NAD+为辅酶的脱氢酶类,它们各自由2个不同的结构域组成,但它们与NAD+结合的结构域构象则基本相同。
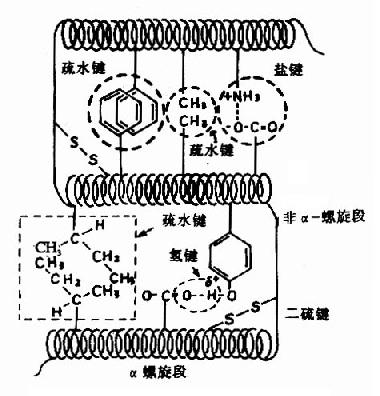
图1-8 蛋白质三级结构中某些次级键
(三)蛋白质的三级结构
蛋白质的多肽链在各种二级结构的基础上再进一步盘曲或折迭形成具有一定规律的三维空间结构,称为蛋白质的三级结构(tertiary structure)。蛋白质三级结构的稳定主要靠次级键,包括氢键、疏水键、盐键以及范德华力(Van der Wasls力)等(图1-8)。这些次级键可存在于一级结构序号相隔很远的氨基酸残基的R基团之间,因此蛋白质的三级结构主要指氨基酸残基的侧链间的结合。次级键都是非共价键,易受环境中pH、温度、离子强度等的影响,有变动的可能性。二硫键不属于次级键,但在某些肽链中能使远隔的二个肽段联系在一起,这对于蛋白质三级结构的稳定上起着重要作用。
现也有认为蛋白质的三级结构是指蛋白质分子主链折叠盘曲形成构象的基础上,分子中的各个侧链所形成一定的构象。侧链构象主要是形成微区(或称结构域domain)。对球状蛋白质来说,形成疏水区和亲水区。亲水区多在蛋白质分子表面,由很多亲水侧链组成。疏水区多在分子内部,由疏水侧链集中构成,疏水区常形成一些“洞穴”或“口袋”,某些辅基就镶嵌其中,成为活性部位。
具备三级结构的蛋白质从其外形上看,有的细长(长轴比短轴大10倍以上),属于纤维状蛋白质(fibrous protein),如丝心蛋白;有的长短轴相差不多基本上呈球形,属于球状蛋白质(globular protein),如血浆清蛋白、球蛋白、肌红蛋白,球状蛋白的疏水基多聚集在分子的内部,而亲水基则多分布在分子表面,因而球状蛋白质是亲水的,更重要的是,多肽链经过如此盘曲后,可形成某些发挥生物学功能的特定区域,例如酶的活性中心等。
(四)蛋白质的四级结构
具有二条或二条以上独立三级结构的多肽链组成的蛋白质,其多肽链间通过次级键相互组合而形成的空间结构称为蛋白质的四级结构(quarternary structure)。其中,每个具有独立三级结构的多肽链单位称为亚基(subunit)。四级结构实际上是指亚基的立体排布、相互作用及接触部位的布局。亚基之间不含共价键,亚基间次级键的结合比二、三级结构疏松,因此在一定的条件下,四级结构的蛋白质可分离为其组成的亚基,而亚基本身构象仍可不变。
一种蛋白质中,亚基结构可以相同,也可不同。如烟草斑纹病毒的外壳蛋白是由2200个相同的亚基形成的多聚体;正常人血红蛋白A是两个α亚基与两个β亚基形成的四聚体;天冬氨酸氨甲酰基转移酶由六个调节亚基与六个催化亚基组成。有人将具有全套不同亚基的最小单位称为原聚体(protomer),如一个催化亚基与一个调节亚基结合成天冬氨酸氨甲酰基转移酶的原聚体。
某些蛋白质分子可进一步聚合成聚合体(polymer)。聚合体中的重复单位称为单体(monomer),聚合体可按其中所含单体的数量不同而分为二聚体、三聚体……寡聚体(oligomer)和多聚体(polymer)而存在,如胰岛素(insulin)在体内可形成二聚体及六聚体。
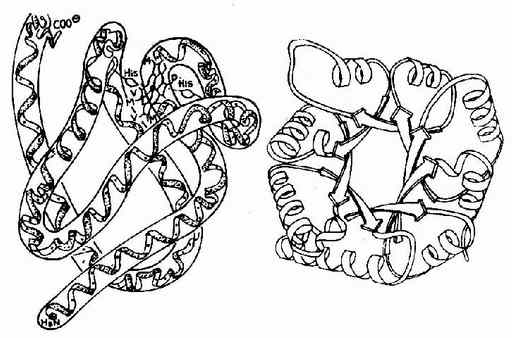
图1-9 肌红蛋白的三级结构和丙糖磷酸异构酶的三级结构图
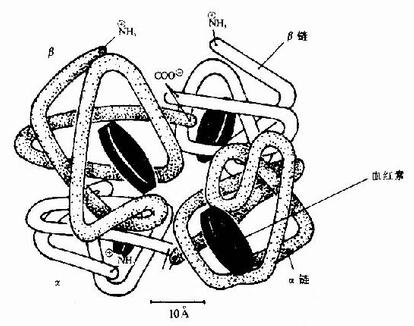
图1-10 面红蛋白亚基结合模式图
三、蛋白质的结构与功能的关系
(一)蛋白质的一级结构与其构象及功能的关系
蛋白质一级结构是空间结构的基础,特定的空间构象主要是由蛋白质分子中肽链和侧链R基团形成的次级键来维持,在生物体内,蛋白质的多肽链一旦被合成后,即可根据一级结构的特点自然折叠和盘曲,形成一定的空间构象。
Anfinsen以一条肽链的蛋白质核糖核酸酶为对象,研究二硫键的还原和氧化问题,发现该酶的124个氨基酸残基构成的多肽链中存在四对二硫键,在大量β-巯基乙醇和适量尿素作用下,四对二硫键全部被还原为桽H,酶活力也全部丧失,但是如将尿素和β-巯基乙醇除去,并在有氧条件下使巯基缓慢氧化成二硫键,此时酶的活力水平可接近于天然的酶。Anfinsen在此基础上认为蛋白质的一级结构决定了它的二级、三级结构,即由一级结构可以自动地发展到二、三级结构(图1-10)。
一级结构相似的蛋白质,其基本构象及功能也相似,例如,不同种属的生物体分离出来的同一功能的蛋白质,其一级结构只有极少的差别,而且在系统发生上进化位置相距愈近的差异愈小(表1-2,表1-3)。
表1-2 胰岛素分子中氨基酸残基的差异部分
| 胰岛素来源 | 氨基酸残基的差异部分 | |||
| A5 | A6 | A10 | A30 | |
| 人 | Thr | Ser | Ile | Thr |
| 猪 | Thr | Ser | Ile | Ala |
| 狗 | Thr | Ser | Ile | Ala |
| 兔 | Thr | Ser | Ile | Ser |
| 牛 | Ala | Ser | Val | Ala |
| 羊 | Ala | Gly | Val | Ala |
| 马 | Thr | Gly | Ile | Ala |
| 抹香猄 | Thr | Ser | Ile | Ala |
| 鲤猄 | Ala | Ser | Thr | Ala |
表1-3 细胞色素C分子中氨基酸残基的差异数目及分歧时间
| 不同种属 | 氨基酸残基的差异数目 | 分歧时间(百万年) |
| 人-猴 | 1 | 50-60 |
| 人-马 | 12 | 70-75 |
| 人-狗 | 10 | 70-75 |
| 猪-牛-羊 | ||
| 马-牛 | 3 | 60-65 |
| 哺乳类-鸡 | 10-15 | 280 |
| 哺乳类-猢 | 17-21 | 400 |
| 脊椎动物-酵母 | 43-48 | 1,100 |
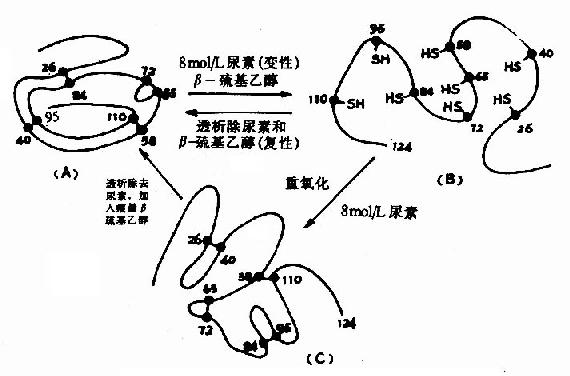
图1-11 核糖核酸酶的变性和复性示意图
(A)天然核糖核酸酶(B)变性失活(C)“错乱”核糖核酸酶
促肾上腺皮质激素(ACTH)和促黑激素(MSH)均为垂体分泌的多肽激素。α-MSH和ACTh 4~10位的氨基酸结构与β-MSH的11~17位一样,故ACTH有较弱的MSH的生理作用(图1-12)。
在蛋白质的一级结构中,参与功能活性部位的残基或处于特定构象关键部位的残基,即使在整个分子中发生一个残基的异常,那么该蛋白质的功能也会受到明显的影响。被称之为“分子病”的镰刀状红细胞性贫血仅仅是574个氨基酸残基中,一个氨基酸残基即β亚基N端的第6号氨基酸残基发生了变异所造成的,这种变异来源于基因上遗传信息的突变(如图1-13)。
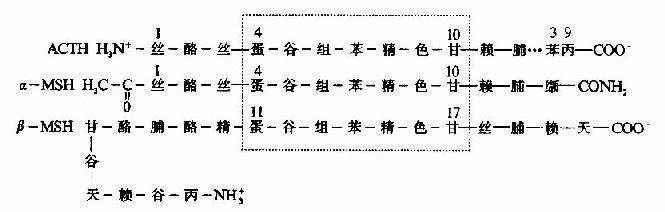
图1-12 ACTH、α-MSH和β-MSH一级结构比较
| 正常 | DNA | ……TGt GGG CTT CTT TTT…… |
| mRNA | ACA CCC GAA GAA AAA | |
| DNA(β亚基) | N端…苏-脯-谷-谷-赖…… | |
| 异常 | DNA | ……TGT GGG GAT CTT TTT…… |
| mRNA | ……ACa CCC GUA GAA AAA…… | |
| hbs(β亚基) | N端…苏-脯-缬-谷-赖…… |
图1-13 镰刀状红细胞性贫血血红蛋白遗传信息的异常
(二)蛋白质空间橡象与功能活性的关系
蛋白质多种多样的功能与各种蛋白质特定的空间构象密切相关,蛋白质的空间构象是其功能活性的基础,构象发生变化,其功能活性也随之改变。蛋白质变性时,由于其空间构象被破坏,故引起功能活性丧失,变性蛋白质在复性后,构象复原,活性即能恢复。
在生物体内,当某种物质特异地与蛋白质分子的某个部位结合,触发该蛋白质的构象发生一定变化,从而导致其功能活性的变化,这种现象称为蛋白质的别构效应(allostery)。
蛋白质(或酶)的别构效应,在生物体内普遍存在,这对物质代谢的调节和某些生理功能的变化都是十分重要的。
现以血红蛋白(hemoglobin,简写Hb)为例来说明构象与功能的关系。
血红蛋白是红细胞中所含有的一种结合蛋白质,它的蛋白质部分称为珠蛋白(globin),非蛋白质部分(辅基)称为血红素(见图1-14)。Hb分子由四个亚基构成,每一亚基结合一分子血红素。正常成人Hb分子的四个亚基为两条α链,两条β链。α链由141个氨基酸残基组成,β链由146个氨基酸残基组成,它们的一级结构均已确定。每一亚基都具有独立的三级结构,各肽链折叠盘曲成一定构象,β亚基中有8个α-螺旋区(分别称A、B……H螺旋区),α亚基中有7个α-螺旋区。在此基础上肽链进一步折叠形成球状,依赖侧链间形成的各种次级键维持稳定,使之球形表面为亲水区,球形向内,在E和F螺旋段间的20多个巯水氨基酸侧链构成口袋形的疏水区,辅基血红素就嵌接在其中,α亚基和β亚基构象相似,最后,四个亚基α2β2聚合成具有四级结构的Hb分子(见图1-15)。在此分子中,四个亚基沿中央轴排布四方,两α亚基沿不同方向嵌入两个β亚基间,各亚基间依多种次级健联系,使整个分子呈球形,这些次级键对于维系Hb分子空间构象有重要作用,例如在四亚基间的8对盐键(图1-16),它们的形成和断裂将使整个分子的空间构象发生变化。
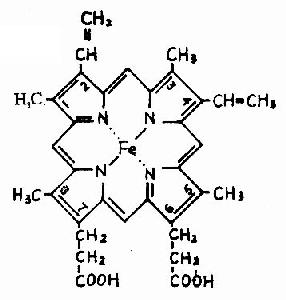
图1-14 血红素的结构式
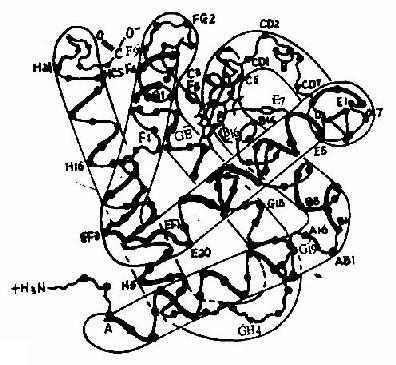
图1-15 血红蛋白β亚基的构象
ABCDEFGH分别代表不同的α-螺旋区。共有八个螺旋区;阿拉伯数字代表在该区氨基酸残基的序号;a-螺旋区之间的移行部位为无规卷曲,用AB,CD,EF,FG…等表示。C1,E7,C5,CF,C3,E3,的中间为血红素,其中较大的黑点代表Fe2+。
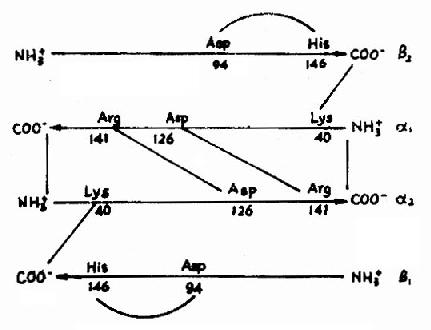
图1-16 血红蛋白亚基间盐键示意图
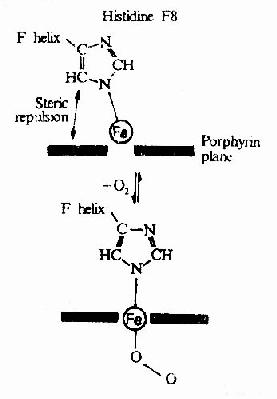
图1-7 铁原子在氧合时落入血红素平面
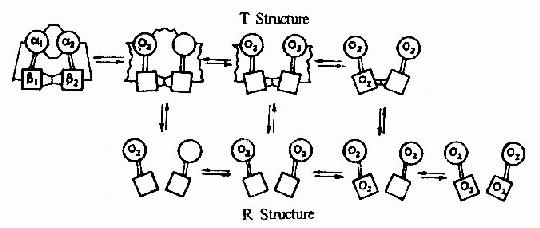
图1-18
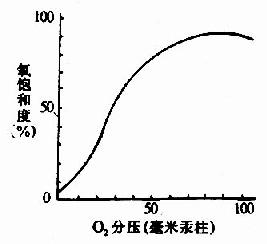
图1-19 Hb的氧饱和曲线
Hb在体内的主要功能为运输氧气,而Hb的别位效应,极有利于它在肺部与O2结合及在周围组织释放O2。
Hb是通过其辅基血红素的Fe++与氧发生可逆结合的,血红素的铁原子共有6个配位键,其中4个与血红素的吡咯环的N结合,一个与珠蛋白亚基F螺旋区的第8位组氨酸(F8)残基的咪唑基的N相连接,空着的一个配位键可与O2可逆地结合,结合物称氧合血红蛋白。
在血红素中,四个吡咯环形成一个平面,在未与氧结合时Fe++的位置高于平面0.7Å,一旦O2进入某一个α亚基的疏水“口袋”时,与Fe++的结合会使Fe++嵌入四吡咯平面中,也即向该平面内移动约0.75Å(图1-17),铁的位置的这一微小移动,牵动F8组氨酸残基连同F螺旋段的位移,再波及附近肽段构象,造成两个α亚基间盐键断裂,使亚基间结合变松,并促进第二亚基的变构并氧合,后者又促进第三亚基的氧合(图1-18)使Hb分子中第四亚基的氧合速度为第一亚基开始氧合时速度的数百倍。此种一个亚基的别构作用,促进另一亚基变构的现象,称为亚基间的协同效应(cooperativity),所以在不同氧分压下,Hb氧饱和曲线呈“S”型(图1-19)。
第四节 蛋白质的理化性质
蛋白质是由氨基酸组成的大分子化合物,其理化性质一部分与氨基酸相似,如两性电离、等电点、呈色反应、成盐反应等,也有一部分又不同于氨基酸,如高分子量、胶体性、变性等。
一、蛋白质的胶体性质
蛋白质分子量颇大,介于一万到百万之间,故其分子的大小已达到胶粒1~100nm范围之内。球状蛋白质的表面多亲水基团,具有强烈地吸引水分子作用,使蛋白质分子表面常为多层水分子所包围,称水化膜,从而阻止蛋白质颗粒的相互聚集。
与低分子物质比较,蛋白质分子扩散速度慢,不易透过半透膜,粘度大,在分离提纯蛋白质过程中,我们可利用蛋白质的这一性质,将混有小分子杂质的蛋白质溶液放于半透膜制成的囊内,置于流动水或适宜的缓冲液中,小分子杂质皆易从囊中透出,保留了比较纯化的囊内蛋白质,这种方法称为透析(dialysis)。
蛋白质大分子溶液在一定溶剂中超速离心时可发生沉降。沉降速度与向心加速度之比值即为蛋白质的沉降系数S。校正溶剂为水,温度20℃时的沉降系数S20·w可按下式计算:
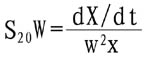
式中X为沉降界面至转轴中心的距离,W为转子角速度,W2X为向心加速度,dX/dt为沉降速度。单位用S,即Svedberg单位,为1×1013秒,分子愈大,沉降系数愈高,故可根据沉降系数来分离和检定蛋白质。
二、蛋白质的两性电离和等电点
蛋白质是由氨基酸组成的,其分子中除两端的游离氨基和羧基外,侧链中尚有一些解离基,如谷氨酸、天门冬氨酸残基中的γ和β-羧基,赖氨酸残基中的ε-氨基,精氨酸残基的胍基和组氨酸的咪唑基。作为带电颗粒它可以在电场中移动,移动方向取决于蛋白质分子所带的电荷。蛋白质颗粒在溶液中所带的电荷,既取决于其分子组成中碱性和酸性氨基酸的含量,又受所处溶液的pH影响。当蛋白质溶液处于某一pH时,蛋白质游离成正、负离子的趋势相等,即成为兼性离子(zwitterion,净电荷为O),此时溶液的pH值称为蛋白质的等电点(isoelectric point,简写pI)。处于等电点的蛋白质颗粒,在电场中并不移动。蛋白质溶液的pH大于等电点,该蛋白质颗粒带负电荷,反之则带正电荷。
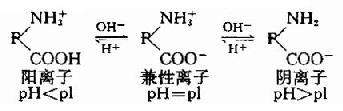
各种蛋白质分子由于所含的碱性氨基酸和酸性氨基酸的数目不同,因而有各自的等电点。
凡碱性氨基酸含量较多的蛋白质,等电点就偏碱性,如组蛋白、精蛋白等。反之,凡酸性氨基酸含量较多的蛋白质,等电点就偏酸性,人体体液中许多蛋白质的等电点在pH5.0左右,所以在体液中以负离子形式存在。
三、蛋白质的变性
天然蛋白质的严密结构在某些物理或化学因素作用下,其特定的空间结构被破坏,从而导致理化性质改变和生物学活性的丧失,如酶失去催化活力,激素丧失活性称之为蛋白质的变性作用(denaturation)。变性蛋白质只有空间构象的破坏,一般认为蛋白质变性本质是次级键,二硫键的破坏,并不涉及一级结构的变化。
变性蛋白质和天然蛋白质最明显的区别是溶解度降低,同时蛋白质的粘度增加,结晶性破坏,生物学活性丧失,易被蛋白酶分解。
引起蛋白质变性的原因可分为物理和化学因素两类。物理因素可以是加热、加压、脱水、搅拌、振荡、紫外线照射、超声波的作用等;化学因素有强酸、强碱、尿素、重金属盐、十二烷基磺酸钠(SDS)等。在临床医学上,变性因素常被应用于消毒及灭菌。反之,注意防止蛋白质变性就能有效地保存蛋白质制剂。
变性并非是不可逆的变化,当变性程度较轻时,如去除变性因素,有的蛋白质仍能恢复或部分恢复其原来的构象及功能,变性的可逆变化称为复性。例如,前述的核糖核酸酶中四对二硫键及其氢键。在β巯基乙醇和8M尿素作用下,发生变性,失去生物学活性,变性后如经过透析去除尿素,β巯基乙醇,并设法使疏基氧化成二硫键,酶蛋白又可恢复其原来的构象,生物学活性也几乎全部恢复,此称变性核糖核酸酶的复性。
许多蛋白质变性时被破坏严重,不能恢复,称为不可逆性变性。
四、蛋白质的沉淀
蛋白质分子凝聚从溶液中析出的现象称为蛋白质沉淀(precipitation),变性蛋白质一般易于沉淀,但也可不变性而使蛋白质沉淀,在一定条件下,变性的蛋白质也可不发生沉淀。
蛋白质所形成的亲水胶体颗粒具有两种稳定因素,即颗粒表面的水化层和电荷。若无外加条件,不致互相凝集。然而除掉这两个稳定因素(如调节溶液pH至等电点和加入脱水剂)蛋白质便容易凝集析出。
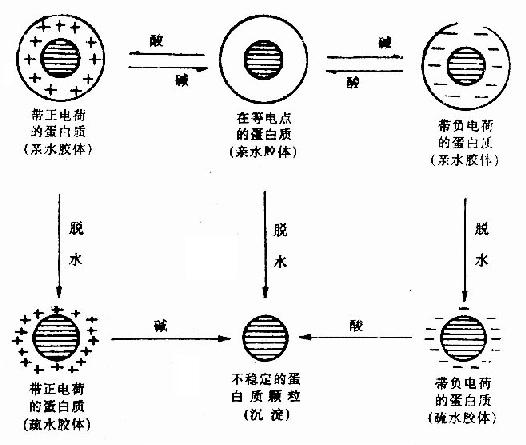
图1-20 蛋白质胶体颗粒的沉淀
从图1-0可以看出,如将蛋白质溶液pH调节到等电点,蛋白质分子呈等电状态,虽然分子间同性电荷相互排斥作用消失了。但是还有水化膜起保护作用,一般不致于发生凝聚作用,如果这时再加入某种脱水剂,除去蛋白质分子的水化膜,则蛋白质分子就会互相凝聚而析出沉淀;反之,若先使蛋白质脱水,然后再调节pH到等电点,也同样可使蛋白质沉淀析出。
引起蛋白质沉淀的主要方法有下述几种:
(一)盐析(Salting Out)
在蛋白质溶液中加入大量的中性盐以破坏蛋白质的胶体稳定性而使其析出,这种方法称为盐析。常用的中性盐有硫酸铵、硫酸钠、氯化钠等。各种蛋白质盐析时所需的盐浓度及pH不同,故可用于对混和蛋白质组分的分离。例如用半饱和的硫酸铵来沉淀出血清中的球蛋白,饱和硫酸铵可以使血清中的白蛋白、球蛋白都沉淀出来,盐析沉淀的蛋白质,经透析除盐,仍保证蛋白质的活性。调节蛋白质溶液的pH至等电点后,再用盐析法则蛋白质沉淀的效果更好。
(二)重金属盐沉淀蛋白质
蛋白质可以与重金属离子如汞、铅、铜、银等结合成盐沉淀,沉淀的条件以pH稍大于等电点为宜。因为此时蛋白质分子有较多的负离子易与重金属离子结合成盐。重金属沉淀的蛋白质常是变性的,但若在低温条件下,并控制重金属离子浓度,也可用于分离制备不变性的蛋白质。
临床上利用蛋白质能与重金属盐结合的这种性质,抢救误服重金属盐中毒的病人,给病人口服大量蛋白质,然后用催吐剂将结合的重金属盐呕吐出来解毒。
(三)生物碱试剂以及某些酸类沉淀蛋白质
蛋白质又可与生物碱试剂(如苦味酸、钨酸、鞣酸)以及某些酸(如三氯醋酸、过氯酸、硝酸)结合成不溶性的盐沉淀,沉淀的条件应当是pH小于等电点,这样蛋白质带正电荷易于与酸根负离子结合成盐。
临床血液化学分析时常利用此原理除去血液中的蛋白质,此类沉淀反应也可用于检验尿中蛋白质。
(四)有机溶剂沉淀蛋白质
可与水混合的有机溶剂,如酒精、甲醇、丙酮等,对水的亲和力很大,能破坏蛋白质颗粒的水化膜,在等电点时使蛋白质沉淀。在常温下,有机溶剂沉淀蛋白质往往引起变性。例如酒精消毒灭菌就是如此,但若在低温条件下,则变性进行较缓慢,可用于分离制备各种血浆蛋白质。
(五)加热凝固
将接近于等电点附近的蛋白质溶液加热,可使蛋白质发生凝固(coagulation)而沉淀。加热首先是加热使蛋白质变性,有规则的肽链结构被打开呈松散状不规则的结构,分子的不对称性增加,疏水基团暴露,进而凝聚成凝胶状的蛋白块。如煮熟的鸡蛋,蛋黄和蛋清都凝固。
蛋白质的变性、沉淀,凝固相互之间有很密切的关系。但蛋白质变性后并不一定沉淀,变性蛋白质只在等电点附近才沉淀,沉淀的变性蛋白质也不一定凝固。例如,蛋白质被强酸、强碱变性后由于蛋白质颗粒带着大量电荷,故仍溶于强酸或强减之中。但若将强碱和强酸溶液的pH调节到等电点,则变性蛋白质凝集成絮状沉淀物,若将此絮状物加热,则分子间相互盘缠而变成较为坚固的凝块。
五、蛋白质的呈色反应
(一)茚三酮反应(Ninhydrin Reaction)
α-氨基酸与水化茚三酮(苯丙环三酮戊烃)作用时,产生蓝色反应,由于蛋白质是由许多α-氨基酸组成的,所以也呈此颜色反应。
(二)双缩脲反应(Biuret Reaction)
蛋白质在碱性溶液中与硫酸铜作用呈现紫红色,称双缩脲反应。凡分子中含有两个以上-CO-NH-键的化合物都呈此反应,蛋白质分子中氨基酸是以肽键相连,因此,所有蛋白质都能与双缩脲试剂发生反应。
(三)米伦反应(Millon Reaction)
蛋白质溶液中加入米伦试剂(亚硝酸汞、硝酸汞及硝酸的混和液),蛋白质首先沉淀,加热则变为红色沉淀,此为酪氨酸的酚核所特有的反应,因此含有酪氨酸的蛋白质均呈米伦反应。
此外,蛋白质溶液还可与酚试剂、乙醛酸试剂、浓硝酸等发生颜色反应。
第五节 蛋白质的分类
蛋白质的种类繁多,结构复杂,迄今为止没有一个理想的分类方法。着眼的测面不同,分类也就各异,例如从蛋白质形状上,可将它们分为球状蛋白质及纤维状蛋白质;从组成上可分为单纯蛋白质(分子中只含氨基酸残基)及结合蛋白质(分子中除氨基酸外还有非氨基酸物质,后者称辅基);单纯蛋白质又可根据理化性质及来源分为清蛋白(又名白蛋白,albumin)、球蛋白(globulin)、谷蛋白(glutelin)、醇溶谷蛋白(prolamine)、精蛋白(protamine)、组蛋白(histone)、硬蛋白(scleroprotein)等(见表1?)。结合蛋白又可按其辅基的不同分为核蛋白(nucleoprotein)、磷蛋白(phosphoprotein)、金属蛋白(metalloprotein)、色蛋白(chromoprotein)等(见表1-5)。
此外,还可以按蛋白质的功能将其分为活性蛋白质(如酶、激素蛋白质、运输和贮存蛋白质、运动蛋白质、受体蛋白质、膜蛋白质等)和非活性蛋白质(如胶原、角蛋白等)两大类。
表1-4 蛋白质按溶解度分类
| 蛋白质分类 | 举 例 | 溶 解 度 |
| 白蛋白 | 血清白蛋白 | 溶于水和中性盐溶液,不溶于饱和硫酸铵溶液 |
| 球蛋白 | 免疫球蛋白、纤维蛋白原 | 不溶于水,溶于稀中性盐溶液,不溶于半饱和和硫酸铵溶液 |
| 谷蛋白 | 麦谷蛋白 | 不溶于水、中性盐及乙醇;溶于稀酸、稀硷 |
| 醇溶谷蛋白 | 醇溶谷蛋白、醇溶玉米蛋白 | 不溶于水、中性盐溶液;溶于70-80%乙醇中 |
| 硬蛋白 | 角蛋白、胶原蛋白、弹性蛋白 | 不溶于水、稀中性盐、稀酸、稀硷和一般不机溶剂 |
| 组蛋白 | 胸腺组蛋白 | 溶于水、稀酸、稀硷、不溶于稀氨水 |
| 精蛋白 | 鱼精蛋白 | 溶于水,稀酸,稀硷、稀氨水 |
表1-5 蛋白质按化学成分分类
| 蛋白质类别 | 举 例 | 非蛋白成分(辅基) |
| 单纯蛋白质 | 血清蛋白,球蛋白 | 无 |
| 核蛋白 | 病毒核蛋白,染色体蛋白 | 核酸 |
| 糖蛋白 | 免疫球蛋白、粘蛋白,蛋白多糖 | 糖类 |
| 脂蛋白 | 乳糜微粒、低密度脂蛋白、极度密度脂蛋白、高密度脂蛋白 | 各种脂类 |
| 磷蛋白 | 酪蛋白、卵黄磷酸蛋白 | 磷酸 |
| 色蛋白 | 血红蛋白、黄素蛋白 | 色素 |
| 金属蛋白 | 铁蛋白、铜兰蛋白 | 金属离子 |
参考资料
蛋白质一级结构的测定方法
研究蛋白质的一级结构从确定组成蛋白质的单元结构枣氨基酸算起,已有150年的悠久历史,直到1955年,Sanger首次阐明胰岛素的氨基酸排列顺序,为研究蛋白质的一级结构开辟了道路。这在分子生物学的发展进程中是一个重要突破。目前关于核酸的一级结构研究,由于Sanger等发明了加减法,可以得到了突飞猛进的发展。对此之下,关于蛋白质的一级结构研究进展不如核酸迅速。但随着Edman液相自动顺序分析仪和固相顺序分析仪以及气相色谱质谱(GCMS)等方法的相继出现。使结构分析的速度也显著加快。至今已完成近千种蛋白质的一级结构分析。目前不仅样品用量减少,而且工作人员也大大减少。当年Sanger分析胰岛素用了整整十年的时间,今天运用自动化仪器,分析一个分子量在10万左右的蛋白质只需要几天,可见新技术的应用和发展对科学发展起的促进作用,蛋白质一级结构测定方法的综述及专著文献较多,这里只扼要加以概述。
蛋白质分子的一级结构测定,概括起来包含多肽链的分离、降解、肽段的分离和顺序分析以及-S-S-定位等。
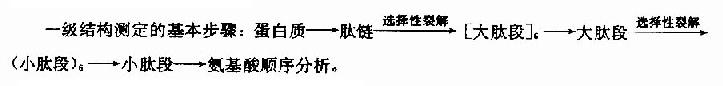
一级结构的测定方法可概述如下:
1.多肽链的分离
在测定一个蛋白质的结构以前,首先必须保证被测蛋白质的纯度,使结果准确可靠。其次要了解它的分子量和亚基数,按照其亚基数将蛋白质分成几个多肽链。
1)肽链的拆开
蛋白质分子多肽链的连接有共价结合和非共价结合两种。要拆开以共价结合的-S-S-连接的多肽链,必须采用的化学处理方法常有:
①过甲酸氧化
用氧化剂过甲酸断裂-S-S-。这个反应一般在0℃下进行2小时左右,两个S就全部能转变成磺酸基,这样被氧化的半胱氨酸称为磺基丙氨酸。
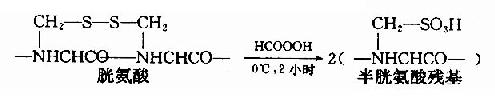
如果蛋白质分子中同时存在半胱胺酸,那么也会被氧化成磺基丙氨酸。此外甲硫氨酸和色氨酸也可被氧化,从而增加分析的复杂性。
②巯基乙醇还原
利用还原剂巯基乙醇亦可使蛋白质的-S-S-断裂。当高浓度的巯基乙醇在pH8?条件下室温保温几小时后,可以使-S-S-定量还原为桽H。与此同时反应系统中还需要有8摩尔脲或6摩尔盐酸胍使蛋白质变性,多肽链松散成为无规则的构型,此时还原剂就可作用于-S-S-。此反应是可逆的,因此要使反应完全,疏基乙醇的浓度必需在0.1-0.5摩尔。
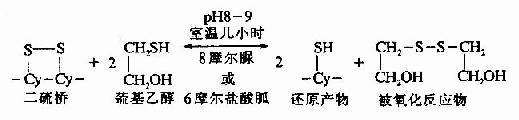
③Cleland试剂的还原作用
Cleland′s指出二硫赤苏糖醇(dithioerythriotol)及二硫苏糖醇(dithiothriotol)在氧化还原能力上是比较强的试剂,只要0.01摩尔就能使蛋白质的-S-S-还原,反应基本与疏基乙醇相似,且在许多球蛋白反应中,可以不用变性剂。
Cleland试剂首先与蛋白质-S-S-形成中间物,反应终了,还原剂被氧化形成一个稳定的六环化合物,蛋白质则被还原。
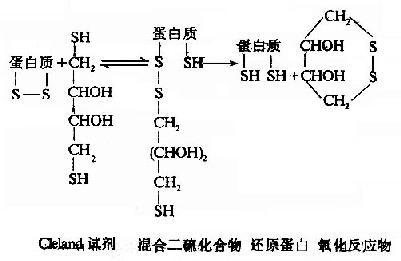
还原蛋白不稳定,SH基极易氧化重新生成-S-S-键。稳定SH基的方法有:
(A)烷基化试剂使SH基转变为稳定的硫醚衍生物。
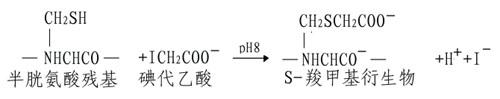
如果碘代乙酰胺代替碘代乙酸,其产物S羧氨甲基衍生物不带电荷,磺代乙酸也可与组氨酸、蛋氨酸和赖氨酸发生反应,但反应条件不同,可通过各种pH及反应时间进行控制。
(B)氨乙基化
蛋白质分子的几条肽链若以非共价健结合,则用尿素、盐酸胍等变性剂即可拆开。蛋白质的多肽链被拆开后,将它分离纯化,一般多用凝胶过滤、离子交换、电泳等方法,兹不赘述。
分离纯化后的每条肽链还要进一步分析其末端。
2)末端分析 其方法较多,这里我们只介绍较常用的几种。
(1)N-末端测定
A.二硝基氟苯法(FDNB,DNFB):1945年Sanger提出此方法,是他的重要贡献之一。
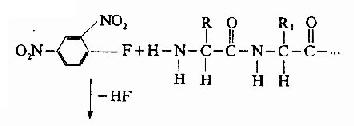
DNP-氨基酸用有机溶剂抽提后,通过层析位置可鉴定它是何种氨基酸。Sanger用此方法测定了胰岛素的N末端分别为甘氨酸及苯丙氨酸。
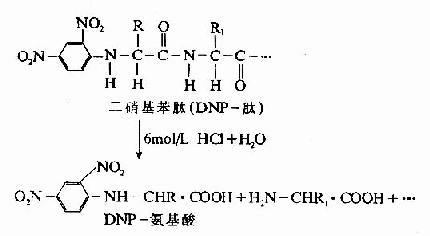
B.氰酸盐法:1963年Stank及Smyth介绍了一种测定N末端的新方法,步骤如下:
由于乙内酰脲氨基酸不带电荷,因此可用离子交换层析法将它与游离氨基酸分开,分离所得的乙内酰脲氨基酸再被盐酸水解,重新生成游离的氨基酸,鉴别此氨基酸即可了解N-末端是何种氨基酸。
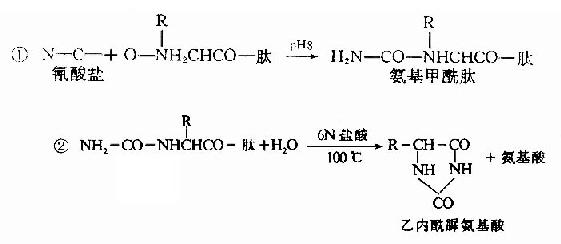
C.二甲基氨基萘磺酰氯法:1956年Hartley等报告了一种测定N-末端的灵敏方法,采用1-二甲基氨基萘-5-磺酰氯,简称丹磺酰氯。它与游离氨基末端作用,方法类似于Sanger的DNFB法,产物是磺酰胺衍生物。
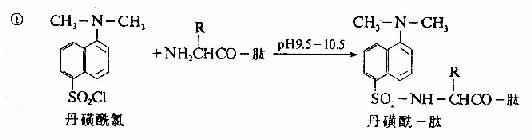
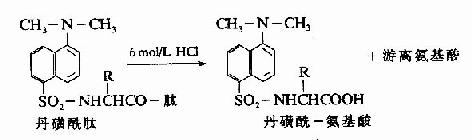
丹磺酰链酸具有强烈的黄色荧光。此法优点为灵敏性较高(比FDNB法提高100倍,样品量小于1毫微克分子)及丹磺酰氨基酸稳定性较高(对酸水解稳定性较DNP氨基酸高),可用纸电泳或聚酰胺薄膜层析鉴定。
(2)C-末端分析
A.肼解法:这是测定C-末端最常用的方法。将多肽溶于无水肼中,100℃下进行反应,结果羧基末端氨基酸以游离氨基酸状释放,而其余肽链部分与肼生成氨基酸肼。
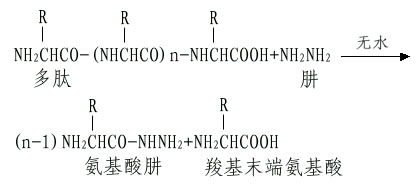
这样羧基末端氨基酸可以采用抽提或离子交换层析的方法将其分出而进行分析。如果羧基末端氨基酸侧链是带有酰胺如天冬酰胺和谷氨酰胺,则肼解时不能产生游离的羧基末端氨基酸。此外肼解时注意避免任何少量的水解,以免释出的氨基酸混淆末端分析。
B.羧肽酶水解法:羧肽酶可以专一性地水解羧基末端氨基酸。根据酶解的专一性不同,可区分为羧肽酶A、B和C。应用羧肽酶测定末端时,需要事先进行酶的动力学实验,以便选择合适的酶浓度及反应时间,使释放出的氨基酸主要是C末端氨基酸。
3)氨基酸组成分析
在进一步分析多肽链的氨基酸顺序之前,首先应了解它是由那几种氨基酸组成的,每种氨基酸有多少?分析组成的方法有:
①层析法
将多肽链完全酸水解成游离氨基酸,然后进行Dansyl标记,聚酰胺薄膜层析,此方法在蛋白质结构分析中是一种超微量的分析术,但此方法用于定量分析尚不够准确。
②离子交换层析法
Spaekman等发展了一种精确的氨基酸组分的定量方法。他们采用磺酸型的离子交换树脂,这是一种高分子量的固体聚苯乙烯,带有大量的功能基团,磺酸基在低pH和低离子强度条件下,根据氨基酸的酸碱性,氨基酸带正电,于是替换下树脂上的Na+,借助静电作用而结合到磺酸基上。
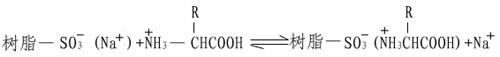
由于各种氨基酸在树脂上的亲和力不同,因此当改变溶液pH和离子强度,便可依次将它们洗脱下来而分开,并进行定量测定。在此基础上发展了氨基酸自动分析仪。随着科学技术的日益进展,氨基酸自动分析仪在样品的用量,分离速度及检测能力上也有了很大的提高。目前最好的仪器样品分析量只要几十Picomole,分析时间只要数十分钟,而且计算全部自动化,给研究蛋白质一级结构带来了极大的方便。
2.多肽链的降解
多肽链的氨基酸组成往往是比较复杂,因此直接分析多肽的氨基酸顺序还是很困难的,多采用将多肽链进一步降解成为更小的片段,然后再行分析。肽键的裂解是一级结构研究工作中的重要问题,它要求裂解点少,选择性强,而且反应产率高,目前主要有化学法和酶解法两类。
1)化学法
(1)溴化氰法 是最理想的化学方法,能选择性断裂甲硫氨酸所在的肽键
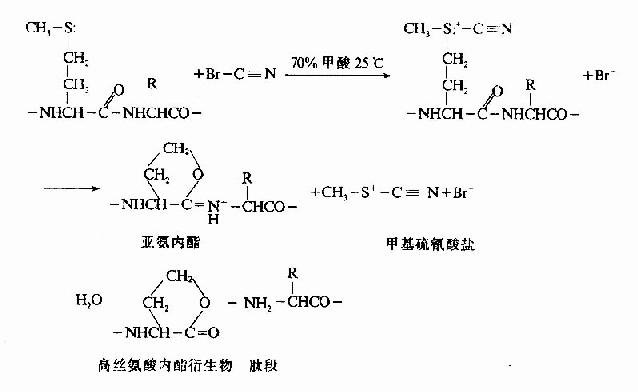
溴化氢化学降解法其优点:
①一般蛋白质含甲硫氨酸较少,由此可获得大片段
②专一性强
③产率高达80%以上
④作用条件温和,在室温中用几到十几小时即可。
(2)部分酸水解法
Sanger在分析胰岛素的一级结构中采用了此法,即用0.1N盐酸在110℃或用6N盐酸在37℃水解。这种部分酸水解的方法特异性不强,因此对大片段的蛋白质和肽均不合适。
(3)羟胺法
这种方法近十年来开始受人注意,羟胺能专一性地裂解AsnGly的肽键,酸性条件下裂解Asn-Pro肽键。已用于某些蛋白质的分析。
(4)N-溴代琥珀酰亚胺法
主要裂解Try处的肽键,五十年代研究较多。但由于它也能断裂TyrHis肽键,因此应用不广。
2)酶解法
酶水解法较化学法具有更多的优越性,使用也更广泛。因其具有较高专一性,而且水解产率较高,所以可以选择各种不同专一性的酶进行专一性的断裂。
常用的酶有胰蛋白酶、糜蛋白酶、胃蛋白酶和嗜热菌蛋白酶。
胰蛋白酶专一断裂Lys,Arg的羧基侧肽键,如果对Lys,Arg,CysH进行化学修饰可改变胰蛋白酶的断裂性质。
(1)赖氨酸的修饰。将Lys用顺丁烯二酸酐或甲基顺丁烯二酸杆修饰,则胰蛋白酶仅使Arg肽键断裂。
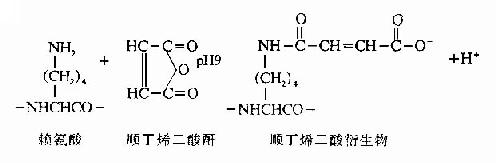
顺丁烯衍生物在中性pH下稳定,胰蛋白酶水解仅使Arg键断裂。在酸性条件下顺丁烯衍生物可脱去封闭,此时再行胰蛋白酶水解,则得赖氨酸为末端的多肽。下述为蛋白质中的赖氨酸,经顺丁烯酰化作用后,被胰蛋白酶水解的例子。
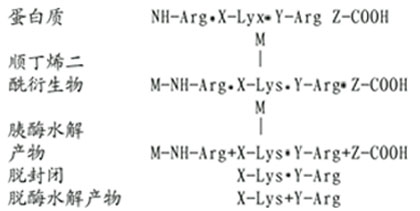
(2)精氨酸的修饰。精氨酸与1,2-和1,3-二羰化合物作用,缩合产物是一杂环化合物,十分稳定。然后胰酶水解仅断裂赖氨酸残基末端的肽键
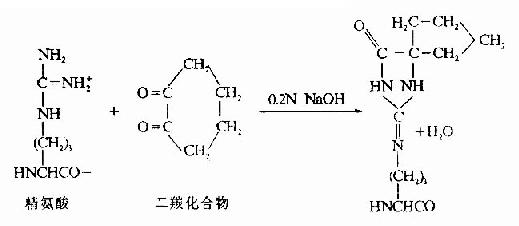
(3)半胱氨酸的修饰。若肽链内Lys、Arg均较少,则为了增加胰酶的裂解点,可以将半胱氨酸进行氨乙基化,其产物Sβ氨乙基半胱氨酸有类似Lys的结构,胰蛋白酶在水解时,不能识别这微细的变化,从而在半胱氨酸处断裂。
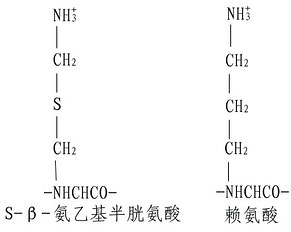
蛋白水解酶的专一性
| 酶 | 米源 | 主要作用点 | 其它作用点 |
| 胰蛋白酶 | 胰 | Arg,Lys | |
| 糜蛋白酶 | 胰 | Tyr,Phe,Trp | Leu,Met,His,Asu,Gln |
| 弹性蛋白酶 | 胰 | Leu,Ile,Ala | 其它等 |
| 胃蛋白酶 | 胃粘膜 | Tyr,Phe,Trp,Met,Len | Ala,Glu,Asp,其它等 |
| 木瓜蛋白酶 | Papayplant木瓜植物 | Arg,Lys,Gly | 其它等 |
| 嗜热菌蛋白酶 | 嗜热解蛋白芽孢杆菌 | Leu,Ile,Phe | Val,Tyr |
| 枯草杆菌蛋白酶 | 枯草杆菌 | 芳香族及脂肪族残基 |
肽链的裂解和重组大致有三种情况:一种是非特异性裂解,如酸水解。由于裂解的片段较小,造成分离的困难。因此这种非特异性裂解对大分子肽链是不适用的。第二种是特异性裂解,采用两种以上的专一裂解,然后进行组合,这种方法一般也适用于分子量小于5万的蛋白质。第三种是逐步的专一裂解,首先将某种氨基酸进行化学修饰,使水解酶专一断裂某一种氨基酸,分成若干片段,然后解除化学封闭,再用此酶裂解,使曾被封闭过的氨基酸断裂。目前倾向于采用这种裂解方式。
3.肽段的分离
大部分肽段的分离主要通过凝胶过滤法,由于大分子肽溶解度小。往往采用甲酸、醋酸、丙酸等有机溶剂使之溶解。单用凝胶过滤法分离之肽一般纯度不高,常需辅以离子交换层析法,大片段肽可用离子交换葡聚糖作载体,小肽则多用Dowex-50等树脂。
小肽分离还常采用高压电泳与层析相结合的指纹图谱法,得到纯净肽。
4.肽的顺序分析
在蛋白质一级结构的测定中,肽的顺序分析是比较重要的一步。肽的顺序分析也有化学法和酶解法两种。
1)化学法Edman降解法
这是目前用于顺序分析的最主要的方法。它的原理是从N端开始,逐步降解。将肽先与异硫氰酸苯酯(PTH试剂)在pH8-9条件下作用,肽的NH2末端接到异硫氰酸苯酯的C原子上生成苯异硫甲氨酰肽,简称PTC肽,在强酸作用下,可使靠近PTC基的氨基酸环化,肽键断裂形成苯氨基噻唑啉酮衍生物和一个失去末端氨基酸的肽链。此肽不被破坏,因而又可出现一个新的N-末端。重复以上的步骤,继续与PTH试剂作用,继续分析,苯氨基噻唑啉酮衍生物很容易由有机溶剂抽提出来进行鉴定。但此衍生物很不稳定,在水中可转化为稳定的乙内酰苯硫脲氨基酸(PTH-氨基酸)。这些步骤通常称为Edman氏逐步降解法。所以可用来测定氨基酸的排列顺序。Edman降解法的优点是样品用量少,灵敏度高。
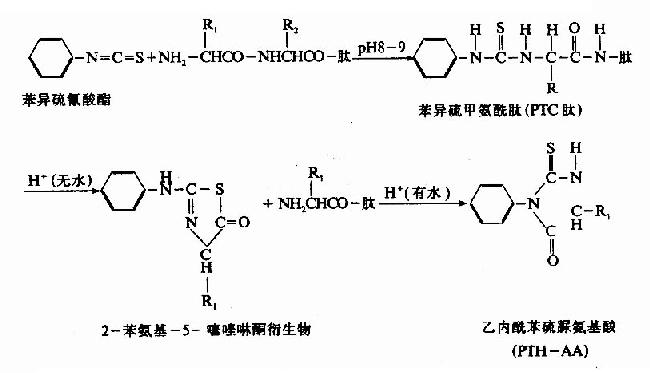
PTH-氨基酸的鉴定可以用各种层析方法,如纸层析、薄层层析、气相层析和质谱法等,现在多用高压液相层析法。虽然此方法具有很多优点,但是由于操作繁琐,工作量大,所以目前有人根据Edman降解的原理作一系列改进。
下面简单介绍几种方法
A.1967年Edman及Begg介绍了一种Edman降解的液相自动分析装置,使顺序分析开始走向自动化。将样品先在反应杯内旋转成薄膜,使之固定。然后与PITC试剂反应。再用有机溶剂多次抽提除去过剩试剂,因而样品易丢失,且仪器昂贵,使用受到限制。
B.1970年Laursen改进为固相氨基酸顺序仪。此法样品用量少,检出灵敏,可分析20?0肽,其原理是将肽共价结合到惰性支持物上,固定后装柱再行Edman降解。
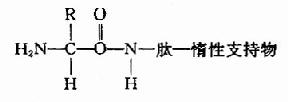
固相顺序仪的惰性支持物有:

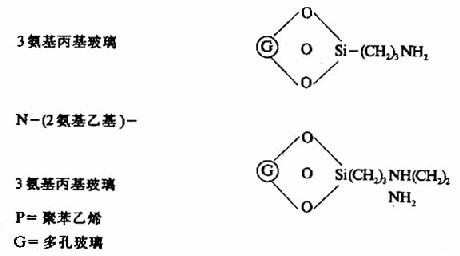
此法成功的关键是肽段的固定,目前采用C端α羧基固定法,重复法高,其中以高丝氨酸内酯法及双异硫氰酯法(DITC)最好,固定率可达90-95%。
C.另外也有从化学反应的角度考虑,试图改进Edman方法。1976年有人将异硫氰酸苯酯的苯基改变为甲氨偶氮苯,试剂为甲氨偶氨苯异硫氰酸盐(简称DABITC)。这是一种有色试剂,产物DABIH氨基酸呈桔黄色,因此鉴定时无需染色,用肉眼即可分辨。此方法灵敏度很高,一次分析小肽段只要几个nanomole样品即可,是目前一种很可取的方法。此外也有人将异硫氰酸酯进行35S标记,使分析样品更向微量化方向发展。
2)酶解法肽谱重迭法
分析肽段也可采用酶解法,利用专一性不同的两种酶将一个肽分别断裂成更小的寡肽,比较两种方法所得之肽段的重复性,进行氨基酸顺序的装配。例如,有一个肽段,通过氨基酸组成分析已知其为十肽,假如先以糜蛋白酶水解,则得到一套寡肽,再以胰蛋白酶水解此十肽,得到另一套寡肽。分析结果如下:
Ala·Phe+Gly·Lys·Asn·Tyr+Arg·Trp+His·Val
糜蛋白酶水解
+肽(Ala·Phe·Gly·Lys·Asn·Tyr·Arg·Trp·His·Val)
胰蛋白酶水解
Ala·Phe·Gly·Lys+Asa·Tyr·Arg+Trp·His·Val
将此两套寡肽可以做分析比较,因为十肽的N末端及C末端已事先测定分别为Ala及Val,因此第一段寡肽必然是Ala,Phe。如此类推如下
| 寡肽号 | 氨基酸组成部分顺序 |
| A-1 | Ala·Pha |
| B-1 | Ala·Phe·Gly·Lys |
| A-2 | Gly·Lys·Asn·Tyr |
| B-2 | Asn·Tyr·Arg |
| A-3 | Arg·Trp |
| B-3 | Trp·His·Val |
| A-4 | His·Val |
| +肽顺序 | Ala·Phe·Gly·Lys·Asn·Tyr·Arg·Trp·His·Val |
水解酶也可运用二肽酶,两组可用同一种酶水解如第一套肽是A桞,C桪,E桭,G桯……第二套肽水解则先将该肽段N端切去一个末位氨基酸,然后再开始二肽酶断裂,结果是A,B桟,D桬,F桮……这样分析比较也可排列出肽段顺序。
5.二硫键定位
蛋白质分子不经任何处理,直接用酶水解,检出其中二硫键的肽段,然后将二硫键拆开,分别测定两个肽的顺序,将此两肽结构与测出的一级结构比较,就能找出相应的二硫键的位置。
含二硫键肽的检出方法。
1)凝胶过滤或离子交换层析:用以分离各肽段,然后用特殊的二硫键显色反应找出含二硫键的肽。
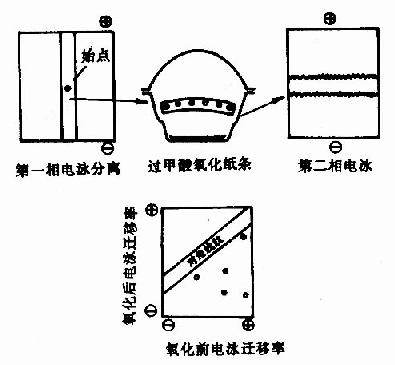
图1-21 对角线电泳技术图解
2)对角线电泳或层析:1966年Brown及Hartlay提出用对角线电泳进行含-S-S-肽的定位,此方法是将水解后的肽混合物进行第一相电泳,样品点在中间,电泳毕,将样品纸条剪下,置于装有过甲酸的器皿中,用过甲酸蒸气处理2小时,使-S-S-断裂,此时含-S-S-肽段的静电荷发生了改变。然后将纸条缝于另一张纸上,进行第二相电泳电泳,电泳条件与第一相相同,只是与第一次方向成直角。在第二相电泳中,那些不含-S-S-的髣民泳情况与第一相相同,因此电泳后各肽斑均坐落在纸的对角线上,而那些含-S-S-的肽由于被氧化,电荷发生变化,第二相电泳速度就与第一相不同,电泳结果这些肽斑就偏离对角线,肽斑可用茚三酮显示。对角线法由于其速度快,操作简便以及能用于小分子样品,是直接分离-S-S-肽的好方法。
含-S-S-肽被分离后,即可进行肽段顺序分析,并与已测定的该蛋白质的一级结构进行比较,即可找出相应的-S-S-位置,至此蛋白质的一级结构基本阐明。
今后蛋白质一级结构的测定正朝自动化、快速化及微量化发展,关键问题仍然是进一步寻找蛋白裂解和肽分离的方法。
蛋白质一级结构的测定不断有新方法和新思路出现,如X衍射法测定一级结构;分离相应蛋白质的mRNA,由mRNA的一级结构排出蛋白质的一级结构等。这些大胆的设想必将有助于蛋白质的一级结构测定,使人们掌握更多的工具和方法去探索生命的奥秘。
第二章 酶(Enzyme)
酶(enzyme)是活细胞内产生的具有高度专一性和催化效率的蛋白质,又称为生物催化剂,生物体在新陈代谢过程中,几乎所有的化学反应都是在酶的催化下进行的。
细胞内合成的酶主要是在细胞内起催化作用,也有些酶合成后释入血液或消化道,并在那里发挥其催化作用,人工提取的酶在合适的条件下也可在试管中对其特殊底物起催化作用。
酶学知识来源于生产实践,我国4千多年前的夏禹时代就酿酒盛行,周朝已开始制醋、酱,并用曲来治疗消化不良。酶的系统研究起始于19世纪中叶对发酵本质的研究。Pasteur提出,发酵离不了酵母细胞。1897年Buchner成功地用不含细胞的酵母液实现发酵,说明具有发酵作用的物质存在于细胞内,并不依赖活细胞。1926年Sumner首次提取出脲酶,并进行结晶,提出酶的本质是蛋白质。现已有二千余种酶被鉴定出来,其中有二百余种得到结晶,特别是近三十年来,随着蛋白质分离技术的进步,酶的分子结构、酶作用机理的研究得到发展,有些酶的结构和作用机理已被阐明。总之,随着酶学理论不断深入,必将对揭示生命本质研究作出更大的贡献。
第一节 酶的作用特点
酶是生物催化剂(biological catalyst),具有两方面的特性,既有与一般催化剂相同的催化性质,又具有一般催化剂所没有的生物大分子的特征。
酶与一般催化剂一样,只能催化热力学允许的化学反应,缩短达到化学平衡的时间,而不改变平衡点。酶作为催化剂在化学反应的前后没有质和量的改变。微量的酶就能发挥较大的催化作用。酶和一般催化剂的作用机理都是降低反应的活化能(activation energy)。
因为酶是蛋白质,所以酶促反应又固有其特点:
1.高度的催化效率
一般而论,酶促反应速度比非催化反应高107?020倍,例如,反应
H2O2+H2O2→2H2O+O2
在无催化剂时,需活化能18,000卡/克分子;胶体钯存在时,需活化能11,700卡/克分子;有过氧化氢酶(catalase)存在时,仅需活化能2,000卡/克分子以下。
2.高度的专一性
一种酶只作用于一类化合物或一定的化学键,以促进一定的化学变化,并生成一定的产物,这种现象称为酶的特异性或专一性(specificity)。受酶催化的化合物称为该酶的底物或作用物(substrate)。
酶对底物的专一性通常分为以下几种:
(1)绝对特异性(absolutespecifictity)
有的酶只作用于一种底物产生一定的反应,称为绝对专一性,如脲酶(urease),只能催化尿素水解成NH3和CO2,而不能催化甲基尿素水解。
(2)相对特异性(relativespecificity)
一种酶可作用于一类化合物或一种化学键,这种不太严格的专一性称为相对专一性。如脂肪酶(lipase)不仅水解脂肪,也能水解简单的酯类;磷酸酶(phosphatase)对一般的磷酸酯都有作用,无论是甘油的还是一元醇或酚的磷酸酯均可被其水解。
(3)立体异构特异性(stereopecificity)
酶对底物的立体构型的特异要求,称为立体异构专一性或特异性。如α-淀粉酶(α-amylase)只能水解淀粉中α-1,4-糖苷键,不能水解纤维素中的β-1,4-糖苷键;L-乳酸脱氢酶(L-lacticacid dehydrogenase)的底物只能是L型乳酸,而不能是D型乳酸。酶的立体异构特异性表明,酶与底物的结合,至少存在三个结合点。
3.酶活性的可调节性
酶是生物体的组成成份,和体内其他物质一样,不断在体内新陈代谢,酶的催化活性也受多方面的调控。例如,酶的生物合成的诱导和阻遏、酶的化学修饰、抑制物的调节作用、代谢物对酶的反馈调节、酶的别构调节以及神经体液因素的调节等,这些调控保证酶在体内新陈代谢中发挥其恰如其分的催化作用,使生命活动中的种种化学反应都能够有条不紊、协调一致地进行。
4.酶活性的不稳定性
酶是蛋白质,酶促反应要求一定的pH、温度等温和的条件,强酸、强碱、有机溶剂、重金属盐、高温、紫外线、剧烈震荡等任何使蛋白质变性的理化因素都可能使酶变性而失去其催化活性。
第二节 酶的分类和命名
一、酶的分类
国际酶学委员会(I.E.C)规定,按酶促反应的性质,可把酶分成六大类:
1.氧化还原酶类(oxidoreductases)指催化底物进行氧化还原反应的酶类。例如,乳酸脱氢酶、琥珀酸脱氢酶、细胞色素氧化酶、过氧化氢酶等。
2.转移酶类(transferases)指催化底物之间进行某些基团的转移或交换的酶类。如转甲基酶、转氨酸、己糖激酶、磷酸化酶等。
3.例如、淀粉酶、蛋白酶、脂肪酶、磷酸酶等。
4.裂解酶类(lyases)指催化一个底物分解为两个化合物或两个化合物合成为一个化合物的酶类。例如柠檬酸合成酶、醛缩酶等。
5.异构酶类(isomerases)指催化各种同分异构体之间相互转化的酶类。例如,磷酸丙糖异构酶、消旋酶等。
6.合成酶类(连接酶类,ligases)指催化两分子底物合成为一分子化合物,同时还必须偶联有ATP的磷酸键断裂的酶类。例如,谷氨酰胺合成酶、氨基酸:tRNA连接酶等。
二、酶的命名
(一)习惯命名法
1.一般采用底物加反应类型而命名,如蛋白水解酶、乳酸脱氢酶、磷酸己糖异构酶等。
2.对水解酶类,只要底物名称即可,如蔗糖酶、胆硷酯酶、蛋白酶等。
3.有时在底物名称前冠以酶的来源,如血清谷氨酸-丙酮酸转氨酶、唾液淀粉酶等。
习惯命名法简单,应用历史长,但缺乏系统性,有时出现一酶数名或一名数酶的现象。
(二)系统命名法
鉴于新酶的不断发展和过去文献中对酶命名的混乱,国际酶学委员会规定了一套系统的命名法,使一种酶只有一种名称。它包括酶的系统命名和4个数字分类的酶编号。例如对催化下列反应酶的命名。
ATP+D—葡萄糖→ADP+D—葡萄糖-6-磷酸
该酶的正式系统命名是:ATP:葡萄糖磷酸转移酶,表示该酶催化从ATP中转移一个磷酸到葡萄糖分子上的反应。它的分类数字是:E.C.2.7.1.1,E.C代表按国际酶学委员会规定的命名,第1个数字(2)代表酶的分类名称(转移酶类),第2个数字(7)代表亚类(磷酸转移酶类),第3个数字(1)代表亚亚类(以羟基作为受体的磷酸转移酶类),第4个数字(1)代表该酶在亚-亚类中的排号(D葡萄糖作为磷酸基的受体)。
第三节 酶的分子组成和化学结构
一、酶的分子组成
根据酶的组成成份,可分单纯酶和结合酶两类。
单纯酶(simpleenzyme)是基本组成单位仅为氨基酸的一类酶。它的催化活性仅仅决定于它的蛋白质结构。脲酶、消化道蛋白酶、淀粉酶、酯酶、核糖核酸酶等均属此列。
结合酶(conjugatedenzyme)的催化活性,除蛋白质部分(酶蛋白apoenzyme)外,还需要非蛋白质的物质,即所谓酶的辅助因子(cofactors),两者结合成的复合物称作全酶(holoenzyme),即:
| 全酶 | =酶 蛋 白 | + 辅助因子 |
| (结合蛋白质) | (蛋白质部分) | (非蛋白质部分) |
酶的辅助因子可以是金属离子,也可以是小分子有机化合物。常见酶含有的金属离子有K+、Na+、Mg2+、Cu2+、(或Cu+)、Zn2+和Fe2+(或Fe3+)等。它们或者是酶活性的组成部分;或者是连接底物和酶分子的桥梁;或者在稳定酶蛋白分子构象方面所必需。小分子有机化合物是些化学稳定的小分子物质,其主要作用是在反应中传递电子、质子或一些基团,常可按其与酶蛋白结合的紧密程度不同分成辅酶和辅基两大类。辅酶(coenzyme)与酶蛋白结合疏松,可以用透析或超滤方法除去;辅基(prostheticgroup)与酶蛋白结合紧密,不易用透析或超滤方法除去,辅酶和辅基的差别仅仅是它们与酶蛋白结合的牢固程度不同,而无严格的界限。
现知大多数维生素(特别是B族维生素)是组成许多酶的辅酶或辅基的成分(见表2-1)。它们的化学结构式见生物氧化章。体内酶的种类很多,而辅酶(基)的种类却较少,通常一种酶蛋白只能与一种辅酶结合,成为一种特异的酶,但一种辅酶往往能与不同的酶蛋白结合构成许多种特异性酶。酶蛋白在酶促反应中主要起识别底物的作用,酶促反应的特异性、高效率以及酶对一些理化因素的不稳定性均决定于酶蛋白部分。
表2-1 B族维生素及其辅酶形式
| B族维生素 | 辅酶形式 | 主要作用 |
| 硫胺素(B1) | 硫胺素焦磷酸酯(TPP) | α-酮酸氧化脱羧酮基转换作用 |
| 硫辛酸 | 6,8-二硫辛酸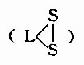 |
α-酮酸氧化脱羧 |
| 泛酸 | 辅酶A(CoA) | 酰基转换作用 |
| 核黄素(B2) | 黄素单核苷酸(FMN) 黄素腺嘌呤二核苷酸(FAD) |
氢原子转移 氢原子转移 |
| 尼克酰胺(PP) | 尼克酰胺腺嘌呤二核苷酸(NAD+) 尼克酰胺腺嘌呤二核苷酸磷酸(NADP+) |
氢原子转移 氢原子转移 |
| 吡哆素(B6) | 磷酸吡哆醛 | 氨基酸代谢 |
| 生物素(H) | 生物素 | 羧化作用 |
| 叶酸 | 四氢叶酸 | “一碳基团”转移 |
| 钴胺素(B12) | 5-甲基钴铵素 5-脱氧腺苷钴铵素 |
甲基转移 |
二、酶的分子结构和活性中心
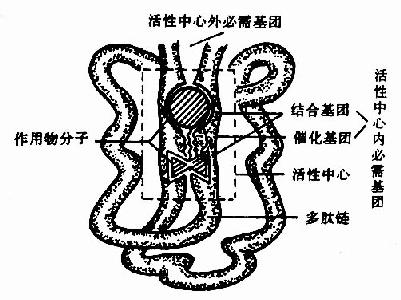
图2-1 酶活性中心示意图
酶的分子中存在有许多功能基团例如,-NH2、-COOH、-SH、-OH等,但并不是这些基团都与酶活性有关。一般将与酶活性有关的基团称为酶的必需基团(essentialgroup)。有些必需基团虽然在一级结构上可能相距很远,但在空间结构上彼此靠近,集中在一起形成具有一定空间结构的区域,该区域与底物相结合并将底物转化为产物,这一区域称为酶的活性中心(active center),对于结合酶来说,辅酶或辅基上的一部分结构往往是活性中心的组成成分。
构成酶活性中心的必需基团可分为两种,与底物结合的必需基团称为结合基团(binding group),促进底物发生化学变化的基团称为催化基团(catalyticgroup)。活性中心中有的必需基团可同时具有这两方面的功能。还有些必需基团虽然不参加酶的活性中心的组成,但为维持酶活性中心应有的空间构象所必需,这些基团是酶的活性中心以外的必需基团。
酶分子很大,其催化作用往往并不需要整个分子,如用氨基肽酶处理木瓜蛋白酶,使其肽链自N端开始逐渐缩短,当其原有的180个氨基酸残基被水解掉120个后,剩余的短肽仍有水解蛋白质的活性。又如将核糖核酸酶肽链C末端的三肽(棻麠丝楃?切断,余下部分也有酶的活性,足见某些酶的催化活性仅与其分子的一小部分有关。
不同的酶有不同的活性中心,故对底物有严格的特异性。例如乳酸脱氢酶是具有立体异构特异性的酶,它能催化乳酸脱氢生成丙酮酸的可逆反应:
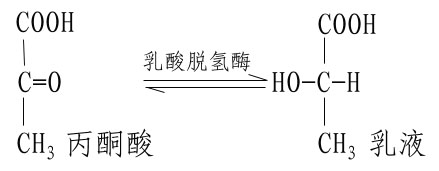
L(+)乳酸通过其不对称碳原子上的桟H3、桟OOH及桹H基分别与乳酸脱氢酶活性中心的A、B及C三个功能基团结合,故可受酶催化而转变为丙酮酸。而D(-)乳酸由于桹H、桟OOH的空间位置与L(+)乳酸相反,与酶的三个结合基团不能完全配合,故不能与酶结合受其催化(图2)。由此可见,酶的特异性不但决定于酶活性中心的功能基团的性质,而且还决定于底物和活性中心的空间构象,只有那些有一定的化学结构,能与酶的结合基团结合,而且空间构型又完全适应的化合物,才能作为酶的底物。
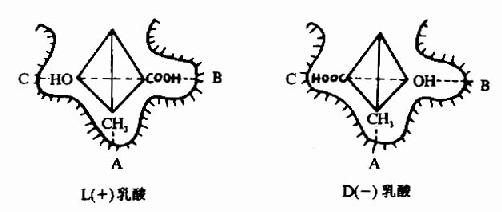
图2-2 乳酸脱氢酶的立体异构特异性
A、B、C分别为LDH活性中心的三个功能基团
但是,酶的结构不是固定不变的,有人提出酶分子(包括辅酶在内)的构型与底物原来并非吻合,当底物分子与酶分子相碰时,可诱导酶分子的构象变得能与底物配合,然后底物才能与酶的活性中心结合,进而引起底物分子发生相应化学变化,此即所谓酶作用的诱导契合学说(induced fit theory)。用X衍射分析的方法已证明,酶在参与催化作用时发生了构象变化。
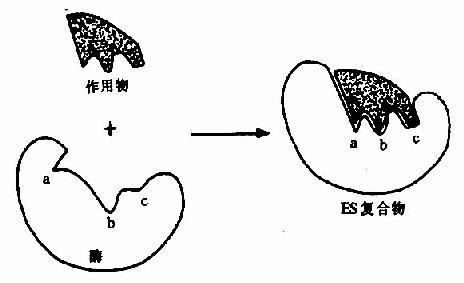
图2-3 底物与酶相互作用的“诱导契合”模式图
第四节 酶的作用机理
一、酶作用在于降低反应活化能
在任何化学反应中,反应物分子必须超过一定的能阈,成为活化的状态,才能发生变化,形成产物。这种提高低能分子达到活化状态的能量,称为活化能。催化剂的作用,主要是降低反应所需的活化能,以致相同的能量能使更多的分子活化,从而加速反应的进行。
酶能显着地降低活化能,故能表现为高度的催化效率(图2?)。例如前述的H2O2酶的例子,可以显着地看出,酶能降低反应活化能,使反应速度增高千百万倍以上。
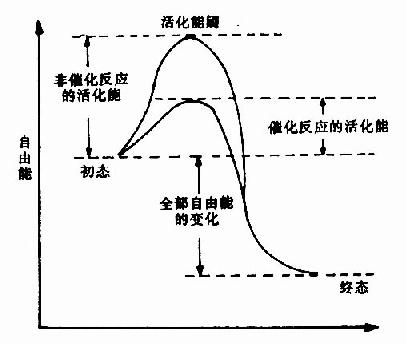
图2-4 非催化过程和催化过程自由能的变化
二、中间复合物学说
目前一般认为,酶催化某一反应时,首先在酶的活性中心与底物结合生成酶-底物复合物,此复合物再进行分解而释放出酶,同时生成一种或数种产物,此过程可用下式表示:
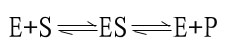
上式中E代表酶,S代表底物,ES代表酶椀孜锔春衔?中间产物),P代表反应产物。由于ES的形成速度很快,且很不稳定,一般不易得到ES复合物存在的直接证据。但从溶菌酶结构的研究中,已制成它与底物形成复合物的结晶,并得到了X线衍射图,证明了ES复合物的存在。
ES的形成,改变了原来反应的途径,可使底物的活化能大大降低,从而使反应加速。
三、酶作用高效率的机理
详细机制仍不太清楚,主要有下列四种因素:
1.趋近效应(approximation)和定向效应(oientation)
酶可以将它的底物结合在它的活性部位由于化学反应速度与反应物浓度成正比,若在反应系统的某一局部区域,底物浓度增高,则反应速度也随之提高,此外,酶与底物间的靠近具有一定的取向,这样反应物分子才被作用,大大增加了ES复合物进入活化状态的机率(图2-5)。
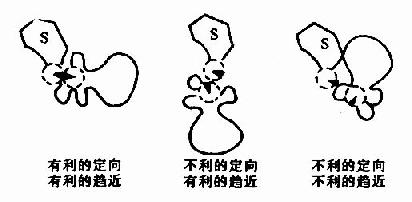
图2-5 底物分子和酶活性中心上的一个催化基团在相互作用时的趋近效应
2.张力作用(distortion or strain)
底物的结合可诱导酶分子构象发生变化,比底物大得多的酶分子的三、四级结构的变化,也可对底物产生张力作用,使底物扭曲,促进ES进入活性状态(图2-6)。

图2-6 酶的活性中心诱导契合使底物分子扭曲
3.酸碱催化作用(acid-base catalysis)
酶的活性中心具有某些氨基酸残基的R基团,这些基团往往是良好的质子供体或受体,在水溶液中这些广义的酸性基团或广义的碱性基团对许多化学反应是有力的催化剂。
| 某些质子供体基团 | 某些受子体基团 |
| -COOH | -COO- |
| -NH+3 | -NH2 |
| -SH | -S- |
 |
|
4.共价催化作用(covalent catalysis)
某些酶能与底物形成极不稳定的、共价结合的ES复合物,这些复合物比无酶存在时更容易进行化学反应。
例如:无酶催化的反应 RX+H2O→ROH+Hx慢
有酶存在时 RX+E桹H→ROH+EX快
EX+H2O→E桹H+HX快
第五节 酶促反应的动力学
酶促反应动力学(kineticsof enzyme-catalyzed reactions)是研究酶促反应速度及其影响因素的科学。这些因素主要包括酶的浓度、底物的浓度、pH、温度、抑制剂和激活剂等。在研究某一因素对酶促反应速度的影响时,应该维持反应中其它因素不变,而只改变要研究的因素。但必须注意,酶促反应动力学中所指明的速度是反应的初速度,因为此时反应速度与酶的浓度呈正比关系,这样避免了反应产物以及其他因素的影响。
酶促反应动力学的研究有助于阐明酶的结构与功能的关系,也可为酶作用机理的研究提供数据;有助于寻找最有利的反应条件,以最大限度地发挥酶催化反应的高效率;有助于了解酶在代谢中的作用或某些药物作用的机理等,因此对它的研究具有重要的理论意义和实践意义。
一、酶浓度对反应速度的影响
在一定的温度和pH条件下,当底物浓度大大超过酶的浓度时,酶的浓度与反应速度呈正比关系(图2-7)。
二、底物浓度对反应速度的影响
在酶的浓度不变的情况下,底物浓度对反应速度影响的作用呈现矩形双曲线(rectangular hyperbola)(图2-8)。
 |
 |
| 图2-7 酶浓度对反应初速度的影响 | 图2-8 底物浓度对反应初速度的影响 |

在底物浓度很低时,反应速度随底物浓度的增加而急骤加快,两者呈正比关系,表现为一级反应。随着底物浓度的升高,反应速度不再呈正比例加快,反应速度增加的幅度不断下降。如果继续加大底物浓度,反应速度不再增加,表现为0级反应。此时,无论底物浓度增加多大,反应速度也不再增加,说明酶已被底物所饱和。所有的酶都有饱和现象,只是达到饱和时所需底物浓度各不相同而已。
(一)米曼氏方程式
解释酶促反应中底物浓度和反应速度关系的最合理学说是中间产物学说。酶首先与底物结合生成酶椀孜锔春衔?中间产物),此复合物再分解为产物和游离的酶。
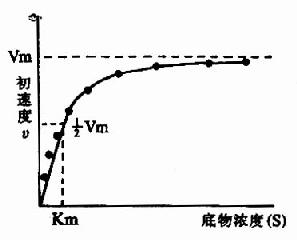
Michaelis和Menten在前人工作的基础上,经过大量的实验,1913年前后提出了反应速度和底物浓度关系的数学方程式,即著名的米椔戏匠淌?michaelismenten equation).
V=Vmax[S]/Km+[S]
Vmax指该酶促反应的最大速度,[S]为底物浓度,Km是米氏常数,V是在某一底物浓度时相应的反应速度。当底物浓度很低时,[S]《Km,则V≌Vmax/Km[S],反应速度与底物浓度呈正比。当底物浓度很高时,[S]》Km,此时V≌Vmax,反应速度达最大速度,底物浓度再增高也不影响反应速度(图2-9)。
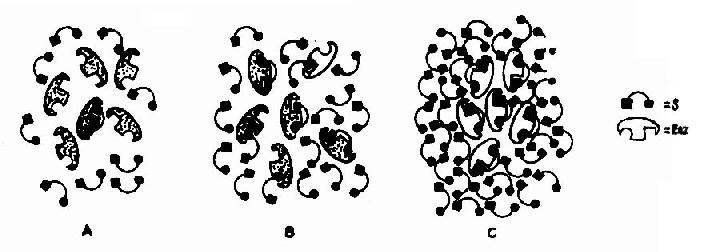
图2-9 酶与不同浓度的底物相互作用模式
(二)米-曼氏方程式的推导
米-曼氏方程式提出后又经riggs和Haldane的充实和发展,经补充和发展的米-曼氏方程工推导如下:
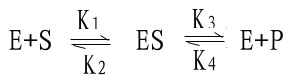 (1)
(1)
式中K1、K2、K3、K4分别为各向反应的速度常数。
从式(1)中知,ES的生成途径来自E+S和E+P,但其中E+P生成ES的速度极小(尤其在起始阶段,P的生成很少),可以忽略不计,又因为底物浓度大大超过酶的浓度,[S]》[E],中间产物ES中的S浓度可以忽略不计,因此,ES的生成速度为:
| d[ES] | = | K1([Et]-[ES])·[S] | (2) |
| dt |
其中[Et]-[ES]为游离酶的浓度,ES的分解速度为:
| - | [ES] | = | K2[ES]+K3[ES]=(K2+K3)[ES] | (3) |
| dt |
当反应体系处于稳态时,ES生成和分解的速度相等,即
K1([Et]-[ES])·[S]=(K2+K3)[ES]
| K2+K3 | = | [Et]-[ES] | ·[S] |
| K1 | [ES] |
令K2+K3/K1=Km 则 Km=[Et]-[ES]/[ES]·[S]
[ES]=[Et][S]/Km+[S] (4)
由于反应速度取决于产物P的生成量,故
V=K3[ES (5)
在酶促反应达最大速度时,所有的酶分子都已与底物结合形成中间产物,此时
[Et]=[ES] (6)
那么 Vmax=K3[Et] (7)
在(4)式两边乘以K3得:
K3·[ES]=K3·[Et][S]/Km+[S] 以(5)和(7)式代入,即:
V=Vmax[S]/Km+[S]
(三)米氏常数的意义
当反应速度为最大速度一半时,米氏方程可以变换如下:
½Vmax=Vmax[S]/Km+[S]
进一步整理可得到:
Km=[S]
可知,Km值等于酶反应速度为最大速度一半时的底物浓度。
因为Km=K2+K3/K1,当K2》K3,即ES解离成E和S的速度大大超过分离成E和P的速度时,K3可以忽略不计,此时Km值近似于ES解离常数KS,此时Km值可用来表示酶对底物的亲和力。
Km=K2/K1=[E][S]/[ES]=KS
Km值愈大,酶与底物的亲和力愈小;Km值愈小,酶与底物亲和力愈大。酶与底物亲和力大,表示不需要很高的底物浓度,便可容易地达到最大反应速度。但是KS值并非在所有酶促反应中都远小于K2,所以Ks值(又称酶促反应的底物常数)和Km值的涵义不同,不能互相代替使用。
Km值是酶的特征性常数,只与酶的性质,酶所催化的底物和酶促反应条件(如温度、pH、有无抑制剂等)有关,与酶的浓度无关。酶的种类不同,Km值不同,同一种酶与不同底物作用时,Km值也不同。各种酶的Km值范围很广,大致在10-1~10-6M之间。
当K3不远远小于K2和K1时,Km表示整个反应的化学平衡的常数。
如果Km值已知,任何底物浓度时酶的饱和度(形成中间产物的酶占总酶的比例,saturation fraction fEs)fEs便可计算出来。
fES=[ES]/[Et]=K3[ES]/K3[Et]=V/Vmax=[S]/Km+[S]
(四)Km和Vmax的求法
如图2?所示,底物浓度曲线是矩形双曲线。
从图中很难精确地测出Km和Vmax。为此人们将米氏方程进行种种变换,将曲线作图转变成直线作图。
1.双倒数作图(doublereciprocal plot or LineweaverBurk plot)
将米氏方程两边取倒数,可转化为下列形式:
1/V=Km/Vmax·1/[S]+1/Vmax
从图2-10可知,1/V对1/[S]的作图得一直线,其斜率是Km/V,在纵轴上的截距为1/Vmax,横轴上的截距为-1/Km。此作图除用来求Km和Vmax值外,在研究酶的抑制作用方面还有重要价值。
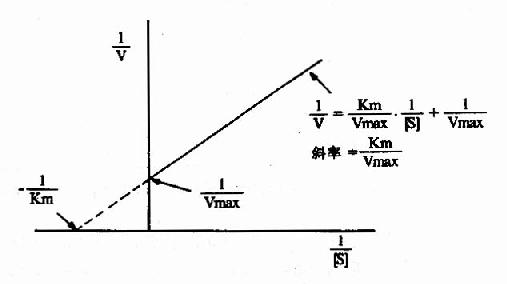
图2-10 双倒数作图法
![v对v/[s]作图法](/lilunshuji/shengwuhuaxueyufenzishengwuxue/shengwuhuaxueyufenzishengwuxue072.jpg)
图2-11 v对v/[s]作图法
2.V对V〖〗[S][SX)]法(EadieHofstee plot)
将米氏方程经移项整理后可写成
VKm+V[S]=Vm[S]
V[S]=Vm[S]-VKm
故V=Vm-KmV/[S]
以V为纵坐标对V/[S]横坐标作图,所得直线,其纵轴的截距为Vmax,斜率为Km(图2-11)。
必须指出米氏方程只适用于较为简单的酶作用过程,对于比较复杂的酶促反应过程,如多酶体系、多底物、多产物、多中间物等,还不能全面地籍此概括和说明,必须借助于复杂的计算过程。
三、pH对反应速度的影响
酶反应介质的pH可影响酶分子,特别是活性中心上必需基团的解离程度和催化基团中质子供体或质子受体所需的离子化状态,也可影响底物和辅酶的解离程度,从而影响酶与底物的结合。只有在特定的pH条件下,酶、底物和辅酶的解离情况,最适宜于它们互相结合,并发生催化作用,使酶促反应速度达最大值,这种pH值称为酶的最适pH(optimum pH)。它和酶的最稳定pH不一定相同,和体内环境的pH也未必相同。
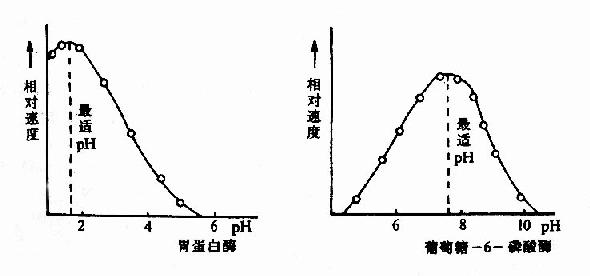
图2-12 胃蛋白酶和葡萄糖-6-磷酸酶的pH活性曲线
动物体内多数酶的最适pH值接近中性,但也有例外,如胃蛋白酶的最适pH约1.8,肝精氨酸酶最适pH约为9.8(见表2-2)。
表2-2 一些酶的最适pH
| 酶 | 最适pH | 酶 | 最适pH | 酶 | 最适pH |
| 胃蛋白酶 | 1.8 | 过氧化氢酶 | 7.6 | 延胡索酸酶 | 7.8 |
| 胰蛋白酶 | 7.7 | 精氨酸酶 | 9.8 | 核糖核酸酶 | 7.8 |
最适pH不是酶的特征性常数,它受底物浓度、缓冲液的种类和浓度以及酶的纯度等因素的影响。
溶液的pH值高于和低于最适pH时都会使酶的活性降低,远离最适pH值时甚至导致酶的变性失活。测定酶的活性时,应选用适宜的缓冲液,以保持酶活性的相对恒定。
四、温度对反应速度的影响
化学反应的速度随温度增高而加快。但酶是蛋白质,可随温度的升高而变性。在温度较低时,前一影响较大,反应速度随温度升高而加快,一般地说,温度每升高10℃,反应速度大约增加一倍。但温度超过一定数值后,酶受热变性的因素占优势,反应速度反而随温度上升而减缓,形成倒V形或倒U形曲线。在此曲线顶点所代表的温度,反应速度最大,称为酶的最适温度(optimum temperature)(图2-13)。
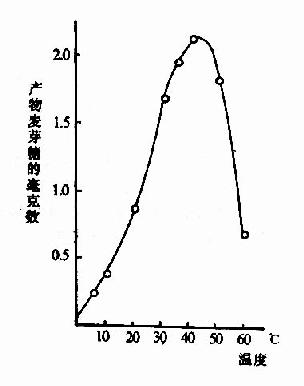
图2-13 温度对唾液淀粉酶活性影响
从动物组织提取的酶,其最适温度多在35℃~40℃之间,温度升高到60℃以上时,大多数酶开始变性,80℃以上,多数酶的变性不可逆。酶的活性虽然随温度的下降而降低,但低温一般不破坏酶。温度回升后,酶又恢复活性。临床上低温麻醉就是利用酶的这一性质以减慢组织细胞代谢速度,提高机体对氧和营养物质缺乏的耐受体,有利于进行手术治疗。
酶的最适温度不是酶的特征性常数,这是因为它与反应所需时间有关,不是一个固定的值。酶可以在短时间内耐受较高的温度,相反,延长反应时间,最适温度便降低。
五、抑制剂对反应速度的影响
凡能使酶的活性下降而不引起酶蛋白变性的物质称做酶的抑制剂(inhibitor)。使酶变性失活(称为酶的钝化)的因素如强酸、强碱等,不属于抑制剂。通常抑制作用分为可逆性抑制和不可逆性抑制两类。
(一)不可逆性抑制作用(irreversibleinhibition)
不可逆性抑制作用的抑制剂,通常以共价键方式与酶的必需基团进行不可逆结合而使酶丧失活性,按其作用特点,又有专一性及非专一性之分。
1.非专一性不可逆抑制
抑制剂与酶分子中一类或几类基团作用,不论是必需基团与否,皆可共价结合,由于其中必需基团也被抑制剂结合,从而导致酶的失活。某些重金属(Pb++、Cu++、Hg++)及对氯汞苯甲酸等,能与酶分子的巯基进行不可逆适合,许多以巯基作为必需基团的酶(通称巯基酶),会因此而遭受抑制,属于此种类型。用二巯基丙醇(british antilewisite,BAL)或二巯基丁二酸钠等含巯基的化合物可使酶复活。
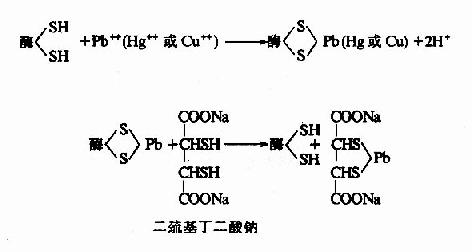
2.专一性不可逆抑制
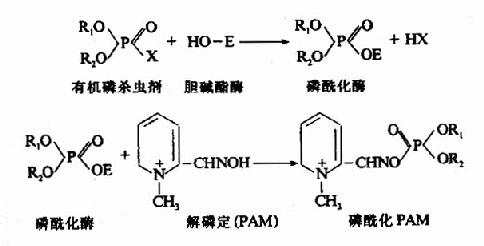
此属抑制剂专一地作用于酶的活性中心或其必需基团,进行共价结合,从而抑制酶的活性。有机磷杀虫剂能专一作用于胆碱酯酶活性中心的丝氨酸残基,使其磷酰化而不可逆抑制酶的活性。当胆碱酯酶被有机磷杀虫剂抑制后,胆碱能神经末稍分泌的乙酰胆碱不能及时分解,过多的乙酰胆碱会导致胆碱能神经过度兴奋的症状。解磷定等药物可与有机磷杀虫剂结合,使酶和有机磷杀虫剂分离而复活。
(二)可逆性抑制(reversible inhibition)
抑制剂与酶以非共价键结合,在用透析等物理方法除去抑制剂后,酶的活性能恢复,即抑制剂与酶的结合是可逆的。这类抑制剂大致可分为以下二类。
1.竞争性抑制(competitive inhibition)
(1)含义和反应式
抑制剂I和底物S对游离酶E的结合有竞争作用,互相排斥,已结合底物的ES复合体,不能再结合I。同样已结合抑制剂的EI复合体,不能再结合S。
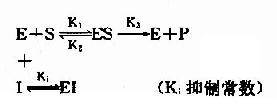
抑制剂I在化学结构上与底物S个相似,能与底物S竞争酶E分子活性中心的结合基团,因此,抑制作用大小取决于抑制剂与底物的浓度比,加大底物浓度,可使抑制作用减弱。
例如,丙二酸、苹果酸及草酰乙酸皆和琥珀酸的结构相似,是琥珀酸脱氢酶的竞争性抑制剂。
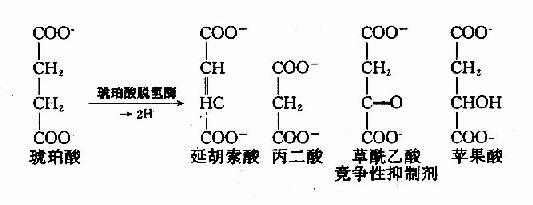
(2)反应速度公式及作图
按米氏公式推导方法,也可演算出竞争性抑制时,抑制剂、底物和反应速度之间的动力学关系及其双倒数方程式为:
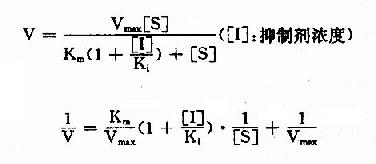
以1V分别为横坐标和纵坐标作图,此方程式可绘成竞争性抑制作用的特性曲线(图2-14)。
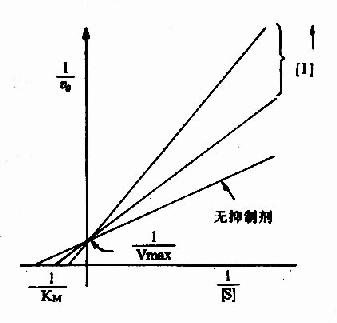
图 2-14 竞争性抑制
有竞争性抑制剂存在的曲线与无抑制剂的曲线相交于纵坐标I/Vmax处,但横坐标的截距,因竞争性抑制存在变小,说明该抑制作用,并不影响酶促反应的最大速度,而使Km值变大。
很多药物都是酶的竞争性抑制剂。例如磺胺药与对氨基苯甲酸具有类似的结构(如图2-15),而对氨基苯甲酸、二氢喋呤及谷氨酸是某些细菌合成二氢叶酸的原料,后者能转变为四氢叶酸,它是细菌合成核酸不可缺少的辅酶。由于磺胺药是二氢叶酸合成酶的竞争性抑制剂,进而减少菌体内四氢叶酸的合成,使核酸合成障碍,导致细菌死亡。抗菌增效剂-甲氧苄氨嘧啶(TMP)能特异地抑制细菌的二氢叶酸还原为四氢叶酸,故能增强磺胺药的作用。
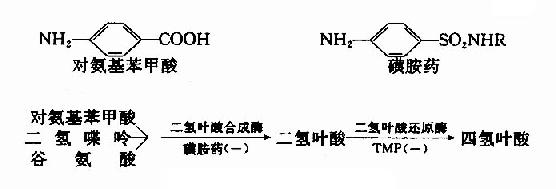
图2-15 磺胺药物的抑菌作用
2.非竞争性抑制(non-competitive inhibition)
(1)含义和反应式
抑制剂I和底物S与酶E的结合完全互不相关,既不排斥,也不促进结合,抑制剂I可以和酶E结合生成EI,也可以和ES复合物结合生成ESI。底物S和酶E结合成ES后,仍可与I结合生成ESI,但一旦形成ESI复合物,再不能释放形成产物P。
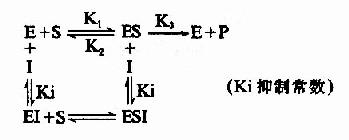
I和S在结构上一般无相似之处,I常与酶分子上结合基团以外的化学基团结合,这种结合并不影响底物和酶的结合,增加底物浓度并不能减少I对酶的抑制程度。
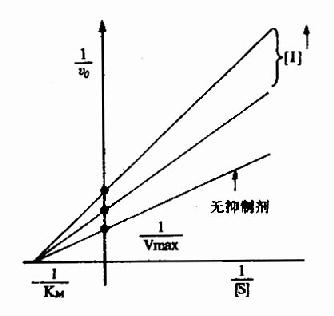
图2-16 非竞争性抑制
(2)反应速度公式及作图
按米氏公式推导方法可演算出非竞争性抑制时,抑制剂、底物浓度和反应速度之间动力学关系:
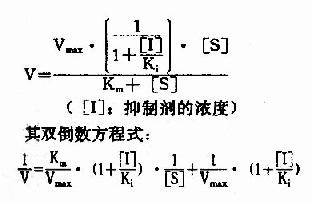
以1V分别为横坐标和纵坐标作图,此方程式可绘成非竞争性抑制作用的特性曲线(图2-16)。
有非竞争性抑制剂存在的曲线与无抑制剂存在的曲线相交于横坐标-1/Km处,纵坐标截距,因非竞争性抑制剂的存在而变大,说明该抑制作用,并不影响底物与酶的亲和力,而使酶促最大反应速度变小。
如赖氨酸是精氨酸酶的竞争性抑制剂,而中性氨基酸(如丙氨酸)则是非竞争性抑制剂。
总上所述,酶的竞争性和非竞争性抑制可通过双倒数作图加以区别。Vmax不因竞争性抑制剂的存在而改变,Km则不因非竞争性抑制剂的存在而改变。
六、激活剂对酶促反应速度的影响
能使酶活性提高的物质,都称为激活剂(activator),其中大部分是离子或简单的有机化合物。如Mg++是多种激酶和合成酶的激活剂,动物唾液中的α-淀粉酶则受Cl-的激活。
第六节 酶在体内存在的几种主要形式
一、酶原
有些酶在细胞内合成时,或初分泌时,没有催化活性,这种无活性状态的酶的前身物称为酶原(zymogen)。酶原向活性的酶转化的过程称为酶原的激活。酶原激活实际上是酶的活性中心形成或暴露的过程。
胃蛋白酶、胰蛋白酶、胰糜蛋白酶、羧基肽酶、弹性蛋白酶在它们初分泌时都是以无活性的酶原形式存在,在一定条件下(表2?)才转化成相应的酶。
表2-3 某些酶原的激活过程
| 酶原 | 激活条件 | 活化的酶 | 水解掉的肽段 | |
| 胃蛋白酶原 | 胃蛋白酶 | + | 六个多肽片段 | |
| 胰蛋白酶原 | 胰蛋白酶 | + | 六肽 | |
| 糜蛋白酶原A | α-糜蛋白酶 | + | 两个二肽 | |
| 羧基肽酶原A | 羧基肽酶A | + | 几个碎片 | |
| 弹性蛋白酶原 | 弹性蛋白酶 | + | 几个碎片 |
例如,胰蛋白酶原进入小肠后,受肠激酶或胰蛋白酶本身的激活,第6位赖氨酸与第7位异亮氨酸残基之间的肽键被切断,水解掉一个六肽,酶分子空间构象发生改变,产生酶的活性中心,于是胰蛋白酶原变成了有活性的胰蛋白酶(图2-17)。
除消化道的蛋白酶外,血液中有关凝血和纤维蛋白溶解的酶类,也都以酶原的形式存在。
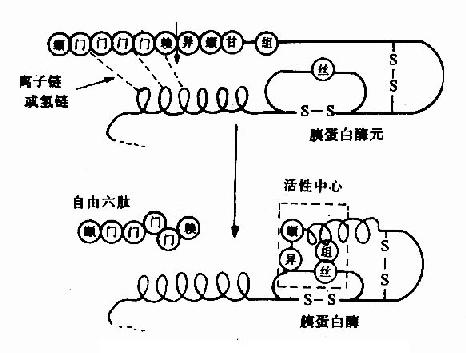
图2-17 胰蛋白酶原激活示意图
酶原激活的生理意义在于避免细胞内产生的蛋白酶对细胞进行自身消化,并可使酶在特定的部位和环境中发挥作用,保证体内代谢的正常进行。
二、同工酶
同工酶(isoenzyme)是指催化的化学反应相同,酶蛋白的分子结构、理化性质乃至免疫学性质不同的一组酶。这类酶存在于生物的同一种属或同一个体的不同组织、甚至同一组织或细胞中。
现已发现有数种同工酶。如6磷酸葡萄糖脱氢酶、乳酸脱氢酶、酸性和碱性磷酸酶、谷丙转氨酶和谷草转氨酸、肌酸磷酸激酶、核糖核酸酶、过氧化酶和胆碱酯酶等。其中乳酸脱氢酶最为大家所熟悉,乳酸脱氢酶(LDH)有五种同工酶,它们的分子量在130,000~150,000范围内,都由四个亚基组成。LDH的亚基可以分为两型:骨骼肌型(M型)和心肌型(H型)。M、H亚基的氨基酸组成有差别,可用电泳分离。其免疫抗体无交叉反应。两种亚基以不同比例组成五种四聚体即为一组LDH同工酶LDH1(H4)、LDH2(H3M)、LDH3(H2M2)、LDH4(HM3)和LDH5(M4)。电泳时都移向正极,其速度以LDH1为最快,依次递减,以LDH5为最慢。若用12M尿素或5M盐酸胍溶液处理,M亚基和H亚基可以分开,但此时LDH无酶的活性。
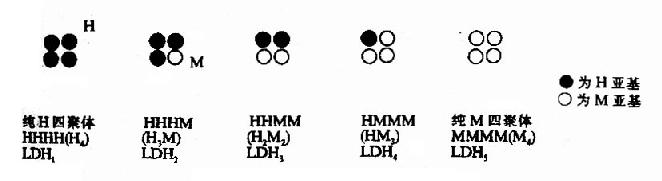
图2-18 LDH同工酶结构模式图
LDH同工酶的两种不同肽链是受不同基因控制产生的。不同类型的LDH同工酶在不同

图2-19人体某些组织中乳酸脱氢酶同工酶电泳示意图
组织中的比例不同(图2?9),心肌中以LDH1及LDH2较为丰富,骨骼肌及肝中含LDH5及LDH4较多。这都与它们的生理功能关。LDH1和LDH2对乳酸亲和力高,易使乳酸脱氢氧化生成丙酮酸,后者进一步氧化可释放出能量供心肌活动的需要;LDH5与LDH4对丙酮酸的亲和力高,而使它得氢还原成乳酸,这对保证肌肉在短暂缺氧时仍可获得能量有关(见糖代谢章)。
在临床检验方面,通过观测病人血清中LDH同工酶的电泳图谱,辅助诊断哪些器官组织发生病变,这远较单纯测定血清LDH总活性的方法敏感。例如,心肌受损病人血清LDH1含量上升,肝细胞受损者血清LDH5含量增高。
三、变构酶
1.概念
有些酶除了活性中心外,还有一个或几个部位,当特异性分子非共价地结合到这些部位时,可改变酶的构象,进而改变酶的活性,酶的这种调节作用称为变构调节(allosteric regulation),受变构调节的酶称变构酶(allostericenzyme),这些特异性分子称为效应剂(effector)。变构酶分子组成,一般是多亚基的,分子中凡与底物分子相结合的部位称为催化部位(catalytic site),凡与效应剂相结合的部位称为调节部位(regulatorysite),这二部位可以在不同的亚基上,或者位于同一亚基。
2.机理
(1)一般变构酶分子上有二个以上的底物结合位点。当底物与一个亚基上的活性中心结合后,通过构象的改变,可增强其他亚基的活性中心与底物的结合,出现正协同效应(positivecooperative effect)。使其底物浓度曲线呈S形。即底物浓度低时,酶活性的增加较慢,底物浓度高到一定程度后,酶活性显著加强,最终达到最大值Vmax(图2-20)。
多数情况下,底物对其变构酶的作用都表现正协同效应,但有时,一个底物与一个亚基的活性中心结合后,可降低其他亚基的活性中心与底物的结合,表现负协同效应(negative cooperative effect)。如3-磷酸甘油醛脱氢酶对NAD+的结合为负协同效应。
(2)变构酶除活性中心外,存在着能与效应剂作用的亚基或部位,称调节亚基(或部位),效应剂与调节亚基以非共价键特异结合,可以改变调节亚基的构象,进而改变催化亚基的构象,从而改变酶活性。凡使酶活性增强的效应剂称变构激活剂(allosteric activitor),它能使上述S型曲线左移,饱和量的变构激活剂可将S形曲线转变为矩形双曲线(图2?0)。凡使酶活性减弱的效应剂称变构抑制剂(allosteric inhibitor),能使S形曲线右移。例如,ATP是磷酸果糖激酶的变构抑制剂,而ADP、AMP为其变构激活剂。
(3)由于变构酶动力学不符合米-曼氏酶的动力学,所以当反应速度达到最大速度一半时的底物的浓度,不能用Km表示,而代之以K0.55表示(图2-20)。为了解释变构酶协同效应的机制并推导出动力学曲线方程式,不少人曾提出各种模型,各有优缺点,现将有关变构作用的Hill模式内容附本章节后,供学习参考。
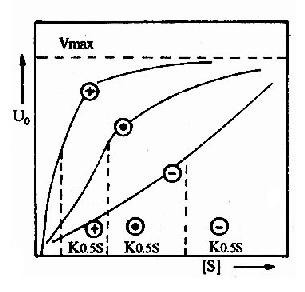
图2-20 变构酶的底物活性曲线
⊙不加变构剂![]() 加变构抑制剂
加变构抑制剂
3.生理意义
(1)在变构酶的S形曲线中段,底物浓度稍有降低,酶的活性明显下降,多酶体系催化的代谢通路可因此而被关闭;反之,底物浓度稍有升高,则酶活性迅速上升,代谢通路又被打开,因此可以快速调节细胞内底物浓度和代谢速度。
(2)变构抑制剂常是代谢通路的终产物,变构酶常处于代谢通路的开端,通过反馈抑制,可以及早地调节整个代谢通路,减少不必要的底物消耗。
例如葡萄糖的氧化分解可提供能量使AMP、ADP转变成ATP,当ATP过多时,通过变构调节酶的活性,可限制葡萄糖的分解,而ADP、AMP增多时,则可促进糖的分解。随时调节ATP/ADP的水平,可以维持细胞内能量的正常供应。
四、修饰酶
体内有些酶可在其他酶的作用下,将酶的结构进行共价修饰,使该酶活性发生改变,这种调节称为共价修饰调节(covalent modification regulation),这类酶称为修饰酶(prosessingenzyme)。
例如某些酶的巯基发生可逆的氧化还原,一些酶以共价键与磷酸、腺苷等基团的可逆结合,都会引起酶结构的变化而呈现不同的活性。酶的共价修饰是体内代谢调节的另一重要的方式。
五、多酶复合体
多酶复合体(multienzymecomplex)常包括三个或三个以上的酶,组成一个有一定构型的复合体。复合体中第一个酶催化的产物,直接由邻近下一个酶催化,第二个酶催化的产物又为复合体第三酶的底物,如此形成一条结构紧密的“流水生产线”,使催化效率显着提高。葡萄糖氧化分解过程的丙酮酸脱氢酶复合体,属于多酶复合体(详见糖代谢章)。
参考资料
别构机制的模式
为了解释别构酶协同效应的机制并推导出动力学曲线的方程式,不少人曾提出过各种模式,各有优缺点,现在主要把Hill模式叙述如下:
Hill模式
在协同结合模式中最早的一种是Hill在1909年提出的,企图解释氧结合至血红蛋白的S形饱和曲线,现称为Hill模式,后来经Atkinson应用于别构酶反应,他设想在这个系统中,n分子的配体(S)能够一步结合到酶上去:
![]()
即此反应的总解离常数(K's)由下式决定
| K'S=[E][S]n/[ESS] | (6-7) |
而酶的饱和分数
| YS=每分子酶蛋白上已结合的底物分子数/每分子酶蛋白上底物结合位点的总数 | (6-8) |
又因总的酶浓度[E0]=[E]+[ES0]
| 故 YS=[ESn]/[E0]=[ESn]/[ESn]+[E] | (6-9) |
合并式6-7和式6-9,消去[ESn],则
| YS=[S]n/K'S+[S]n | (6-10) | ||
| YSK'S+YS[S]n=[S]n, | |||
| YSK'S=(1-Y)[S]n | (6-11) | ||
| Ys/1-Ys=[S]n/K'S | (6-11) | ||
| log | YS | =nlog[S]-logK'S | (6-13) |
| 1-YS | |||
因此以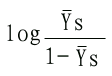 对log[S]作图的话,可得斜率为n,纵轴截距为-logK'S的直线(见下图)。
对log[S]作图的话,可得斜率为n,纵轴截距为-logK'S的直线(见下图)。
因v=k0[ESu],Vm=k0[E0],故
| (6-14) |
将式6-10代入式6-14,即得
| [S]n/K'S+[S]n=v/Vm | |
| Vm[S]n=K'Sv+v[S]n | (6-15) |
| (Vm-v)[S]n=K'Sv | (6-16) |
| v/Vm-v=[S]n/K'S | (6-17) |
| logv/Vm-v=nlog[S]-logK'S | (6-18) |
式6-13或6-18即为Hill方程式,式6-18如以logv/Vm-v对log[S]作图,也可得一直线(见下图)。
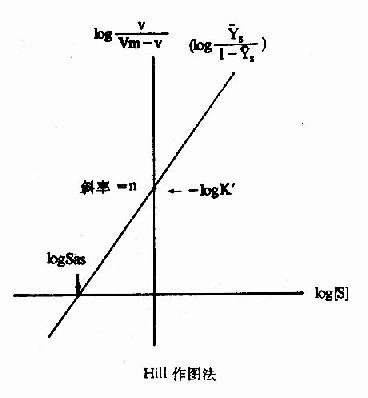
Hill作图法
如v=Vm/2时,式6-19为log1=nlog[S]-logK'S=0(6-19)
此时的[S]即S0.5,故nlogS0.5=logK'5(6-20)式6-18所得的直线斜率为n,纵轴截距为-logk'S,而横轴截距为logK'S/n,即log[S]0.5,但[S0.5]也可在已知logK'S后通过式6?0求取。
上节已述及,S0-5就相当于米曼氏动力学中的Km,当K0《k-1/k1时,可反映别构酶对底物的亲和力,S0.5愈小,亲和力愈大,而K's实际上已与亲和力关系不大,因受到n的影响。故反映底物亲和力的参数,已从非别构酶的Km一项移到别构酶的[S]一项,并且式6?0可看出K'S是随[S]而改变的,不是一个常数。由于K'S的测定是假设V=(1/2)Vm或[S]=S0.5的条件下计算的,故有些作者用S0.5S,来代表别构酶的K'5,以免与Km混淆。
Hill作图法的斜率n,称为Hill系数,即前述的协同系数,一般可用nH或h代表。当nH=1时,式6-1变为V=Vm[S]/(K1+[S]),即米曼氏方程式,表示无协同作用,此时K'或S0.5S,=S0-5=Km,至于nH>1为正协同,nH<1为负协同。
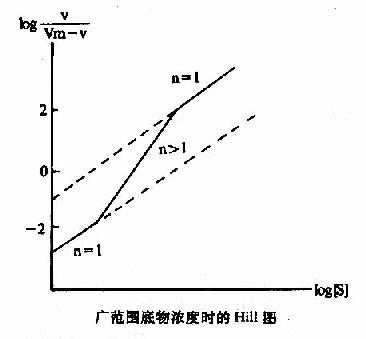
Hill模式比较简单,式6-1或式6-10都是S形曲线方程式,但有不少缺点:(1)按理,Hill系数应等于酶分子中可能有结合底物的位点数,但因忽略了ESn-1,ESn-2…ES1等中间形式的酶底物复合体,根据Hill氏作图计算出来的n值一般均低于真实的位点数。以别构蛋白Hb为例,理论上每分子Hb可结合四分子氧,即n=4,但计算结果n=2.6~2.8。在负协同效应时,每分子酶也结合n个底物(n>1)但计算结果却是n<1。故Hill系数已不能代表结合底物的位点数,而只能作为底物协同性的指标。(2)在S浓度过高(酶90%以上被S饱和)或过低(酶仅10%以下被S饱和)时,Hill线的斜率n常等于1,故当测定别构酶活力时,[S]的范围较广,得出的Hill线不是直线而是折线(见下图)。(3)n分子的底物同时和酶作用,反应的级数为n+1,如n-4则为五级反应,这在动力学上是不可能的。但尽管如此,Hill作图法仍不失是一个求取别构酶S0.5和鉴定协同类型及协同作用大小的常用方法。
广范围底物浓度时的Hill图
第三章 维生素(Vitamins)
维生素是维持人和动物机体健康所必须的一类营养素,本质为低分子有机化合物,它们不能在体内合成,或者所合成的量难以满足机体的需要,所以必须由食物供给。维生素的每日需要量甚少(常以毫克或微克计),它们既不是构成机体组织的原料,也不是体内供能的物质,然而在调节物质代谢、促进生长发育和维持生理功能等方面却发挥着重要作用,如果长期缺乏某种维生素,就会导致疾病(avitaminosis)。
维生素的种类很多,通常按其溶解性分为脂溶性维生素和水溶性维生素两大类。
脂溶性维生素包括:
维生素A(视黄醇retinol)
维生素D(钙化醇calciferol)
维生素E(生育酚tocopherol)
维生素K(凝血维生素)
水溶性维生素包括:
维生素B复合体,其中有:
维生素B1(硫胺素thiamine)
维生素B2(核黄素riboflavin)
维生素PP(尼克酸及尼克酰胺nicotinic acid and nicotinamide)
维生素B6(吡哆醇pyndoxine及其醛、胺衍生物)
泛酸(遍多酸pantothenic acid)
生物素(biotin)
硫辛酸(lipoic acid)
叶酸(folic acid)
维生素B12(钴胺素cobalamin)
维生素C(抗坏血酸ascorbic acid)
维生素P(通透性维生素)
第一节 脂溶性维生素
脂溶性维生素中以维生素A和D在营养上更为重要,缺少他们将分别引起维生素A或D缺乏病。维生素E缺乏病仅在动物实验时观察到,至于维生素K,因肠道细菌可以合成它,所以人类维生素K缺乏病多系吸收障碍或因长期使用抗生素或维生素K的代谢拮抗药(metabolic antagonists)所致。
一、化学特点
1.维生素A
维生素A是由β-白芷酮环和两分子2-甲基丁二烯构成的不饱和一元醇。一般所说维生素A系指A1而言,存在于哺乳动物和咸水鱼肝脏中。在淡水鱼肝油中尚发现另一种维生素A,称为A2,其生理效用仅及A1的40%。从化学结构上比较,维生素A2在β-白芷酮环上比A1多一个双键。
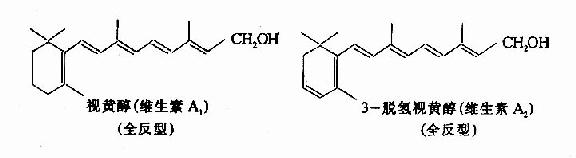
维生素A的侧链含有4个双链,故可形成多种顺反异构体,其中较重要的有全反型(AⅡ-trans)和Ⅱ-顺型(11-cis)。视黄醇在体内可被氧化成视黄醛(retinal),此反应是可逆的。
视黄醛进一部被氧化则成视黄酸(retinoicacid),但此反应在体内是不可逆的。
视黄醇是黄色片状结晶,通常与脂肪酸形成酯存在于食物中。不论是维生素A1或A2都可与三氯化锑起反应,呈现深兰色。这种性质可用于测定维生素A。
维生素A的化学性质活泼,易被空气氧化而失去生理作用,紫外线照射亦可使之破坏,故维生素A的制剂应装在棕色瓶内避光贮存。
维生素A只存在于动物性食品(肝、蛋、肉)中,但是在很多植物性食品如胡萝卜、红辣椒、菠菜、芥菜等有色蔬菜中也含有具有维生素A效能的物质,例如各种类胡萝卜素(carotenoid),其中最重要者为β-胡萝卜素(β-carotene)。
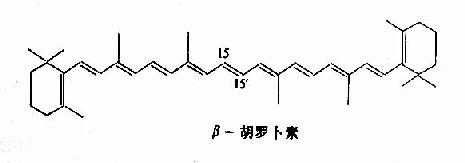
β-胡萝卜素可被小肠粘膜或肝脏中的加氧酶(β-胡萝卜素-15,15′-加氧酶)作用转变成为视黄醇,所以又称做维生素A元(provitamin A)。尽管理论上1分子β-胡萝卜素可以生成2分子维生素A,但由于胡萝卜素的吸收不良,转变有限,所以实际上6微克β-胡萝卜素才具有1微克维生素A的生物活性。
食物中的维生素A酯在小肠受酯酶的作用而水解,所产生的脂肪酸和维生素A进入小肠上皮细胞后又重新合成维生素A酯,并掺入乳糜微粒,通过淋巴转运,贮存于肝脏。肝脏中的维生素A可应机体需要向血中释放。血浆中的维生素A是非酯化型的。它与视黄醇结合蛋白(RBP)结合而被转运。食物中的类胡萝卜素经小肠吸收后主要在小肠粘膜转变为维生素A,一部分也可在肝脏中进行此种转变。
2.维生素D
维生素D系固醇类的衍生物,人体内维生素D主要是由7-脱氢胆固醇经紫外线照射而转变,称为维生素D3或胆钙化醇(cholecalciferol)。植物中的麦角固醇经紫外线照射后可产生另一种维生素D,称为维生素D2或钙化醇。
两种维生素D具有同样的生理作用。人体主要从动物食品中获取一定量的维生素D3(它常与维生素A共同存在),而植物中的麦角固醇除非经过紫外线照射(转变为维生素D2),否则很难被人体吸收利用。然而,正常成人所需要的维生素D主要来源于7-脱氢胆固醇的转变。7-脱氢胆固醇存在于皮肤内,它可由胆固醇脱氢产生,也可直接由乙酰CoA合成。人体每日可合成维生素D3200?00国际单位(1国际单位=0.025微克维生素D3),因此只要充分接受阳光照射,即完全可以满足生理需要。
不论维生素D2或D3,本身都没有明显的生理活性,它们必须在体内进行一定的代谢转化,才能生成活性的化合物,即活性维生素D。(参阅第十八章)
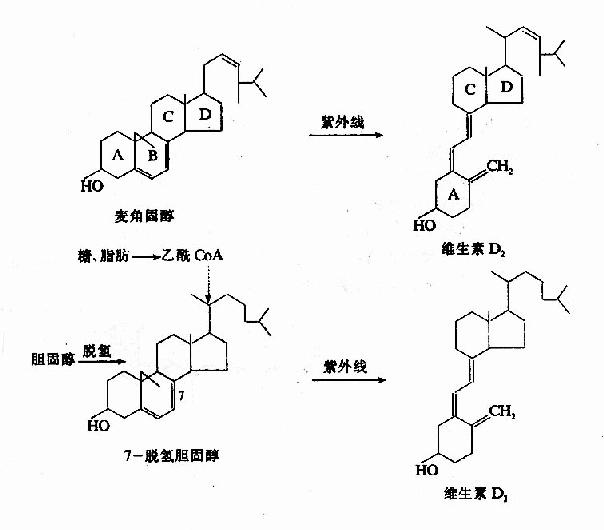
图3-1 维生素D2和D3的生成
维生素D2及D3均为无色针状结晶,易溶于脂肪和有机溶剂,除对光敏感外,化学性质一般较稳定。
3.维生素E
维生素E又称为生育酚,已经发现的生育酚有α、β、γ和δ四种,其中以α-生育酚的生理效用最强。它们都是苯骈二氢吡喃的衍生物。α-生育酚的结构如下:
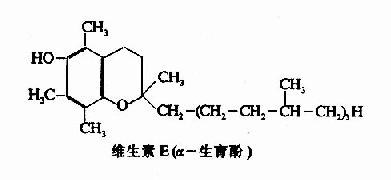
维生素E为油状物,具有特异的紫外吸收光谱(295nm波长处),在无氧状况下能耐高热,并对酸和碱有一定抗力,但对氧却十分敏感,是一种有效的抗氧化剂。维生素E被氧化后即失效。
4.维生素K
维生素K是2-甲基1,4-萘醌的衍生物,自然界已发现的有两种,存于绿叶植物中者为维生素K1,肠道细菌合成者为维生素K2,它们的结构如下。
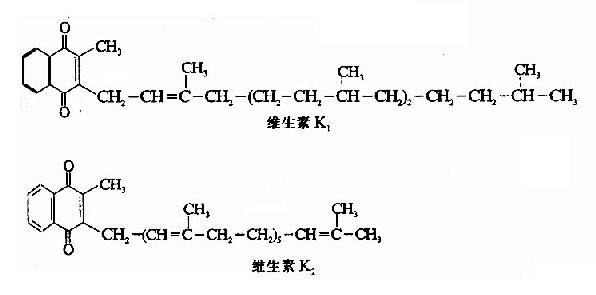 1,4-萘醌即具有维生素K的作用,尤以2-甲基1,4-萘醌的作用最强,为天然维生素K效力的三倍,但其毒性较大。2-甲基1,4-萘醌又称维生素K3,水溶性,可以人工合成,现在药用维生素K多为其还原性衍生物或亚硫酸钠盐。
1,4-萘醌即具有维生素K的作用,尤以2-甲基1,4-萘醌的作用最强,为天然维生素K效力的三倍,但其毒性较大。2-甲基1,4-萘醌又称维生素K3,水溶性,可以人工合成,现在药用维生素K多为其还原性衍生物或亚硫酸钠盐。
二、生理作用
1.维生素A维生素A的生理作用主要表现在以下三个方面。
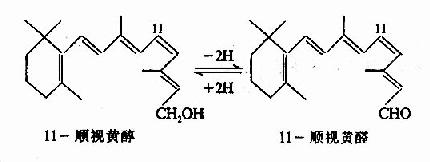
(1)构成视网膜的感光物质,即视色素。已知维生素A的缺乏主要影响暗视觉,与暗视觉有关的是视网膜杆状细胞中所含的视紫红质(visual purple,又名rhodopsin)。视紫红质是由维生纱A的醛衍生物(视黄醛)与蛋白质结合生成的、视蛋白与视黄醛的结合要求后者具有一定的构型,体内只有11-顺位的视黄醛才能与视蛋白结合,此种结合反应需要消耗能量并且只在暗处进行,因为视紫红质遇光则易分解。视紫红质对弱光非常敏感,甚至一个光量子即可诱发它的光化学反应,导致其最终分解成视蛋白和全反位视黄醛。
视紫红质
↓
前光视紫红质
↓
光视紫红质
↓
间视紫红质Ⅰ
↓
间视紫红质Ⅱ
↓
视蛋白+全反位视黄醛
因为在此过程中视紫红质分解而退色,所以又叫做“漂白”(bleaching)、视紫红质的漂白是放能反应,通过视杆细胞外段特有的结构,能量转换为神经冲动,引起视觉。由于视紫红质的分解,残留在视网膜内的视紫红质的量甚少,若不及时再合成,则视网膜就不能再感受弱光的刺激,此时在光线弱的暗处就看不见物体了。然而,由视紫红质分解所产生的全反位视黄醛可以经还原、异构转变为11-顺位视黄醇,并进一步又氧化成11-顺视黄醛。这样,在暗处11-顺视黄醛又可与视蛋白结合再生成视紫红质,如下图所示。
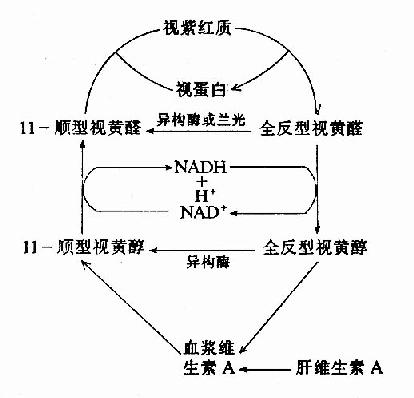
图3-2 视紫红质的合成、分解与视黄醛的关系
人们从强光下转而进入暗处,起初看不清物体,但稍停一会儿,由于在暗处视紫红质的合成增多,分解减少,杆细胞内视紫红质含量逐渐积累,对弱光的感受性加强,便又能看清物体,这一过程称为暗适应(dark adaptation)。从上图可以看出,当维生素A缺乏时,11-顺视黄醛得不到足够的补充,杆细胞内视紫红质的合成减弱,暗适应的能力下降,可致夜盲(nightblindness),祖国医学称此症状为“雀目”。
(2)维持上皮结构的完整与健全
维生素A是维持一切上皮组织健全所必需的物质,缺乏时上皮干燥、增生及角化,其中以眼、呼吸道、消化道、泌尿道及生殖系统等的上皮影响最为显著。在眼部,由于泪腺上皮角化,泪液分泌受阻,以致角膜、结合膜干燥产生干眼病(xerophthalmia),所以维生素A又称为抗干眼病维生素。皮脂腺及汗腺角化时,皮肤干燥,毛囊周围角化过度,发生毛囊丘疹与毛发脱落。由于上皮组织的不健全,机体抵抗微生物侵袭的能力降低,容易感染疾病。
(3)促进生长、发育
缺乏维生素A时,儿童可出现生长停顿、骨骼成长不良和发育受阻。在缺乏维生素A的雌性大鼠则出现排卵减少,影响生殖。
维生素A如何维持上皮组织的健全和促进儿童和幼小动物的生长、发育其机理尚未完全阐明。近年来的研究表明,维生素A(视黄醇)及其衍生物视黄酸可影响上皮细胞的分化过程。缺乏维生素A则培养中的上皮细胞趋向于分化为复层鳞状上皮,而向培养基中添加维生素A则减弱此种表型的表达,刺激粘液分泌上皮的形成。再从分子机制上探讨则发现维生素A具有类固醇激素样的作用,通过与细胞内受体结合,形成复合物转位于细胞核内,启动某种基因的转录和促进某种蛋白质的合成(参看代谢调节一章)。此种作用已在角质细胞的角蛋白合成和胚胎癌细胞的Ⅳ型胶原蛋白合成中得到证实。视黄酸还有促进胚胎的正常发育和分化以及对抗促癌剂(promoters)的作用。然而,有人认为维生素A的抗癌作用不在于它的对基因表达的调整,而是与它对细胞表面的作用有关。已知维生素A可促进糖蛋白的合成,特别是作为细胞表面受体的糖蛋白和纤维粘连蛋白(fibronectin)的合成。癌变细胞其表面因缺乏纤维粘连蛋白而丧失正常粘附能力,此缺陷可被维生素A所逆转。维生素A还使细胞表面上的EGF受体(上皮生长因子受体)数目增加,通过促进EGF与细胞的结合而促进生长。
2.维生素D
维生素D能促进小肠对食物中钙和磷的吸收,维持血中钙和磷的正常含量,促进骨和齿的钙化作用,详见第18章钙磷代谢。
3.维生素E
维生素E与动物生殖机能有关,雌性动物缺少维生素E则失去正常生育能力,一般虽能受孕,但由于子宫机能障碍,易引起胎儿死亡及吸收、导致流产。在雄性动物缺少维生素E则睾丸生殖上皮发生退行性变,伴有输精管萎缩,精子退化,尾部消失,丧失活动力。在人类单纯由于缺少维生素E而发生的病尚属罕见,但在临床上它可作为药物使用,治疗某些习惯性流产,有时能收到一定效果。
实验研究表明,维生素E有稳定不饱和脂肪酸的作用,缺少维生素E则体内脂肪组织中的不和脂肪酸易于被过氧化物氧化而聚合,此种过氧化物聚合物一方面使得皮下脂肪熔点升高,刺激组织引起病变,形成硬皮症,另一方面它对神经、肌肉及血管等组织亦起着有害作用,动物缺少维生素E则其横纹肌萎缩或瘫痪,肌纤维甚至可以坏死。维生素E对脂肪代谢和肌肉代谢的调节作用是与它本身的化学性质相关的。因为维生素E对氧非常敏感,是一种强有力的抗氧化剂,可以降低组织的氧化速度。当它与不饱和脂肪酸共存时则可防止后者被过氧化物氧化。同样,肠道内或肝脏内的维生素A亦可因维生素E之存在而减少其被氧化破坏。维生素E的此种抗氧化剂作用常应用来保存维生素A制剂和各种食用油脂。
此外,维生素E尚能促进与生物氧化有关的辅酶Q(参与第6章)的合成。
4.维生素K
维生素K可以促进肝脏合成多种凝血因子,因而促进血液凝固,详见第14章。
第二节 水溶性维生素
一、维生素B复合体
维生素B复合体是一个大家族(维生素B族),至少包括十余种维生素。其共同特点是:①在自然界常共同存在,最丰富的来源是酵母和肝脏;②从低等的微生物到高等动物和人类都需要它们作为营养要素;③同其他维生素比较,B族维生素作为酶的辅基而发挥其调节物质代谢作用,了解得更为清楚;④从化学结构上看,除个别例外,大都含氮;⑤从性质上看此类维生素大多易溶于水,对酸稳定,易被碱破坏。
除上述共性外,各个维生素尚有其特点,为了叙述方便,现将B族中各个维生素按其化学特点和生理作用归纳为以下三组。
(一)硫胺素、硫辛酸、生物素及泛酸
硫胺素(即维生素B1)因其结构中有含S的噻唑环与含氨基的嘧啶环故名,其纯品大多以盐酸盐或硫酸盐的形式存在。盐酸硫胺素为白色结晶,有特殊香味,在水中溶解度较大,在碱性溶液中加热极易分解破坏,而在酸性溶液中虽加热到120℃也不被破坏。氧化剂及还原剂均可使其失去作用,硫胺素经氧化后转变为脱氢硫胺素(又称硫色素thiochrome),它在紫外光下呈兰色荧光,可以利用此特性来检测生物组织中的维生素B1或进行定量测定。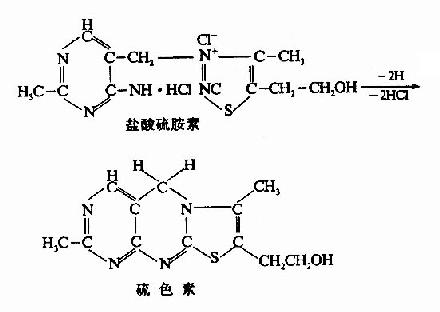
维生素B1易被小肠吸收,在肝脏中维生素B1被磷酸化成为焦磷酸硫胺素(TPP,又称辅羧酶),它是体内催化a-酮酸氧化脱羧的辅酶,也是磷酸戊糖循环中转酮基酶的辅酶(参看糖代谢)。当维生素B1缺乏时,由于TPP合成不足,丙酮酸的氧化脱羧发生障碍,导致糖的氧化利用受阻。在正常情况下,神经组织的能量来源主要靠糖的氧化供给,所以维生素B1缺乏首先影响神经组织的能量供应,并伴有丙酮酸及乳酸等在神经组织中的堆积,出现手足麻木、四肢无力等多发性周围神经炎的症状。严重者引起心跳加快、心脏扩大和心力衰竭,临床上称为脚气病(beriberi),因此又称维生素B1为抗脚气病维生素。
维生素B1尚有抑制胆碱酯酶(choline esterase)的作用,胆碱酯酶能催化神经递质-乙酰胆碱(acetylcholine)水解,而乙酰胆碱与神经传导有关。因此,缺乏维生素B1时,由于胆碱酯酶活性增强,乙酰胆碱水解加速,使神经传导受到影响,可造成胃肠蠕动缓慢、消化液分泌减少、食欲不振和消化不良等症状。反之,给以维生素B1,则可增加食欲、促进消化。
硫辛酸学名6.8-二硫辛酸,其结构式如下:
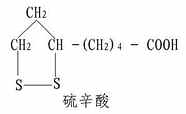
硫辛酸分子内含双S键,故常用 表示之。
表示之。
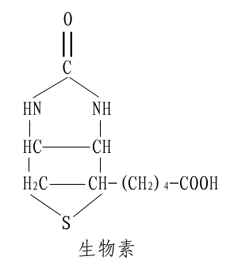
生物素的结构包括含硫的噻吩环、尿素及戊酸三部分,如下式
泛酸系由β-丙氨酸与羟基丁酸结合而构成,因其广泛存在于动植物组织故名泛酸或遍多酸。
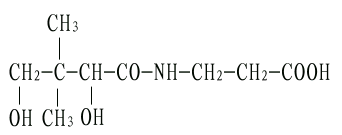
泛酸,N-(α,r-二羟,β,β-二甲基丁酰)β-丙氨酸
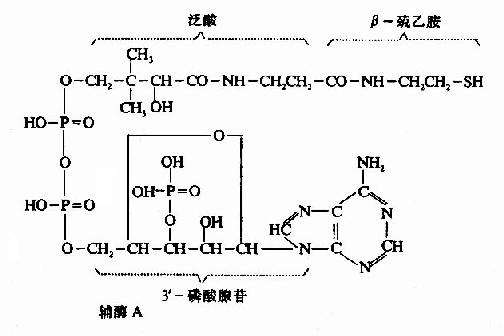
泛酸在机体组织内是与巯基乙胺、焦磷酸及3′-磷酸腺苷结合成为辅酶A而起作用的。辅酶A的结构如下,因其活性基为桽H故常用CoASH表示之。
由上可见,硫胺素、硫辛酸、生物素和泛酸这四种维生素在化学结构上有着共同特点,前三者本身结构含S,后者本身虽不含S,但由它构成的辅酶A却是含S的,这些维生素主要参与糖和脂肪的代谢,硫胺素和硫辛酸与氧化脱羧反应有关,生物素与羧化反应有关,而泛酸则通过构成辅酶A而参与酰基化反应。在这些维生素参与的代谢变化中,含S的活性基也显示着特殊的功能。关于它们在代谢中的作用详见糖代谢和脂代谢有关章节。
(二)维生素B2、维生素PP和维生素B6
维生素B2是由核醇(ribitol)与异咯嗪(isoalloxazine)结合构成的,由于异咯嗪是一种黄色色素,所以维生素B2又称为核黄素。维生素B2为桔黄色针状结晶,溶于水呈绿色荧光,在碱性溶液中受光照射时极易破坏,因此维生素B2应贮于褐色容器,避光保存。
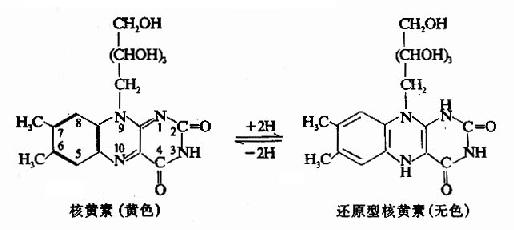
维生素B2分子中的异咯嗪,其第1和第10位氮原子可反复接受和放出氢,因而具有可逆的氧化还原特性,这一特点与它的主要生理功能相关。
核黄素在体内经磷酸化作用可生成黄素单核苷酸(FMN)和黄素腺嘌呤二核苷酸(FAD),它们分别构成各种黄酶的辅酶参与体内生物氧化过程,其结构式和作用特点详见第6章。
维生素B2缺乏时,主要表现为口角炎、舌炎、阴囊炎及角膜血管增生和巩膜充血等。幼儿缺乏它则生长迟缓。但这些症状目前还难以用它参与黄酶的作用来解释,其机理尚不清楚。
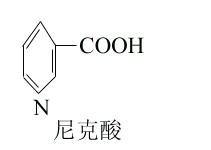
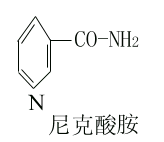
维生素PP即抗癞皮病因子,又名预防癞皮病因子(pellagrapreventing factor)它包括尼克酸(烟酸)和尼克酰胺(烟酰胺),均为吡啶衍生物。
 |
 |
尼克酸和尼克酰胺的性质都较稳定,不易被酸、碱及热破坏。动物组织中大多以尼克酰胺的形式存在,尼克酸在人体内可从色氨酸代谢产生并可转变成尼克酰胺。由色氨酸转变为维生素PP的量有限,不能满足机体的需要,所以仍需从食物中供给。一般饮食条件下,很少缺乏维生素PP,玉米中缺乏色氨酸和尼克酸,长期单食玉米则有可能发生维生素PP缺乏病-癞(糙)皮病(pellagra)。若将各种杂糖合理搭配,可防止此病的发生。
尼克酰胺是构成辅酶Ⅰ(NAD+)和辅酶Ⅱ(NADP+)的成分,这两种辅酶结构中的尼克酰胺部分具有可逆地加氢和脱氢的特性,在生物氧化过程中起着递氢体的作用(它们的结构和作用参看生物氧化一章)。
维生素PP缺乏时,主要表现为癞皮病,其特征是体表暴露部分出现对称性皮炎,此外还有消化不良,精神不安等症状,严重时可出现顽固性腹泻和精神失常。但是这些症状与维生素PP在代谢中所起的作用有何联系,目前尚不十分清楚。
维生素B6包括吡哆醇,吡哆醛和吡哆胺三种化合物,在体内它们可以相互转变。
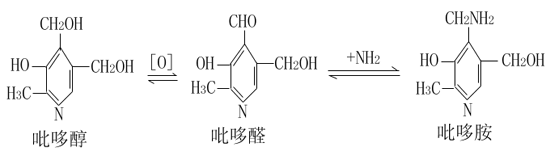
在机体组织内维生素B6多以其磷酸酯的形式存在,参与氨基酸的转氨、某些氨基酸的脱羧以及半胱氨酸的脱巯基作用(参看第7章)。
动物缺乏维生素B6亦可发生与癞皮病类似的皮肤炎。在人类尚未发现单纯的维生素B6缺乏症。
维生素B2、维生素PP和维生素B6常共同存在,在营养上亦有共同特点,即当其缺乏都表现为皮肤炎症。然而从在代谢中的作用来看,前二者共同参与生物氧化过程,维生素B6则主要参与氨基酸的代谢。
(三)叶酸和维生素B12
叶酸由蝶酸(pteroicacid)和谷氨酸结合构成,在植物绿叶中含量丰富故名。在动物组织中以肝脏含叶酸最丰富。
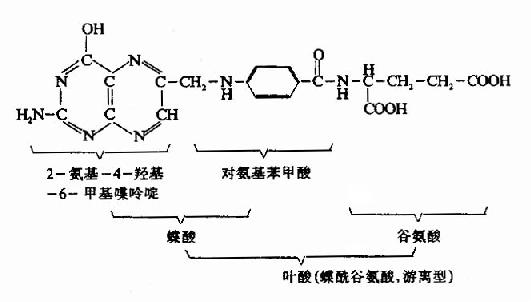
食物中的叶酸多以含5分子或7分子谷氨酸的结合型存在,在肠道中受消化酶的作用水解为游离型而被吸收。若缺乏此种消化酶则可因吸收障碍而致叶酸缺乏。
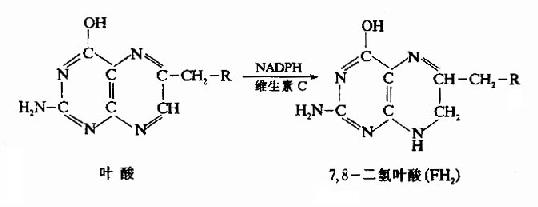
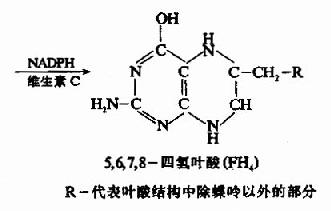
叶酸在体内必须转变成四氢叶酸(FH4或THFA)才有生理活性。小肠粘膜、肝及骨髓等组织含有叶酸还原酶,在NADPH和维生素C的参与下,可催化此种转变。
四氢叶酸参与体内“一碳基团”的转移,是一碳基团转移酶系统的辅酶。因此,四氢叶酸在体内嘌呤和嘧啶的合成上起重要作用。例如N5,N10-甲炔四氢叶酸(N5,N0=CHFH4)和N10-甲酰四氢叶酸(N10-CHO·FH4)可参与嘌呤核苷酸的合成,其中甲炔基(=CH-)和甲酰基(-CHO)分别成为嘌呤碱中第8位和第2位上两个碳原子的来源。在尿嘧啶脱氧核苷酸(d-UMP)转变成胸腺嘧啶脱氧核苷酸(d-TMP)的过程中,N5,10-甲烯四氢叶酸(N5,N10-CH2-FH4)可供给甲烯基(-CH2-)而形成胸腺嘧啶中的甲基(参看核酸代谢)。
由此可见,叶酸与核苷酸的合成有密切关系,当体内缺乏叶酸时,“一碳基团”的转移发生障碍,核苷酸特别是胸腺嘧啶脱氧核苷酸的合成减少,以致骨髓中幼红细胞DNA的合成受到影响,细胞分裂增殖的速度明显下降。此时血红蛋白的合成虽也有所减弱,但影响较小。幼红细胞可因分裂障碍而使细胞增大,形成巨幼红细胞(megaloblast)。由这种巨幼红细胞产生的成熟红细胞,其平均体积也较正常大,可在周围血液中见到,所以叶酸缺乏引起的贫血属于巨幼细胞性大红细胞性贫血(megaloblastic macrocytic anemia)。因白细胞分裂增殖同样需要叶酸,故叶酸缺乏时,尚可见周围血液中粒细胞减少,且粒细胞的体积也偏大,核分叶增多。
人类肠道细菌能合成叶酸,故一般不发生缺乏症,但当吸收不良、代谢失常或组织需要过多,以及长期使用肠道抑菌药物或叶酸拮抗药等状况下,则可造成叶酸缺乏。叶酸拮抗药种类很多,其中氨蝶呤(aminopterin)及氨甲蝶呤(methotrexate简写MTX)在结构上与叶酸相似,都是叶酸还原酶的强抑制剂,常用作抗癌药。
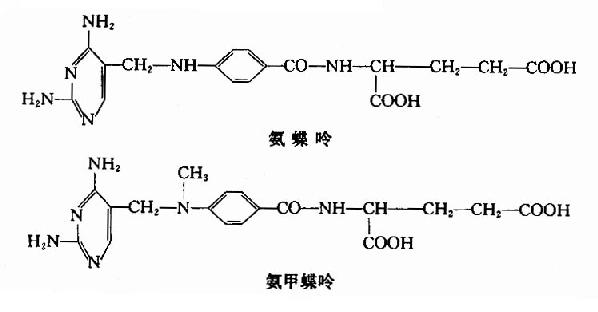
维生素B12结构复杂,因其分子中含有金属钴和许多酰氨基,故又称为钴胺素。
维生素B12分子中的钴(可以是一价、二价或三价的)能与-CN、-OH、-CH3或5′-脱氧腺苷等基团相连,分别称为氰钴胺、羟钴胺、甲基钴胺和5′-脱氧腺苷钴胺,后者又称为辅酶B12。其实,甲基钴胺也是维生素B12的辅酶形式。维生素B12的两种辅酶形式一一甲基钴胺和5′-脱氧腺苷钴胺在代谢中的作用各不相同。
甲基钴胺(CH3·B12)参与体内甲基移换反应和叶酸代谢,是N5-甲基四氢叶酶甲基移换酶的辅酶。此酶催化N5CH3·FH4和同型半胱氨酸之间不可逆的甲基移换反应,产生四氢叶酸和蛋氨酸。
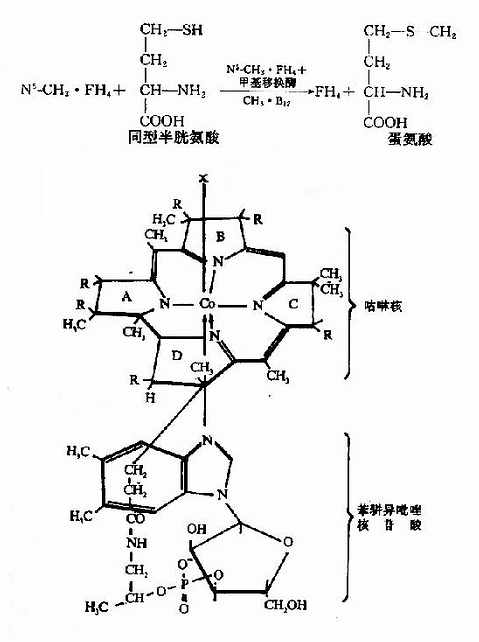
图3-3 维生素B12的结构
N5-CH3-FH3来源于N5,N10-CH2-FH4的还原(参看蛋白质代谢一章中“一碳基团”的代谢),此还原反应在体内也是不可逆的。由dUMP甲基化生成dTMP时,只能利用N6,N10-CH2-FH4供给甲基,而不能利用N5-CH3·FH4。因此,必须通过上述甲基移换反应使FH4“再生”,从而保证dTMP的不断合成。
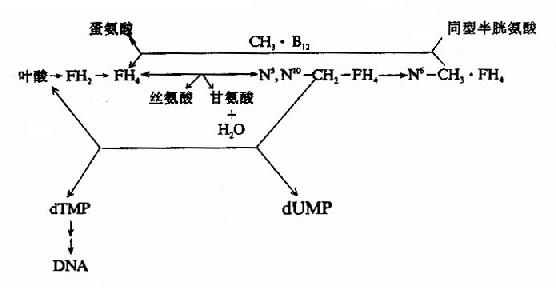
图3-4 维生素B12和叶酸代谢以及与DNA合成的关系
由上图可见,甲基钴胺的作用是促进叶酸的周转利用,以利于胸腺嘧啶脱氧核苷酸和DNA的合成,如果缺乏维生素B12,则叶酸陷入N5-CH3·FH4这个“陷井”而难以被机体再利用,犹如缺乏叶酸一样,所以维生素B12缺乏所引起的贫血,同缺乏叶酸一样,也是巨幼细胞性大红细胞贫血。
上述以CH3·B12作辅酶的甲基移换反应不仅促进FH4的再利用,而且还促进蛋氨酸的再利用(蛋氨酸→同型半胱氨酸→蛋氨酸,参看氨基酸的代谢)。蛋氨酸经活化后可作为甲基供体促进胆碱和磷脂的合成,有利于肝脏的代谢。所以临床上把叶酸和维生素B12作为治疗肝脏病的辅助药物,除了考虑到它们的促核酸与蛋白质合成作用外,还考虑到它们有保护肝脏,防止发生脂肪肝的作用。
5′-脱氧腺苷钴胺(5′-dA·B12)是甲基丙二酰辅酶A变位酶的辅酶,参与体内丙酸的代谢。
体内某些氨基酸、奇数碳脂肪酸和胆固醇分解代谢中可产生丙酰CoA。正常情况下,丙酰COA经羧化生成甲基丙二酰CoA,后者再受甲基丙二酰CoA变位酶和辅酶B12(即5′-dA·B12)的作用转变为琥珀酰CoA,最后进入三羧酸循环而被氧化利用(参看糖代谢)。
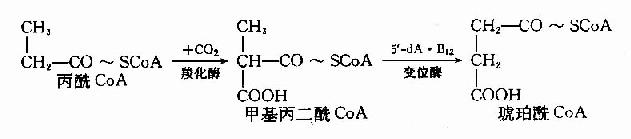
当维生素B12缺乏时,由于这些代谢途径受阻,将导致甲基丙二酰COA和丙酰COA的堆积,结果引起甲基丙二酰COA水解,产生甲基丙二酸由尿排出。所以维生素B12缺乏病人尿中出现甲基丙二酸,这可作为一个很灵敏的诊断指标。据分析,患者脑脊液中甲基丙二酸的浓度大于血浆中浓度,表明代谢障碍主要发生在神经组织。另外,同位素示踪实验发现,堆积的丙酰CoA掺入到病变的神经髓鞘,构成异常的奇数碳脂肪酸(15C和17C),这可能与神经髓鞘的退行性变有关。因为5′-dA-B12所参与的代谢途径与叶酸无关,所以维生素B12缺乏患者除了造血系统的症状与叶酸缺乏相似外,尚有其独特的神经症状。维生素B12缺乏引起丙酸CoA代谢障碍可用下列图解表示。
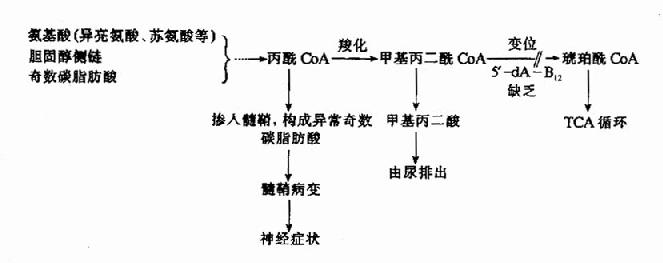
图3-5 维生素B12缺乏对丙酰CoA-代谢的影响
维生素B12广泛存在于动物性食品中,人体对它的需要量甚少(每日仅需2?微克),而体内贮存量很充裕,所以因摄入不足而致维生素B12缺乏者在临床上比较少见。但是维生素B12的吸收与正常胃粘膜分泌的一种糖蛋白密切相关,这种糖蛋白叫做内因子(intrinsic factor简写IF)。维生素B12必须与内因子结合后才能被小肠吸收。这一方面是由于维生素B12的吸收部位在回肠下段,只有维生素B12与内因子结合成IF-B12复合物才能被肠粘膜上的受体接纳;另一方面二者的结合有相互保护的作用;内因子保护维生素B12不被肠道细菌所破坏;维生素B12保护内因子不被消化液中的酶所水解。某些疾病如萎缩性胃炎、胃全切除的病人或者先天缺乏内因子,均可因维生素B12的吸收障碍而致维生素B12的缺乏。对这类病人只有采取注射的方式给予维生素B12才有效。
二、维素素C和P
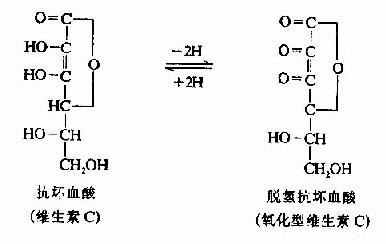
维生素C又名抗坏血酸(ascorbic acid),它是含有内脂结构的多元醇类,其特点是具有可解离出H+的烯醇式羟基,因而其水溶液有较强的酸性。维生素C可脱氢而被氧化,有很强的还原性,氧化型维生素C(脱氢抗坏血酸dehydroascorbic acid)还可接受氢而被还原。
维生素C含有不对称碳原子,具有光学异构体,自然界存在的、有生理活性的是L-型抗坏血酸。
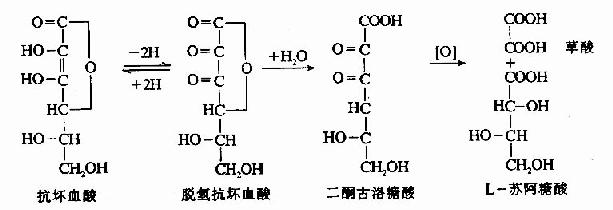
维生素C在酸性水溶液(pH<4)中较为稳定,在中性及碱性溶液中易被破坏,有微量金属离子(如Cu++、Fe+++等)存在时,更易被氧化分解;加热或受光照射也可使维生素C分解。此外,植物组织中尚含有抗坏血酸氧化酶,能催化抗坏血酸氧化分解,失去活性,所以蔬菜和水果贮存过久,其中维生素C可遭到破坏而使其营养价值降低。
大多数动物能够利用葡萄糖以合成维生素C,但是人类、灵长类动物和豚鼠由于体内缺少合成维生素C的酶类,所以不能合成维生素C,而必须依赖食物供给。食物中的维生素C可迅速自胃肠道吸收,吸收后的维生素C广泛分布于机体各组织,以肾上腺中含量最高。但是维生素C在体内贮存甚少,必须经常由食物供给。维生素C在体内分解可以产生草酸和苏阿糖酸(threonic acid)。
维生素C具有广泛的生理作用,除了防治坏血病外,临床上还有许多应用,从感冒到癌症,维生素C是应用最多的一种维生素。但是其作用机理有些还不十分清楚,从使用的剂量来看,有越来越大的趋势,已超出了维生素的概念,而是作为保健药物使用了。
已知维生素C参与体内代谢功能主要有以下几个方面。
(一)参与体内的羟化反应
维生素C对于许多物质的羟化反应都有重要作用,而羟化反应又是体内许多重要化合物的合成或分解的必经步骤,例如胶元的生成、类固醇的合成与转变,以及许多有机药物或毒物的生物转化等,都需要羟化作用才能完成。
1.胶元的合成
当胶元(collancg)合成时,多肽链中的脯氨酸(Pro)和赖氨酸(Lys)残基需要分别被羟化成为羟脯氨酸和羟赖氨酸残基(详见第十五章)。维生素C是此种羟化反应必需的辅助因素之一,因为在羟化反应中,不仅需要相应的羟化酶,而且还需要O2、Fe++和a-酮戊二酸等,维生素C有助于维持Fe++的还原状态,并能激活羟化酶。
胶原是细胞间质的重要成分,因此,当维生素C缺乏时,胶原和细胞间质合成障碍,毛细管壁脆性增大,通透性增强,轻微创伤或压力即可使毛细血管破裂,引起出血现象,临床上称为坏血病(scurvy)。
2.类固醇的羟化
正常情况下,体内胆固醇约有80%转变为胆酸后排出,在胆固醇转变为胆酸前,需先将环状部分羟化(7α羟化作用,参看胆固醇代谢),而后侧链断裂,最终生成胆酸,缺乏维生素C则此种羟化过程受阻,胆固醇转变成胆酸的作用下降,肝中胆固醇堆积,而血中胆固醇浓度增高。因此,临床上用大量维生素C可降低血中胆固醇,其机理可能在于维生素C促进胆固醇向胆酸转变。
此外,肾上腺皮质激素合成加强时,皮质中维生素C含量显著下降,这可能是皮质激素合成过程中某些羟化步骤需消耗维生素C。
3.芳香族氨基酸的羟化
苯丙氨酸(Phe)羟化为酪氨酸(Tyr),酪氨酸转变为儿茶酚胺(catecholamine)或分解为尿黑酸等过程中许多羟化步骤均需有维生素C的参加。又如色氨酸(Trp)转变为5-羟色胺(5-HT)时也需要维生素C(参看氨基酸代谢和神经组织生化等章节),儿茶酚胺和5-羟色胺都是重要的神经递质,它们在调节神经活动方面有重要作用。
4.有机药物或毒物的羟化
药物或毒物在内质网上的羟化过程,是重要的生物转化反应,缺乏维生素C时,此种羟化反应明显下降,药物或毒物的代谢显著减慢,给予维生素C后,催化此类羟化反应的酶系活性升高,促进药物或毒物的代谢转变,因而有增强解毒的作用(参看肝脏生化一章中生物转化作用)。
(二)还原作用
维生素C在体内作为重要的还原剂而起作用,主要有以下几个方面。
1.保护巯基和使巯基再生
已知许多含巯基的酶当其在体内发挥催化作用时需要有自由的桽H,而维生素C能使酶分子中-SH保持在还原状态,从而保持酶有一定的活性,维生素C还可使氧化型的谷光甘肽(G-S-S-G)还原为还原型的谷胱甘肽(G-SH),使-SH得以再生,从而保证谷胱甘肽的功能。例如不饱和脂酸易被氧化成脂性过氧化物,后者可使各种细胞膜,尤其是溶酶体膜破裂,释放出各种水解酶类,致使组织自溶,造成严重后果,还原型谷胱甘肽在谷胱甘肽过氧化酶的催化下可使脂性过氧化物还原,从而消除其对组织细胞的破坏作用,而G-SH便氧化成G-S-S-G,在谷胱甘肽还原酶催化下,维生素C也可使G-S-S-G还原成G-SH,从而使后者不断得到补充。
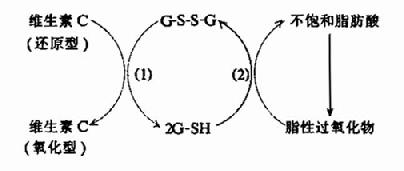
图3-6 维生素C与谷胱甘肽拉化还原反应的关系
(1):G-SH还原酶(2):G-SH过氧化酶
再如某些含巯基的酶在金属中毒(如铅中毒)时被抑制,给以大量维生素C往往可以缓解其毒性。据认为,金属离子能与体内巯基酶类的桽H结合,使其失活,以致代谢障碍而中毒。维生素C可以将G-S-S-G还原为G-SH,后者可与金属离子结合而排出体外,所以维生素C能保护含巯基的酶,具有解毒作用。
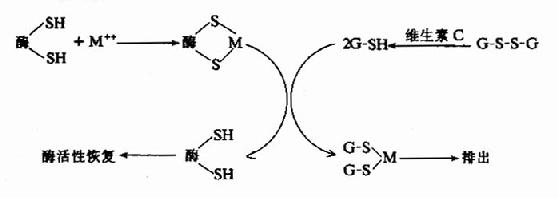
图3-7 维生素C解毒示意图
2.促进铁的吸收和利用
维生素C能使难吸收的Fe+++还原成易吸收的Fe++,促进铁的吸收,它还能促使体内的Fe+++还原,有利于血红素的合成。此外,维生素C还有直接还原高铁血红蛋白(MHb)的作用。
3.促进叶酸转变为四氢叶酸(见前)
由此可见,维生素C对缺铁性贫血和巨幼细胞性贫血的治疗都可起辅助作用。
4.抗体的生成
抗体分子中含有相当数量的双S键,所以抗体的合成需要足够量的半胱氨酸,体内高浓度的维生素C可以把胱氨酸还原成半胱氨酸,有利于抗体的合成。维生素C增强机体的免疫功能不限于促进抗体的合成,它还能增强白细胞对流感病毒的反应性以及促进H2O2在粒细胞中的杀菌作用等。
维生素P又称为通透性维生素(P代表permeability),最初由柠檬中分离出来,化学本质为黄素酮类(flavonone),称为柠檬素(citrin)。以后又发现多种具有类似结构和活性的物质,所以维生素P不是单一的化合物,主要的维生素P类化合物有桔皮苷、芸香苷(芦丁)及L-表儿茶素等。
维生素P的主要生理作用在于维持毛细血管壁的正常通透性,缺少它则通透性增强。因为在自然界维生素P常与维生素C共存,故一般认为坏血病系此两种维生素共同缺乏的结果。虽然在人类尚未发现单纯缺乏维生素P的疾病,但临床上可以应用维生素P防治某些因毛细血管通透性增强而引起的疾病。维生素P的作用机制尚未被阐明,有实验表明它有“节约”维生素C和抑制透明质酸酶(参看第17章)的作用。
营养学上较为重要的维生素有A、D、B1、B2、PP和C六种,它们的来源、需要量、生理功能和缺乏症简要总结如附表。
附表 几种与人体营养有关维生素的来源、需要量、主要功能及缺乏症
| 名称 | 来源 | 需要量* | 主要生理功能 | 缺乏症 |
| (视黄醇) | 肝、蛋黄、鱼肝油、奶汁、绿叶蔬菜、胡萝卜、玉米等 | 3.500 I.U乳母孕妇加倍 | 1.与眼的暗视觉有关,是合成视紫煞费苦心质的原料 2.维持上皮组织的结构完整 3.促进生长发育 |
夜盲症 干眼病 |
| (钙化醇) | 鱼肝油、肝、蛋黄、日光照射皮肤可制造D3 | 400 I.U儿童、孕妇乳母500-1000I.U | 调节钙磷代谢、促进钙磷吸收 | 儿童:佝偻病 成人:软骨病 |
| 维生素B1 (硫胺素) |
醇母、眉头、绿叶蔬菜 | 2mg | 1.为α-酮酸氧化脱羧的辅酶TPP的成分 2.抑制胆碱酯酶的活性 |
脚气病 胃肠道机能障碍 |
| (抗癞皮病因子) | 肉、酵母、谷类及花生等,人体可自色氨醇转变一部分 | 2mg | 构成黄酶的辅酶成分,参与体内生物氧化体系 | 口角炎、舌炎、唇炎、阴囊皮炎等 |
| (抗坏血酸) | 新鲜水果、蔬菜、特别是鲜枣、辣椒、红果、菜花、桔子等含量较高 | 15mg | 构成脱氢酶辅酶的成分,参与生物氧化体系 | 癞皮病(表现为对称性皮炎、舌炎、腹泻及神经症状) |
| 50-75mg | 1.参与体内羟化反应,与细胞间质的生成、类固醇的羟化和生物转化有关 2.参与体内某些还原反应,有保护巯基酶、解毒和促抗体生成的作用 |
坏血病 |
*除特殊注明外均为正常成人每日需要量,为国际单位
第四章 糖代谢
第一节 概述(overview)
一、代谢的基本概念(Basis concepts of Metabolism)
机体内的化学反应是在酶的催化下完成的。在细胞内这些反应不是相互独立的,而是相互联系的,一个反应的产物可能就是下一个反应的底物,这样构成一连串的反应,称之为代谢途径(pathway),由不同的代谢途径相互交叉构成一个有组织有目的的化学反应网络(network),称为代谢(metabolism)。体内的代谢途径主要分为两类:一类是由大分子(多糖、蛋白、脂类等)不断降解为小分子(如CO2,NH3,H2O)的过程称之为分解代谢(catabolism);另一类是由小分子(如氨基酸等)生成大分子(如蛋白质)的过程称之为合成代谢(anabolism)。分解代谢主要分三个阶段进行:第一阶段是由复杂的大分子分解为物质基本组成单位的过程,即糖、脂肪和蛋白质降解生成葡萄糖、脂肪酸、甘油和氨基酸;第二阶段是由这些基本分子转变为代谢中间产物,即活泼的二碳化合物的过程,如上述葡萄糖、氨基酸和脂肪酸等降解为乙酰CoA,这期间有少量能量的释放,生成ATP;第三阶段是乙酰CoA氧化生成CO2和H2O的过程,这期间生成的NADH,FADH2通过氧化磷酸化过程,生成大量ATP。合成代谢一般不是分解代谢简单的逆向反应,而是由不同酶催化的,通常需要消耗ATP,还原供氢体多为NADPH。很显然,分解代谢是一个发散的过程(divergent process),而合成代谢是一个集合过程(convergent process)。在正常的机体内,代谢受着严格的调控(regulation),处在动态平衡状态中,这种调节主要是通过各种代谢途径中关键的限速酶的活性变化来实现的。调控发生在两个水平上:一个是细胞内水平,主要由代谢底物、产物的多少来完成;第二个是整体水平,主要通过神经-内分泌系统来实现。
二、食物中糖的消化和吸收(Digestion and absorption of carbohydrates)
食物中的糖类主要是植物淀粉(starch)和动物糖原(glycogen)两类可消化吸收的多糖、少量蔗糖(sucrose)、麦芽糖(maltose)、异麦芽糖(isomaltose)和乳糖(lactose)等寡糖或单糖,这些糖首先在口腔被唾液中的淀粉酶(α-amylase)部分水解α-1,4糖苷键(α-1.4glycosidic bond),进而在小肠被胰液中的淀粉酶进一步水解生成麦芽糖,异麦芽糖和含4个糖基的临界糊精(α-dextrins),最终被小肠粘膜刷毛缘的麦芽糖酶(maltase)、乳糖酶(lactase)和蔗糖酶(sucrase)水解为葡萄糖(glucose)、果糖(fructose)、半乳糖(galatose),这些单糖可吸收入小肠细胞。此吸收过程是一个主动耗能的过程,由特定载体完成,同时伴有Na+转运,不受胰岛素的调控。除上述糖类以外,由于人体内无β-糖苷酶,食物中含有的纤维素(cellulose)无法被人体分解利用,但是其具有刺激肠蠕动等作用,对于身体健康也是必不可少的。临床上,有些患者由于缺乏乳糖酶等双糖酶,可导致食物中糖类消化吸收障碍而使未消化吸收的糖类进入大肠,被大肠中细菌分解产生CO2、H2等,引起腹胀,腹泻等症状。
三、糖的主要生理功能(Functions of carbohydrate)
糖是自然界最丰富的物质之一,人体每日摄入的糖比蛋白质、脂肪多,占到食物总量的百分之五十以上,糖是人体能量的主要来源之一,以葡萄糖为主供给机体各种组织能量,1克葡萄糖完全氧化分解可产生2840J/mol的能量,除了供给机体能量以外,糖也是组成人体组织结构的重要成分:与蛋白质结合形成糖蛋白(glycoprotein)构成细胞表面受体、配体,在细胞间信息传递中起着重要作用;与脂类结合形成糖脂(glyeolipid)是神经组织和细胞膜中的组成成分;还有血浆蛋白、抗体和某些酶及激素中也含有糖。糖的基本结构式是(CH2O)n,故也称之为碳水化合物。
第二节 糖的分解代谢(catabolism of carbohydrate)
人体组织均能对糖进行分解代谢,主要的分解途径有四条:(1)无氧条件下进行的糖酵解途径;(2)有氧条件下进行的有氧氧化;(3)生成磷酸戊糖的磷酸戊糖通路;(4)生成葡萄糖醛酸的糖醛酸代谢。
一、糖酵解途径(glycolytic pathway)
糖酵解途径是指细胞在胞浆中分解葡萄糖生成丙酮酸(pyruvate)的过程,此过程中伴有少量ATP的生成。在缺氧条件下丙酮酸被还原为乳酸(lactate)称为糖酵解。有氧条件下丙酮酸可进一步氧化分解生成乙酰CoA进入三羧酸循环,生成CO2和H2O。
(一)葡萄糖的转运(transport of glucose)
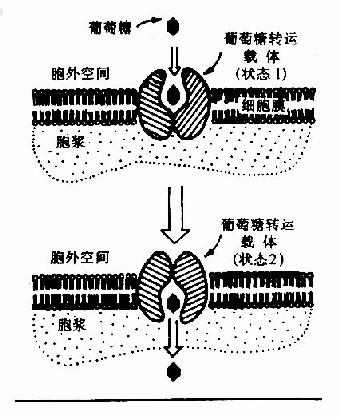
图4-1 葡萄糖通过转运载体转入细胞示意图 GLUT代表葡萄糖转运载体
葡萄糖不能直接扩散进入细胞内,其通过两种方式转运入细胞:一种是在前一节提到的与Na+共转运方式,它是一个耗能逆浓度梯度转运,主要发生在小肠粘膜细胞、肾小管上皮细胞等部位;另一种方式是通过细胞膜上特定转运载体将葡萄糖转运入细胞内(图4-1),它是一个不耗能顺浓度梯度的转运过程。目前已知转运载体有5种,其具有组织特异性如转运载体-1(GLUT-1)主要存在于红细胞,而转运载体-4(GLUT-4)主要存在于脂肪组织和肌肉组织。
(二)糖酵解过程
糖酵解分为两个阶段共10个反应,每个分子葡萄糖经第一阶段共5个反应,消耗2个分子ATP为耗能过程,第二阶段5个反应生成4个分子ATP为释能过程。
1.第一阶段
(1)葡萄糖的磷酸化(phosphorylation of glucose)
进入细胞内的葡萄糖首先在第6位碳上被磷酸化生成6-磷酸葡萄糖(glucose6phophate,G-6-P),磷酸根由ATP供给,这一过程不仅活化了葡萄糖,有利于它进一步参与合成与分解代谢,同时还能使进入细胞的葡萄糖不再逸出细胞。催化此反应的酶是己糖激酶(hexokinase,HK)。己糖激酶催化的反应不可逆,反应需要消耗能量ATP,Mg2+是反应的激活剂,它能催化葡萄糖、甘露糖、氨基葡萄糖、果糖进行不可逆的磷酸化反应,生成相应的6-磷酸酯,6-磷酸葡萄糖是HK的反馈抑制物,此酶是糖氧化反应过程的限速酶(ratelimiting enzyme)或称关键酶(key enzyme)它有同工酶Ⅰ-Ⅳ型,Ⅰ、Ⅱ、Ⅲ型主要存在于肝外组织,其对葡萄糖Km值为10-5~10-6M。
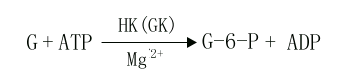
Ⅳ型主要存在于肝脏,特称葡萄糖激酶(glucokinase,GK),对葡萄糖的Km值1~10-2M,正常血糖浓度为5mmol/L,当血糖浓度升高时,GK活性增加,葡萄糖和胰岛素能诱导肝脏合成GK,GK能催化葡萄糖、甘露糖生成其6-磷酸酯,6-磷酸葡萄糖对此酶无抑制作用。
HK与GK两者区别见表4-1。
表4-1 己糖激酶(HK)和葡萄糖激酶(GK)的区别
| HK | GK | |
| 组织分布 | 绝大多数组织 | 肝脏和β细胞 |
| Km | 低 | 高 |
| 6-磷酸葡萄糖的抑制 | 有 | 无 |
(2)6-磷酸葡萄糖的异构反应(isomerization of glucose-6-phosphate)
这是由磷酸己糖异构酶(phosphohexoseisomerase)催化6-磷酸葡萄糖(醛糖aldose sugar)转变为6-磷酸果糖(fructose-6-phosphate,F-6-P)的过程,此反应是可逆的。

(3)6-磷酸果糖的磷酸化(phosphorylation of fructose-6-phosphate)
此反应是6磷酸果糖第一位上的C进一步磷酸化生成1,6-二磷酸果糖,磷酸根由ATP供给,催化此反应的酶是磷酸果糖激酶1(phosphofructokinasel,PFK1)。
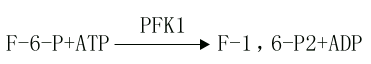
PFK1催化的反应是不可逆反应,它是糖的有氧氧化过程中最重要的限速酶,它也是变构酶,柠檬酸、ATP等是变构抑制剂,ADP、AMP、Pi、1,6-二磷酸果糖等是变构激活剂,胰岛素可诱导它的生成。
(4)1.6二磷酸果糖裂解反应(cleavageof fructose1,6 di/bis phosphate)
醛缩酶(aldolase)催化1.6-二磷酸果糖生成磷酸二羟丙酮和3-磷酸甘油醛,此反应是可逆的。

(5)磷酸二羟丙酮的异构反应(isomerization of dihydroxyacetonephosphate)
磷酸丙糖异构酶(triosephosphate isomerase)催化磷酸二羟丙酮转变为3-磷酸甘油醛,此反应也是可逆的。
![]()
到此1分子葡萄糖生成2分子3-磷酸甘油醛,通过两次磷酸化作用消耗2分子ATP。
2.第二阶段:
(6)3-磷酸甘油醛氧化反应(oxidation of glyceraldehyde-3-phosphate
此反应由3-磷酸甘油醛脱氢酶(glyceraldehyde 3-phosphatedehydrogenase)催化3-磷酸甘油醛氧化脱氢并磷酸化生成含有1个高能磷酸键的1,3-二磷酸甘油酸,本反应脱下的氢和电子转给脱氢酶的辅酶NAD+生成NADH+H+,磷酸根来自无机磷酸。

(7)1.3-二磷酸甘油酸的高能磷酸键转移反应
在磷酸甘油酸激酶(phosphaglyceratekinase,PGK)催化下,1.3-二磷酸甘油酸生成3-磷酸甘油酸,同时其C1上的高能磷酸根转移给ADP生成ATP,这种底物氧化过程中产生的能量直接将ADP磷酸化生成ATP的过程,称为底物水平磷酸化(substratelevel phosphorylation)。此激酶催化的反应是可逆的。
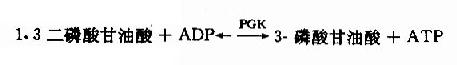
(8)3-磷酸甘油酸的变位反应
在磷酸甘油酸变位酶(phosphoglyceratemutase)催化下3-磷酸甘油酸C3-位上的磷酸基转变到C2位上生成2-磷酸甘油酸。此反应是可逆的。

(9)2-磷酸甘油酸的脱水反应
由烯醇化酶(enolase)催化,2-磷酸甘油酸脱水的同时,能量重新分配,生成含高能磷酸键的磷酸烯醇式丙酮酸(phosphoenolpyruvatePEP)。本反应也是可逆的。
![]()
(10)磷酸烯醇式丙酮酸的磷酸转移
在丙酮酸激酶(pyruvatekinase,PK)催化下,磷酸烯醇式丙酮酸上的高能磷酸根转移至ADP生成ATP,这是又一次底物水平上的磷酸化过程。但此反应是不可逆的。
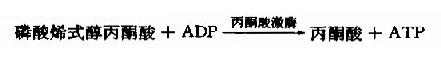
丙酮酸激酶是糖的有氧氧化过程中的限速酶,具有变构酶性质,ATP是变构抑制剂,ADP是变构激活剂,Mg2+或K+可激活丙酮酸激酶的活性,胰岛素可诱导PK的生成,烯醇式丙酮酸又可自动转变成丙酮酸。
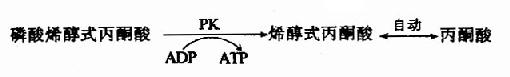
总结糖的无氧酵解 在细胞液阶段的过程中,一个分子的葡萄糖或糖原中的一个葡萄糖单位,可氧化分解产生2个分子的丙酮酸,丙酮酸将进入线粒体继续氧化分解,此过程中产生的两对NADH+H+,由递氢体α-磷酸甘油(肌肉和神经组织细胞)或苹果酸(心肌或肝脏细胞)传递进入线粒体,再经线粒体内氧化呼吸链的传递,最后氢与氧结合生成水,在氢的传递过程释放能量,其中一部分以ATP形式贮存。
在整个细胞液阶段中的10或11步酶促反应中,在生理条件下有三步是不可逆的单向反应,催化这三步反应的酶活性较低,是整个糖的有氧氧化过程的关键酶,其活性大小,对糖的氧化分解速度起决定性作用,在此阶段经底物水平磷酸化产生四个分子ATP。
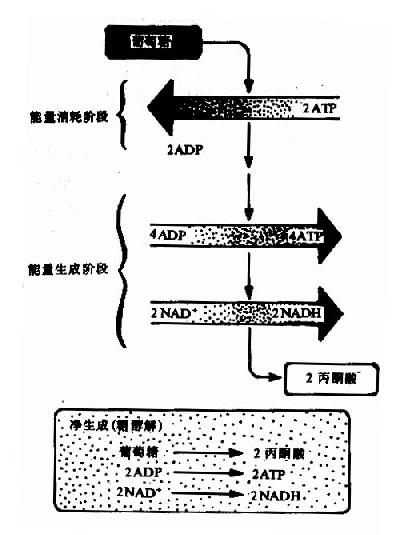
图4-2 葡萄糖分解的两个阶段
总而言之,经过糖酵解途径,一个分子葡萄糖可氧化分解产生2个分子丙酮酸。在此过程中,经底物水平磷酸化可产生4个分子ATP,如与第一阶段葡萄糖磷酸化和磷酸果糖的磷酸化消耗二分子ATP相互抵消,每分子葡萄糖降解至丙酮酸净产生2分子ATP,如从糖原开始,因开始阶段仅消耗1分子ATP,所以每个葡萄糖单位可净生成3分子ATP(图4-2)。葡萄糖+2Pi+2NAD++2ADP→2丙酮酸+2ATP+2NADH+2H++2H2O
(三)丙酮酸在无氧条件下生成乳酸
氧供应不足时从糖酵解途径生成的丙酮酸转变为乳酸。缺氧时葡萄糖分解为乳酸称为糖酵解(glycolysis),因它和酵母菌生醇发酵非常相似。丙酮酸转变成乳酸由乳酸脱氢酶(lactatedehydrogenase)催化丙酮酸乳酸脱氢酶乳酸在这个反应中丙酮酸起了氢接受体的作用。由3-磷酸甘油醛脱氢酶反应生成的NADH+H+,缺氧时不能经电子传递链氧化。正是通过将丙酮酸还原成乳酸,使NADH转变成NAD+,糖酵解才能继续进行。
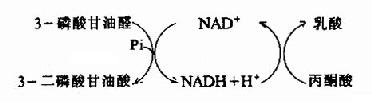
乳酸脱氢酶是由M和H二种亚基构成的四聚体,组成5种同工酶。这些同工酶在组织中分布不同,对丙酮酸的KM也有较大差异。H4主要分布在心肌。它的酶动力学参数表明H4有利于催化乳酸氧化成丙酮酸。所以心肌进行有氧氧化而且能利用乳酸作为燃料。骨骼肌中为M4型。它对反应方面无倾向性,但肌细胞内底物的浓度有利于生成乳酸。
(四)糖酵解及其生理意义
糖酵解是生物界普遍存在的供能途径,但其释放的能量不多,而且在一般生理情况下,大多数组织有足够的氧以供有氧氧化之需,很少进行糖酵解,因此这一代谢途径供能意义不大,但少数组织,如视网膜、睾丸、肾髓质和红细胞等组织细胞,即使在有氧条件下,仍需从糖酵解获得能量。
在某些情况下,糖酵解有特殊的生理意义。例如剧烈运动时,能量需求增加,糖分解加速,此时即使呼吸和循环加快以增加氧的供应量,仍不能满足体内糖完全氧化所需要的能量,这时肌肉处于相对缺氧状态,必须通过糖酵解过程,以补充所需的能量。在剧烈运动后,可见血中乳酸浓度成倍地升高,这是糖酵解加强的结果。又如人们从平原地区进入高原的初期,由于缺氧,组织细胞也往往通过增强糖酵解获得能量。
在某些病理情况下,如严重贫血、大量失血、呼吸障碍、肿瘤组织等,组织细胞也需通过糖酵解来获取能量。倘若糖酵解过度,可因乳酸产生过多,而导致酸中毒。
(五)糖酵解的调节
正常生理条件下,人体内的各种代谢受到严格而精确的调节,以满足机体的需要,保持内环境的稳定。这种控制主要是通过调节酶的活性来实现的。在一个代谢过程中往往催化不可逆反应的酶限制代谢反应速度,这种酶称为限速酶。糖酵解途径中主要限速酶是己糖激酶(HK),磷酸果糖激酶-1(PFK-1)和丙酮酸激酶(PK)。
1.激素的调节
胰岛素能诱导体内葡萄糖激酶、磷酸果糖激酶、丙酮酸激酶的合成,因而促进这些酶的活性,一般来说,这种促进作用比对限速酶的变构或修饰调节慢,但作用比较持久。
2.代谢物对限速酶的变构调节
上述三个限速酶中,起决定作用的是催化效率最低的酶PFK-1。其分子是一个四聚体形式,不仅具有对反应底物6-磷酸果糖和ATP的结合部位,而且尚有几个与别位激活剂和抑制剂结合的部位,6-磷酸果糖、1,6二磷酸果糖、ADP和AMP是其激活剂,而ATP、柠檬酸等是其抑制剂,ATP既可作为反应底物又可作为抑制剂,其原因在于:此酶一个是与作为底物的ATP结合位点,另一个是与作为抑制剂的ATP结合位点,两个位点对ATP的亲和力不同,与底物的位点亲和力高,抑制剂作用的位点亲和力低。对ATP有两种结合位点,这样,当细胞内ATP不足时,ATP主要作为反应底物,保证酶促反应进行,而当细胞内ATP增多时,ATP作为抑制剂,降低了酶对6-磷酸果糖的亲和力。
它在体内也是由6-磷酸果糖磷酸化而成,但磷酸化是在C2位而不是C4位,参与的酶也是另一个激酶,磷酸果糖激酶-2(PFK-2)。
2,6-二磷酸果糖可被二磷酸果糖磷酸酶-2去磷酸而生成6-磷酸果糖,失去其调节作用。2,6-二磷酸果糖的作用在于增强磷酸果糖激酶-1对6-磷酸果糖的亲和力和取消ATP的抑制作用(图4-3)。
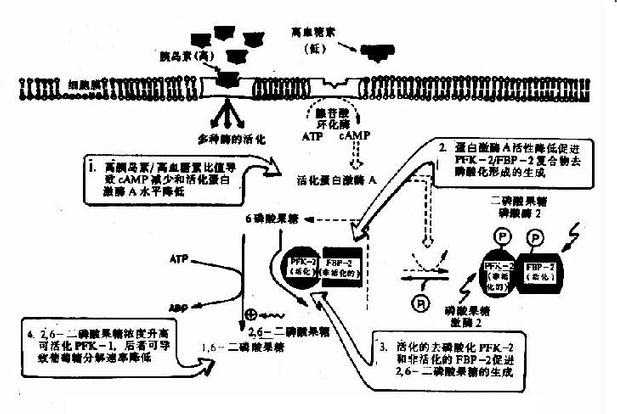
图4-3 胰岛素浓度升高对肝细胞内2,6-二磷酸果糖浓度的影响
临床上丙酮酸激酶异常,可导致葡萄糖酵解障碍,红细胞破坏出现溶血性贫血。
二、糖的有氧氧化
葡萄糖在有氧条件下,氧化分解生成二氧化碳和水的过程称为糖的有氧氧化(aerobicoxidation)。有氧氧化是糖分解代谢的主要方式,大多数组织中的葡萄糖均进行有氧氧化分解供给机体能量。
(一)有氧氧化过程
糖的有氧氧化分两个阶段进行。第一阶段是由葡萄糖生成的丙酮酸,在细胞液中进行。第二阶段是上述过程中产生的NADH+H+和丙酮酸在有氧状态下,进入线粒体中,丙酮酸氧化脱羧生成乙酰CoA进入三羧酸循环,进而氧化生成CO2和H2O,同时NADH+H+等可经呼吸链传递,伴随氧化磷酸化过程生成H2O和ATP,下面主要将讨论有氧氧化在线粒体中进行的第二阶段代谢。
1.丙酮酸的氧化脱羧
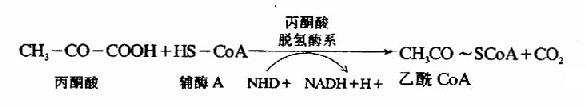
催化氧化脱羧的酶是丙酮酸脱氢酶系(pyruvatedehydrogenase system),此多酶复合体括丙酮酸脱羧酶,辅酶是TPP,二氢硫辛酸乙酰转移酶,辅酶是二氢硫辛酸和辅酶A,还有二氢硫辛酸脱氢酶,辅酶是FAD及存在于线粒体基质液中的NAD+,多酶复合体形成了紧密相连的连锁反应机构,提高了催化效率。
从丙酮酸到乙酰CoA是糖有氧氧化中关键的不可逆反应,催化这个反应的丙酮酸脱氢酶系受到很多因素的影响,反应中的产物,乙酰CoA和NADH++H+可以分别抑制酶系中的二氢硫辛酸乙酰转移酶和二氢硫辛酸脱氢酶的活性,丙酮酸脱羧酶(pyruvate decarboxylase,PDC)活性受ADP和胰岛素的激活,受ATP的抑制。
丙酮酸脱氢反应的重要特征是丙酮酸氧化释放的自由能贮存在乙酰CoA中的高能硫酯键中,并生成NADH+H+(图4-4)。
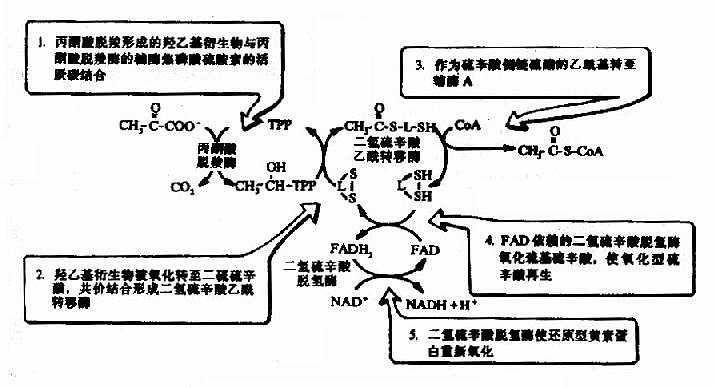
图4-4 丙酮酸脱氢酶复合物的作用机制

2.三羧酸循环(tricarboxylic acid cycle)
乙酰CoA进入由一连串反应构成的循环体系,被氧化生成H2O和CO2。由于这个循环反应开始于乙酰CoA与草酰乙酸(oxaloacetate)缩合生成的含有三个羧基的柠檬酸,因此称之为三羧酸循环或柠檬酸循环(citric acid cycle)。其详细过程如下:
(1)乙酰CoA进入三羧酸循环
乙酰CoA具有硫酯键,乙酰基有足够能量与草酰乙酸的羧基进行醛醇型缩合。首先从CH3CO基上除去一个H+,生成的阴离子对草酰乙酸的羰基碳进行亲核攻击,生成柠檬酰CoA中间体,然后高能硫酯键水解放出游离的柠檬酸,使反应不可逆地向右进行。该反应由柠檬酸合成酶(citrate synthetase)催化,是很强的放能反应。

由草酰乙酸和乙酰CoA合成柠檬酸是三羧酸循环的重要调节点,柠檬酸合成酶是一个变构酶,ATP是柠檬酸合成酶的变构抑制剂,此外,α-酮戊二酸、NADH能变构抑制其活性,长链脂酰CoA也可抑制它的活性,AMP可对抗ATP的抑制而起激活作用。
(2)异柠檬酸形成
柠檬酸的叔醇基不易氧化,转变成异柠檬酸而使叔醇变成仲醇,就易于氧化,此反应由顺乌头酸酶催化,为一可逆反应。

(3)第一次氧化脱酸
在异柠檬酸脱氢酶作用下,异柠檬酸的仲醇氧化成羰基,生成草酰琥珀酸(oxalosuccinate)的中间产物,后者在同一酶表面,快速脱羧生成α-酮戊二酸(αketoglutarate)、NADH和CO2,此反应为β-氧化脱羧,此酶需要Mn2+作为激活剂。

此反应是不可逆的,是三羧酸循环中的限速步骤,ADP是异柠檬酸脱氢酶的激活剂,而ATP,NADH是此酶的抑制剂。
(4)第二次氧化脱羧
在α-酮戊二酸脱氢酶系作用下,α-酮戊二酸氧化脱羧生成琥珀酰CoA、NADH+H+和CO2,反应过程完全类似于丙酮酸脱氢酶系催化的氧化脱羧,属于α氧化脱羧,氧化产生的能量中一部分储存于琥珀酰CoA的高能硫酯键中。
α-酮戊二酸脱氢酶系也由三个酶(α-酮戊二酸脱羧酶、硫辛酸琥珀酰基转移酶、二氢硫辛酸脱氢酶)和五个辅酶(TPP、硫辛酸、HSCoA、NAD+、FAD)组成。

此反应也是不可逆的。α-酮戊二酸脱氢酶复合体受ATP、GTP、NAPH和琥珀酰CoA抑制,但其不受磷酸化/去磷酸化的调控。
(5)底物磷酸化生成ATP
在琥珀酸硫激酶(succinatethiokinase)的作用下,琥珀酰CoA的硫酯键水解,释放的自由能用于合成GTP,在细菌和高等生物可直接生成ATP,在哺乳动物中,先生成GTP,再生成ATP,此时,琥珀酰CoA生成琥珀酸和辅酶A。

(6)琥珀酸脱氢
琥珀酸脱氢酶(succinatedehydrogenase)催化琥珀酸氧化成为延胡索酸。该酶结合在线粒体内膜上,而其他三羧酸循环的酶则都是存在线粒体基质中的,这酶含有铁硫中心和共价结合的FAD,来自琥珀酸的电子通过FAD和铁硫中心,然后进入电子传递链到O2,丙二酸是琥珀酸的类似物,是琥珀酸脱氢酶强有力的竞争性抑制物,所以可以阻断三羧酸循环。

(7)延胡索酸的水化
延胡索酸酶仅对延胡索酸的反式双键起作用,而对顺丁烯二酸(马来酸)则无催化作用,因而是高度立体特异性的。
(8)草酰乙酸再生
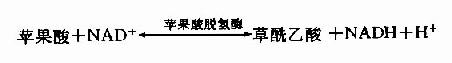
在苹果酸脱氢酶(malicdehydrogenase)作用下,苹果酸仲醇基脱氢氧化成羰基,生成草酰乙酸(oxalocetate),NAD+是脱氢酶的辅酶,接受氢成为NADH+H+(图4-5)。
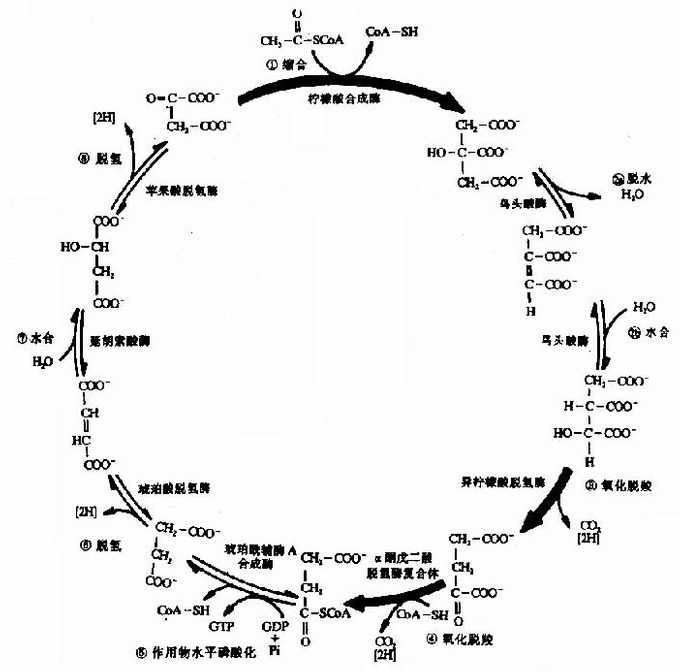
图4-5 三羧酸循环
三羰酸循环总结:
乙酰CoA+3NADH++FAD+GDP+Pi+2H2O—→
2CO2+3NADH+FADH2+GTP+3H+ +CoASH
①CO2的生成,循环中有两次脱羧基反应(反应3和反应4)两次都同时有脱氢作用,但作用的机理不同,由异柠檬酸脱氢酶所催化的β氧化脱羧,辅酶是NAD+,它们先使底物脱氢生成草酰琥珀酸,然后在Mn2+或Mg2+的协同下,脱去羧基,生成α-酮戊二酸。
α-酮戊二酸脱氢酶系所催化的α氧化脱羧反应和前述丙酮酸脱氢酶系所催经的反应基本相同。
应当指出,通过脱羧作用生成CO2,是机体内产生CO2的普遍规律,由此可见,机体CO2的生成与体外燃烧生成CO2的过程截然不同。
②三羧酸循环的四次脱氢,其中三对氢原子以NAD+为受氢体,一对以FAD为受氢体,分别还原生成NADH+H+和FADH2。它们又经线粒体内递氢体系传递,最终与氧结合生成水,在此过程中释放出来的能量使ADP和Pi结合生成ATP,凡NADH+H+参与的递氢体系,每2H氧化成一分子H2O,生成3分子ATP,而FADH2参与的递氢体系则生成2分子ATP,再加上三羧酸循环中有一次底物磷酸化产生一分子ATP,那么,一分子CH2COSCoA参与三羧酸循环,直至循环终末共生成12分子ATP。
③乙酰CoA中乙酰基的碳原子,乙酰CoA进入循环,与四碳受体分子草酰乙酸缩合,生成六碳的柠檬酸,在三羧酸循环中有二次脱羧生成2分子CO2,与进入循环的二碳乙酰基的碳原子数相等,但是,以CO2方式失去的碳并非来自乙酰基的两个碳原子,而是来自草酰乙酸。
④三羧酸循环的中间产物,从理论上讲,可以循环不消耗,但是由于循环中的某些组成成分还可参与合成其他物质,而其他物质也可不断通过多种途径而生成中间产物,所以说三羧酸循环组成成分处于不断更新之中。
例如 草楚酰乙酸——→天门冬氨酸
α-酮戊二酸——→谷氨酸
草酰乙酸——→丙酮酸——→丙氨酸
其中丙酮酸羧化酶催化的生成草酰乙酸的反应最为重要。
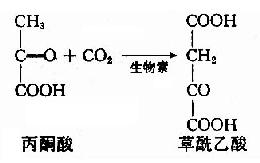
因为草酰乙酸的含量多少,直接影响循环的速度,因此不断补充草酰乙酸是使三羧酸循环得以顺利进行的关键。
三羧酸循环中生成的苹果酸和草酰乙酸也可以脱羧生成丙酮酸,再参与合成许多其他物质或进一步氧化(图4-6)。

(二)糖有氧氧化的生理意义
1.三羧酸循环是机体获取能量的主要方式。1个分子葡萄糖经无氧酵解仅净生成2个分子ATP,而有氧氧化可净生成38个ATP(如表4?),其中三羧酸循环生成24个ATP,在一般生理条件下,许多组织细胞皆从糖的有氧氧化获得能量。糖的有氧氧化不但释能效率高,而且逐步释能,并逐步储存于ATP分子中,因此能的利用率也很高。
2.三羧酸循环是糖,脂肪和蛋白质三种主要有机物在体内彻底氧化的共同代谢途径,三羧酸循环的起始物乙酰辅酶A,不但是糖氧化分解产物,它也可来自脂肪的甘油、脂肪酸和来自蛋白质的某些氨基酸代谢,因此三羧酸循环实际上是三种主要有机物在体内氧化供能的共同通路,估计人体内2/3的有机物是通过三羧酸循环而被分解的。
3.三羧酸循环是体内三种主要有机物互变的联结机构,因糖和甘油在体内代谢可生成α-酮戊二酸及草酰乙酸等三羧酸循环的中间产物,这些中间产物可以转变成为某些氨基酸;而有些氨基酸又可通过不同途径变成α-酮戊二酸和草酰乙酸,再经糖异生的途径生成糖或转变成甘油,因此三羧酸循环不仅是三种主要的有机物分解代谢的最终共同途径,而且也是它们互变的联络机构。
(三)糖有氧氧化的调节
如上所述糖有氧氧化分为两个阶段,第一阶段糖酵解途径的调节在糖酵解部分已探讨过,下面主要讨论第二阶段丙酸酸氧化脱羧生成乙酰CoA并进入三羧酸循环的一系列反应的调节。丙酮酸脱氢酶复合体、柠檬酸合成酶、异柠檬酸脱氢酶和α-酮戊二酸脱氢酶复合体是这一过程的限速酶。
丙酮酸脱氢酶复合体受别位调控也受化学修饰调控,该酶复合体受它的催化产物ATP、乙酰CoA和NADH有力的抑制,这种别位抑制可被长链脂肪酸所增强,当进入三羧酸循环的乙酰CoA减少,而AMP、辅酶A和NAD+堆积,酶复合体就被别位激活,除上述别位调节,在脊椎动物还有第二层次的调节,即酶蛋白的化学修饰,PDH含有两个亚基,其中一个亚基上特定的一个丝氨酸残基经磷酸化后,酶活性就受抑制,脱磷酸化活性就恢复,磷酸化-脱磷酸化作用是由特异的磷酸激酶和磷酸蛋白磷酸酶分别催化的,它们实际上也是丙酮酸酶复合体的组成,即前已述及的调节蛋白,激酶受ATP别位激活,当ATP高时,PDH就磷酸化而被激活,当ATP浓度下降,激酶活性也降低,而磷酸酶除去PDH上磷酸,PDH又被激活了。
对三羧酸循环中柠檬酸合成酶、异柠檬酸脱氢酶和α-酮戊二酸脱氢酶的调节,主要通过产物的反馈抑制来实现的,而三羧酸循环是机体产能的主要方式。因此ATP/ADP与NADH/NAD+两者的比值是其主要调节物。ATP/ADP比值升高,抑制柠檬酸合成酶和异柠檬酶脱氢酶活性,反之ATP/ADP比值下降可激活上述两个酶。NADH/NAD+比值升高抑制柠檬酸合成酶和α-酮戊二酸脱氢酶活性,除上述ATP/ADP与NADH/NAD+之外其它一些代谢产物对酶的活性也有影响,如柠檬酸抑制柠檬酸合成酶活性,而琥珀酰CoA抑制α-酮戊二酸脱氢酶活性。总之,组织中代谢产物决定循环反应的速度,以便调节机体ATP和NADH浓度,保证机体能量供给。(图4-7)。
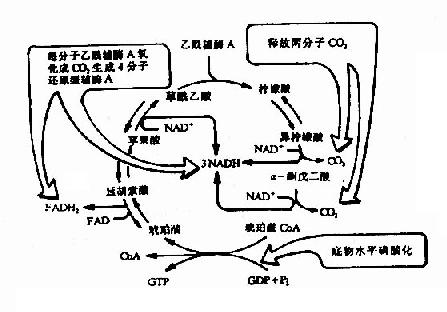
图4-6 三羧酸循环中还原型辅酶和CO2的生成
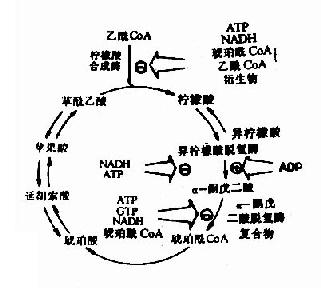
图4-7 三羧酸循环的抑制剂和激活剂
(四)有氧氧化和糖酵解的相互调节
Pasteur在研究酵母发酵时,发现在供氧充足的条件下,细胞内糖酵解作用受到抑制。葡萄糖消耗和乳酸生成减少,这种有氧氧化对糖酵解的抑制作用称为巴士德效应(Pasteureffect)。
产生巴士德效应主要是由于在供氧充足的条件下,细胞内ATP/ADP比值升高,抑制了PK和PFK,使6-磷酸果糖和6-磷酸葡萄糖含量增加,后者反馈抑制已糖激权衡利弊(HK),使葡萄糖利用减少,呈现有氧氧化对糖酵解的抑制作用。
Crabtree效应与巴士德效应相反,在癌细胞发现给予葡萄糖时不论供氧充足与否都呈现很强的酵解反应,而糖的有氧氧化受抑制,称为Crabtree效应或反巴士德效应。这种现象较普遍地存在于癌细胞中,此外也存在于一些正常组织细胞如视网膜、睾丸、颗粒白细胞等。
一般认为,具Crabtree效应的细胞,其酵解酶系(如PK、PFK、HK+)活性强,而线粒体内氧化酶系如细胞色素氧化酶活性则较低,它们在争夺ADF、Pi及ADH+H+方面线粒体必然处于劣势,因而缺乏进行氧化磷酸化的底物,即使在供氧充足的情况下,其有氧氧化生成ATP的能力仍低于正常细胞,呈现Crabtree效应。
三、磷酸戊糖途径
磷酸戊糖途径(pentosephosphate pathway)又称已糖单磷酸旁路(hexose monophosphate shut HMS)或磷酸葡萄糖旁路(phosphogluconate shut)。此途径由6-磷酸葡萄糖开始生成具有重要生理功能的NADPH和5-磷酸核糖。全过程中无ATP生成,因此此过程不是机体产能的方式。其主要发生在肝脏、脂肪组织、哺乳期的乳腺、肾上腺皮质、性腺、骨髓和红细胞等。
(一)反应过程
磷酸戊糖途径在细胞液中进行,全过程分为不可逆的氧化阶段和可逆的非氧化阶段。在氧化阶段,3个分子6-磷酸葡萄糖在6-磷酸葡萄糖脱氢酶和6-磷酸葡萄糖酸脱氢酶等催化下经氧化脱羧生成6个分子NADPH+H+,3个分子CO2和3个分子5-磷酸核酮糖;在非氧化阶段,5-磷酸核酮糖在转酮基酶(TPP为辅酶)和转硫基酶催化下使部分碳链进行相互转换,经三碳、四碳、七碳和磷酸酯等,最终生成2分子6-磷酸果糖和1分子3-磷酸甘油,它们可转变为6-磷酸葡萄糖继续进行磷酸戊糖途径,也可以进入糖有氧氧化或糖酵解途径(图4-8)。此反应途径中的限速酶是6-磷酸葡萄糖脱氢酶,此酶活性受NADPH浓度影响,NADPH浓度升高抑制酶的活性,因此磷酸戊糖途径主要受体内NADPH的需求量调节。
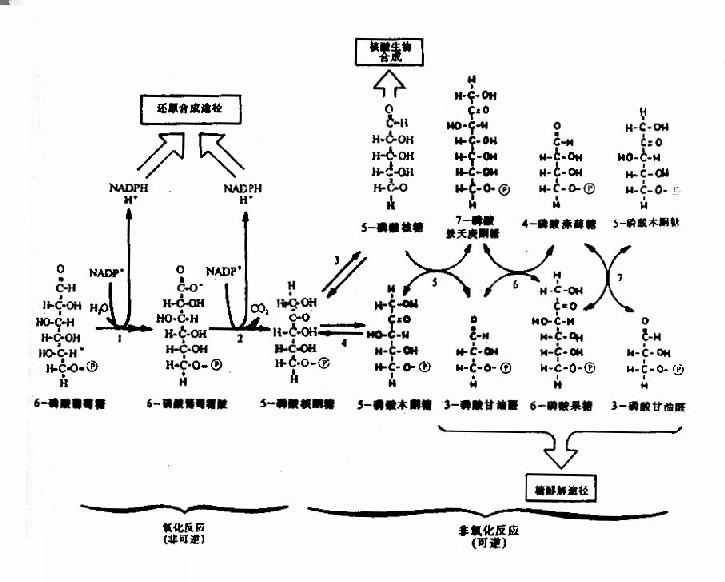
图4-8 已糖磷酸支路反应
(二)生理意义
1.5-磷酸核糖的生成,此途径是葡萄糖在体内生成5-磷酸核糖的唯一途径,故命名为磷酸戊糖通路,体内需要的5-磷酸核糖可通过磷酸戊糖通路的氧化阶段不可逆反应过程生成,也可经非氧化阶段的可逆反应过程生成,而在人体内主要由氧化阶段生成,5-磷酸核糖是合成核苷酸辅酶及核酸的主要原料,故损伤后修复、再生的组织(如梗塞的心肌、部分切除后的肝脏),此代谢途径都比较活跃。
2.NADPH+H+与NADH不同,它携带的氢不是通过呼吸链氧化磷酸化生成ATP,而是作为供氢体参与许多代谢反应,具有多种不同的生理意义。
(1)作为供氢体,参与体内多种生物合成反应,例如脂肪酸、胆固醇和类固醇激素的生物合成,都需要大量的NADPH+H+,因此磷酸戊糖通路在合成脂肪及固醇类化合物的肝、肾上腺、性腺等组织中特别旺盛。
(2)NADPH+H+是谷胱甘肽还原酶的辅酶,对维持还原型谷胱甘肽(GSH)的正常含量,有很重要的作用,GSH能保护某些蛋白质中的巯基,如红细胞膜和血红蛋白上的SH基,因此缺乏6-磷酸葡萄糖脱氢酶的人,因NADPH+H+缺乏,GSH含量过低,红细胞易于破坏而发生溶血性贫血。
(3)NADPH+H+参与肝脏生物转化反应,肝细胞内质网含有以NADPH+H+为供氢体的加单氧酶体系,参与激素、药物、毒物的生物转化过程。
(4)NADPH+H+参与体内嗜中性粒细胞和巨噬细胞产生离子态氧的反应,因而有杀菌作用。
四、糖醛酸代谢
糖醛酸代谢(uronicacid metabolism)主要在肝脏和红细胞中进行,它由尿嘧啶核苷二磷酸葡萄糖(UDPG)上联糖原合成途径,经过一系列反应后生成磷酸戊糖而进入磷酸戊糖通路,从而构成糖分解代谢的另一条通路。
1-磷酸葡萄糖和尿嘧啶核苷三磷酸(UTP)在尿二磷葡萄糖焦磷酸化酶(UDPG焦磷酸化酶)催化下生成尿二磷葡萄糖(UDPG),UDPG经尿二磷葡萄糖脱氢酶的作用进一步氧化脱氢生成尿二磷葡萄糖醛酸,脱氢酶的辅酶是NAD+,尿二磷葡萄糖醛酸(UDPGA)脱去尿二磷生成葡萄糖醛酸(glucuronic acid)。葡萄糖醛酸在一系列酶作用下,经NADPH+H+供氢和NAD+受氢的二次还原和氧化的过程,生成5-磷酸木酮糖进入磷酸戊糖通路(图4-9)。
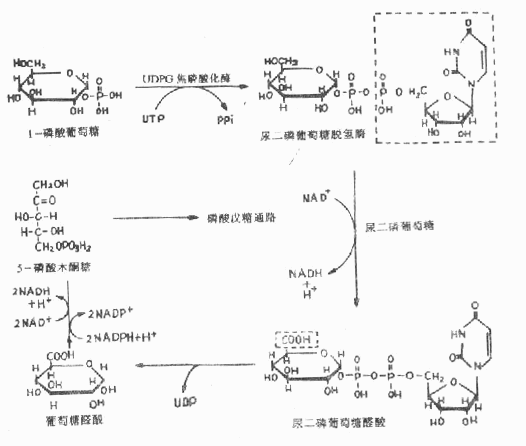
图4-9 糖醛酸代谢
糖醛酸代谢的主要生理功能在于代谢过程中生成了尿二磷葡萄糖醛酸,它是体内重要的解毒物质之一(详见肝脏生化章),同时又是合成粘多糖的原料(见结缔组织章)。此代谢过程要消耗NADPH+H+(同时生成NADH+H+),而磷酸戊糖通路又生成NADPH+H+,因此两者关系密切,当磷酸戊糖通路发生障碍时,必然会影响糖醛酸代谢的顺利进行。
五、其它单糖的酵解
人体可吸收利用的单糖除了葡萄糖以外,还有果糖和半乳糖等单糖,它们均可以通过转变过程,最终进入糖酵解途径。
果糖主要由蔗糖分解生成,存在于水果、蔬菜、蜂蜜中。它可被己糖激酶磷酸化,生成6-酸果糖而进入糖酵解途径。
![]()
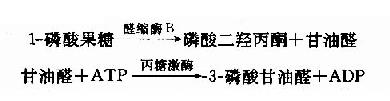
这是体内各种组织均可进行的果糖磷酸化,但是由于己糖激酶对果糖的亲和力远远低于对葡萄糖的亲和力,因此在正常,以葡萄糖为主的食物代谢时,组织对果糖的磷酸化效率是很低的。只有在高果糖食物时,此代谢才进行。除上述反应外,果糖还有另一个磷酸化反应由果糖激酶(fructokinase)催化,此酶主要存在于肝、肾、小肠细胞中,本反应催化果糖在C1位上磷酸化生成1磷酸果糖。
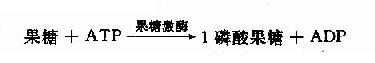
1-磷酸果糖可进一步由醛缩酶B催化裂解形成磷酸二羟丙酮和甘油醛,磷酸二羟丙酮可进入糖酵解途径。甘油醛可进一步被丙糖激酶催化生成3-磷酸甘油醛。
通过上述反应果糖可转变为糖酵解过程中的中间产物而进入糖酵解代谢途径。在上述反应中,限制果糖代谢的主要酶是磷酸酶B,此酶催化效率低,过量果糖可引起1磷酸果糖堆积而导致肝脏损害,出现低血糖、呕吐、黄疸、出血等以及高尿酸症和痛风。半乳糖来自牛乳中乳糖的水解,可由半乳糖激酶催化生成1磷酸半乳糖。
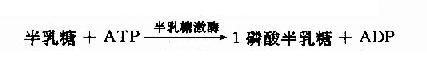
1-磷酸半乳糖可在1-磷酸半乳糖尿苷酰转移酶催化下与尿嘧啶核苷二磷酸葡萄糖(UDPG)作用,生成1磷酸葡萄糖和尿嘧啶核苷二磷酸半乳糖(UDp Gal)。
UDPG+1磷酸半乳糖←→1-磷酸葡萄糖+UDPGal
1-磷酸葡萄糖可在葡萄糖变位酶催化下转变为6-磷酸葡萄糖
1-磷酸葡萄糖←→6-磷酸葡萄糖
而UDPGal可在UDPG差向异构酶催化下转变为UDPG
UDPGal←→UDPG
这样1分子半乳糖可转变为1分子6-磷酸葡萄糖而进入酵解反应,而DPG无净消耗。1-磷酸
半乳糖尿苷酰转移酶缺乏可引起类似果糖代谢障碍出现的临床症状,而且影响更广泛可出现神经系统障碍,反应迟钝,尤其象脑、红细胞等特殊组织。
第三节 糖异生
非糖物质转变为葡萄糖或糖原的过程称为糖异生(gluconeogenesis)。非糖物质主要有生糖氨基酸(甘、丙、苏、丝、天冬、谷、半胱、脯、精、组等)、有机酸(乳酸、丙酮酸及三羧酸循环中各种羧酸等)和甘油等。不同物质转变为糖的速度不同。
进行糖异生的器官,首推肝脏,长期饥饿和酸中毒时肾脏中的糖异生作用大大加强,相当于同重量的肝组织的作用。
一、糖异生的途径
糖异生的途径基本上是糖酵解或糖有氧氧化的逆过程,糖酵解通路中大多数的酶促反应是可逆的,但是糖酵解途径中己糖激酶、磷酸果糖激酶和丙酮酸激酶三个限速酶催化的三个反应过程,都有相当大的能量变化,因为己糖激酶(包括葡萄糖激酶)和磷酸果糖激酶所催化的反应都要消耗ATP而释放能量,丙酮酸激酶催化的反应使磷酸烯醇式丙酮酸转移其能量及磷酸基生成ATP,这些反应的逆过程就需要吸收相等量的能量,因而构成“能障”,为越过障碍,实现糖异生,可以由另外不同的酶来催化逆行过程,而绕过各自能障,这种由不同的酶催化的单向反应,造成两个作用物互变的循环称为作用物循环或底物循环。
(一)由丙酮酸激酶催化的逆反应是由两步反应来完成的。
首先由丙酮酸羧化酶催化,将丙酮酸转变为草酰乙酸,然后再由磷酸烯醇式丙酮酸羧激酶催化,由草酰乙酸生成磷酸烯醇式丙酮酸。
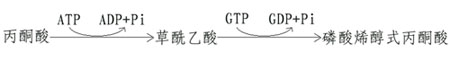
这个过程中消耗两个高能键(一个来自ATP,另一个来自GTP),而由磷酸烯醇式丙酮酸分解为丙酮酸只生成1个ATP。
由于丙酮酸羧化酶仅存在于线粒体内,胞液中的丙酮酸必须进入线粒体,才能羧化生成草酰乙酸,而磷酸烯醇式丙酮酸羧激酶在线粒体和胞液中都存在,因此草酰乙酸可在线粒体中直接转变为磷酸烯醇式丙酮酸再进入胞液中,也可在胞液中被转变为磷酸烯醇式丙酮酸。但是,草酰乙酸不能通过线粒体膜,其进入胞液可通过两种方式将其转运:一种是经苹果酸脱氢酶作用,将其还原成苹果酸,然后通过线粒体膜进入胞液,再由胞液中NAD+-苹果酸脱氢酶将苹果酸脱氢氧化为草酰乙酸而进入糖异生反应途径,由此可见,以苹果酸代替草酰乙酸透过线粒体膜不仅解决了糖异生所需要的碳单位,同时又从线粒体内带出一对氢,以NADH+H+形成使1,3-二磷酸甘油酸生成3磷酸甘油醛,从而保证了糖异生顺利进行。另一种方式是经谷草转氨酶的作用,生成天门冬氨酸后再逸出线粒体,进入胞液中的天门冬氨酸再经胞液中谷草转氨酶催化而恢复生成草酰乙酰。有实验表明,以丙酮酸或能转变为丙酮酸的某些成糖氨基酸作为原料成糖时,以苹果酸通过线粒体方式进行糖异生,而乳糖进行糖异生反应时,它在胞液中变成丙酮酸时已脱氢生成NADH+H+,可供利用,故常在线粒体内生成草酰乙酸后,再变成天门冬氨酸而出线粒体内膜进入胞浆(图4-10)。
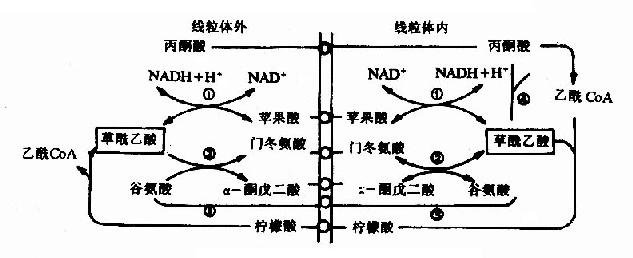
图4-10 草酸乙酸逸出线粒体方式
①苹果酸脱氢酶 ②谷草转氨酶 ③柠檬合成酶 ④丙酮酸羧化酶 ⑤ATP-柠檬裂酸酶合
(二)由己糖激酶和磷酸果糖激酶催化的两个反应的逆行过程
由两个特异的磷酸酶水解己糖磷酸酯键完成,催化G-6-P水解生成葡萄糖的酶为葡萄糖-6-磷酸酶(glucose-6-phosphatase);催化1,6-二磷酸果糖水解生成F-6-P的酶是果糖二磷酸酶(fructose diphosphatase)。
除上述几步反应以外,糖异生反应就是糖酵解途径的逆反应过程。因此,糖异生可总结为:
2丙酮酸+4ATP+2GTP+2NADH+2H+ +6H2O→葡萄糖+2NAD++4ADP+2GDP+6Pi+6H+
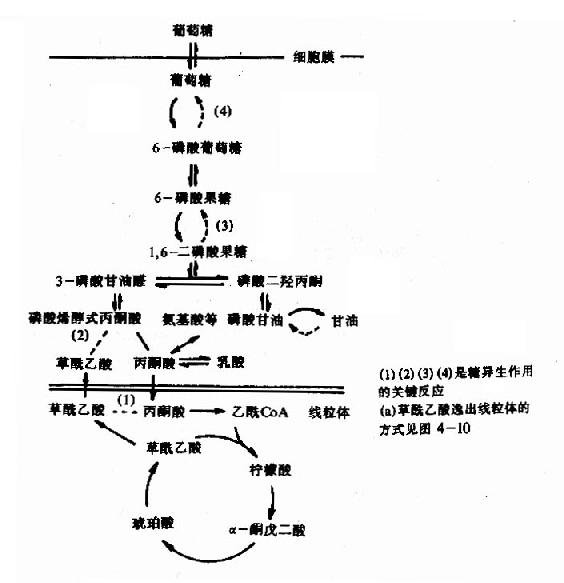
图4-11 肝与肾皮质中糖氧化与糖异生的通路
现将肝脏和肾皮质中糖的氧化与糖异生作用过程总结如图4?1,糖异生作用的三种主要原料有乳酸、甘油和氨基酸等,乳酸在乳酸脱氢酶作用下转变为丙酮酸,经前述羧化支路成糖;甘油被磷酸化生成磷酸甘油后,氧化成磷酸二羟丙酮,再循糖酵解逆行过程合成糖;氨基酸则通过多种渠道成为糖酵解或糖有氧氧化过程中的中间产物,然后生成糖;三羧酸循环中的各种羧酸则可转变为草酰乙酸,然后生成糖。
二、糖异生的生理意义
(一)糖异生作用的主要生理意义
是保证在饥饿情况下,血糖浓度的相对恒定。
图4-12 Cori循环
血糖的正常浓度为3.89?.11mmol/L,即使禁食数周,血糖浓度仍可保持在3.40mmol/L左右,这对保证某些主要依赖葡萄糖供能的组织的功能具有重要意义,停食一夜(8-10小时)处于安静状态的正常人每日体内葡萄糖利用,脑约125g,肌肉(休息状态)约50g,血细胞等约50g,仅这几种组织消耗糖量达225g,体内贮存可供利用的糖约150g,贮糖量最多的肌糖原仅供本身氧化供能,若只用肝糖原的贮存量来维持血糖浓度最多不超过12小时,由此可见糖异生的重要性。
(二)糖异生作用与乳酸的作用密切关系
在激烈运动时,肌肉糖酵解生成大量乳酸,后者经血液运到肝脏可再合成肝糖原和葡萄糖,因而使不能直接产生葡萄糖的肌糖原间接变成血糖,并且有利于回收乳酸分子中的能量,更新肌糖原,防止乳酸酸中毒的发生。(图4-12)
(三)协助氨基酸代谢
实验证实进食蛋白质后,肝中糖原含量增加;禁食晚期、糖尿病或皮质醇过多时,由于组织蛋白质分解,血浆氨基酸增多,糖的异生作用增强,因而氨基酸成糖可能是氨基酸代谢的主要途径。
(四)促进肾小管泌氨的作用
长期禁食后肾脏的糖异生可以明显增加,发生这一变化的原因可能是饥饿造成的代谢性酸中毒,体液pH降低可以促进肾小管中磷酸烯醇式丙酮酸羧激酶的合成,使成糖作用增加,当肾脏中α酮戊二酸经草酰乙酸而加速成糖后,可因α-酮戊二酸的减少而促进谷氨酰胺脱氨成谷氨酸以及谷氨酸的脱氨,肾小管细胞将NH3分泌入管腔中,与原尿中H+结合,降低原尿H+的浓度,有利于排氢保纳作用的进行,对于防止酸中毒有重要作用。
三、糖异生的调节
糖异生的限速酶主要有以下4个酶:丙酮酸羧化酶、磷酸烯醇式丙酮酸羧激酶、果糖二磷酸酶和葡萄糖磷酸酶。
(一)激素对糖异生的调节
激素调节糖异生作用对维持机体的恒稳状态十分重要,激素对糖异生调节实质是调节糖异生和糖酵解这两个途径的调节酶以及控制供应肝脏的脂肪酸,更大量的脂肪酸的获得使肝脏氧化更多的脂肪酸,也就促进葡萄糖合成,胰高血糖素促进脂肪组织分解脂肪,增加血浆脂肪酸,所以促进糖异生;而胰岛素的作用则正相反。胰高血糖素和胰岛素都可通过影响肝脏酶的磷酸化修饰状态来调节糖异生作用,胰高血糖素激活腺苷酸环化酶以产生cAMP,也就激活cAMP依赖的蛋白激酶,后者磷酸化丙酮酸激酶而使之抑制,这一酵解途径上的调节酶受抑制就刺激糖异生途径,因为阻止磷酸烯醇式丙酮酸向丙酮酸转变。胰高血糖素降低2,6-二磷酸果糖在肝脏的浓度而促进1,6-二磷酸果糖转变为6磷酸果糖,这是由于2,6-二磷酸果糖是果糖二磷酸酶的别位抑制物,又是6磷酸果糖激酶的别位激活物,胰高血糖素能通过cAMP促进双功能酶(6磷酸果糖激酶2/果糖2,6-二磷酸酶)磷酸化。这个酶经磷酸化后就灭活激酶部位却活化磷酸酶部位,因而2,6-二磷酸果糖生成减少而被水解为6磷酸果糖增多。这种由胰高血糖素引致的2,6-二磷酸果糖下降的结果是6磷酸果糖激酶1活性下降,果糖二磷酸酶活性增高,果糖二磷酸转变为6磷酸果糖增多,有利糖异生,而胰岛素的作用正相反(图4-13)。
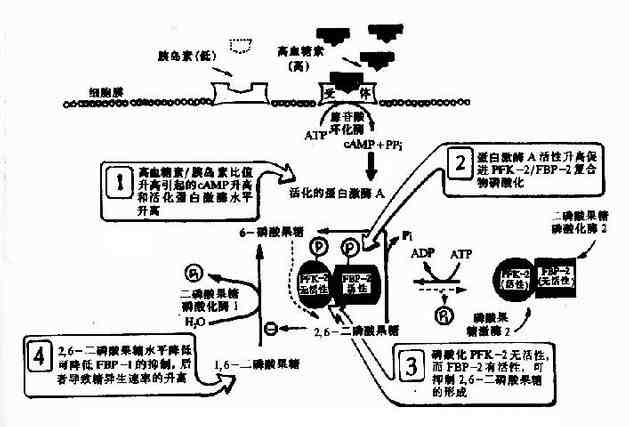
图4-13 高血糖素水平升高对肝细胞外2,6-二磷酸果糖浓度的影响
除上述胰高血糖素和胰岛素对糖异生和糖酵解的短快调节,它们还分别诱导或阻遏糖异生和糖酵解的调节酶,胰高血糖素/胰岛素比例高诱导大量磷酸烯醇式丙酮酸羧激酶,果糖6-磷酸酶等糖异生酶合成而阻遏葡萄糖激酶和丙酮酸激酶的合成。
(二)代谢物对糖异生的调节
1.糖异生原料的浓度对糖异生作用的调节血浆中甘油、乳酸和氨基酸浓度增加时,使糖的异生作用增强。例如饥饿情况下,脂肪动员增加,组织蛋白质分解加强,血浆甘油和氨基酸增高;激烈运动时,血乳酸含量剧增,都可促进糖异生作用。
2.乙酰辅酶A浓度对糖异生的影响乙酰辅酶A决定了丙酮酸代谢的方向,脂肪酸氧化分解产生大量的乙酰辅酶A可以抑制丙酮酸脱氢酶系,使丙酮酸大量蓄积,为糖异生提供原料,同时又可激活丙酮酸羧化酶,加速丙酮酸生成草酰乙酸,使糖异生作用增强。
此外乙酰CoA与草酰乙酸缩合生成柠檬酸由线粒体内透出而进入细胞液中,可以抑制磷酸果糖激酶,使果糖二磷酸酶活性升高,促进糖异生。
第四节 糖原的合成与分解
糖原是由多个葡萄糖组成的带分枝的大分子多糖(图4-14),分子量一般在106-107道尔顿,可高达108道尔顿,是体内糖的贮存形式,分子中葡萄糖主要以α-1,4-糖苷键相连形成直链,其中部分以α-1,6-糖苷键相连构成枝链,糖原主要贮存在肌肉和肝脏中,肌肉中糖原约占肌肉总重量的1-2%约为400克,肝脏中糖原占总量6-8%约为100克。肌糖原分解为肌肉自身收缩供给能量,肝糖原分解主要维持血糖浓度(图4-15)。
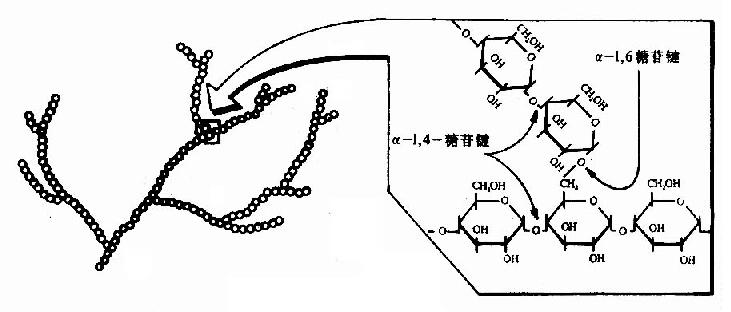
图4-14 糖原的结构
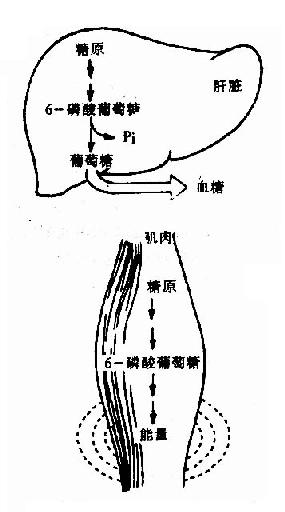
图4-15 肌糖原和肝糖原的功能
一、糖原的合成
由葡萄糖(包括少量果糖和半乳糖)合成糖原的过程称为糖原合成,反应在细胞质中进行,需要消耗ATP和UTP,合成反应包括以下几个步骤:
(1)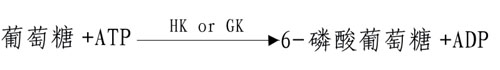
(2)
(3)1-磷酸葡萄糖+UTP UDPG+PPi(焦磷酸)
UDPG+PPi(焦磷酸)
(4)UDPG+糖原(Gn) UDP+糖原(Gn+1)
UDP+糖原(Gn+1)
糖原合成酶催化的糖原合成反应不能从头开始合成第一个糖分子,需要至少含4个葡萄糖残基的α-1,4-多聚葡萄糖作为引物(primer),在其非还原性末端与UDPG反应,UDPG上的葡萄糖基C1与糖原分子非还原末端C4形成α-1,4-糖苷链,使糖原增加一个葡萄糖单位,UDPG是活泼葡萄糖基的供体,其生成过程中消耗UTP,故糖原合成是耗能过程,糖原合成酶只能促成α-1,4-糖苷键,因此该酶催化反应生成为α-1,4-糖苷键相连构成的直链多糖分子如淀粉。
机体内存在一种特殊蛋白质称为glycogenin,可做为葡萄糖基的受体,从头开始如合成第一个糖原分子的葡萄糖,催化此反应的酶是糖原起始合成酶(glycogen initiaor synthase),进而合成一寡糖链作为引物,再继续由糖原合成酶催化合成糖。同时糖原分枝链的生成需分枝酶(branching enzyme)催化,将5-8个葡萄糖残基寡糖直链转到另一糖原子上以α-1.6-糖苷键相连,生成分枝糖链,在其非还原性末端可继续由糖原合成酶催化进行糖链的延长。多分枝增加糖原水溶性有利于其贮存,同时在糖原分解时可从多个非还原性末端同时开始,提高分解速度(图4-16)。
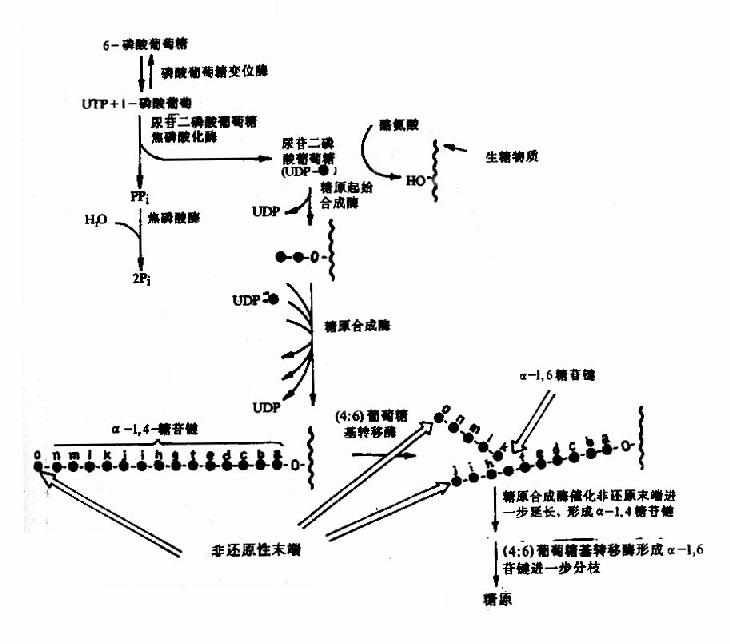
图4-16 糖原合成
二、糖原的分解
糖原分解不是糖原合成的逆反应,除磷酸葡萄糖变位酶外,其它酶均不一样,反应包括:
(1)Gn糖原+Pi![]() G-1-P+g(n-1)
G-1-P+g(n-1)
(2)G-1-P![]() G-6-P
G-6-P
(3)G-6-P+H2O![]() G+PI
G+PI
这样将糖原中1个糖基转变为1分子葡萄糖,但是磷酸化酶只作用于糖原上的α(1→4)糖苷键,并且催化至距α(1→6)糖苷键4个葡萄糖残基时就不再起作用,这时就要有脱枝酶(debranching enzyme)的参与才可将糖原完全分解。脱枝酶是一种双功能酶,它催化糖原脱枝的两个反应,第一种功能是4-α-葡聚糖基转移酶(4-α-D-glucanotrnsferase)活性,即将糖原上四葡聚糖分枝链上的三葡聚糖基转移到酶蛋白上,然后再交给同一糖原分子或相邻糖原分子末端具自由4羟基的葡萄糖残基上,生成α(1→4)糖苷键,结果直链延长3个葡萄糖(图5-6),而α(1→6)分枝处只留下1个葡萄糖残基,在脱枝酶的另一功能,即1,6-葡萄糖苷酶活性催化下,这个葡萄糖基被水解脱下,为游离的葡萄糖,在磷酸化酶与脱枝酶的协同和反复的作用下,糖原可以完全磷酸化和水解(图4-17)。
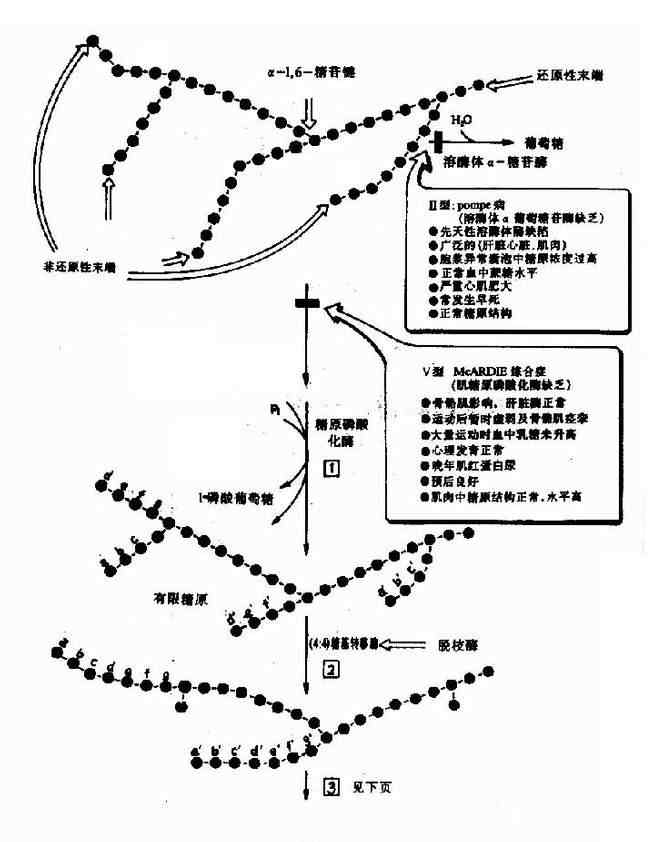
图4-17 糖原的分解
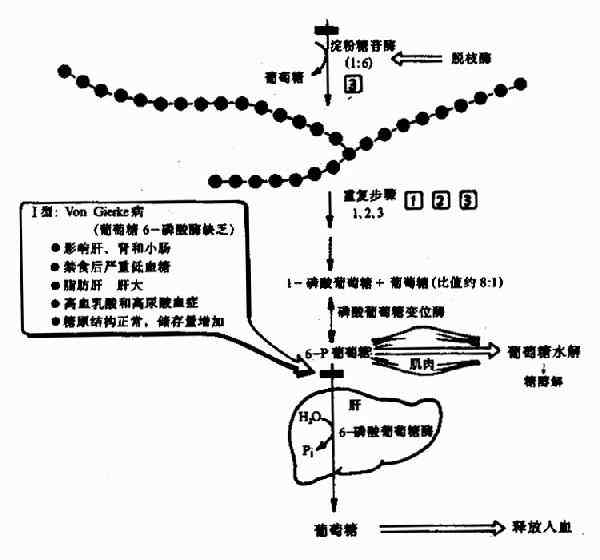
三、糖原代谢的调节
糖原合成酶和磷酸化酶分别是糖原合成与分解代谢中的限速酶,它们均受到变构与共价修饰两重调节。
(一)糖原代谢的别构调节
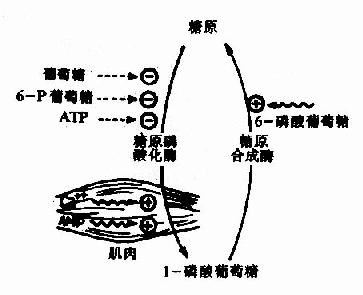
图4-18 糖原合成和分解的调节
6-磷酸葡萄糖可激活糖原合成酶,刺激糖原合成,同时,抑制糖原磷酸化酶阻止糖原分解,ATP和葡萄糖也是糖原磷酸化酶抑制剂,高浓度AMP可激活无活性的糖原磷酸化酶b使之产生活性,加速糖原分解。Ca2+可激活磷酸化酶激酶进而激活磷酸化酶,促进糖原分解(图4-18)。
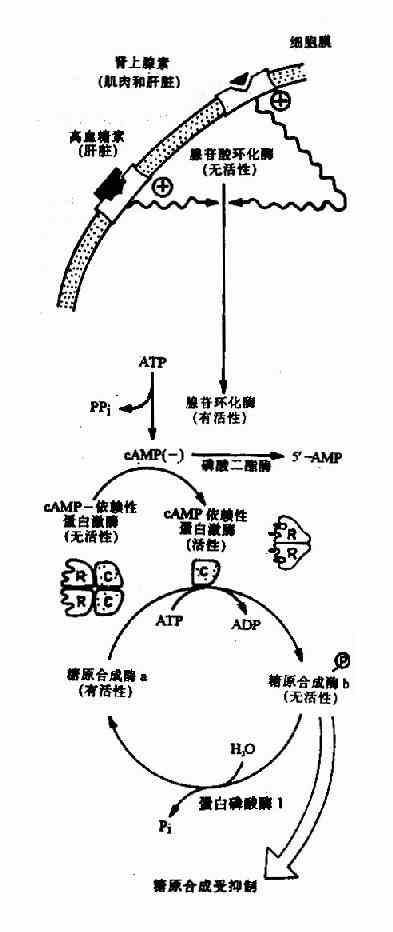
图4-19 糖原合成的抑制
(二)激素的调节
体内肾上腺素和胰高血糖素可通过cAMP连锁酶促反应逐级放大,构成一个调节糖原合成与分解的控制系统。
当机体受到某些因素影响,如血糖浓度下降和剧烈活动时,促进肾上腺素和胰高血糖素分泌增加,这两种激素与肝或肌肉等组织细胞膜受体结合,由G蛋白介导活化腺苷酸环化酶,使cAMP生成增加,cAMP又使cAMP依赖蛋白激酶(cAMpdependent protein kinase)活化,活化的蛋白激酶一方面使有活性的糖原合成酶a磷酸化为无活性的糖原合成酶b(图4?9);另一面使无活性的磷酸化酶激酶磷酸化为有活性的磷酸化酶激酶,活化的磷酸化酶激酶进一步使无活性的糖原磷酸化酶b磷酸化转变为有活性的糖原磷酸化酶a(图4?0),最终结果是抑制糖原生成,促进糖原分解,使肝糖原分解为葡萄糖释放入血,使血糖浓度升高,肌糖原分解用于肌肉收缩。
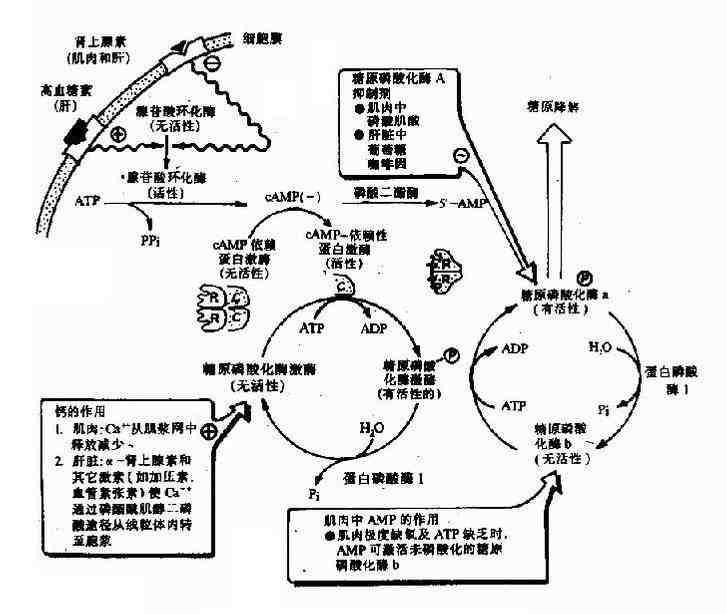
图4-20 糖原合成的抑制
第五节 血糖及血糖含量调节
血液中的糖主要是葡萄糖,称为血糖(bloodsugar),血糖的含量是反映体内糖代谢状况的一项重要指标。正常情况下,血糖含量有一定的波动范围,正常人空腹静脉血含葡萄糖3.89~6.11mmol/L,当血糖的浓度高于8.89~10.00mmol/L,超过肾小管重吸收的能力,就可出现糖尿现象,通常将8.89~10.00mmol/L,血糖浓度称为肾糖阈(renal threshold ofglucose),即尿中出现糖时血糖的最低界限。
在进食后,由于大量葡萄糖吸收入血,血糖升高,但一般在2小时后又可恢复到正常范围,在轻度饥饿初期,血糖可以稍低于正常,但在短期内,即使不进食物,血糖也可恢复并维持在正常水平,为什么血糖含量能经常地维持在一定范围内?这是血糖有许多来源和去路,这些来源和去路在神经和激素的调节下,使血糖处于动态平衡状态。
血糖含量维持一定水平,对于保证人体各组织器官特别是脑组织的正常机能活动极为重要,脑组织主要依靠糖有氧氧化供能,所以脑组织在血糖低于正常值的1/3-1/2时,即可引起机能障碍,在动物甚至引起死亡。
一、血糖的来源和去路
血糖的每一来源和去路都是糖代谢反应的一条途径,血糖的根本来源是食物中的糖类,在不进食而血糖趋于降低时,则肝糖原分解作用加强,当长期饥饿时,则肝脏糖异生作用增强,因而血糖仍能继续维持在正常水平。
血糖的主要去路是在组织器官中氧化供能,也可合成糖原贮存或转变成脂肪及某些氨基酸等,血糖从尿中排出不是一种正常的去路,只是在血糖浓度超过肾糖阈时,一部分糖从尿中排出,称为糖尿(glucosuria)。
二、激素对血糖的调节作用
多种激素参与对血糖浓度的调节,使血糖浓度降低的激素有胰岛素,使血糖升高的激素主要有肾上腺素、胰高血糖素、肾上腺皮质激素、生长素等,它们对血糖的调节主要是通过对糖代谢各主要途径的影响来实现的。
三、神经调节
用电刺激交感神经系的视丘下部腹内侧核(ventromedial hypothalamic nucleus,VMH)或内脏神经,能使肝糖原减少,血糖升高,同时磷酸化酶磷酸酶活性迅速降低,磷酸化酶a的含量增加和葡萄糖-6-磷酸酶的活性升高。上升效果在电刺激后仅30秒钟即可达到最高值,比注射肾上腺素或胰高血糖素的效果快,而且cAMP的含量不变,磷酸化酶激酶的活性也不变,说明电刺激的直接应答反应与肾上腺素或胰高血糖素的作用不同。
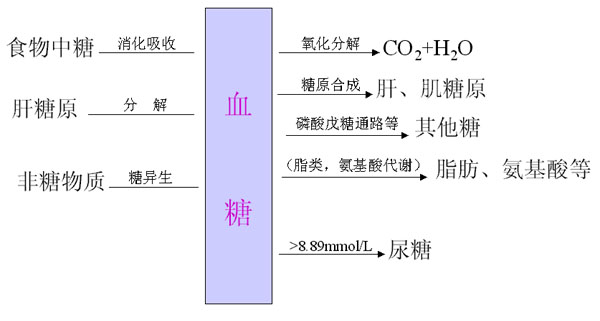
用电刺激副交感神经系的视丘下部外侧核(lateral hypothalamic nucleus,LH)或迷走神经时,肝糖原合成酶I活性增加,而磷酸烯醇式丙酮酸羧激酶活性却降低,从而肝糖原合成增加,摘除胰岛的动物,仍可得到类似结果,以上事实证明神经对血糖浓度可通过对糖原合成和分解代谢的调节而产生影响。
四、糖代谢障碍
1.高血糖及糖尿症(hyperglycemia and glucosuria)
空腹血糖浓度高于7.22~7.78mmol/L(folin吴宪法)称为高血糖,超过肾糖阈时出现糖尿。在生理情况下也会出现高血糖和糖尿,如情绪激动时交感神经兴奋,使肾上腺素分泌增加,肝糖原分解,血糖浓度上升而出现糖尿,称为情感性糖尿(emotional glucosuria),一次食入大量的糖,血糖急剧增高,出现糖尿称为饮食性糖尿(alimentary glucosuria)。临床上静脉点滴葡萄糖速度过快,每小时每公斤体重超过0.4~0.5克时,也会引起糖尿。
 糖耐量曲线
糖耐量曲线
持续性高血糖和糖尿,特别是空腹血糖和糖耐量曲线高于正常范围,主要见于糖尿病(diabetes mellitus)。
某些慢性肾炎、肾病综合症等引起肾脏对糖的重吸收障碍而出现糖尿,但血糖及糖耐量曲线均正常。
2.低血糖(hypoglycemia)
空腹血糖浓度低于3.33~3.89mmol/L(folin吴宪法)时称为低血糖。
低血糖影响脑的正常功能,因为脑细胞中含糖原极少,脑细胞所需要的能量主要来自葡萄糖的氧化,当血糖含量降低时,就会影响脑细胞的机能活性,因而出现头晕、倦怠无力、心悸、手颤、出冷汗、严重时出现昏迷,称为低血糖休克,如不及时给病人静脉注入葡萄糖液,就会死亡。
出现低血糖的病因有:(1)胰性(胰岛β细胞机能亢进、胰岛α-细胞机能低下等);(2)肝性(肝癌、糖原病等);(3)内分泌异常(垂体机能低下,肾上腺皮质机能低下等);(4)肿瘤(胃癌)等;(5)饥饿或不能进食者等。
表4-2 激素对血糖及糖原合成、分解代谢影响
| 降低血糖的激素 | 升高血糖的激素 | ||||
| 激素 | 对糖代谢影响 | 促进释放 主要因素 |
激素 | 对糖代谢影响 | 促进释放 主要因素 |
| 胰 岛 素 |
1.促进肌肉、脂肪组织细胞膜对葡萄糖的通透性,使血糖易于时入细胞内(肝、脑例外) 2.促进葡萄糖激酶活性,使血糖易于进入肝细胞内合成肝糖原. 3.促进糖氧化. 4.促进糖变成脂肪. 5.抑制糖异生,肝糖元分解. |
高血糖,高氨基酸,迷走神经兴奋. 胰泌素,胰高血糖素. |
肾上腺素 | 1.促进肝糖原分解为血糖. 2.促进肌糖原酵解. 3.促进糖异生 |
交感神经兴奋,低血糖 |
| 胰高血糖素 | 1.促进肝糖原分解成血糖. 2.促进糖异生. |
低血糖,低氨基酸,促胰酶(胆囊素收缩素) | |||
| 糖皮质激素 | 1.促进肝外组织蛋白分解生成氨基酸. 2.促进肝脏中糖异生. |
应激 | |||
| 生长素 | 早期:有胰岛素样作用(时间很短). 晚期:有抗胰岛素样作用(主要作用) |
低血糖,运动,应激 | |||
3.糖耐量试验(glucose tolerane test,GTT)
临床上常用糖耐量试验来诊断病人有无糖代谢异常,常用口服的糖耐量试验,被试者清晨空腹静脉采血测定血糖浓度,然后一次服用100克葡萄糖,服糖后的1/2、1、2小时(必要时可在3小时)各测血糖一次,以测定血糖的时间为横坐标(空腹时为0时),血糖浓度为纵座标,绘制糖耐量曲线,正常人服糖后1/2-1小时达到高峰,然后逐渐降低,一般在2小进左右恢复正常值,糖尿病患者空腹血糖高于正常值,服糖后血糖浓度急剧升高,2小时后仍可高于正常。
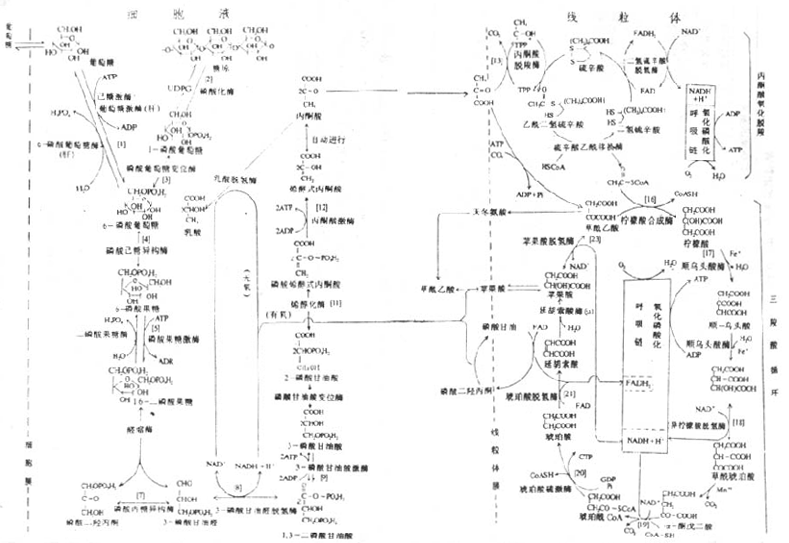
第五章 脂类代谢
第一节 概 述
脂类是机体内的一类有机大分子物质,它包括范围很广,其化学结构有很大差异,生理功能各不相同,其共同理化性质是不溶于水而溶于有机溶剂。
一、脂类的分类及其功能
脂类分为两大类,即脂肪(fat)和类脂(lipids)
(一)脂肪:即甘油三脂或称之为脂酰甘油(triacylglycerol),它是由1分子甘油与3个分子脂肪酸通过酯键相结合而成。人体内脂肪酸种类很多,生成甘油三脂时可有不同的排列组合,因此,甘油三脂具有多种形式。贮存能量和供给能量是脂肪最重要的生理功能。1克脂肪在体内完全氧化时可释放出38kJ(9.3kcal),比1克糖原或蛋白质所放出的能量多两倍以上。脂肪组织是体内专门用于贮存脂肪的组织,当机体需要时,脂肪组织中贮存在脂肪可动员出来分解供给机体能量。此外,脂肪组织还可起到保持体温,保护内脏器官的作用。
(二)类脂:包括磷脂(phospholipids),糖脂(glycolipid)和胆固醇及其酯(cholesterol and cholesterol ester)三大类。磷脂是含有磷酸的脂类,包括由甘油构成的甘油磷脂(phosphoglycerides)和由鞘氨醇构成的鞘磷脂(sphingomyelin)。糖脂是含有糖基的脂类。这三大类类脂是生物膜的主要组成成分,构成疏水性的“屏障”(barrier),分隔细胞水溶性成分和细胞器,维持细胞正常结构与功能。此外,胆固醇还是脂肪酸盐和维生素D3以及类固醇激素合成的原料,对于调节机体脂类物质的吸收,尤其是脂溶性维生素(A,D,E,K)的吸收以及钙磷代谢等均起着重要作用。
二、脂类的消化和吸收
正常人一般每日每人从食物中消化60?50克的脂类,其中甘油三脂占到90%以上,除此以外还有少量的磷脂、胆固醇及其酯和一些游离脂肪酸(free fattyacids)。食物中的脂类在成人口腔和胃中不能被消化,这是由于口腔中没有消化脂类的酶,胃中虽有少量脂肪酶,但此酶只有在中性PH值时才有活性,因此在正常胃液中此酶几乎没有活性(但是婴儿时期,胃酸浓度低,胃中PH值接近中性,脂肪尤其是乳脂可被部分消化)。脂类的消化及吸收主要在小肠中进行,首先在小肠上段,通过小肠蠕动,由胆汁中的胆汁酸盐使食物脂类乳化,使不溶于水的脂类分散成水包油的小胶体颗粒,提高溶解度增加了酶与脂类的接触面积,有利于脂类的消化及吸收。在形成的水油界面上,分泌入小肠的胰液中包含的酶类,开始对食物中的脂类进行消化,这些酶包括胰脂肪酶(pancreatic lipase),辅脂酶(colipase),胆固醇酯酶(pancreatic cholesteryl ester hydrolase or cholesterol esterase)和磷脂酶A2(phospholipase A2)。
食物中的脂肪乳化后,被胰脂肪酶催化,水解甘油三酯的1和3位上的脂肪酸,生成2-甘油一酯和脂肪酸。此反应需要辅脂酶协助,将脂肪酶吸附在水界面上,有利于胰脂酶发挥作用。
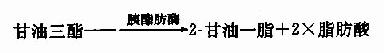
食物中的磷脂被磷脂酶A2催化,在第2位上水解生成溶血磷脂和脂肪酸,胰腺分泌的是磷脂酶A2原,是一种无活性的酶原形成,在肠道被胰蛋白酶水解释放一个6肽后成为有活性的磷脂酶A2催化上述反应。
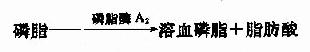
食物中的胆固醇酯被胆固醇酯酶水解,生成胆固醇及脂肪酸。

食物中的脂类经上述胰液中酶类消化后,生成甘油一酯、脂肪酸、胆固醇及溶血磷脂等,这些产物极性明显增强,与胆汁乳化成混合微团(mixed micelles)。这种微团体积很小(直径20nm),极性较强,可被肠粘膜细胞吸收。
脂类的吸收主要在十二指肠下段和盲肠。甘油及中短链脂肪酸(<=10C)无需混合微团协助,直接吸收入小肠粘膜细胞后,进而通过门静脉进入血液。长链脂肪酸及其它脂类消化产///物随微团吸收入小肠粘膜细胞。长链脂肪酸在脂酰CoA合成酶(fattyacyl CoA synthetase)催化下,生成脂酰CoA,此反应消耗ATP。
![]()
脂酰CoA可在转酰基酶(acyltransferase)作用下,将甘油一酯、溶血磷脂和胆固醇酯化生成相应的甘油三酯、磷脂和胆固醇酯。体内具有多种转酰基酶,它们识别不同长度的脂肪酸催化特定酯化反应。
这些反应可看成脂类的改造过程,即将食物中动、植物的脂类转变为人体的脂类。
在小肠粘膜细胞中,生成的甘油三酯、磷脂、胆固醇酯及少量胆固醇,与细胞内合成的载脂蛋白(apolipprotein)构成乳糜微粒(chylomicrons),通过淋巴最终进入血液,被其它细胞所利用。可见,食物中的脂类的吸收与糖的吸收不同,大部分脂类通过淋巴直接进入体循环,而不通过肝脏。因此食物中脂类主要被肝外组织利用,肝脏利用外源的脂类是很少的(见图5-5)。
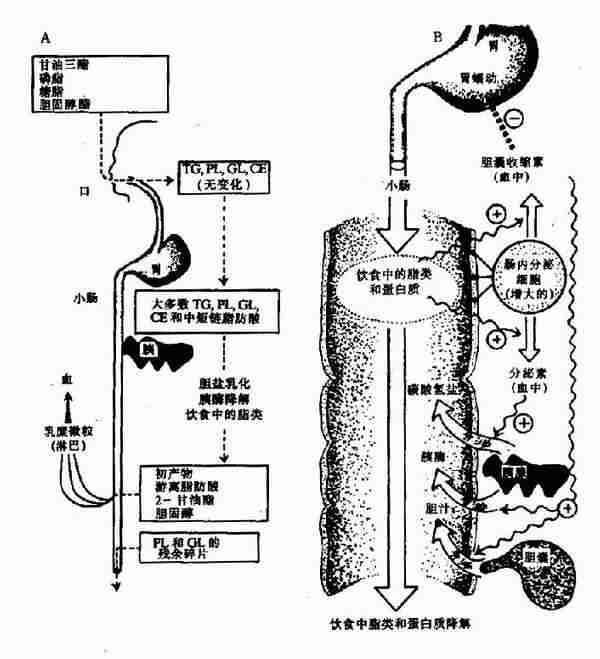
图5-1 脂类消化 A.概貌 B.小肠中脂类代谢的激素控制
第二节 血脂及其代谢
血浆中含有的脂类统称为血酯,包括甘油三酯、磷脂、胆固醇及其酯和非酯化脂肪(nonesterified fatty acid),亦称游离脂肪酸(free fatty acid,简写FFA)。血脂在脂类的运输和代谢上起着重要作用。血脂只占体重的0.04%,其含量受到饮食、营养、疾病等因素的影响,因而是临床上了解患者脂类代谢情况的一个重要窗口。正常人血脂含量见表5?。它们是以脂蛋白的形式存在并运输的,脂蛋白由脂类与载脂蛋白结合而形成。脂蛋白具有微团结构,非极性的甘油三酯、胆固醇酯等位于核心,外周为亲水性的载脂蛋白和胆固醇磷脂等的极性基因,这样使脂蛋白具有较强水溶性,可在血液中运输(图5-2)。
表5-1 正常成人空腹血脂的主要成分和含量
| 脂类物质 | 含量(毫克/100毫升血浆) | 脂类物质 | 含量(毫克/100毫升血浆) |
| 脂类总重 | 400-700(500) | 胆固醇 | 105-260(200) |
| 甘油三酯 | 10-160(100) | 酯型 | 90-260(145) |
| 磷脂 | 150-250(200) | 自由型 | 40-70(55) |
| 磷脂酰胆碱 | 80-225(110) | 脂肪酸总量 | 110-485(300) |
| 磷脂酰乙醇胺 | 0-30(10) | 非酯化型化脂肪酸 | 5-20 |
| 神经磷脂 | 10-50(30) |
注:括弧内为平均值
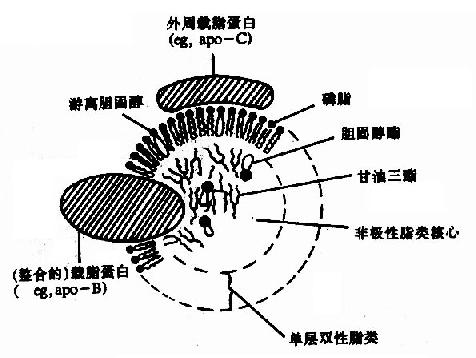
图5-2 血浆脂蛋白的一般结构
一、血浆脂蛋白的分类
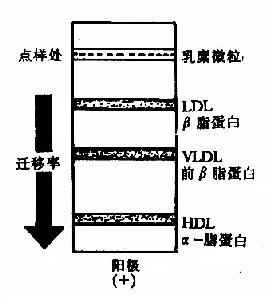
图5-3 血浆脂蛋白的电泳行为
血液中的脂蛋白不是单一的分子形式,其脂类和蛋白质的组成有很大的差异,因此血液中的脂蛋白存在多种形式。根据它们各自的特性采用不同的分类方法,可将它们进行多种分类,一般采用电泳法和超速离心法进行血浆脂蛋白的分类。
(一)电泳分类法
本法根据不同脂蛋白所带表面电荷不同,在一定外加电场作用下,电泳迁移率不同,可将血浆脂蛋白分为四类。如以硝酸纤维素薄膜为支持物,电泳结果是:α-脂蛋白泳动最快,相当于α1-球蛋白的位置;前β脂蛋白次之,相当于α2-球蛋白位置;β-脂蛋白泳动在前-β之后,相当于β-球蛋白的位置;乳糜微粒停留在点样的位置上(见图5-3)。
(二)超速离心法
本法依据不同脂蛋白中蛋白质脂类成分所占比例不同,因而分子密度不同(甘油三酯含量多者密度低,蛋白质含量多的分子密度高),在一定离心力作用下,分子沉降速度或漂浮率不同,将脂蛋白分为四类,即乳糜微粒(chylomicrons)、极低密度脂蛋白(very low densitylipoprotein,VLDL)、低密度脂蛋白(lowdensity lipoprotein,LDL)和高密度脂蛋白(highdensitylipoprotein,HDL);分别相当于电泳分离中的乳糜微粒、前β脂蛋白、β脂蛋白和α脂蛋白。除上述几类脂蛋白以外,还有一种中间密度脂蛋白(intermediate density lipoprotein,IDL)其密度位于VLDL与LDL之间,这是VLDL代谢的中间产物。HDL在代谢过程中分子中蛋白与脂类成分有变化,可将HDL再分为HDL1、HDL2与HDL3。HDL1是在高胆固醇膳食时才出现,HDL2为成熟的HDL,HDL3为新生的HDL,其分子中蛋白成分多。
血浆中的游离中短链脂肪酸可与血浆白蛋白结合而被运输,称之为脂酸白蛋白。由于脂类染色时脂肪酸不着色,所以不易观察,实际上它的位置与白蛋白相当。
二、血浆脂蛋白的组成
(一)脂蛋白中脂类的组成特点:
除脂酸白蛋白外,各类脂蛋白均含有甘油三酯、磷脂、胆固醇及其酯。但组成比例有很大差异,其中甘油三酯在乳糜微粒中含量为最高,达其化学组成的90%左右。磷脂含量以HDL为最高,达40%以上。胆固醇及其酯以LDL中最多,几乎占其含量50%。VLDL中以甘油三酯含量为最多,达60%(见表5-2)。
表5-2 血浆脂蛋白的组成
| 组成 | |||||||||||||
| 分类 | 密度 | 颗粒直径 | S1 | 电泳 | 蛋白质 | 总脂 | 占总脂的% | 合成 | 功能 | ||||
| (mm) | 位置 | 甘油 | 胆固 | 游离 | 部位 | ||||||||
| % | % | 磷脂 | 胆固醇 | ||||||||||
| 三酯 | 醇 酯 | 脂肪酸 | |||||||||||
| CM | <0.95 | 90- | >400 | 原点 | 1-2 | 98-99 | 88 | 8 | 3 | 1 | 小肠粘 | 转运外源性情 | |
| 1000 | 膜细胞 | 甘油三酯 | |||||||||||
| VLDL | 0.95- | 30- | 20- | α2球 | 7-10 | 90-93 | 56 | 20 | 15 | 8 | 1 | 肝细胞 | 转运内源性 |
| 前β脂蛋白 | 1.006 | 90 | 400 | 蛋白 | 甘油三酯 | ||||||||
| LDL | 1.006- | 20-25 | 2-20 | β球 | 21 | 79 | 13 | 28 | 48 | 10 | 1 | 血浆 | 转运内源性 |
| β脂蛋白 | 1.063 | 蛋白 | 胆固醇 | ||||||||||
| HDL | 1.063- | 12-20 | 沉降 | α1球 | 33 | 67 | 16 | 43 | 61 | 10 | 4 | 肝肠 | 转运外源 |
| α脂蛋白 | 1.125 | 蛋白 | 血浆 | 性胆固醇 | |||||||||
| HDL2 | 1.125 | 7.5-10 | 沉降 | α1球 | 57 | 43 | 13 | 46 | 29 | 6 | 6 | 肝肠 | 转运内源性 |
| HDL3 | 1.120 | 蛋白 | 血浆 | 胆固醇 | |||||||||
(二)载脂蛋白(apoprotein,apo)
脂蛋白中与脂类结合的蛋白质称为载脂蛋白,载脂蛋白在肝脏和小肠粘膜细胞中合成。目前已发现了十几种载脂蛋白,结构与功能研究比较清楚的有apoA、apoB、apoC、apoD与apoE五类。每一类脂蛋白又可分为不同的亚类,如apoB分为B100和B48;apoC分为CⅠ、CⅡ、CⅢ等。载脂蛋白在分子结构上具有一定特点,往往含有较多的双性α-螺旋结构,表现出两面性,分子的一侧极性较高可与水溶剂及磷脂或胆固醇极性区结合,构成脂蛋白的亲水面,分子的另一侧极性较低可与非极性的脂类结合,构成脂蛋白的疏水核心区。
载脂蛋白的主要功能是稳定血浆脂蛋白结构,作为脂类的运输载体。除此以外有些脂蛋白还可作为酶的激活剂:如apoAI激活卵磷脂胆固醇脂酰转移酶(lecithincholesteroltransferase.LCAT),apoCⅡ可激活脂蛋白脂肪酶(lipoproteinlipase,LPL)。有些脂蛋白也可作为细胞膜受体的配体:如apo B-48,apoE参与肝细胞对CM的识别,apoB-100可被各种组织细胞表面LDL受体所识别等(见表5-3)。
表5-3 血浆脂蛋白的载脂蛋白
| 载脂蛋白 | 脂蛋折 | 氨基酸数 | 分子量 | 来源 | 功能 | 含量 |
| AⅠ | HDL,CM | 243 | 28.300 | 肝、肠 | 激活LCAT;HDL受体配基 | 121.8±13.7* |
| AⅡ | HDL,CM | 77 | 17.500 | 肝、肠 | 稳定HDL结构?抑制LCAT? | 33.0±5.0* |
| AⅣ | CM,HDL | 371 | 46.000 | 肠 | 功能不清(促进CM合成?) | 17±2△ |
| B-100 | LDL,VLDL,IDL | 4536 | 512,723 | 肝 | LDL受体配基(识别LDL受体) | 87.3±143* |
| B-48 | CM,CM残粒 | 265 000 | 肠 | 促进CM合成 | 5△ | |
| CⅠ | VLDL,HDL,CM | 57 | 6,500 | 肝 | 激活LCAT? | 7.8±2.4* |
| CⅡ | VLDL,HDL,CM | 79 | 8,800 | 肝 | 激活肝外LPL | 5.0±1.8* |
| CⅢ | VLDL,HDL,CM | 79 | 8,900 | 肝 | 抑制LPL,抑制肝apoE受体 | 11.8±3.6* |
| D | HDL | 22,100 | 肝? | 功能不清(转达运胆固醇酯? | 10±4△ | |
| VLDL,HDL,CM | LDL受体配基,肝CM残受体) | |||||
| E | CM残粒 | 299 | 34,000 | 肝 | (apoE受体)配基 | 3.5±1.2* |
*华西医科大学生化教研室对625例成都地区正常成人测定的结果。△国外报导参考值。
LCAT:卵磷脂胆固醇脂酰转移酶 LPL:脂蛋白脂肪酶
(三)脂蛋白的代谢
1.乳糜微粒(CM)
乳糜微粒是在小肠粘膜细胞中生成的,食物中的脂类在细胞滑面内质网上经再酯化后与粗面内质网上合成的载脂蛋白构成新生的(nascent)乳糜微粒(包括甘油三酯、胆固醇酯和磷脂以及poB48),经高尔基复合体分泌到细胞外,进入淋巴循环最终进入血液。
新生乳糜微粒入血后,接受来自HDL的apoC和apoE,同时失去部分apoA,被修饰成为成熟的乳糜微粒。成熟分子上的apoCⅡ可激活脂蛋白脂肪酶(LPL)催化乳糜微粒中甘油三酯水解为甘油和脂肪。此酶存在于脂肪组织、心和肌肉组织的毛细血管内皮细胞外表面上。脂肪酸可被上述组织摄取而利用,甘油可进入肝脏用于糖异生。通过LPL的作用,乳糜微粒中的甘油三酯大部分被水解利用,同时apoA、apoC、胆固醇和磷脂转移到HDL上,CM逐渐变小,成为以含胆固醇酯为主的乳糜微粒残余颗粒(remnant)。肝细胞膜上的apoE受体可识别CM残余颗粒,将其吞噬入肝细胞,与细胞溶酶体融合,载脂蛋白被水解为氨基酸,胆固醇酯分解为胆固醇和脂肪酸,进而可被肝脏利用或分解,完成最终代谢(图5-4)。
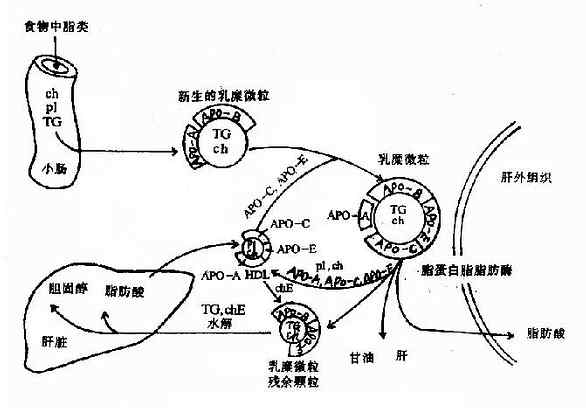
图5-4 乳糜微粒(CM)的代谢过程
TG:甘油三酯;pL:磷脂;Ch:胆固醇;ChE:胆固醇酯;ApO:载脂蛋白;HDL:高密度脂蛋白。
由此可见,CM代谢的主要功能就是将外源性甘油三酯转运至脂肪、心和肌肉等肝外组织而利用,同时将食物中外源性胆固醇转运至肝脏。
2.极低密度脂蛋白(VLDL)
VLDL主要在肝脏内生成,VLDL主要成分是肝细胞利用糖和脂肪酸(来自脂动员或乳糜微粒残余颗粒)自身合成的甘油三酯,与肝细胞合成的载脂蛋白apoB100、apoAI和apoE等加上少量磷脂和胆固醇及其酯。小肠粘膜细胞也能生成少量VLDL。
VLDL分泌入血后,也接受来自HDL的apoC和apoE:apoCⅡ激活LPL,催化甘油三酯水解,产物被肝外组织利用。同时VLDL与HDL之间进行物质交换,一方面是将apoC和apoE等在两者之间转移,另一方面是在胆固醇酯转移蛋白(cholesteryl ester transfer protein)协助下,将VLDL的磷脂、胆固醇等转移至HDL,将HDL的胆固醇酯转至VLDL,这样VLDL转变为中间密度脂蛋白(IDL)。IDL有两条去路:一是可通过肝细胞膜上的apoE受体而被吞噬利用,另外还可进一步入被水解生成LDL(图5-5)。
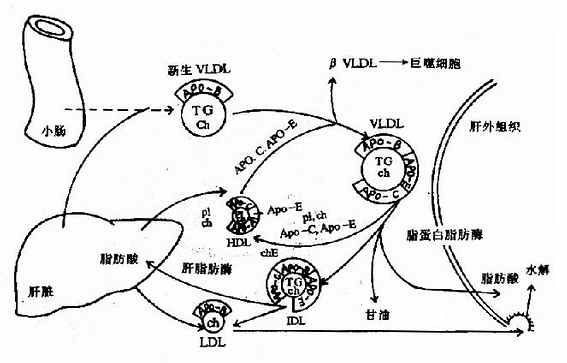
图5-5 极低密度脂蛋白(VLDL)的代谢过程
IDL:中间密度脂蛋白;LDL:低密度脂蛋白;
由此可见,VLDL是体内转运内源性甘油三酯的主要方式。
3.低密度脂蛋白(LDL)
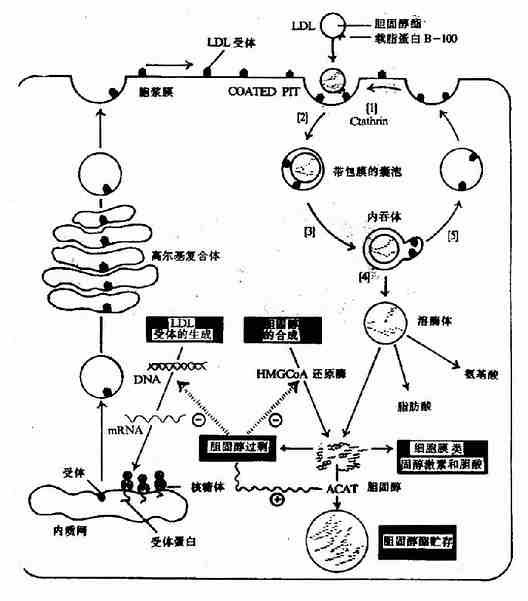
图5-6 细胞对LDL的摄取和降解
LDL由VLDL转变而来,LDL中主要脂类是胆固醇及其酯,载脂蛋白为apoB100。
LDL在血中可被肝及肝外组织细胞表面存在的apoB100受体识别,通过此受体介导,吞入细胞内,与溶酶体融合,胆固醇酯水解为胆固醇及脂肪酸。这种胆固醇除可参与细胞生物膜的生成之外,还对细胞内胆固醇的代谢具有重要的调节作用:①通过抑制HMGCoA还原酶(HMGCoa reductase)活性,减少细胞内胆固醇的合成;②激活脂酰CoA胆固醇酯酰转移酶(acyl CoA:cholesterol acyltransferase,ACAT)使胆固醇生成胆固醇酯而贮存;③抑制LDL受体蛋白基因的转录,减少LDL受体蛋白的合成,降低细胞对LDL的摄取(图5-6)。
除上述有受体介导的LDL代谢途径外,体内内皮网状系统的吞噬细胞也可摄取LDL(多为经过化学修饰的LDL),此途径生成的胆固醇不具有上述调节作用。因此过量的摄取LDL可导致吞噬细胞空泡化。
从以上可以看出,LDL代谢的功能是将肝脏合成的内源性胆固醇运到肝外组织,保证组织细胞对胆固醇的需求。
4.高密度脂蛋白(HDL)
HDL在肝脏和小肠中生成。HDL中的载脂蛋白含量很多,包括apoA、apoC、apoD和apoE等,脂类以磷脂为主。
HDL分泌入血后,新生的HDL为HDL3,一方面可作为载脂蛋白供体将apoC和apoE等转移到新生的CM和VLDL上,同时在CM和VLDL代谢过程中再将载脂蛋白运回到HDL上,不断与CM和VLDL进行载脂蛋白的变换。另一方面HDL可摄取血中肝外细胞释放的游离胆固醇,经卵磷脂胆固醇酯酰转移酶(LCAT)催化,生成胆固醇酯。此酶在肝脏中合成,分泌入血后发挥活性,可被HDL中apoAI激活,生成的胆固醇酯一部分可转移到VLDL。通过上述过程,HDL密度降低转变为HDL2。HDL2最终被肝脏摄取而降解(图5-7)。
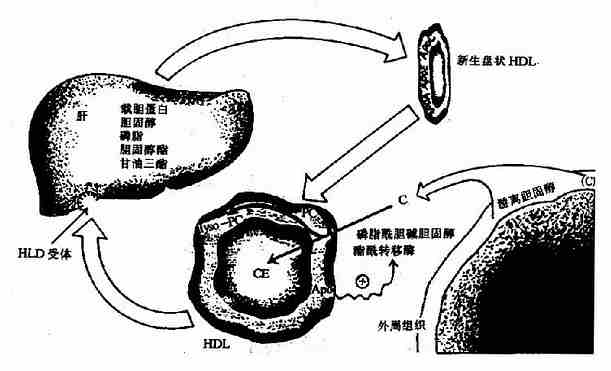
图5-7 HDL代谢 PC表示磷脂酰胆碱,LysoPC表示溶解性磷脂酰胆碱
由此可见,HDL的主要功能是将肝外细胞释放的胆固醇转运到肝脏,这样可以防止胆固醇在血中聚积,防止动脉粥样硬化,血中HDL2的浓度与冠状动脉粥样硬化呈负相关。
(四)高脂蛋白血症
血浆脂蛋白代谢紊乱可以表现为高脂蛋白血症和低脂蛋白血症,后者较为少见,现只介绍高脂蛋白血症。
高脂蛋白血症(hyperlipoproteinemia)亦称高脂血症(hyperlipidemia),因实际上两者均系血中脂蛋白合成与清除紊乱所致。这类病症可以是遗传性的,也可能是其他原因引起的,表现为血浆脂蛋白异常、血脂增高等,现将其六种主要类型列于表5-4。
表5-4 高脂蛋白血症的类型
| 类型 | 脂蛋白变化 | 血脂的变化 | ||
| 主要升高的脂类 | 次要升高的脂类 | 病因 | ||
| Ⅰ | CM增高 | 甘油三酯 | 胆固酯 | LPL或apoCⅡ遗传缺陷 |
| Ⅱa | LDL增高 | 胆固醇 | LDL受体的合成或功能的遗传缺陷 | |
| Ⅱb | LDL VLDL增高 | 甘油三酯 | 胆固醇 | 遗传因素影不大,主要受膳食影响 |
| Ⅲ | LDL增高 | 甘油三酯胆固醇 | apoE异常于扰了CM及VLDL残粒的吸收 | |
| Ⅳ | VLDL增高 | 甘油三酯 | 胆固醇 | 分子缺陷不清,多由于肥胖,饮酒过量或糖尿病所致 |
| Ⅴ | CM VLDL增高 | 甘油三酯 | 胆固醇 | 实际为型Ⅰ和Ⅳ型的混合症 |
第三节 甘油三酯代谢
甘油三酯是人体内含量最多的脂类,大部分组织均可以利用甘油三酯分解产物供给能量,同时肝脏、脂肪等组织还可以进行甘油三酯的合成,在脂肪组织中贮存。
一、甘油三酯的分解代谢
脂肪组织中的甘油三酯在一系列脂肪酶的作用下,分解生成甘油和脂肪酸,并释放入血供其它组织利用的过程,称为脂动员。
![]()
在这一系列的水解过程中,催化由甘油三酯水解生成甘油二酯的甘油三酯脂肪酶是脂动员的限速酶,其活性受许多激素的调节称为激素敏感脂肪酶(hormone sensitive lipase,HSL)。胰高血糖素、肾上腺素和去甲肾上腺素与脂肪细胞膜受体作用,激活腺苷酸环化酶,使细胞内cAMP水平升高,进而激活cAMP依赖蛋白激酶,将HSL磷酸化而活化之,促进甘油三酯水解,这些可以促进脂动员的激素称为脂解激素(lipolytichormones)。胰岛素和前列腺素等与上述激素作用相反,可抑制脂动员,称为抗脂解激素(antilipolytichormones)(见图5-8)。
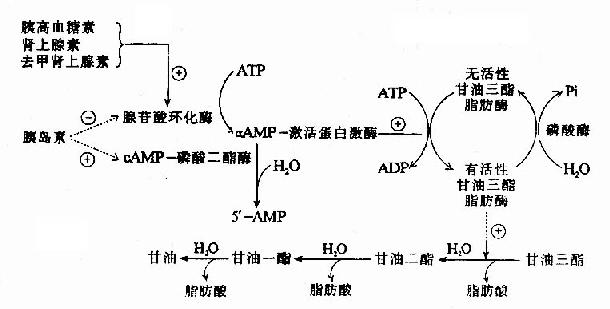
图5-8 激素影响甘油三酯脂肪酶活性的作用机理
脂动员生成的脂肪酸可释放入血,与白蛋白结合形成脂酸白蛋白运输至其它组织被利用。但是,脑及神经组织和红细胞等不能利用脂肪酸,甘油被运输到肝脏,被甘油激酶催化生成3磷酸甘油,进入糖酵解途径分解或用于糖异生。脂肪和肌肉组织中缺乏甘油激酶而不能利用甘油。
二、甘油三酯合成代谢
人体可利用甘油、糖、脂肪酸和甘油一酯为原料,经过磷脂酸途径和甘油一酯途径合成甘油三酯。
(一)甘油一酯途径
以甘油一酯为起始物,与脂酰CoA共同在脂酰转移酶作用下酯化生成甘油三酯。

(二)磷脂酸途径
磷脂酸即3磷酸1,2甘油二酯,是合成含甘油脂类的共同前体。糖酵解的中间产物类磷酸二羟丙酮在甘油磷酸脱氢酶作用下,还原生成α磷酸甘油(或称3磷酸甘油);游离的甘油也可经甘油激酶催化,生成α磷酸甘油(因脂肪及肌肉组织缺乏甘油激酶,故不能利用激离的甘油)。α磷酸甘油在脂酰转移酶(acyl transferase)作用下,与两分子脂酰CoA反应生成3磷酸1,2甘油二酯即磷脂酸(phosphatidic acid)。此外,磷酸二羟丙酮也可不转为α磷酸甘油,而是先酯化,后还原生成溶血磷脂酸,然后再经酯化合成磷脂酸(图5-9)。
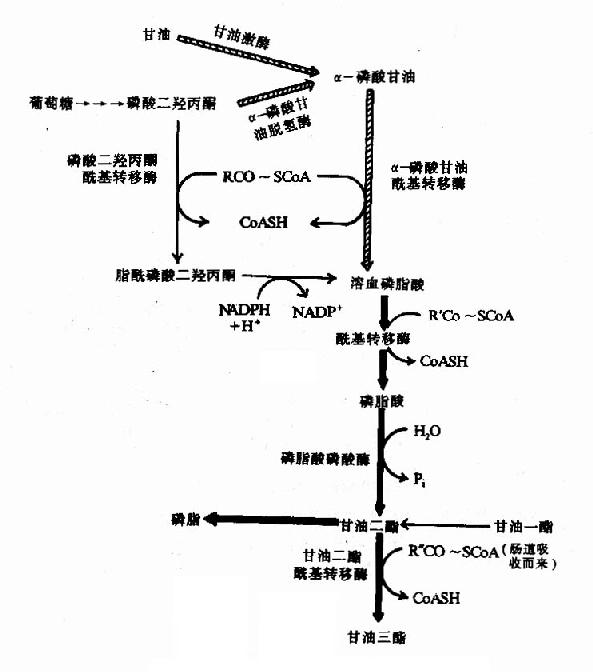
图5-9 甘油三酯的合成
注:图中粗线表示生成磷脂酸的主要途径
磷脂酸在磷脂酸磷酸酶作用下,水解释放出无机磷酸,而转变为甘油二酯,它是甘油三酯的前身物,只需酯化即可生成甘油三酯。
甘油三酯所含的三个脂肪酸可以是相同的或不同的,可为饱和脂肪酸或不饱和脂肪酸。
甘油三酯的合成速度可以受激素的影响而改变,如胰岛素可促进糖转变为甘油三酯。由于胰岛素分泌不足或作用失效所致的糖尿病患者,不仅不能很好利用葡萄糖,而且葡萄糖或某些氨基酸也不能用于合成脂肪酸,而表现为脂肪的氧化速度增加,酮体生成过多,其结果是患者体重下降。此外,胰高血糖素、肾上腺皮质激素等也影响甘油三酯的合成。
(三)不同组织甘油三酯合成特点
不同的组织细胞中甘油三酯的合成各有特点,下面主要讨论肝脏、脂肪组织和小肠粘膜上皮细胞合成甘油三酯的特点。
1.肝脏 肝脏可利用糖、甘油和脂肪酸作原料,通过磷脂酸途径合成甘油三酯。脂肪酸的来源有脂动员来的脂肪酸,由糖和氨基酸转变生成的脂肪酸和食物中来的外源性脂肪酸(食物中脂肪消化吸收后经血入肝的中短链脂肪酸,乳糜微粒残余颗粒中脂肪分解生成的脂肪酸)。
肝细胞含脂类物质约4-7%,其中甘油三酯约占1/2,甘油三酯含量过高会引起脂肪肝,正常情况下,肝脏合成的甘油三酯和磷脂、胆固醇、载脂蛋白一起形成极低密度脂蛋白,分泌入血。若磷脂合成障碍或载脂蛋白合成障碍就会影响甘油三酯转运出肝,引起脂肪肝。另外,若进入肝脏的脂肪酸过多,合成甘油三酯的量超过了合成载脂蛋白的能力,也可引起脂肪肝。
2.脂肪组织 脂肪组织甘油三酯的合成与肝脏基本相同,二者的区别是脂肪组织不能利用甘油,只能利用糖分解提供的α-磷酸甘油;脂肪组织能大量储存甘油三酯。
3.小肠粘膜上皮细胞 小肠粘膜上皮细胞合成甘油三酯有两条途径。在进餐后,食物中的甘油三酯水解生成游离脂肪酸和甘油一酯。吸收后经甘油酯途径合成甘油三酯。这些甘油三酯参与乳糜微粒的组成。这一途径是小肠粘膜甘油三酯合成的主要特点。而在饥饿情况下,小肠粘膜也能利用糖、甘油和脂肪酸作原料,经磷脂酸途径合成甘油三酯,这一部分甘油三酯参与极低密度脂蛋白组成。此时的合成原料和过程又类似于肝脏。
这三种组织中甘油三酯合成的特点可总结如下表。
表5-5 不同组织中甘油三酯合成的特点
| 小肠粘膜上皮细胞 | |||||
| 主要合成途径 | 进餐后 | 空腹 | 肝脏 | 脂肪组织 | |
| 甘油-酯途径 | 磷脂酸途径 | 磷脂酸途径 | 磷脂酸途径 | ||
| a-磷酸甘油的来源 | 糖 | 否 | 可 | 可 | 可 |
| 甘油 | 否 | 可 | 可 | 否 | |
| 主要中间产物 | 甘油二酯 | 磷脂酸 | 磷脂酸 | 磷脂酸 | |
| 甘油三酯可否贮存 | 否 | 否 | 否 | 可 | |
| 动员或分泌形式 | 乳摩微粒 | 极低密度脂度蛋白 | 极低密度脂蛋白 | FFA+甘油 | |
| 生理功能 | 合成外源性TC | 合成内源性TC | 合成内源性TC | 贮存甘油三酯 | |
有关甘油三酯合成代谢的调节目前了解甚少。
第四节 脂肪酸代谢
一、脂肪酸的氧化分解
脂肪酸在有充足氧供给的情况下,可氧化分解为CO2和H2O,释放大量能量,因此脂肪酸是机体主要能量来源之一。肝和肌肉是进行脂肪酸氧化最活跃的组织,其最主要的氧化形式是β-氧化。
(一)脂肪酸的β-氧化过程
此过程可分为活化,转移,β-氧化共三个阶段。
1.脂肪酸的活化
和葡萄糖一样,脂肪酸参加代谢前也先要活化。其活化形式是硫酯:脂肪酰CoA,催化脂肪酸活化的酶是脂酰CoA合成酶(acyl CoA synthetase)。
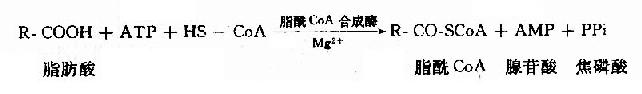
活化后生成的脂酰CoA极性增强,易溶于水;分子中有高能键、性质活泼;是酶的特异底物,与酶的亲和力大,因此更容易参加反应。
脂酰CoA合成酶又称硫激酶,分布在胞浆中、线粒体膜和内质网膜上。胞浆中的硫激酶催化
中短链脂肪酸活化;内质网膜上的酶活化长链脂肪酸,生成脂酰CoA,然后进入内质网用于甘油三酯合成;而线粒体膜上的酶活化的长链脂酰CoA,进入线粒体进入β-氧化。
2.脂酰CoA进入线粒体:催化脂肪酸β-氧化的酶系在线粒体基质中,但长链脂酰CoA不能自由通过线粒体内膜,要进入线粒体基质就需要载体转运,这一载体就是肉毒碱(carnitine),即3-羟-4-三甲氨基丁酸。
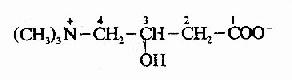
长链脂肪酰CoA和肉毒碱反应,生成辅酶A和脂酰肉毒碱,脂肪酰基与肉毒碱的3羟基通过酯键相连接。
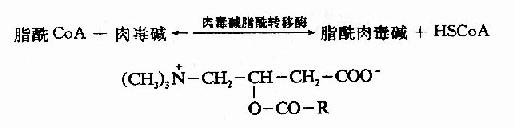
催化此反应的酶为肉毒碱脂酰转移酶(carnitineacyl transferase)。线粒体内膜的内外两侧均有此酶,系同工酶,分别称为肉毒碱脂酰转移酶I和肉毒碱脂酰转移酶Ⅱ。酶Ⅰ使胞浆的脂酰CoA转化为辅酶A和脂肪酰肉毒碱,后者进入线粒体内膜。位于线粒体内膜内侧的酶Ⅱ又使脂肪酰肉毒碱转化成肉毒碱和脂酰CoA,肉毒碱重新发挥其载体功能,脂酰CoA则进入线粒体基质,成为脂肪酸β-氧化酶系的底物(图5-10)。
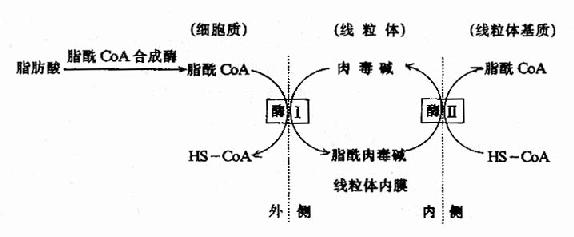
图5-10 肉毒碱参与脂酰辅酶A转入线粒体示意图
酶Ⅰ:位于线粒体内膜外侧的肉毒碱脂酰转移酶
酶Ⅱ:位于线粒体内膜内侧的肉毒碱脂酰转移酶
长链脂酰CoA进入线粒体的速度受到肉毒碱脂酰转移酶Ⅰ和酶Ⅱ的调节,酶Ⅰ受丙二酰CoA抑制,酶Ⅱ受胰岛素抑制。丙二酰CoA是合成脂肪酸的原料,胰岛素通过诱导乙酰CoA羧化酶的合成使丙二酰CoA浓度增加,进而抑制酶Ⅰ。可以看出胰岛素对肉毒碱脂酰转移酶Ⅰ和酶Ⅱ有间接或直接抑制作用。饥饿或禁食时胰岛素分泌减少,肉毒碱脂酰转移酶Ⅰ和酶Ⅱ活性增高,转移的长链脂肪酸进入线粒体氧化供能。
3.β-氧化的反应过程:脂酰CoA在线粒体基质中进入β氧化要经过四步反应,即脱氢、加水、再脱氢和硫解,生成一分子乙酰CoA和一个少两个碳的新的脂酰CoA。
第一步脱氢(dehydrogenation)反应由脂酰CoA脱氢酶活化,辅基为FAD,脂酰CoA在α和β碳原子上各脱去一个氢原子生成具有反式双键的α、β-烯脂肪酰辅酶A。

第二步加水(hydration)反应由烯酰CoA水合酶催化,生成具有L-构型的β-羟脂酰CoA。
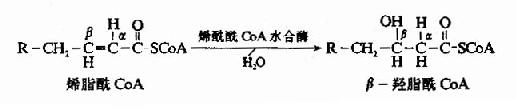
第三步脱氢反应是在β-羟脂肪酰CoA脱饴酶(辅酶为NAD+)催化下,β-羟脂肪酰CoA脱氢生成β酮脂酰CoA。
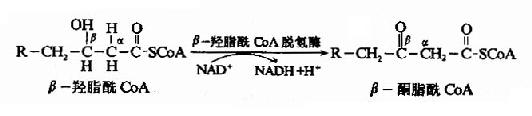
第四步硫解(thiolysis)反应由β-酮硫解酶催化,β-酮酯酰CoA在α和β碳原子之间断链,加上一分子辅酶A生成乙酰CoA和一个少两个碳原子的脂酰CoA。
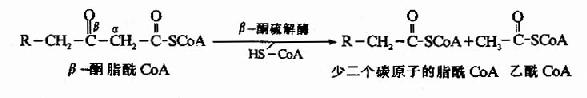
上述四步反应与TCA循环中由琥珀酸经延胡索酸、苹果酸生成草酰乙酸的过程相似,只是β-氧化的第四步反应是硫解,而草酰乙酸的下一步反应是与乙酰CoA缩合生成柠檬酸。
长链脂酰CoA经上面一次循环,碳链减少两个碳原子,生成一分子乙酰CoA,多次重复上面的循环,就会逐步生成乙酰CoA。
从上述可以看出脂肪酸的β-氧化过程具有以下特点。首先要将脂肪酸活化生成脂酰CoA,这是一个耗能过程。中、短链脂肪酸不需载体可直拉进入线粒体,而长链脂酰CoA需要肉毒碱转运。β-氧化反应在线粒体内进行,因此没有线粒体的红细胞不能氧化脂肪酸供能。β-氧化过程中有FADH2和NADH+H+生成,这些氢要经呼吸链传递给氧生成水,需要氧参加,乙酰CoA的氧化也需要氧。因此,β-氧化是绝对需氧的过程。
脂肪酸β-氧化的整个过程可用下图(图5-11)表示:
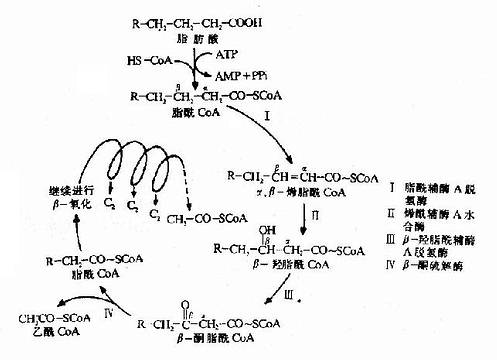
图5-11 脂肪酸β氧化反应过程
(二)脂肪酸β-氧化的生理意义
脂肪酸β-氧化是体内脂肪酸分解的主要途径,脂肪酸氧化可以供应机体所需要的大量能量,以十八个碳原子的饱和脂肪酸硬脂酸为例,其β-氧化的总反应为:
CH3(CH2)15COSCoA+8NAD++*CoASH+8H2O——→9CH3COSCoA+8FADH2+8NADH+8H+
8分子FADH2提供8×2=16分子ATP,8分子NADH+H+提供8×3=24分子ATP,9分子乙酰CoA完全氧化提供9×12=108个分子ATP,因此一克分子硬脂酸完全氧化生成CO2和H2O,共提供148克分子ATP。硬脂酸的活化过程消耗2克分子ATP,所以一克分子硬脂酸完全氧化可净生成146克分子ATP。一克分子葡萄糖完全氧化可生成38分子ATP。三克分子葡萄糖所含碳原子数与一克分子硬脂酸相同,前者可提供114克分子ATP,后者可提供146克分子ATP。可见在碳原子数相同的情况下脂肪酸能提供更多的能量。脂肪酸氧化时释放出来的能量约有40%为机体利用合成高能化合物,其余60%以热的形式释出,热效率为40%,说明人体能很有效地利用脂肪酸氧化所提供的能量。
脂肪酸β-氧化也是脂肪酸的改造过程,人体所需要的脂肪酸链的长短不同,通过β-氧化可将长链脂肪酸改造成长度适宜的脂肪酸,供机体代谢所需。
脂肪酸β-氧化过程中生成的乙酰CoA是一种十分重要的中间化合物,乙酰CoA除能进入三羧酸循环氧化供能外,还是许多重要化合物合成的原料,如酮体、胆固醇和类固醇化合物。
(三)脂肪酸的特殊氧化形式
1.丙酸的氧化:人体内和膳食中含极少量的奇数碳原子脂肪酸,经过β-氧化除生成乙酰CoA外还生成一分子丙酰CoA,某些氨基酸如异亮氨酸、蛋氨酸和苏氨酸的分解代谢过程中有丙酰CoA生成,胆汁酸生成过程中亦产生丙酰CoA。丙酰CoA经过羧化反应和分子内重排,可转变生成琥珀酰CoA,可进一步氧化分解,也可经草酰乙酸异生成糖,反应过程见下图。
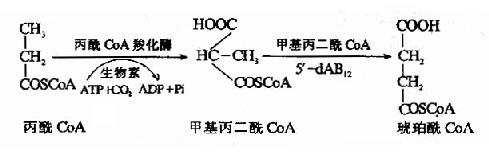
甲基丙二酰CoA变位酶的辅酶是5′-脱氧腺苷B12(5′dAB12),维生素B12缺乏或5′-dAB12生成障碍均影响变位酶活性,使甲基丙二酰CoA堆积。结果,一方面甲基丙二酰CoA脱去辅酶A,生成甲基丙二酸引起血中甲基丙二酸含量增高(甲基丙二酸血症),并从尿中排出体外(24小时排出量大于4mg时称为甲基丙二酸尿症)。另一方面又引起丙酰CoA浓度增高,可参与神经髓鞘脂类合成,生成异常脂肪酸(十五碳、十七碳和十九碳脂肪酸),引起神经髓鞘脱落、神经变性(临床上称为亚急性合并变性症)。
2.ω-氧化:脂肪酸的ω-氧化是在肝微粒体中进行,由加单氧酶催化的。首先是脂肪酸的ω碳原子羟化生成ω-羧脂肪酸,再经ω醛脂肪酸生成α、ω-二羧酸,然后在α-端或ω-端活化,进入线粒体进入β-氧化,最后生成琥珀酰CoA。
3.α-氧化:脂肪酸在微粒体中由加单氧酶和脱羧酶催化生成α-羟脂肪酸或少一个碳原子的脂肪酸的过程称为脂肪酸的α-氧化。长链脂肪酸由加单氧酶催化、由抗坏血酸或四氢叶酸作供氢体在O2和Fe2+参与下生成α-羟脂肪酸,这是脑苷脂和硫脂的重要成分,α-羟脂肪酸继续氧化脱羧就生成奇数碳原子脂肪酸。α-氧化障碍者不能氧化植烷酸(phytanic acid,3、7、11、15-四甲基十六烷酸)。牛奶和动物脂肪中均有此成分,在人体内大量堆积便引起Refsum氏病。α-氧化主要在脑组织内发生,因而α-氧化障碍多引起神经症状。
4.不饱和脂肪酸(unsaturated fatty acid)的氧化:人体内约有1/2以上的脂肪酸是不饱和脂肪酸,食物中也含有不饱和脂肪酸。这些不饱和脂肪酸的双键都是顺式的,它们活化后进入β-氧化时,生成3顺烯脂酰CoA,此时需要顺3反2异构酶催化使其生成2反烯脂酰CoA以便进一步反应。2反烯脂酰CoA加水后生成Dβ-羟脂酰CoA,需要β-羟脂酰CoA差向异构酶催化,使其由D构型转变成L构型,以便再进行脱氧反应(只有Lβ-羟脂酰CoA才能作为β-羟脂酰CoA脱氢酶的底物)。
不饱和脂肪酸完全氧化生成CO2和H2O时提供的ATP少于相同碳原子数的饱和脂肪酸。
(四)酮体的生成与利用
酮体(acetonebodies)是脂肪酸在肝脏进行正常分解代谢所生成的特殊中间产物,包括有乙酰乙酸(acetoacetic acid约占30%),β-羟丁酸(βhydroxybutyric acid约占70%)和极少量的丙酮(acetone)。正常人血液中酮体含量极少(约为0.8?.0mg/dl,0.22mM),这是人体利用脂肪氧化供能的正常现象。但在某些生理情况(饥饿、禁食)或病理情况下(如糖尿病),糖的来源或氧化供能障碍,脂动员增强,脂肪酸就成了人体的主要供能物质。若肝中合成酮体的量超过肝外组织利用酮体的能力,二者之间失去平衡,血中浓度就会过高,导致酮血症(acetonemia)和酮尿症(acetonuria)。乙酰乙酸和β-羟丁酸都是酸性物质,因此酮体在体内大量堆积还会引起酸中毒。
1.酮体的生成过程:
酮体是在肝细胞线粒体中生成的,其生成原料是脂肪酸β-氧化生成的乙酰CoA。首先是二分子乙酰CoA在硫解酶作用下脱去一分子辅酶A,生成乙酰乙酰CoA。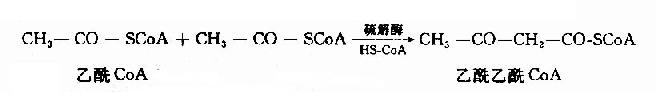
在3-羟-3-甲基戊二酰CoA(hydroxy methyl glutarylCoA,HMGCoA)合成酶催化下,乙酰乙酰CoA再与一分子乙酰CoA反应,生成HMGCoA,并释放出一分子辅酶。这一步反应是酮体生成的限速步骤。
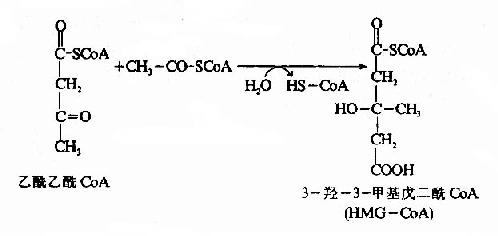
HMG-CoA裂解酶催化HMG-CoA生成乙酰乙酸和乙酰CoA,后者可再用于酮体的合成。
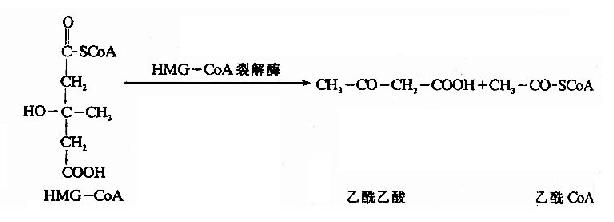
线粒体中的β-羟丁酸脱氢酶催化乙酰乙酸加氢还原(NADH+H+作供氢体),生成β-羟丁酸,此还原速度决定于线粒体中[NADH+H+]/[NAD+]的比值,少量乙栈酸可自行脱羧生成丙酮。
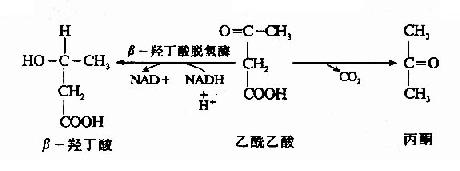
上述酮体生成过程实际上是一个循环过程,又称为雷宁循环(lynen cycle),两个分子乙酰CoA通过此循环生成一分子乙酰乙酸(见图5-12)。
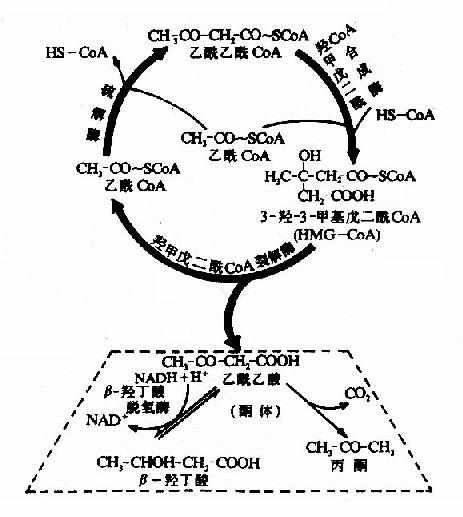
图5-12 肝脏内酮体的生成
酮体生成后迅速透过肝线粒体膜和细胞膜进入血液,转运至肝外组织利用。
2.酮体的利用过程
骨骼肌、心肌和肾脏中有琥珀酰CoA转硫酶(succinylCoa thiophorase),在琥珀酰CoA存在时,此酶催化乙酰乙酸活化生成乙酰乙酰CoA。

心肌、肾脏和脑中还有硫激酶,在有ATP和辅酶T存在时,此酶催化乙酰化酸活化成乙酰乙酰CoA。
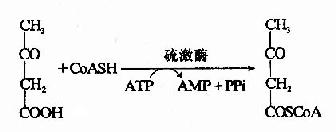
经上述两种酶催化生成的乙酰乙酰CoA在硫解酶作用下,分解成两分子乙酰CoA,乙酰CoA主要进入三羧酸循环氧化分解。
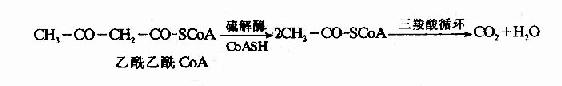
丙酮除随尿排出外,有一部分直接从肺呼出,代谢上不占重要地位,肝外组织利用乙酰乙酸和β-羟丁酸的过程可用下图表示(图5-13)。
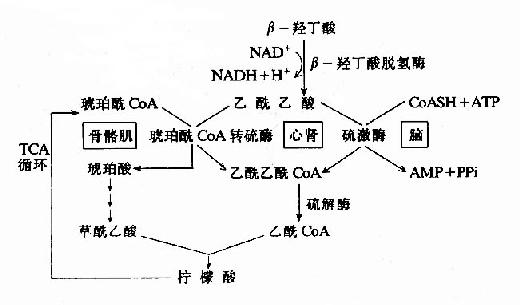
图5-13 酮体利用过程
肝细胞中没有琥珀酰CoA转硫酶和乙酰乙酸硫激酶,所以肝细胞不能利用酮体。
肝外组织利用酮体的量与动脉血中酮体浓度成正比,自中酮体浓度达70mg/dl时,肝外组织的利用能力达到饱和。肾酮阈亦为70mg/dl,血中酮体浓度超过此值,酮体经肾小球的滤过量超过肾小管的重吸收能力,出现酮尿症。脑组织利用酮体的能力与血糖水平有关,只有血糖水平降低时才利用酮体。
酮体的生成和利用过程可用下图表示(图5-14)。
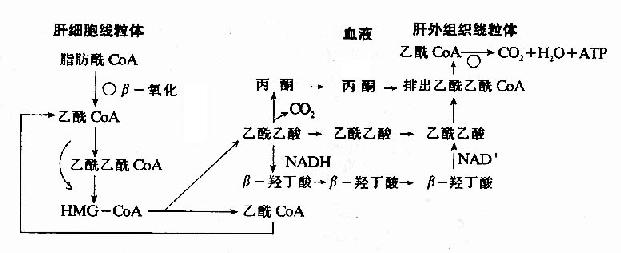
图5-14 酮体的生成和利用
3.酮体生成的意义
(1)酮体易运输:长链脂肪酸穿过线粒体内膜需要载体肉毒碱转运,脂肪酸在血中转运需要与白蛋白结合生成脂酸白蛋白,而酮体通过线粒体内膜以及在血中转运并不需要载体。
(2)易利用:脂肪酸活化后进入β-氧化,每经4步反应才能生成一分子乙酰CoA,而乙酰乙酸活化后只需一步反应就可以生成两分子乙酰CoA,β-羟丁酸的利用只比乙酰乙酸多一步氧化反应。因此,可以把酮体看作是脂肪酸在肝脏加工生成的半成品。
(3)节省葡萄糖供脑和红细胞利用:肝外组织利用酮体会生成大量的乙酰CoA,大量乙酰CoA
抑制丙酮酸脱氢酶系活性,限制糖的利用。同时乙酰CoA还能激活丙酮酸羧化酶,促进糖异生。肝外组织利用酮体氧化供能,就减少了对葡萄糖的需求,以保证脑组织、红细胞对葡萄糖的需要。脑组织不能利用长链脂肪酸,但在饥饿时可利用酮体供能,饥饿5?周时酮体供能可多达70%。
(4)肌肉组织利用酮体,可以抑制肌肉蛋白质的分解,防止蛋白质过多消耗,其作用机理尚不清楚。
(5)酮体生成增多常见于饥饿、妊娠中毒症、糖尿病等情况下。低糖高脂饮食也可使酮体生成增多。
二、脂肪酸的合成
人体内的脂肪酸大部分来源于食物,为外源性脂肪酸,在体内可通过改造加工被人体利用。同时机体还可以利用糖和蛋白转变为脂肪酸称为内源性脂肪酸,用于甘油三酯的生成,贮存能量。合成脂肪酸的主要器官是肝脏和哺乳期乳腺,另外脂肪组织、肾脏、小肠均可以合成脂肪酸,合成脂肪酸的直接原料是乙酰CoA,消耗ATP和NADPH,首先生成十六碳的软脂酸,经过加工生成人体各种脂肪酸,合成在细胞质中进行。
(一)软脂酸的生成
脂肪酸的合成首先由乙酰CoA开始合成,产物是十六碳的饱和脂肪酸即软酯酸(palmitoleic acid)。
1.乙酰CoA的转移
乙酰CoA可由糖氧化分解或由脂肪酸、酮体和蛋白分解生成,生成乙酰CoA的反应均发生在线粒体中,而脂肪酸的合成部位是胞浆,因此乙酰CoA必须由线粒体转运至胞浆。但是乙酰CoA不能自由通过线粒体膜,需要通过一个称为柠檬酸丙酮酸循环(citratepyruvate cycle)来完成乙酰CoA由线粒体到胞浆的转移。首先在线粒体内,乙酰CoA与草酰乙酸经柠檬酸合成酶催化,缩合生成柠檬酸,再由线粒体内膜上相应载体协助进入胞液,在胞液内存在的柠檬酸裂解酶(citrate lyase)可使柠檬酸裂解产生乙酰CoA及草酰乙酸。前者即可用于生成脂肪酸,后者可返回线粒体补充合成柠檬酸时的消耗。但草酰乙酸也不能自由通透线粒体内膜,故必须先经苹果酸脱氢酶催化,还原成苹果酸再经线粒体内膜上的载体转运入线粒体,经氧化后补充草酰乙酸。也可在苹果酸酶作用下,氧化脱羧生成丙酮酸,同时伴有NADPH的生成。丙酮酸可经内膜载体被转运入线粒体内,此时丙酮酸可再羧化转变为草酰乙酸。每经柠檬酸丙酮酸循环一次,可使一分子乙酸CoA由线粒体进入胞液,同时消耗两分子ATP,还为机体提供了NADPH以补充合成反应的需要(见图5-15)。
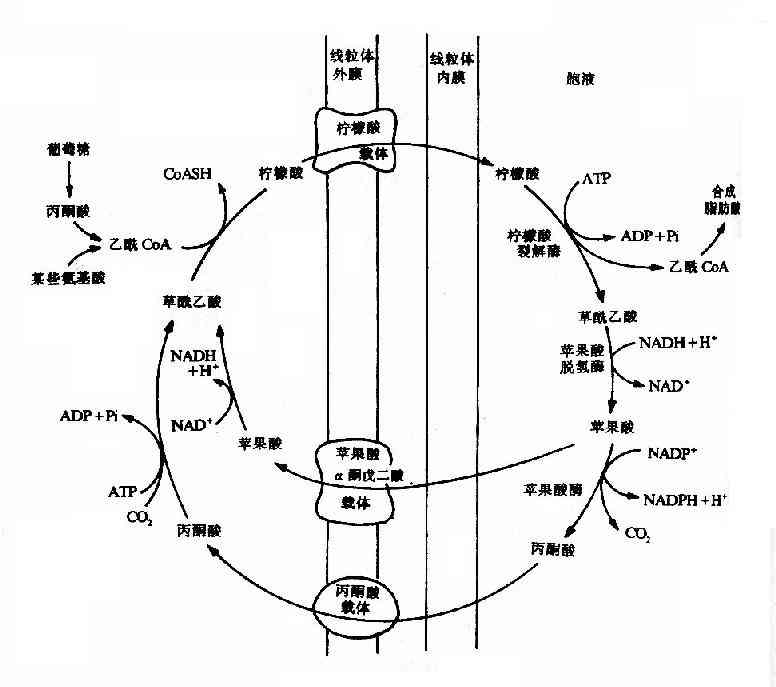
图5-15 柠檬酸-丙酮酸循环
2.丙二酰CoA的生成
乙酰CoA由乙酰CoA羧化酶(acetyl CoA carboxylase)催化转变成丙二酰CoA(或称丙二酸单酰CoA)反应如下:

乙酰CoA羧化酶存在于胞液中,其辅基为生物素,在反应过程中起到携带和转移羧基的作用。该反应机理类似于其他依赖生物素的羧化反应,如催化丙酮酸羧化成为草酰乙酸的反应等。
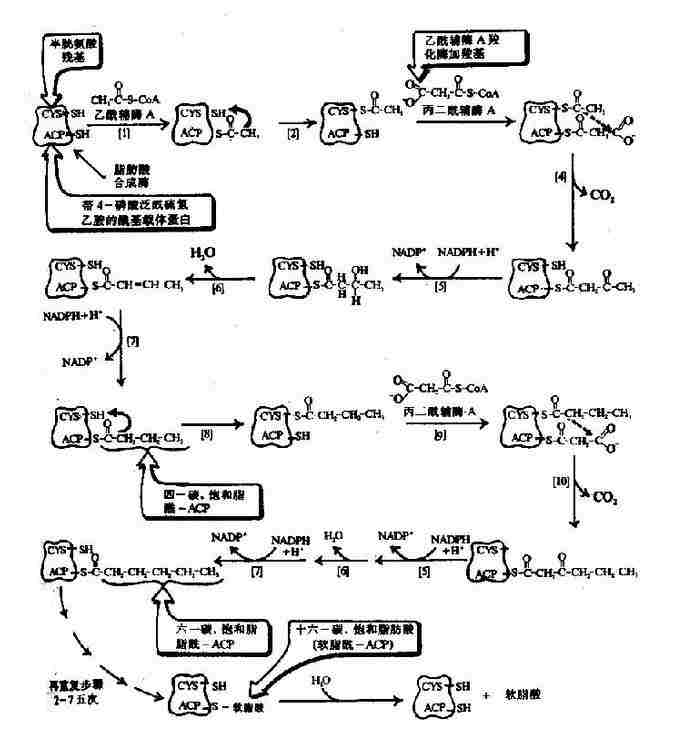
图5-16 原核生物脂肪酸合成酶复合物生成软脂酸(16:0)
由乙酰CoA羧化酶催化的反应为脂肪酸合成过程中的限速步骤。此酶为一别构酶,在变构效应剂的作用下,其无活性的单体与有活性的多聚体(由10?0个单体呈线状排列)之间可以互变。柠檬酸与异柠檬酸可促进单体聚合成多聚体,增强酶活性,而长链脂肪酸可加速解聚,从而抑制该酶活性。乙酰CoA羧化酶还可通过依赖于cAMP的磷酸化及去磷酸化修饰来调节酶活性。此酶经磷酸化后活性丧失,如胰高血糖素及肾上腺素等能促进这种磷酸化作用,从而抑制脂肪酸合成;而胰岛素则能促进酶的去磷酸化作用,故可增强乙酰CoA羧化酶活性,加速脂肪酸合成。
同时乙酰CoA羧化酶也是诱导酶,长期高糖低脂饮食能诱导此酶生成,促进脂肪酸合成;反之,高脂低糖饮食能抑制此酶合成,降低脂肪酸的生成。
3.软脂酸的生成
软脂酸的合成实际上是一个重复循环的过程,由1分子乙酰CoA与7分子丙二酰CoA经转移、缩合、加氢、脱水和再加氢重复过程,每一次使碳链延长两个碳,共7次重复,最终生成含十六碳的软脂酸(图5-16)。
在原核生物(如大肠杆菌中)催化此反应的酶是一个由7种不同功能的酶与一种酰基载体蛋白(acyl carrier protein,ACP)聚合成的复合体。在真核生物催化此反应是一种含有双亚基的酶,每个亚基有7个不同催化功能的结构区和一个相当于ACP的结构区,因此这是一种具有多种功能的酶。
脂肪酸合成需消耗ATP和NADPH+H+,NADPH主要来源于葡萄糖分解的磷酸戊糖途径。此外,苹果酸氧化脱羧也可产生少量NADPH。
脂肪酸合成过程不是β-氧化的逆过程,它们反应的组织,细胞定位,转移载体,酰基载体,限速酶,激活剂,抑制剂,供氢体和受氢体以及反应底物与产物均不相同(表5-6)。
表5-6 脂肪酸合成和分解的比较
| 合成 | 分解 | |
| 反应最活跃时期 | 高糖膳食后 | 饥饿 |
| 刺激激素 | 胰岛素/胰高血糖素高比值 | 胰岛素/胰高血糖素低比值 |
| 主要组织定位 | 肝脏为主 | 肌肉、肝脏 |
| 亚细胞定位 | 胞浆 | 线粒体为主 |
| 酰基载体 | 柠檬酸(线粒体到胞浆) | 肉毒碱(胞浆到线粒体) |
| 含磷酸酰疏基乙胺的活性载体 | 酰基载体蛋白区,CoA | CoA |
| 氧化还原辅因子 | NADPH | NAD+,FAD |
| 二碳供体/产物 | 丙二酰CoA;酰基供体 | 乙酰CoA:产物 |
| 激活剂 抑制剂 |
柠檬酸脂辅酶CoA(抑制乙酰CoA羧化酶) | 丙二酰CoA(抑制肉毒碱酰基转移酶) |
| 反应产物 | 软脂酸 | 乙酰辅酶A |
(二)其它脂肪酸的生成
人体内不仅有软脂酸,还有碳链长短不等的其它脂肪酸,也有各种不饱和脂肪酸,除营养必需脂肪酸依赖食物供应外,其它脂肪酸均可由软脂酸在细胞内加工改造而成。
1.碳链的延长和缩短
脂肪酸碳链的缩短在线粒体中经β-氧化完成,经过一次β-氧化循环就可以减少两个碳原子。
脂肪酸碳链的延长可在滑面内质网和线粒体中经脂肪酸延长酶体系催化完成。
在内质网,软脂酸延长是以丙二酰CoA为二碳单位的供体,由NADPH+H+供氢,亦经缩合脱羧、还原等过程延长碳链,与胞液中脂肪酸合成过程基本相同。但催化反应的酶体系不同,其脂肪酰基不是以ACP为载体,而是与辅酶A相连参加反应。除脑组织外一般以合成硬脂酸(18C)为主,脑组织因含其他酶,故可延长至24碳的脂肪酸,供脑中脂类代谢需要。
在线粒体,软脂酸经线粒体脂肪酸延长酶体系作用,与乙酰CoA缩合逐步延长碳链,其过程与脂肪酸β氧化逆行反应相似,仅烯脂酰CoA还原酶的辅酶为NADPH+H+与β氧化过程不同。通过此种方式一般可延长脂肪酸碳链至24或26碳,但以硬脂酸最多。
2.脂肪酸脱饱和
人和动物组织含有的不饱和脂肪酸主要为软油酸(16:1△9)、油酸(18:1△9)、亚油酸(18:2△9,12)、亚麻酸(18:3△9,12,15)、花生四烯酸(20:4△5,8,11,14)等。其中最普通的单不饱和脂肪酸棗软油酸和油酸可由相应的脂肪酸活化后经去饱和酶(acylCoAdesaturase)催化脱氢生成。这类酶存在于滑面内质网,属混合功能氧化酶(见肝脏代谢章)。因该酶只催化在△9形成双键,而不能在C10与末端甲基之间形成双键,故亚油酸(linoleate)、亚麻酸(linolenate)及花生四烯酸(arachidonate)在体内不能合成或合成不足。但它们又是机体不可缺少的,所以必须由食物供给,因此,称之为必需脂肪酸(essential fatty acid)。植物组织含有可以在C10与末端甲基间形成双键(即ω3和ω6)的去饱和酶,能合成以上3种多不饱和脂肪酸。当食入亚油酸后,在动物体内经碳链加长及去饱和后,可生成花生四烯酸。
(三)脂肪酸合成的调节
乙酰CoA羧化酶催化的反应是脂肪酸合成的限速步骤,很多因素都可影响此酶活性,从而使脂肪酸合成速度改变。脂肪酸合成过程中其他酶,如脂肪酸合成酶、柠檬酸裂解酶等亦可被调节。
1.代谢物的调节
在高脂膳食后,或因饥饿导致脂肪动员加强时,细胞内软脂酰CoA增多,可反馈抑制乙酰CoA羧化酶,从而抑制体内脂肪酸合成。而进食糖类,糖代谢加强时,由糖氧化及磷酸戊糖循环提供的乙酰CoA及NADPH增多,这些合成脂肪酸的原料的增多有利于脂肪酸的合成。此外,糖氧化加强的结果,使细胞内ATP增多,进而抑制异柠檬酸脱氢酶,造成异柠檬酸及柠檬酸堆积,在线粒体内膜的相应载体协助下,由线粒体转入胞液,可以别构激活乙酰CoA羧化酶。同时本身也可裂解释放乙酰CoA,增加脂肪酸合成的原料,使脂肪酸合成增加。
2.激素的调节
胰岛素、胰高血糖素、肾上腺素及生长素等均参与对脂肪酸合成的调节。
胰岛素能诱导乙酰CoA羧化酶、脂肪酸合成酶及柠檬酸裂解酶的合成,从而促进脂肪酸的合成。此外,还可通过促进乙酰CoA羧化酶的去磷酸化而使酶活性增强,也使脂肪酸合成加速。
胰高血糖素等可通过增加cAMP,致使乙酰CoA羧化酶磷酸化而降低活性,因此抑制脂肪酸的合成。此外,胰高血糖素也抑制甘油三酯合成,从而增加长链脂酰CoA对乙酰CoA羧化酶的反馈抑制,亦使脂肪酸合成被抑制。
(四)前列腺素、血栓素及白三烯
前列腺素(prostaglandin,PG),血栓素(thromboxane,TX)和白三烯(leukotrienes,LT)均由花生四烯酸衍生而来。它们在细胞内生成后,可作为调节物对几乎所有的细胞代谢发挥调节作用,而且与炎症、过敏反应和心血管疾病等病理过程有关。
生物膜上的膜磷脂含有花生四烯酸,它可被磷脂酶A2水解,释放花生四烯酸。花生四烯酸可在前列腺素内过氧化物合成酶催化下,消耗O2和还原性谷胱甘肽,发生氧化和环化反应,生成前列腺素H2。前列腺素H2可进一步衍生成其它前列腺素及血栓素(见图5?7)。可的松(cortisol)抑制磷酸酶A2活性,减少花生四烯酸的生成,从而抑制前列原素的合成,阿斯匹林(aspirin)和保泰松(phenylbutazone)抑制前列腺素内过氧化物合成酶活性使前列腺素和血栓素生成减少。
图5-17 花生四烯酸生成PG,TX和LT概况
三、PG、TX及LT的生理功能
PG等在细胞内含量很低,仅10?1pmol/L,但具有很强的生理活性。
(一)PG
PGE2能诱发炎症,促进局部血管扩张,毛细血管通透性增加,引起红、肿、痛、热等症状。PGE2、PGA2使动脉平滑肌舒张,有降低血压的作用;PGE2及PGI2抑制胃酸分泌,促进胃肠平滑肌蠕动。卵泡产生的PGE2及PGE2α在排卵过程中起重要作用,PGE2α可使卵巢平滑肌收缩,引起排卵、子宫释放的PGE2α能使黄体溶解,分娩时子宫内膜释出的PGE2α能引起子宫收缩加强,促进分娩。
(二)TX
血小板产生的TXA2及PGE2促进血小板聚集,血管收缩,促进凝血及血栓形成,而血管内皮细胞释放的PGI2则有很强的舒血管及抗血小板聚集,抑制凝血及血栓形成,与TXA2的作用对抗。北极地区爱斯基摩人摄食富含花生四烯酸的血类食物,能在体内合成PGE3,PGI3及TXA3等三类化合物。PGI3能抑制花生四烯酸从膜磷脂释放,因而抑制PGI2及TXA2的合成。由于PGI3的活性与PGI2相同,而TXA3则较TXA2弱得多,因此爱斯基摩人抗血小板聚集及抗凝血作用较强,被认为是他们不易患心肌梗塞的重要原因之一。
(三)LT
已证实过敏反应的慢反应物质(SRSA)是LTC4、TD4及LTE4的混合物,其使支气管平滑肌收缩的作用较组胺及PGF2强100000倍,作用缓慢而持久。此外,LTG4还能调节白细胞的功能,促进其游走及趋化作用,刺激腺苷酸环化酶,诱发多核白细胞脱颗粒,使溶酶释放水解酶类,促进炎症及过敏反应的发展。
第五节 磷脂代谢
磷脂是一类含有磷酸的脂类,机体中主要含有两大类磷脂,由甘油构成的磷脂称为甘油磷脂(phosphoglyceride);由神经鞘氨醇构成的磷脂,称为鞘磷脂(sphingolipid)。其结构特点是:具有由磷酸相连的取代基团(含氨碱或醇类)构成的亲水头(hydrophilichead)和由脂肪酸链构成的疏水尾(hydrophobic tail)。在生物膜中磷脂的亲水头位于膜表面,而疏水尾位于膜内侧(图5-18)。
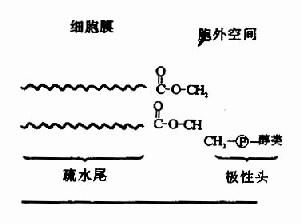
图5-18 显示胞膜定位的磷脂结构
一、甘油磷脂的代谢
(一)分类及生理功能
甘油磷脂是机体含量最多的一类磷脂,它除了构成生物膜外,还是胆汁和膜表面活性物质等的成分之一,并参与细胞膜对蛋白质的识别和信号传导。
甘油磷脂基本结构是磷脂酸和与磷酸相连的取代基团(X);
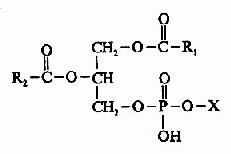
甘油磷脂由于取代基团不同又可以分为许多类,其中重要的有:
胆碱(choline)+磷脂酸→磷脂酰胆碱(phosphatidylcholine)又称卵磷脂(lecithin)
乙醇胺(ethanolamine)+磷脂酸→磷脂酰乙醇胺(phosphatidylethanolamine)又称脑磷脂(cephain)
丝氨酸(serine)+磷脂酸→磷脂酰丝氨酸(phosphatidylserine)
甘油(glycerol)+磷脂酸→磷脂酰甘油(phosphatidylglycerol)
肌醇(inositol)+磷脂酸→磷脂酰肌醇(phosphatidylinositol)
此外,还有心磷脂(cardiolipin)是由甘油的C1和C3与两分子磷脂酸结合而成。心磷脂是线粒体内膜和细菌膜的重要成分,而且是唯一具有抗原性的磷脂分子。
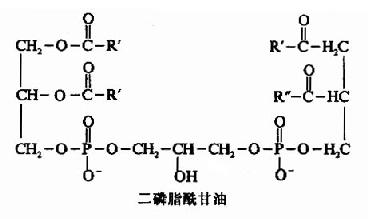
除以上6种以外,在甘油磷脂分子中甘油第1位的脂酰基被长链醇取代形成醚,如缩醛磷脂(p
lasmalogen)及血小板活化因子(plateletactivating factor,PAF),它们都属于甘油磷脂。结构式如下:
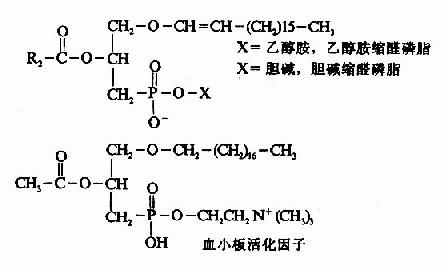
(二)甘油磷脂的合成
合成全过程可分为三个阶段,即原料来源、活化和甘油磷脂生成。甘油磷脂的合成在细胞质滑面内质网上进行,通过高尔基体加工,最后可被组织生物膜利用或成为脂蛋白分泌出细胞。机体各种组织(除成熟红细胞外)即可以进行磷脂合成。
1.原料来源
合成甘油磷脂的原料为磷脂酸与取代基团。磷脂酸可由糖和脂转变生成的甘油和脂肪酸生成(详见甘油三酯合成代谢),但其甘油C2位上的脂肪酸多为必需脂肪酸,需食物供给。取代基团中胆碱和乙醇胺可由丝氨酸在体内转变生成或食物供给。
丝氨酸——→乙醇胺——→胆碱
2.活化
磷脂酸和取代基团在合成之前,两者之一必须首先被CTP活化而被CDP携带,胆碱与乙醇胺可生成CDP胆碱和CDP乙醇胺,磷脂酸可生成CDP甘油二酯。
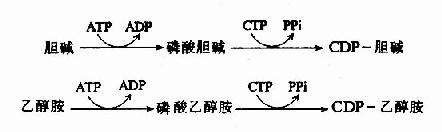
3.甘油磷脂生成
(1)磷脂酰胆碱和磷脂酰乙醇胺
这两种磷脂生成是由活化的CDP胆碱与CDP-乙醇胺和甘油二脂生成。此外磷脂酰乙醇胺在肝脏还可由与腺苷蛋氨酸提供甲基转变为磷脂酰胆碱。
(2)磷脂酰丝氨酸
体内磷脂酰丝氨酸合成是通过Ca++激活的酰基交换反应生成,由磷脂酰乙醇胺与丝氨酸反应生成磷脂酰丝氨酸和乙醇胺。
磷脂酰乙醇胺+丝氨酸—→磷脂酰丝氨酸+乙醇胺
(3)磷脂酰肌醇、磷脂酰甘油和心磷脂
上述三者生成是由活化的CDP甘油二酯与相应取代基团反应生成

(4)缩醛磷脂与血小板活化因子
缩醛磷脂与血小板活化因子的合成过程与上述磷脂合成过程类似,不同之处在于磷脂酸合成之前,由糖代谢中间产物磷酸二羟丙酮转变生成脂酰磷酸二羟丙酮以后,由一分子长链脂肪醇取代其第一位脂酰基,其后再经还原(由NADPH供H)、转酰基等步骤合成磷脂酸的衍生物。此产物替代磷脂酸为起始物,沿甘油三酯途径合成胆碱或乙醇胺缩醛磷脂。血小板活化因子与缩醛磷脂的不同在于长链脂肪醇是饱和长链醇,第2位的脂酰基为最简单的乙酰基。
(三)甘油磷脂的分解
在生物体内存在一些可以水解甘油磷脂的磷脂酶类,其中主要的有磷脂酶A1、A2、B、C和D,它们特异地作用于磷脂分子内部的各个酯键,形成不同的产物。这一过程也是甘油磷酯的改造加工过程。
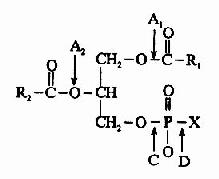
磷脂酶A1:自然界分布广泛,主要存在于细胞的溶酶体内,此外蛇毒及某些微生物中亦有,可有催化甘油磷脂的第1位酯键断裂,产物为脂肪酸和溶血磷脂2。
磷脂酶A2:普遍存在于动物各组织细胞膜及线粒体膜,能使甘油磷脂分子中第2位酯键水解,产物为溶血磷脂1及其产物脂肪酸和甘油磷酸胆碱或甘油磷酸乙醇胺等。
溶血磷脂是一类具有较强表面活性的性质,能使红细胞及其他细胞膜破裂,引起溶血或细胞坏死。当经磷脂酶B作用脱去脂肪酸后,转变成甘油磷酸胆碱或甘油磷酸乙醇胺,即失去溶解细胞膜的作用。
磷脂酶C:存在于细胞膜及某些细胞中,特异水解甘油磷脂分子中第3位磷酸酯键,其结果是释放磷酸胆碱或磷酸乙醇胺,并余下作用物分子中的其他组分。
磷脂酶D:主要存在于植物,动物脑组织中亦有,催化磷脂分子中磷酸与取代基团(如胆碱等)间的酯键,释放出取代基团。
二、鞘磷脂的代谢
鞘脂类(sphingolipid),组成特点是不含甘油而含鞘氨醇(sphingosine),其基本结构是:
按照取代基团X的不同可分为两种
X为磷酸胆碱称为鞘磷脂(sphingmyelin)
X为糖基称为鞘糖脂(glycosphingolipid)
(一)鞘磷脂的合成
体内的组织均可合成鞘磷脂,以脑组织最为活跃,是构成神经组织膜的主要成分,合成在细胞内质网上进行。
以脂酰CoA和丝氨酸为原料,消耗NADPH生成二氢鞘氨醇,进而经脂肪酰转移酶作用生成神经酰胺。
(二)鞘磷脂的分解
鞘磷脂经磷脂酶(sphingomyelinase)作用,水解产生磷酸胆碱和神经酰胺。如缺乏此酶可引起肝、脾肿大及神经障碍如痴呆等鞘磷脂沉积症。
第六节 胆固醇代谢
一、肝胆固醇的来源及释放途径
胆固醇是体内最丰富的固醇类化合物,它既作为细胞生物膜的构成成分,又是类固醇类激素、胆汁酸及维生素D的前体物质。因此对于大多数组织来说,保证胆固醇的供给,维持其代谢平衡是十分重要的。胆固醇广泛存在于全身各组织中,其中约1/4分布在脑及神经组织中,占脑组织总重量的2%左右。肝、肾及肠等内脏以及皮肤、脂肪组织亦含较多的胆固醇,每100g组织中约含200至500mg,以肝为最多,而肌肉较少,肾上腺、卵巢等组织胆固醇含量可高达1%-5%,但总量很少。肝脏胆固醇来源见图5-19。
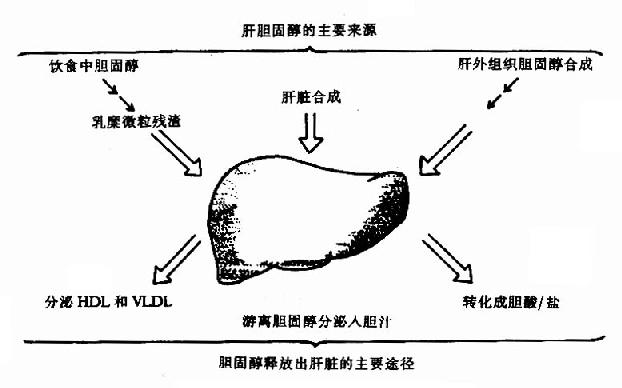
图5-19 肝胆固醇的来源及释放途径
人体固醇的来源靠体内合成及从食物摄取,正常人每天膳食中约含胆固醇300-500mg,主要来自动物内脏、蛋黄、奶油及肉类。植物性食品不含胆固醇,而含植物固醇如β谷固醇、麦角固醇等,它们不易为人体吸收,摄入过多还可抑制胆固醇的吸收。
(二)合成原料
乙酰CoA是胆固醇合成的直接原料,它来自葡萄糖、脂肪酸及某些氨基酸的代谢产物。另外,还需要ATP供能和NADPH供氢。合成1分子胆固醇需消耗18分子乙酰CoA、36分子ATP和16分子NADPH。
(三)合成基本过程
胆固醇合成过程比较复杂,有近30步反应,整个过程可根据为3个阶段。
1.3羟-3甲基戊二酸甲酰CoA(HMGCoA)的生成
在胞液中,3分子乙酰CoA经硫解酶及HMGCoA合成酶催化生成HMGCoA,此过程与酮体生成机制相同。但细胞内定位不同,此过程在胞液中进行,而酮体生成在肝细胞线粒体内进行,因此肝脏细胞中有两套同功酶分别进行上述反应。
2.
HMGCoA在HMG CoA还原酶(HMGCoA reductase)催化下,消耗两分子NADPH+H+生成甲羟戊酸(MVA)

此过程是不可逆的,HMG还原酶是胆固醇合成的限速酶。
3.胆固醇的生成
MVA先经磷酸化、脱羧、脱羟基、再缩合生成含30C的鲨烯,经内质网环化酶和加氧酶催化生成羊毛脂固醇,后者再经氧化还原等多步反应最后失去了3个C,合成27C的胆固醇(图5-20)。
图5-20 甲羟戊酸合成胆固醇

图5-21 胆固醇的结构 显示脂肪酸在胆固醇酯中的位点
(四)胆固醇合成的调节
胆固醇合成的过程中HMGCoA还原酶为限速酶,因此各种因素通过对该酶的影响可以达到调节胆固醇合成的作用。
1.激素的调节
HMGCoA还原酶在胞液中经蛋白激酶催化发生磷酸化丧失活性,而在磷蛋白磷酸酶作用下又可以脱去磷酸恢复酶活性,胰高血糖素等通过第二信使cAMP影响蛋白激酶,加速HMGCoA还原酶磷酸化失活,从而抑制此酶,减少胆固醇合成。胰岛素能促进酶的脱磷酸作用,使酶活性增加,则有利于胆固醇合成。此外,胰岛素还能诱导HMGCoA还原酶的合成,从而增加胆固醇合成。甲状腺素亦可促进该酶的合成,使胆固醇合成增多,但其同时又促进胆固醇转变为胆汁酸,增加胆固醇的转化,而且此作用强于前者,故当甲状腺机能亢进时,患者血清胆固醇含量反而下降。
2.胆固醇浓度的调节
胆固醇可反馈抑制HMGCoA还原酶的活性,并减少该酶的合成,从而达到降低胆固醇合成的作用,细胞内胆固醇来自体内生物合成或胞外摄取。血中胆固醇主要由低密底脂蛋白(LDL)携带运输,借助细胞膜上的LDL受体介导内吞作用进入细胞。当胞内胆固醇过高,可抑制LDL受体的补充,从而减少由血中摄取胆固醇。
现知遗传性家族高胆固醇血症患者体内严重缺乏LDL受体,因此LDL携带的胆固醇不能被摄取,来自膳食的胆固醇不能从血液中被迅速清除,故血中胆固醇浓度过高,当体内总胆固醇过高,超过合成生物膜、胆汁酸及类固醇激素等的需要时,胆固醇及其酯则沉积在动脉内皮下的巨噬细胞中(这些细胞是由迁移到动脉内皮下的血单核细胞分化而成的),引起内皮下变形,进而导致血小板在动脉内壁集聚。若同时伴有动脉壁损伤或胆固醇转运障碍,则易在动脉内膜形成脂斑,继续发展可使动脉管腔变狭窄。可见动脉粥样硬化与血中高水平的胆固醇有关,特别与存在于LDL中的胆固醇水平有关。
二、胆固醇的转化
胆固醇在体内不被彻底氧化分解为CO2和H2O,而经氧化和还原转变为其它含环戊烷多氢菲母核的化合物。其中大部分进一步参与体内代谢,或排出体外。
胆固醇在体内可作为细胞膜的重要成分。此外,它还可以转变为多种具有重要生理作用的物质,在肾上腺皮质可以转变成肾上腺皮质激素;在性腺可以转变为性激素,如雄激素、雌激素和孕激素(progestogen);在皮肤,胆固醇可被氧化为7-脱氢胆固醇,后者经常紫外线照射转变为维生素D3;在肝脏,胆固醇可氧化成胆汁酸,促进脂类的消化吸收。
胆固醇在肝脏氧化生成的胆汁酸,随胆汁排出,每日排出量约占胆固醇合成量的40%。在小肠下段,大部分胆汁酸又通过肝循环重吸收入肝构成胆汁的肝肠循环(见图5?2);小部分胆汁酸经肠道细菌作用后排出体外。药物如消胆胺可与胆汁酸结合,阻断胆汁酸的肠肝循环,增加胆汁酸的排泄,间接促进肝内胆固醇向胆汁酸的转变。肝脏也能将胆固醇直接排入肠内,或者通过肠粘膜脱落而排入肠腔;胆固醇还可被肠道细菌还原为粪固醇后排出体外。
图5-22 胆汁酸和胆汁酸盐的肝肠循环
第六章 生物氧化(Biological oxidation)
第一节 概 述
体内大部分物质都可进行氧化反应,在生物体内进行的氧化反应与体外氧化反应有许多共同之处:它们都遵循氧化反应的一般规律,常见的氧化方式有脱电子、脱氢和加氧等类型;最终氧化分解产物是CO2和H2O,同时释放能量。但是生物氧化反应又有其特点:①体外氧化反应主要以热能形式释放能量;而生物氧化主要以生成ATP方式释放能量,为生物体所利用。②其最大区别在于:体外氧化往往在高温,强酸,强碱或强氧化剂的催化下进行;而生物氧化是在恒温(37℃)和中性pH环境下进行,催化氧化反应的催化剂是酶。
一、生物氧化酶类
体内催化氧化反应的酶有许多种,按照其催化氧化反应方式不同可分为三大类。
(一)脱氢氧化酶类
这一类中依据其反应受氢体或氧化产物不同,又可以分为三种。
1.氧化酶类(oxidases)
氧化酶直接作用于底物,以氧作为受氢体或受电子体,生成产物是水。氧化酶均为结合蛋白质,辅基常含有Cu2+,如细胞色素氧化酶、酚氧化酶、抗坏血酸氧化酶等。抗坏血酸氧化酶可催化下述反应:
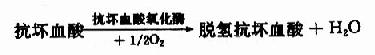
2.需氧脱氢酶类(aerobic dehydrogenases)
需氧脱氢酶以FAD或FMN为辅基,以氧为直接受氢体,产物为H2O2或超氧离子(O2),某些色素如甲烯蓝(methylene blue,MB)、铁氰化钾([K3Fe(CN)6]、二氯酚靛酚可以作为这类酶的人工受氢体。如D氨基酸氧化酶(辅基FAD)、L-氨基酸氧化酶(辅基FMN)、黄嘌呤氧化酶(辅基FAD)、醛脱氢酶(辅基FAD)、单胺氧化酶(辅基FAD)、二胺氧化酶等。

粒细胞中NADH氧化酶和NADPH氧化酶也是需氧脱氢酶,它们催化下述反应:

超氧离子在超氧化物歧化酶(superoxidedismutase,SOD)催化下生成H2O2与O2:
![]()
3.不需氧脱氢酶类(anaerobic dehydrogenases)
这是人体内主要的脱氢酶类,其直接受氢体不是O2,而只能是某些辅酶(NAD+、NADP+)或辅基(FAD、FMN),辅酶或辅基还原后又将氢原子传递至线粒体氧化呼吸链,最后将电子传给氧生成水,在此过程中释放出来的能量使ADP磷酸化生成ATP,如3磷酸甘油醛脱氢酶、琥珀酸脱氢酶、细胞色素体系等。
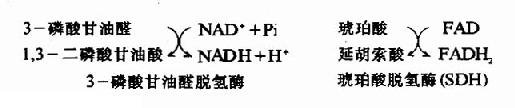
4.加氧酶类(oxygenases)
顾名思义,加氧酶催化加氧反应。根据向底物分子中加入氧原子的数目,又可分为加单氧酶(monooxygenase)和加双氧酶(dioxygenase)。
(1)加单氧酶 又称为多功能氧化酶、混合功能氧化酶(mixed function oxidase)、羟化酶(hydroxylase)。加单氧酶催化O2分子中的一个原子加到底物分子上使之羟化,另一个氧原子被NADPH+H+提供的氢还原生成水,在此氧化过程中无高能磷酸化合物生成,反应如下:

加单氧酶实际上是含有黄素酶及细胞色素的酶体系,常常是由细胞色素P450、NADPH细胞色素P450还原酶、NADPH和磷脂组成的复合物。细胞色素P450是一种以血色素为辅基的b族细胞色素,其中的Fe3+可被Na2S2O3等还原为Fe2+,还原型的细胞色素P450与CO结合后在450nm有最大吸收峰,故名细胞色素P450,它的作用类似于细胞色素aa3,能与氧直接反应,将电子传递给氧,因此也是一种终末氧化酶。
加单氧酶主要分布在肝、肾组织微粒体中,少数加单氧酶也存在于线粒体中,加单氧酶主要参与类固醇激素(性激素、肾上腺皮质激素)、胆汁酸盐、胆色素、活性维生素D的生成和某些药物、毒物的生物转化过程。加单氧酶可受底物诱导,而且细胞色素P450基质特异性低,一种基质提高了加单氧酶的活性便可同时加快几种物质的代谢速度,这与体内的药物代谢关系十分密切,例如以苯巴比妥作诱导物,可以提高机体代谢胆红素、睾酮、氢化可地松、香豆素、洋地黄毒苷的速度,临床用药时应予考虑。
(2)加双氧酶 此酶催化O2分子中的两个原子分别加到底物分子中构成双键的两个碳原子上,如色氨酸吡咯酶(色氨酸加双氧酶)、胡萝卜素加双氧酶分别催化下述反应:
5.过氧化氢酶和过氧化物酶
前已叙及需氧脱氢酶和超氧化物歧化酶催化的反应中有H2O2生成。过氧化氢具有一定的生理作用,粒细胞和吞噬细胞中的H2O2可杀死吞噬的细菌,甲状腺上皮细胞和粒细胞中的H2O2可使I氧化生成I2,进而使蛋白质碘化,这与甲状腺素的生成和消灭细菌有关。但是H2O2也可使巯基酶和蛋白质氧化失活,还能氧化生物膜磷脂分子中的多不饱和脂肪酸,损伤生物膜结构、影响生物膜的功能,此外H2O2还能破坏核酸和粘多糖。人体某些组织如肝、肾、中性粒细胞及小肠粘膜上皮细胞中的过氧化物酶体内含有过氧化氢酶(触酶)和过氧化物酶,可利用或消除细胞内的H2O2和过氧化物,防止其含量过高而起保护作用。
(1)过氧化氢酶(Catalase)此酶催化两个H2O2分子的氧化还原反应,生成H2O并释放出O2。
![]()
过氧化氢酶的催化效率极高,每个酶分子在0℃每分钟可催化264万个过氧化氢分子分解,因此人体一般不会发生H2O2的蓄积中毒。
(2)过氧化物酶(Peroxidase)此酶催化H2O2或过氧化物直接氧化酚类或胺类物质。
R+H2O2——→RO+H2O或RH2+H2O2——→R+2H2O
某些组织的细胞中还有一种含硒(Se)的谷胱甘肽过氧化物酶(glutathione peroxidase),可催化下述反应:
H2O2+2G-SH——→2H2O+GSSG
ROOH+2G-SH——→ROH+GSSG+H2O
生成的GSSG又可在谷胱甘肽还原酶催化下由NADPH+H+供氢还原生成G-SH:

临床工作中判定粪便、消化液中是否有隐血时,就是利用血细胞中的过氧化物酶活性将愈创木酯或联苯胺氧化成蓝色化合物。
二、生物氧化的基本概念
机体内进行的脱氢,加氧等氧化反应总称为生物氧化,按照生理意义不同可分为两大类,一类主要是将代谢物或药物和毒物等通过氧化反应进行生物转化,这类反应不伴有ATP的生成;另一类是糖、脂肪和蛋白质等营养物质通过氧化反应进行分解,生成H2O和CO2,同时伴有ATP生物能的生成,这类反应进行过程中细胞要摄取O2,释放CO2故又形象地称之为细胞呼吸(cellularrespiration)。
代谢物在体内的氧化可以分为三个阶段,首行是糖、脂肪和蛋白质经过分解代谢生成乙酰辅酶A中的乙酰基;接着乙酰辅酶A进入三羧酸循环脱氢,生成CO2并使NAD+和FAD还原成NADH+H+、FADH2;第三阶段是NADH+H+和FADH2中的氢经呼吸链将电子传递给氧生成水,氧化过程中释放出来的能量用于ATP合成。从广义来讲,上述三个阶段均为生物氧化,狭义地说只有第三个阶段才算是生物氧化,这是体内能量生成的主要阶段,有关的前两个阶段已在代谢各章中讲述,本章只讨论第三个阶段,即代谢物脱下的氢是如何交给氧生成水的?细胞通过什么方式将氧化过程中释放的能量转变成ATP分子中的高能键的?
第二节 呼 吸 链
呼吸链(respiratorychain)是由一系列的递氢体(hydrogen transfer)和递电子体(eletron transfer)按一定的顺序排列所组成的连续反应体系,它将代谢物脱下的成对氢原子交给氧生成水,同时有ATP生成。实际上呼吸链的作用代表着线粒体最基本的功能,呼吸链中的递氢体和递电子体就是能传递氢原子或电子的载体,由于氢原子可以看作是由H+和e组成的,所以递氢体也是递电子体,递氢体和递电子体的本质是酶、辅酶、辅基或辅因子。
一、呼吸链的组成
构成呼吸链的递氢体和递电子体主要分为以下五类
(一)尼克酰胺腺嘌呤二核苷酸(NAD+)或称辅酶I(CoI)。
为体内很多脱氢酶的辅酶,是连接作用物与呼吸链的重要环节,分子中除含尼克酰胺(维生素PP)外,还含有核糖、磷酸及一分子腺苷酸(AMP),其结构如下:
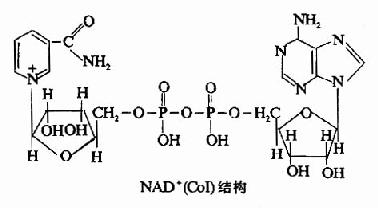
NAD+的主要功能是接受从代谢物上脱下的2H(2H++2e),然后传给另一传递体黄素蛋白。
在生理pH条件下,尼克酰胺中的氮(吡啶氮)为五价的氮,它能可逆地接受电子而成为三价氮,与氮对位的碳也较活泼,能可逆地加氢还原,故可将NAD+视为递氢体。反应时,NAD+的尼克酰胺部分可接受一个氢原子及一个电子,尚有一个质子(H+)留在介质中。
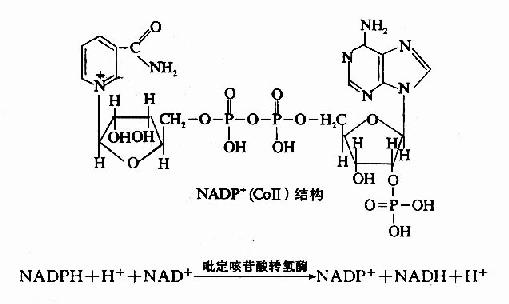
此外,亦有不少脱氢酶的辅酶为尼克酰胺腺嘌呤二核苷酸磷酸(NADP+),又称辅酶Ⅱ(CoⅡ),它与NAD+不同之处是在腺苷酸部分中核糖的2′位碳上羟基的氢被磷酸基取代而成。
当此类酶催化代谢物脱氢后,其辅酶NADP+接受氢而被还原生成NADPH+H+,它须经吡啶核苷酸转氢酶(pyridine nucleotidetranshydrogenase)作用将还原当量转移给NAD+,然后再经呼吸链传递,但NADPH+H+一般是为合成代谢或羟化反应提供氢。

(二)黄素蛋白(flavoproteins)
黄素蛋白种类很多,其辅基有两种,一种为黄素单核苷酸(FMN),另一种为黄素腺嘌呤二核苷酸(FAD),两者均含核黄素(维生素B2),此外FMN尚含一分子磷酸,而FAD则比FMN多含一分子腺苷酸(AMP),其结构如下:
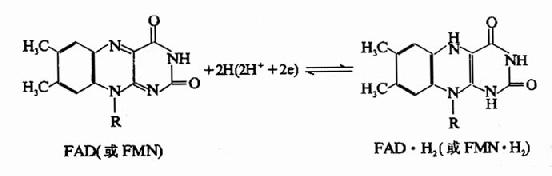
在FAD、FMN分子中的异咯嗪部分可以进行可逆的脱氢加氢反应。
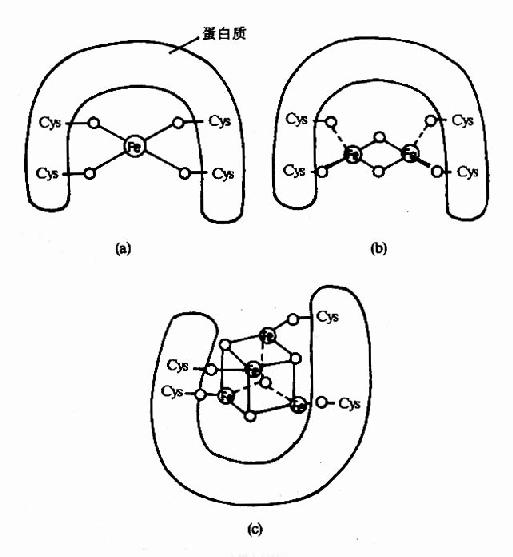
FAD或FMN与酶蛋白部分之间是通过非共价键相连,但结合牢固,因此氧化与还原(即电子的失与得)都在同一个酶蛋白上进行,故黄素核苷酸的氧化还原电位取决于和它们结合的蛋白质,所以有关的标准还原电位指的是特定的黄素蛋白,而不是游离的FMN或FAD;在电子转移反应中它们只是在黄素蛋白的活性中心部分,而其本身不能作为作用物或产物,这和NAD+不同,NAD+与酶蛋白结合疏松,当与某酶蛋白结合时可以从代谢物接受氢,而被还原为NADH,后者可以游离,再与另一种酶蛋白结合,释放氢后又被氧化为NAD+。
多数黄素蛋白参与呼吸链组成,与电子转移有关,如NADH脱氢酶(NADh dehydrogenase)以FMN为辅基,是呼吸链的组分之一,介于NADH与其它电子传递体之间;琥珀酸脱氢酶,线粒体内的甘油磷酸脱氢酶(glycerol phosphate dehydrogenase)的辅基为FAD,它们可直接从作用物转移还原当量H++e reducing equivalent)到呼吸链,此外脂肪酰CoA脱氢酶与琥珀酸脱氢酶相似,亦属于FAD为辅基的黄素蛋白类,也能将还原当量从作用物传递进入呼吸链,但中间尚需另一电子传递体称为电子转移黄素蛋白(electrontransferring flavoprotein,ETFP,辅基为FAD)参与才能完成。
(三)铁硫蛋白(ironsulfur proteins,Fe-S)
又称铁硫中心,其特点是含铁原子。铁是与无机硫原子或是蛋白质肽链上半胱氨酸残基的硫相结合,常见的铁硫蛋白有三种组合方式(a)单个铁原子与4个半胱氨酸残基上的巯基硫相连。(b)两个铁原子、两个无机硫原子组成(2Fe-2S),其中每个铁原子还各与两个半胱氨酸残基的巯基硫相结合。(c)由4个铁原子与4个无机硫原子相连(4Fe4S),铁与硫相间排列在一个正六面体的8个顶角端;此外4个铁原子还各与一个半胱氨酸残基上的巯基硫相连(图6-1)。
图6-1 铁硫蛋白结构
(a)单个铁与半胱氨酸硫相连 (b)2Fe-2S (c)4Fe-4S
铁硫蛋白中的铁可以呈两价(还原型),也可呈三价(氧化型),由于铁的氧化、还原而达到传递电子作用。
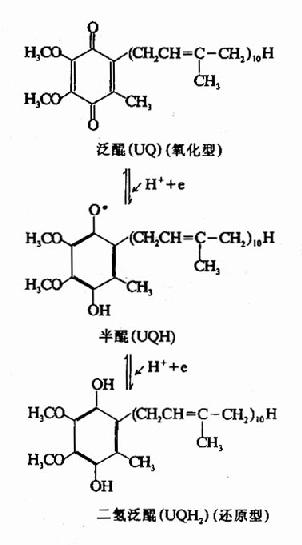
在呼吸链中它多与黄素蛋白或细胞色素b结合存在。
(四)泛醌(ubiquinone,UQ或Q)
亦称辅酶Q(coenzymeQ),为一脂溶性苯醌,带有一很长的侧链,是由多个异戊二烯(isoprene)单位构成的,不同来源的泛醌其异戊二烯单位的数目不同,在哺乳类动物组织中最多见的泛醌其侧链由10个异戊二烯单位组成。
泛醌接受一个电子和一个质子还原成半醌,再接受一个电子和质子则还原成二氢泛醌,后者又可脱去电子和质子而被氧化恢复为泛醌。
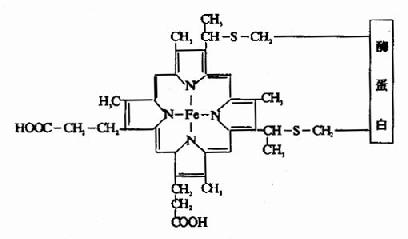
(五)细胞色素体系
1926年Keilin首次使用分光镜观察昆虫飞翔肌振动时,发现有特殊的吸收光谱,因此把细胞内的吸光物质定名为细胞色素。细胞色素是一类含有铁卟啉辅基的色蛋白,属于递电子体。线粒体内膜中有细胞色素b、c1、c、aa3,肝、肾等组织的微粒体中有细胞色素P450。细胞色素b、c1、c为红色细胞素,细胞色素aa3为绿色细胞素。不同的细胞色素具有不同的吸收光谱,不但其酶蛋白结构不同,辅基的结构也有一些差异。
细胞色素c为一外周蛋白,位于线粒体内膜的外侧。细胞色素C比较容易分离提纯,其结构已清楚。哺乳动物的Cyt c由104个氨基酸残基组成,并从进化的角度作了许多研究。Cyt c的辅基血红素(亚铁原卟啉)通过共价键(硫醚键)与酶蛋白相连(见图6-2),其余各种细胞色素中辅基与酶蛋白均通过非共价键结合。
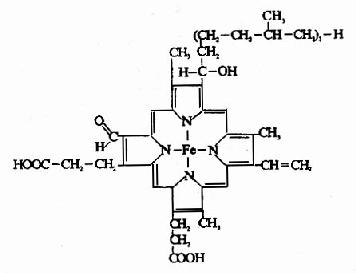
图6-2 细胞色素C的辅基与酶蛋白的联接方式
细胞色素a和a3不易分开,统称为细胞色素aa3。和细胞色素P450、b、c1、c不同,细胞色素aa3的辅基不是血红素,而是血红素A(见图6?)。细胞色素aa3可将电子直接传递给氧,因此又称为细胞色素氧化酶。
图6-3 血红素A结构式
铁卟啉辅基所含Fe2+可有Fe2+←→Fe3++e的互变,因此起到传递电子的作用。铁原子可以和酶蛋白及卟啉环形成6个配位键。细胞色素aa3和P450辅基中的铁原子只形成5个配位键,还能与氧再形成一个配位键,将电子直接传递给氧,也可与CO、氰化物、H2S或叠氮化合物形成一个配位键。细胞色素aa3与氰化物结合就阻断了整个呼吸链的电子传递,引起氰化物中毒。
二、呼吸链中各种传递体的排列顺序
(一)确定排列顺序的方法
1.标准氧化还原电位的数值表示氧化还原能力的大小,标准氧化还原电位负值越大,其还原性越强,容易被氧化;标准氧化还原电位正值越大,其氧化性越强,容易被还原。因此呼吸链中各种组分的排列顺序应当由低电位依次向高电位排列(图-4)。
图6-4 各种传递体的标准氧化还原电位
2.还原程度来确定。Chance和Williams使用分光光度法测定离体的线粒体在有氧条件下三羧酸循环反应达到平衡时,呼吸链中各种传递体的还原程度。反应达到平衡时从底物一侧到氧一侧的各种传递体的还原程度应当是递减的,底物的一侧最高,氧一侧最低,如下表中数据所示。
表6-1 有氧动态平衡时电子传递体的还原程度
| 传递体 | NAD | FP | Cyt b | Cyt c | Cty aa3 |
| 还原型% | 53 | 20 | 16 | 6 | 1 |
FP:黄素蛋白
这种情况好象物理学上的联通管,图6?A中,若进水量等于出水量,即流量达到平衡时,离进水口最近的水管中水位最高,离出水管最近的水管中水位最低,从进水管到出水管水位逐渐减低,若把水流视为电子流,就是上述实验中的情况。
3.使用特异的抑制剂 特异的抑制剂能阻断呼吸链中的特定环节,阻断部位的底物一侧的各种传递体应为还原型,阻断部位的氧一侧的各种传递体应为氧化型,正象我们阻断联通管的底部一样,阻断部位以前的各水管中水是满的,而阻断部位以后的各水管中水均流光(见图6-5,B)。
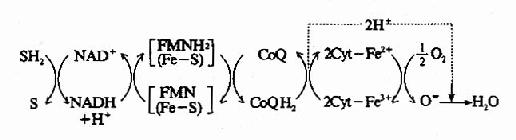
图6-5 有氧氧化稳定时各种传递体的还原太分数
A.不加抑制剂 B.加入抗霉A阻断
复合物Ⅰ:催化NADH氧化、CoQ还原。
复合物Ⅱ:催化琥珀酸氧化、CoQ还原
复合物Ⅲ:催化Co QH2氧化、Cyt c还原
复合物Ⅳ:催化Cyt c氧化、O2还原
表6-2 使用抗霉素A前后各种递电子体的还原型百分数
| FP | Cyt b | Cyt c+c1 | Cty aa3 | |
| 琥珀酸 | 40 | 25 | 19 | 4 |
| 琥珀酸+抗霉素A | 100 | 100 |
从表中可以看出,FP、Cyt b位于抗霉素A阻断部位之前,Cytc、cl、aa3位于阻断部位之后。用不同的抑制剂作此实验,就可以确定呼吸链中各种传递体的排列顺序。
4.在体外实验中,将线粒体分成各种复合物,检测其各自催化的反应,再将其重组,检测其催化能力。
美国格林(Green)等实验室成功地将呼吸链分离成具有催化活性的四种复合物以及CoQ和Cytc.检测各个复合物的功能发现:
可以看出CoQ在复合物Ⅰ与Ⅲ,Ⅱ与Ⅲ之间传递还原当量,Cyt c在复合物Ⅲ与Ⅳ之间传递还原当量。他们又将这四种复合物1:1:1:1的比例混合,加上CoQ和Cyt c重组,基本上恢复了线粒体原有的催化能力。
借助上述实验方法,呼吸链各组分的排列顺序已基本明确,但仍有些不一致的看法,其中以CoQ至细胞色素C这一部分研究得还很不清楚,对于Fe-S和CoQ的定位和数量也有争议。
(二)氧化呼吸链
1.NADH氧化呼吸链 人体内大多数脱氢酶都以NAD+作辅酶,在脱氢酶催化下底物SH2脱下的氢交给NAD+生成NADH+H+,在NADH脱氢酶作用下,NADH+H+将两个氢原子传递给FMN生成FMNH2,再将氢传递至CoQ生成CoQH2,此时两个氢原子解离成2H++2e,2H+游离于介质中,2e经Cyt b、c1、c、aa3传递,最后将2e传递给1/2O2,生成O2-,O2与介质中游离的2H+结合生成水,综合上述传递过程可用图6-6表示。
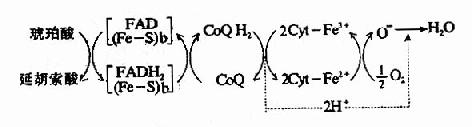
图6-6 NADH氧化呼吸链
SH2:作用物;(Fe-S):铁硫中心;Cyt:细胞色素
2.琥珀酸氧化呼吸链 琥珀酸在琥珀酸脱氢酶作用下脱氢生成延胡索酸,FAD接受两个氢原子生成FADH2,然后再将氢传递给CoQ,生成CoQH2,此后的传递和NADH氧化呼吸链相同,整个传递过程可用图6-7表示。
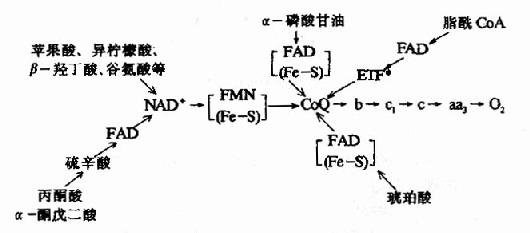
图6-7 琥珀酸氧化呼吸链
(Fe-S):铁硫中心:b:琥珀酸脱氢酶复合体的细胞色素
3.线粒体氧化呼吸链总结 线粒体中物质代谢会生成大量的NADH+H+和FADH2-它们可来自丙酮酸氧化脱羧、三羧酸循环、脂肪酸的β-氧化和L-谷氨酸的氧化脱氨等反应,现将某些重要底物氧化时的呼吸链总结于图6-8。
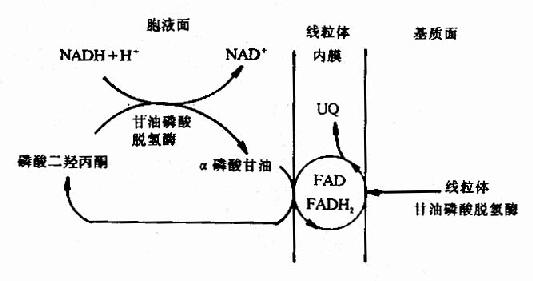
图6-8 线粒体中某些底物氧化时的呼吸链
*ETF:电子传递黄素蛋白,辅基为FAD
三、胞浆中NADH的转移
体内很多物质氧化分解产生NADH,反应发生在线粒体内,则产生的NADH可直接通过呼吸链进行氧化磷酸化,但亦有不少反应是在线粒体外进行的,如3-磷酸甘油醛脱氢反应,乳酸脱氢反应及氨基酸联合脱氨基反应等等。由于所产生的NADH存在于线粒体外,而真核细胞中,NADH不能自由通过线粒体内膜,因此,必须借助某些能自由通过线粒体内膜的物质才能被转入线粒体,这就是所谓穿梭机制,体内主要有两种穿梭机制。
1.α磷酸甘油穿梭(glycerolα-phosphateshuttle)
该穿梭机制主要在脑及骨骼肌中,它是借助于α-磷酸甘油与磷酸二羟丙酮之间的氧化还原转移还原当量,使线粒体外来自NADH的还原当量进入线粒体的呼吸链氧化,具体过程如图6-9。
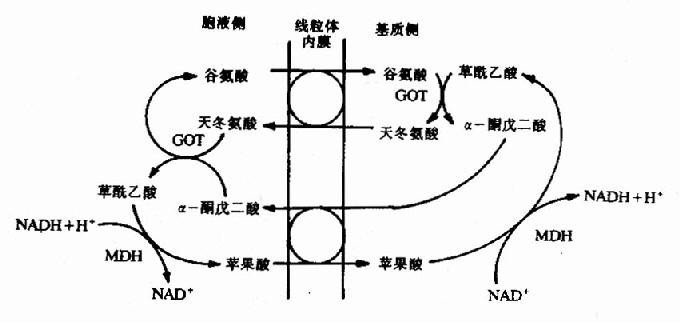
图6-9 α磷酸甘油穿
当胞液中NADH浓度升高时,胞液中的磷酸二羟丙酮首先被NADH还原成α磷酸甘油(3-磷酸甘油),反应由甘油磷酸脱氢酶(辅酶为NAD+)催化,生成的α磷酸甘油可再经位于线粒体内膜近外侧部的甘油磷酸脱氢酶催化氧化生成磷酸二羟丙酮。线粒体与胞液中的甘油磷酸脱氢酶为同工酶,两者不同在于线粒体内的酶是以FAD为辅基的脱氢酶,而不是NADH+,FAD所接受的质子、电子可直接经泛醌、复合体Ⅲ、Ⅳ传递到氧,这样线粒体外的还原当量就被转运到线粒体氧化了,但通过这种穿梭机制果只能生成2分子ATP而不是3分子ATP。
2.苹果酸,天冬氨酸穿梭(malate aspartate shuttle):
这种穿梭机制主要在肝、肾、心中发挥作用,其穿梭机制比较复杂,不仅需借助苹果酸、草酸乙酸的氧化还原,而且还要借助α酮酸与氨基酸之间的转换,才能使胞液中来的NADH的还原当量转移进入线粒体氧化,具体过程如图6-10。
![]()
图6-10 苹果酸天冬氨酸穿梭
GOT:谷草转氨酸;MDH:苹果酸脱氢酶
当胞液中NADH浓度升高时,首先还原草酰乙酸成为苹果酸,此反应由苹果酸脱氢酶催化,胞液中增多的苹果酸可通过内膜上的二羧酸载体系统与线粒体内的α酮戊二酸交换;进入线粒体的苹果酸,经苹果酸脱氢酶催化又氧化生成草酰乙酸并释出NADH,还原当量从复合体I进入呼吸链经CoQ、复合体Ⅲ、Ⅳ传递,最image/005061360后给氧,所以仍可产生3分子ATP,与在线粒体内产生的NADH氧化相同。与此同时线粒体内的α酮戊二酸由于与苹果酸交换而减少,需要补充,于是在转氨酶作用下由谷氨酸与草酰乙酸进行转氨基反应,生成α酮戊二酸和天冬氨酸,天冬氨酸借线粒体膜上的谷氨酸天冬氨酸载体转移系统与胞液的谷氨酸交换,从而补充了线粒体内谷氨酸由于转氨基作用而造成的损失,进入胞液的天冬氨酸再与胞液中α酮戊二酸进行转氨基,重新又产生草酰乙酸以补充最初的消耗,从而完成整个穿梭过程。
第三节 ATP的生成、储存和利用
ATP几乎是生物组织细胞能够直接利用的唯一能源,在糖、脂类及蛋白质等物质氧化分解中释放出的能量,相当大的一部分能使ADP磷酸化成为ATP,从而把能量保存在ATP分子内。
ATP为一游离核苷酸,由腺嘌呤、核糖与三分子磷酸构成,磷酸与磷酸间借磷酸酐键相连,当这种高能磷酸化合物水解时(磷酸酐键断裂)自由能变化(G)为30.5KJ/mol,而一般的磷酸酯水解时(磷酸酯键断裂)自由能的变化只有8至12KJ/mol,因此曾称此磷酸酐键为高能磷酸键,但实际上这样的名称是不够确切的,因为一种化合物水解时释放自由能的多少取决于该化合物整个分子的结构,以及反应的作用物自由能与产物自由能的差异,而不是由哪个特殊化学键的破坏所致,但为了叙述及解释问题方便,高能磷酸键的概念至今仍被生物化学界采用。
ATP是一高能磷酸化合物,当ATP水解时首先将其分子的一部分,如磷酸(Pi)或腺苷酸(AMP)转移给作用物,或与催化反应的酶形成共价结合的中间产物,以提高作用物或酶的自由能,最终被转移的AMP或Pi将被取代而放出,ATP多以这种通过磷酸基团等转移的方式,而非单独水解的方式,参加酶促反应提供能量,用以驱动需要加入自由能的吸能反应,ATP水解反应的总结如下:
ATP——→ADP+Pi
或ATP——→AMP+PPi
(焦磷酸)
一、ATP的生成方式
体内ATP生成有两种方式
(一)底物水平磷酸化(substrate level phosphorylation)
底物分子中的能量直接以高能键形式转移给ADP生成ATP,这个过程称为底物水平磷酸化,这一磷酸化过程在胞浆和线粒体中进行,包括有:

(二)氧化磷酸化(oxidative phosphorylation)
氧化和磷酸化是两个不同的概念。氧化是底物脱氢或失电子的过程,而磷酸化是指ADP与Pi合成ATP的过程。在结构完整的线粒体中氧化与磷酸化这两个过程是紧密地偶联在一起的,即氧化释放的能量用于ATP合成,这个过程就是氧化磷酸化,氧化是磷酸化的基础,而磷酸化是氧化的结果。
机体代谢过程中能量的主要来源是线粒体,既有氧化磷酸化,也有底物水平磷酸化,以前者为主要来源。胞液中底物水平磷酸化也能获得部分能量,实际上这是酵解过程的能量来源。对于酵解组织、红细胞和组织相对缺氧时的能量来源是十分重要的。
二、氧化磷酸化偶联部位的测定
确定氧化磷酸化偶联部位通常用两种方法。
(一)P/0值测定
P/0值指在氧化磷酸化过程中消耗一克原子氧所消耗的无机磷的克原子数,或者说消耗一克原子氧所生成的ATP的克分子数。P/0值实质上指的是呼吸过程中磷酸化的效率。
测定P/0值的方法通常是在一密闭的容器中加入氧化的底物、ADP、Pi、氧饱和的缓冲液,再加入线粒体制剂时就会有氧化磷酸化进行。反应终了时测定O2消耗量(可用氧电极法)和Pi消耗量(或ATP生成量)就可以计算出P/0值了。在反应系统中加入不同的底物,可测得各自的P/0值,结合我们所了解的呼吸链的传递顺序,就可以分析出大致的偶联部位了。
表6-3 离体线粒体的P/0比值
| 底物 | 呼吸的组成 | P/0比值 | 生成ATP数 |
| (1)β-羟丁酸 | NAD+→FMN→CoQ→Cyt→O2 | 2.4-2.8 | 3 |
| (2)琥珀酸 | FAN→CoQ→Cyt→O2 | 1.7 | 2 |
| (3)抗坏血酸 | Cyt→Cytaa3→O2 | 0.88 | 1 |
| (4)细胞色素c | Cytaa3→O2 | 0.61-0.68 | 1 |
从上表可以看出P/0值为小数,由于线粒体的偶联作用在离体条件下不能完全发挥,故可认为实际的ATP生成数是他们所接近的正整数值。
比较表中的(1)和(2),呼吸链传递的差异是在CoQ之间,两者ATP的生成数相差1,所以这个ATP的生成部位一定在NAD→CoQ之间。
比较表中(2)和(3),呼吸链传递的差异是在Cyt c之间,两者ATP的生成数相差1,所以这个ATP的生成部位在CoQ→Cyt c之间。
比较表中(3)和(4),生成的ATP数均为1,呼吸链传递的区别是在Cyt c→Cyt aa3,故Cytc→ aa3不存在偶联部位,而在Cyt aa3→O2之间存在着一个偶联部位。
(二)根据氧化还原电位计算电子传递释放的能量是否能满足ATP合成的需要
氧化还原反应中释放的自由能△G'O与反应底物和产物标准氧化还原电位差值(△E'O)之间存在下述关系:△G'O=nF△E'O
式中n为氧化还原反应中电子转移数目,F为法拉弟常数(23.062千卡/克分子·伏特,或96500库仑/克分子)。
一克分子ATP水解生成ADP与Pi所释放的能量为7.3千卡,凡氧化过程中释放的能量大于7.3千,均有可能生成一克分子ATP,就是说可能存在有一个偶联部位,根据上式计算,当n=2时,△E'O=0.1583V时可释放7.3千卡能量,所以反应底物与生成物的标准氧化还原电位的变化大于0.1583V的部位均可能存在着一个偶联部位。
从图6-11可以看出,在NAD→CoQ,Cyt b→Cyt c和Cyt aa3→O2处可能存在着偶联部位。必须明确,这种计算的基础是反应处在热力学平衡状态,温度为25℃,pH为7.0,反应底物和产物的浓度均为1克分子,这种条件在体内是不存在的。因此这一计算结果只能供参考。
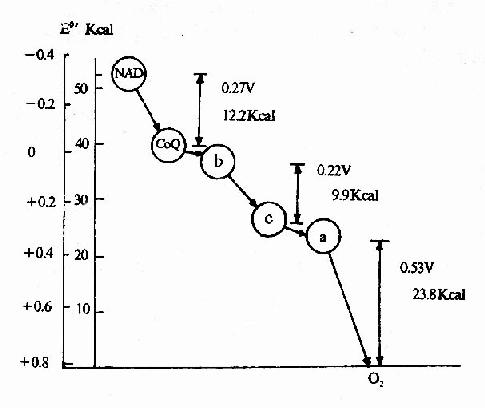
图6-11 呼吸链中电子对传递时自由能的变化
综上所述,呼吸链中电子传递和磷酸化的偶联部位可用图6-12表示。
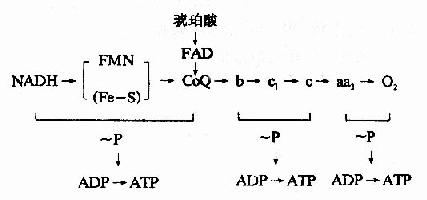
图6-12 偶联部位示意图
呼吸链磷酸化的全过程可用下述方程式表示
NADH+H++3ADP+3Pi+1/2O2→NAD++3ATP+4H2O
FADH2+2ADP+2Pi+1/2O2→FAD+2ATP+3H2O
三、氧化磷酸化中ATP生成的结构基础
ATP是由位于线粒体内膜上的ATP合成酶催化ADP与Pi合成的。ATP合成酶是一个大的膜蛋白质复合体,分子量在480?00kD,是由两个主要组成(或称因子)构成,一是疏水的F0,另一是亲水的F1,又称F0F1复合体。在电子显微镜下观察线粒体时,可见到线粒体内膜基质侧有许多球状颗粒突起,这就是ATP合成酶,其中球状的头与茎是F1部分,分子量为350?/P>380kD,由α3、β3、γ、δ、ε等9种多肽亚基组成,β与α亚基上有ATP结合部位;γ亚基被认为具有控制质子通过的闸门作用;δ亚基是F1与膜相连所必需,其中中心部分为质子通路;ε亚基是酶的调节部分,F0是由3?个大小不一的亚基组成,其中有一个亚基称为寡霉素敏感蛋白质(oligomycinsensitivityconferringprotein,OSCP),此外尚有一个蛋白质部分为分子量28kD的因子,F0主要构成质子通道(见图6-13)。
图6-13 线粒体内膜上三联体(三分子体)结构示意图
四、氧化磷酸化的偶联机制
有关氧化磷酸化的偶联机理已经作了许多研究,目前氧化磷酸化的偶联机理还不完全清楚,50年代Slater及Lehninger提出了化学偶联学说,1964年Boear又提出了构象变化偶联学说,这两种学说的实验依据不多,支持这两种观点的人已经不多了。目前多数人支持化学渗透学说(chemiosmotic hypothesis),这是英国生化学家P.Mitchell于1961年提出的,当时没有引起人们的重视,1966年他根据逐步积累的实验证据和生物膜研究的进展,逐步地完善了这一学说。
氧化磷酸化的化学渗透学说的基本观点是:
1.线粒体的内膜中电子传递与线粒体释放H+是偶联的,即呼吸链在传递电子过程中释放出来的能量不断地将线粒体基质内的H+逆浓度梯度泵出线粒体内膜,这一过程的分子机理还不十分清楚(见图6-14)。
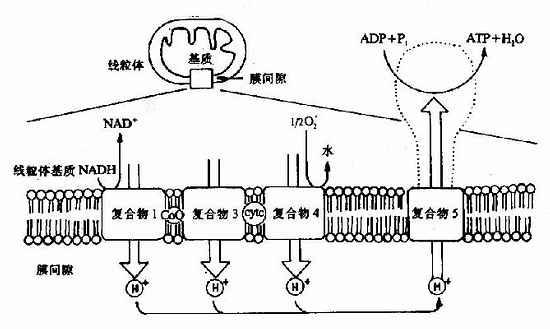
图6-14 电子传递与质子传递偶联(注:复合物Ⅱ未显示)
2.H+不能自由透过线粒体内膜,结果使得线粒体内膜外侧H+浓度增高,基质内H+浓度降低,在线粒体内膜两侧形成一个质子跨膜梯度,线粒体内膜外侧带正电荷,内膜内侧带负电荷,这就是跨膜电位△ψ。由于线粒体内膜两侧H+浓度不同,内膜两侧还有一个pH梯度△pH,膜外侧pH较基质pH约低1.0单位,底物氧化过程中释放的自由能就储存于△ψ和△pH中,若以△P表示总的质子移动力,那么三者的关系可用下式表示:
△P=△ψ-59△pH
3.线粒体外的H+可以通过线粒体内膜上的三分子体顺着H+浓度梯度进入线粒体基质中,这相当于一个特异的质子通道,H+顺浓度梯度方向运动所释放的自由能用于ATP的合成,寡霉素能与OSCP结合,特异阻断这个H+通道,从而抑制ATP合成。有关ATP合成的分子机制目前还不十分清楚。
4.解偶联剂的作用是促进H+被动扩散通过线粒体内膜,即增强线粒体内膜对H+的通透性,解偶联剂能消除线粒体内膜两侧的质子梯度,所以不能再合成ATP。
总之,化学渗透学说认为在氧化与磷酸化之间起偶联作用的因素是H+的跨膜梯度。
每对H+通过三分子体回到线粒体基质中可以生成一分子ATP。以NADH+H+作底物,其电子沿呼吸链传递在线粒体内膜中形成三个回路,所以生成3分子ATP。以FADH2为底物,其电子沿琥珀酸氧化呼吸链传递在线粒体内膜中形成两个回路,所以生成两个ATP分子。
自从Mitchell提出化学通透学说以来,已为大量的实验结果验证,为该学说提供了实验依据。
美国Cohen等人于1978年使用完整的大鼠肝细胞作实验材料,以核磁共振(nuclearmagneticresonance,NMR)的方法直接观察到完整细胞中胞液与线粒体基质之间存在H+跨膜梯度,胞液的pH值比线粒体基质的pH值低0.3单位,用解偶联剂处理,或用氮气代替氧气切断氧的供应,那么胞液和线粒体基质之间的pH梯度消失。
嗜盐菌(halobacteriumhaloblum)是一种能在高浓度盐溶液中生长的细菌,该菌中有一种结合蛋白质,称为菌紫质(bacteriorhodopsin),菌紫质能将光能转换成化学能。有人使用嗜盐菌作实验,在无O2的情况下用光照射嗜盐菌,尽管无氧化作用,菌体内仍维持一定的ATP浓度,若加入解偶联剂或加入磷酸化抑制剂DCC,则菌体内ATP浓度降低;而加入呼吸抑制剂抑制电子传递,即不影响ATP合成,ATP浓度不变,这说明电子传递和H+运动是可以分开加以研究的,嗜盐菌为研究化学渗透学说的H+运动提供了一个理想的模型。于是,有人分离嗜盐菌的菌紫质,并将其重组在人工脂质体中,然后用光照射,可测得跨膜电位为120mV(内负外正),同时膜外侧H+浓度增高,膜内外△pH约为1.8单位,可以算出总的质子移动力约为△P=-120mV-59×1.8mV=226mV,若再将牛心线粒体内膜重组在此脂质体中,光照后可使ADP+Pi生成ATP,这说明质子跨膜梯度可以经过线粒体内膜的三分子体将H+跨膜梯度中储存的能量转变为ATP分子中的化学能。
五、氧化磷酸化抑制剂
氧化磷酸化抑制剂可分为三类,即呼吸抑制剂、磷酸化抑制剂和解偶联剂。
(一)呼吸抑制剂这类抑制剂抑制呼吸链的电子传递,也就是抑制氧化,氧化是磷酸化的基础,抑制了氧化也就抑制了磷酸化。呼吸链某一特定部位被抑制后,其底物一侧均为还原状态,其氧一侧均为氧化态,这很容易用分光亮度法(双波长分光亮度计)检定,重要的呼吸抑制剂有以下几种。
鱼藤酮(rotenone)系从植物中分离到的呼吸抑制剂,专一抑制NADH→CoQ的电子传递。
抗霉素A(actinomycinA)由霉菌中分离得到,专一抑制CoQ→Cyt c的电子传递。
CN、CO、NaN3和H2S均抑制细胞色素氧化酶。
(二)磷酸化抑制剂这类抑制剂抑制ATP的合成,抑制了磷酸化也一定会抑制氧化。
寡霉素(oligomycin)可与F0的OSCP结合,阻塞氢离子通道,从而抑制ATP合成。
二环己基碳二亚胺(dicyclohexylcarbodiimide,DCC)可与F0的DCC结合蛋白结合,阻断H+通道,抑制ATP合成。栎皮酮(quercetin)直接抑制参与ATP合成的ATP酶。
(三)解偶联剂(uncoupler) 解偶联剂使氧化和磷酸化脱偶联,氧化仍可以进行,而磷酸化不能进行,解偶联剂作用的本质是增大线粒体内膜对H+的通透性,消除H+的跨膜梯度,因而无ATP生成,解偶联剂只影响氧化磷酸化而不干扰底物水平磷酸化,解偶联剂的作用使氧化释放出来的能量全部以热的形式散发。动物棕色脂肪组织线粒体中有独特的解偶联蛋白,使氧化磷酸化处于解偶联状态,这对于维持动物的体温十分重要。
常用的解偶联剂有2,4-二硝基酚(dinitrophenol,DNP),羰基-氰-对-三氟甲氧基苯肼(FCCP),双香豆素(dicoumarin)等,过量的阿斯匹林也使氧化磷酸化部分解偶联,从而使体温升高。
过量的甲状腺素也有解偶联作用,甲状腺素诱导细胞膜上Na+-K+-ATP酶的合成,此酶催化ATP分解,释放的能量将细胞内的Na+泵到细胞外,而K+进入细胞,Na+-K+-ATP酶的转换率为100个分子ATP/秒,酶分子数增多,单位时间内分解的ATP增多,生成的ADP又可促进磷酸化过程。甲亢病人表现为多食、无力、喜冷怕热,基础代谢率(BMR)增高,因此也有人将甲状腺素看作是调节氧化磷酸化的重要激素。
六、氧化磷酸化的调节
机体的氧化磷酸化主要受细胞对能量需求的调节
(一)ATP/ADP值对氧化磷酸化的直接影响线粒体内膜中有腺苷酸转位酶,催化线粒体内ATP与线粒体外ADP的交换,ATP分子解离后带有4个负电荷,而ADP分子解离后带有3个负电荷,由于线粒体内膜内外有跨膜电位(△ψ),内膜外侧带正电,内膜内侧带负电,所以ATP出线粒体的速度比进线粒体速度快,而ADP进线粒体速度比出线粒体速度快。Pi进入线粒体也由磷酸转位酶催化,磷酸转位酶催化OH与Pi交换,磷酸二羧酸转位酶催化Pi2-与二羧酸(如苹果酸)交换。
当线粒体中有充足的氧和底物供应时,氧化磷酸化就会不断进行,直至ADP+Pi全部合成ATP,此时呼吸降到最低速度,若加入ADP,耗氧量会突然增高,这说明ADP控制着氧化磷酸化的速度,人们将ADP的这种作用称为呼吸受体控制。
机体消耗能量增多时,ATP分解生成ADP,ATP出线粒体增多,ADP进线粒体增多,线粒体内ATP/ADP值降低,使氧化磷酸化速度加快,ADP+Pi接受能量生成ATP。机体消耗能量少时,线粒体内ATP/ADP值增高,线粒体内ADP浓度减低就会使氧化磷酸化速度减慢。
(二)ATP/ADP值的间接影响ATP/ADP值增高时,使氧化磷酸化速度减慢,结果NADH氧化速度减慢,NADH浓度增高,从而抑制了丙酮酸脱氢酶系、异柠檬酸脱氢酶、α-酮戊二酸脱氢酶系和柠檬酸合成酶活性,使糖的氧化分解和TCA循环的速度减慢。
(三)ATP/ADP值对关键酶的直接影响ATP/ADP值增高会抑制体内的许多关键酶,如变构抑制磷酸果糖激酶、丙酮酸激酶和异柠檬酸脱氢酶,还能抑制丙酮酸脱羧酶、α-酮戊二酸脱氢酶系,通过直接反馈作用抑制糖的分解和TCA循环。
七、高能磷酸化合物的储存和利用
无论是底物水平磷酸化还是氧化磷酸化,释放的能量除一部分以热的形式散失于周围环境中之外,其余部分多直接生成ATP,以高能磷酸键的形式存在。同时,ATP也是生命活动利用能量的主要直接供给形式。
(一)高能化合物
人体存在多种高能化合物,但这些高能化合物的能量并不相同。
体外实验中,在pH7.0,25℃条件下,每克分子ATP水解生成ADP+Pi时释放的能量为7.1千卡或30.4千焦耳,在体内,pH7.4,37℃,ATP、ADP+Pi、Mg2+均处于细胞内生理浓度的情况下,每克分子ATP水解生成ADP+Pi时释放的能量为33.5-50千焦耳或8-12千卡(表6-4)。
表6-4 几种常见高能化合物水解时释放的能量
| 化合物 | 千焦耳/克分子 | 千卡/克分子 |
| 磷酸烯醇式丙酮酸 | -62.1 | -14.8 |
| 1,3-二磷酸甘油酸 | -49.5 | -11.8 |
| 磷酸肌酸 | -43.9 | -10.5 |
| 乙酰CoA | -31.4 | -8.2 |
| ATP | -30.4 | -7.3 |
| S-腺苷蛋氨酸 | -29.3 | -7.0 |
| F-6-P | -15.6 | -3.8 |
| 谷氨酰胺 | -14.2 | -3.4 |
| G-6-P | -13.48 | -3.3 |
卫生学规定,中度体力劳动者每日每kg体重需供给能量34-40千卡,若一成人重70kg,从事中度体力劳动,则每日应供应含能量2450千卡的食物,其中40%的能量转变成化学能储存于ATP分子的高能键中,这一部分能量应为2450×0.4=980.0千卡,按每克分子ATP水解生成ADP+Pi释放7.3千卡能量计算,应当合成:980÷7.3=134.3克分子ATP,ATP的分子量为507.22,所以134.3克分子ATP重达68.12kg,这足以表明ATP在体内的代谢十分旺盛。
ATP在能量代谢中之所以重要,就是因为ATP水解时的标准自由能变化位于多种物质水解时标准自由能变化的中间,它能从具有更高能量的化合物接受高能磷酸键,如接受PEP、1,3-二磷酸甘油、磷酸肌酸分子中的~Pi生成ATP,ATP也能将~Pi转移给水解时标准自由能变化较小的化合物,如转移给葡萄糖生成G-6-P。
(二)ATP能量的转移
ATP是细胞内的主要磷酸载体,ATP作为细胞的主要供能物质参与体内的许多代谢反应,还有一些反应需要UTP或CTP作供能物质,如UTP参与糖元合成和糖醛酸代谢,GTP参与糖异生和蛋白质合成,CTP参与磷脂合成过程,核酸合成中需要ATP、CTP、UTP和GTP作原料合成RNA,或以dATP、dCTP、dGTP和dTTP作原料合成DNA。
作为供能物质所需要的UTP、CTP和GTP可经下述反应再生:
UDP+ATP→UTP+ADP
GDP+ATP→GTP+ADP
CDP+ATP→CTP+ADP
dNTP由dNDP的生成过程也需要ATP供能:
dNDP+ATP→dNTP+ADP
(三)磷酸肌酸
ATP是细胞内主要的磷酸载体或能量传递体,人体储存能量的方式不是ATP而是磷酸肌酸。肌酸主要存在于肌肉组织中,骨骼肌中含量多于平滑肌,脑组织中含量也较多,肝、肾等其它组织中含量很少。
磷酸肌酸的生成反应如下:
![]()
肌细胞线粒体内膜和胞液中均有催化该反应的肌酸激酶,它们是同工酶。线粒体内膜的肌酸激酶主要催化正向反应,生成的ADP可促进氧化磷酸化,生成的磷酸肌酸逸出线粒体进入胞液,磷酸肌酸所含的能量不能直接利用;胞液中的肌酸激酶主要催化逆向反应,生成的ATP可补充肌肉收缩时的能量消耗,而肌酸又回到线粒体用于磷酸肌酸的合成,此过程可用图6-15表示。
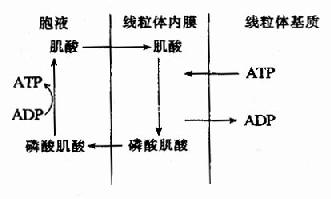
图6-15 磷酸肌酸的生成与利用
肌肉中磷酸肌酸的浓度为ATP浓度的5倍,可储存肌肉几分钟收缩所急需的化学能,可见肌酸的分布与组织耗能有密切关系。
ATP的生成、储存和利用可用下图表示(图6-16)
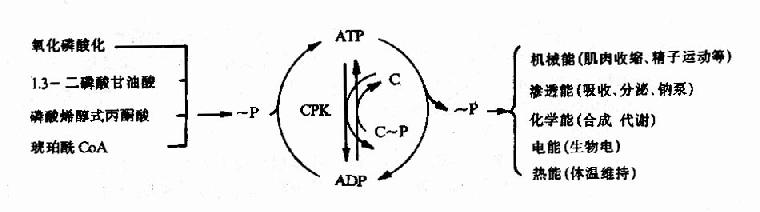
图6-16 ATP的生成、储存和利用总结示意图
CPK:肌酸磷酸激酶
第七章 氨基酸代谢
氨基酸是构成蛋白质分子的基本单位。蛋白质是生命活动的基础。体内的大多数蛋白质均不断地进行分解与合成代谢,细胞中不停地利用氨基酸合成蛋白质和分解蛋白质成为氨基酸。体内的这种转换过程一方面可清除异常蛋白质,这些异常蛋白质的积聚会损伤细胞。另一方面使酶或调节蛋白的活性由合成和分解得到调节,进而调节细胞代谢。实际上酶的水平取绝于其合成同样也由酶的分解来决定。所以,对细胞来说,蛋白质的分解与合成同样重要。
蛋白质分解代谢首先在酶的催化下水解为氨基酸,而后各氨基酸进行分解代谢,或转变为其它物质、或参与新的蛋白质的合成。因此氨基酸代谢是蛋白质分解代谢的中心内容。
第一节 氨基酸的一般代谢
食物蛋白经过消化吸收后,以氨基酸的形式通过血液循环运到全身的各组织。这种来源的氨基酸称为外源性基酸。机体各组织的蛋白质在组织酶的作用下,也不断地分解成为氨基酸;机体还能合成部分氨基酸(非必需氨基酸);这两种来源的氨基酸称为内源性氨基酸。外源性氨基酸和内源性氨基酸彼此之间没有区别,共同构成了机体的氨基酸代谢库(metabolic pool)。氨基酸代谢库通常以游离氨基酸总量计算,机体没有专一的组织器官储存氨基酸,氨基酸代谢库实际上包括细胞内液、细胞间液和血液中的氨基酸。
氨基酸的主要功能是合成蛋白质,也合成多肽及其他含氮的生理活性物质。除了维生素之外(维生素PP是个例外)体内的各种含氮物质几种都可由氨基酸转变而成,包括蛋白质、肽类激素、氨基酸衍生物、黑色素、嘌呤碱、嘧啶碱、肌酸、胺类、辅酶或辅基等。
从氨基酸的结构上看,除了侧链R基团不同外,均有α-氨基和α羧基。氨基酸在体内的分解代谢实际上就是氨基、羧基和R基团的代谢。氨基酸分解代谢的主要途径是脱氨基生成氨ammonia)和相应的α酮酸;氨基酸的另一条分解途径是脱羧基生成CO2和胺。胺在体内可经胺氧化酶作用,进一步分解生成氨和相应的醛和酸。氨对人体来说是有毒的物质,氨在体内主要合成尿素排出体外,还可以合成其它含氮物质(包括非必需氨基酸、谷氨酰胺等),少量的氨可直接经尿排出。R基团部分生成的酮酸可进一步氧化分解生成CO2和水,并提供能量,也可经一定的代谢反应转变生成糖或脂在体内贮存。由于不同的氨基酸结构不同,因此它们的代谢也有各自的特点。
各组织器官在氨基酸代谢上的作用有所不同,其中以肝脏最为重要。肝脏蛋白质的更新速度比较快,氨基酸代谢活跃,大部分氨基酸在肝脏进行分解代谢,同时氨的解毒过程主要也在肝脏进行。分枝氨基酸的分解代谢则主要在肌肉组织中进行。
食物中蛋白质的含量也影响氨基酸的代谢速率。高蛋白饮食可诱导合成与氨基酸代谢有关的酶系,从而使代谢加快(图7-1)。
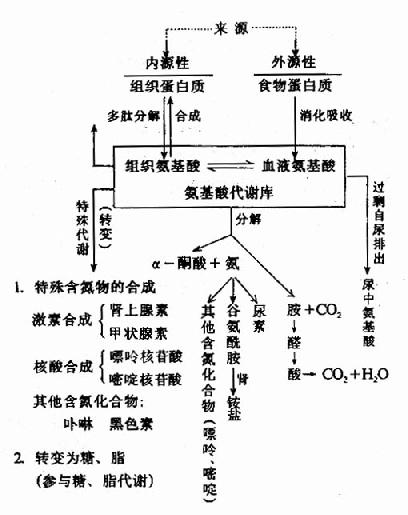
图7-1 氨基酸代谢的基本概况
一、氨基酸的脱氨基作用
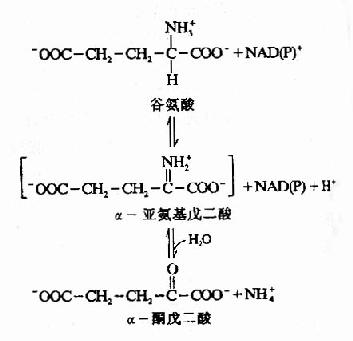
图7-2 谷氨酸脱氢酶催化的氧化脱氢反应
脱氨基作用是指氨基酸在酶的催化下脱去氨基生成α酮酸的过程。这是氨基酸在体内分解的主要方式。参与人体蛋白质合成的氨基酸共有20种,它们的结构不同,脱氨基的方式也不同,主要有氧化脱氨、转氨、联合脱氨和非氧化脱氨等,以联合脱氨基最为重要。
(一)氧化脱氨基作用(Oxidative Deamination)
氧化脱氨基作用是指在酶的催化下氨基酸在氧化脱氢的同时脱去氨基的过程。
不需氧脱氢酶催化的氧化脱氨基作用
谷氨酸在线粒体中由谷氨酸脱氢酶(glutamatedehydrogonase)催化氧化脱氨。谷氨酸脱氢酶系不需氧脱氢酶,以NAD+或NADP+作为辅酶。氧化反应通过谷氨酸Cα脱氢转给NAD(P)+形成α亚氨基戊二酸,再水解生成α酮戊二酸和氨(图7-2)。
谷氨酸脱氢酶为变构酶。GDP和ADP为变构激活剂,ATP和GTP为变构抑制剂。
在体内,谷氨酸脱氢酶催化可逆反应。一般情况下偏向于谷氨酸的合成(△G°′≈30kJ·mal1),因为高浓度氨对机体有害,此反应平衡点有助于保持较低的氨浓度。但当谷氨酸浓度高而NH3浓度低时,则有利于脱氨和α酮戊二酸的生成。
(二)转氨基作用
转氨基作用(Transamination)指在转氨酶催化下将α-氨基酸的氨基转给另一个α-是酮酸,生成相应的α酮酸和一种新的α-氨基酸的过程。
体内绝大多数氨基酸通过转氨基作用脱氨。参与蛋白质合成的20种α-氨基酸中,除甘氨酸、赖氨酸、苏氨酸和脯氨酸不参加转氨基作用,其余均可由特异的转氨酶催化参加转氨基作用。转氨基作用最重要的氨基受体是α酮戊二酸,产生谷氨酸作为新生成氨基酸:

进一步将谷氨酸中的氨基转给草酰乙酸,生成α酮戊二酸和天冬氨酸:
![]()
或转给丙酮酸。生成α酮戊二酸和丙氨酸,通过第二次转氨反应,再生出α酮戊二酸。
![]()
因而体内有较强的谷草转氨酸(glutamicpyruvic transaminase,GPT)和谷丙转氨酸(glutamic oxaloacetictrans aminase,GOT)活性。
转氨基作用是可逆的,该反应中△G°′≈0,所以平衡常数约为1。反应的方向取绝于四种反应物的相对浓度。因而,转氨基作用也是体内某些氨基酸(非必需氨基酸)合成的重要途径。
2.转氨基作用机理:
转氨基作用过程可分为两个阶段:
(1)一个氨基酸的氨基转到酶分子上,产生相应的酮酸和氨基化酶:
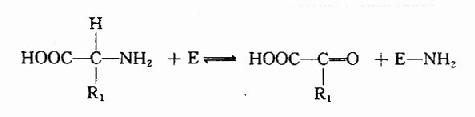
(2)NH2转给另一种酮酸,(如α酮戊二酸)生成氨基酸,并释放出酶分子:
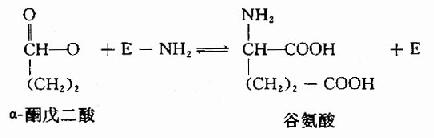
为传送NH2基因,转氨酶需其含醛基的辅酶-磷酸吡哆醛(pyridoxal-5′-phosphate,PLP)的参与。在转氨基过程中,辅酶PLP转变为磷酸吡哆胺(pyridoxamine5′phosphate,PMP)。PLP通过其醛基与酶分子中赖氨酸ω氨基缩合形成Schiff碱而共价结合子酶分子中。
Esmond Snell,Alexande Branstein和David Metgler等揭示转氨作用是一种兵乓机制,二阶段各分三步进行(图7-3)。
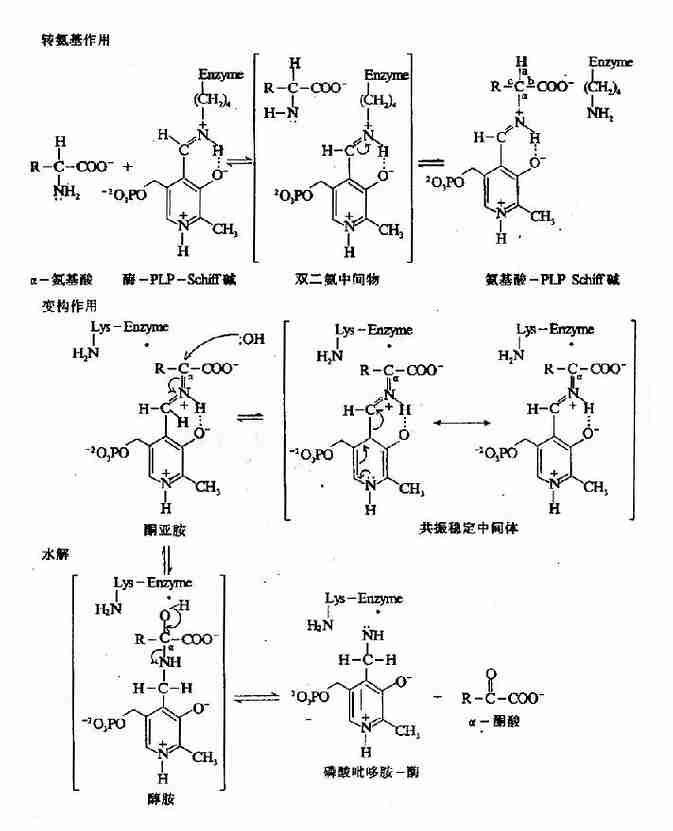
图7-3 PLP依赖的酶促转氨基反应机理
第一阶段:氨基酸转变为酮酸
(1)氨基酸的亲核性NH2基团作用于酶PLp Schiff碱C原子,通过转亚氨基反应(transimination ortransSchiffigation)形成一种氨基酸PLp Schiff碱,同时使酶分子中赖氨酸的NH2基团复原。
(2)通过酶活性位点赖氨酸催化去除氨基酸α氢,并通过一共振稳定的中间产物在PLP第4位C原子上加质子,将氨基酸桺Lp Schiff碱分子重排为一个α酮酸PMP schiff碱。
(3)水解生成PMP和α-酮酸。
第二阶段:α-酮酸转变为氨基酸
为完成转氨反应循环,辅酶必需由PMP形式转变为E-PLp-Schiff形式,此过程亦包括三步,为上述反应的逆过程。
(1)PMP与一个α-酮酸作用形成α-酮酸-Schiff碱。
(2)分子重排,α-酮酸-PMp-Schiff碱变为氨基酸-PLP-Schiff碱。
(3)酶活性位点赖氨酸ω-NH2基团攻击氨基酸-PLp-Schiff碱,通过转亚氨基生成有活性的酶-PLP Schiff碱,并释放出形成的新氨基酸。
转氨基反应中,辅酶在PLP和PMP间转换,在反应中起着氨基载体的作用,氨基在α-酮酸和α-氨基酸之间转移。可见在转氨基反应中并无净NH3的生成。
3.转氨基作用的生理意义
转氨基作用起着十分重要的作用。通过转氨作用可以调节体内非必需氨基酸的种类和数量,以满足体内蛋白质合成时对非必需氨基酸的需求。
转氨基作用还是联合脱氨基作用的重要组成部分,从而加速了体内氨的转变和运输,勾通了机体的糖代谢、脂代谢和氨基酸代谢的互相联系。
(三)联合脱氨基作用
联合脱氨基作用是体内主要的脱氨方式。主要有两种反应途径:
1.由L-谷氨酸脱氢酶和转氨酶联合催化的联合脱氨基作用:先在转氨酶催化下,将某种氨基酸的α-氨基转移到α-酮戊二酸上生成谷氨酸,然后,在L-谷氨酸脱氢酶作用下将谷氨酸氧化脱氨生成α-酮戊二酸,而α-酮戊二酸再继续参加转氨基作用。
L-谷氨酸脱氢酶主要分布于肝、肾、脑等组织中,而α-酮戊二酸参加的转氨基作用普遍存在于各组织中,所以此种联合脱氨主要在肝、肾、脑等组织中进行。联合脱氨反应是可逆的,因此也可称为联合加氨。
2.嘌呤核苷酸循环(purine nucleotide cycle):骨骼肌和心肌组织中L谷氨酸脱氢酶的活性很低,因而不能通过上述形式的联合脱氨反应脱氨。但骨骼肌和心肌中含丰富的腺苷酸脱氨酶(adenylatedeaminase),能催化腺苷酸加水、脱氨生成次黄嘌呤核苷酸(IMP)。
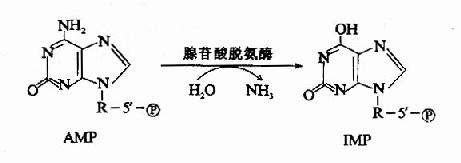
一种氨基酸经过两次转氨作用可将α-氨基转移至草酰乙酸生成门冬氨酸。门冬氨酸又可将此氨基转移到次黄嘌呤核苷酸上生成腺嘌呤核苷酸(通过中间化合物腺苷酸代琥珀酸)。其脱氨过程可用图7-4表示。
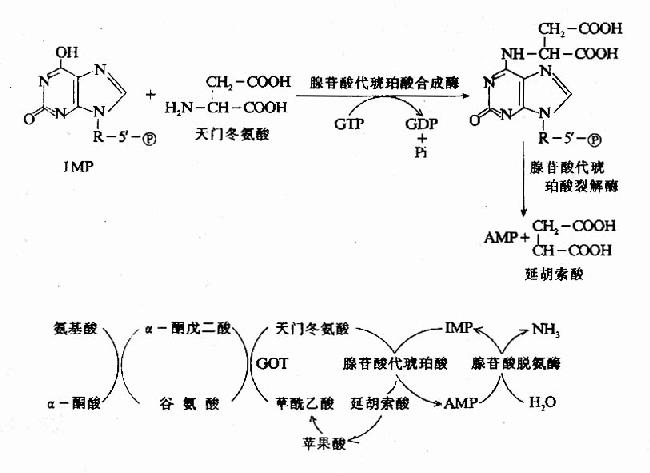
图7-4 腺嘌呤核苷酸循环
目前认为嘌呤核苷酸循环是骨骼肌和心肌中氨基酸脱氨的主要方式。John lowenstein证明此嘌呤核苷酸循环在肌肉组织代谢中具有重要作用。肌肉活动增加时需要三羧酸循环增强以供能。而此过程需三羧酸循环中间产物增加,肌肉组织中缺乏能催化这种补偿反应的酶。肌肉组织则依赖此嘌呤核苷酸循环补充中间产物-草酰乙酸。研究表明肌肉组织中催化嘌呤核苷酸循环反应的三种酶的活性均比其它组织中高几倍。AMP脱氨酶遗传缺陷患者(肌腺嘌呤脱氨酶缺乏症)易疲劳,而且运运后常出现痛性痉挛。
这种形式的联合脱氨是不可逆的,因而不能通过其逆过程合成非必需氨基酸。这一代谢途径不仅把氨基酸代谢与糖代谢、脂代谢联系起来,而且也把氨基酸代谢与核苷酸代谢联系起来。
(四)非氧化脱氨基作用(nonoxidativedeamination)
某些氨基酸还可以通过非氧化脱氨基作用将氨基脱掉。
1.脱水脱氨基 如丝氨酸可在丝氨酸脱水酶的催化下生成氨和丙酮酸。
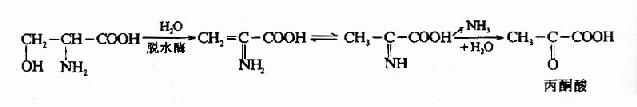
苏氨酸在苏氨酸脱水酶的作用下,生成α-酮丁酸,再经丙酰辅酶A,琥珀酰AoC参加代谢,如下图所示。
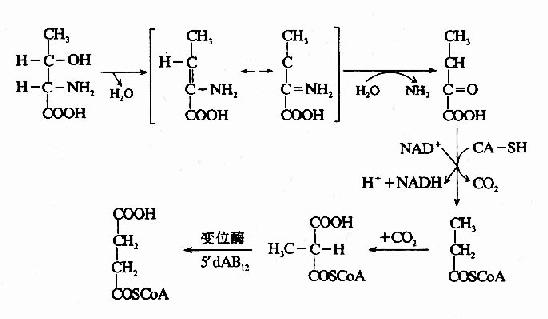
这是苏氨酸在体内分解的途径之一。
2.脱硫化氢脱氨基 半胱氨酸可在脱硫化氢酶的催化下生成丙酮酸和氨。
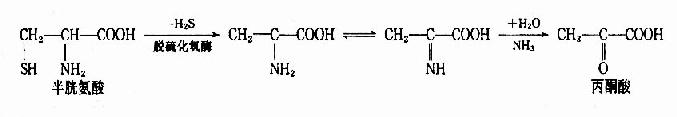
3.直接脱氨基 天冬氨酸可在天冬氨酸酶作用下直接脱氨生成延胡索酸和氨。

二、氨的代谢
(一)氨的来源
1.组织中氨基酸分解生成的氨 组织中的氨基酸经过联合脱氨作用脱氨或经其它方式脱氨,这是组织中氨的主要来源。组织中氨基酸经脱羧基反应生成胺,再经单胺氧化酶或二胺氧化酶作用生成游离氨和相应的醛,这是组织中氨的次要来源,组织中氨基酸分解生成的氨是体内氨的主要来源。膳食中蛋白质过多时,这一部分氨的生成量也增多。
2.肾脏来源的氨 血液中的谷氨酰胺流经肾脏时,可被肾小管上皮细胞中的谷氨酰胺酶(glutaminase)分解生成谷氨酸和NH3。
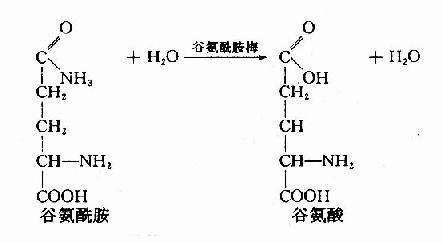
这一部分NH3约占肾脏产氨量的60%。其它各种氨基酸在肾小管上皮细胞中分解也产生氨,约占肾脏产氨量的40%。
肾小管上皮细胞中的氨有两条去路:排入原尿中,随尿液排出体外;或者被重吸收入血成为血氨。氨容易透过生物膜,而NH+4不易透过生物膜。所以肾脏产氨的去路决定于血液与原尿的相对pH值。血液的pH值是恒定的,因此实际上决定于原尿的pH值。原尿pH值偏酸时,排入原尿中的NH3与H+结合成为NH+4,随尿排出体外。若原尿的pH值较高,则NH3易被重吸收入血。临床上血氨增高的病人使用利尿剂时,应注意这一点。
3.肠道来源的氨 这是血氨的主要来源。正常情况下肝脏合成的尿素有15?0%经肠粘膜分泌入肠腔。肠道细菌有尿素酶,可将尿素水解成为CO2和NH3,这一部分氨约占肠道产氨总量的90%(成人每日约为4克)。肠道中的氨可被吸收入血,其中3/4的吸收部位在结肠,其余部分在空肠和回肠。氨入血后可经门脉入肝,重新合成尿素。这个过程称为尿素的肠肝循环(enterohepatin circulation of urea)。
肠道中的一小部分氨来自腐败作用(putrescence)。这是指未被消化吸收的食物蛋白质或其水解产物氨基酸在肠道细菌作用下分解的过程。腐败作用的产物有胺、氨、酚、吲哚、H2S等对人体有害的物质,也能产生对人体有益的物质,如脂肪酸、维生素K、生物素等。
肠道中NH3重吸收入血的程度决定于肠道内容物的pH值,肠道内pH值低于6时,肠道内氨生成NH+4,随粪便排出体外;肠道内pH值高于6时,肠道内氨吸收入血。临床上给高血氨病人作灌肠治疗时,禁忌使用肥皂水等,以免加重病情。
(二)氨的去路
氨是有毒的物质,人体必须及时将氨转变成无毒或毒性小的物质,然后排出体外。主要去路是在肝脏合成尿素、随尿排出;一部分氨可以合成谷氨酰胺和门冬酰胺,也可合成其它非必需氨基酸;少量的氨可直接经尿排出体外。尿中排氨有利于排酸。
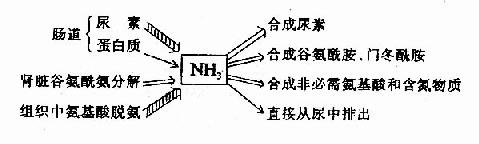
图7-5 氨的来源和去路
(三)氨的转运
1.葡萄糖-丙氨酸循环:肌肉组织中以丙酮酸作为转移的氨基受体,生成丙酸经血液运输到肝脏。在肝脏中,经转氨基作用生成丙酮酸,可经糖异生作用生成葡萄糖,葡萄糖由血液运输到肌肉组织中,分解代谢再产生丙酮酸,后者再接受氨基生成丙氨酸。这一循环途径称为“丙氨酸椘咸烟茄贰?alanineglucose cycle)。通过此途径,肌肉氨基酸的NH2基,运输到脏脏以NH3或天冬氨酸合成尿素。(图7-6)
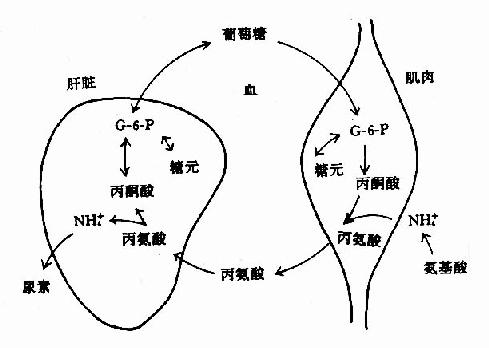
图7-6 葡萄糖丙氨酸循环
饥饿时通过此循环将肌肉组织中氨基酸分解生成的氨及葡萄糖的不完全分解产物丙酮酸,以无毒性的丙氨酸形式转运到肝脏作为糖异生的原料。肝脏异性生成的葡萄糖可被肌肉或其它外周组织利用。
2.氨与谷氨酸在谷氨酰胺合成酶(glutamine synthetase)的催化下生成谷氨酰胺(glutamine),并由血液运输至肝或肾,再经谷氨酰酶(glutaminaes)水解成谷氨酸和氨。谷氨酰胺主要从脑、肌肉等组织向肝或肾运氨。
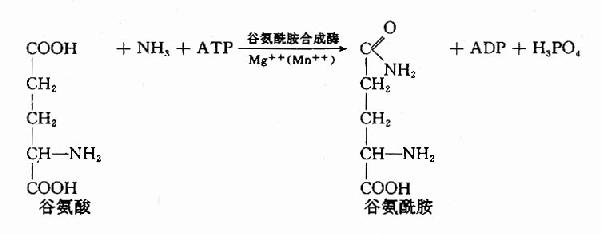
(四)尿素合成
根据动物实验,人们很早就确定了肝脏是尿素合成的主要器官,肾脏是尿素排泄的主要器官。1932年Krebs等人利用大鼠肝切片作体外实验,发现在供能的条件下,可由CO2和氨合成尿素。若在反应体系中加入少量的精氨酸、鸟氨酸或瓜氨酸可加速尿素的合成,而这种氨基酸的含量并不减少。为此,Krebs等人提出了鸟氨酸循环(ornithine cyclc)学说。其后由Ratner和Cohen详细论述了其各步反应。鸟氨酸循环可概括为:
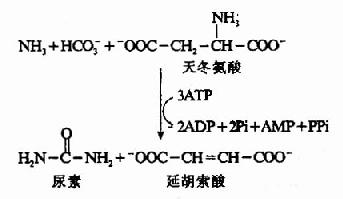
尿素中的两个N原子分别由氨和天冬氨酸提供,而C原子来自HCO-3,五步酶促反应,二步在线粒体中,三步在胞液中进行。其详细过程可分为以下五步:
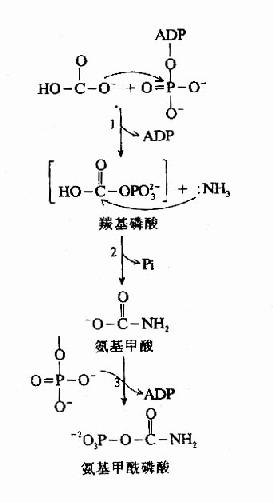
图7-7 CPSⅠ 作用机理
1.氨基甲酰磷酸的合成
氨基甲酰磷酸(carbamylphosphate)是在Mg++、ATP及N乙酰谷氨酸(Nacetyl glutamic acid,AGA)存在的情况下,由氨基甲酰磷酸合成酶I(carbamyl phosphate synthetaseI, CPSI)催化NH3和HCO-3在肝细胞线粒体中合成。
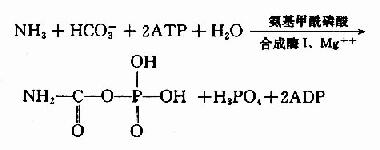
真核细胞中有两种CPS:(1)线粒体CPS-Ⅰ利用游离NH3为氮源合成氨基甲酰磷酸,参与尿素合成。(2)胞液CPS-Ⅱ,利用谷氨酰胺作N源,参与嘧啶的从头合成。
CPS-Ⅰ催化的反应包括下述三步(图7-7)。
(1)ATP活化HCO-3生成ADP和羰基硫酸(carbonyl phosphate)
(2)NH2与羰基硫酸作用替代硫酸根,生成氨基甲酸(carbamate)和Pi。
(3)第2个ATP对氨甲酸磷酸化,生成氨基甲酰磷酸和ADP。
此反应是不可逆的,消耗2分子ATP。CPS1是一种变构酶,AGA是此酶变构激活剂。由乙酰CoA和谷氨酸缩合而成。
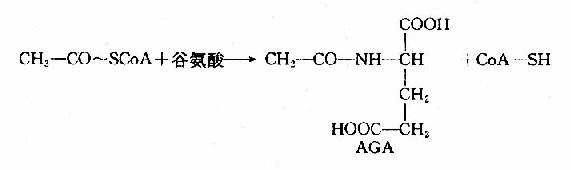
肝细胞线粒体中谷氨酸脱氢酶和氨基甲酰磷酸合成酶I催化的反应是紧密偶联的。谷氨酸脱氢酶催化谷氨酸氧化脱氨,生成的产物有NH3和NADH+H+。NADH经NADH氧化呼吸链传递氧化生成H2O,释放出来的能量用于ADP磷酸化生成ATP。因此谷氨酸脱氢酶催化反应不仅为氨基甲酰磷酸的合成提供了底物NH3,同时也提供了该反应所需要的能量ATP。氨基甲酰磷酸合成酶I将有毒的氨转变成氨基甲酰磷酸,反应中生成的ADP又是谷氨酸脱氢酶的变构激活剂,促进谷氨酸进一步氧化脱氨。这种紧密偶联有利于迅速将氨固定在肝细胞线粒体内,防止氨逸出线粒体进入细胞浆,进而透过细胞膜进入血液,引起血氨升高。
2.瓜氨酸(citrulline)的生成:
乌氨酸氨基甲酰转移酶(ornithinetranscarbamoylase)存在于线粒体中,通常与CPS-I形成酶的复合物催化氨基甲酰磷酸转甲酰基给鸟氨酸生成瓜氨酸。(注意:鸟氨酸,瓜氨酸均非标准α-氨基酸,不出现在蛋白质中)。此反应在线粒体内进行,而鸟氨酸在胞液中生成,所以必需通过一特异的穿棱系统进入线粒体内。
3.精氨酸代琥珀酸(Argininosuccinate)的合成。
瓜氨酸穿过线粒体膜进入胞浆中,在胞浆中由精氨酸代琥珀酸合成酶(Argininosuccinate Synthetase)催化瓜氨酸的脲基与天冬氨酸的氨基缩合生成精氨酸代琥珀酸,获得尿素分子中的第二个氮原子。此反应由ATP供能。
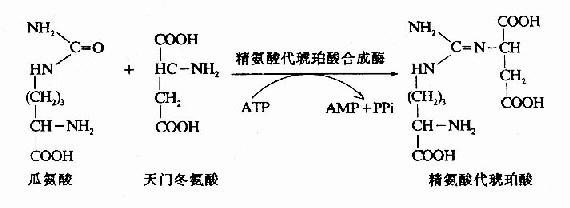
4.精氨酸(Arginine)的生成
精氨酸代琥珀酸裂解酶(Argininosuccinase)催化精氨酸代琥珀酸裂解成精氨酸和延胡索酸
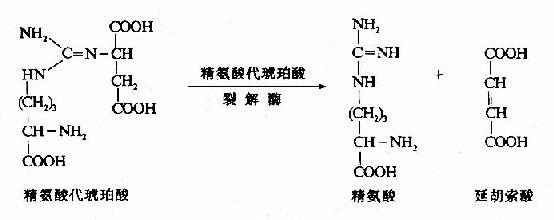
上述反应中生成的延胡索酸可经三羧酸循环的中间步骤生成草酰乙酸,再经谷草转氨酶催化转氨作用重新生成天冬氨酸。由此,通过延胡索酸和天冬氨酸,使三羧酸循环与尿素循环联系起来。
5.尿素的生成
尿素循环的最后一步反应是由精氨酸酶(arginase)催化精氨酸水解生成尿素并再生鸟氨酸,鸟氨酸再进入线粒体参与另一轮循环。
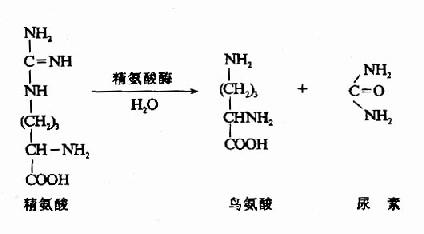
尿素合成是一个耗能的过程,合成1分子尿素需要消耗4个高能磷酸键。(3个ATP水解生成2个ADP,2个Pi,1个AMP和PPi)。从尿素循环底物水平上,能量的消耗大于恢复。由L-谷氨酸脱氢酶催化脱氨和延胡索酸经草酰乙酸再生成天冬氨酸反应中均有NADH的生成。经线粒体再氧化可生成6个ATP(图7-8)。
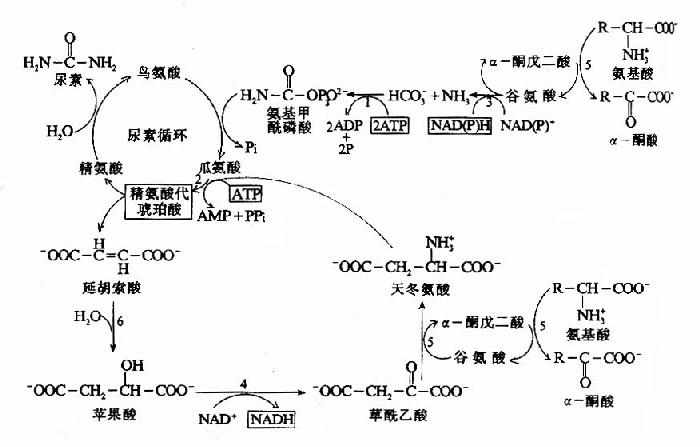
图7-8 尿素循环的能量代谢
6.尿素循环的调节
CPS-I是线粒体内变构酶,其变构激活剂AGA由N乙酰谷氨酸合成酶催化生成,并由特异水解酶水解。肝脏生成尿素的速度与AGA浓度相关。当氨基酸分解旺盛时,由转氨作用引起谷氨酸浓度升高,增加AGA的合成,从而激活CPS-I,加速氨基甲酰磷酸合成,推动尿素循环。精氨酸是AGA合成酶的激活剂,因此,临床利用精氨酸治疗高氨血症。
(五)高氨血症和氨中毒
正常生理情况下,血氨处于较低水平。尿素循环是维持血氨低浓度的关键。当肝功能严重损伤时,尿素循环发生障碍,血氨浓度升高,称为高氨血症。氨中毒机制尚不清楚。一般认为,氨进入脑组织,可与α酮戊二酸结合成谷氨酸,谷氨酸又与氨进一步结合生成谷氨酰胺,从而使α酮戊二酸和谷氨酸减少,导致三羧酸循环减弱,从而使脑组织中ATP生成减少。谷氨酸本身为神经递质,且是另一种神经递质γ-氨基丁酸(γ-aminobutyrate,GABA)的前体,其减少亦会影响大脑的正常生理功能,严重时可出现昏迷。
二、α-酮酸的代谢
氨基酸经联合脱氨或其它方式脱氨所生成的α-酮酸有下述去路。
1.生成非必需氨基酸-α-酮酸经联合加氨反应可生成相应的氨基酸。八种必需氨基酸中,除赖氨酸和苏氨酸外其余六种亦可由相应的α-酮酸加氨生成。但和必需氨基酸相对应的α-酮酸不能在体内合成,所以必需氨基酸依赖于食物供应。
2.氧化生成CO2和水这是α-酮酸的重要去路之一。由图7?可以看出α-酮酸通过一定的反应途径先转变成丙酮酸、乙酰CoA、或三羧酸循环的中间产物,再经过三羧酸循环彻底氧化分解。三羧酸循环将氨基酸代谢与糖代谢、脂肪代谢紧密联系起来。
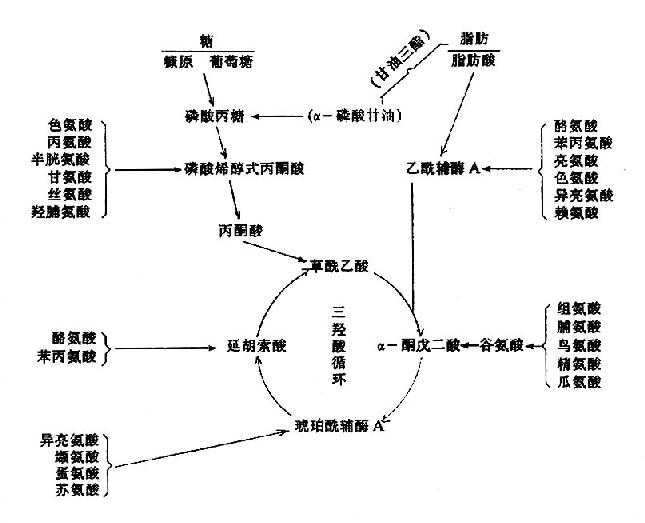
图7-9 氨基酸与糖、脂肪的关系
3.转变生成糖和酮体 使用四氧嘧啶(alloxan)破坏犬的胰岛β-细胞,建立人工糖尿病犬的模型。待其体内糖原和脂肪耗尽后,用某种氨基酸饲养,并检查犬尿中糖与酮体的含量。若饲某种氨基酸后尿中排出葡萄糖增多,称此氨基酸为称生糖氨基酸(glucogenic amino acid);若尿中酮体含量增多,则称为生酮氨基酸(ketogenicamino acid)。尿中二者都增多者称为生糖兼生酮氨基酸(glucogenic and ketogenicamino acid)。从表7-1中可以看出,凡能生成丙酮酸或三羧酸循环的中间产物的氨基酸均为生糖氨基酸;凡能生成乙酰CoA或乙酰乙酸的氨基酸均为生酮氨基酸;凡能生成丙酮酸或三羧酸循环中间产物同时能生成乙酰CoA或乙酰乙酸者为生糖兼生酮氨基酸。
表7-1 氨基酸和糖、脂肪的共有中间代谢产物
| 氨基酸简称 | 共同中间代谢产物 | 生糖或生酮 |
| 天 | 草酰乙酸 | 生糖 |
| 丝、甘、丙、羟、脯、半胱、胱、 | 丙酮酸 | 生糖 |
| 苏 | 丙酮酸、琥珀酰辅酶A | 生糖 |
| 色 | 丙酮酸、乙酰乙酸 | 生糖兼生酮 |
| 谷、组、鸟、精、瓜、脯 | α-酮戊二酸 | 生糖 |
| 蛋、 缬 | 琥珀酰辅酶A | 生糖 |
| 异亮 | 琥珀酰辅酶A、乙酰辅酶A | 生糖兼生酮 |
| 酪、苯丙 | 乙酰乙酸、延胡索酸 | 生糖兼生酮 |
| 亮 | 乙酰乙酸 | 生酮 |
| 赖 | 乙酰辅酶A、α-酮戊二酸(?) | 生糖兼生酮 |
亮氨酸为生酮氨基酸,赖氨酸、异亮氨酸、色氨酸、苯丙氨酸和酪氨酸为生糖兼生酮氨基酸,其余氨基酸均为生糖氨基酸。
三、脱羧基作用
部分氨基酸可在氨基酸脱羧酶(decarboxylose)催化下进行脱羧基作用(decarboxylation),生成相应的胺,脱羧酶的辅酶为磷酸吡哆醛。
从量上讲,脱羧基作用不是体内氨基酸分解主要方式,但可生成有重要生理功能的胺。下面列举几种氨基酸脱羧产生的重要胺类物质。
1.γ-氨基丁酸(γ-aminobutyric acid GABA)
GABA由谷氨酸脱羧基生成,催化此反应的酶是谷氨酸脱羧酶。此酶在脑、肾组织中活性很高,所以脑中GABA含量较高。
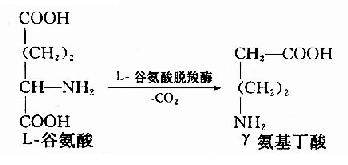
GABA是一种仅见于中枢神经系统的抑制性神经递质,对中枢神经元有普遍性抑制作用。在脊髓,作用于突触前神经末梢,减少兴奋性递质的释放,从而引起突触前抑制,在脑则引起突触后抑制。
GABA可在GABA转氨酶(GABA-T)作有下与α-酮戊二酸反应生成琥珀酸r-半醛(succinic acid semialdehyde),进而氧化生成琥珀酸。
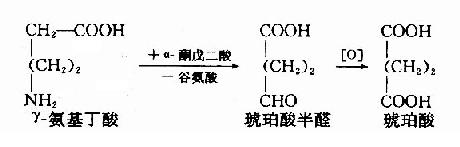
神经元胞体和突触的线粒体内含有大量的GABA转氨酶。由此就构成了GABA旁路(图7-10)。它能使α酮戊二酸经此旁路生成琥珀酸,活跃三羧酸循环,可为脑组织提供约20%的能量。谷氨酸具有兴奋作用,GABA有抑制作用,两者可共同调节神经系统的功能。临床上对于惊厥和妊娠呕吐的病人常常使用维生素B6治疗,其机理就在于提高脑组织内谷氨酸脱羧酶的活性,使GABA生成增多,增强中枢抑制作用。
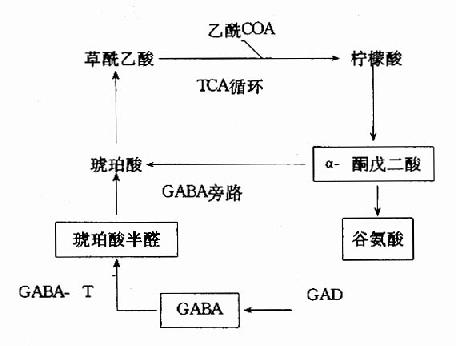
图7-10 脑中TCA循环和GAB代谢旁路
2.组胺(histamine)
由组氨酸脱羧生成。组胺主要由肥大细胞产生并贮存,在乳腺、肺、肝、肌肉及胃粘膜中含量较高。
组胺是一种强烈的血管舒张剂,并能增加毛细血管的通透性。可引起血压下降和局部水肿。组胺的释放与过敏反应症状密切相关。组胺可刺激胃蛋白酶和胃酸的分泌,所以常用它作胃分泌功能的研究。
3.5羟色胺(5hydroxytryptamine,5HT)
色氨酸在脑中首先由色氨酸羟化酶(tryoptophanhydroxylase)催化生成5羟色氨酸(5hydroxytryptophan),再经脱羧酶作用生成5羟色胺。
5-羟色胺在神经组织中有重要的功能,目前已肯定中枢神经系统有5-羟色胺能神经元。5-羟色胺可使大部分交感神经节前神经元兴奋,而使付交感节前神经元抑制。
其它组织如小肠、血小板、乳腺细胞中也有5-羟色胺,具有强烈的血管收缩作用。
4.牛磺酸(taurine)
体内牛磺酸主要由半胱氨酸脱羧生成。半胱氨酸先氧化生成磺酸丙氨酸,再由磺酸丙氨酸脱羧酶催化脱去羧基,生成牛磺酸。牛磺酸是结合胆汁酸的重要组成分。

5.多胺(palyamine)
鸟氨酸在鸟氨酸脱羧酶催化下可生成腐胺(putrescine),S-腺苷蛋氨酸(S-adenosyl methionine SAM)在SAM脱羧酶催化脱羧生成S-腺苷-3-甲硫基丙胺。在精脒合成酶(spormidinesynthetase)催化下将S-腺苷-3-甲硫基丙胺的丙基移到腐胺分子上合成精脒(cpermidine),再在精胺合成酶(spermine symthetase)催化下,再将另一分子S-腺苷-3-甲硫基丙胺的丙胺基转移到精脒分子上,最终合成了精胺(sperrmine)。腐胺、精脒和精胺总称为多胺或聚胺polyamine)(图7-11)。
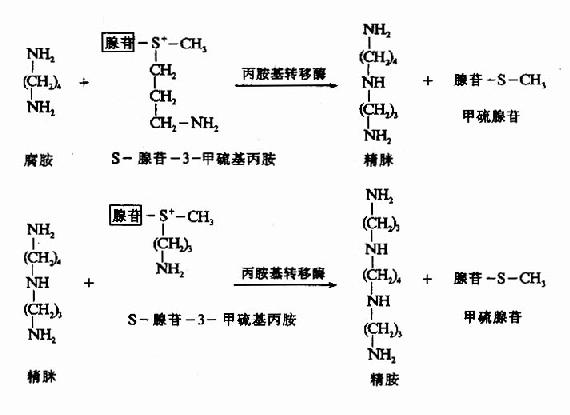
图7-11 多胺的生成
多胺存在于精液及细胞核糖体中,是调节细胞生长的重要物质,多胺分子带有较多正电荷,能与带负电荷的DNA及RNA结合,稳定其结构,促进核酸及蛋白质合成的某些环节。在生长旺盛的组织如胚胎、再生肝及癌组织中,多胺含量升高。所以可将利用血或尿中多胺含量作为肿瘤诊断的辅助指标。
第二节 个别氨基酸代谢
一、一碳单位代谢
某些氨基酸在代谢过程中能生成含一个碳原子的基团,经过转移参与生物合成过程。这些含一个碳原子的基团称为一碳单位(C1unit或one carbon unit)。有关一碳单位生成和转移的代谢称为一碳单位代谢。
体内的一碳单位有:甲基(-CH3,methyl)、甲烯基(-CH2,methylene),甲炔基(-CH=,methenyl)、甲酰基(-CHO,formyl)及亚氨甲基(-CH=NH,formimino)等。它们可分别来自甘氨酸、组氨酸、丝氨酸、色氨酸、蛋氨酸等(图7-12)。
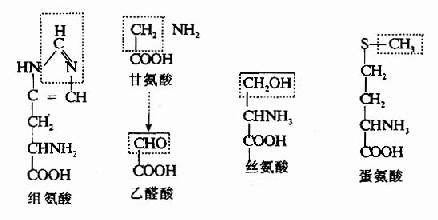
图7-12 一碳单位的来源
(一)一碳单位代酸的辅酶
一碳单位不能游离存在,通常与四氢叶酸(Tetrahydrofolic acid,FH4)结合而转运或参加生物代谢,FH4是一碳单位代谢的辅酶。
四氢叶酸由叶酸(folicacid)衍生而来。叶酸需经二次还原方可转变为活性辅酶形式-FH4(图7-13)。两次还原均由二氢叶酸还原酶(dihyclrofolatereductase)所催化。
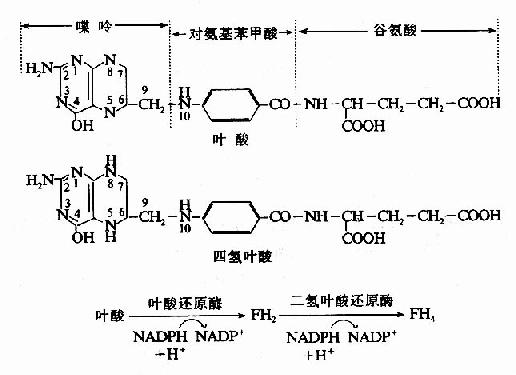
图7-13 四氢叶酸的生成
一碳单位共价连接于FH4分子的N5、N10位或N5和N10位上。
(二)一碳单位的来源及转换
一碳单位主要来源于丝氨酸,在丝氨酸羟甲基转移酶催化为甘氨酸过程中产生的N5,N10甲烯FH4;甘氨酸在甘氨酸合成酶(glycine synthase)催化下可分解为CO2,NH+4和N5,N10桟H2桭H4。此外,苏氨酸和丝氨酸都可经相应酶催化转变为丝氨酸。因此亦可产生N5、N10桟H2桭H4。
在组氨酸转变为谷氨酸过程中由亚胺甲基谷氨酸提供了N5桟H=NHFH4。
色氨酸分解代谢能产生甲酸,甲酸可与FH4结合产生N10桟HO桭H4。
体内一碳单位分别处于甲酸、甲醛不同的氧化水平,在相应的酶促氧化还原反应下可相互转换(图7-14)。这些反应中,N5-CH3-FH4的生成基本是不可逆的。N5-CH3桭H4可将甲基转移给同型半胱氨酸生成蛋氨酸和FH4。催化此反应的酶是N5-CH3FH4同型半胱氨酸甲基转移酶,辅酶为甲基B12。此反应不可逆,故N5-CH3FH4不能自蛋氨酸生成。
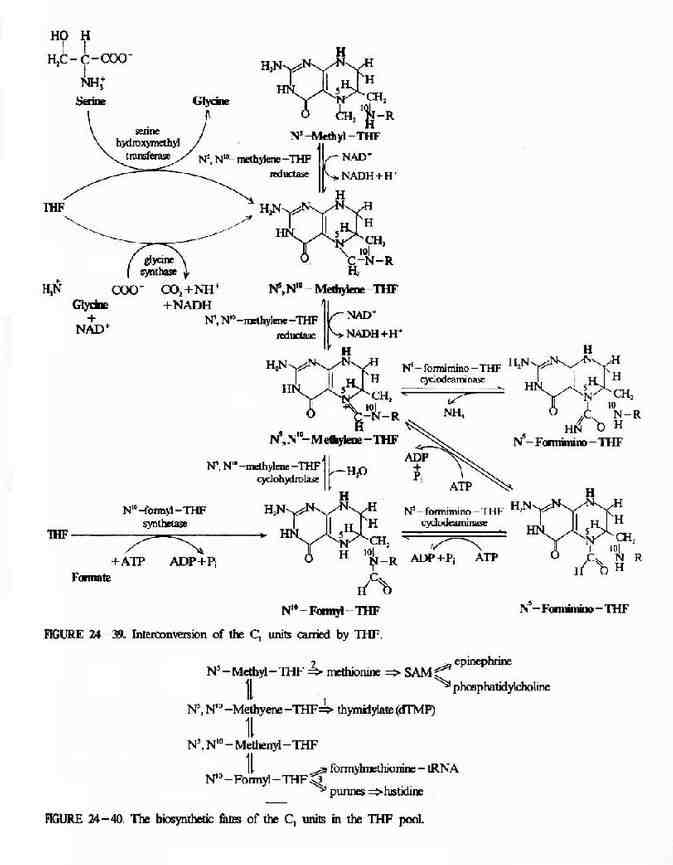
图7-14 一碳单位的相互转化
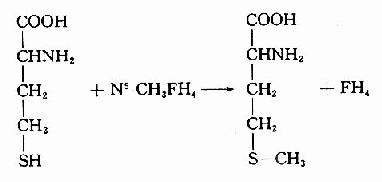
蛋氨酸分子中的甲基也是一碳单位。在ATP的参与下蛋氨酸转变生成S-腺苷蛋氨酸(Sadenosylmethionine,又称活性蛋氨酸)。S腺苷蛋氨酸是活泼的甲基供体。因此四氢叶酸并不是一碳单位的唯一载体。
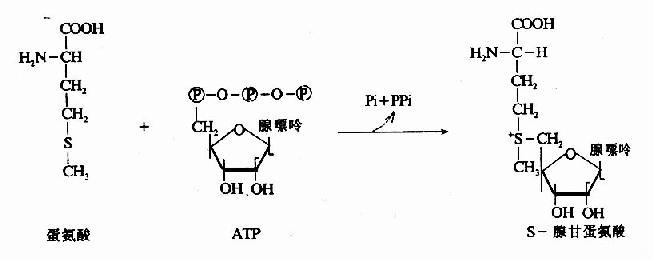
(三)一碳单位的功能
1.一碳单位是合成嘌呤和嘧啶的原料,在核酸生物合成中有重要作用。如N5-N10-CH=FH4直接提供甲基用子脱氧核苷酸dUMP向dTMP的转化。N10-CHO-FH4和N5N10-CH=FH4分别参与嘌呤碱中C2,C3原子的生成。
2.SAM提供甲基可参与体内多种物质合成。例如肾上腺素、胆碱、胆酸等。
一碳单位代谢将氨基酸代谢与核苷酸及一些重要物质的生物合成联系起来。一碳单位代谢的障碍可造成某些病理情况,如巨幼红细胞贫血等。磺胺药及某抗癌药(氨甲喋呤等)正是分别通过干扰细菌及瘤细胞的叶酸、四氢叶酸合成,进而影响核酸合成而发挥药理作用的。
二、含硫氨基酸的代谢
含硫氨基酸共有蛋氨酸、半胱氨酸和胱氨酸三种,蛋氨酸可转变为半胱氨酸和胱氨酸,后两者也可以互变,但后者不能变成蛋氨酸,所以蛋氨酸是必需氨基酸。
(一)蛋氨酸代谢
1.转甲基作用与蛋氨酸循环 蛋氨酸中含有S甲基,可参与多种转甲基的反应生成多种含甲基的生理活性物质。在腺苷转移酶催化下与ATP反应生成S-腺苷蛋氨酸(S-adenosglmethiomine,SAM)。SAM中的甲基是高度活化的,称活性甲基,SAM称为活性蛋氨酸。
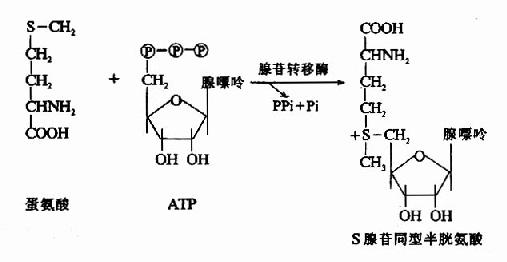
SAM可在不同甲基转移酶(methyl transferase)的催化下,将甲基转移给各种甲接受体而形成许多甲基化合物,如肾上腺素、胆碱、甜菜碱、肉毒碱、肌酸等都是从SAM中获得甲基的。SAM是体内最主要的甲基供体。
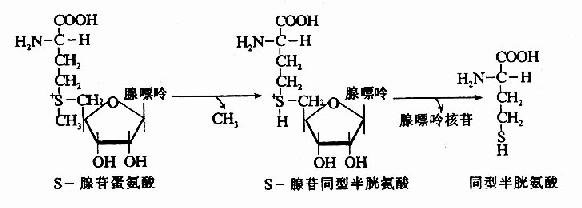
SAM转出甲基后形成S腺苷同型半胱氨酸Sadenosylhomocystine,SAH),SAH水解释出腺苷变为同型半胱氨酸(homocystine,hCys)。同型半胱氨酸可以接受N5桟H3桯F4提供的甲基再生成蛋氨酸,形成一个循环过程,称为蛋氨酸循环(methionine cycle)。此循环的生理意义在于蛋氨酸分子中甲基可间接通过N5桟H3桭H4由其它非必需氨基酸提供,以防蛋氨酸的大量消耗(图7-15)。
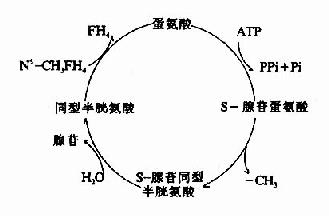
图7-15 S-腺苷蛋氨酸循环
N5-CH3FH4同型半胱氨酸甲基转移酶的辅酶是甲基B12。维生素B12缺乏会引起蛋氨酸循环受阻。临床上可以见到维生素B12缺乏引起的巨幼细胞性贫血。1962年Noronha与Silverman首先提出了甲基陷阱学说(methyl-trap hypothesis),后来Herbert与Zaulsky又作了修改。这个学说认为:由于维生素B12缺乏,引起甲基B12缺乏,使甲基转移酶活性低下,甲基转移反应受阻导致叶酸以N5-CH3FH4形式在体内堆积。这样,其它形式的叶酸大量消耗,以这些叶酸作辅酶的酶活力降低,影响了嘌呤碱和胸腺嘧啶的合成,因而影响核酸的合成,引起巨幼细胞性贫血。也就是说,维生素B12对核酸合成的影响是间接地通过影响叶酸代谢而实现的。
虽蛋氨酸循环可生成蛋氨酸,但体内不能合成同型半胱氨酸,只能由蛋氨酸转变而来,所以体内实际上不能合成蛋氨酸,必须由食物供给。
同型半胱氨酸还可在胱硫醚合成酶(cystathiorinesynthase)催化下与丝氨酸缩合生成胱硫醚(cystathionine),再经胱硫醚酶催化水解生成半胱氨酸,α-酮丁酸和氨。α-酮丁酸转变为琥珀酸单酰CoA,通过三羧酸循环,可以生成葡萄糖、所以蛋氨酸为生糖氨基酸。
2.肌酸的合成 肌酸(creatine)和磷酸肌酸(creatinephosphate)在能量储存及利用中起重要作用。二者互变使体内ATP供应具有后备潜力。肌酸在肝和肾中合成,广泛分布于骨骼肌、心肌、大脑等组织中。肌酸以甘氨酸为骨架,精氨酸提供脒基、SAM供给甲基、在脒基转移酶和甲基转移酶的催化下合成。在肌酸激酶(creatinephosphohinase,CPK)催化下将ATP中桺转移到肌酸分子中形成磷酸肌酸(CP)储备起来(图7-16)。
图7-16 肌酸的代谢
CPK由两种亚基组成;即M亚基(肌型)与B亚基(脑型)。有三种同工酶;即MM型(在骨骼肌中)BB型在脑中)和MB型(在心肌中)。心肌梗塞时,血中MB型CPK活性增高,可作辅助诊断的指标之一。
肌酸和磷酸肌酸代谢的终产物是肌酸酐(creatinine)简称肌酐。正常成人,每日尿中肌酐量恒定。肾功能障碍时,检查血或尿中肌酐含量以帮助诊断。
(二)半胱氨酸和胱氨酸的代谢
1.半胱氨酸和胱氨酸的互变 半胱氨酸含巯基(-SH),胱氨酸含有二硫键(S-S-),二者可通过氧化还原而互变。胱氨酸不参与蛋白质的合成,蛋白质中的胱氨酸由半胱氨酸残基氧化脱氢而来。在蛋白质分子中两个半胱氨酸残基间所形成的二硫键对维持蛋白质分子构象起重要作用。而蛋白分子中半胱氨酸的巯基是许多蛋白质或酶的活性基团。
2.半胱氨酸分解代谢 人体中半胱氨酸主要通过两条途径降解为丙酮酸。一是加双氧酶催化的直接氧化途径,或称半胱亚磺酸途径,另一是通过转氨的3-巯基丙酮酸途径。
3.活性硫酸根代谢 含硫氨基酸经分解代谢可生成H2S,H2S氧化成为硫酸。半胱氨酸巯基亦可先氧化生成亚磺基,然后再生成硫酸。其中一部分以无机盐形式从尿中排出,一部分经活化生成3′磷酸腺苷-5'-磷酸硫酸(3'-phosphoadenosine5'-phosphosulfate,PAPS),即活性硫酸根。
PAPS的性质活泼,在肝脏的生物转化中有重要作用。例如类固醇激素可与PAPS结合成硫酸酯而被灭活,一些外源性酚类亦可形成硫酸酯而增加其溶解性以利于从尿于排出。此外,PAPS也可参与硫酸角质素及硫酸软骨素等分子中硫酸化氨基多糖的合成。
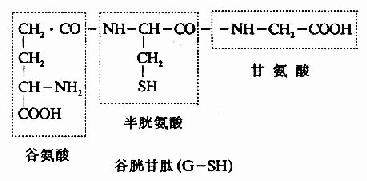
4.谷胱甘肽的合成 谷胱甘肽(glutathiose,rglutamylcysteinglglycine,GSH)是一种含γ-酰胺键的三肽,由谷氨酸、半胱氨酸及甘氨酸组成。GSH的合成通过γ-谷氨酰基循环(γ-glutamyl cycle),由Meister提出,又称为Meister循环(图7-17)。γ-谷氨酰基循环有双重作用,一是GSH的再合成,二是通过GSH的合成与分解将外源氨基酸主动转运到细胞内。
图7-17 γ-谷氨酰基循环
GSH的合成由γ-谷氨酰半胱氨酸合成酶(γ-glutamylcysteinsynthetase)和GSH合成酶(GSHsynthetase)所催化。由ATP水解供能。GSH的分解中γ-谷氨酰转肽酶(γ-glutamyl transpeptidase)、γ-谷氨酰环转移酶(γ-gltamyl cyclotransforase)和5氧脯氨酸酶(5oxoprolinase)及一个细胞内肽酶(protease)所催化。
GSH在人体解毒、氨基酸转运及代谢中均有重要作用。GSH的活性基团是其半胱氨酸残基上的巯基,GSH有氧化型和还原型两种形式,可以互变。
谷胱甘胱还原酶催化上面反应,辅酶为NADPH,细胞中GSH与GSSG的比例为100:1。GSH可保护某些蛋白质及酶分子的巯基不被氧化,从而维持其生物活性。如红细胞中含有较多GSH,对保护红细胞膜完整性及促使高铁血红蛋白还原为血红蛋白均有重要作用。此外,体内产生的过氧化物及自由基,亦可通过含硒的GSH过氧化酶而被清除,如:
![]()
三、芳香族氨基酸的代谢
芳香族氨基酸包括苯丙氨酸,酪氨酸和色氨酸,苯丙氨酸和酪氨酸结构相似,在体内苯丙氨酸可转变成酪氨酶,所以合并在一起讨论。
(一)苯丙氨酸和酪氨酸
1.苯丙氨酸在体内一般先转变为酪氨酸。由苯丙氨酸羟化酶(phenylalamine hyolroxylase)催化引入羟基完成,其辅酶为四氢生物嘌呤。反应生成的二氢生物喋呤,由二氢叶酸还原酶催化,借助NADPH+H还原为四氢化合物(图7-18)。
图7-18 酪氨酸的生成
苯丙氨酸羟化酶所催化反应不可逆,体内酷氨酸不能转变为苯丙氨酸。
2.儿茶酚胺与黑色素的合成 酪氨酸经酪氨酸羟化酶(tyrosine hydroxylase)催化生成3,4二羟苯丙氨酸(3,4dihydroxyphenylalanineL-DOPA)(多巴)。此酶也是以四氢生物喋呤为辅酶的加单氧酶,多巴经多巴脱羧酶催化生成多巴胺(dopamine)。多巴胺在多巴胺β-氧化酶(dopamine βoxidase)催化下使β碳原子羟化,生成去甲肾上腺素(norepinephrine)。而后由SAM提供甲基使去甲肾上腺素甲基化生成肾上腺素(epinephrine)。多巴胺、去甲肾上腺素、肾上腺素统称为儿茶酚胺(catecholamine)。酪氨酸羟化酶是儿茶酚胺合成的限速酶,受终产物的反馈调节(图7-19)。
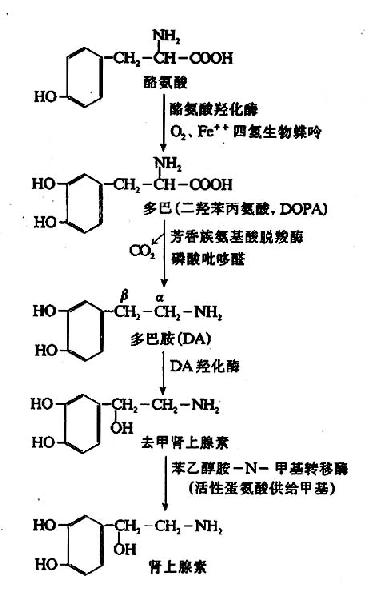
图7-19 儿茶酚胺的合成
在黑色素细胞中,酪氨酸在酪氨酸酶催化下羟化生成多巴,多巴再经氧化生成多巴醌而进入合成黑色素的途径。所形成的多巴醌进一步环化和脱羧生成吲哚醌。黑色素即是吲哚醌的聚合物。人体若缺乏酪氨酸酶,黑色素合成障碍,皮肤、毛发发“白”,称为白化病(albinism)(图7-20)。
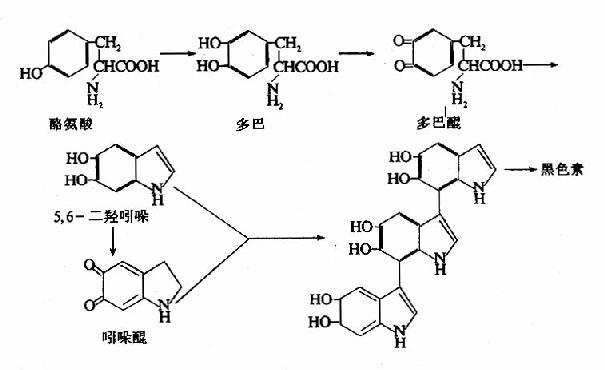
图7-20 黑色素的生成
3.酪氨酸是生糖兼生酮氨基酸 酪氨酸经转氨基作用生成对羟基苯丙酮酸,进一步分解则生成乙酰乙酸和延胡索酸,所以是生糖兼生酮氨基酸。
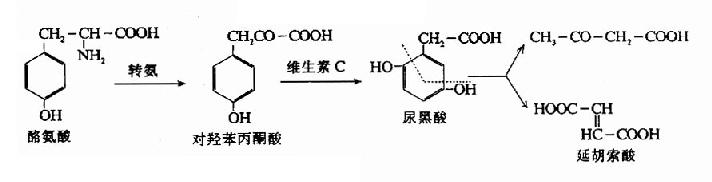
4.代谢障碍 已知在苯丙氨酸和酪氨酸代谢中,有许多代谢性疾患。最重要的是苯丙酮酸尿症(phenylketonuria,PKV),因缺乏苯丙氨酸羟化酶所致。苯丙氨酸不能正常地转变为酪氨酸,体内苯丙氨酸蓄积,并由转氨基作用生成苯丙酮酸(一部分还原为苯乙酸)并从尿液中排出。苯丙酮酸的堆积对中枢神经系统有毒性,故本病伴发智力发育障碍。早期发现时可控制饮食中苯丙氨酸含量,有利于智力发育。
另一代谢疾患为尿黑酸尿症(alkaptonuria)。酪氨酸在分解代谢中生成中间产物尿黑酸,如尿黑酸氧化酶缺乏,则尿黑酸裂环降解受阻,大量尿黑酸排入尿中,经空气氧化为相应的对醌,后者可聚合为黑的色素。此种代谢性疾患一般无严重后果。
此外,巴金森病(Parkinson′sdisease)是由于脑生成多巴胺的功能退化所致的一种严重的神经系统疾病。临床常用L多巴治疗,L-多巴本身不能通过血脑屏障无直接疗效,但在相应组织中脱羧可生成多巴胺达到治疗作用。目前,采用将大脑中植移肾上腺髓质,借此生成多巴胺以弥补脑中多巴胺不足,取得较好疗效。
(二)色氨酸的代谢
色氨酸是必需氨基酸。大多数蛋白质中含量均较少,机体对其摄取少,分解亦少。除参加蛋白质合成外,还可经氧化脱羧生成5羟色胺(前述)。并可降解产生生糖,生酮成分,此过程中产生一碳单位及尼克酸等。
1.色氨酸分解首先在色氨酸-2,3-加双氧酶(tryptophan-2,3-dioxygenase)作用下将吡酪环打开,生成N-甲酰犬尿氨酸(N-Formylkynurenine)。此酶辅基为铁卟啉,Vit C有保护辅基中Fe2+不被氧化的作用,亦可说Vit C是此酶的激活剂。在甲酰化酶(formamidase)的作用下,甲酰犬尿氨酸脱甲酰基生成甲酸和犬尿氨酸,甲酸可参加一碳单位代谢。而犬尿氨酸则有三个不同代谢方向。
(1)犬尿氨酸主要由犬尿氨酸羟化酶(Rynurenine-3-monoxygenase)催化生成3羟犬尿氨酸(3-hydroxykynurenine),而后由犬尿氨酸酶(kynureninase)(以PLP为辅酶)催化水解裂出丙氨酸,并生成了3-羟邻氨苯甲酸(3-hydroxyanthranilate),丙氨酸可经转氨生成丙酮酸,而3-羟邻苯甲酸经氧化裂环,脱羧等反应生成α酮乙酸,进而生成乙酰乙酸。因此,色氨酸为生糖兼生酮氨基酸。
(2)少量犬尿氨酸经转氨作用并缩合生成犬尿酸。
(3)少量裂解出丙氨酸后生成邻氨苯甲酸。
2.尼克酸的生成 色氨酸分解代谢中的3-羟邻氨苯甲酸经3-羟邻氨苯丙酸-3,4,-加双氧酶(3-hydroxyanthranilate-3,4-dioxygenase)催化裂环,可生成尼克酸,是构成NAD(P)+的关键成分。这是体内合成维生素的一个特例。
四、支链氨基酸的代谢
支链氨基酸(branchedamino acid,BCAA)包括亮氨酸、异亮氨酸和缬氨酸。三者均为必需氨基酸。分解代谢主要在肌肉组织中进行。它们分属于三类,亮氨酸为生酮氨基酸,缬氨酸为生糖氨基酸,异亮氨酸为生糖兼生酮氨基酸。
三种支链氨基酸分解代谢过程均较复杂,一般可分为二阶段。第一阶段,三种氨基酸前三步反应性质相同,产物类似。均为CoA的衍生物,可称为共同反应阶段。第二阶段则反应各异,经若干步反应,亮氨酸产生乙酰CoA及乙酰乙酰CoA,缬氨酸产生琥珀酸单酰CoA,异亮氨酸产生乙酰CoA及琥珀酸单酰CoA分别纳入生糖或生酮的代谢(图7-21)。
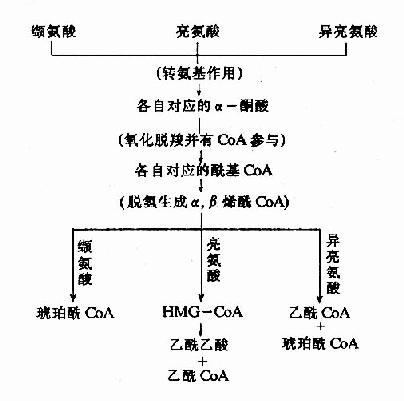
图7-21 支链氨基酸的分解代谢
第三节 氨基酸的生物合成
组成人体蛋白质的氨基酸中,有些氨基酸只能在植物及微生物体内合成,人体必须从食物中摄取,这些氨基酸即必需氨基酸(escential amino acids),其余的氨基酸可利用代谢中间产物合成,称为非必需氨基酸(nonescential amino acids)。(表7-2)除酪氨酸外,体内非必需氨基酸由四种共同代谢中间产物(丙酮酸、草酰乙酸、α-酮戊二酸及3-磷酸甘油)之一作其前体简单合成。如前所述,酪氨酸由苯丙氨酸必需氨基酸羟化生成,严格讲酪氨酸不是非必需氨基酸,对每日膳食中苯丙氨酸的需要量同时亦反映了对酪氨酸的需要量。
表7-2人体中必需和非必需氨基酸
| Essential | Nonessential |
| Arginine | Alanine |
| Histidine | Asparagine |
| Isoleucine | Aspartate |
| Leucine | Cysteine |
| Lysine | Glutamate |
| Methionine | Glutamine |
| Phenylalanine | Glycine |
| Threonine | Proline |
| Tryptophan | Serine |
| Valine | Tyrosine |
*Althoughmammals synthesize arginine,they cleave most of it to form urea(Sections 24-2Dand E).
1.丙氨酸,天冬酰胺、天冬氨酸、谷氨酸及谷氨酰胺由丙酮酸、草酰乙酸和α-酮戊二酸合,三种α-酮酸:丙酮酸、草酰乙酸和α-酮戊二酸分别为丙氨酸,天冬氨酸和谷氨酸的前体,经一步转氨反应可生成相应氨基酸(图7-22、反应1-3)。天冬酰胺和谷氨酰胺分别由天冬氨酸和谷胺酸加氨反应生成(图7-22反应4,5)。谷氨酰胺合成酶(glutamine cynthetase)催化谷氨酰胺合成,NH3为氨基供体、反应中消耗ATP生成ADP和Pi。而天冬酰胺由天冬酰胺合成酶(asparagine synthetase)催化合成,利用谷氨酰胺提供氨基、消耗ATP生成AMP+PPi。
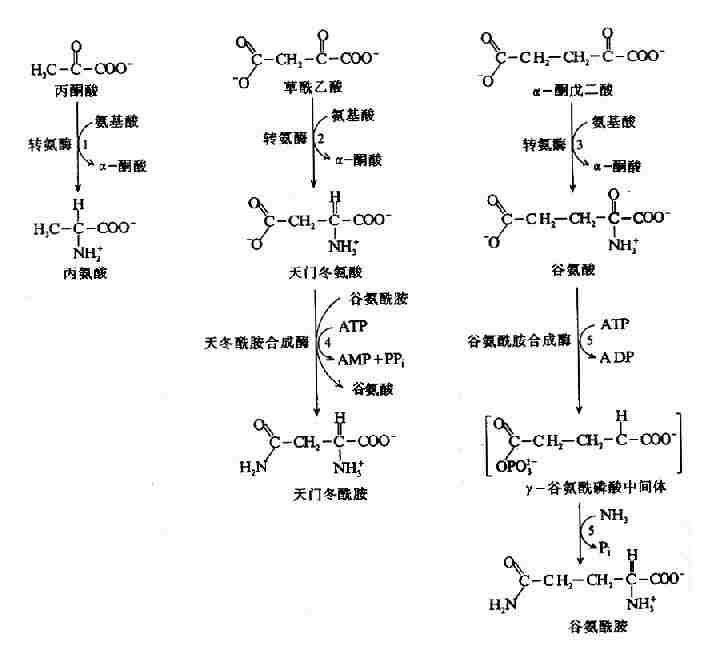
图7-22 氨酸、天冬氨酸、谷氨酸、天冬酰胺和谷氨酰胺的合成
谷氨酰胺是许多生物合成反应的氨基供体,同时也是体内NH2的贮存形式。谷氨酰胺合成酶位于体内氨代谢的中枢位置。实事上,此酶由α-酮戊二酸激活,此种调控作用有利于防止谷氨酸氧化脱氨造成体内氨的堆积。
2.谷氨酸是脯氨酸,鸟氨酸和精氨酸的前体。谷氨酸γ羧基还原生成醛,继而形成中间Schiff碱,进一步还原可生成脯氨酸(图7?3)。此过程中的中间产物5-谷氨酸半醛(glutamate-5-semialdehyde)在鸟氨酸-δ-氨基转移酶(ornithine-δ-amino-transferase)催化下直接转氨生成鸟氨酸。
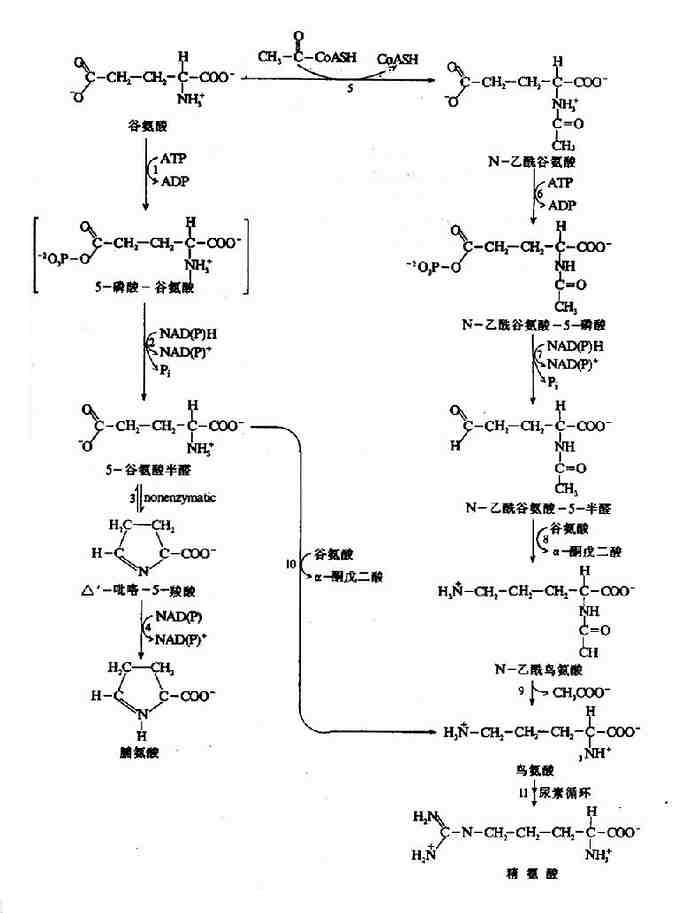
图7-23 由谷氨酸生成脯氨酸、鸟氨酸和精氨酸
3.丝氨酸、半胱氨酸和甘氨酸由三磷酸甘油生成。丝氨酸由糖代谢中间产物3-磷酸甘油经三步反应生成。(1)3-磷酸甘油酸在3-磷酸甘油酸脱氢酶催化下生成了一磷酸羟基丙酮酸(3-phosphohydroxypyruvate)。(2)由谷氨酸提供氨基经转氨作用生成3-磷酸丝氨酸(3-phosphoserine)。(3)3磷酸丝氨酸水解生成丝氨酸。
丝氨酸以两种途径参与甘氨酸的合成:(1)由丝氨酸羟甲酰转移酶(serine hydroxymethyltransforese)催化直接生成甘氨酸,同时生成N5,N10-甲酰FH4。(2)由N5,N10-CHO-FH4,CO2和NH+4在甘氨酸合成酶(glycineaynthase)催化下缩合生成。
在蛋氨酸代谢中已讨论过,人体中半胱氨酸可由蛋氨酸分解代谢中间产物同型半胱氨酸和丝氨酸合成,半胱氨酸的巯基来源于必需氨基酸-蛋氨酸,故有人将其称为半必需氨基酸(semiessential amino acid)。而在植物及微生物中,半胱氨酸在丝氨酸乙酰转移酶催化下被乙酰基取代生成O-乙酰丝氨酸(O-acetyl serine)。(2)乙酰基被巯基取代生成半胱氨酸。反应中的羟基由PAPS经PAPS还原酶及亚硫酸还原酶(sulfite reductase)催化生成。
第八章 核苷酸代谢(Nucleotide Metabo lism)
核苷酸在人体内广泛分布,具有多种生物学功能:①核苷酸是构成核酸的基本单位,这是其最主要功能。②储存能量。三磷酸核苷酸,尤其是ATP是细胞的主要能量形式。另外,一些活化的中间产物,如UDP葡萄糖,亦含有核苷酸成分。③参与代谢和生理调节:许多代谢过程受到体内ATP、ADP或AMP水平的调节。cAMP(或cGMP)是多种细胞膜激素受体的调节作用的第二信使。④组成辅酶。如腺苷酸可作为NAD+、ANDP+、FMN、FAD及CoA等的组成成分。
几乎所有细胞均可以从头合成及补救合成两种途径合成核苷酸。本章重点讨论核苷酸的生物合成过程。同时学习其合成的调节及缺陷,并了解核苷酸的分解代谢等内容。
第一节 核苷酸的化学结构
核苷酸是组成核酸的基本单位。组成DNA的核苷酸是脱氧核糖核苷酸(deoxyribonucleotide)。组成RNA的是核糖核苷酸(ribonudeotide)。核苷酸可以进一步水解为核苷(nucleoside)和磷酸,核苷又可以水解为戊糖(pentose)和碱基(base)(图8-1)

图8-1 核酸的组成
核苷酸中的戊糖有核糖(ribose)和脱氧核糖(deoxyribose)两种,分别存在于核糖核苷酸和脱氧核糖核苷酸中。核苷酸中的碱基均为含氮杂环化合物,分属于嘌呤衍生物和嘧啶衍生物。核苷酸中的嘌呤碱基主要有鸟嘌呤(guanine)和腺嘌呤(adenine);嘧啶碱基主要有:尿嘧啶(uracil)、胞嘧啶(cytosine)和胸腺嘧啶(thymine)。其中尿嘧啶只存在于RNA中,而胸腺嘧啶只存在于DNA中。
图8-2 核糖核苷酸(a)和脱氧核糖核苷酸(b)的化学结构
碱基与戊糖以糖苷键相连接构成核苷,通常是戊糖的C1′与嘧啶碱的N1或嘌呤碱的N9相连接。核苷中的戊糖与磷酸以磷酸酯键连接构成核苷酸。(图8-2)体内核苷酸大多数是以核糖或脱氧核糖C5′上羟基被磷酸化,形成5′一核苷酸(5′-nucleotide)。除一磷酸核苷外,体内还有核苷的二磷酸酯和三磷酸酯形式。以核糖腺苷酸为例,除AMP外,还有二磷酸腺苷(adenosine5′-diphosphate ADP)及三磷酸腺苷(adenosine5′-triphosphate ATP)。二磷酸核苷酸和三磷酸核苷酸多为核苷酸有关代谢中间产物或酶活性及代谢的调节物质。三磷酸核苷酸是参与核酸合成的直接形式,并同时为生理储能和供能的重要形式。
第二节 嘌呤核苷酸的合成代谢
一、嘌呤核苷酸的合成
体内嘌呤核苷酸的合成有两条途径:①利用磷酸核糖、氨基酸、一碳单位及CO2等简单物质为原料合成嘌呤核苷酸的过程,称为从头合成途径(denovo synthesis),是体内的主要合成途径。②利用体内游离嘌呤或嘌呤核苷,经简单反应过程生成嘌呤核苷酸的过程,称重新利用(或补救合成)途径(saluagepathway)。在部分组织如脑、骨髓中只能通过此途径合成核苷酸。
(一)嘌呤核苷酸的从头合成
早在1948年,Buchanan等采用同位素标记不同化合物喂养鸽子,并测定排出的尿酸中标记原子的位置的同位素示踪技术,证实合成嘌呤的前身物为:氨基酸(甘氨酸、天门冬氨酸、和谷氨酰胺)、CO2和一碳单位(N10甲酰FH4,N、N10-甲炔FH4)(图8-3)。
图8-3 嘌呤环合成的原料来源
随后,由Buchanan和Greenberg等进一步搞清了嘌呤核苷酸的合成过程。出人意料的是,体内嘌呤核苷酸的合成并非先合成嘌呤碱基,然后再与核糖及磷酸结合,而是在磷酸核糖的基础上逐步合成嘌呤核苷酸。嘌呤核苷酸的从头合成主要在胞液中进行,可分为两个阶段:首先合成次黄嘌呤核苷酸(inosine monophosphate IMP);然后通过不同途径分别生成AMP和GMP。下面分步介绍嘌呤核苷酸的合成过程。
1.IMP的合成:IMP的合成包括11步反应:(图8-4)
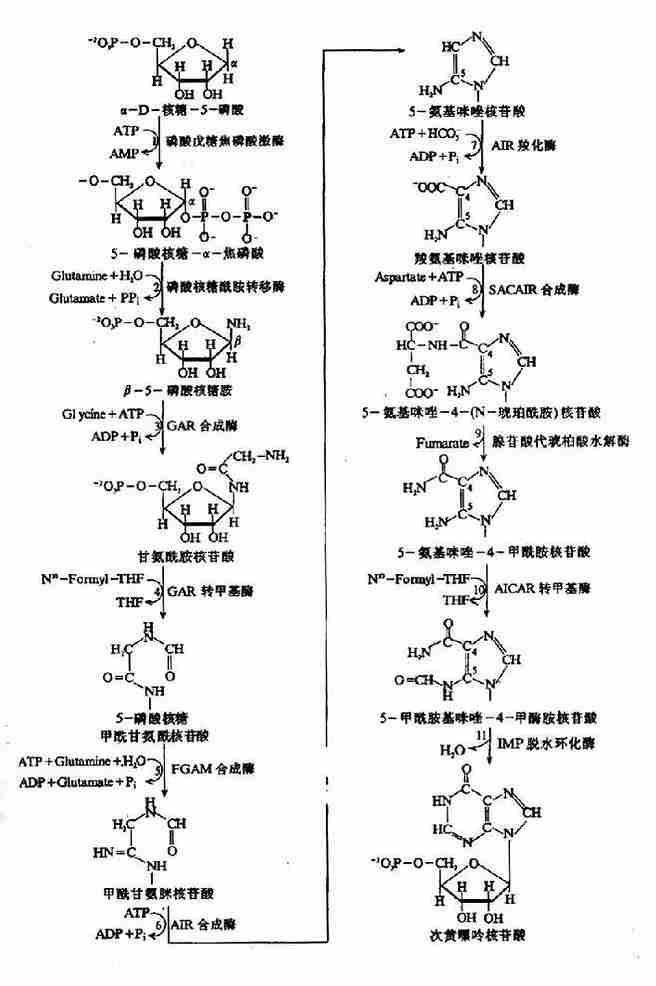
图8-4 IMP的合成
(1)5-磷酸核糖的活化:嘌呤核苷酸合成的起始物为α-D-核糖-5-磷酸,是磷酸戊糖途径代谢产物。嘌呤核苷酸生物合成的第一步是由磷酸戊糖焦磷酸激酶(ribosephosphate pyrophosphohinase)催化,与ATP反应生成5-磷酸核糖-α-焦磷酸(5-phosphorlbosylα-pyrophosphatePRPP)。此反应中ATP的焦磷酸根直接转移到5-磷酸核糖C1位上。PRPP同时也是嘧啶核苷酸及组氨酸、色氨酸合成的前体。因此,磷酸戊糖焦磷酸激酶是多种生物合成过程的重要酶,此酶为一变构酶,受多种代谢产物的变构调节。如PPi和2,3-DPG为其变构激活剂。ADP和GDP为变构抑制剂。
(2)获得嘌呤的N9原子:由磷酸核糖酰胺转移酶(amidophosphoribosyltransterase)催化,谷氨酰胺提供酰胺基取代PRPP的焦磷酸基团,形成β-5-磷酸核糖胺(β-5-phosphoribasylamine PRA)。此步反应由焦磷酸的水解供能,是嘌呤合成的限速步骤。酰胺转移酶为限速酶,受嘌呤核苷酸的反馈抑制。
(3)获得嘌呤C4、C5和N7原子:由甘氨酰胺核苷酸合成酶(glycinamide ribotidesynthetase)催化甘氨酸与PRA缩合,生成甘氨酰胺核苷酸(glycinamide ribotide,GAR)。由ATP水解供能。此步反应为可逆反应,是合成过程中唯一可同时获得多个原子的反应。
(4)获得嘌呤C8原子:GAR的自由α-氨基甲酰化生成甲酰甘氨酰胺核苷酸(formylglycinamide ribotideFGAR)。由N10-甲酰-FH4提供甲酰基。催化此反应的酶为GAR甲酰转移酶(GAr transtormylase)。
(5)获得嘌呤的N3原子:第二个谷氨酰胺的酰胺基转移到正在生成的嘌呤环上,生成甲酰甘氨脒核苷酸(formylglycinamidine ribotide,FGAM)。此反应为耗能反应,由ATP水解生成ADP+Pi,供能。
(6)嘌呤咪唑环的形成:FGAM经过耗能的分子内重排,环化生成5-氨基咪唑核苷酸(5-aminoimidazole ribotide,AIR)。
(7)获得嘌呤C6原子:C6原子由CO2提供,由AIR羧化酶(AIrcarboxylase)催化生成羧基氨基咪唑核苷酸(carboxyamino imidazoleribotide,CAIR)。
(8)获得N1原子:由天门冬氨酸与AIR缩合反应,生成5-氨基咪唑-4-(N-琥珀酰胺)核苷酸(4-aminoimidazole-4-(N-succinylocarboxamide)ribotide,SACAIR)。此反应与(3)步相似,由ATP水解供能。
(9)去除延胡索酸:SACAIR在SACAIR甲酰转移酶催化下脱去延胡索酸生成5-氨基咪唑-4-甲酰胺核苷酸(5-aminoimidazole-4-carboxamideribotide,AICAR)。(8)、(9)两步反应与尿素循环中精氨酸生成鸟氨酸的反应相似。
(10)获得C2:嘌呤环的最后一个C原子由N10-甲酰-FH4提供,由AICAR甲酰转移酶催化AICAR甲酰化生成5-甲酰胺基咪唑-4-甲酰胺核苷酸(5-formaminoimidazole-4carboxyamideribotide,FAICAR)。
(11)环化生成IMP:FAICAR脱水环化生成 IMP。与反应(6)相反,此环化反应无需ATP供能。
2.由IMP生成AMP和GMP
上述反应生成的IMP并不堆积在细胞内,而是迅速转变为AMP和GMP。AMP与IMP的差别仅是6位酮基被氨基取代(图8-5)。此反应由两步反应完成。(1)天门冬氨酸的氨基与IMP相连生成腺苷酸代琥珀酸(adenylosuccinate),由腺苷酸代琥珀酸合成酶催化,GTP水解供能。(2)在腺苷酸代琥珀酸裂解酶作用下脱去延胡索酸生成AMP。
GMP的生成也由二步反应完成。(1)IMP由IMP脱氢酶催化,以NAD+为受氢体,氧化生成黄嘌呤核苷酸(xanthosinemonophosphate,XMP)。(2)谷氨酰胺提供酰胺基取代XMP中C2上的氧生成GMP,此反应由GMP合成酶催化,由ATP水解供能(图8-5)。
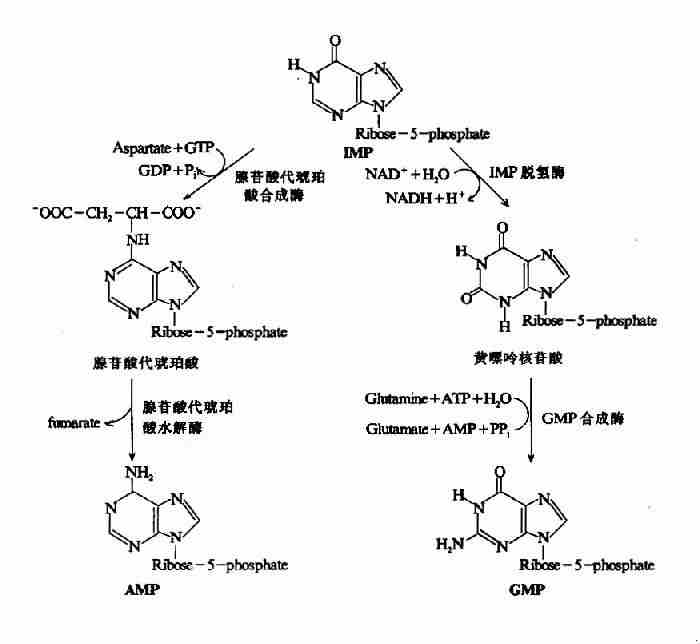
图8-5 IMP分别生成AMP和GMP
3.一磷酸核苷磷酸化生成二磷酸核苷和三磷核苷。
要参与核酸的合成。一磷酸核苷必须先转变为二磷酸核苷再进一步转变为三磷酸核苷。二磷酸核苷由碱基特异的核苷一磷酸激酶(nucleoside monophosphate kinase)催化,由相应一磷酸核苷生成。例如腺苷激酶催化AMP磷酸化生成ADP

二磷酸核苷激酶对底物的碱基及戊糖(核糖或脱氧核糖)均无特异性。此酶催化反应系通过“乒乓机制”,即底物NTP使酶分子的组氨酶残基磷酸化,进而催化底物NDP的磷酸化。反应△G≈0,为可逆反应。
4.嘌呤核苷酸从头合成的调节
从头合成是体内合成嘌呤核苷酸的主要途径。但此过程要消耗氨基酸及ATP。机体对合成速度有着精细的调节。在大多数细胞中,分别调节IMP,ATP和GTP的合成,不仅调节嘌呤核苷酸的总量,而且使ATP和GTP的水平保持相对平衡。嘌呤核苷酸合成调节网可见图8-6。
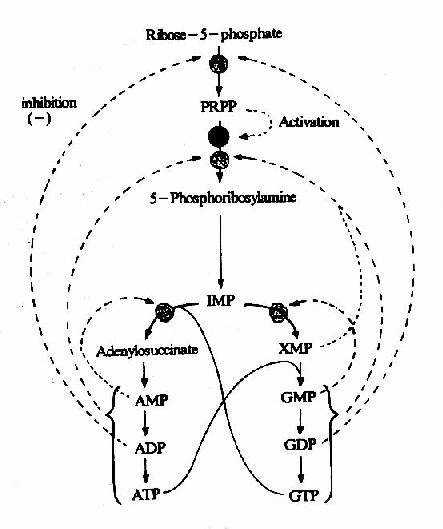
图8-6 嘌呤合成的调节网
IMP途径的调节主要在合成的前二步反应,即催化PRPP和PRA的生成。核糖磷酸焦磷酸激酶受ADP和GDP的反馈抑制。磷酸核糖酰胺转移酶受到ATP、ADP、AMP及GTP、GDP、GMP的反馈抑制。ATP、ADP和AMP结合酶的一个抑制位点,而GTP、GDP和GMP结合另一抑制位点。因此,IMP的生成速率受腺嘌呤和鸟嘌呤核苷酸的独立和协同调节。此外,PRPP可变构激活磷酸核糖酰胺转移酶。
第二水平的调节作用于IMP向AMP和GMP转变过程。GMP反馈抑制IMP向XMP转变,AMP则反馈抑制IMP转变为腺苷酸代琥珀酸,从而防正生成过多AMP和GMP。此外,腺嘌呤和鸟嘌呤的合成是平衡。GTP加速IMP向AMP转变,而ATP则可促进GMP的生成,这样使腺嘌呤和鸟嘌呤核苷酸的水平保持相对平衡,以满足核酸合成的需要。
(二)补救合成途径:
大多数细胞更新其核酸(尤其是RNA)过程中,要分解核酸产生核苷和游离碱基。细胞利用游离碱基或核苷重新合成相应核苷酸的过程称为补救合成(saluage pathway)。与从头合成不同,补救合成过程较简单,消耗能量亦较少。由二种特异性不同的酶参与嘌呤核苷酸的补救合成。腺嘌呤磷酸核糖转移酶(Adenine phosphoribosyl transterase,APRT)催化PRPP与腺嘌呤合成AMP:

![]()
人体由嘌呤核苷的补救合成只能通过腺苷激酶催化,使腺嘌呤核苷生成腺嘌呤核苷酸。
嘌呤核苷酸补救合成是一种次要途径。其生理意义一方面在于可以节省能量及减少氨基酸的消耗。另一方面对某些缺乏主要合成途径的组织,如人的白细胞和血小板、脑、骨髓、脾等,具有重要的生理意义。例如SesehNyhan综合征是由于HGPRT的严重遗传缺陷所致。此种疾病是一种性连锁遗传缺陷,见于男性。患者表现为尿酸增高及神经异常。如脑发育不全、智力低下、攻击和破坏性行为、常咬伤自己的嘴唇、手和足趾,故亦称自毁容貌症。其尿酸增高较易解释,由于HGPRT缺乏,使得分解产生的PRPP不能被利用而堆积,PRPP促进嘌呤的从头合成,从而使嘌呤分解产物-尿酸增高。而神经系统症状的机制尚不清楚。
第三节 嘧啶核苷酸的合成代谢
嘧啶核苷酸合成也有两条途径:即从头合成和补救合成。本节主要论述其从头合成途径。
(一)嘧啶核苷酸的从头合成
与嘌呤合成相比,嘧啶核苷酸的从头合成较简单,同位素示踪证明,构成嘧啶环的N1、C4、C5及C6均由天冬氨酸提供,C3来源于CO2,N3来源于谷氨酰胺。(图8-7)
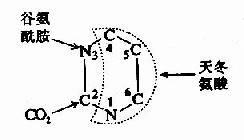
图8-7 嘧啶环合成的原料来源
嘧啶核苷酸的合成是先合成嘧啶环,然后再与磷酸核糖相连而成的。
1.尿嘧啶核苷酸(UMP)的合成,由6步反应完成:(图8-8)
图8-8 UMP的生物合成
(1)合成氨基甲酰磷酸(carbamoyl phosphate):嘧啶合成的第一步是生成氨基甲酰磷酸,由氨基甲酰磷酸合成酶Ⅱ(carbamoyl phosphate synthetase Ⅱ,CPS-Ⅱ)催化CO2与谷氨酰胺的缩合生成。正如氨基酸代谢中所讨论的,氨基甲酰磷酸也是尿素合成的起始原料。但尿素合成中所需氨基甲酰磷酸是在肝线粒体中由CPS-Ⅰ催化合成,以NH3为氮源;而嘧啶合成中的氨基甲酰磷酸在胞液中由CPSⅡ催化生成,利用谷氨酰胺提供氮源。CPS-Ⅰ和CPS-Ⅱ的比较见下表8-1。
(2)合成甲酰天冬氨酸(carbamoyl aspartate):由天冬氨酸氨基甲酰转移酶(aspartate transcarbamoylase,ATCase)催化天冬氨酸与氨基甲酰磷酸缩合,生成氨基甲酰天冬氨酸(carbamoyl aspartate)。此反应为嘧啶合成的限速步骤。ATCase是限速酶,受产物的反馈抑制。不消耗ATP,由氨基甲酰磷酸水解供能。
表8-1 两种氨基甲酰磷酸合成酶的比较
| 氨基甲酰磷酸合成酶Ⅰ | 氨基甲酰磷酸合成酶Ⅱ | |
| 分布 | 线粒体现肝脏) | 胞液(所有细胞) |
| 氮源 | 氨 | 谷氨酰胺 |
| 变构激活剂 | N乙酰谷氨酸 | 无 |
| 反馈抑制剂 | 无 | UMP(哺乳类动物) |
| 功能 | 尿素合成 | 嘧啶合成 |
(3)闭环生成二氢乳清酸(dihydroortate):由二氢乳清酸酶(dihyolroorotase)催化氨基甲酰天冬氨酸脱水、分子内重排形成具有嘧啶环的二氢乳清酸。
(4)二氢乳清酸的氧化:由二氢乳清酸还原酶(dihydroorotate dehyolrogenase)催化,二氢乳清酸氧化生成乳清酸(orotate)。此酶需FMN和非血红素Fe2+,位于线粒体内膜的外侧面,由醌类(quinones)提供氧化能力,嘧啶合成中的其余5种酶均存在于胞液中。
(5)获得磷酸核糖:由乳清酸磷酸核糖转移酶催化乳清酸与PRPP反应,生成乳清酸核苷酸(orotidine-5′-monophosphate,OMP)。由PRPP水解供能。
(6)脱羧生成UMP:由OMP脱羧酶(omp decarboxylase)催化OMP脱羧生成UMP。
Jones等研究表明,在动物体内催化上述嘧啶合成的前三个酶,即CPS-Ⅱ,天冬氨酸氨基甲酰转移酶和二氢乳清酸酶,位于分子量约210kD的同一多肽链上,是一个多功能酶;因此更有利于以均匀的速度参与嘧啶核苷酸的合成。与此相类似,反应(5)和(6)的酶(乳清酸磷酸核糖转移酶和OMP脱羧酶)也位于同一条多肽链上。嘌呤核苷酸合成的反应(3)、(4)、(6),反应(7)和(8)及反应(10)和(11)也均为多功能酶。这些多功能酶的中间产物并不释放到介质中,而在连续的酶间移动,这种机制能加速多步反应的总速度,同时防止细胞中其它酶的破坏。
2.UTP和CTP的合成
三磷酸尿苷(UTP)的合成与三磷酸嘌呤核苷的合成相似。
三磷酸胞苷(CTP)由CTP合成酶(CTP synthetase)催化UTP加氨生成。(图8-9)动物体内,氨基由谷氨酰胺提供,在细菌则直接由NH3提供。此反应消耗1分子ATP。
图8-9 由UTP合成CTP
3.嘧啶核苷酸从头合成的调节
在细菌中,天冬氨酸氨基甲酰转移酶(ATCase)是嘧啶核苷酸从头合成的主要调节酶。在大肠杆菌中,ATCase受ATP的变构激活,而CTP为其变构抑制剂。而在许多细菌中、UTP是ATCase的主要变构抑制剂。
在动物细胞中,ATCase不是调节酶。嘧啶核苷酸合成主要由CPS-Ⅱ调控。UDP和UTP抑制其活性,而ATP和PRPP为其激活剂。第二水平的调节是OMP脱羧酶,UMP和CMP为其竞争抑制剂。(图8-10)
此外,OMP的生成受PRPP的影响。
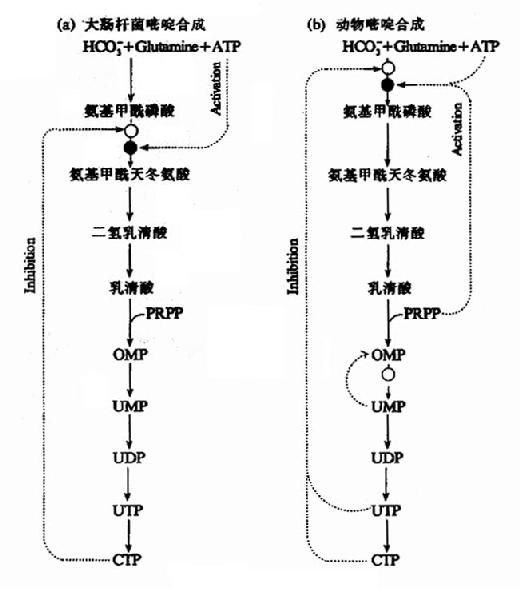
图8-10 嘧啶合成的调节网
4.乳清酸尿症(Orotic aciduria)
乳清酸尿症是一种遗传性疾病,主要表现为尿中排出大量乳清酸、生长迟缓和重度贫血。是由于催化嘧啶核苷酸从头合成反应(5)和(6)的双功能酶的缺陷所致。临床用尿嘧啶或胞嘧啶治疗。尿嘧啶经磷酸化可生成UMP,抑制CPSⅡ活性,从而抑制嘧啶核苷酸的从头合成。
第四节 脱氧核糖核苷酸的生成
DNA与RNA有两方面不同:(1)其核苷酸中戊糖为2脱氧核糖而非核糖。(2)含有胸腺嘧啶碱基,不含尿嘧啶碱基。
图8-11 大肠杆菌硫氧化还原
蛋白的320残基亚单位结构图
(一)脱氧核糖的生成:
脱氧核糖核苷酸是通过相应核糖核苷酸还原,以H取代其核糖分子中C2上的羟基而生成,而非从脱氧核糖从头合成。此还原作用是在二磷酸核苷酸(NDP)水平上进行的。(此处N代表A、G、U、C等碱基)。
催化脱氧核糖核苷酸生成的酶是核糖核苷酸还原酶(ribonudeotide reductase)。已发现有三种不同的核糖核苷酸还原酶,此反应过程较复杂。核糖核苷酸还原酶催化循环反应的最后一步是酶分子中的二硫键还原为具还原活性的巯基的酶再生过程。硫氧化还原蛋白(thioredoxin)是此酶的一种生理还原剂,由108个氨基酸组成,分子量约12kD。含有一对邻近的半胱氨酸残基(图811)。所含硫基在核糖核苷酸还原酶作用下氧化为二硫键,后者再在在硫氧化还原蛋白还原酶(thioredoxinreductase)催化,由NADPH供氢重新还原为还原型的硫氧化还原蛋白。因此,NADPH是NDP还原为dNDP的最终还原剂。(图8-12)
核糖核苷酸还原酶是一种变构酶,包括B1、B2两个亚基,只有B1与B2结合时。才具有酶活性。在DNA合成旺盛、分裂速度快的细胞中,核糖核苷酸还原酶系活性较强。
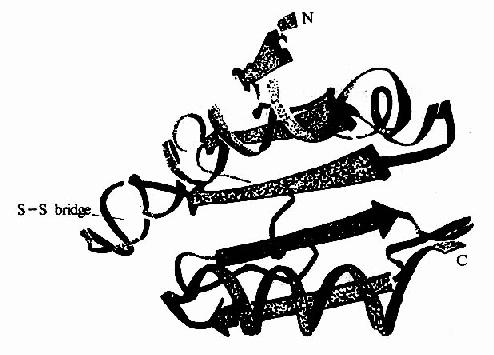
图8-12 大肠杆菌硫氧化还原蛋白的X线衍射结构
(二)脱氧核糖核苷酸合成的调节
四种dNTP的合成水平受到反馈调节,同时保持dNTP的适当比例也是细胞正常生长所必需的。实际上,缺少任一种dNTP都是致命的,而一种dNTP过多也可致突变,因为过多的dNTP可错误掺入DNA链中。核糖核苷酸还原酶的活性对脱氧核糖核苷酸的水平起着决定作用。各种dNTP通过变构效应调节不同脱氧核糖核苷酸生成。因为,某一种特定NDP经还原酶作用生成dNDP时,需要特定NTP的促进,同时受到另一些NTP的抑制(表82)。通过调节使4种dNTP保持适当的比例。
表8-2 核糖核苷酸还原酶的别构调节
| 作用物 | 主要促进剂 | 主要抑制剂 |
| CDP | ATP | dATP、dGTP、dTTP |
| UDP | ATP | dATP、dGTP |
| ADP | dGTP | dATP、ATP |
| GDP | dTTP | dATP |
例如,当存在混合的NDP底物时,由ATP促使CDP和UDP还原生成dUDP和dCDP。经dUDP转变为dTTP(后述),dTTP则反馈抑制CDP和UDP还原,同时促进dGDP的生成,dGDP磷酸化生成dGTP则抑制GDP、CDP和UDP的还原,而促进ADP的还原生成dADP。当dATP升高与酶
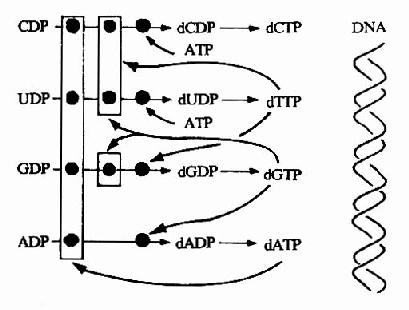
图8-13 脱氧核苷酸合成调节网络
活性位点结合,则抑制所有NDP的还原反应(图8-13)。细胞内dCTP和dTTP的适当比例并非由核糖核苷酸还原酶调节,而是通过脱氧胞嘧啶脱氨酶(deoxycytidinedeaminase)决定。此酶催化dUMP的生成,dUMP则是dTTP的前体。此酶受dCTP激活,受dTTP抑制。
dNTP由dNDP磷酸化生成:
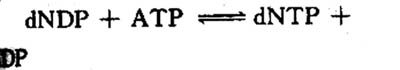
由二磷酸核苷酸激酶(mucleosidediphosphafe kinase),催化与催化NDP磷酸化的反应相似。
(三)脱氧胸腺嘧啶核苷酸的生成
脱氧胸腺嘧啶核苷酸(dTMP)是由脱氧尿嘧啶核苷酸(dUMP)甲基化生成。而dUMP由dUTP水解生成:
![]()
体内进行此种“浪废”能量的反应过程的意义在于:细胞必须减少细胞内dUTP浓度以防止脱氧尿嘧啶掺入DNA中,因为合成DNA的酶系不能有效识别dUTP和dTTP。
dUMP甲基化生成dTMP由胸腺嘧啶合成酶(thymidylatesynthetase,TS)催化,N5,N10-甲烯FH4提供甲基(图8-14)。N5、N10-甲烯-FH4提供甲基后生成的FH2又可以再经二氢叶酸还原酶的作,重新生成四氢叶酸。
图8-14 dTMP的生成
第五节 核苷酸的分解代谢
食物中的核酸多与蛋白质结合为核蛋白,在胃中受胃酸的作用,或在小肠中受蛋白酶作用,分解为核酸和蛋白质。核酸主要在十二指肠由胰核酸酶(pancreatic nucleases)和小肠磷酸二酯酶(phosphodiesterases)降解为单核苷酸。核苷酸由不同的碱基特异性核苷酸酶(nucleotidases)和非特异性磷酸酶(phosphatases)催化,水解为核苷和磷酸。核苷可直接被小肠粘膜吸收,或在核苷酶(nucleosidases)和核苷磷酸化酶(nucleoside phosphorylases)作用下,水解为碱基,戊糖或1-磷酸戊糖:
体内核苷酸的分解代谢与食物中核苷酸的消化过程类似,可降解生成相应的碱基,戊糖或1-磷酸核糖。1-磷酸核糖在磷酸核糖变位酶催化下转变为5-磷酸核糖,成为合成PRPP的原料。碱基可参加补救合成途径,亦可进一步分解。
一、嘌呤的分解代谢
嘌呤核苷酸可以在核苷酸酶的催化下,脱去磷酸成为嘌呤核苷,嘌呤核苷在嘌呤核苷磷酸化酶(purine nucleoside phosphorylase,PNP)的催化下转变为嘌呤。嘌呤核苷及嘌呤又可经水解,脱氨及氧化作用生成尿酸(图8-15)
图8-15 嘌呤核苷酸的分解代谢
哺乳动物中,腺苷和脱氧腺苷不能由PNP分解,而是在核苷和核苷酸水平上分别由腺苷脱氨酶(adenosine deaminase,ADA)和腺苷酸脱氨酸(AMPdeaminase)催化脱氨生成次黄嘌呤核苷或次黄嘌呤核苷酸。它们再水解成次黄嘌呤,并在黄嘌呤氧化酶(xanthineoxidase)的催化下逐步氧化为黄嘌呤和尿酸(uric acid)。ADA的遗传性缺乏,可选择性清除淋巴细胞,导致严重联合免疫缺陷病(Severecombined immunodeficiency olisease,SCID)。
体内嘌呤核苷酸的分解代谢主要在肝脏、小肠及肾脏中进行。正常生理情况下,嘌呤合成与分解处于相对平衡状态,所以尿酸的生成与排泄也较恒定。正常人血浆中尿酸含量约0.12~0.36mmol/L(2~6mg/dl)。男性平均为0.27mmol/L(4.5mg/dl),女性平均为0.21mmol/L(3.5mg/dl)左右。当体内核酸大量分解(白血病、恶性肿瘤等)或食入高嘌呤食物时,血中尿酸水平升高,当超过0.48mmol/L(8mg/dl)时,尿酸盐将过饱合而形成结晶,沉积于关节、软组织、软骨及肾等处,而导致关节炎、尿路结石及肾疾患,称为痛风症。痛风症多见于成年男性,其发病机理尚未阐明。临床上常用别嘌呤醇(allopurinol)治疗痛风症。别嘌呤醇与次黄嘌呤结构类似,只是分子中N8,与C2互换了位置,故可抑制黄嘌呤氧化酶,从而抑制尿酸的生成。同时,别嘌呤在体内经代谢转变,与PRPP生成别嘌呤核苷酸,不仅消耗了PRPP,使其含量下降,而且还能反馈抑制PRPP酰胺转移酶,阻断嘌呤核苷酸的从头合成。
二、嘧啶核苷酸的分解代谢

嘧啶核苷酸的分解代谢途径与嘌呤核苷酸相似。首先通过核苷酸酶及核苷磷酸化酶的作用,分别除去磷酸和核糖,产生的嘧啶碱再进一步分解。嘧啶的分解代谢主要在肝脏中进行。分解代谢过程中有脱氨基、氧化、还原及脱羧基等反应。胞嘧啶脱氨基转变为尿嘧啶。尿嘧啶和胸腺嘧啶先在二氢嘧啶脱氢酶的催化下,由NADPH+H+供氢,分别还原为二氢尿嘧啶和二氢胸腺嘧啶。二氢嘧啶酶催化嘧啶环水解,分别生成β-丙氨酸(β-alanine)和β-氨基异丁酸(β-aminosiobutyrate)。β-丙氨酸和β氨基异丁酸可继续分解代谢。β-氨基异丁酸亦可随尿排出体外。食入含DNA丰富的食物、经放射线治疗或化学治疗的患者,以及白血病患者,尿中β-氨基异丁酸排出量增多。嘧啶核苷酸分解代谢见图8-16。
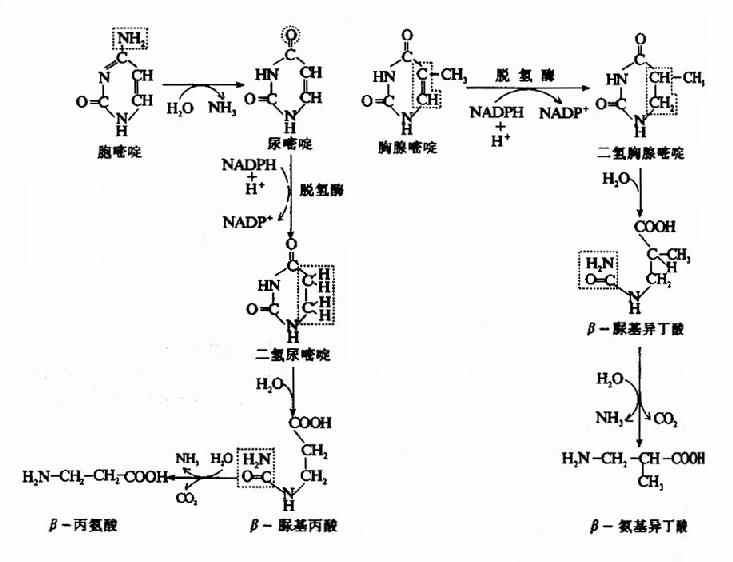
图8-16 嘧啶核苷酸的分解代谢
第九章 物质代谢调节(Regulation in Metabolism)
物质代谢是生命现象的基本特征,是生命活动的物质基础。人体物质代谢是由许多连续的和相关的代谢途径所组成,而代谢途径(如糖的氧化,脂肪酸的合成等)又是由一系列的酶促化学反应组成。在正常情况下,各种代谢途径几乎全部按照生理的需求,有节奏、有规律地进行,同时,为适应体内外环境的变化,及时地调整反应速度,保持整体的动态平衡。可见,体内物质代谢是在严密的调控下进行的。
代谢调节机制普遍存在于生物界,是生物在长期进化过程中逐步形成的一种适应能力。进化程度越高的生物,其代谢调节的机制越复杂。单细胞的微生物受细胞内代谢物浓度变化的影响,改变其各种相关酶的活性和酶的含量,从而调节代谢的速度,这是细胞水平的代谢调节,是生物体在进化上较为原始的调节方式。较复杂的多细胞生物,出现了内分泌细胞。高等动物则出现了专门的内分泌器官,这些器官所分泌的激素可以对其他细胞发挥代谢调节作用。激素可以改变某些酶的催化活性或含量,也可以改变细胞内代谢物的浓度,从而影响代谢反应的速度,这称为激素水平的调节。高等动物不仅有完整的内分泌系统,而且还有功能复杂的神经系统。在中枢神经的控制下,或者通过神经递质对效应器直接发生影响,或者通过改变某些激素的分泌,来调节某些细胞的功能状态,并通过各种激素的互相协调而对整体代谢进行综合调节,这种调节即称整体水平的调节。以上所述的细胞水平的代谢调节、激素水平的调节和整体水平的调节,在高等动物和人体内全都存在,下面分别进行介绍。
第一节 细胞水平的代谢调节
一、细胞内酶的分隔分布
从物质代谢过程中可知,酶在细胞内是分隔着分布的。代谢上有关的酶,常常组成一个酶体系,分布在细胞的某一组分中,例如,糖酵解酶系和糖元合成、分解酶系存在于胞液中;三羧酸循环酶系和脂肪酸β-氧化酶系定位于线粒体;核酸合成的酶系则绝大部分集中在细胞核内。这样的酶的隔离分布为代谢调节创造了有利条件,使某些调节因素可以较为专一地影响某一细胞组分中的酶的活性,而不致影响其他组分中的酶的活性,从而保证了整体反应的有序性。一些代谢物或离子在各细胞组分间的穿梭移动也可以改变细胞中某些组分的代谢速度。例如,在胞液中生成的脂酰辅酶A主要用于合成脂肪;但在肉毒碱的作用下,经肉毒碱脂酰转移酶的催化,脂酰辅酶A可进入线粒体,参与β-氧化的过程。又如,Ca++从肌细胞线粒体中出来,可以促进胞液中的糖元分解,而Ca++进入线粒体则有利于糖元合成。
物质代谢实质上是一系列的酶促反应,代谢速度的改变并不是由于代谢途径中全部酶活性的改变,而常常只取决于某些甚至某一个关键酶活性的变化。此酶通常是整条通路中催化最慢一个反应的酶,称为限速酶。它的活性改变不但可以影响整个酶体系催化反应的总速度,甚至还可以改变代谢反应的方向。如,细胞中ATP/AMP的比值增加,可以抑制磷酸果糖激酶(和丙酮酸激酶)的活性,这不但减慢了糖酵解的速度,还可以通过激活果糖-1,6-二磷酸酶而使糖代谢方向倾向于糖异生。因此,改变某些关键酶的活性是体内代谢调节的一种重要方式。
人体代谢的细胞水平调节,从速度方面来说有两种方式,一种是快速调节,一般在数秒或数分钟内即可发生。这种调节是通过激活或抑制体内原有的酶分子来调节酶促反应速度的,是在温度、pH、作用物和辅酶等因素不变的情况下,通过改变酶分子的构象或对酶分子进行化学修饰来实现酶促反应速度的迅速改变的。另一种是迟缓调节,一般经数小时后才能实现。这种方式主要是通过改变酶分子的合成或降解速度来调节细胞内酶分子的含量。现将这两类调节作用分述如下:
二、酶分子结构的调节
(一)变构调节
1.变构调节的概念 某些物质能与酶分子上的非催化部位特异地结合,引起酶蛋白的分子构象发生改变,从而改变酶的活性,这种现象称为酶的变构调节或称别位调节(allosteric regulation)。受这种调节作用的酶称为别构酶或变构酶(allostericenzyme),能使酶发生变构效应的物质称为变构效应剂(allosteric effector);如变构后引起酶活性的增强,则此效应剂称为激活变构剂(allosteric activator)或正效应物;反之则称为抑制变构剂(allostericinhibitor)或负效应物。变构调节在生物界普遍存在,它是人体内快速调节酶活性的一种重要方式。现将某些代谢途径的变构效应剂列表如下:
表9-1 糖和脂肪代谢酶系中某些变构酶及其变构效应剂
| 代谢途径 | 变构酶 | 激活变构剂 | 抑制变构剂 |
| 糖氧化分解 | 已糖激酶 | G-6-P | |
| 磷酸果糖激酶 | AMP、ADP、FDP、Pi | ATP、柠檬酸 | |
| 丙酮酸激酶 | FDP | ATP、乙酸CoA | |
| 异柠檬酸脱氢酶 | AMP | ATP、长链脂酰CoA | |
| 柠檬酸合成酶 | ADP、AMP | ATP | |
| 糖异生 | 果糖-1,6-二磷酸酶 | AMP | |
| 丙酮酸羟化酶 | 乙酰CoA、ATP | ||
| 脂肪酸合成 | 乙酰CoA羟化酶 | 柠檬酸、异柠檬酸 | 长链脂酰CoA |
2.变构调节的生理意义 变构效应在酶的快速调节中占有特别重要的地位。在前面已经提及,代谢速度的改变,常常是由于影响了整条代谢通路中催化第一步反应的酶或整条代谢反应中限速酶的活性而引起的。这些酶对底物不遵守米曼氏动力学原则。它们往往受到一些代谢物的抑制或激,这些抑制或激活作用大多是通过变构效应来实现的。因而,这些酶的活力可以极灵敏地受到代谢产物浓度的调节,这对机体的自身代谢调控具有重要的意义。例如,变构酶对于人体能量代谢的调节具有重要意义。在休息状态下,机体能量消耗降低,ATP在细胞内积聚,而ATP是磷酸果糖激酶的抑制变构剂,所以导致F-6-P和G-6-P的积聚,G-6-P又是已糖激酶的抑制变构剂,从而减少葡萄糖的氧化分解。同时,ATP也是丙酮酸激酶和柠檬酸合成酶的抑制变构剂,更加强了对葡萄糖氧化分解的抑制,从而减少了ATP的进一步生成。反之,当体内ATP减少而ADP或AMP增加时,AMP则可抑制果糖1,6-二磷酸酶,降低糖异生,同时激活磷酸果糖激酶和柠檬酸合成酶等酶,加速糖的分解氧化,利于体内ATP的生成。这样,通过变构调节,使体内ATP的生成不致过多或过少,保证了机体的能源被有效利用。
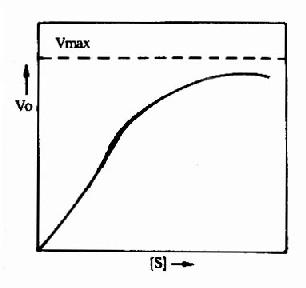
图9-1 变构酶的底物浓度曲线
3.变构调节的机理 目前已知,能受变构调节的酶,常常是由两个以上亚基组成的聚合体。有的亚基与作用物结合,起催化作用,称为催化亚基;有的亚基与变构剂结合,发挥调节作用,称调节亚基。但也可在同一亚基上既存在催化部位又存在调节部位。变构剂与调节亚基(或部位)间是非共价键的结合,结合后改变酶的构象(如,变为疏松或紧密),从而使酶活性被抑制或激活。变构酶与米-曼氏酶不同,其动力学不符合米曼氏方程式:酶促反应速度和作用物浓度的关系曲线不呈矩形而常常呈S形,S形曲线与氧合血红蛋白的解离曲线相似(图9-1)。
当变构剂与调节亚基(或部位)结合后,变物剂对酶分子的构象发生什么样的影响呢?下面以果-1,6-二磷酸酶为例阐述这一过程。果糖-1,6-二磷酸酶是由四个结构相同的亚基所组成,每个亚基的分子量约为310,000Da。每个亚基上既有催化部位也有调节部位。在催化部位上能结合一分子FDP,在调节部位上能结合一分子变构剂。此酶有两种存在形式,即紧密型(T型、高活性)与松弛型(R型、低活性)。AMP是此酶的抑制变构剂。当酶处于T型时,因其调节部位转至聚合体内部而难以与AMP结合,故对AMP不敏感而表现出较高的活性。在第一个AMP分子与调节部位结合后,T型逐步转变成R型,各亚基构象相继发生改变,调节部位相继暴露,与AMP的亲和力逐步增加,酶的活性逐渐减弱,这就是果糖-1,6-二磷酸酶由紧密型变成松弛型的变构过程。抑制变构剂促进高活性型至低活性型的转变,激活变构剂则促进低活性型至高活性型的转变。这一变构过程是可逆的(图9-2)。图中3-磷酸甘油醛和脂肪酸-载体蛋白可使活性型转变为高活性型。
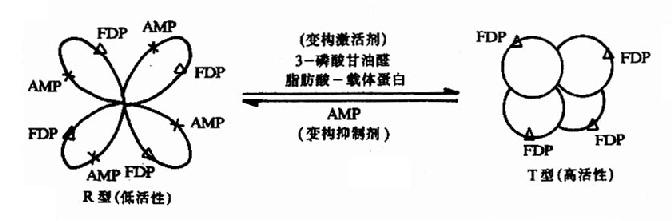
图9-2 果糖-1,6二磷酸酶的变构效应
△:酶亚基上的催化部位 X:酶亚基上的调节部位 FDP:果糖-1,6-二磷酸
变构效应剂可以是酶的底物,也可以是酶系的终产物,还有的是与它们结构不同的其他化合物,一般说,都是小分子物质。一种酶可有多种变构效应剂存在。
果糖-1,6-二磷酸酶的变构过程是T型与R型的可逆转变。有些酶的变构效应还可表现为酶分子的聚合或解聚,如乙酰CoA羧化酶,它是脂肪酸合成过程中的关键酶。它是由四种不同亚基构成的原聚体,每个亚基有不同的功能,分别是:生物素载体蛋白,它能结合辅基生物素;生物素羧化酶,它能催化生物素发生羧化反应;羧基转移酶,它能将生物素上的羧基转移给乙酰CoA形成丙二酰CoA;和调节亚基,它能与柠檬酸或异柠檬酸结合,使原聚体聚合为多聚体。Kieinschmidt等已在电子显微镜下看到了由柠檬酸和异柠檬酸使原聚体聚合形成的纤维状的多聚体(图9-3)。只有多聚体酶才有催化活性。ATPMg++可使多聚体解聚为原聚体而使酶失活。长链脂酰CoA可拮抗柠檬酸的促聚合作用,因此,它们都是该酶的变构抑制剂。
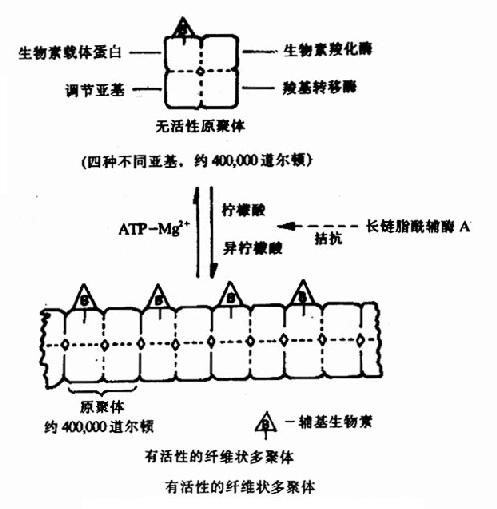
图9-3 乙酰CoA羧化酶聚合解聚示意图
(二)酶分子化学修饰调节
1.酶分子化学修饰的概念
酶分子肽链上的某些基团可在另一种酶的催化下发生可逆的共价修饰,从而引起酶活性的改变,这个过程称为酶的酶促化学修饰(chemical modification)。如磷酸化和脱磷酸,乙酰化和去乙酰化,腺苷化和去腺苷化,甲基化和去甲基化以及-SH基和-S-S-基互变等,其中磷酸化和脱磷酸作用在物质代谢调节中最为常见。
细胞内存在着多种蛋白激酶(ProteinKinase),它们可以将ATP分子中的γ-磷酸基团转移至特定的蛋白分子底物上,使后者磷酸化(phosphorylation)。磷酸化反应可以发生在丝氨酸、苏氨酸或酪氨酸残基上。催化丝氨酸或苏氨酸残基磷酸化的酶统称为蛋白丝氨酸/苏氨酸激酶(Protein Serine/Threonine Kinase)。催化酪氨酸残基磷酸化的酶统称为蛋白酪氨酸激酶(ProteinTyrosine Kinase)。与此相对应的,细胞内亦存在着多种蛋白丝氨酸/苏氨酸磷酸酶(ProteinSerine/Threonine Phosphotase)和蛋白酪氨酸磷酸酶(Protein Tyrosine Phosphotase),它们可将相应的磷酸基团移去。酶的化学修饰如变构调节一样,也是机体物质代谢中快速调节的一种重要方式,表9?列出了一些酶的酶促化学修饰的实例。
表9-2 某些酶的酶促化学修饰调节
| 酶类 | 反应类型 | 效应 |
| 糖无磷酸化酶 | 磷酸化/脱磷酸 | 激活/抑制 |
| 磷酸化酶b激酶 | 磷酸化/脱磷酸 | 激活/抑制 |
| 磷酸化酶磷酸酶 | 磷酸化/脱磷酸 | 抑制/激活 |
| 糖元合成酶 | 磷酸化/脱磷酸 | 抑制/激活 |
| 丙酮酸脱羟酶 | 磷酸化/脱磷酸 | 抑制/激活 |
| 脂肪酶(脂肪细胞) | 磷酸化/脱磷酸 | 激活/抑制 |
| 谷氨酰胺合成酶(大肠杆菌) | 腺苷化/脱腺苷 | 抑制/激活 |
| 黄嘌呤氧化(脱氢)酶 | -SH/-S-S- | 脱氢/氧化 |
2.酶促化学修饰的机理
肌肉糖元磷酸化酶的酶促化学修饰是研究得比较清楚的一个例子。该酶有两种形式,即无活性的磷酸化酶b和有活性的磷酸化酶a。磷酸化酶b是二聚体,分子量约为85,000Da。它在酶的催化下,使每个亚基分别接受ATP供给的一个磷酸基团,转变为磷酸化酶a,后者具有高活性。两分子磷酸化酶a二聚体可以再聚合成活性较低的(低于高活性的二聚体)磷酸化酶a四聚体(图9-4)。
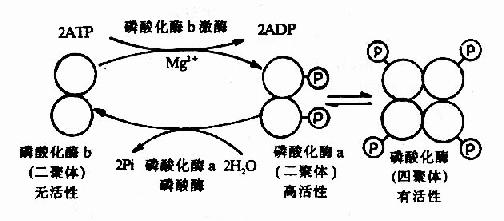
图9-4 肌肉磷酸化酶的酶促化学修饰作用
3.酶促化学修饰的特点
(1)绝大多数酶促化学修饰的酶都具有无活性(或低活性)与有活性(或高活性)两种形式。它们之间的互变反应,正逆两向都有共价变化,由不同的酶进行催化,而催化这互变反应的酶又受机体调节物质(如激素)的控制。
(2)存在瀑布式效应。由于酶促化学修饰是酶所催化的反应,故有瀑布式(逐级放大)效应。少量的调节因素就可通过加速这种酶促反应,使大量的另一种酶发生化学修饰。因此,这类反应的催化效率常较变构调节为高。
(3)磷酸化与脱磷酸是常见的酶促化学修饰反应。一分子亚基发生磷酸化常需消耗一分子ATP,这与合成酶蛋白所消耗的ATP相比,显然是少得多;同时酶促化学修饰又有放大效应,因此,这种调节方式更为经济有效。
(4)此种调节同变构调节一样,可以按着生理的需要来进行。在前述的肌肉糖元磷酸化酶的化学修饰过程中,若细胞要减弱或停止糖元分解,则磷酸化酶a在磷酸化酶a磷酸酶的催化下即水解脱去磷酸基而转变成无活性的磷酸化酶b,从而减弱或停止了糖元的分解。
此外,酶促化学修饰与变构调节只是两种主要的调节方式。对某一种酶来说,它可以同时受这两种方式的调节。如,糖元磷酸化酶受化学修饰的同时也是一种变构酶,其二聚体的每个亚基都有催化部位和调节部位。它可由AMP激活,并受ATP抑制,这属于变构调节。细胞中同一种酶受双重调节的意义可能在于,变构调节是细胞的一种基本调节机制,它对于维持代谢物和能量平衡具有重要作用,但当效应剂浓度过低,不足以与全部酶分子的调节部位结合时,就不能动员所有的酶发挥作用,故难以应急。当在应激等情况下,若有少量肾上腺素释放,即可通过cAMP,启动一系列的瀑布式的酶促化学修饰反应,快速转变磷酸化酶b成为有活性的磷酸化酶a,加速糖元的分解,迅速有效地满足机体的急需。
三、酶含量调节
除通过改变酶分子的结构来调节细胞内原有酶的活性外,生物体还可通过改变酶的合成或降解速度以控制酶的绝对含量来调节代谢。要升高或降低某种酶的浓度,除调节酶蛋白合成的诱导和阻遏过程外,还必须同时控制酶降解的速度,现分述如下:
(一)酶蛋白合成的诱导和阻遏
酶的底物或产物、激素以及药物等都可以影响酶的合成。一般将加强酶合成的化合物称为诱导剂(inducer),减少酶合成的化合物称为阻遏剂(repressor)。诱导剂和阻遏剂可在转录水平或翻译水平影响蛋白质的合成,但以影响转录过程较为常见。这种调节作用要通过一系列蛋白质生物合成的环节,故调节效应出现较迟缓。但一旦酶被诱导合成,即使除去诱导剂,酶仍能保持活性,直至酶蛋白降解完毕。因此,这种调节的效应持续时间较长。
1.底物对酶合成的诱导作用 受酶催化的底物常常可以诱导该酶的合成,此现象在生物界普遍存在。高等动物体内,因有激素的调节作用,底物诱导作用不如微生物体内重要,但是,某些代谢途径中的关键酶也受底物的诱导调节。例如,若鼠的饲料中酪蛋白含量从8%增至70%,则鼠肝中的精氨酸酶的活性可增加2?倍。在食物消化吸收后,血中多种氨基酸的浓度增加,氨基酸浓度的增加又可以诱导氨基酸分解酶体系中的关键酶,如苏氨酸脱水酶和酪氨酸转氨酶等酶的合成。这种诱导作用对于维持体内游离氨基酸浓度的相对恒定有一定的生理意义。
2.产物对酶合成的阻遏 代谢反应的终产物不但可通过变构调节直接抑制酶体系中的关键酶或起催化起始反应作用的酶,有时还可阻遏这些酶的合成。例如,在胆固醇的生物合成中,β-羟-β-甲基戊二酰辅酶A(HMgCoA)还原酶是关键酶,它受胆固醇的反馈阻遏。但这种反馈阻遏只在肝脏和骨髓中发生,肠粘膜中胆固醇的合成似乎不受这种反馈调节的影响。因此摄食大量胆固醇,浆胆固醇仍有升高的危险。此外,如δ-氨基-γ-酮戊酸(ALA)合成酶,它是血红素合成酶系中的起始反应酶,它受血红素的反馈阻遏。
3.激素对酶合成的诱导作用 激素是高等动物体内影响酶合成的最重要的调节因素。糖皮质激素能诱导一些氨基酸分解代谢中起催化起始反应作用的酶和糖异生途径关键酶的合成,而胰岛素则能诱导糖酵解和脂肪酸合成途径中的关键酶的合成。
4.药物对酶合成的诱导作用
很多药物和毒物可促进肝细胞微粒体中单加氧酶(或称混合功能氧化酶)或其他一些药物代谢酶的诱导合成,从而促进药物本身或其他药物的氧化失活,这对防止药物或毒物的中毒和累积有着重要的意义。其作用的本质,也属于底物对酶合成的诱导作用。另一方面,它也会因此而导致出现耐药现象。如,长期服用苯巴比妥的病人,会因苯巴比妥诱导生成过多的单加氧酶而使苯巴比妥药效降低。氨甲喋呤治疗肿瘤时,也可因诱导叶酸还原酶的合成而使原来剂量的氨甲喋呤不足而出现药物失效现象。
(二)酶分子降解的调节
细胞内酶的含量也可通过改变酶分子的降解速度来调节。饥饿情况下,精氨酸酶的活性增加,主要是由于酶蛋白降解的速度减慢所致。饥饿也可使乙酰辅酶A羧化酶浓度降低,这除了与酶蛋白合成减少有关外,还与酶分子的降解速度加强有关。苯巴比妥等药物可使细胞色素b5和NADPH-细胞色素P450还原酶降解减少,这也是这类药物使单加氧酶活性增强的一个原因。
酶蛋白受细胞内溶酶体中蛋白水解酶的催化而降解,因此,凡能改变蛋白水解酶活性或蛋白水解酶在溶酶体内分布的因素,都可间接地影响酶蛋白的降解速度。有关情况尚了解不多。总之,通过酶降解以调节酶含量的重要性不如酶的诱导和阻遏作用。
第二节 激素对物质代谢的调节
细胞的物质代谢反应不仅受到局部环镜的影响,即各种代谢底物、产物的正、负反馈调节,而且还受来自于机体其它组织器官的各种化学信号的控制,激素就属于这类化学信号。激素是一类由特殊的细胞合成并分泌的化学物质,它随血液循环于全身,作用于特定的组织或细胞(称为靶组织或靶细胞,target cell),指导细胞物质代谢沿着一定的方向进行。同一激素可以使某些代谢反应加强,而使另一些代谢反应减弱,从而适应整体的需要。对于每一个细胞来说,激素是外源性调控信号,而对于机体整体而言,它仍然属于内环境的一部分。通过激素来控制物质代谢是高等动物体内代谢调节的一种重要方式。
激素的作用必须通过其受体来实现。受体是一类可以与相应的配体(ligand)特异地结合的物质,常为糖蛋白或脂蛋白。激素作为一类配体,与受体的结合具有高度的特异性和亲和性。只有那些具有相应受体的细胞才可以成为该激素的靶细胞。
在糖、脂类和氨基酸代谢过程中,具有重要调节作用的激素-胰岛素、肾上腺素和胰高血糖素等(具体作用见代谢各章)均为水溶性物质,因此不能进入细胞内。但这类激素的受体均存在于细胞膜表面,那么它们是如何通过与细胞膜表面受体结合,将位于胞外的化学信号传递至胞内,又是如何引起细胞内各种代谢过程的改变的呢?这里以肾上腺素为例做一简要说明。
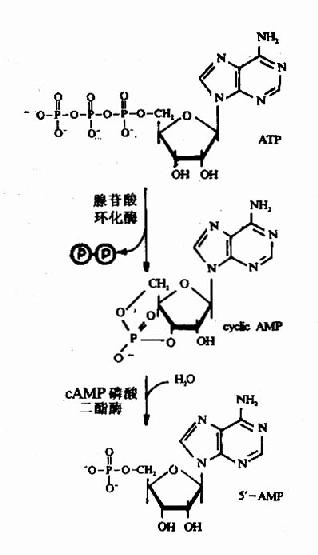
图9-5 CAMP的结构和代谢
(一)cAMP是激素在细胞内的信使
五十年代初期,Sutherland在实验中发现,肝细胞组织切片若加入肾上腺素,可以加速肝糖原分解为葡萄糖;测定磷酸化酶(分解肝糖元的酶),发现其活性增加。因此他认为,磷酸化酶是肝糖元分解的限速酶,肾上腺素能激活此酶。但是,若用纯化的磷酸化酶与肾上腺素一起温育,后者对酶则没有激活作用。由此提示,肾上腺素激活磷酸化酶是一间接过程,需要肝细胞中其它物质的协助。进一步对肝匀浆做试验,若其中加入ATP、Mg++及肾上腺素,则磷酸化酶又可被激活。若只取肝匀浆离心后的上清液,则不能观察到肾上腺素的这种激活作用;只有再加入沉淀中的细胞膜,激活效应才又恢复。这一实验表明,肾上腺素对磷酸化酶的激活至少需要两种以上的因素。后来的实验证实,肾上腺素首先作用于细胞膜,使膜上的腺苷酸环化酶活化,后者使细胞内ATP在Mg2+的存在下转变为cAMP,而cAMP可再使胞浆中的磷酸化酶b转变为磷酸化酶a。由于肾上腺素并不进入细胞,其作用是通过细胞内cAMP传递的,因此将cAMP称为细胞内信使(Intracellular Messenger)。
cAMP广泛存在于生物界,但其在正常细胞中的含量甚微,仅为0.1μM,在激素作用下,可升高约100倍。细胞中cAMP的浓度除了与催化cAMP生成的腺苷酸环化酶有关外,还受到催化cAMP分解的磷酸二酯酶的控制(见图9-5)。
有许多药物能抑制磷酸二酯酶的活性,如甲基黄嘌呤(包括茶碱、氨茶碱和咖啡因等)。二丁基cAMP不易被磷酸二酯酶水解,同时又能抑制此酶活性,故有提高cAMP水平的作用。
激素中多数激素可使cAMP的生成加速,少数激素则可以降低细胞内cAMP的浓度。大部分肽类激素,包括胰高血糖素、甲状旁腺素、降钙素、抗利尿激素和催产素等以及儿茶酚胺类激素均可通过相应的受体激活靶细胞膜上的腺苷酸环化酶,从而使胞内cAMP的浓度增加。
现将几种激素对cAMP浓度的影响及其与受体结合后引起的生理效应列表如下:
表9-3 某些激素对cAMP浓度的影响及其最终生理效应
| 激素 | 靶组织或靶器官 | cAMP浓度 | 对酶或化学反应的影响 | 最终生理效应 |
| 肾上腺素 | 肝 | ↑ | 糖原合成酶↓ | 糖原合成↓ |
| 磷酸化酶↑ | 糖原分解↑ | |||
| 脂肪组织 | ↑ | 脂肪酶↑ | 脂肪分解↑ | |
| 心肌、骨骼肌 | ↑ | 磷酸化酶↑ | 糖原分解↑ | |
| 胰高血糖素 | 肝、心肌 | ↑ | 磷酸化酶↑ | 糖原分解↑ |
| 脂肪组织 | ↑ | 脂肪酶↑ | 脂肪分解↑ | |
| 胰岛β-细胞 | ↑ | - | 胰岛素分泌↑ | |
| 促肾上腺皮质激素 | 肾上腺皮质 | ↑ | 胆固醇→孕烯醇酮↑ | 糖皮质激素合成↑ |
| (ACTH) | 脂肪组织 | ↑ | 脂肪酶↑ | 脂肪分解↑ |
| 促甲状腺激素 | 甲状腺 | ↑ | 磷酸化酶↑ | 糖原分解↑,摄到碘 |
| (TSH) | 及合成分泌T3、T4↑ | |||
| 脂肪组织 | ↑ | 脂肪酶↑ | 脂肪分解↑ | |
| 脂肪组织 | ↓ | 脂肪酶↓ | 脂肪分解↓ | |
| 胰岛素 | 肝、骨骼肌 | ↓ | 磷酸化酶↓ | 糖原分解↓ |
| 糖原合成酶↑ | 糖原合成↑ | |||
| 丙酮酸→磷酸烯醇式丙酮酸↓ | 糖异生↑ |
↑代表增高或增强 ↓代表降低或减弱
激素与其专一性细胞膜受体结合后,是如何激活腺苷酸环化酶的呢?近来有人认为,GTP和GTP调节蛋白即G蛋白,起着介导激素对腺苷酸环化酶激活的作用。当激素与受体结合后,G-蛋白与TP结合,生成GTP-G蛋白复合物,后者能活化腺苷酸环化酶(详见第十二章)。
(二)cAMP依赖性蛋白激酶是cAMP的靶分子
cAMP作为变构剂作用于cAMP依赖性蛋白激酶(cAMP-dependentProtein Kinase A激酶)。这种蛋白激酶由两个亚基组成,一个亚基是催化亚基,具有催化蛋白质磷酸化的作用;另一个亚基是调节亚基,是催化亚基的抑制物。当调节亚基与催化亚基结合时,酶呈无活性状态。cAMP的效应是与调节亚基结合,使后者发生变构而脱离催化亚基,从而使催化亚基进入激活状态(图9-6)。
图9-6 蛋白激酶的激活过程 C为催化亚基 R为调节亚基
活化形式的催化亚基在ATP的作用下,使细胞中的相应底物磷酸化,从而改变这些蛋白质的功能:有些被激活,有些则被抑制。例如,糖原分解过程中的磷酸化酶可在A激酶的作用下被磷酸化而激活(图9-6),而糖原合成酶则在A激酶的作用下被磷酸化而失去活性。总的效应是糖原分解加强和糖原合成的抑制,使血糖浓度升高。
总之,很多多肽和儿茶酚胺类激素的作用是通过下列过程来实现的,即激素与膜受体结合→腺苷酸环化酶活性↑→cAMP水平↑→A激酶被激活→蛋白质发生磷酸化→生理效应发生。
八十年代中期,对腺苷酸环化酶活化机制的研究导致了另外一种重要的调节蛋白桮蛋白的发现。G蛋白在膜受体和腺苷酸环化酶间具有中介作用。它的发现使我们更为深入地认识了激素的作用机理(详见第十二章)。
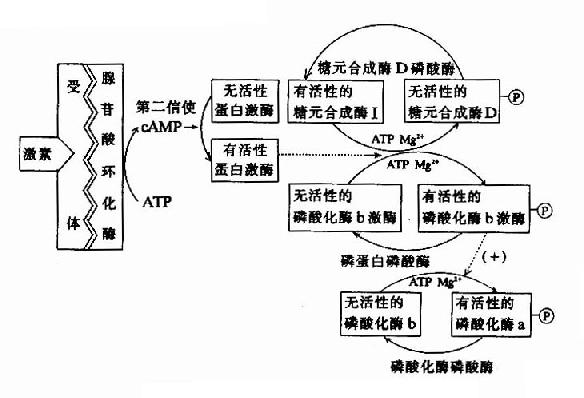
图9-7 激素调节糖原代谢的连续激活反应
第三节 物质代谢的整体调节
机体内各种组织器官和各种细胞在功能上都不会独立于整体之外,而是处于一个严密的整体系统中。一个组织可以为其它组织提供底物,也可以代谢来自其它组织的物质。这些器官之间的相互联系是依靠神经-内分泌系统的调节来实现的。神经系统可以释放经递质来影响组织中的代谢,又能影响内分泌腺的活动,改变激素分泌的状态,从而实现机体整体的代谢协调和平衡。图9-8、图9-9和图9-10分别展示了在早期饥饿、饥饿和饱食情况下机体的代谢调节过程。在早期饥饿时,血糖浓度有下降趋势,这时肾上腺素和糖皮质激素的调节占优势,促进肝糖原分解和肝脏糖异生功能,在短期内维持血糖浓度的恒定,以供给脑组织和红细胞等重要组织对葡萄糖的需求。若饥饿时间继续延长,则肝糖原被消耗饴尽,这时糖皮质激素也参与发挥调节作用,促进肝外组织蛋白分解为氨基酸,便于肝脏利用氨基酸、乳酸和甘油等物质生成葡萄糖,这在一定程度上维持了血糖浓度的恒定;这时,脂动员也加强,分解为甘油和脂肪酸,肝脏将脂肪酸分解生成酮体,酮体在此时是脑组织和肌肉等器官重要的能量来源。在饱食情况下,胰岛素发挥重要作用,它促进肝脏合成糖原和将糖转变为脂肪,抑制糖异生;胰岛素还促进肌肉和脂肪组织的细胞膜对葡萄糖的通透性,使血糖容易进入细胞,并被氧化利用。
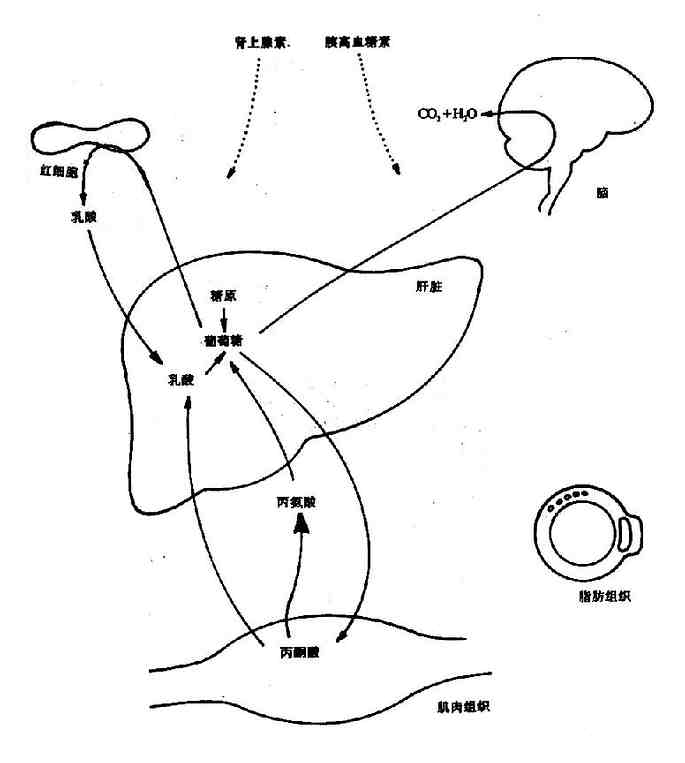
图9-8 早期饥饿情况下机体主要组织间代谢联系
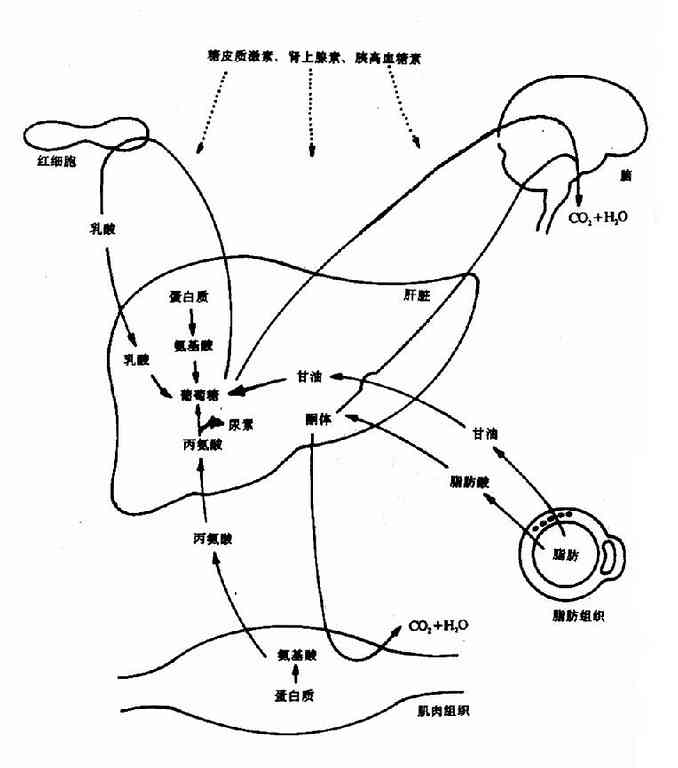
图9-9 饥饿情况下机体主要组织间代谢联系
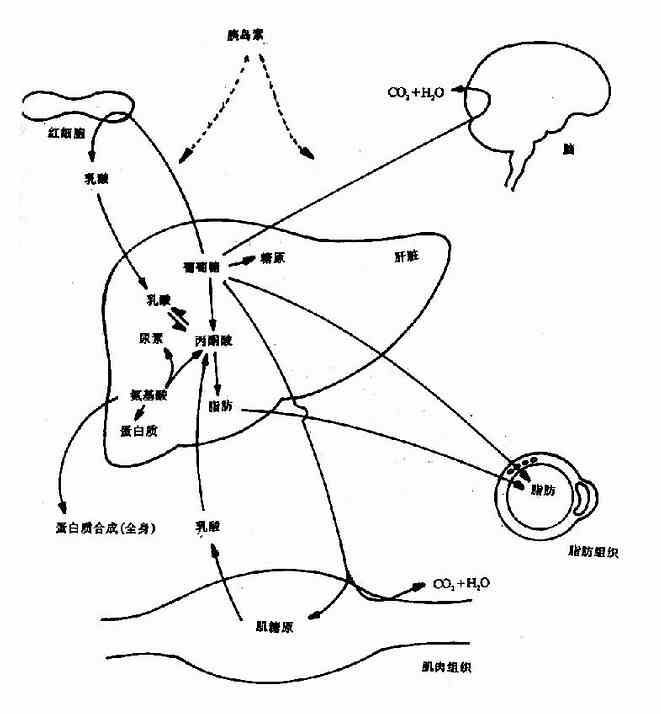
图9-10 饱食情况下机体主要组织间代谢关系
第十章 血浆蛋白与凝血
血液由有形成分红细胞、白细胞和血小板,以及无形的液体成分血浆(plasma)组成。血液凝固后析出淡黄色透明液体,称为血清(serum)。血清与血浆的区别在于血清中没有纤维蛋白原,但含有一些在凝血过程中生成的分解产物。
生理情况下,血液经血管在全身不断流动,转运各种物质与组织之间。血浆,组织间液以及其它细胞外液共同构成机体的内环境。因此血液在沟通内外环境,维持内环境的相对稳定(如pH、渗透压、各种化学成分的浓度等),物质的运输(营养物、代谢产物、代谢调节物),免疫防御及凝血与抗凝血作用等方面都起着重要作用。
第一节 血浆蛋白质
血浆蛋白是血浆中最主要的固体成分,含量为60~80g/L,血浆蛋白质种类繁多,功能各异。用不同的分离方法可将血浆蛋白质分为不同的种类。最初用盐析法只是将血浆蛋白分为白蛋白和球蛋白,后来用分段盐析法可细分为白蛋白、拟球蛋白、优球蛋白和纤维蛋白等组分。用醋酸纤维薄膜电泳法可分为白蛋白、α1球蛋白、α2球蛋白、β-球蛋白和γ-球蛋白等5条区带,而用分辨力较高的聚丙烯酰胺凝脉电泳法则可分为30多条区带。用等电聚焦电泳与聚丙烯酰胺电泳组合的双向电泳,分辨力更高,可将血浆蛋白分成一百余种。目前临床较多采用简便快速的醋酸纤维薄膜电泳法,所获得的血浆蛋白种类及正常含量见表10-1。
表10-1 血浆蛋白的种类、生成部位、主要功能和正常含量
| 血浆蛋白种类 | 生成部位 | 主要功能 | 正常含量 (克/100毫升血浆) |
||
| 白蛋白 | 肝脏 | 维持血浆渗透 压、运输、营养 |
|||
| 3.8-4.8 | |||||
| α球蛋白 | α1球蛋白 | 主要在肝脏 | 运输 | 1.5-3.0 | |
| α2球蛋白 | |||||
| β球蛋白 | 大部分在肝脏 | 运输 | |||
| γ球蛋白 | 主要在肝外 | 免疫 | |||
| 纤维蛋白原 | 肝脏 | 凝血 | 0.2-0.4 | ||
近年来已知的血浆蛋白质有二百多种,有些蛋白质的功能尚未阐明。将其中主要的血浆蛋白质含量及功能归纳如表10-2。
表10-2 血浆蛋白各组分的名称、浓度及生物学活性
| 名称 | 符号 | 正常血浆中浓度(毫克/100毫升) | 生物学活性 |
| 白蛋白: | |||
| 前白蛋白 | PA/Pre-AL | 28-35 | 结合甲状腺素 |
| 白蛋白 | AIb | 4,200±700 | 维持血浆胶体渗透压、运输、营养 |
| α1球蛋白: | |||
| α脂蛋白(HDL) | aLP | 217-270 | 磷酯、甘油三酯、胆固醇、脂溶性维生素的运输 |
| α1酸性糖蛋白 | α1AGP | 75-100 | 又称乳清类粘蛋白、感染初期活性物质,抑制黄体酮 |
| α1抗胰蛋白酶 | α1AT | 210-500 | 抗胰蛋白酶和糜蛋白酶 |
| 运钴胺素蛋白Ⅰ | 与维生素B12结合 | ||
| 运皮质醇蛋白 | TSC | 5-7 | 运输皮质醇 |
| 甲胎蛋白 | AFP | 0.5-2.0×10-3 | ? |
| α2球蛋白: | |||
| α2神经氨酸糖蛋白 | C1s I | 24±10 | 抑制补体第一成分C1s |
| (C1s酯酶抑制物) | 酯酶的抑制物 | ||
| 甲状腺素结合球蛋白 | TBG | 1-2 | 和甲状腺素(T4)结合 |
| α2HS糖蛋白 | α2HS | ? | 炎症时被激活 |
| 铜兰蛋白 | CP | 27-63 | 有氧化酶活性,与铜结合,参与铜的代谢,急性时权反应物 |
| 凝血酶原 | 5-10 | 参加凝血作用 | |
| α2巨球蛋白 | α2M | 200±60 | 抑制纤溶酶和胰蛋白酶,活化生长激纱和胰岛素,也可和其它低分子物质结合,急性时相反应物 |
| 胆硷酯酶 | ChE | 1±0.2 | 水解乙酰胆碱 |
| 缚珠蛋白(结合珠蛋白) | Hp | 100(30-190) | 和Hb结合 |
| 血管紧张素原 | 使血管收缩,升高血压;促进醛固 | ||
| 红细胞生成素 | 酮分泌促进RBC生成 | ||
| α2脂蛋白(VLDL) | α2Lp | 28-71(随年龄性别而异) | 运输脂类(主要是甘油三酯)、脂溶性维生素和激素 |
| β球蛋白: | |||
| β脂蛋白(LDL) | βLp | 219-340(随年龄性别而异) | 运输脂类(胆固醇、磷脂等)脂溶性维生素、激素 |
| 运铁蛋白 | Tf | 250±40 | 运输铁、抗菌、抗病素 |
| 运血红素蛋白 | Hpx | 80-100 | 与血红素结合 |
| C反应蛋白 | CRP | <1.2 | 与肺炎球菌的C多糖起反应 |
| 运钴铵素蛋白Ⅱ | 与维生素B12结合 | ||
| 纤溶酶原 | Pm | 30±2 | 有纤溶酶活性 |
| 纤维蛋白原 | Fib | 350(200-00) | 凝血因子Ⅰ,急性时相反应物 |
| γ球蛋白: | |||
| 免疫球蛋白A | IgA | 247±87 | 抗体活性,分泌型抗体 |
| 免疫球蛋白D | IgD | 3(0.3-40) | 抗体活性 |
| 免疫球蛋白E | IgE | 0.033 | 反应素活性 |
| (0.01-0.13) | |||
| 免疫球蛋白M | IgM | 146±56 | 抗体活性 |
| 免疫球蛋白G | IgG | 1280±260 | 抗体活性 |
血浆蛋白质多种多样,各种血浆蛋白有其独特的功能,除按分离方法分类外。目前亦采用功能分类法。可分为以下8类:①凝血系统蛋白质,包括12种凝血固子(除Ca2+外)。②纤溶系统蛋白质,包括纤溶酶原、纤溶酶、激活剂及抑制剂等。③补体系统蛋白质。④免疫球蛋白。⑤脂蛋白。⑥血浆蛋白酶抑制剂,包括酶原激活抑制剂、血液凝固抑制剂、纤溶酶抑制剂、激肽释放抑制剂、内源性蛋白酶及其他蛋白酶抑制剂。⑦载体蛋白。⑧未知功能的血浆蛋白质。
血浆蛋白质具有以下共同特征:
1.血浆蛋白质绝大部分由肝脏合成。除γ球蛋白由浆细胞合成,内皮细胞合成少量血浆蛋白质外。
2.血浆蛋白质为分泌型蛋白质。在与肉质网结合的多核糖体(pllyribosome)上合成,分泌入血浆前经历了剪切信号肽、糖基化、磷酸化等翻译后修饰加工过程,成为成熟蛋白质。
3.血浆蛋白质几乎都是糖蛋白,含有N-或O-连接的寡糖链。仅白蛋白、视黄醇结合蛋白和C-反应蛋白等少数不含糖。糖链可参与血浆蛋白分子的三级结构的形成,具有多种功能。
4.各种血浆蛋白质都具有其特征性的循环半衰期。
5.许多血浆蛋白质有多态性(polymorphism)。多态性指在同种属人群中,有两种以上,发生频率不低于1%的表现型。最典型的是ABO血型物质。此外,α1抗胰蛋白酶、结合珠蛋白、铁转运蛋白、血浆铜蓝蛋白等都显示多态性。研究血浆蛋白多态性对遗传学及临床医学均有重要意义。
6.当急性炎症或组织损伤时,某些血浆蛋白水平增高。这些血浆蛋白被称为急性期蛋白质(acute phaseprotein)。包括C反应蛋白(CRP)、α1抗胰蛋白酶、α2酸性糖蛋白及纤维蛋白原等。急性期蛋白在人体炎症反应中发挥一定作用。
血浆蛋白的主要功能可归纳为以下几个方面:
1.维持血浆胶体渗透压。主要靠血浆白蛋白,因其含量多而分子小,血浆胶体渗透压的75~80%由它维持。
2.调节血浆pH值,维持酸碱平衡。血浆蛋白的等电点大部分在pH4~6,血浆中蛋白多以负离子形式存在,以
![]() (Pr表示血浆蛋白)形式构成血浆中的缓冲对。
(Pr表示血浆蛋白)形式构成血浆中的缓冲对。
3.运输 血浆蛋白中许多组分具有运输功能,可送输营养物质、代谢物、激素、药物及金属离子等。
4.凝血和抗凝血作用。各种凝血因子及抗凝血因子在减少出血,防止循环阻塞中发挥重要作用。
5.免疫作用,抵御感染。主要靠抗体和补体系统发挥作用。
一、白蛋白
人血浆白蛋白(albumin)是人血浆含量最多的蛋白质,约45g/L,占血浆总蛋白的60%。肝脏每天合成12g白蛋白,占肝脏分泌蛋白的50%。人血浆白蛋白基因位于第4号染色体上,其初级翻译产物为前白蛋白原(preproalbumin)。在分泌过程中切除信号肽,生成白蛋白原(proalbumis)。继而在高尔基氏体经组织蛋白酶B切除N末端的一个6肽片断(精-甘-缬-苯丙-精-精),成为成熟的白蛋白。由585个氨基酸组成的一条多肽链,含17个二硫键,分子量约为69,000。白蛋白的分子呈椭园形,其长短轴分别为150和38,较球蛋白和纤维蛋白原分子对称,故白蛋白粘性较低。白蛋白等电点为pH4.7,比血浆蛋白其他组分的PI低,所以在常用的弱碱性电泳缓冲液中所带负电荷多,加之分子量小,故电泳迁移速度快。
血浆白蛋白主要有两方面生理功能:①维持血浆胶体渗透压。因血浆中白蛋白含量最高,且分子量较小,故血浆中它的分子数最多。因此在血浆胶体渗透压中起主要作用,提供75-80%的血浆总胶体渗透压。②与各种配体(ligands)结合,起运输功能。许多物质如游离脂肪酸、胆红素、性激素、甲状腺素、肾上腺素、金属离子、磺胺药、青霉素G、双香豆素、阿斯匹林等药物都能与白蛋白结合,增加亲水性而便于运输。
二、金属结合蛋白
1.结合珠蛋白(haptoglobin;Hp)是一种血浆糖蛋白,分子量约为90.000。能与红细胞外血红蛋白(Hb)结合形成紧密的非共价复合物Hb-Hp。每100ml血浆中具有足以结合40?80mg血红蛋白的Hp。每天降解的Hb约有10%释入血循环中,成为红细胞外游离的Hb,Hb与Hp结合成Hb-Hp复合物后分子量可达155.000,不能透过肾小球,从而防止游离血红蛋白从肾脏丢失,避免Hb所含铁的丢失。保证铁再用于合成代谢。
溶血性贫血患者血浆结合珠蛋白浓度下降。由于溶血时大量的Hb释出,Hp与游离Hb结合成复合物而被肝细胞摄取、清除。此外,Hp也是一种急性期蛋白,患各种炎症时其血浆中含量升高。
2.铁转运蛋白(transferrin;Tf) 铁转运蛋白属β球蛋白。是由肝脏内合成的糖蛋白,分子量约80.000。具高度多态性,目前已发现20多种不同类型的Tf。每分子Tf可结合2分子的Fe3+。铁转运蛋白的生理功能是将铁运送到需要铁的组织与细胞。每天血红蛋白分解代谢,释出25mg左右的铁。游离铁有毒性,它与Tf结合后不仅毒性降低而且还将铁运送到需铁部位。铁是许多含铁蛋白质生物活性的发挥所必不可少的,如血红蛋白、肌红蛋白、细胞色素、过氧化物酶等。因此,任何生长、增殖细胞的膜上都有铁转运蛋白的受体。携带Fe3+的Tf与受体结合后经内吞作用进入细胞内,供细胞内合成利用。
三、铜蓝蛋白(ceruloplasmin;Cp)
铜蓝蛋白(ceruloplosminCp)属α2球蛋白。也是由脏脏合成的一种糖蛋白、分子量为160,000,由8个分子量1.8万的亚基组成。每分子Cp可牢固地结合6个铜离子,并因携铜而呈蓝色。Cp除作为铜的载体外,还具有氧化酶的活性,可将Fe2+氧化为Fe3+,利于铁掺入铁转运蛋白,促进铁的运输。
正常人体内含铜约100?50mg,主要位于骨、脏脏和肌肉中。血浆中的铜90%由Cp转运,10%与白蛋白结合而送输。成人每日摄取铜2mg,主要在小肠上段吸收,同白蛋白结合送输到肝,即掺入肝细胞合成Cp。部分铜可从胆汁中排出。肝病时铜蓝蛋白合成减少,血浆Cp含量降低。肝豆状核变性(wilso病)是一种遗传病,可能因为肝细胞溶酶体不能将来自铜蓝蛋白的铜排入胆汁,导致铜在肝、肾、脑及红细胞中聚积,发生铜中毒。肝中铜含量增加,抑制铜和Cp结合,血中Cp含量下降(<20mg/dl)。可出现溶血性贫血、慢性肝病,以及神经系统症状。由于角膜内铜的沉着,在角膜周围出现绿色或金黄色的色素环,称为KayseFleischer环,是肝豆状核变性的一种特征性改变,具有诊断价值。减少铜摄入,服用D青霉胺鳌合铜离子,可对肝豆状核变性进行治疗。
第二节 血液凝固
血液的可凝固性质对机体有重要保护作用。当血管系统受伤时,必须迅速可靠地封闭起来,以尽可能减少出血。血小板变形(粘性变态)参于封闭作用,此种封闭作用要靠纤维蛋白凝结物的支持,而后者的形成是多种凝血因子相互作用,发生一系列酶促反应的结果。目前已发现的凝血因子有14种(表10-3)。
这些凝血因子除Ca2+外均为蛋白质,大多是由肝脏合成的血浆糖蛋白,它们大多属蛋白水解酶类。有7种为蛋白酶原,在凝血过程中被激活。无活性的凝血因子用罗马数码表示,其活性型以附加的下角码a字来表示。
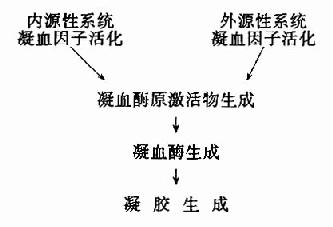
图10-1 血液凝固过程
一、血液凝固的机理
血液凝固的化学本质是溶胶状态的纤维蛋白原转变为凝胶状态的纤维蛋白,催化此反应的主 要是凝血酶。而正常血液中以无活性的凝血酶原形式存在,在一定条件下被激活而成为凝血酶。凝血酶原激活物是由活化的凝血固子与磷脂胶粒和钙形成的复合物。因此,凝血因子的活化是导致血液凝固的触发机制。据触发凝血过程的方式不同,又有内源性(intrinsic)与外源性(extrinsic)凝血之分。内源性凝血指因心血管内膜受损或血液抽出体外接触异物表面而触发的,仅有血管内凝血因子参与的凝血过程;而外源性凝血则指有受损组织释放的组织凝血活素所参与的凝血过程。血液凝固过程的梗概可图解如下:(图10-1)
二、凝血酶原激活物的生成
凝血酶原激活物由活化的凝血因子Xa、Va、Ca++及磷脂胶粒构成的复合体。因子X被激活为Xa是此过程的关键步骤。因子X的激活有两条途径:即内源性和外源性途径。
表10-3 凝血因于命名及其部分特性
| 凝血因子 | 同义名 | 合成场所 | 分子量 | 亚基数目 | 含糖量% | 血浆浓度mg% | 衍生物 | 功能 |
| Ⅰ | 纤维蛋白原(Fibrinogen) | 肝 | 340,000(人,牛) | 3×2 | 3-4 | 200-400 | 纤维蛋白 | 形成凝胶 |
| Ⅱ | 凝血酶原(Prothrombin) | 肝 | 68,700(人) 72,000(牛) |
1 | 8.2(人) 10-14(牛) |
10-15 | 凝血酶 | 蛋白酶 |
| Ⅲ | 组织凝血活素(Tissue Thromboplastin) | 各组织细胞 | 330,00 220,000(牛) |
辅因子 | ||||
| Ⅳ | 钙离子(Calcium Ion) | 辅因子 | ||||||
| Ⅴ | 前加速素(Proaccelerin) | 肝 | 290,000-400,000 | 多聚 | 11-18 | 5-10 | Ⅳ(Va) | 辅因子 |
| Ⅶ | 血清凝血活酶转变加速素(Convertin)又称SPCA) | 肝 | 63,000(人) | 1 | 9.1 | 0.4-0.7 | Ⅶa | 蛋白酶 |
| Ⅷ | 抗甲种箇以病球蛋白(Antihemotpilic Globulin简写AHG) | 肝为主 | 1,100,000(人,牛) | ? | 6(人) 9(牛) |
15-20 | Ⅷa | 辅因子 |
| Ⅸ | 血浆凝血活素成分(Plasma Thromboplastin简写PTC)又名抗乙种血友病因子 | 肝 | 55,400(人,牛) | 1 | 26 | 3-5 | Ⅸa | 蛋白酶 |
| Ⅹ | Stuart-Prower因子 | 肝 | 55,000(人,牛) | 1 | 10 | 5-10 | Ⅹa | 蛋白酶 |
| Ⅺ | 血浆凝血活素前质(Plasma Thro mboplastin Antecedent简写PTA)又名抗丙种血友病因子 | 肝?网状内皮系统? | 160,000(人,牛) | 2 | 12 | 0.5-0.9 | Ⅺa | 蛋白酶 |
| Ⅻ | 接因子(Hageman因子) | 网状内皮系统? | 90,00(牛) 82,000(人) |
3 | 15 | 0.1-0.5 | Ⅻa | 蛋白酶 |
| XⅢ | 纤维蛋白稳定因子(Fibrin Stabilizing Factor简写FSK) | 血水板?肝? | 320,000(血浆) 146,000-165,000 (血小板) |
5(血浆) | 1-2 | Ⅻa | 形成桥键 | |
| 前激肽释放酶(Prekallidrein) | 肝 | 80,000 | 1 | 10 | 1-2 | 激肽释放酶 | 蛋白酶 | |
| 高分子量激肽原(High Molecular Weight Kininogen HMWK) | 110,000-15,000 | 1 | ? | 7 | 缓激肽 | 辅因子 |
罗马数字后的a表示活化的意思(activated),因子Ⅵ实际上就是Ⅴa。
(一)内源性途径
内源性途径涉及多种凝血因子活化,可分为二步:
1.接触活化 是因子Ⅻ,也称Hagemann因子的激活作用。此蛋白质在接触到荷负电的表面,如玻璃或在体内接触到胶原蛋白时,发生构象改变,激活的因子Ⅻa为一蛋白酶,能将激肽释放酶原转变为激肽释放酶,又可活化因子Ⅻ,形成一个正反馈。同时因子Ⅻa还可激活下一个因子Ⅺ,将它转变为Ⅺa。此外,在Ⅻ因子活化中还有高分子量激肽原(high molecular weightkininogen,HMWK)的参与(图10-2)。
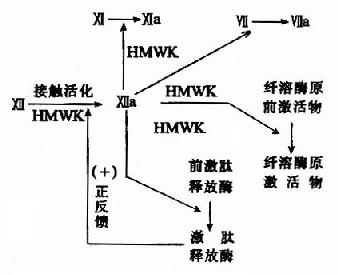
图10-2 内源性凝血的接触活化阶段
2.磷脂胶粒反应阶段:活化的Ⅻ即Ⅻa作用于因子Ⅺ,在Ca++的存在下水解因子Ⅺ产生Ⅺa,因子Ⅺa无酶活性,但可使因子X的活化反应速度提高1000倍。活化的因子X(即Xa)及凝血酶都有激活因子Ⅷ和Ⅴ的作用。活化的因子Xa、Va和Ca++结合在磷脂胶粒上形成凝血酶原激活物。磷脂胶粒是由血小板提供的富含丝氨酸磷脂的脂蛋白,对凝血因子和Ca++有较强的亲和力,从因子Ⅺ的活化到凝血酶原激活物的生成一系列反应均在磷胶胶粒上进行,故称磷脂胶粒反应阶段。(图10-3)
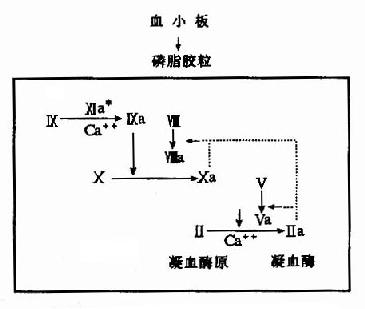
图10-3 内源性凝血的磷脂胶粒反应阶段
(*主要在外源性凝血中起作用因子Ⅶa亦可使因子活化·虚线……示正反馈回路)
(二)外源性途径
组织损伤后释放因子Ⅲ(组织凝血活素),它是一种脂蛋白,在脑、肺、胎盘等组织中含量最丰富,它的磷脂部分类似血小板所提供的磷脂胶粒,能把血浆中凝血因子Ⅶ和X通过Ca++桥而结合在其表面上。因子Ⅶ可由Ⅻa和凝血酶激活、亦可被Xa激活、Ⅶa可激活因子X产生Xa,而组织凝血活素的蛋白部分可使此反应加速16,000倍。未活化的因子Ⅶ也具有催化作用,但仅有Ⅶa的2%(图10-4)。
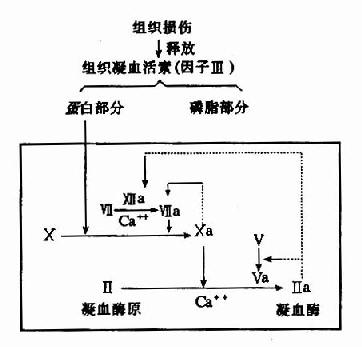
图10-4 外源性凝血中凝血酶原激活物的生成及凝血酶生成(虚线示正反馈回路)
三、凝血酶原的激活
凝血酶原(Ⅱ,prothrombin)是含582氨基酸残基的酶原,被因子Xa在Arg-Thr及Arg-Ile处切开,切除N端274个氨基酸残基,余下308个氨基酸残基分成A、B两条肽链,由一个二硫键相连,即为凝血酶(thrombin)。(图10-5)因子Va无酶活性,但可使Xa的活性增强350倍,加速凝血酶的生成。磷脂胶粒与酶(Xa)和底物(凝血酶原)之间借Ca++作为桥相连。因凝血酶原肽链的N未端含有10个γ羧基谷氨酸残基。相邻的羧基可与Ca++形成复合体。另一方面,Ca++又可与磷脂中磷酸基结合,这样使Xa和Va与凝血酶原接触在一起,于是Xa将凝血酶原水解为凝血酶(图10-6)。
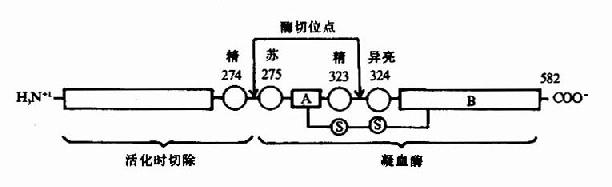
图10-5 因子Xa激活凝血酶原示意图
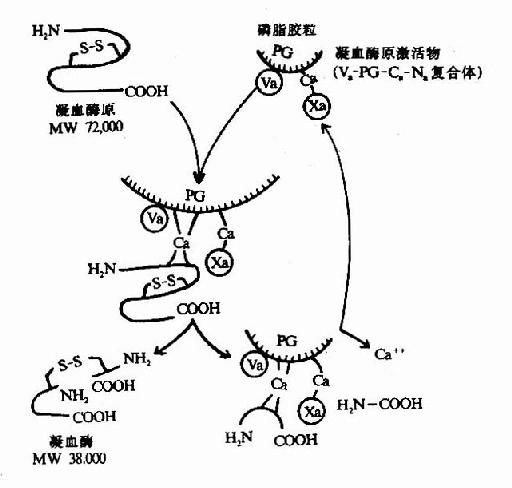
图10-6 凝血酶的生成
凝血酶原及因子Ⅶ、Ⅺ、Ⅹ均由肝合成,合成过程中需要维素K作为辅因子。缺乏Vitk则生成异常凝血酶原,只有正常活性的1?%。研究表明Vitk参与凝血酶原γ羧基谷氨酸的生成。Vitk参与羧基化的机理为:氢醌型Vitk在酶的催化下夺去γC上的一个质子,使γ-C呈阴离子,而和CO2结合。2,3环氧Vitk则在酶催化下被硫辛酸还原而重复利用,因而Vitk在此羧化反应中起辅酶的作用。(图10-7)
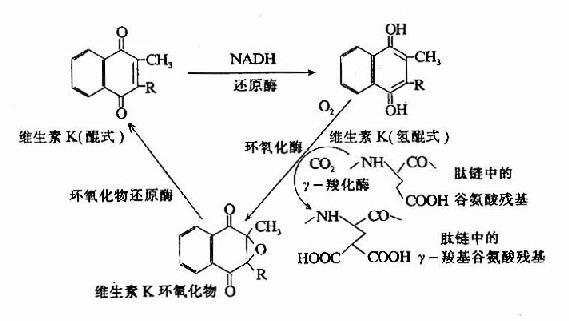
图10-7 维生素K在谷氨酸残基r-羧化反应中的作用(维生素K循环)
四、纤维蛋白原转变为纤维蛋白
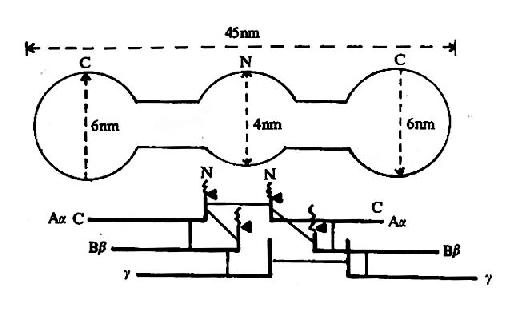
图10-8 纤维素蛋白原分子示意图
上半为电镜下的分子形状 下半示6条多肽链,
一为双硫键,▲为凝血酶作用点
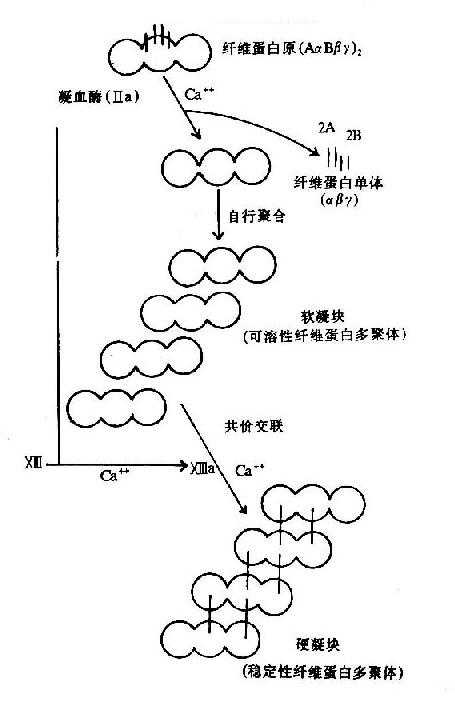
图10-9 纤维素蛋白凝胶的生成
血液凝固的实质是纤维蛋白凝胶的生成,它是血浆中纤维蛋白原(fibrinogen)在凝血酶作用下降解为纤维蛋白并聚合成不溶性的网状结构。
纤维蛋白原分子由两对α链、β-链及γ-链组成,每3条肽链(α、β、γ)绞合成索状,形成两条索状肽链,在N末端有二硫键使态个分子得到稳定。α及β肽链的N-端分别有一段16个及14个氨基酸的小肽,称为纤维肽A及B。因此,纤维蛋白原可写为(AαBβγ)2(图10-8)。
凝血酶的本质为一种蛋白水解酶,能特异性作用于Aα和Bβ链上的精-甘肽键。切除A、B纤维肽。因纤维肽A及B均为酸性肽,带较多负电荷。由于电荷排斥作用阻碍纤维蛋白原之间聚合。切除纤维肽A及B转变为纤维蛋白后负性减小,同时暴露了互补结合位点,有利于自动聚合,纤维蛋白单位通过边靠边、端靠端的聚合形成聚合链。此种多聚体不稳定,称为软凝块(soft clot)。它再通过因子XⅢa的作用结成牢固的网。因子XⅢa为转肽酶,能催化一个单体的谷氨酸残基的γ-羧基与另一单体的赖氨酸残基的氨基之间形成共价结合,其间释出NH3(图10-9,10)。因此,因子XⅢa称为纤维蛋白稳定因子(fibrin stabilizingfactor,FSF)。因子XⅢ存在于血小板及血浆中,经凝血酶切除部分肽段后被激活为XⅢa。
由此产生的稳定纤维蛋白网与软凝块不同,它们在5M的脲及1%氯乙酸溶液中不溶解。在血小板的血栓收缩蛋白作用下,此网状结构收缩,于是伤口边缘彼此靠近,易于伤口闭合。成纤维细胞的表面带有一种类似纤维蛋白的蛋白质,称粘连蛋白,它由Ⅻa催化与纤维蛋白结成网。并将纤维蛋白固定下来。所以,因子Ⅻa还直接参与伤口的愈合。
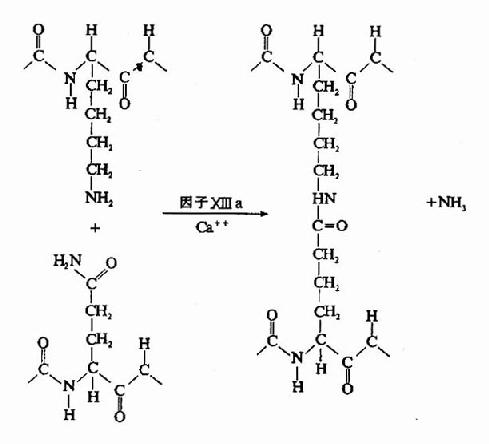
图10-10 因子XⅢa作用机理
总结上述凝血过程可归纳出以下特点:
1.凝血因子的活化本质上为蛋白质的有限水解,而许多凝血因了本身既是蛋白酶,又是酶作用的底物。这些本质为蛋白酶的凝血因子(Ⅱ、Ⅵ、Ⅺ、Ⅹ、Ⅻ)的氨基酸顺序很相似,与许多丝氨酸蛋白酶同源;活性中心的丝氨酸残基参与肽键的水解。C-端约250个氨基酸残基同源性很高,是具有催化活性的结构域。而N端的氨基酸序列变化较大,决定各凝血因子作用底物的专一性。它们催化的反应需Ca++和磷脂参加。
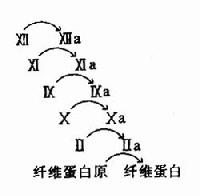
图10-11 血液凝固的瀑布效应
2.磷脂胶粒(内源性途径由血小板,外源性途径由组织凝血活素提供)使活化反应在胶粒表面进行,大大提高反应速度,而Ca++的作用在于促进酶和底物与磷脂表面的结合。
3.凝血因子活化呈瀑布效应(cascade)使血液凝固具有高效率和精密调控的特征。如图10-11所示。
4.维生素K在内、外源性凝血中均有重要作用。
5.凝血过程中的正反馈使反应不断加速,但终产物纤维蛋白有抗凝血作用。机体内凝血与抗凝血是密切联系的。
五、凝血作用的调节
由上所述,凝血过程是一个级联放大的瀑布效应,加之正反馈作用,可把最初生成的酶活性极大增强,把所有步骤加起来可增强106倍。如此高的激活速度会对机体构成危险,就是说,此过程一旦启动,整个血液就会凝固起来。此外,血凝可造成心肌梗死、脑血栓等严重疾病。因此,机体内的凝血作用必须保持适度。实事上,血浆及血管内皮等处存在着多种抗凝物质,凝血过程中生成的纤维蛋白(抗凝血酶Ⅰ)有强烈吸附凝血酶的作用。血浆中抗凝血蛋白(antithrombin抗凝血酶Ⅲ)是一种分子量约58,000的糖蛋白,能与具有蛋白酶作用的凝血因子(Ⅱa、IXa、Xa、Ⅺa、Ⅻa)以1:1分子比结合形成复合物,从而封闭酶的活性中心。肝素(heparin)能加速复合体的形成,使抗凝血酶的活性提高数百倍。肝素是由肥大细胞和嗜碱性粒细胞产生的高分子酸性粘多糖,是一种重要抗凝血物质、除上述作用外,尚具有抑制血小板的粘附、集聚,从而影响血小板磷脂的释放等作用。肝素作为抗凝剂已广泛应用于临床。
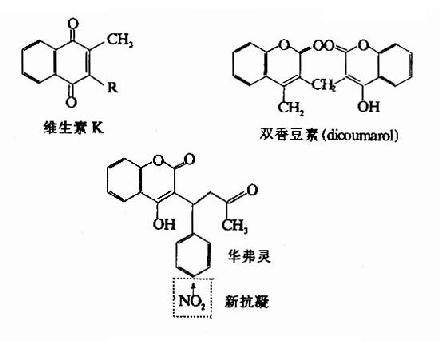
图10-12 几种抗凝物质结构
血浆中还存在另一种抗凝血的蛋白质桟蛋白。含Gla残基,是分子量约62,000的糖蛋白,以酶原形式存在,被凝血酶激活后能水解Ⅴa及Ⅶa,从而发挥抗凝血功能。先天性缺乏C蛋白者,往往在婴儿期即死于广泛的血栓。
除天然存在于血浆中的抗凝物质外,临床上常用一些人工抗凝剂如草酸盐和柠檬酸盐,它们的作用是通过螯合去除Ca。此外还有双香豆素类化合物能拮抗Vitk,而发挥抗凝血作用(图10-12)。
六、纤维蛋白溶解
血液凝固所产生的纤维蛋白可被血浆中纤维蛋白溶酶系统重新溶解,对于防止血栓形成和保持血流通畅具有重要意义。正常人的一些分泌液(如乳汁、唾液、泪液、子宫及阴道分泌物、精液等)中均含有纤维蛋白溶酶原(plasminogen)激活物,激活纤维蛋白溶解过程,随时清除分泌管道内的纤维蛋白,以保持分泌管道的通畅及月经血液的流动性。
(一)纤维蛋白溶解机理
纤维蛋白溶解(fibrinolysis)过程可分为二相,即纤维蛋白酶原激活和纤维蛋白溶解。
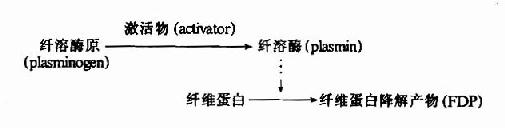
1.纤维蛋白酶原的激活
(1)纤维蛋白酶原激活物:
血液中纤维蛋白酶(plasmin,简称纤溶酶)以纤溶酶原形式存在,只有在纤溶激活物作用下转变为纤溶酶才具有活性。纤溶激活物可分为组织激活物和血液激活物两大类。
组织激活物主存在于组织细胞溶酶体中,以子宫、前列腺、甲状腺、肺、肾等含量较多。其中研究的最好的是肾中的尿激酶(urokinase),因其可少量出现在尿液中而得名。对肾小管血栓的溶解具有重要作用。
血液激活物主要来自静脉、微静脉的血管内皮细胞。在受到某些刺激(如剧烈运动、情绪紧张、创伤、休克等)时,可促使内皮细胞合成增多并释放入血。已知血小板释放5桯T对血管内皮细胞释放纤溶激活物具有重要意义。
此外,由溶血性链球菌提取的一种蛋白质称为链激酶(streptokinase),能与纤溶酶原形成复合物,后者具有纤溶激活物的性质。尿激酶和链激酶目前已广泛应用于临床溶栓治疗。
(2)纤溶酶原的激活
纤溶酶原为分子量86,000的蛋白。纤溶激活物均为蛋白水解酶,能水解纤溶酶原使之在肽链的ArgVal间切断而活化生成纤溶酶。纤溶酶本身亦可活化纤溶酶原,同时还可水解纤维蛋白原、因子Ⅴ、Ⅶ、IX和Ⅻ等,从而抑制凝血。
2.纤维蛋白的溶解
纤维蛋白的溶解过程是分步进行的,首先被纤溶酶水解释出A、B、C小分子多肽,留下X片段仍保留凝固特性。X片断进一步水解为片断D和Y,Y再水解为D和E片断。(图1013)最终分解产物为A、B、C、D、E五种片段。这些片断统称为纤维蛋白降解产物(fibrin degradationproduct,FDP)。FDP的生理作用是:片断X,Y可与纤维蛋白单体聚合,抑制多聚体的生成;片断D可直接抑制纤维蛋白单体的聚合;片断Y、E则可竞争抑制凝血酶。而且,大部分FDP可干扰血小板的粘附、聚集。可见FDP在抗凝中有重要作用。
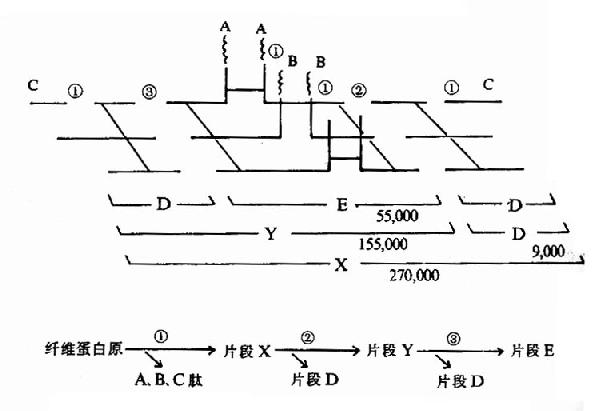
图10-13 纤溶酶对纤维蛋白(原)的降解(片段下的数字为分子量)
(二)纤溶抑制物
机体组织和体液广泛存在纤溶抑制物。按其作用可分为:纤溶酶原激活的抑制物;纤溶酶抑制物,又称抗纤溶酶(antiplasmin)。
图10-14 纤维蛋白溶解过程
图10-15 凝血全过程示意图(→示转变或释放;→示催化作用;
除接触活化阶段外,均需Ca++参与,图中未显示)
正常血液中抗纤溶酶活性是纤溶酶活性的20?0倍。故在生理条件下,纤溶酶难以发挥作用。抗纤溶酶有两种:①慢作用的抗纤维酶,属α1抗胰蛋白酶,分子量为45,000,可与纤溶酶形成牢固的复合物。②快作用抗纤溶酶,属α2巨球蛋白,分子量80,000,是纤溶酶的竞争抑制剂。
血小板中纤溶抑制物是快速作用的抗纤溶酶。在血栓形成早期,血小板纤溶抑制作用大于纤溶激活作用;在血栓生成以后,随着血小板内5桯T的释放,则血管内皮释放血液激活物增多,又引起纤维蛋白溶解,防止血栓继续增长而阻塞血流循环。
因此可见机体内血液凝固、抗凝、纤溶与抗纤溶是相互抑制、相互协调、共同维护血液系统的正常生理功能,其相互关系可见图10-14~17。
图10-16 凝血与纤溶的比较
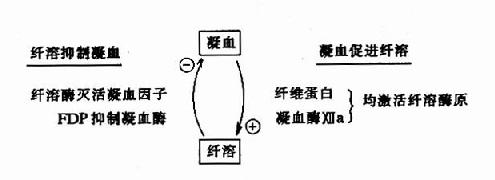
图10-17 凝血与纤溶的相互关系
第三节 红细胞的代谢
一、血红素的生物合成
成熟红细胞中,血红蛋白(hemoglolin,Hb)占红细胞内蛋白质总量的95%,它是血液运输O2的最重要物质,和CO2的送输亦有一定关系。血红蛋白是由4个亚基组成的四聚体,每一亚基由一分子珠蛋白(globin)与一分子血红素(heme)缔合而成。由于珠蛋白的生物合成与一般蛋白质相同,因此本节重点介绍血红素的生物合成。
血红素也是其它一些蛋白质,如肌红蛋白(myoglobin),过氧化氢酶(catalase),过氧化物酶(peroxidase)等的辅基。因而,一般细胞均可合成血红素,且合成通路相同。在人红细胞中,血红素的合成从早动红细胞开始,直到网织红细胞阶段仍可合成。而成熟红细胞不再有血红素的合成。
(一)血红素的合成通路(过程)
血红素合成的基本原料是甘氨酸、琥珀酰辅酶A及Fe++。合成的起始和终末过程均在线粒体,而中间阶段在胞液中进行。合成过程分为如下四个步骤:
1.δ-氨基-γ-酮戊酸(δ-aminplevulinicacid,ALA)的生成:在线粒体中,首先由甘氨酸和琥珀酰辅酶A在ALA合成酶(ALa synthetase)的催化下缩合生成ALA。ALA合成酶由两个亚基组成,每个亚基分子量为60,000。其辅酶为磷酸吡哆醛。此酶为血红素合成的限速酶,受血红素的反馈抑制。
2.卟胆原的生成:线粒体生成的ALA进入胞液中,在ALA脱水酶(ALa dehydrase)的催化下,二分子ALA脱水缩合成一分子卟胆原(prophobilinogen,PBG)。ALA脱水酶由八个亚基组成,分子量为26万。为含巯基酶。
3.尿卟啉原和粪卟啉原的生成:在胞液中,四分子PBG脱氨缩合生成一分子尿卟啉原Ⅲ(uroporphyrinogen Ⅲ,UPG Ⅲ)。此反应过程需两种酶即尿卟啉原合酶(uroporphyrinogen synthetase)又称卟胆原脱氨酶(PBGdeaminase)和尿卟啉原Ⅲ同合酶(uroporphyrinogenⅢ cosynthase)。首先,PBG在尿卟啉原合酶作用下,脱氨缩合生成线状四吡咯。再由尿卟啉原Ⅲ同合酶催化,环化生成尿卟啉原Ⅲ。无尿卟啉原Ⅲ同合酶时,线状四吡咯可自然环化成尿卟啉原Ⅰ(UPG-Ⅰ),两种尿卟啉原的区别在于:UPGⅠ第7位结合的是乙酸基,第8位为丙酸基;而UPg Ⅲ则与之相反,第7位是丙酸基,第8位是乙酸基。正常情况下UPG-Ⅲ与UPG-Ⅰ为10000:1。
式中A代表乙酸基,P代表丙酸基
尿卟啉原Ⅲ进一步经尿卟啉原Ⅲ脱羧酶催化,使其四个乙酸基(A)脱羧变为甲基(M),从而生成粪卟啉原Ⅲ(coproporphyrinogen Ⅲ,CPG Ⅲ)。
4.血红素的生成:胞液中生成的粪卟啉原Ⅲ再进入线粒体中,在粪卟啉原氧化脱羧酶作用下,使2、4位的丙酸基(P)脱羧脱氢生成乙烯基(V),生成原卟啉原IX。再经原卟啉原IX氧化酶催化脱氢,使连接4个吡咯环的甲烯基氧化成甲炔基,生成原卟啉IX。最后在亚铁螯合酶(ferrochelatase)催化下和Fe2+结合生成血红素。(图10-18)。
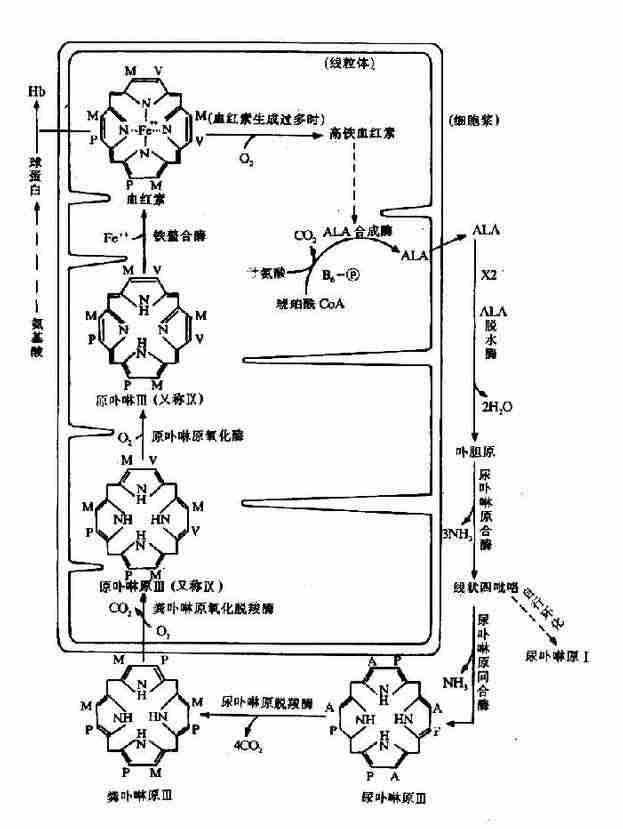
A.乙酸基 P.丙酸基 M.甲基 V.乙烯基
图10-18 血红素的生物合成及其调节
血红素生成后从线粒体转入胞液,与珠蛋白结合而成为血红蛋白。正常成人每天合成6克Hb,相当于合成210mg血红素。
(二)血红素合成的调节
血红素的合成受多种因素的调节,其中主要是调节ALA的生成。
1.ALA合成酶 血红素合成酶系中,ALA合成酶是限速酶,其量最少。血红素对此酶有反馈抑制作用。目前认为,血红素在体内可与阻遏蛋白结合,形成有活性的阻遏蛋白,从而抑制ALA合成酶的合成。此外,血红素还具有直接的负反馈调节ALA合成酶活性的作用。实验表明,血红素浓度为5×10-6M时便可抑制ALA合成酶的合成,浓度为10-5~10-4M时则可抑制酶的活性。正常情况下血红素生成后很快与珠蛋白结合,但当血红素合成过多时,则过多的血红素被氧化为高铁血红素(hematin),后者是ALA合成酶的强烈抑制剂,而且还能阻遏ALA合成酶的合成。
雄性激素——睾丸酮在肝脏5β-还原酶作用下可生成5β-氢睾丸酮,后者可诱导ALA合成酶的产生,从而促进血红素的生成。某些化合物也可诱导ALA合成酶,如巴比妥、灰黄霉素等药物,能诱导ALA合成酶的合成。
2.ALA脱水酶与亚铁螯合酶:ALA脱水酶和亚铁螯合酶对重金属敏感,如铅中毒可抑制这些酶而使血红素合成减少。
3.造血生长因子:目前已发现多种造血生长因子,如多系(multi)一集落刺激因子,中性粒细胞-巨噬细胞集落刺激因子(GM-CSF)、白细胞介素3(IL-3),及促红细胞生成素等。其中促红细胞生成素(erythropoiefin,EPO)在红细胞生长,分化中发挥关键作用。人EPO基因位于7号染色体长臂21区,由4个内含子和5个外显子组成。所编码的多肽由193个氨基酸残基组成。在分泌过程中经水解去除信号肽,成为166个氨基酸的成熟肽。分子量为18398。EPO为一种糖蛋白,由多肽和糖基两部分组成,总分子量为34000。糖基在Epo合成后分泌及生物活性方面均有重要作用。成人血清Epo主要由肾脏合成,胎儿和新生儿主要由肝脏合成。当循环血液中红细胞容积减低或机体缺氧时,肾分泌Epo增加。Epo可促进原始红细胞的增殖和分化、加速有核红细胞的成熟,并促进ALA合成酶生成,从而促进血红素的生成。
此外铁对血红素的合成有促进作用。而血红素又对珠蛋白的合成有促进作用。
血红素合成代谢异常而引起卟啉化合物或其前身体的堆积,称为卟啉症(porphyria)。先天性红细胞生成性卟啉症(congenitalerythropoietic porphyria)是由于先天性缺乏尿卟啉原Ⅲ同合酶,而使线状四吡咯向尿卟啉原Ⅲ的转变受阻,致使尿卟啉原Ⅰ生成增多。病人尿中有大量尿卟啉Ⅰ和粪卟啉Ⅰ出现。
二、成熟红细胞的代谢特点
成熟红细胞不仅无细胞核,而且也无线粒体、核蛋白体等细胞器,不能进行核酸和蛋白质的生物合成,也不能进行有氧氧化,不能利用脂肪酸。血糖是其唯一的能源。红细胞摄取葡萄糖属于易化扩散,不依赖胰岛素。成熟红细胞保留的代谢通路主要是葡萄糖的酵解和磷酸戊糖通路以及2.3一二磷酸甘油酸支路(2,3-biphosphoglycerate,2.3桞PG)。通过这些代谢提供能量和还原力(NADH,NADPH)以及一些重要的代谢物(2,3桞PG),对维持成熟红细胞在循环中约120的生命过程及正常生理功能均有重要作用。
(一)糖酵解
循环血液中的红细胞每天消耗约30g葡萄糖,其中90~95%经糖酵解被利用。一分子葡萄糖经酵解可产生2分子ATP。红细胞中生成的ATP主要用于维持红细胞膜上的离子泵(钠泵、钙泵),以保持红细胞的离子平衡;维持细胞膜可塑性;谷胱甘肽合成及核苷酸的补救合成等。缺乏ATP则红细胞膜内外离子平衡失调,红细胞内Na+进入多于K+排出、Ca++进入增多,红细胞因吸入过多水分而膨大成球状甚至破裂。同时由于ATP缺乏,可使红细胞膜可塑性下降,硬度增高,易被脾脏破坏,造成溶血。
红细胞无氧酵解中生成的NADH+H+是高铁血红蛋白还原酶的辅助因子,此酶催化高铁血红蛋白还原为有载氧功能的血红蛋白。
(二)2,3-二磷酸甘油酸(2,3-BPG)支路
在糖无氧酵解通路中,1,3-二磷酸甘油酸(1,3-BPG)有15~50%在二磷酸甘油酸变位酶催化下生成2,3-BPG,后者再经2,3-BPG磷酸酶催化生成3磷酸甘油酸。经此2,3-BPG的侧支循环称2,3-BPG支路(图10-19)。
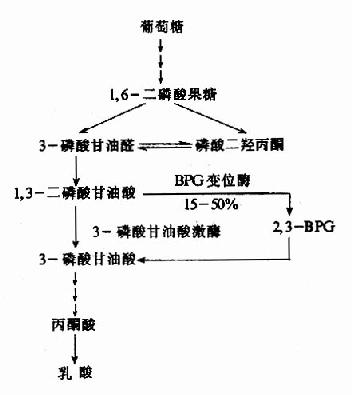
图10-19 2,3-BPG支路
红细胞中2,3-BPG磷酸酶活性远低于BPG变位酶,使2,3-BPG的生成大于分解,因而红细胞中2,3-BPG的浓度处于有机磷酸酯的巅峰,较糖酵解其它中间产物的有机磷酸酯高出数+甚至数百倍(表10-4)。
表10-4 红细胞中各种糖酵解中间产物的浓度(微克分子/升红细胞)
| 糖酵解中间产物 | 动脉血 | 静脉血 |
| 6-磷酸葡萄糖 | 30.0 | 24.8 |
| 6-磷酸果糖 | 9.3 | 3.3 |
| 1,6二磷酸果糖 | 0.8 | 1.3 |
| 磷酸丙糖 | 4.5 | 5.0 |
| 3-磷酸甘油酸 | 19.2 | 16.5 |
| 2-磷酸甘油酸 | 5.0 | 1.9 |
| 磷酸烯醇式丙酮酸 | 10.8 | 6.6 |
| 丙酮酸 | 87.5 | 143.2 |
| 2,3-DPG | 3400 | 4940 |
2,3-BPG能特异地与去氧血红蛋白(deoxy Hb)结合,2,3-BPG进入血红蛋白α2β2四聚体中心空隙两个β亚基之间,借其分子中所带5个负电荷与两个β亚基的带正带氨基酸残基以盐键及氢键结合,使两个β亚基保持分开的状态,即促使血红蛋白由紧密态向松驰态转换,从而减低血红蛋白对氧的亲和力(图10-20)。
图10-20 BPG与Hb的作用示意图
当红细胞内2,3-BPG浓度升高时有利于HbO2放氧,而2,3-BPG浓度下降则有利于Hb与氧结合。BPG变位酶及2,3-BPG磷酸酶受pH值调节。在肺泡毛细血管血液pH高,BPG变位酶受抑制而2,3-BPG磷酸酶活性强。使红细胞内2,3-BPG的浓度降低,有利于Hb与O2结合。
反之,在外周组织毛细血管中,血液pH下降,2,3-BPG的浓度升高,则利于HbO2放氧,借此调节氧的运输和利用,具有重要生理意义。但2,3-BPG的生成是以减少一个ATP的生成为代价的。
(三)磷酸戊糖通路
红细胞内利用葡萄糖的5~10%通过磷酸戊糖通路代谢,为红细胞提供另一种还原力(NADPH),NADPH在红细胞氧化还原系统中发挥重要作用,具有保护膜蛋白、血红蛋白及酶蛋白的巯基不被氧化,还原高铁血红蛋白等多种功能。
1.GSH的主要生理功能是对抗氧化剂对巯基的氧化。细胞内可自发生成少量超氧阴离子(O-2),同时感染时的白细胞吞噬作用亦可产生O-2,可被超氧化物歧化酶(superoxidedismufase SOD),催化生成过氧化氢(H2O2)。
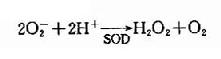
而GSH在谷胱甘肽过氧化酶作用下将H2O2还原为H2O,GSH自身被氧化为氧化型谷胱甘肽(GSSG)。后者在谷胱甘肽还原酶催化下,由NADPH+H+供氢重新还原为GSH。(图10-21)。
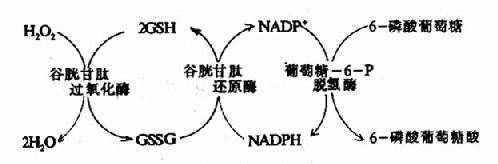
图10-21 谷胱甘肽的氧化与还原
催化NADPH生成的关键酶为葡萄糖-6-磷酸脱氢酶。此酶缺陷的病人一般情况下无症状,但有外界因素(如进食某种蚕豆)影响,即引起溶血。因吃蚕豆可诱导发病,故这种病又称蚕豆病。
2.高铁血红蛋白(methemoglobin MHb)的还原:由于各种氧化作用,红细胞内经常有少量MHb产生,而由于红细胞内有一系列酶促及非酶促的MHb还原系统(表10?),故正常红细胞中MHb只占1-2%。
表10-5 红细胞中MHb还原系统
| 还原系统 | 占总还原能力的百分比(%) |
| 酶促还原系统 | |
| NADH脱氢酶Ⅰ | 61 |
| NADH脱氢酶Ⅱ | 5 |
| NADH脱氢酶 | 6 |
| 非酶促还原系统 | |
| 抗坏血酸 | 16 |
| 谷胱甘肽 | 12 |
由表10-5可知,催化MHb还原的主要是NADH-脱氢酶,辅酶为NADH+H+。NADPH脱氢酶,(以NADPH+H+为辅酶)也参与MHb还作,但作用较小。除此之外,抗坏血酸和GSH可直接还原MHb,而氧化型抗坏血酸和GSSG的还原作用最终需NADPH+H+供氢。
第十一章 肝脏的生物化学
肝脏在人体生命活动中占有十分重要作用。在消化、吸收、排泄、生物转化以及各类物质的代谢中均起着重要的作用,被誉为“物质代谢中枢”。
肝脏具有肝动脉和门静脉的双重血液供应,具有丰富的血窦,肝细胞膜通透性大,利于进行物质交换。从消化道吸收的营养物质经门静脉进入肝脏被改造利用,有害物质则可进行转化和解毒。肝脏可通过肝动脉获得充足的氧以保证肝内各种生化反应的正常进行。肝脏还通过胆道系统与肠道沟通,将肝脏分泌的胆汁排泄入肠道。
肝细胞亚微结构与其生理机能相适应。肝细胞内有大量的线粒体、内质网、微粒体及溶酶体等,适应肝脏活跃的生物氧化、蛋白质合成、生物转化等多种功能。
第一节 肝脏的化学组成特点
正常人肝脏重约1-1.5kg,其中水份占70%。除水外,蛋白质含量居首位。已知肝脏内的酶有数百种以上,而且有些酶是其它组织中所没有或含量极少的。例如合成酮体和尿素的酶系;催化芳香族氨基酸及含硫氨基酸代谢的酶类主要存在于肝脏中。
正常人肝脏化学组成见表11-1。肝脏成分常随营养及疾病的情况而改变。例如,饥饿多日后,肝中蛋白质及糖原含量下降,磷脂及甘油三酯的含量升高。肝内脂类含量增加时,水分含量下降。如患脂肪肝时,水分可降至50%-5%左右。
表11-1 正常人肝脏的化学组成(按新鲜组织重量百分率计算)
| 成分 | 百分率 | 成分 | 百分率 |
| 水 | 70 | Na | 0.190 |
| 蛋白质* | 15 | K | 0.215 |
| 糖质 | 5-10 | Cl | 0.016 |
| 葡萄糖 | 0.1 | Ca | 0.012 |
| 甘油三酯 | 2 | Mg | 0.022 |
| 磷脂 | 2.5 | Fe | 0.010 |
| 胆固醇 | 0.3 | Zn | 0.006 |
| Cu | 0.002 |
*其中86.6%为球蛋白,6.6%为白蛋白
此外,肝脏含铁蛋白较多,是机本贮存铁最多的器官。
第二节 肝脏在物质代谢中的作用
一、肝脏在糖代谢中的作用
肝脏是调节血糖浓度的主要器官。当饭后血糖浓度升高时,肝脏利用血糖合成糖原(肝糖原约占肝重的5%)。过多的糖则可在肝脏转变为脂肪以及加速磷酸戊糖循环等,从而降低血糖,维持血糖浓度的恒定。相反,当血糖浓度降低时,肝糖原分解及糖异生作用加强,生成葡萄糖送入血中,调节血糖浓度,使之不致过低。因此,严重肝病时,易出现空腹血糖降低,主要由于肝糖原贮存减少以及糖异生作用障碍的缘故。临床上,可通过耐量试验(主要是半乳糖耐量试验)及测定血中乳酸含量来观察肝脏糖原生成及糖异生是否正常。
肝脏和脂肪组织是人体内糖转变成脂肪的两个主要场所。肝脏内糖氧化分解主要不是供给肝脏能量,而是由糖转变为脂肪的重要途径。所合成脂肪不在肝内贮存,而是与肝细胞内磷脂、胆固醇及蛋白质等形成脂蛋白,并以脂蛋白形式送入血中,送到其它组织中利用或贮存。
肝脏也是糖异生的主要器官,可将甘油、乳糖及生糖氨基酸等转化为葡萄糖或糖原。在剧烈运动及饥饿时尤为显著,肝脏还能将果糖及半乳糖转化为葡萄糖,亦可作为血糖的补充来源。
糖在肝脏内的生理功能主要是保证肝细胞内核酸和蛋白质代谢,促进肝细胞的再生及肝功能的恢复。(1)通过磷酸戊糖循环生成磷酸戊糖,用于RNA的合成;(2)加强糖原生成作用,从而减弱糖异生作用,避免氨基酸的过多消耗,保证有足够的氨基酸用于合成蛋白质或其它含氮生理活性物质。
肝细胞中葡萄糖经磷酸戊糖通路,还为脂肪酸及胆固醇合成提供所必需的NADPH。通过糖醛酸代谢生成UDP葡萄糖醛酸,参与肝脏生物转化作用。
二、肝脏在脂类代谢中的作用
肝脏在脂类的消化、吸收、分解、合成及运输等代谢过程中均起重要作用。
肝脏能分泌胆汁,其中的胆汁酸盐是胆固醇在肝脏的转化产物,能乳化脂类、可促进脂类的消化和吸收。
肝脏是氧化分解脂肪酸的主要场所,也是人体内生成酮体的主要场所。肝脏中活跃的β-氧化过程,释放出较多能量,以供肝脏自身需要。生成的酮体不能在肝脏氧化利用,而经血液运输到其它组织(心、肾、骨骼肌等)氧化利用,作为这些组织的良好的供能原料。
肝脏也是合成脂肪酸和脂肪的主要场所,还是人体中合成胆固醇最旺盛的器官。肝脏合成的胆固醇占全身合成胆固醇总量的80%以上,是血浆胆固醇的主要来源。此外,肝脏还合成并分泌卵磷脂胆固醇酰基转移酶(LCAT),促使胆固醇酯化。当肝脏严重损伤时,不仅胆固醇合成减少,血浆胆固醇酯的降低往往出现更早和更明显。
肝脏还是合成磷脂的重要器官。肝内磷脂的合成与甘油三酯的合成及转运有密切关系。磷脂合成障碍将会导致甘油三酯在肝内堆积,形成脂肪肝(fatty liver)。其原因一方面由于磷脂合成障碍,导致前β脂蛋白合成障碍,使肝内脂肪不能顺利运出;另一方面是肝内脂肪合成增加。卵磷脂与脂肪生物合成有密切关系。卵磷脂合成过程的中间产物——甘油二酯有两条去路:即合成磷脂和合成脂肪,当磷脂合成障碍时,甘油二酯生成甘油三酯明显增多。
三、肝脏在蛋白质代谢中的作用
肝内蛋白质的代谢极为活跃,肝蛋白质的半寿期为10天,而肌肉蛋白质半寿期则为180天,可见肝内蛋白质的更新速度较快。肝脏除合成自身所需蛋白质外,还合成多种分泌蛋白质。如血浆蛋白中,除γ-珠蛋白外,白蛋白、凝血酶原、纤维蛋白原及血浆脂蛋白所含的多种载脂蛋白(ApoA,Apo B,C.E)等均在肝脏合成。故肝功能严重损害时,常出现水肿及血液凝固机能障碍。
肝脏合成白蛋白的能力很强。成人肝脏每日约合成12g白蛋白,占肝脏合成蛋白质总量的四分之一。白蛋白在肝内合成与其它分泌蛋白相似,首先以前身物形式合成,即前白蛋白原(preproalbumin),经剪切信号肽后转变为白蛋白原(proalturnin)。再进一步修饰加工,成为成熟的白蛋白(alturnin)。分子量69,000,由550个氨基酸残基组成。血浆白蛋白的半寿期为10天,由于血浆中含量多而分子量小,在维持血浆胶体渗透压中起着重要作用。
肝脏在血浆蛋白质分解代谢中亦起重要作用。肝细胞表面有特异性受体可识别某些血浆蛋白质(如铜兰蛋白、α1抗胰蛋白酶等),经胞饮作用吞入肝细胞,被溶酶体水解酶降解。而蛋白所含氨基酸可在肝脏进行转氨基、脱氨基及脱羧基等反应进一步分解。肝脏中有关氨基酸分解代谢的酶含量丰富,体内大部分氨基酸,除支链氨基酸在肌肉中分解外,其余氨基酸特别是芳香族氨基酸主要在肝脏分解。故严重肝病时,血浆中支链氨基酸与芳香族氨基酸的比值下降。
在蛋白质代谢中,肝脏还具有一个极为重要的功能:即将氨基酸代谢产生的有毒的氨通过鸟氨酸循环的特殊酶系合成尿素以解氨毒。鸟氨酸循环不仅解除氨的毒性,而且由于尿素合成中消耗了产生呼吸性H+的CO2,故在维持机体酸碱平衡中具有重要作用。
肝脏也是胺类物质解毒的重要器官,肠道细菌作用于氨基酸产生的芳香胺类等有毒物质,被吸收入血,主要在肝细胞中进行转化以减少其毒性。当肝功不全或门体侧支循环形成时,这些芳香胺可不经处理进入神经组织,进行β-羟化生成苯乙醇胺和β-羟酪胺。它们的结构类似于儿茶酚胺类神经递质,并能抑制后者的功能,属于“假神经递质”,与肝性脑病的发生有一定关系。
四、肝脏在维生素代谢中的作用
肝脏在维生素的贮存、吸收、运输、改造和利用等方面具有重要作用。肝脏是体内含维生素较多的器官。某些维生素,如维生素A、D、K、B2、PP、B6、B12等在体内主要贮存于肝脏,其中,肝脏中维生素A的含量占体内总量的95%。因此,维生素A缺乏形成夜盲症时,动物肝脏有较好疗效。
肝脏所分泌的胆汁酸盐可协助脂溶性维生素的吸收。所以肝胆系统疾患,可伴有维生素的吸收障碍。例如严重肝病时,维生素B1的磷酸化作用受影响,从而引起有关代谢的紊乱,由于维生素K及A的吸收、储存与代谢障碍而表现出血倾向及夜盲症。
肝脏直接参与多种维生素的代谢转化。如将β-胡罗卜素转变为维生素A,将维生素D3转变为25-(OH)D3。多种维生素在肝脏中,参与合成辅酶。例如将尼克酰胺(维生素PP)合成NAD+及NADP+;泛酸合成辅酶A;维生素B6合成磷酸吡哆醛;维生素B2合成FAD,以及维生素B1合成TPP等,对机体内的物质代谢起着重要作用。
五、肝脏在激素代谢中的作用
许多激素在发挥其调节作用后,主要在肝脏内被分解转化,从而降低或失去其活性。此过程称激素的灭活(inactivation)。灭活过程对于激素的作用具调节作用。
肝细胞膜有某些水溶性激素(如胰岛素、去甲肾上腺素)的受体。此类激素与受体结合而发挥调节作用,同时自身则通过肝细胞内吞作用进入细胞内。而游离态的脂溶性激素则通过扩散作用进入肝细胞。
一些激素(如雌激素、醛固酮)可在肝内与葡萄糖醛酸或活性硫酸等结合而灭活。垂体后叶分泌的抗利尿激素亦可在肝内被水解而“灭活”。因此肝病时由于对激素“灭活”功能降低,使体内雌激素、醛固酮、抗利尿激素等水平升高,则可出现男性乳房发育、肝掌、蜘蛛痣及水钠潴溜等现象。
许多蛋白质及多肽类激素也主要在肝脏内“灭活”。如胰岛素和甲状腺素的灭活。甲状腺素灭活包括脱碘、移去氨基等,其产物与葡萄糖醛酸结合。胰岛素灭活时,则包括胰岛素分子二硫键断裂,形成A、B链,再在胰岛素酶作用下水解。严重肝病时,此激素的灭活减弱,于是血中胰岛素含量增高。
第三节 肝脏的生物转化作用
一、肝脏生物转化的概述
生物转化的定义 机体将一些内源性或外源性非营养物质进行化学转变,增加其极性(或水溶性),使其易随胆汁或尿液排出,这种体内变化过程称为生物转化(biotransformation)。
日常生活中,许多非营养性物质由体内外进入肝脏。这些非营养物质椐其来源可分为:(1)内源性物质:系体内代谢中产生的各种生物活性物质如激素、神经递质等及有毒的代谢产物如氨、胆红素等。(2)外源性物质:系由外界进入体内的各种异物,如药品、食品添加剂、色素及其它化学物质等。这些非营养物质既不能作为构成组织细胞的原料,又不能供应能量,机体只能将它们直接排出体外,或先将它们进行代谢转变,一方面增加其极性或水溶性,使其易随尿或胆汁排出,另一方面也会改变其毒性或药物的作用。
一般情况下,非营养物质经生物转化后,其生物活性或毒性均降低甚至消失,所以曾将此种作用称为生理解毒(physiological detoxification)。但有些物质经肝脏生物转化后其毒性反而增强,许多致癌物质通过代谢转化才显示出致癌作用,如3,4-苯并芘的致癌。因而不能将肝脏的生物转化作用一概称为“解毒作用”。
肝脏是生物转化作用的主要器官,在肝细胞微粒体、胞液、线粒体等部位均存在有关生物转化的酶类。其它组织如肾、胃肠道、肺、皮肤及胎盘等也可进行一定的生物转化,但以肝脏最为重要,其生物转化功能最强。
二、生物转化反应类型
肝脏内的生物转化反应主要可分为氧化(oxidation)、还原(reduction)、水解(hydrolysis)与结合(conjugation)等四种反应类型。
(一)氧化反应
1.微粒体氧化酶系
微粒体氧化酶系在生物转化的氧化反应中占有重要的地位。它是需细胞色素P450的氧化酶系,能直接激活分子氧,使一个氧原子加到作用物分子上,故称加单氧酶系(monooxygenase)。由于在反应中一个氧原子掺入到底物中,而一个氧原子使NADPH氧化而生成水,即一种氧分子发挥了两种功能,故又称混合功能氧化酶(mixedfunction oxidase)。亦可称为羟化酶。加单氧酶系的特异性较差,可催化多种有机物质进行不同类型的氧化反应。
(1)加单氧酶系的组成
加单氧酶系由NADPH,NADPH细胞色素P450还原酶及细胞色素P450组成。NADPH-细胞色素P450还原酶以FAD和FMN为辅基。二者比例为1:1。细胞色素P450是以铁卟啉原IX为辅基的b族细胞色素,含有与氧和作用物结合的部位。
(2)加单氧酶系反应过程
加单氧酶系催化总反应式如下:
NADPH+H++O2+RH→NADP++H2O+ROH
反应中作用物氧化生成羟化物。细胞色素P450含单个血红素辅基,只能接受一个电子,而NADPH是2个电子供体,NADPH-P450还原酶则既是2个电子受体又是1个电子的供体。正好沟通此电子传递链。作用物经加单氧酶系氧化的步骤见图11-2。
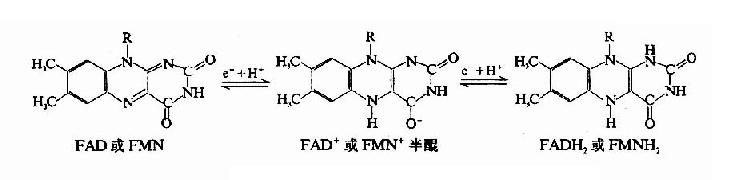
图11-1 氧化与还原型FAD与FMN
图11-2 加单氧酶系的反应过程
(3)加单氧酶系的生理意义及作用特点
加单氧酶系的生理意义是参与药物和毒物的转化。经羟化作用后可加强药物或毒物的水溶性有利于排泄。如甲苯为常用化工原料,在肝脏经加氧羟化生成对-甲酸,极性增强,易于排出体外。另外,维生素D3羟化为具有生物活性的25-(OH)D3。
加单氧酶系酶可诱导生成,如苯巴比妥类药物可诱导加单氧酶的合成,长期服用此类药物的病人,对异戊巴比妥,氨基比林等多种药物的转化及耐受能力亦同时增强。
2.线粒体单胺氧化酶系
胺氧化酶属于黄素酶类,存在于线粒体中,可催化组胺、酪胺、尸胺、腐胺等肠道腐败产物氧化脱胺,生成相应的醛类。例如:
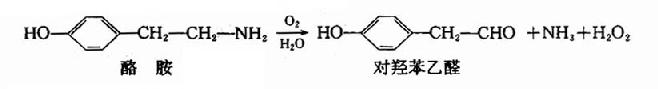
3.脱氢酶系
胞液中含有以NAD+为辅酶的醇脱氢酶与醛脱氢酶,分别催化醇或醛脱氢,氧化生成相应的醛或酸类。如:
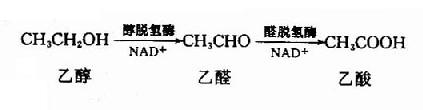
(二)还原反应
肝微粒体中存在着由NADPH及还原型细胞色素P450供氢的还原酶,主要有硝基还原酶类和偶氮还原酶类,均为黄素蛋白酶类。还原的产物为胺。如硝基苯在硝基还原酶催化下加氢还原生成苯胺,偶氮苯在偶氮还原酶催化下还原生成苯胺。此外,催眠药三氯乙醛也可在肝脏被还原生成三氯乙醇而失去催眠作用。
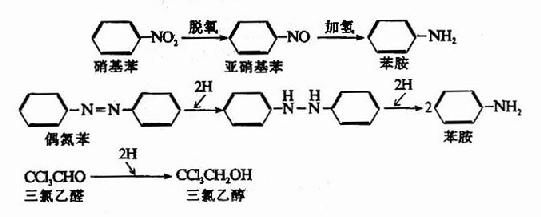
(三)水解反应
肝细胞中有各种水解酶。如酯酶、酰胺酶及糖苷酶等,分别水解各种酯键、酰胺键及糖苷键。分布广泛,人肝脏中水解酶类可催化乙酰苯胺、普鲁卡因、利多卡因及简单的脂肪族酯类的水解。如
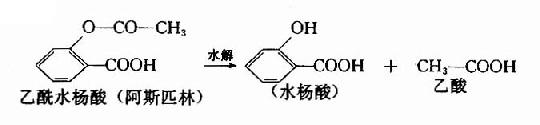
(四)结合反应
结合反应是体内最重要的生物转化方式。凡含有羟基、羧基或氨基等功能基的非营养物质,在肝内与某种极性较强的物质结合,增加水溶性、同时也掩盖了作用物上原有的功能基团,一般具有解毒功能。某些非营养物质可直接进行结合反应,有些则先经氧化、还原、水解反应后再进行结合反应。结合反应可在肝细胞的微粒体、胞液和线粒体内进行。椐参加反应的结合剂不同可分为多种反应类型:
1.葡萄糖醛酸结合反应
葡萄糖醛酸结合是最为重要和普遍的结合方式。尿苷二磷酸葡萄糖醛酸(UDPGA)为葡萄糖醛酸的活性供体,由糖醛酸循环产生。肝细胞微粒体中有UDP葡萄糖醛酸转移酶,能将葡萄糖醛酸基转移到毒物或其他活性物质的羟基、氨基及羧基上,形成葡萄糖醛酸苷。结合后其毒性降低,且易排出体外。胆红素、类固醇激素、吗啡、苯巴比妥类药物等均可在肝脏与葡萄糖醛酸结合而进行生物转化。临床上,用葡萄糖醛酸类制剂(如肝泰乐)治疗肝病,其原理即增强肝脏的生物转化功能。
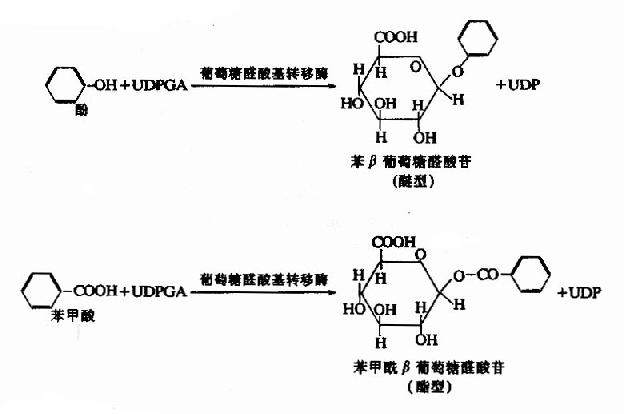
2.硫酸结合反应
以3′-磷酸腺苷5′-磷酸硫酸(PAPS)为活性硫酸供体,在肝细胞胞液中有硫酸转移酶,能催化将PAPS中的硫酸根转移到类固醇、酚类的羟基上,生成硫酸酯。雌酮在肝内与硫酸结合而失活。

3.乙酰基结合反应
在乙酰基转移酶的催化下,由乙酰CoA作乙酰基供体,与芳香族胺类化合物结合生成相应的乙酰化衍生物。如磺胺类药物及抗结核药异烟肼在肝脏经乙酰化而失去作用。
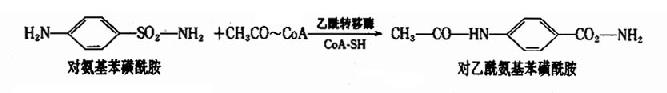
4.甲基结合反应
肝细胞液及微粒体中具有多种转甲基酶,含有羟基、巯基或氨基的化合物可进行甲基化反应,甲基供体是S腺苷蛋氨酸(SAM)。例如,尼克酰胺可甲基化生成N甲基尼克酰胺。
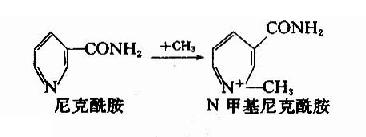
5.甘氨酸结合反应
某些毒物、药物的羧基与辅酶A结合形成酰基辅酶A后,在酰基CoA:氨基酸N-酰基转移酶催化下与甘氨酸结合,生成相应的结合产物。如马尿酸的生成。
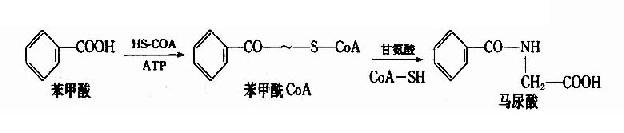
由上可见,肝脏的生物转化作用范围是很广的。很多有毒的物质进入人体后迅速集中在肝脏进行解毒,这是一方面,然而另一方面,正是由于这些有害物质容易在肝脏聚集,如果毒物的量过多,也容易使肝脏本身中毒,因此,对肝病患者,要限制服用主要在肝内解毒的药物、以免中毒。
上面列举的一些生物转化反应包括药物、毒物或腐败产物,经转化后毒性或生物活性减弱。然而有些物质,通过生物转化、其活性或毒性反而加强,即不是灭活而是激活。如苯骈芘(致癌物)是在肝内经过生物转化才形成终致癌物的。
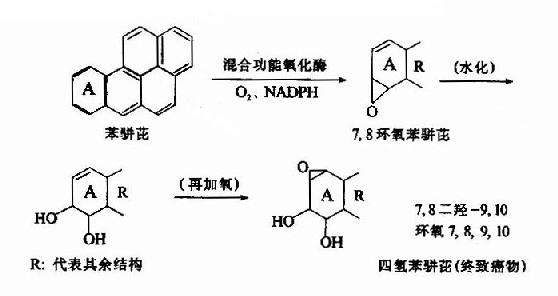
还有些致癌物在体内存在多种转化方式,有的属于致癌(活化),有的则属于解毒,例如黄曲霉素B1的生物转化。
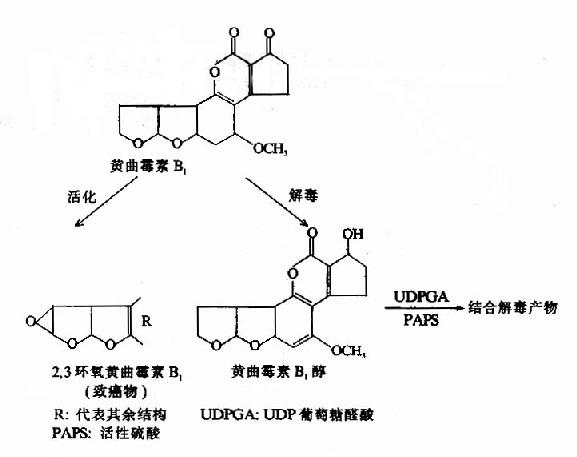
三、影响生物转化的因素
生物转化作用受年龄、性别、肝脏疾病及药物等体内外各种因素的影响。例如新生儿生物转化酶发育不全,对药物及毒物的转化能力不足,易发生药物及毒素中毒等。老年人因器官退化,对氨基比林、保泰松等的药物转化能力降低,用药后药效较强,副作用较大。此外,某些药物或毒物可诱导转化酶的合成,使肝脏的生物转化能力增强,称为药物代谢酶的诱导。例如,长期服用苯巴比妥,可诱导肝微粒体加单氧酶系的合成,从而使机体对苯巴比妥类催眠药产生耐药性。同时,由于加单氧酶特异性较差,可利用诱导作用增强药物代谢和解毒,如用苯巴比妥治疗地高辛中毒。苯巴比妥还可诱导肝微粒体UDP-葡萄糖醛酸转移酶的合成,故临床上用来治疗新生儿黄疸。另一方面由于多种物质在体内转化代谢常由同一酶系催化,同时服用多种药物时,可出现竞争同一酶系而相互抑制其生物转化作用。临床用药时应加以注意,如保泰松可抑制双香豆素的代谢,同时服用时双香豆素的抗凝作用加强,易发生出血现象。
肝实质性病变时,微粒体中加单氧酶系和UDP-葡萄糖醛酸转移酶活性显著降低,加上肝血流量的减少,病人对许多药物及毒物的摄取、转化发生障碍,易积蓄中毒,故在肝病患者用药要特别慎重。
第四节 胆汁酸代谢
肝细胞分泌的胆汁具有双重功能:一是作为消化液,促进脂类的消化和吸收,二是作为排泄液,将体内某些代谢产物(胆红素、胆固醇)及经肝生物转化的非营养物排入肠腔,随粪便排出体外。胆汁酸是胆汁的主要成分,具有重要生理功能。
一、胆汁酸的种类
正常人胆汁中的胆汁酸(bileacid)按结构可分为两大类:一类为游离型胆汁酸,包括胆酸(cholic acid)、脱氧胆酸(deoxycholic acid)、鹅脱氧胆酸(chenodeoxy cholicacid)和少量的石胆酸(litho chalic acid):另一类是上述游离胆汁酸与甘氨酸或牛磺酸结合的产物、称结合型胆汁酸。主要包括甘氨胆酸、甘氨鹅脱氧胆酸,牛磺胆酸及牛磺鹅脱氧胆酸等。一般结合型胆汁酸水溶性较游离型大,PK值降低,这种结合使胆汁酸盐更稳定,在酸或Ca2+存在时不易沉淀出来。
表11-2 正常人肝胆汁与胆囊胆汁的组成成分比较
| 肝胆汁 | 胆囊胆汁 | |
| %胆汁 | %胆汁 | |
| 水 | 97 | 86 |
| 总固体 | 3 | 14 |
| 胆汁酸盐 | 1.93 | 9.14 |
| 胆固醇 | 0.06 | 0.26 |
| 无机盐 | 0.84 | 0.65 |
| 粘蛋白和色素 | 0.53 | 2.98 |
从来源上分类可分为初级胆汁酸和次级胆汁酸。肝细胞内,以胆固醇为原料直接合成的胆汁酸称为初级胆汁酸,包括胆酸和鹅脱氧胆酸。初级胆汁酸在肠道中受细菌作用,进行7-α脱羟作用生成的胆汁酸,称为次级胆汁酸(secondary bile acid),包括脱氧胆酸和石胆酸。各种胆汁酸的结构如图11-3所示。
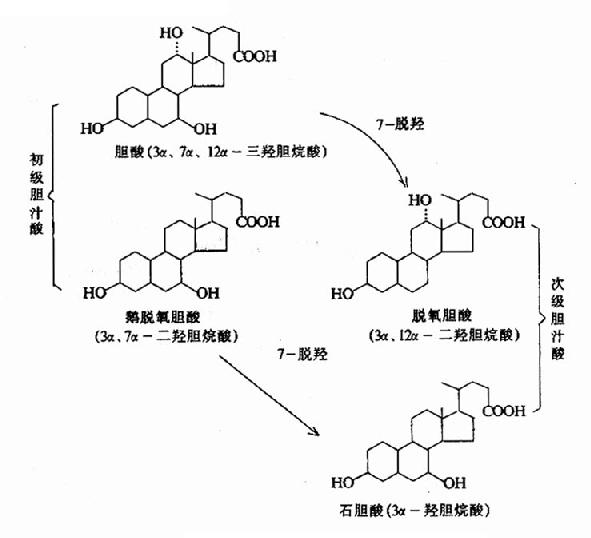
图11-3 各种游离胆汁酸的结构
胆酸和鹅脱氧胆酸都是含24个碳原子的胆烷酸衍生物。两者结构上的差别只是含羟基数不同,胆酸含有3个羟基(3α、7α、12α),而鹅脱氧胆酸含2个羟基(3α、7α)。次级胆汁酸脱氧胆酸和石胆酸结构特点是C-7位上无羟基。
二、初级胆汁酸的生成
胆汁酸由胆固醇转变而来,这也是胆固醇排泄的重要途径之一。肝细胞内由胆固醇转变为初级胆汁酸的过程很复杂,需经过多步酶促反应完成。归纳起来有以下几种变化:(图11-4,5,6)。
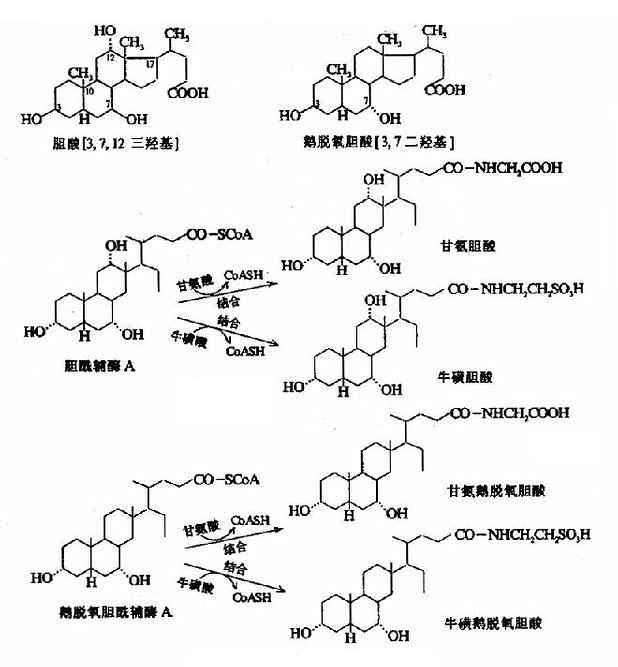
图11-4 结合型初级胆汁酸的生成
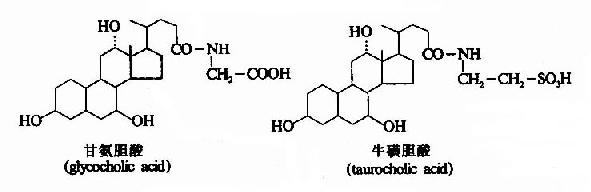
图11-5 两种结合胆汁酸的结构
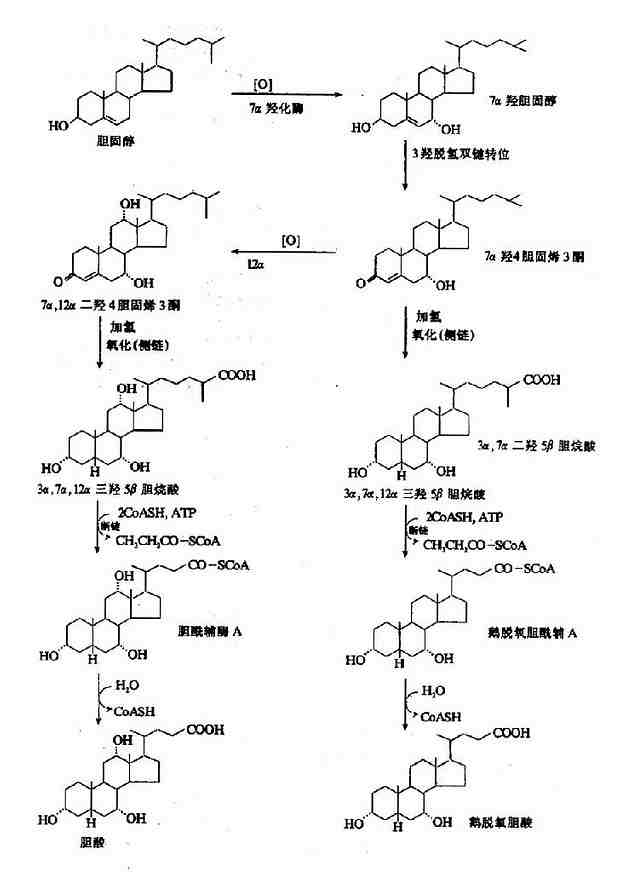
图11-6 游离型初级胆汁酸的生成
(1)羟化,是最主要的变化。首先在7α-羟化酶催化下,胆固醇转变为7α-羟胆固醇,然后再转变成鹅脱氧胆酸或胆酸,后者的生成还需要在12位上进行羟化。
(2)侧链氧化断裂生成含24个碳的胆烷酰CoA和一分子丙酰CoA(需ATP和辅酶A)。
(3)胆固醇的3-β-羟基差向异构化,转变为3-α-羟基。
(4)加水,水解下辅酶A分别形成胆酸与鹅脱氧胆酸。胆酰CoA和鹅脱氧胆酰CoA也可与甘氨酸或牛磺酸结合,生成结合型胆汁酸。
上述反应中,第一步(7α-羟化)是限速步骤,7α-羟化酶是限速酶。该酶属微粒体加单氧酶系,需细胞色素P450及NADPH、NADPH-细胞色素P450还原酶及一种磷脂参与反应。7α-羟化酶受终产物椀ㄖ岬姆蠢∫种啤R虼巳舨捎媚承┐胧?如口服阴离子交换树脂消胆胺)减少肠道胆汁酸的重吸收,则可促进胆汁酸的生成,从而降低血清胆固醇。此外,维生素C对此羟化反应有促进作用。
甲状腺素能通过激活侧链氧化酶系,促进肝细胞初级胆汁酸的合成。所以甲状腺机能亢进病人的血清胆固醇浓度常偏低,而甲状腺机能低下病人血清胆固醇含量则偏高。
三、次级胆汁酸的生成及胆汁酸的肠肝循环
随胆汁流入肠腔的初级胆汁酸在协助脂类物质消化吸收的同时,在小肠下段及大肠受肠道细菌作用,一部分被水解、脱去7α羟基,转变为次级胆汁酸。(图11-7)在合成次级胆汁酸的过程,可产生少量熊脱氧胆酸,它和鹅脱氧胆酸均具有溶解胆结石的作用。
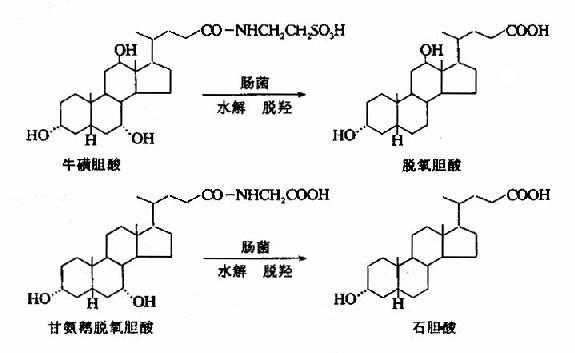
图11-7 次级胆汁酸的生成
肠道中的各种胆汁酸平均有95%被肠壁重吸收,其余的随粪便排出。胆汁酸的重吸收主要有两种方式:①结合型胆汁酸在回肠部位主动重吸收。②游离型胆汁酸在小肠各部及大肠被动重吸收。胆汁酸的重吸收主要依靠主动重吸收方式。石胆酸主要以游离型存在,故大部分不被吸收而排出。正常人每日从粪便排出的胆汁酸约0.4-0.6克。
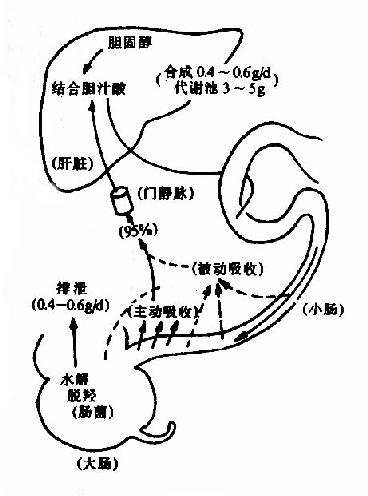
图11-8 胆汁酸的肠肝循环
由肠道重吸收的胆汁酸(包括初级和次级胆汁酸;结合型和游离型胆汁酸)均由门静脉进入肝脏,在肝脏中游离型胆汁酸再转变为结合型胆汁酸,再随胆汁排入肠腔。此过程称为“胆汁酸的肠肝循环”(enterohepatic circulation of bileacid),(图11-8)。
胆汁酸肠肝循环的生理意义在于使有限的胆汁酸重复利用,促进脂类的消化与吸收。正常人体肝脏内胆汁酸池不过3-5克,而维持脂类物质消化吸收,需要肝脏每天合成16-32克,依靠胆汁酸的肠肝循环可弥补胆汁酸的合成不足。每次饭后可以进行2-4次肠肝循环,使有限的胆汁酸池能够发挥最大限度的乳化作用,以维持脂类食物消化吸收的正常进行。若肠肝循环被破坏,如腹泻或回肠大部切除,则胆汁酸不能重复利用。此时,一方面影响脂类的消化吸收,另一方面胆汁中胆固醇含量相对增高,处于饱和状态,极易形成胆固醇结石。
四、胆汁酸的生理功能
胆汁酸分子内既含有亲水性的羟基及羧基或磺酸基,又含有疏水性烃核和甲基。亲水基团均为α型,而甲基为β型,两类不同性质的基团恰位于环戊烷多氢菲核的两侧,使胆汁酸构型上具有亲水和疏水的两个侧面(图11-9)。使胆汁酸具有较强的界面活性,能降低油水两相间的表面张力,促进脂类乳化。同时扩大脂肪和脂肪酶的接触面,加速脂类的消化。
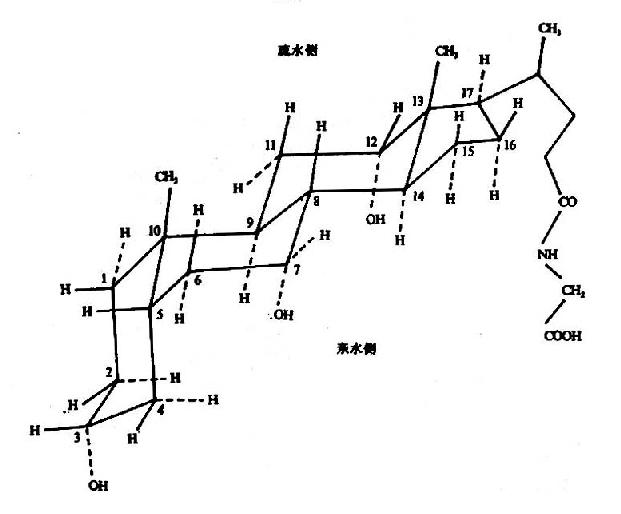
图11-9 甘氨胆酸的立体构型
胆汁酸还具有防止胆石生成的作用,胆固醇难溶于水,须掺入卵磷脂-胆汁酸盐微团中,使胆固醇通过胆固醇通过胆道运送到小肠而不致析出。胆汁中胆固醇的溶解度与胆汁酸盐,卵磷脂与胆固醇的相对比例有关。如胆汁酸及卵磷脂与胆固醇比值降低,则可使胆固醇过饱合而以结晶形式析出形成胆石。不同胆汁酸对结石形成的作用不同,鹅脱氧胆酸可使胆固醇结石溶解,而胆酸及脱氧胆酸则无此作用。临床常用鹅脱氧脱酸及熊脱氧胆酸治疗胆固醇结石。
第五节 胆色素代谢
胆色素(bilepigment)是含铁卟啉化合物在体内分解代谢的产物,包括胆红素(bilirubin)胆绿素(biliverdin)、胆素原(bilinogen)和胆素(bilin)等化合物。其中,除胆素原族化合物无色外,其余均有一定颜色,故统称胆色素。胆红素是胆汁中的主要色素,胆色素代谢以胆红素代谢为主心。肝脏在胆色素代谢中起着重要作用。
一、胆红素的生成及转运
(一)胆红素的来源
体内含卟啉的化合物有血红蛋白、肌红蛋白、过氧化物酶、过氧化氢酶及细胞色素等。成人每日约产生250?50mg胆红素,胆红素来源主要有:①80%左右胆红素来源于衰老红细胞中血红蛋白的分解。②小部分来自造血过程中红细胞的过早破坏。③非血红蛋白血红素的分解。
(二)胆红素的生成
体内红细胞不断更新,衰老的红细胞由于细胞膜的变化被网状内皮细胞识别并吞噬,在肝、脾及骨髓等网状内皮细胞中,血红蛋白被分解为珠蛋白和血红素。血红素在微粒体中血红素加氧酶(beme oxygenase)催化下,血红素原卟啉IX环上的α次甲基桥(=CH-)的碳原子两侧断裂,使原卟啉IX环打开,并释出CO和Fe3+和胆绿素IX(biliverdin)。Fe3+可被重新利用,CO可排出体外。线性四吡咯的胆绿素进一步在胞液中胆绿素还原酶(辅酶为NADPH)的催化下,迅速被还原为胆红素。(图11-10)。
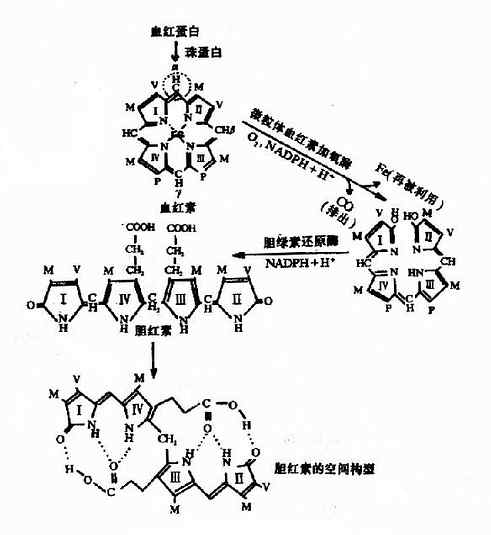
图11-10 胆红素的生成
血红素加氧酶是胆红素生成的限速酶,需要O2和NADPH参加,受底物血红素的诱导。而同时血红素又可作为酶的辅基起活化分子氧的作用。
用X线衍射分析胆红素的分子结构表明,胆红素分子内形成氢键而呈特定的卷曲结构分子中Ⅲ、Ⅳ两个吡咯环之间是单键连接。因此,Ⅲ环与Ⅳ环能自由旋转。在一定的空间位置,Ⅲ环上的丙酸基的羧基可与Ⅳ环,Ⅰ环上亚氨基的氢和Ⅰ环上的羰基形成氢键;Ⅳ环上的丙酸基的羧基也与Ⅱ环、Ⅲ环上亚氨基的氢和Ⅱ环上的羰基形成氢键。这6个氢键的形成使整个分子卷曲成稳定的构象。把极性基团封闭在分子内部,使胆红素显示亲脂、疏水的特性。
(三)胆红素在血液中的运输
在生理pH条件下胆红素是难溶于水的脂溶性物质,在网状内皮细胞中生成的胆红素能自由透过细胞膜进入血液,在血液中主要与血浆白蛋白或α1球蛋白(以白蛋白为主)结合成复合物进行运输。这种结合增加了胆红素在血浆中的溶解度,便于运输;同时又限制胆红素自由透过各种生物膜,使其不致对组织细胞产生毒性作用,每个白蛋白分子上有一个高亲和力结合部位和一个低亲和力结合部位。每分子白蛋白可结合两分子胆红素。在正常人每100ml血浆的血浆白蛋白能与20-25mg胆红素结合,而正常人血浆胆红素浓度仅为0.1-1.0mg/dl,所以正常情况下,血浆中的白蛋白足以结合全部胆红素。但某些有机阴离子如磺胺类、脂肪酸、胆汁酸、水杨酸等可与胆红素竞争与白蛋白结合,从而使胆红素游离出来,增加其透入细胞的可能性。过多的游离胆红素可与脑部基底核的脂类结合,并干扰脑的正常功能,称胆红素脑病或核黄疸。因此,在新生儿高胆红素血症时,对多种有机阴离子药物必需慎用。
二、胆红素在肝脏中的代谢
(一)肝细胞对胆红素的摄取
血中胆红素以“胆红素-白蛋白”的形式送输到肝脏,很快被肝细胞摄取。肝细胞摄细胞摄取血中胆红素的能力很强。实验证明,注射具有放射性的胆红素后,大约只需18分钟就可从血浆中清除50%。肝脏能迅速从血浆中摄取胆红素,是由于肝细胞内两种载体蛋白枣Y蛋白和Z蛋白所起的重要作用。这两种载体蛋白(以Y蛋白为主)能特异性结合包括胆红素在内的有机阴离子。当血液入肝,在狄氏(Disse)间隙中肝细胞上的特殊载体蛋白结合胆红素,使其从白蛋白分子上脱离,并被转运到肝细胞内。随即与细胞液中Y和Z蛋白结合,主是与Y蛋白结合,当Y蛋白结合饱合时,Z蛋白的结合才增多。这种结合使胆红素不能返流入血,从而使胆红素不断向肝细胞内透入。胆红素被载体蛋白结合后,即以“胆红素-Y蛋白”(胆红素-Z蛋白)形式送至内质网。这是一个耗能的过程,而且是可逆的。如果肝细胞处理胆红素的能力下降,或者生成胆红素过多,超过了肝细胞处理胆红素的能力,则已进入肝细胞的胆红素还可返流入血,使血中胆红素水平增高。
图11-11 葡萄糖醛酸胆红素的生成
Y蛋白是一种碱性蛋白,由分子量为22000和27.000的两个亚基组成,约占肝细胞胞液蛋白质总量的5%。它也是一种诱导蛋白,苯巴比妥可诱导Y蛋白的合成。甲状腺素、溴酚磺酸钠(BSP)和靛青绿(ICG)等可竞争结合Y蛋白,影响胆红素的转运。Y蛋白能与上述多种物质结合,故又称“配体结合蛋白”(ligadin)。由于新生儿在出生7周后Y蛋白才达到正常成人水平,故易产生生理性的新生儿非溶血性黄疸,临床上可用苯巴比妥治疗。
Z蛋白是一种酸性蛋白,分子量为12,000,与胆红素亲和力小于Y蛋白。当胆红素浓度较低时,胆红素优先与Y蛋白结合。在胆红素浓度高时,则Z蛋白与胆红素的结合量增加。
(二)肝细胞对胆红素的转化作用
肝细胞内质网中有胆红素-尿苷二磷酸葡萄糖醛酸转移酶(bilirutin-UDp glucuronyl transferase,BR-UDPGA-T),它可催化胆红素与葡萄糖醛酸以酯键结合,生成胆红素葡萄糖醛酸酯。由于胆红素分子中有两个丙酸基的羧基均可与葡萄糖醛酸C1上的羟基结合、故可形成两种结合物,即胆红素葡萄糖醛酸-酯和胆红素葡萄糖醛酸二酯(图11-11)。在人胆汁中的结合胆红素主要胆红素葡萄糖醛酸二酯(占70-80%),其次为为胆红素葡萄糖醛酸-(占20-30%),也有小部分与硫酸根、甲基、乙酰基、甘氨酸等结合。
胆红素经上述转化后称为结合胆红素,结合胆红素较未结合胆红素脂溶性弱而水溶性增强,与血浆白蛋白亲和力减小,故易从胆道排出,也易透过肾小球从尿排出。但不易通过细胞膜和血脑屏障,因此不易造成组织中毒,是胆红素解毒的重要方式。
(三)肝脏对胆红素的排泄作用
胆红素在内质网经结合转化后,在细胞浆内经过高尔基复合体、溶酶体等作用,运输并排入毛细胆管随胆汁排出。毛细胆管内结合胆红素的浓度远高于细胞内浓度,故胆红素由肝内排出是一个逆浓度梯度的耗能过程,也是肝脏处理胆红素的一个溥弱环节,容易受损。排泄过程如发生障碍,则结合胆红素可返流入血,使血中结合胆红素水平增高。
糖皮质激素不仅能诱导葡萄糖醛酸转移酶的生成,促进胆红素与萄萄糖醛酸结合,而且对结合胆红素的排出也有促进作用。因此,可用此类激素治疗高胆红素血症。
肝脏对胆红素的摄取、转化和排出可见图11-12。
图11-12 肝细胞内胆红素代谢示意图
三、胆红素在肠道中的转变
结合胆红素随胆汁排入肠道后,自回肠下段至结肠,在肠道细菌作用下,由β-葡萄糖醛酸酶催化水解脱去葡萄糖醛酸,生成未结合胆红素,后者再逐步还原成为无色的胆素原族化合物,即中胆素原(meso-bilirutinogen)、粪胆素原(stercobilinogen)及尿胆素原(urobilinogen)。粪胆素原在肠道下段或随粪便排出后经空气氧化,可氧化为棕黄色的粪胆素,它是正常粪便中的主要色素(图11-13)。正常人每日从粪便排出的胆素原约40?80mg。当胆道完全梗阻时,因结合胆红素不能排入肠道,不能形成粪胆素原及粪胆素,粪便则呈灰白色。临床上称之为白陶土样便。
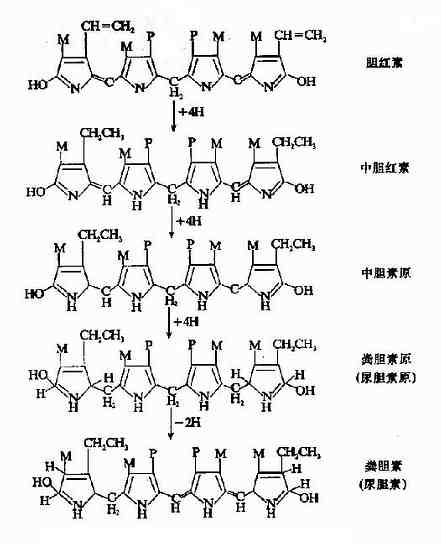
图11-13 胆红素在肠内的变化
生理情况下,肠道中约有10-0%的胆素原可被重吸收入血,经门静脉进入肝脏。其中大部分(约90%)由肝脏摄取并以原形经胆汁分泌排入肠腔。此过程称为胆色素的肠肝循环(enterohepatic circulation of bile pigments)。在此过程中,少量(10%)胆素原可进入体循环,可通过肾小球滤出,由尿排出,即为尿胆素原。正常成人每天从尿排出的尿胆素原约0.5-4.0mg,尿胆素原在空气中被氧化成尿胆素,是尿液中的主要色素,尿胆素原、尿胆素及尿胆红素临床上称为尿三胆。
胆红素的生成及代谢可总结为图11-14。
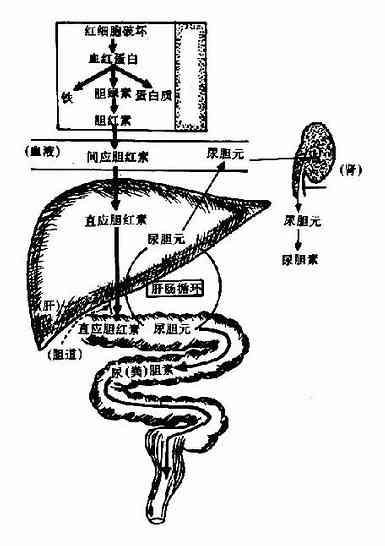
图11-14 正常胆红素的代谢
四、血清胆红素与黄疸
正常血清中存在的胆红素按其性质和结构不同可分为两大类型。凡未经肝细胞结合转化的胆红素,即其侧链上的丙酸基的羧基为自由羧基者,为未结合胆红素;凡经过肝细胞转化,与葡萄糖醛酸或其它物质结合者,均称为结合胆红素。
血清中的未结合胆红素与结合胆红素,由于其结构和性质不同,它们对重氮试剂的反应(范登堡试验Van den Bergh test)不同,未结合胆红素由于分子内氢键的形成,第10位碳桥被埋在分子的中心,这个部位是线性四吡咯结构的胆红素转变为二吡咯并与重氮试剂结合的关键部分。不破坏分子内氢键则胆红素不能与重氮试剂反应。必须先加入酒精或尿素破坏氢键后才能与重氮试剂反应生成紫红色偶氮化合物,称为范登堡试验的间接反应。所以未结合胆红素又称“间接反应胆红素”或“间应胆红素”。而结合胆红素不存在分子内氢键,能迅速直接与重氮试剂反应形成紫红色偶氮化合物,故又称“直接反应胆红素”或“直应胆红素”。
除上述两种胆红素外,现发现还存在着“第三种胆红素”,称为δ-胆红素。它的实质是与血清白蛋白紧密结合的结合胆红素。正常血清中它的含量占总胆红素的20-30%。它的出现可能与肝脏功能成熟有关。当肝病初期,它与血清中其它两种胆红素一起升高,但肝功能好转时它的下降较其它两种为缓慢,从而使其所占比例升高,有时可高达60%。
正常人血浆中胆红素的总量不超过1mg/dl,其中未结合型约占4/5,其余为结合胆红素。凡能引起胆红素的生成过多,或使肝细胞对胆红素处理能力下降的因素,均可使血中胆红素浓度增高,称高胆红素血症(hyperbilirubinemia)。胆红素是金黄色色素,当血清中浓度高时,则可扩散入组织,组织被染黄,称为黄疸(jaundice)。特别是巩膜或皮肤,因含有较多弹性蛋白,后者与胆红素有较强亲和力,故易被染黄。粘膜中含有能与胆红素结合的血浆白蛋白,因此也能被染黄。黄疸程度与血清胆红素的浓度密切相关。一般血清中胆红素浓度超过2mg/dl时,肉眼可见组织黄染;当血清胆红素达7~8mg/dl以上时,黄疸即较明显。有时血清胆红素浓度虽超过正常,但仍在2mg/dl以内,肉眼尚观察不到巩膜或皮肤黄染,称为隐性黄疸。应注意黄疸系一种常见体征,并非疾病名称。凡能引起胆红素代谢障碍的各种因素均可形成黄疸。根据其成因大致可分三类:①因红细胞大量破坏,网状内皮系统产生的胆红素过多,超过肝细胞的处理能力,因而引起血中未结合胆红素浓度异常增高者,称为溶血性黄疸或肝前性黄疸;②因肝细胞功能障碍,对胆红素的摄取结合及排泄能力下降所引起的高胆红素血症,称为肝细胞性或肝原性黄疸;③因胆红素排泄的通道受阻,使胆小管或毛细胆管压力增高而破裂,胆汁中胆红素返流入血而引起的黄疸,称梗阻性黄疸或肝后性黄疸。三种类型黄疸的血、尿、粪的改变情况总结如表11-3。
表11-3 黄疸时血、尿、粪的改变
| 指标 | 正常 | 阻塞性黄疸 | 溶血性黄疸 | 肝细胞性黄疸 | |
| 血胆红素 | 总量 | <1mg/dl | >1mg/dl | >1mg/dl | >1mg/dl |
| 直接 | 0-0.8mg/dl | ↑↑ | ↑ | ||
| 间接 | <1mg/dl | ↓↓ | ↑ | ||
| 尿色 | 正常 | 深 | 较深 | 深 | |
| 尿三胆 | 尿胆红素 | — | ++ | — | ++ |
| 尿胆素原 | 少量 | ↓ | ↓ | 不一定 | |
| 尿胆素 | |||||
| 粪便颜色 | 正常 | 完全阻塞时陶土色 | 深 | 变浅或正常 |
第十二章 钙磷代谢及微量元素
人体所需的营养素中包括部分无机盐。许多离子,主要是金属离子,在酶促反应过程中发挥作用;维护渗透压,主要为钠、钾、氯等;钙磷是骨骼的重要组成成分;此外,无机离子还参与信息传递,凝血过程等多种生理功能。
这些无机元素据人体中含量和需要量可分为常量元素和微量元素。体内含量较多(>5g),每天要量在100mg以上,如钙、磷、钾、钠、氯、镁等称为常量元素,而人体内含量甚微,每日需要量仅为μg或mg水平者,称为微量元素。包括铁、碘、铜、锌、锰、钴、钼、硒、铬、氟等。
本章重点讨论钙、磷的代谢及部分微量元素的作用。
第一节 钙磷代谢
钙和磷是人体内含量最丰富的无机元素。在正常成人,钙约占体重1.5-2.2%,总量约为700-1400g。磷占体重0.8-1.2%,总量约400-800g。其中99%的钙和86%的磷以羟磷灰石的形式存在于骨和牙齿当中。其余分布于体液和软组织中,以溶解状态存在。
人体内钙的存在状态见下图所示。
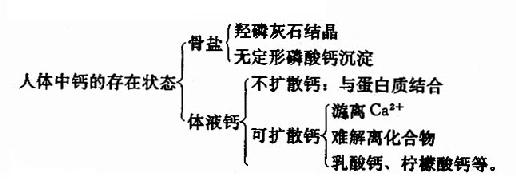
钙和磷的代谢在许多方面是相互联系的,机体从食物中摄取钙和磷、又把它们从尿和粪中排泄,成人每日摄取和排泄量大致相等,处于动态平衡之中(图12-1)。
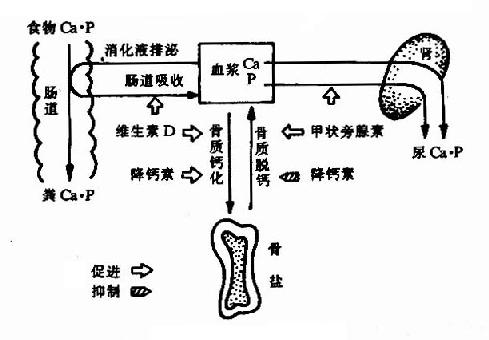
图12-1 钙磷代谢概貌
一、血钙和血磷
血钙指血浆中所含的钙,平均为9-11mg/dl。可分为可扩散钙(diffusible calcium)和非扩散钙(nondiffusiblecalcium)。非扩散钙指与血浆蛋白(主要为白蛋白)结合的钙。不易透过毛细血管壁。可扩散钙主要为游离Ca2+及少量与柠檬酸或其它酸结合的可溶性钙盐(表12-1)。
表12-1 正常人血浆钙各部分的含量
| 毫克/100毫升 | 毫克当量/升 | 占总量的% | |
| Ca2+ | 4.27 | 2.36 | 47.5 |
| 蛋白结合钙 | 4.56 | 2.28 | 46.0 |
| CaPO4 | 0.16 | 0.08 | 1.6 |
| 柠檬酸钙 | 0.17 | 0.08 | 1.7 |
| 其它未定钙 | 0.32 | 0.16 | 3.2 |
| 总计 | 9.93 | 4.96 | 100.0 |
血浆中发挥生理作用的主要为游离Ca2+,而血浆中Ca2+一蛋白结合钙和小分子结合钙之间呈动态平衡关系。此平衡受血浆PH影响,血液偏酸时,游离Ca2+浓度升高;相反,血液偏碱时,蛋白结合钙增多,游离Ca2+浓度下降。因此,临床上碱中毒时常伴有抽搐现象,与低血钙有关。
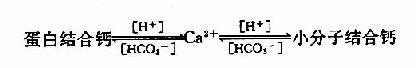
正常人血浆中无极磷的浓度为3.4?.0mg/dl、儿童稍高为4.5-6.5mg/dl。血浆中磷80~85%以HPO4形式存在。15-20%以H2PO4-形式存在,而PO43-的含量甚微。
血浆中钙、磷浓度关系密切,在以mg/dl表示时,二者的乘积([Ca]×[P])为30~40。当([Ca]×[P])>40,则钙和磷以骨盐形式沉积于骨组织;若([Ca]×[P])<35则妨碍骨的钙化,甚至可使骨盐溶解,影响成骨作用。
血钙和血磷含量的相对稳定依赖于钙、磷的吸收与排泄、钙化及脱钙间的相对平衡、而这些平衡又主要受维生素D3、甲状旁腺素和降钙素等激素的调节。
二、钙、磷的吸收与排泄
(一)钙、磷的吸收
体内钙和磷均由食物供给。正常成人每日摄取钙约1克、磷约0.8克。儿童及妊娠、哺乳期妇女需要量相应增加。
食物中所含钙主要为各种复合物,必须转变为游离Ca2+,才能被肠道吸收。当肠道内PH值<6时,有利于Ca2+的释放。因此,钙的吸收部位在小肠,而吸收率依次为十二指肠>空肠>回肠。食物中钙吸收率通常只有30%,当体内缺钙或生理需钙量增加时,吸收率可增高。
肠粘膜对钙的吸收机理较为复杂,既有跨膜转运,又有细胞内转运;既有逆浓度梯度的主动吸收,又有顺浓度梯度的被动扩散或易化转运。已知肠粘膜细胞内有多种钙结合蛋白(calnium binding protein,简写为CaBP),它与Ca2+有较强亲和力,可促进钙的吸收。磷的吸收与钙有密切关系,而且钙和磷的吸收又与钠的吸收和分布相互交织在一起,如图12-2所示。
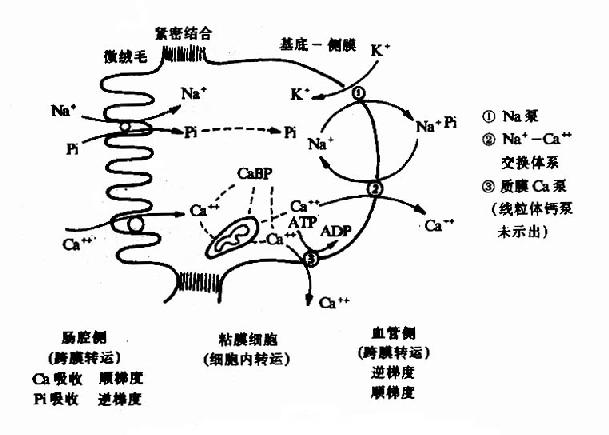
图12-2 肠粘膜对钙和磷的吸收示意图
如图122,Ca2+由肠腔进入粘膜细胞内是顺浓度梯度的,但由于微绒毛对Ca2+的通透性极低,故需要特殊的转运载体。Pi伴随着Na+的吸收进入粘膜细胞内,又随着Na+的泵出而至细胞外液(血管侧),后者虽然对Pi来说是顺梯度的,但要依赖Na+泵,所以有人将Pi的吸收称为“继发的主动转运”(secondaryactive transport)。至于CaBP的作用,现在认为它主要在细胞内转运过程中起作用,因为它对Ca2+的亲和力恰好介于质膜钙泵与线粒体膜钙泵对Ca2+的亲和力之间,是把线粒体蓄积的钙输送给基底一侧膜钙泵的一种输送蛋白。
食物中的磷主要以无机磷酸盐和有机磷酸酯两种形式存在,肠道主要吸收无机磷,有机含磷物则经水解释放出无机磷而被吸收。磷的吸收较易、吸收率可达70?0%。其吸收部位遍及小肠,以空肠吸收率最高。磷的吸收量比钙大,而且是逆电荷梯度进入小肠粘膜细胞,可见其有独立的吸收机制,目前对磷吸收机制尚未完全了解。肠道中酸碱性、食物成分以及血钙和血磷浓度均可影响钙和磷的吸收。
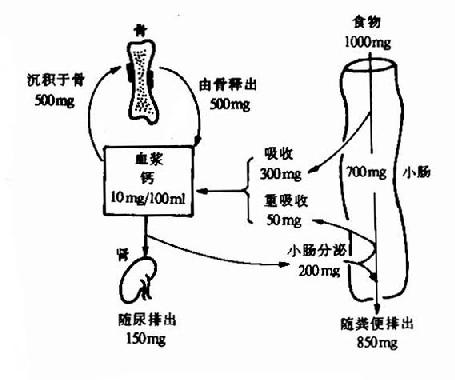
图12-3 人体每日钙的更新率
(二)钙和磷的排泄
人体排出钙主要有两条途径:约20%经肾排出,80%随粪便排出。肾小球每日滤出钙约10g,95%以上被肾小管重吸收,0.5-5%随尿排出。正常人从尿排出钙量较稳定,受食物钙量影响不大,但与血钙水平相关。血钙升高则尿钙排出增多。粪便中钙主要为食物中未吸收钙及消化液中钙。其量随钙的摄入量及肠收状态波动较大。
正常成人每日进出体内的钙量大致相等,即处于钙平衡状态。图12-3说明机体钙平衡的情况,图中数字为每日钙变化量的平均数。
磷亦通过肠道和肾脏排泄,以肾脏排泄为主。尿磷排出量占总排出量的60?0%。尿磷排出量取绝于肾小球滤过率和肾小管重吸收功能,并随肠道摄入量的变化而变化。
三、钙、磷与骨的钙化及脱钙
骨是一种特殊的结缔组织,不仅做为人体的支架组织,而且是人体中钙、磷的最大储库。通过成骨与溶骨作用,不断与细胞外液进行钙磷交换、对维持血钙和血磷稳定有重要作用。
(一)骨的组成
骨由无机盐、又称骨盐(bonysalts)、有机基质和骨细胞等组成。骨盐增加骨的硬度,基质决定骨的形状及韧性,骨细胞在代谢中起主导作用。
骨盐占骨干重的65~70%,其主要成分为磷酸钙,占84%,其它还有CaCO3占10%,柠檬酸钙占2%,磷酸镁占1%,和Na2HPO4占2%等。骨盐约有60%以结晶的羟磷灰石(hydroxyapatite)形式存在,其余40%为无定形的CaHPO4。据认为后者可以转变为前者。羟磷灰石[Ca10(PO4)6(OH)2]是微细的结晶,亦称骨晶(bone crystal)。每克骨盐含有约1016个结晶,总的表面积可达100平方米,体液中其他离子如Ca2+、Mg2+、Na+、Cl-、HCO3-、F-,柠檬酸根等可吸附在羟磷灰石的晶格之间。骨晶性质稳定,不易解离,但在其表层进行离子交换的速度较快。
骨中镁离子占体内镁离子总量的50%,骨中钠离子也占体内钠离子总量的35%,而且大部分钠易于交换。所以骨骼不仅是身体的支持组织,也是贮存大量钙、磷、钠、镁的器官,在维持体液电解质浓度的稳定性上具有重要作用。此外,骨盐中的Ca2+还可与体液中的H+交换,当体液中[H+]增多(酸中毒)时,由于Ca2+H+交换,可致骨盐溶解。
骨基质包括胶原和非胶原化合物。胶原约占90%以上。非胶原蛋白中含量较多的是骨钙素(osteocalcin)和骨连接素(osteonectin)。骨钙素为一种依赖维生素K的小分子酸性蛋白质,分子量约6000,其谷氨酸残基在γ位羧化为γ-羧基谷氨酸,与羟磷灰石、Ca2+有很高亲和力、骨连接素是附着于胶原的一种糖蛋白,易与羟磷石结合,可能作为骨盐沉积的核心。
(二)成骨作用与钙化
骨的生长、修复或重建过程,称为成骨作用(osteogenesis)。成骨过程中,成骨细胞先合成胶原和糖白多糖等细胞间质成分,形成所谓“骨样质”(osteoid),继后骨盐沉积于骨样质中,此过程称为钙化(calcification)。
关于钙化的机理,尚未完全阐明,研究表明下列变化可能参与和影响骨盐的沉积:
(1)电镜下可见成骨细胞表面突起形成很多囊泡。囊泡膜富含类脂并具有很高的碱性磷酸酶活性,可水解基质中多种磷酸酯,使无机磷浓度升高。囊泡中富含丝氨酸磷酯,能与Ca2+紧密结合,故能有效摄取周围基质中Ca2+。此外,成骨细胞具有钙泵作用,可从周围间隙中浓集钙。这些因素共同作用,使骨组织钙化局部Ca2+和HPO42-升高,使[Ca]×[P]积升高,利于钙盐的沉积。
(2)正常血中存在钙化抑制物,如焦磷酸盐(pyrophosphate),而成骨细胞囊泡中的磷酸酶可水解焦磷酸盐,一方面解除其抑制作用,另一方面提供了充分的无机磷作为骨盐沉着的原料。
(3)基质中的骨连接素可能提供羟磷灰石结晶形成的“晶核”,促使羟磷石结晶的形成。骨钙素则可直接结合羟磷灰石,避免羟磷灰石在局部堆积,使之有规律地沉积于胶原上。
(4)实验表明,胶原纤维的成熟和骨样组织的正常,是骨盐沉着的重要前提。
骨的生成和钙化是一个复杂的生物过程,受多种因素的影响和调节,此方面的研究正在深入进行,并取得了一些可喜的进展。如发现了多种与骨生成相关的蛋白及细胞因子等。
(三)溶骨作用与脱钙
骨在不断的新旧更替之中,原有旧骨的溶解和消失称为骨的吸收(bone resorption)或溶骨作用(osteolysis)。溶骨作用包括基质的水解和骨盐的溶解,后者又称为脱钙(decalcification)。溶骨作用同成骨作用一样,是通过骨组织细胞的代谢活动完成的。溶骨作用主要由破骨细胞引起,可分为细胞外相和细胞内相两相完成。
破骨作用起始于细胞外。破骨细胞通过接触骨面的刷状缘,溶酶体释放出多种水解酶类,如胶原酶可水解胶原纤维,糖苷酶水解氨基多糖。同时,破骨细胞通过糖元分解代谢产生大量乳酸,丙酮酸等酸性物质扩散到溶骨区,使局部酸性增加,促使羟磷灰石从解聚的胶原中释出。破骨细胞产生柠檬酸能与Ca2+结合形成不解离的柠檬酸钙,降低局部Ca++的浓度,从而促进磷酸钙的溶解。继后,多肽、羟磷灰石等经胞饮作用进入破骨细胞,并与溶酶体溶合形成次级溶酶体。在此多肽水解为氨基酸、羟磷灰石转变为可溶性钙盐。最后,氨基酸、磷及Ca2+从破骨细胞释放入细胞外液,再入血,可参与血磷、血钙的组成。因骨的有机质主要为胶原,溶骨作用增强时,血及尿中羟脯氨酸增高。因此可将血及尿中羟脯氨酸的量作为溶骨程度的参考指标。
正常成人,成骨与溶骨作用维持动态平衡,每年骨的更新率约1?%。骨骼发育生长时期,成骨作用大于溶骨作用。而老年人则骨的吸收明显大于骨的生成,骨质减少而易发生骨质疏松症(osteoporosis)。骨盐在骨中沉积或释放,直接影响血钙、血磷水平,在平时骨中约有1%的骨盐与血中的钙经常进行交换维持平衡,因此血钙浓度与骨代谢密切相关。
四、钙磷代谢的调节
体内钙、磷代谢的平衡主要由甲状旁腺素、1,25-(OH)2D3和降钙素来调节。
(一)甲状旁腺素(Parathormone,PTH)
1.合成及分泌
甲状旁腺素是由甲状旁腺主细胞合成和分泌的一种单链多肽激素,成熟PTH含84个氨基酸残基,分子量约为9500。是维持血钙恒定的主要激素。
PTH的合成遵循典型的胞内多肽合成途径。首先合成的是含115个氨基酸的前甲状旁腺激素原(Pre Pro PTH)。在粗面内质网切除N端25个氨基酸的信号肽,降解为激素原(Pro PTH),含90个氨基酸残基,无生理活性。Pro PTH在高尔基体中进一步切去N端6个氨基酸残基,组装为成熟的、具生物活性的PTH分泌颗粒。(图12-4)。
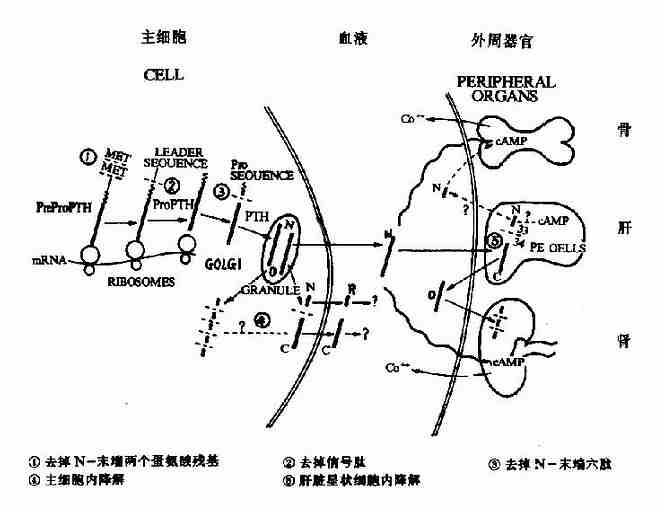
图12-4 PTH及其前体的合成、分泌及代谢
完全相同的生物活性。主要受体结合位点在1-6,它的切除会导致全部生物活性丧失。C-未端片断不具有生物活性,但决定PTH的免疫原性,这在PTH放射免疫测定时应注意。
PTH在血液中的半衰期仅数分钟,甲状旁腺细胞内PTH的储存亦有限。因而,分泌细胞不断进行PTH的合成及分泌。血钙是调节PTH水平的主要因素,血钙不仅调节PTH的分泌,而且影响PTH的降解。低血钙的即刻效应(几秒钟内)是刺激贮存的PTH的释放,而持续作用主要是抑制PTH的降解速度。后者是调节外周血PTH水平的主要机制。当血Ca2+水平下降时,体内PTH降解速度减慢,血中PTH水平增高。此外,1,25-(OH)2D3与PTH分泌也有关系,当血中1,25-(OH)2D3增多时,PTH的分泌减少,降钙素则可促进PTH分泌。一方面是通过降低血钙的间接作用,另一方面可直接刺激甲状旁腺分泌PTH。
(二)生理作用
PTH作用的靶器官是肾脏,骨骼和小肠。PTH作用于靶细胞膜上腺苷酸环化酶系统,增加胞浆内cAMP及焦磷酸盐(PPi)的水平。前者促进线粒体内Ca2+向胞浆透出,后者则作用于细胞膜外侧,增加Ca2+向细胞内透入,使细胞浆Ca2+浓度升高,于是细胞膜上的“钙泵”被激活,将Ca2+大量输送到细胞外液。PTH作用的总效应是升高血钙。
1.对骨的作用
PTH具有促进成骨和溶骨的双重作用。实验研究表明小剂量PTH可促进成骨作用,而大剂量则可促进溶骨作用。PTH可刺激骨细胞分泌胰岛素样生长因子I(IGF桰),从而促进骨胶原和基质的合成,利于成骨作用。临床上利用此作用,给骨质疏松症患者连续使用小剂量PTH治疗,取得良好疗效。另一方面PTH能使骨组织中破骨细胞的数量和活性增加,破骨细胞分泌各种水解酶,并且产生大量乳酸和柠檬酸等酸性物质,使骨基质及骨盐溶解,释放钙和磷到细胞外液。但PTH只引起血钙升高;而血磷却减少,其原因在于PTH对肾脏的作用。
2.对肾脏的作用
PTH对肾脏作用出现最早,主要是增加肾近曲小管对Ca2+的重吸收,降低肾磷排泄阈并抑制肾小管对磷的重吸收。其机理是通过细胞膜受体和cAMP系统,改变细胞膜对Ca2+通透性,使Ca2+内流增多、胞浆内Ca2+浓度升高,减低腔面对Na+通透性,Na+桯+交换减少,Na+、HCO3-排出增多,磷排出也相应增加。同时,通过浆膜面的“钙泵”使Ca2+进入血液,其结果使尿钙减少,尿磷增多,最终使血钙升高,血磷降低。
3.对小肠的作用
PTH对小肠的钙、磷吸收的影响,一般认为是通过激活肾脏1α-羟化酶,促进1,25-(OH)2D3的合成而间接发挥作用的,此效应出现得较为缓慢。
(二)1,25-(OH)[XB]2[/XB]D[XB]3[/XB]
1.合成及调节
1,25-(OH)2D3是一种激素,由维生素D3在体内代谢生成,是维生素D3在体内的主要生理活性形式。维生素D3及其前体在皮肤、肝、肾等经过一系列的酶促反应生成1,25-(OH)2D3,再经血液运输到小肠、骨及肾等靶器官发挥生理作用。
皮肤:胆固醇代谢中间产物在皮肤分布较多。在紫外线照射下先转变为前维生素D3(previtamin D3),后者在体温条件下经36小时自动异构化为维生素D3(图12-5)。
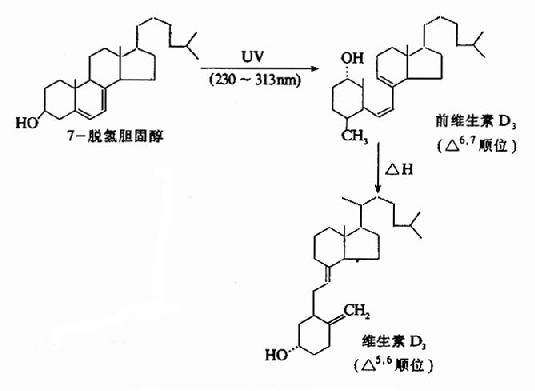
图12-5 维生素D3的生成
(2)肝脏:皮下转化生成及肠道吸收的维生素D3入血后,与维生素D结合蛋白(DBP)结合运送到肝脏,在肝细胞微粒体中维生素D-25羟化酶催化,转变为25-(OH)D3。维生素D-25羟化酶受产物25-(OH)D3的反馈抑制。合成的25-(OH)D3再与DBP结合而运输,它是血浆中维生素D3的主要形式。
(3)肾脏:肝脏生成的25-OH)D3经血运往肾脏,在肾近曲小管上皮细胞线粒体内1α-羟化酶系(包括黄素酶、铁硫蛋白和细胞色素P450)的作用下,转变成1,25-(OH)2D3。此外,肾脏中还有24,25-(OH)2D3及1,24,25-(OH)2D3等代谢产物。其活性均较弱。(图12-6)。
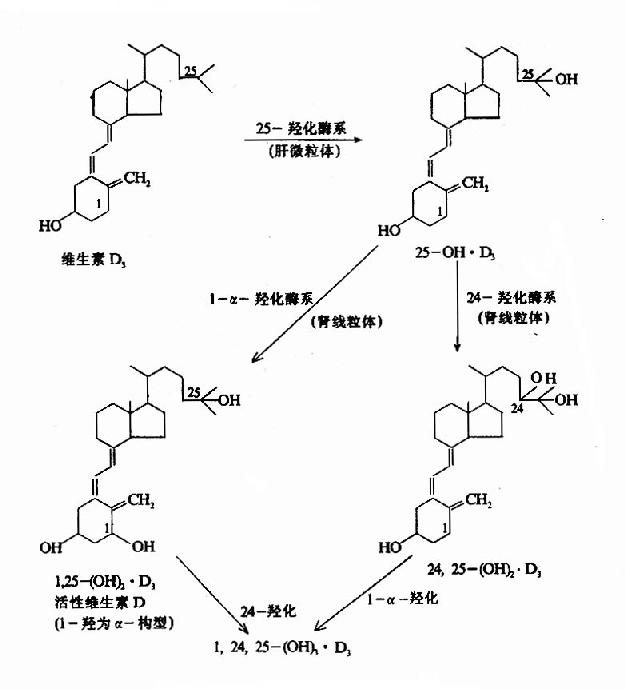
图12-6 维生素D3的代谢
(4)调节:1,25-(OH)2D3的合成受多种因素影响和调控。主要通过1α-羟化酶调节,主要影响因素有PTH、血液和细胞外液磷酸盐浓度、1,25-(OH)2D3及血钙等。
PTH是1α-羟化酶的主要调节者。PTH能促进1α-羟化酶合成,抑制24α-羟化酶,从而使25-(OH)D3转变为1,25-(OH)2D3增多,转变为24,25-(OH)2D3减少。低血钙由于使PTH升高而刺激1,25-(OH)2D3的生成。低血磷可刺激1α-羟化酶活性,且低血磷刺激1,25-(OH)2D3合成作用不依赖于PTH。此外,维生素D3不仅不受1α-羟化酶作用,而且还抑制1α-羟化酶。
2.1,25—OH)2D3的生理作用
1,25-(OH)2D3作用的靶器官是小肠、骨,而对肾脏作用较弱。
(1)对小肠的作用:1,25-(OH)2D3能促进小肠对钙、磷的吸收,这是其最主要的生理功。1,25-(OH)2D3与小肠粘膜细胞内的特异胞浆受体结合,进入细胞核内,促进DNA转录生成mRNA,从而使钙结合蛋白(calciumbinding protein,CaBp)和 Ca2+-Mg2+ATP酶)合成增高。从而使进Ca2+的吸收转运。同时1,25-(OH)2D3可影响小肠粘膜细胞膜磷脂的合成及不饱合脂肪酸的量,增加Ca2+的通透性,利于肠腔内Ca2+的吸收。1,25—OH)2D3促进Ca2+吸收同时伴随磷吸收的增强,但对磷吸收的作用机制尚未了解清楚。
(2)对骨的作用,1,25-(OH)2D3对骨亦有溶骨和成骨的双重作用。体外实验证明,1,25-(OH)2D3能刺激破骨细胞活性和加速破骨细胞的生成,从而促进溶骨作用。在体内则与PTH协同作用,促进破骨细胞增生,并增强其破骨作用。另一方面,由于1,25-(OH)2D3增加小肠对钙、磷的吸收,提高血钙、血磷,又促进钙化。同时,1,25-(OH)2D3还刺激成骨细胞分泌胶原等,促进骨的生成。所以,在钙、磷供应充足时,1,25-(OH)2D3主要促进成骨。当血钙降低、肠道钙吸收不足时,主要促进溶骨,使血钙升高。
(3)对肾的作用1,25—(OH)2D3可促进肾小管对钙、磷的重吸收。但此作用较弱,处于次要地位。只在骨骼生长和修复期,钙、磷供应不足情况下较明显。
1,25-(OH)2D3总的调节效果是使血钙、血磷增高。
(三)降钙素(CalcitoninCT)
1.化学本质
降钙素是由甲状腺滤泡旁细胞(又称C细胞)所分泌的一种单链多肽类激素,由32个氨基酸组成,分子量为3500。N-末端1,7位氨基酸为半胱氨酸,以二硫键相连,形成一个封闭环,C-末端为脯氨酸。分子内部的氨基酸顺序变化较大,不同种类CT,32个氨基酸中只有9个位置是相同的(图127)。但从体结构来看,这几种CT的结构又很相似,其所有亲水和疏
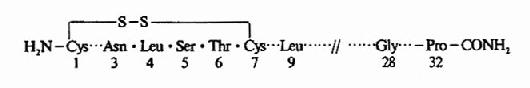
图12-7 猪、牛、鲑鱼和人类降钙素的共性结构
水氨基酸残基的位置相对固定。如疏水基的酪氨酸、苯丙氨酸、亮氨酸在分子中有规律的间隔出现(4、9、12、16、19、22位),带电荷的酸性氨基酸都在15和30位上。如天冬氨酸、谷氨酸、甘氨酸。所以每种CT对各种哺乳动物都有生物活性。一般认为CT生物活性有赖于分子中32个氨基酸结构的完整性,目前对此说法有一些新的见解,并取得一些新进展。例如人工合成一种自1922氨基酸残基单个缺失或片断缺失的鲑鱼CT同类物,其降钙作用为天然鲑鱼CT的2倍。
2.CT的合成与分泌
在人甲状腺C细胞中以CT mRNA为模板的最初翻译产物是分子量约15000的蛋白,经过修饰先转变为分子量12000的产物,最后转变为3500的成熟CT。血钙是影响CT分泌的主要因素。血钙升高可刺激CT的分泌。血钙降低则抑制CT的分泌,但CT合成的速度不受影响,因而细胞内CT含量增高。甲状旁腺功能低下患者,其C细胞中CT含量亦增多。
3.CT的生理功能
CT作用的靶器官也主要为骨和肾,其作用与PTH相反,其作用是抑制破骨作用,抑制钙、磷的重吸收,降低血钙和血磷。
目前已发现在骨、肾、肠粘膜、精子等细胞上有CT受体,CT与受体结合激活腺苷酸环化酶,通过cAMP发挥生物效应。近来发现随着细胞内Ca2+增加而出现CT的功能效应,有人提出Ca2+是CT作用于破骨细胞的第二信使。
(1)CT对骨的作用:CT直接抑制破骨细胞的生成,又可加速破骨细胞转化为成骨细胞,因而增强成骨作用,抑制骨盐溶解、降低血钙、血磷浓度。
(2)CT对肾的作用:CT直接抑制肾小管对钙、磷离子的重吸收,从而使尿磷,尿钙排出增多,同时还可通过抑制肾1α—羟化酶而减少1,25-(OH)2D3的生成而间接抑制肠道对钙、磷的吸收率,结果使血浆钙、磷水平下降。
(3)对小肠作用:通过抑制1,25-(OH)2D3生成间接抑制钙的吸收,一般认为无直接作用。
综上可见,PTH,1,25-(OH)2D3、及CT均可调节钙、磷代谢,三者相互协调,相互制约、以维持血中钙、磷的动态平衡。三者对钙、磷代谢的调总结于表12-2。
表12-2 三种激素对钙、磷代谢的调节
| PTH | 1,25-(OH)2D3 | CT | |
| 血钙 | ↑ | ↑ | ↓ |
| 血磷 | ↓ | ↑ | ↓ |
| 小肠钙吸收 | ↑ | ↑↑ | ↓ |
| 小肠磷吸收 | ↑ | ↑ | ↓ |
| 肾钙重吸收 | ↓ | ↑ | ↓ |
| 溶肾作用 | ↑↑ | ↑ | ↓ |
| 成骨作用 | ↑ | ↑ | ↑ |
第二节 镁的代谢
镁(magnesium)的代谢及功能与钙、磷有密切关系。人体含镁量约20-28g,一半以上存在于骨中,其余在细胞内,是细胞内重要阳离子之一。细胞外液镁不超过总量的1%。镁与人类许多生理功能密切相关,在疾病发生及临床治疗中有重要作用。
骨中镁主要以Mg3(PO4)2和MgCO3的形式存在,吸附于羟磷石表面。但它与钙不同,不易随机体需要从骨中动员出来。但镁在一定程度上可置换骨中的钙,其置换的量取绝于骨钙动员的状况。
正常人血镁浓度为0.8?.1mmol/L。约1/3与血浆蛋白(主要是白蛋白)结合,少部分与磷酸、柠酸酸等结合成不易解离的化合物。而绝大部分(约60%)以Mg2+形式存在。
细胞内镁则大部分与磷酸根、柠檬酸根及其它阴离子结合为复合物,尤其是与ATP结合为Mg·ATP=形式,参与需要ATP的反应。
(一)镁的吸收与排泄
人体每日镁的需要量为0.2?.4g,主要从绿色蔬菜中获得。镁的吸收主要在小肠,膳食中磷酸盐和乳糖的含量、肠腔内镁的浓度及肠道功能状态均影响镁的吸收。维生素D对肠道镁的吸收有轻微的促进作用。钙与镁的吸收有竞争作用。因此,食物中含钙过多则妨碍镁的吸收。
镁的排泄主要是通过肠道和肾脏。60-70%的镁从粪便排出,血浆中可扩散镁可透过肾小球滤出,大部分可被肾小管重吸收,只有2-10%随尿排出。缺镁则肾小管重吸收加强,而甲状腺素促进镁的排泄。
(二)镁的生理功能
1.镁是许多酶系的辅助因子或激活剂,广泛参与体内各种物质代谢,包括蛋白质、脂肪、糖及核酸的代谢。
2.镁离子对神经系统和心肌作用十分重要,对中枢神经系统和神经肌肉接头,镁离子能起到镇静和抑制作用。
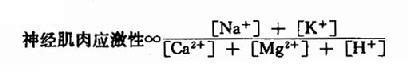
对于神经肌肉应激性,Mg2+与Ca2+是协同的,但对于心肌则Ca2+与Mg2+的作用又是拮抗的如下式:
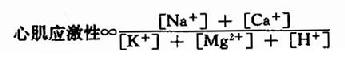
因此,低血镁可引起与低血钙类似的手足搐搦症,而镁中毒则可导致四肢软弱无力及心律不齐等。
3.镁作用于外周血管可引起血管扩张。
血清Mg2+浓度对PTH和CT的分泌均有影响。血清Mg2+浓度过低,则PTH分泌受抑制,而不再受Ca2+的调节。因此,可出现低血钙与低血镁并存的情况。新生儿低血钙亦往往伴有低血镁,单独给予镁剂,则血镁和血钙均可升高。此外,低血镁还可影响PTH对靶细胞的作用,此时给予外源性PTH亦不起反应。高血镁可刺激CT的分泌,结果可出现低血钙与高血镁并存的情况。
第三节 微量元素
人体是由几十种元素组成的,含量占人体总重量万分之一以下,每日需要量在100mg以下者称为微量元素。如铁、铜、锌、碘等41种元素,其总量约占人体的0.05%。目前公认的人体必需微量元素有铁、铜、锌、碘、锰、硒、氟、钼、钴、铬、镍、钒、锶、锡等14种,绝大多数为金属元素。在体内一般结合成化合物或络合物,广泛分布于各组织中,含量较恒定。微量元素主要来自食物,动物性食物含量较高,种类也较植物性食物多。
微量元素在体内的作用是多种多样的,其主要通过形成结合蛋白、酶、激素和维生素等发挥作用。微量元素生理作用主要有以下方面:(1)参与构成酶活性中心或辅酶:人体内有一半以上的酶其活性部位含有微量元素。有些酶需要一种以上的微量元素才能发挥最大活性。有些金属离子构成酶的辅基。如细胞色素氧化酶中有Fe2+,谷胱甘肽过氧化物酶(GSH-Px)为含硒酶。(2)参与体内物质运输:如血红蛋白中Fe2+参与O2的送输:碳酸酐酶含锌、参与CO2的送输。(3)参与激素和维生素的形成:如碘是甲状腺素合成的必需成分,钴是维生素B12的组成成分等。
随着对微量元素的生物作用的不断深入研究,其在人体中的作用日益受到人们的重视,发现许多微量元素在生化、生理、营养、致癌及临床诊断中有重要意义,并揭示了一些原来病因不明、防治不易的疾病的发病机理。如缺硒导致的克山病、缺锌诱发的侏儒症、缺碘与地方性甲状腺肿等。因此,对微量元素认识及检测人体中微量元素的水平,对疾病的发生、发展、诊断及防治均有重要意义。本节分别介绍一些微量元素的代谢及功能。
一、铜
成人体内含铜量约100-50mg,在肝、肾、心、毛发及脑中含量较高。人体每日需要量约1.5-2.0mg,而推荐量为2-3mg。
食物中铜主要在胃和小肠上部吸收,吸收后送至肝脏,在肝脏中参与铜蓝蛋白(coruloplasmin)的组成。肝脏是调节体内铜代谢的主要器官。铜可经胆汁排出,极少部分由尿排出。
体内铜除参与构成铜兰蛋白(见血液生化)外,还参与多种酶的构成,如细胞色素C氧化酶、酪氨酸酶、赖氨酸氧化酶,多巴胺β羟化酶、单胺氧化酶、超氧化物歧化酶等。因此,铜的缺乏会导致结缔组织中胶原交联障碍,以及贫血、白细胞减少、动脉壁弹性减弱及神经系统症状等。体内铜代谢异常的遗传病目前除wilson病(肝豆状核变性)外,还发现有Menke病,表现为铜的吸收障碍导致肝、脑中铜含量降低,组织中含铜酶活力下降,机体代谢紊乱。
二、锌
人体内含锌约2-3g,遍布于全身许多组织中,不少组织含有较多锌,如眼睛含锌达0.5%。成人每日需要量为15-200mg。
锌主要在小肠中吸收。肠腔内有与锌特异结合的因子,能促进锌的吸收。肠粘膜细胞中的锌结合蛋白能与锌结合并将其转动到基度膜一侧,锌在血中与白蛋白结合而送输。锌主要随胰液、胆汁排泄入肠腔。由粪便排出,部分锌可从尿及汗排出。
锌是80多种酶的组成成分或激动剂。如DNA聚合酶,碱性磷酸酶、碳酸酐酶,乳酸脱氢酶、谷氨酸脱氢酶、超氧化物歧化酶等,参与体内多种物质的代谢。锌还参与胰岛素合成。近来还发现,在固醇类及甲状腺素的核受体中DNA结合区,有锌参与构成的锌指结构(详见第一章)。可推测锌在基因调控中亦有重要作用。因此,缺锌会导致多种代谢障碍,如儿童缺锌可引起生长发育迟缓,生殖器发育受损,伤口愈合迟缓等。另外,缺锌还可致皮肤干燥,味觉减退等。
三、碘
正常成人体内碘含量25-50mg,大部分集中于甲状腺中。成人每日需要量为0.15mg。
碘主要由食物中摄取,碘的吸收快而且完全,吸收率可高达100%。吸收入血的碘与蛋白结合而送输,主浓集于甲状腺被利用。体内碘主要由肾排泄,约90%随尿排出,约10%随粪便排出。
碘主要参与合成甲状腺素(三碘甲腺原氨酸,(T3),和四碘甲腺原氨酸(T4))。甲状腺素在调节代谢及生长发育中均有重要作用。成人缺碘可引起甲状腺肿大,称甲状腺肿。胎儿及新生儿缺碘则可引起呆小症、智力迟钝、体力不佳等严重发育不良。常用的预防方法是食用含碘盐或碘化食油等。
四、锰
成人体内含锰量约10-20mg,主储存于肝和肾中。在细胞内则主要集中于线粒体中。每日需要量为3-5mg。
锰在肠道中吸收与铁吸收机制类似,吸收率较低,仅3?%。吸收后与血浆β1球蛋白、运锰蛋白结合而送输。主要由胆汁和尿中排出。
锰参与一些酶的构成,如线粒体中丙酮酸羧化酶、精氨酸酶等。不仅参加糖和脂类代谢,而且在蛋白质、DNA和RNA合成中起作用。锰在自然界分布广泛,以茶叶中含量最丰富。镁的缺乏较少。若吸收过多可出现中毒症状,主要由于生产及生活中防护不善,以粉尘形式进入人体所致。锰是一种原浆毒,可引起慢性神经系统中毒,表现为锥体外系的功能障碍。并可引起眼球集合能力减弱,眼球震颤、睑裂扩大等。
五、硒
硒是人体必需的一种微量元素,体内含量约14-21mg,广泛分布于除脂肪组织以外的所有组织中。主要以含硒蛋白质形式存在。人体每日硒的需要量为50-200μg。
硒是谷胱甘肽过氧化物酶(GSH桺x)及磷脂过氧化氢谷胱甘肽氧化酶(PHGSH桺x)的组成成分。GSH桺x中每克分子酶四聚体含有4克原子硒,硒半胱氨酸的硒醇是酶的催化中心。该酶在人体内起抗氧化作用,能催化GSH与胞液中的过氧化物反应,防止过氧化物对机体的损伤。GSH桺x活力下降,线粒体不可逆地失去容积控制和收缩能力并最后破裂。缺硒所致肝坏死可能是过氧化物代谢受损的结果。PHGSH桺x与GSH桺x不同,它存在于肝和心肌细胞线粒体内膜间隙中,作用是抗氧化、维持线粒体的完整,避免脂质过氧化物伤害。此外,I型碘甲腺原氨酸5′-脱碘酶(5′ID1)也是一种含硒酶,其活性中心为SeCys,分布于甲状腺、肝、肾和脑垂体中。能催化甲状腺激素T4向其活性形式T3的转化。
近年来研究发现硒与多种疾病的发生有关。如克山病、心肌炎、扩张型心肌病、大骨节病、及碘缺乏病均与缺硒有关。硒还具有抗癌作用,是肝癌、乳腺癌、皮肤癌、结肠癌、鼻咽癌及肺癌等的抑制剂。硒还具有促进人体细胞内新陈代谢、核酸合成和抗体形成、抗血栓及抗衰老等多方面作用。
硒是人体必需的微量元素,但硒过多也会对人体产生毒性作用,如脱发、指甲脱落、周围性神经炎、生长迟缓及生育力降低等。因此不可盲目补硒、推荐的补硒安全值为400-500μg/d。
六、氟
在人体内氟含量约为2-3g,其中90%积存于骨及牙中。每日需要量为2.4mg。
氟主要经胃部吸收,氟易吸收且吸收较迅速。氟主要经尿和粪便排泄、体内氟约80%从尿排出。
氟能与羟磷灰石吸附,取代其羟基形成氟磷灰石,能加强对龋齿的抵抗作用。
3(Ca3(PO4)2)·Ca(OH)2+2F-→3(Ca3(PO4)2·CaF2+2OH-。
此外,氟还可直接刺激细胞膜中G蛋白,激活腺苷酸环化酶或磷脂酶C,启动细胞内cAMP或磷脂酰肌醇信号系统,引起广泛生物效应。
氟过多亦可对机体产生损伤、如长期饮用高氟(>2mg/L)水。牙釉质受损出现斑纹、牙变脆易破碎等。
七、钒
钒在人体内含量极低,体内总量不足1mg。主要分布于内脏,尤其是肝、肾、甲状腺等部位,骨组织中含量也较高。人体对钒的正常需要量为100μg/d。
钒在胃肠吸收率仅5%,其吸收部位主要在上消化道。此外环境中的钒可经皮肤和肺吸收入体中。血液中约95%的钒以离子状态(VO2+)与转铁蛋白结合而送输,因此钒与铁在体内可相互影响。
钒对骨和牙齿正常发育及钙化有关,能增强牙对龋牙的抵抗力。钒还可以促进糖代谢,刺激钒酸盐依赖性NADPH氧化反应,增强脂蛋白脂酶活性,加快腺苷酸环化酶活化和氨基酸转化及促进红细胞生长等作用。因此钒缺乏时可出现牙齿、骨和软骨发育受阻。肝内磷脂含量少、营养不良性水肿及甲状腺代谢异常等。
第十三章 结缔组织生化(Biochemistryof Connective Tissue)
结缔组织是人体中分布最为广泛的一种组织,包括骨、牙、软骨、肌腱、韧带、皮肤角质及血管等(表13-1)。其组成特点是细胞少而间质多,其细胞间质一般由基质(ground substance)和纤维(fiber)两部分组成。基质为无定形的胶态物质,主要成分为蛋白多糖(Proteoglycan)。纤维包括胶原纤维、弹性纤维和网状纤维,分别由胶原蛋白、弹性蛋白及网状蛋白构成。本章着重介绍蛋白多糖和胶原蛋白结构、功能及代谢。
表13-1 各种结缔组织的生化功能和大分子结构
(取自Karlson、Gerok、Groβ著《病理生化学》)
| 组织类型 | 机械性能 | 蛋白质 | 碳水化物* |
| 骨质 | 负荷重量** | Ⅰ型胶原蛋白 | 硫酸软骨素 |
| (抗压、维持外形) | 透明质酸 | ||
| 硫酸角质素 | |||
| 肋软骨 | 抗压、减少摩擦 | Ⅱ型胶原蛋白 | 硫酸软骨素 |
| 弹性好 | (硫酸角质素) | ||
| 肌腱 | 抗张强度大 | Ⅰ型胶原蛋白 | 硫酸皮肤素 |
| 弹性(延性)小 | 硫酸软骨素 | ||
| 大血管 | 延性强 | 弹性蛋白 | 硫酸软骨素 |
| 抗裂性强 | Ⅲ型和Ⅰ型胶原蛋白 | 透明质酸、硫酸皮肤素不相识硫酸乙酰肝素 | |
| (肝素***) | |||
| 关节液 | 润滑防震 | Ⅱ型胶原蛋白 | 透明质酸 |
| 皮肤 | 有中度延性和变形性而 | Ⅰ型(80%)与Ⅲ型胶原蛋白、 | 硫酸皮肤素 |
| 具韧性 | 角蛋白 | 透明质酸 | |
| 基底膜 | 变形性良好、分隔作用、 | Ⅵ型和Ⅴ型蛋胶原蛋白、昆布 | 硫酸乙酰肝素(?) |
| 选择性渗透 | 氨酸粘连蛋白 | ||
| 角膜 | 透明、坚固 | Ⅰ型与Ⅱ型胶原蛋白 | 硫酸角质素 |
| 软骨素(硫酸软骨素) |
*主要成分(多于50%)用黑体字印出,低于10%的组分在括号中。
**以钙盐沉着(羟磷灰石)计。
***肥大细胞的典型多糖。
第一节 蛋白多糖
结缔组织基质中蛋白质与多糖以共价和非共价键相连构成多种巨大分子称为蛋白多糖(proteoglycans)或粘蛋白(mucoproteins)。其分子组成以多糖链为主,蛋白质部分所占比例较小。往往一条多糖链上联结多条多肽链,分子量可达数百万以上。
一、化学结构
蛋白多糖中的多糖链为杂多糖,因其组成成分中均含氨基已糖,所以称为氨基多糖或糖胺聚糖(glycosaminoglycans)。人体组缔组织中常见的氨基多糖包括透明质酸(hyaluronicacid)、硫酸软骨素(chondroitin sulfate)、硫酸角质素(keratan sulfate)和肝素(heparin)等。
表13-2 人体中常见的糖胺多糖
| 名称 | 基本结构单位 | 主要存在部位 |
| 透明质酸 | 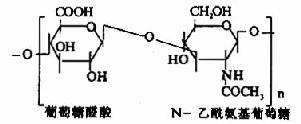 |
关节液、软骨、结缔组织基质、皮肤、脐带、玻璃体液 |
| 4-硫酸软骨素(硫酸软骨素A) | 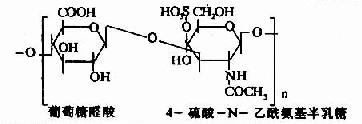 |
骨、软骨、角膜、皮肤、血管 |
| 6-硫酸软骨素(硫酸软骨素C) | 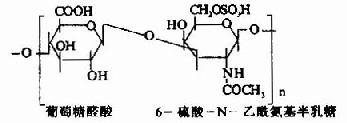 |
软骨、肌腱、脐带、椎间盘 |
| 硫酸皮肤素(硫酸软骨素B) | 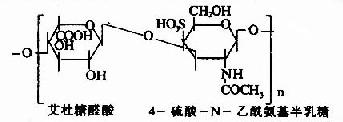 |
皮肤、韧带、动脉、心瓣膜 |
| 硫酸角质素 | 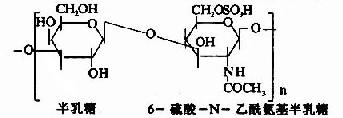 |
角膜、软骨、髓核 |
| 肝素 | 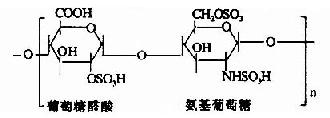 |
肺、皮肤、肝、肠等肥大细胞及嗜碱性白细胞内 |
其中硫酸软骨素B又称为硫酸皮肤素(dermatan sulfate)。各种糖胺多糖的结构单元为二糖单位,均含有乙酰氨基已糖和糖醛酸(硫酸角质素例外,不含糖醛酸而代之以半乳糖)。除透明质酸外都含硫酸。因而糖胺多糖为酸性,加之分子大具有粘性,故又称为酸性粘多糖(acidmucopolysaccharide,AMPS)。
经电子显微镜图形及实验推测,蛋白多糖为“瓶刷状”分子结构(图13-1),其蛋白多糖亚单位(“刷毛”)非共价附着于透明质酸主链上(backbone),其间相隔200-300A。
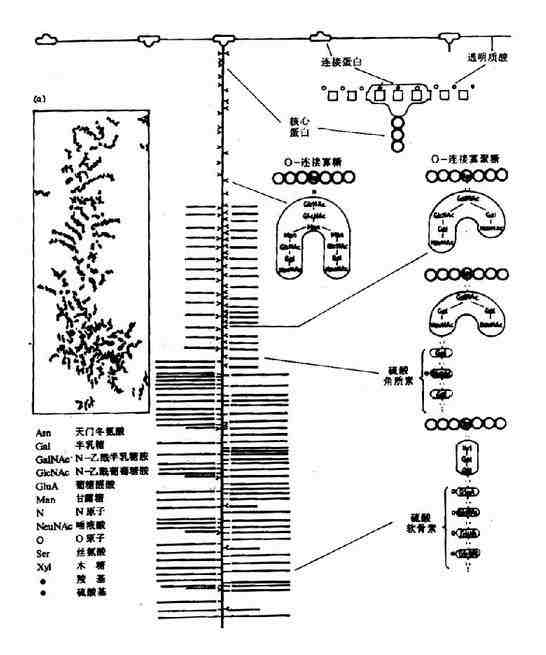
图13-1 蛋白多糖的分子结构
蛋白多糖亚单位由一个核心蛋白(coreprotein)和共价连接其上的糖胺多糖组成,后者主要为硫酸角质素和硫酸软骨素。人体中有多种不同的核心蛋白,分子量达200~300kD,是所有组织细胞中分泌的最大的一种多肽。核心蛋白高度伸展N-末端,形成一球状区,约60-70kD,非共价连接于透明质酸链上,另一种约40-60kD的连接蛋白(link protein)参与稳定球状区与透明质酸链的非共价连接。核心蛋白及多糖组成的亚单位可分为三区:
(1)N-端区:包括球状连接区,含有较少的寡糖链。
(2)富含寡糖区:为硫酸角质素寡糖链的主要附着区。寡糖链共价连接于核心蛋白分子中丝氨酸和苏氨酸残基侧链氧原子上。
(3)C-末端区:富含硫酸软骨素。通过半乳糖半乳糖木糖三糖连接于核心蛋白的丝氨酸残基。
蛋白多糖的透明质酸主链长度为4000~40,000,可附着上百个核心蛋白,每条核心蛋白可结合50条硫酸角质素链和100条硫酸软骨素链,由此可见蛋白多糖分子巨大,分子量可高达数千万。
二、蛋白多糖的生理功能
蛋白多糖分子大,具高度亲水性,对保持结缔组织水分及与组织间物质交换均有重要作用。例如软骨组织中胶原纤维排列成网格状,网格间隙中填充蛋白多糖,因其有高度亲水性,吸附大量水份在其中,当软骨受压时,水分可被挤压出去,而减压后又可重吸进来。关节软骨无血管供应,其营养物质的交换主要靠运动产生压力变化使液体流动。由此可以解释长期不运动导致关节软骨的萎缩。
蛋白多糖的糖链上含有较多的酸性基团,对于细胞外液中Ca++、Mg++、K+、Na+等阳离子有较大的亲和力,因此能调节这些阳离子在组织中的分布。
蛋白多糖分子巨大,有较大的粘滞性,附着于组织表面,能缓冲组织之间的机械磨擦,因而具有润滑、保护作用。例如关节液中的蛋白多糖有润滑关节面的作用。类风湿关节炎患者,关节液中蛋白多糖减少,失去原有润滑作用,因而关节面易被破坏。
蛋白多糖与创伤的愈合亦有密切关系。皮肤创伤后的肉芽形成过程中,通常先有糖胺多糖的增生,进而促进胶原纤维的合成,其机理尚不清楚。近年来发现蛋白多糖可调节某些蛋白生长因子的作用。例如碱性成纤维细胞生长因子(basic fibrotlast growth factor,bFGF)结合于蛋白多糖的肝素或硫酸角质素链上,而且要以bFGF糖胺多糖复合物形式与细胞表面受体结合。bFGF与肝素或硫酸角质素结合能保护bFGF免被降解。当核蛋白水解或肝素或硫酸角质素链部分降解时可释放出活性bFGF糖胺多糖复合物,刺激细胞增殖及分化。其它一些生长因子也有类似作用机制,很明显,广泛和大量存在的蛋白多糖可局限这些生长因子在其分泌细胞短距离内作用。这对于组织的特有结构具有重要意义。
三、蛋白多糖的生物合成
蛋白多糖的合成首先按蛋白质生物合成的原理,在核糖体上合成多肽,并分泌入内质网中,在内质网中修饰过程中,由相应的转移酶催化活性单糖转移到氨基酸的侧链上,合成胺基多糖。但糖链的延伸和加工修饰在高尔基体进行。所以说多肽的合成受专一基因控制,而氨基多糖的合成主要由酶的分隔定位和对酶特异性所决定。
参与胺基多糖合成的各种单糖及其衍生物需先活化成活性单糖,即与二磷酸尿苷(UDP)结合,而各种单糖及其衍生物均可由葡萄糖转变而来,如下图13-2所示:
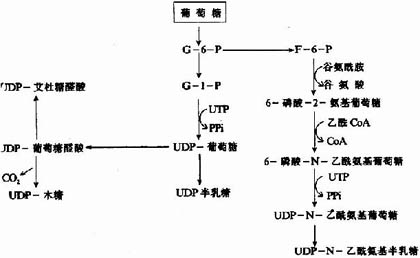
图13-2 各种单糖及其衍生物的来源
糖胺多糖合成的起始步骤是在木糖转移酶(Xylose transfevase)的催化下,将一分子木糖基连接到核心蛋白多肽链的丝氨酸残基上,形成O-糖苷键(O-glycosidicbond)。再由半乳糖转移酶(galactose transforase)催化依次转移两分子半乳糖,构成“木棸霔半”三糖连接区。然后再由高度特异的糖基转移酶作用逐渐按顺序延长,糖链合成后再进一步修饰。由差向异构酶催化将葡萄糖醛酸转变为艾杜糖醛酸,而硫酸基则是由活性硫酸根(PAPS)提供,由硫酸转移酶
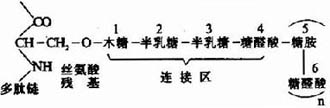
图13-3 糖胺多糖链与多肽链的连接
催化加到新合成的多糖链的氨基或羟基上。(图13-4为硫酸软骨素A合成过程示意图),当Vit A缺乏时硫酸转移酶活性下降,糖胺多糖合成受限,可引起组织生长、发育的障碍。
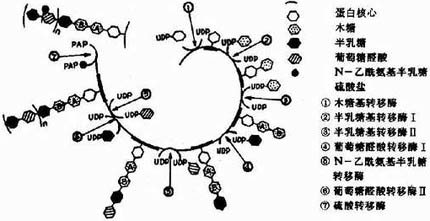
图13-4 硫酸软骨素A的合成示意
四、蛋白多糖的分解代谢
结缔组织基质中的蛋白多糖主要受组织蛋白酶D等的作用,部分肽链水解产生的带多糖链的小片段可被细胞吞噬,进而在溶酶体中逐步水解成各种单糖及其衍生物。因此,溶酶体是糖胺多糖分解的主要场所。
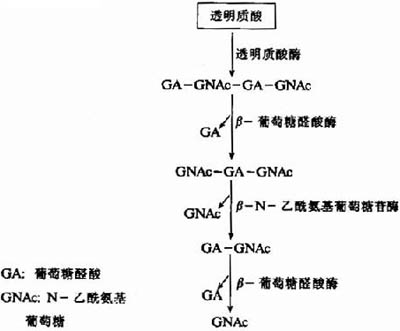
图13-5 透明质酸的水解
溶酶体中分解糖胺多糖的酶包括内切糖苷酶、外切糖苷酶及硫酸酯酶等。如图13-5所示透明质酸的水解过程:首先透明质酸酶(hyaluronidase)为一种内切酶,能水解透明质酸、硫酸软骨素A和C中的β-N-乙酰氨基已糖糖苷键,产生主要为四糖或六糖的寡糖。随后再由β-葡萄糖醛酸酶及β-N-乙酰氨基葡萄糖苷酶等外切酶进一步水解,成为单糖及其衍生物。
大多数糖胺多糖都含有硫酸基团。溶酶体中也存在多种硫酸酯酶,能水解各种硫酸酯键。有些糖苷酶有很强的底物特异性、不能水解带硫酸基的寡糖链,因此,硫酸酯酶的先天性缺乏会引起糖胺多糖分解障碍,导致粘多糖症(mucoplysaccharidoses)。
第二节 胶原蛋白
胶原蛋白(collagen)存在所有多细胞动物体内,是体内含量最多的一类蛋白质,存在于几乎所有组织中,是一种细胞外蛋白质,以不溶纤维形式存在,具高度抗张能力,是决定结缔组织韧性的主要因素。
一、胶原蛋白的结构
单个的Ⅰ型胶原分子分子量约285kD,宽14A,长约3000A。由三条多肽链组成。哺乳动物个体中有30种不同的多肽链构成16种不同的胶原,其中最常见的列于表13-3中。
表13-3 胶原的主要类型
| 类型 | 链组成 | 分布 |
| Type | Chain Composition | Distribution |
| Ⅰ | [a1(Ⅰ)]2a2(I) | 皮肤、骨、肌腱、血管、角膜 |
| Ⅱ | [a1(Ⅱ)]3 | 软骨、椎间盘 |
| Ⅲ | [al(Ⅲ)]3 | 血管、新生儿皮肤 |
图13-6 胶原的右手超螺旋结构
胶原蛋白的氨基酸组成有如下特征:①甘氨酸几乎占总氨基酸残基的三分之一,即每隔两个其他氨基酸残基(X,Y)即有一个甘氨酸,故其肽链可用(甘-X-Y)n来表示。②含有较多在其他蛋白质中少见的羧脯氨酸和羧赖氨酸残基,也有较多脯氨酸(pro)和赖氨酸。如脯氨酸(Pro)和4—羟脯氨酸(4—hydroxyproline,Hyp)含量高达15~30%。同时还含有少量3—羟脯氨酸(3hydroxyproline)和5—羟赖氨酸(5—hydroxylysine,Hyl)。羟脯氨酸残基可通过形成分子内氢键稳定胶原蛋白分子。例如,正常胶原在39℃变性,而在缺乏脯氨酸羟化酶条件下合成的胶原在24℃变性成为白明胶(gelatin)。而羟赖氨酸上可结合半乳糖-葡萄糖苷,与特定组织功能相关。如在基底膜胶原(Ⅳ型)中含hyl较多,含糖也较多,可能与基底膜的滤过功能有关。③胶原中缺乏色氨酸,所以它在营养上为不完全蛋白质。
在胶原纤维中,胶原蛋白分子单位称为原胶原(tropo collagen)。每个原胶原分子由三条α-肽链组成,α-肽链自身为α螺旋结构,三条α-肽链则以平行、右手螺旋形式缠绕成“草绳状”三股螺旋结构(图13-6)。肽链中每三个氨基酸残基中就有一个要经过此三股螺旋中央区,而此处空间十分狭窄,只有甘氨酸适合于此位置,由此可解释其氨基酸组成中每隔两个氨基酸残基出现一个甘氨酸的特点。而且三条α-肽链是交错排列的,因而使三条α-肽链中的Gly、X、Y残基位于同一水平上,借Gly中的N-H基与相邻链X残基上羟基形成牢固的氢键(图13-7),以稳定其分子结构。
原胶原分子平行排列成束,通过共价交联,可形成稳定的胶原微纤维(microfibvil),进一步行聚集成束,形成胶原纤维。胶原分子通过分子内或分子间的交联成为不溶性的纤维。因胶原分子氨基酸组成中缺乏半胱氨酸,不可能象角蛋白那样以二硫键相联,而是通过组氨酸与赖氨酸间的共价交联,一般发生在胶原分子的C-或N末端之间。
图13-7 胶原样多聚体三螺旋轴的C端投影图
胶原纤维在不同组织中的排列方式与其功能相关。如在肌腱、皮肤及软骨,要分别在一维、二维和三维方向承受张力,因而其胶原纤维排列分别为平行束状,多角的纤维片层及不规则排列等方式。(表13-4)
表13-4 胶原纤维在不同组织中的排列
| 组织 | 排列 |
| 肌腱 | 平行束 |
| 皮肤 | 多角的纤维片层 |
| 软骨 | 无规则排列 |
| 角膜 | 交叉排布的光滑片层使光的散身最小化 |
二、胶原的生物合成
结缔组织中的原胶原分子主要由成纤维细胞合成,软骨中胶原由软骨细胞合成,骨胶原来自成骨细胞,基底膜中胶原则由上皮或内皮细胞合成。胶原的生物合成可分为细胞内和细胞外两大阶段。

图13-8 胶原结构示意图
1.细胞内合成阶段
在结缔组织细胞中,首先是按蛋白质合成的原则先合成一条很长的,约1400个氨基酸残基的肽链,称为溶胶原蛋白,而后转入内质网中进行羟基化和糖基化修饰。
(1)羟基化修饰
胶原分子组成中含有羟脯氨酸和羟赖氨酸,这两种氨基酸并无遗传密码、反密码及tRNA引导入肽链,而是在内质网中,由脯氨酸、赖氨酸残基经羟化生成的。由脯氨酸羟化酶(prolylhydroxylase)和赖氨酸羟化酶(lysyl hydroxylase)催化,此酶为加单氧酶,需Fe++和维生素C为辅因子,α-酮戊二酸作辅底物。如脯氨酸的羟化反应:
此羟化反应中需分子氧,缺氧会妨碍胶原的生成,因而缺氧可使伤口愈合延迟。而维生素C是维持羟化酶活性所必需的,缺乏维生素C,胶原合成不能形成正常的纤维,可出现皮肤结节,血管脆弱及伤口愈合缓慢等症状。羟化作用对三股螺旋的坚固性有重要作用,羟化不足的链在体温下不能形成坚固的三股螺旋,因而不能从细胞内排出。
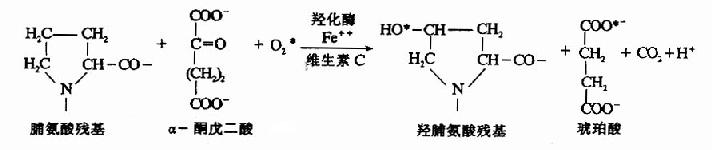
(2)糖基化修饰
胶原分子中含有共价连接的糖基,根据组织不同,糖含量可达0.4-12%。其中糖基主要为葡萄糖、半乳糖及它们的双糖。在内质网中由半乳糖基转移酶及葡萄糖基转移酶催化将糖基联于5-羟赖氨酸残基上。
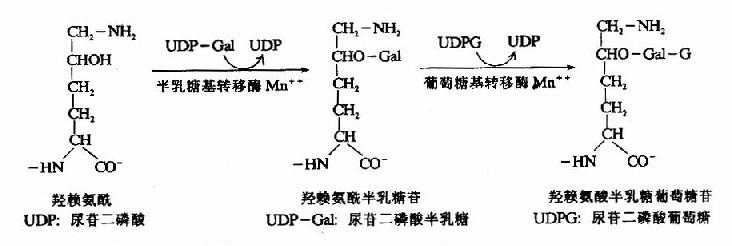
糖基化的作用目前尚未完全阐明,研究发现这些糖基位于胶原纤维中原胶原的接头处。推测糖基化与纤维的定向排列有关。
经羟基化和糖基化修饰的溶胶原蛋白,形成三股螺旋而排出细胞外。
2.细胞外胶原纤维成熟阶段
分泌到细胞外的溶胶原由内切酶作用,水解N—末端和C—末端的附加肽链,形成原胶原蛋白,原胶原分子可在中性pH条件下,借分子间各部分不同电荷的相互吸引而自动聚合成胶原纤维,此种聚合不稳定,经共价交联成网使之进一步固定。
胶原纤维的共价交联由赖氨酸氧化酶(lysyloxidase)催化,此酶含Cu++,是参与交联反应过程的唯一酶,能将赖氨酸转变为醛赖氨酸(allysine)ε-醛赖氨酸与另一α-肽链的ε赖氨酸醛醛缩合生成ε-醛赖氨酸醛酸(Allysinealdol),再与组氨酸反应生成醇醛组氨酸(aldol histidine),后者再与5-羟赖氨酸进行醛胺缩合形成希夫碱结构(图13-9)可使4条α-肽链间共价交联。
通过共价交联,胶原微纤维的张力加强,韧性增大,溶解度降低,最终形成不溶性的胶原纤维。
图13-9 胶原纤维的交联过程
胶原蛋白分子共价交联对胶原正常功能有重要意义。例如人或动物进食山藜豆所致的山藜豆中毒(lathyrivsm)表现为严重的骨、关节及大血管壁的异常,其发病即因为山藜豆毒素β—氨基丙晴(β—mino propionitrile)
![]()
与赖氨酸氧化酶活性位点共价结合而使之失活,从而导致胶原纤维变脆弱。
胶原蛋白与许多人类疾病相关。如骨形成不全(osteogenesis imperfecta)或称脆骨病(brittle bonediesease),即是由于胶原蛋白生物合成或转录后的修饰作用障碍所致。现已清楚是由于I型胶原突变所致,据突变发生的位置及性质不同,发病的严重性亦不同。此外,有些胶原性疾病涉及多种胶原合成紊乱或合成过程中酶(如赖氨酸羟化酶,赖氨酸氧化酶)活性的异常。如EhlersDanlos综合症即有10种以上不同胶原的缺陷,其症状主要为关节过度伸张,皮肤弹性增高、脆弱,血管脆弱及外伤后皮下粘蛋白或皮下脂肪小结形成等,又被称为“印第安橡皮人”(Indiarubber man)。
三、胶原的分解代谢
胶原纤维由于广泛的共价交联,其结构稳定,不易被一般蛋白酶水解。体内有特异作用于胶原的胶原酶(calagenase),对其分解起关键作用。此酶在N椂嗽?/4处切断原胶原,切断后的碎片可自动变性,经细胞外非特异性蛋白酶及肽酶水解或被细胞吞噬后由溶酶体酶进一步分解,形成小分子寡肽或游离氨基酸。
胶原酶在某些修复或再生组织如分娩后子宫、重建的骨组织以及愈合的伤口等含量较高,Ca++为其激活剂。血清中α2巨球蛋白能与胶原酶结合而抑制其活性。胶原酶对温度十分敏感,36℃时酶活性比30℃大10倍。炎症局部温度升高,可能因此加速胶原分解。
胶原分解后产生的寡肽及氨基酸中均含有羟脯氨酸,这在其它蛋白分解产物中少见。因而测定尿中羟脯氨酸或含羟脯氨酸的短肽的含量,可作为判断体内胶原分解的指标。
第三节 弹性蛋白及角蛋白
一、弹性蛋白
弹性蛋白构成弹性纤维,弹性纤维是有橡皮样弹性的纤维,能被拉长数倍,并可恢复原样,它是结缔组织弹性的主要因素。弹性蛋白分布没有胶原蛋白广泛,但在组织内也大量存在,如富有弹性的组织,肺、大动脉、某些韧带、皮肤及耳部软骨等。
弹性蛋白中疏水性氨基酸含量高达95%,其中有许多是甘氨酸、脯氨酸和亮氨酸。弹性蛋白初合成时为水溶性单体,分子量为70000,称为原弹性蛋白(tropoelastin),在修饰中部分脯氨酸羟化生成羟脯氨酸。原弹性蛋白从细胞中分泌出来后,部分赖氨酸经氧化酶催化氧化为醛基,并与另外的赖氨酸的ε-氨基缩合成吡啶衍生物,称为链素(图13-10)。
图13-10
交联后使弹性蛋白卷曲,从而具有弹性、并且使弹性蛋白溶解性降低,稳定性增高。
二、角蛋白
角蛋白(kevatin)是皮肤、毛发和指甲等组织的重要组成成分。是一种抗机械、抗化学刺激的蛋白质,存在于所有高等脊椎动物体中。角蛋白可分为α角蛋白(αkevatin),主要存在于哺乳动物;和β角蛋白(βkevatin),主要分布于鸟类和爬行动物。哺乳动物有30种不同的角蛋白,可分为相对酸性(Ⅰ型)和碱性(Ⅱ型)两类多肽。

图13-11头发的显微结构
通过电子显微镜分析表明:毛发主要由α角蛋白组成,一根典型毛发直接约20μm,由死细胞组成。由约80粗的微纤维(microfibril)通过二硫键交联构成的巨纤维(macrofibrils)组成。
角蛋白中的肽链卷曲为α螺旋,两条分别为Ⅰ型和Ⅱ型的角蛋白肽链紧密结合为平行的左手螺旋二聚体(dimer)此二聚体首-尾相连构成原纤维(protofibril),4条原纤维构成微纤维(microfibril)(图13-11),微纤维再横向粘合为200μm直径的巨纤维(macrofibril)。α-角蛋白富含半胱氨酸,并能与邻近的多肽链通过二硫键进行交联,因此,α-角蛋白很难溶解,并受得起一定的拉力。烫发时先用巯基化合物破坏二硫键使之易于卷曲,然后用氧化剂恢复二硫键使卷曲固定。
图13-12 α角蛋白的结构
遗传性皮肤疾病表皮松懈单片疱疹(epidermolysis bullosa zimplex EBS)和表皮松懈角化过度症(epidermolytichyperkeratosis,EHK)在对常人无害的机械摩擦下使上皮基底细胞和表皮基底细胞破裂而生成水疱为特征。研究表明EBS主要是皮肤14或5型角蛋白的异常,而EHK则主要是1或10型角蛋白的异常,由此可见角蛋白在维持人体正常生理防护功能方面有重要意义。
第四节 结缔组织代谢的调节
生长激素在促进蛋白质合成的同时亦促进蛋白多糖和胶原的合成。动物实验表明,生长激素的促软骨生长作用,至少部分是通过生长调节素A(somatomedin A)而间接作用的,它刺激软骨细胞的增殖和硫酸盐掺入蛋白多糖,所以又称“硫酸化因子”。
甲状腺素促进蛋白多糖的分解,甲状腺功能低下时常出现粘液性水肿,与蛋白多糖分解减弱在皮下蓄积有关。
睾丸酮和雌激素均可促进透明质酸的合成,而肾上腺皮质激素能稳定溶酶体,减少溶酶体酶的释放,从而维持蛋白多糖的稳定。胰岛素可促进糖胺多糖的合成,糖尿病人创伤愈合缓慢、易感染及并发血管退行性变等可能与此有关。糖皮质激素对胶原蛋白的合成及分解均有影响,长期使用可产生皮肤变薄、骨质疏松以及延缓创伤愈合等副作用,用药时应加以注意。
第十四章 神经组织生化(Biochemistry of Neural Tissue)
神经组织生化或称神经生化学(neurochemistry),半个多世纪以来已发展成为一门独立的学科。然而,由于神经系统结构和功能极为复杂以及研究方法上的难度较大,迄今积累的资料还很不完备,特别是有关代谢与功能间的内在联系,很多问题还不十分清楚。因此,本章仅就与医学关系较密切的某些问题,有选择地加以介绍,而不是系统地阐述。
第一节 血脑屏障
大约在一百年前就已发现,给动物注入活性染料,全身组织都染上色而唯独脑组织却不染色。但是如果把染料直接注入蛛网膜下腔,则脑组织迅速被染色。以后的大量实验研究表明,有些物质完全不能由血进入脑组织间液;有些物质进入很缓慢;而有些物质的进入颇为迅速。总之,在血-脑之间有一种选择性地阻止某些物质由血人脑的“屏障(barrier)”存在,称为血脑屏障(BBB)。血脑屏障的功能在于保证脑的内环境的高度稳定性,以利于中枢神经系统的机能活动,同时能阻止异物(微生物、毒素等)的侵入而有保护作用。
一、血脑屏障的结构特点
血脑屏障的物质基础是脑的毛细血管,它与其他组织中的毛细血管不同,有以下三个特点:
(1)脑毛细血管内皮细胞间相互“焊接”得十分紧密,不象其他组织毛细血管壁那样有较大的缝隙;(2)毛细血管内皮细胞外的基底膜(basement membrane)是连续的;(3)毛细血管壁外表面积的85%都被神经胶质细胞的终足所包绕。由此可见,物质由血液进入脑组织间液要穿越较多的层次,包括脂性的(质膜)和非脂性的(基底膜)膜的结构。其中,穿越毛细血管内皮细胞是关键性的步骤。与其他组织,譬如肌肉组织的毛细血管内皮细胞相比较,脑毛细血管内皮细胞的胞饮作用(pinocytosis)很微弱。因此,对脑毛细血管内皮细胞来说,借胞饮作用转运物质(大分子和电解质)的能力是很有限的,这就更加强了脑毛细血管壁的屏障功能。
二、物质通过血脑屏障的方式
物质可以通过扩散(diffusion)或载体转运(mediated transport)的方式由血液进入脑组织,从脑组织进入血液。
以扩散方式通过血脑屏障的物质最主要的是水和气体。静脉注入重水(D2O)的示踪实验表明,脑中水分子交换的半寿期为12-25秒。水可以根据血浆渗透压的改变而自由进出脑组织。临床上采用静脉注入甘露醇一类的物质,提高血浆渗透压,可使脑脱水以降低颅内压,O2、CO2、N2O等气体以及挥发性麻醉剂亦可迅速扩散进入脑组织。脂溶性物质及脂溶剂容易透过亲脂性的质膜,因而也能迅速扩散入脑,已知扩散最快的物质是乙醇。
葡萄糖、氨基酸和各种离子是靠载体转运的。由于葡萄糖载体转运系统的立体特异性(stereospecificity),只有D-葡萄糖才能进入脑,而L-型的则不能。各种氨基酸进入脑组织的快慢不同,这与有无相应的氨基酸载体以及载体的量与质(特异性)有关。引人注目的是凡营养上必需的氨基酸大都转运迅速,而难以越过血脑屏障的都是非必需氨基酸。各种离子的转运快慢也不同,但都比进出其他组织的速度慢得多。可扩散入脑的物质一旦解离形成离子则越过血脑屏障的速度减慢,例如NH3、水杨酸(未解离者)、CO2分别较NH+4、水杨酸根、HCO3-进入脑组织快。H+的转运也很慢,与CO2的迅速扩散呈鲜明对比。注意到这个特点对理解血液pH与脑组织pH的不一致很重要,即血液的Pco2比血液pH更能反映脑组织的酸碱度。当用碱性药物(NaHCO3)纠正糖尿病酸中毒时要谨慎,因为CO2的扩散比HCO3-的进入脑组织要快,这就有可能使脑组织的pH进一步下降。
三、影响因素
物质通过血脑屏障的难易取决于两方面的影响因素:一是物质本身的性质和状态;另一是血脑屏障的结构和功能。
(一)物质的亲脂性与亲水性
细胞膜是以类脂为基础的双分子层结构,所以凡是亲脂性强的物质就易于透过细胞膜;反之,亲水性强者则不易透过。而物质的亲脂性与亲水性又取决于物质的化学结构:含极性基团多者亲水性强;含疏水基团多者则极性小而亲脂性强。亦即物质的极性与亲脂性之间呈负相关。在药物学上应用这一原理,可以把某些作用于中枢神经系统的药物进行化学修饰,降低其极性,增强其亲水性,使其能更迅速地透过血脑屏障,从而提高药物的疗效。例如把巴比妥转变为苯巴比妥而提高催眠药的效果。
(二)与血浆蛋白的结合
在一般组织的毛细血管,亲水性物质大多通过内皮细胞之间的缝隙并越过基底膜而进入组织内(通透性,permeability)。但是,如前所述,脑毛细血管内皮细胞之间“焊接”十分紧密,通透性较小,实验证明,分子量大于2,000的物质即不能由内皮细胞联接处通过。因此,与血浆蛋白结合的物质就难以通过血脑屏障,而实际上血浆中的许多物质(激素、脂肪酸、胆红素等)又都是与血浆蛋白结合而运输的,由于物质与血浆蛋白的结合是可逆的,所以结合与解离的动态平衡直接影响到物质通过血脑屏障的速度。例如患高胆红素血症(参看肝脏生化)的婴儿,血中胆红素与血浆蛋白结合,从而防止胆红素进入脑组织造成损害。但是如果此时给以磺胺类药物。由于后者能同胆红素竞争与血浆蛋白的结合,使大量游离的胆红素(亲脂性)迅速通过血脑屏障,可引起严重的后果。
(三)载体转运系统
脑毛细血管内皮细胞膜上有多种载体蛋白,能促进一些本来难以通过血脑屏障的极性分子的转运。已经肯定的载体系统有:(1)已糖载体;(2)中性氨基酸载体;(3)碱性氨基酸载体;(4)短链单羧酸载体等。
葡萄糖载体具有较强的特异性已如前述。此外,甘露糖亦能较快进入脑组织,半乳糖次之, 而果糖则很难通过血脑屏障。由于缺乏酸性氨基酸载体,所以谷氨酸和天门冬氨酸是难以通过血脑屏障的。必需氨基酸特别是芳香族的和支链的最容易通过血脑屏障,蛋氨酸的通过亦较迅速。尽管能通过血脑屏障的氨基酸甚多,但已发现的氨基酸载体却只有少数几个,因此,至少有些氨基酸载体的特异性不是很强的,于是就有可能出现竞争的现象。例如,患先天性苯丙酮酸尿症(phenylketonuria,PKU)的小儿,血中苯丙氨酸浓度太高,影响色氨酸进入脑组织,导致小儿脑发育不全。
(四)生物转化作用
某些物质在通过脑毛细血管内皮细胞时将遭受到胞浆内酶系统的作用而被破坏,所以即使能进入毛细血管内皮细胞的物质也不一定都能通过血脑屏障而进入脑实质。现已发现脑毛细血管内皮细胞含有单胺氧化酶(MAO)可使属于单胺类的神经递质(如儿茶酚胺,5-羟色胺等,见后)氧化分解,又γ-氨基丁酸(GABA)虽然可被脑毛细血管内皮细胞摄入,但却又遭受细胞内GABA转氨酶的作用而被破坏,如果用β-氨基乙酸抑制该酶则GABA是可以进入脑组织的。脑毛细血管壁内的这种生物转化作用加强了血脑屏障的屏蔽功能,使脑组织的内环境免受血液中化学成份骤然变动的影响。
(五)发育的影响
新生儿血脑屏障发育不全,通透性较高。正在迅速生长的脑组织对某些积极进行代谢的物质摄取率大增,这可能是由于转运本身加快,也可能是由于代谢物的高转换率所致。
此外,脑的不同区域的血脑屏障也存在着差别。病理情况下,例如血管性脑水肿、脑肿瘤、以及电离辐射损伤等均可发生血脑屏障通透性的增高。
第二节 脑代谢的某些特点
一、能量供应(Energy Supply)
脑的活动瞬息万变,需要大量能量的及时供应。脑细胞本身的生物高分子(核酸及蛋白质)的合成以及神经递质的合成与释放固然都是耗能的过程,但这些尚不足以说明为什么脑细胞的功能活动较之其他组织细胞要消耗更多的能量。脑的能量消耗主要在于经常不断地把Na+泵出细胞外,使去极化(depolarization)后的膜迅速恢复膜电位,以维持神经的兴奋和传导。脑的代谢率(metabolic rate)是很高的,它可以用单位时间的耗氧量(oxygenconsumption)和基质消耗量或产物生成量作指标来表示,如表14-1。
表14-1 正常青年男子的脑血流量和代谢率
| 速率 | ||
| 每百克脑组织 | 全脑 | |
| 血流量(ml/分) | 57 | 798 |
| 耗氧量(ml/分) | 3.5 | 49 |
| 葡萄糖消耗(mg/分) | 5.5 | 77 |
| CO2生成(ml/分) | 3.5 | 49 |
脑血流量占心输出量的15%,耗氧量占全身总耗氧量(约250ml/分)的20%,然而脑的重量只不过占体重的2%。分析流入和流出脑组织血液的化学成分(动静脉差法)发现,除了葡萄糖外,其他可作为能源的物质没有明显的减少。由上表可见每百克脑组织每分钟产生的二氧化碳和消耗的氧均为3.5ml(156微克分子),呼吸商(respiratoryquotient)为1。再者,按化学计算(1克分子葡萄糖完全氧化要消耗6克分子的氧),葡萄糖的消耗率还稍高于氧的消耗率。
这些事实综合起来说明,脑组织是以葡萄糖的氧化来供能的,甚至可以说,至少在正常条件下,脑组织唯一利用糖作为能源。因为脑中糖原含量很少(小于0.1%),所以必须依赖血糖的供应。虽然脑组织还可以利用酮体,但必须以低血糖为前提,例如在饥饿引起酮血症(ketonemia)的情况下。如果血糖和血酮体均增高时(糖尿病酮血症),脑仍然优先利用葡萄糖以供能。有人认为,脑利用酮体作能源是对饥饿时低血糖的适应,长期慢性饥饿的病人,脑的耗氧量的一半可用来氧化酮体。
脑细胞含有完整的糖酵解(EMP)酶系,已糖激酶活性约为其他组织的20倍。但是即使最大程度地发挥糖酵解的作用也不能满足供能的需要,而必须依赖糖的有氧氧化。所以氧的供给一刻也不能中断。由于脑组织主要依赖糖的有氧氧化供给能量,所以它对缺糖和缺氧均极敏感。血糖下降50%即可致昏迷,而中断(流向脑的)血流几分钟就可引起死亡。临床上使用大剂量胰岛素做为治疗手段也可以引起昏迷。胰岛素对脑的这种影响,现在认为是间接作用的结果,也就是因为胰岛素降低了血糖之故。因为胰岛素是大分子物质,它不能透过血脑屏障,这和对其他组织或周围神经组织的作用不同。在那些组织,胰岛素的作用可能主要是直接影响其对葡萄糖的摄取。
脑内ATP的水平甚高,它的合成和利用均很迅速。据测定,脑内ATP末端磷酸基的半数更新时间平均只有约3秒钟,脑组织的磷酸肌酸(CP)水平比ATP还要高,它可看作是ATP末端高能磷酸键的一种贮存形式。在磷酸肌酸激酶(CPK)的催化下,ATP和CP可相互转变。
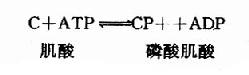
这是一个等能反应,因此在相互转变中不致于有能量的丢失。脑中CPK活性较强,有利于能量的贮存和动用。此外,脑组织中还有活性较强的肌激酶(myokinase),它可催化下列反应。此反应的意义在于“挖掘潜力”,即充分利用ATP中的两个高能磷酸键。
上述两种激酶都是维持脑内高水平ATP的有力保证。
二、类脂的组成和代谢
除脂肪组织外,脑是全身含脂类最多的组织,但脂肪组织主要含甘油三酯(贮存脂),而脑组织中的脂类几乎全是类脂。脑干重的1/2是脂类,这是就全脑平均而言,如果分别测定脑灰质和脑白质的化学成分,就会发现灰质含水份和蛋白质较多,脂类仅占干重的1/3;而白质中的脂类含量较多,约占干重的55%。
表14-2 正常成人脑的脂类组成
| 成分 | 灰质 | 白质 | ||||
| 温重(%) | 干重(%) | 总脂(%) | 温重(%) | 干重(%) | 总脂(%) | |
| 水 | 81.9 | 71.0 | ||||
| 总脂 | 5.9 | 32.7 | 100 | 15.6 | 54.9 | 100 |
| 总磷脂 | 4.1 | 22.7 | 69.5 | 7.2 | 25.2 | 45.9 |
| 胆固醇 | 1.3 | 7.2 | 22.0 | 4.3 | 15.1 | 27.5 |
| 总半乳糖苷脂 | 0.4 | 2.4 | 7.3 | 4.1 | 14.5 | 26.4 |
| 总神经节苷能 | 0.3 | 1.7 | 0.05 | 0.18 | ||
由上表可见,以湿重计,脑白质中脂类含量约三倍于灰质。这种差别主要是由于白质中的神经纤维外被以髓鞘(myelin sheath),而髓鞘的脂类可高达干重的70-80%。
脑中的类脂主要用以构成神经元(neurone)的质膜和髓鞘。这些膜性结构与其他组织细胞的膜结构有共同之处,即都是由类脂与蛋白质构成的复合物,但在类脂的组成和代谢上亦有一些特点。尤其是髓鞘,它含有某些特殊的类脂成分,这些成分或者仅见于髓鞘,或者髓鞘中含量较多,而在其他组织中则较少见,例如缩醛磷脂(plasmalogen)和脑苷脂(cerebroside)。
脑不从血中摄取脂肪酸,本身也不含游离脂肪酸,那么组成这些类脂的脂肪酸是从哪里来的呢?实验证明,脑中的脂肪酸和胆固醇都可由乙酰CoA合成,而乙酰CoA的主要来源还是葡萄糖。
髓鞘形成(Myelination)之前的未成熟的脑组织含胆固醇和磷脂较多,而含脑苷脂极少,脑苷脂合成酶系的活性也极低。当髓鞘形成时,此酶系的活性升高,脑苷脂的含量亦相应增多,髓鞘形成与神经系统的发育和功能密切相关,而髓鞘脱落(demyelination)是神经系统疾病的重要的病理改变之一。髓鞘的代谢特点是正在进行髓鞘形成时代谢很快,一旦形成之后就变得很慢,成为体内最稳定的一种结构。据认为,这是由于髓鞘缺乏催化类脂分解代谢的酶系。已经形成的髓鞘,除了个别成分(如三磷酸肌醇磷脂)有较高的更新率外,其他磷脂和胆固醇等的更新率均甚低。
三、谷氨酸的代谢与功能
脑的游离氨基酸组成与血浆有很明显的差别,这是由于血脑屏障的特点和脑本身氨基酸代谢特点造成的。脑和血浆中某些游离氨基酸的含量对比如表14-3。
表14-3 人脑和血浆中某些游离氨基酸的含量
| 氨基酸 | 脑 | 血浆 |
| 微克分子/克 | 微克分子/毫升 | |
| 谷氨酸 | 10.6 | 0.05 |
| N-乙酰天门冬氨酸 | 5.7 | - |
| 谷氨酰胺 | 4.3 | 0.7 |
| γ-氨基丁酸 | 2.3 | - |
| 天门冬氨酸 | 2.2 | 0.01 |
| 色氨酸 | 0.05 | 0.05 |
由表14-3可见,脑中游离氨基酸以谷氨酸(Glu)含量最高,它比其在血浆中的浓度要高出200倍以上。谷氨酸、谷氨酰胺(Gln)和γ氨基丁酸(GABA)三者含量总和约占脑中游离氨基酸总量的一半。所以,在脑的氨基酸代谢中,谷氨酸占有重要位置。
然而,谷氨酸难以通过血脑屏障,脑内谷氨酸来源于自身的合成,同位素示踪实验表明脑内谷氨酸合成的原料是葡萄糖,它来自血糖。葡萄糖进入脑细胞后先转变成α-酮戊二酸(α-KG),后者可在谷氨酸脱氢酶的催化下转变成谷氨酸,亦可经转氨基作用生成谷氨酸,一般认为后一途径更切合实际,因为谷氨酸脱氢酶(GDH)催化逆反应时KmNH4+为8mM,远高于细胞内氨之浓度。谷氨酸在谷氨酰胺合成酶的作用下与氨结合成为谷氨酰胺,这是一个耗能反应(消耗ATP),脑中谷氨酰胺合成酶的活性强,其KmNH4+仅为0.39mM。所生成的谷氨酰胺,与谷氨酸不同,可以通过血脑屏障而进入血中,这样,脑组织从血中摄入葡萄糖,通过代谢,还血液以谷氨酰胺,清除了脑中的氨,以免氨的积存危害脑的功能。
图14-1 脑中谷氨酸代谢与氨的消除
脑中谷氨酸代谢的另一个特点是脱羧生成γ-氨基丁酸(又名γ-氨酪酸GABA),催化此反应的酶是谷氨酸脱羧酶(GAD),它需要磷酸吡哆醛作辅酶。GABA是一种抑制性的神经递质,仅见于中枢神经系统。脑内GABA主要贮于灰质,特别是纹状体、黑质、小脑的齿状核等处。
GABA对中枢神经元有普遍性抑制作用。1963年曾有人提出,GABA能作用于突触前神经末梢,减少兴奋性递质的释放,从而引起抑制。这种效应称为突触前抑制(presynaptic inhibition)。GABA在脊髓中的作用就是以突触前抑制为主。在脑内则GABA主要是引起突触后抑制(postsynaptic inhibition)。睡眠时皮层释放GABA增多,因此有人认为GABA可能与睡眠、觉醒的生理机能有关。
 |
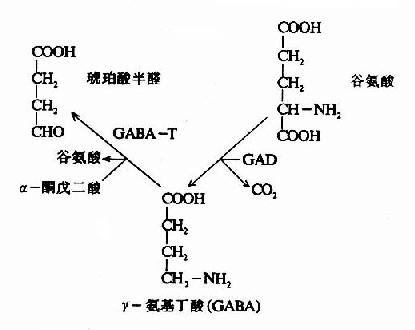 |
| 图14-2a 脑中TCA循环和GABA代谢旁路 | 图14-2b GAD和GABA-T的作用 |
在神经元胞体和突触(synapse)的线粒体内含有大量的γ-氨基丁酸转氨酶(GABA-T),它可催化GABA与α酮戊二酸之间的转氨作用,生成琥珀酸半醛(succinic acid semialdehyde)和谷氨酸。这可看作是GABA灭活的一种方式。GABA-T也是需要磷酸吡哆醛作辅酶,但与GAD比较,它同磷酸吡哆醛的亲和力大,所以当体内维生素B6缺乏时,主要影响GAD的活性。例如,使用异烟肼治疗结核病时,由于异烟肼能与维生素B6(吡哆醛)结合成异烟腙(isoniazone),加速维生素B6从尿中排泄,引起脑组织内维生素B6浓度下降,GAD活性亦下降,结果GABA的合成受阻,容易使中枢过度兴奋而发生抽搐等症状。所以长期使用异烟肼时应合并使用维生素B6。此外,临床上对于惊厥、妊娠呕吐的病人,也常使用维生素B6,其道理也是提高脑组织内GAD的活性,使GABA生成增多,中枢抑制相对加强。
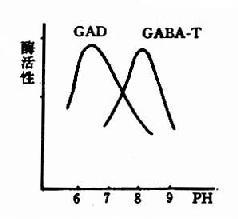
图14-3 GAD与GABA-T的作用最适pH
GABA经转氨作用后的产物琥珀酸半醛可脱氢生成琥珀酸,后者进入三羧酸循环而被氧化利用。因此,与脑组织中的三羧酸循环相连系,存在着一条GABA代谢旁路(GABa shunt)。
谷氨酸脱羧酶与γ-氨基丁酸转氨酶的协同作用对保持脑中GABA一定浓度有重要意义。两种酶的最适pH不同,GAD的最适pH为6.5,而GABA-T则为pH8.2。(图14-3)由此可见,脑细胞内pH稍有变动就可明显改变这两种酶的活性对比。当酸中毒时,脑中GAD活性增强而GABA-T活性减弱,可致脑中GABA水平上升,呈现中枢抑制;反之,当碱中毒时脑中GABA-T活性增强而GAD活性减弱,脑中GABA水平下降,易于发生痉挛。
尚须指出,谷氨酸对神经中枢有兴奋作用,而其脱羧产物GABA却有抑制作用,所以谷氨酸的代谢与中枢的兴奋和抑制调节有关。此外,通过GABA代谢旁路,也把脑的氧化代谢与兴奋抑制功能联系起来了。
第三节 神经递质(Neurotransmitter)的代谢
神经系统内存在着许多化学物质,但它们不一定都是递质(transmitter)。作为神经递质,必须具备几个基本条件:(1)被认为是递质的物质应特异性地存在于以该物质为递质的神经元中,而且,在这种神经元的末梢有合成该递质的酶系统;(2)递质在神经末梢内合成以后,通常是集中贮存在囊泡(vesicle)内,这样可以防止被胞浆内的其它酶所破坏;(3)当神经冲动到来时,神经末梢内的递质就自突触前膜释放入突触间隙;(4)递质通过突触间隙,作用于突触后膜的叫做受体的特殊部位,引起突触后膜离子通透性改变以及电位变化;(5)神经递质在发挥上述效应后,其作用应该迅速终止,以保证突触传递的高度灵活。作用的终止有几种方式:一是被酶所水解,失去活性;其次是被突触前膜“重摄取”,或是一部分为后膜所摄取;也有的部分进入血循环,在血中一部分被酶所降解破坏。
目前已知的神经递质种类很多,但主要的有乙酰胆硷、儿茶酚胺类(去甲肾上腺素和多巴胺)、5羟色胺、GABA、某些氨基酸和寡肽等。
一、乙酰胆碱(Acetylcholine简写Ach)
乙酰胆碱是许多外周神经如运动神经、植物性神经系统的节前纤维和付交感神经节后纤维的兴奋性神经递质。
(一)合成和贮存
Ach由胆碱和乙酰CoA所合成。胆碱乙酰化酶(choline acetylase)催化下列反应:
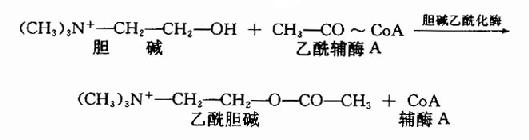
由于胆碱乙酰化酶位于胞浆内,因此设想Ach是先在胞浆内合成,然后进入囊泡贮存。平时囊泡中和胞浆中的Ach大约各占一半,且两者可能处于平衡状态。囊泡内贮存的Ach是一种结合型的(与蛋白质结合),而释放至胞浆时,则变为游离型。
(二)释放、重摄取和失活
当神经冲动沿轴突到达末梢时,囊泡趋近突触膜,并与之融合、破裂,此时囊泡内结合型Ach转变为游离型Ach,释放入突触间隙。同时,还可能有一部分胞浆内新合成的Ach也随之释放。
Ach作用于突触后膜(突触后神经元或效应细胞的膜)表面的受体,引起生理效应。已经确定Ach受体是一种分子量为42,000的蛋白质,通常以脂蛋白的形式存在于膜上。
Ach在传递信息之后和受体分开,游离于突触间隙,其中极少部分在突触前膜的载体系统作用下重新被摄入突触前神经元。大部分Ach是在胆碱酯酶的作用下水解成胆碱和乙酸而失去活性,也有一部分经弥散而离开突触间隙。关于乙酰胆碱在神经末梢中的代谢,可总结如图(14-4,14-5)。
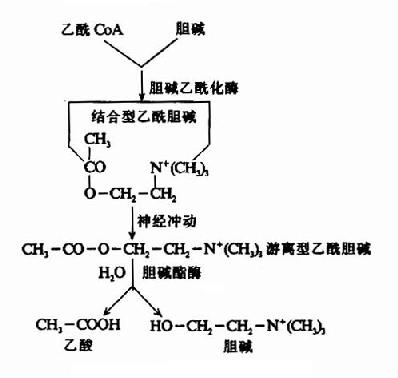 |
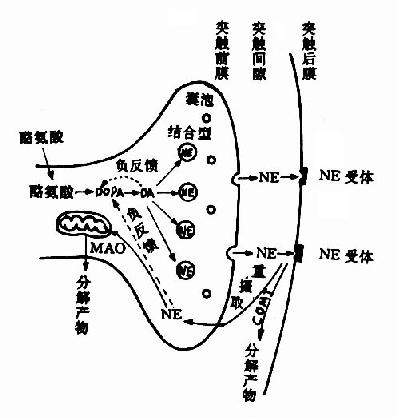 |
| 图14-5 乙酰胆碱的代谢 | 图14-4 突触部位Ach的动态 |
二、儿茶酚胺类(Catecholamines)
儿茶酚胺类是指含有邻苯二酚基本结构的胺类。体内具有生物活性的儿茶酚胺包括多巴胺(dopamine,DA)、去甲肾上腺素(norepinephrine,noradrenaline,NE)和肾上腺素(epinephrine,adrenalin,E)。它们的结构如下。
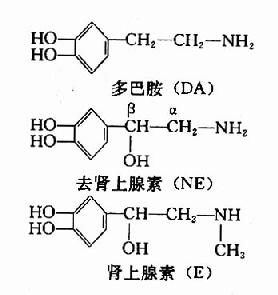
去甲肾上腺素和肾上腺素既是肾上腺髓质所分泌的激素,又是交感和中枢神经系统中去甲肾上腺素能纤维的神经递质。NE在中枢内分布广泛,含量较多,E则少,因此我们着重介绍NE的代谢。DA则主要集中在锥体外系,也是一种神经递质。
(一)儿茶酚胺的生物合成
神经组织中儿茶酚胺的合成原料来自血液中的酪氨酸,其合成过程如图14-6。
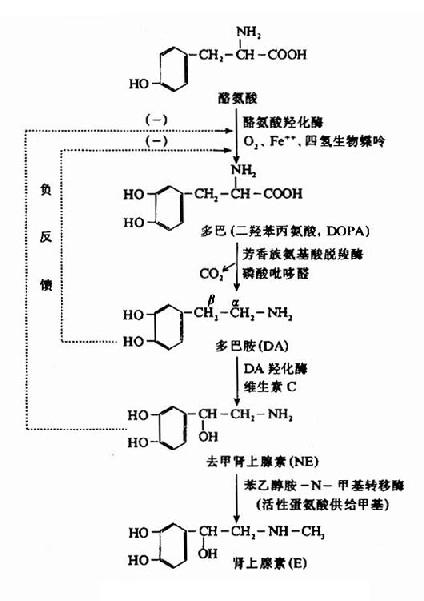
图14-6 儿茶酚胺类的生物合成
在上述过程中,第一步有酪氨酸羟化酶参加,它位于去甲肾上腺素能神经纤维的胞浆内,含量少,活性低,成为NE生成的限速酶,四氢生物蝶呤是它的辅酶,O2和Fe++也是合成时必不可少的因素;第二步反应是由胞浆中芳香族氨基酸脱羧酶所催化,这酶的特异性不高,和一般氨基酸脱羧酶一样,要求磷酸吡哆醛作为辅酶;第三步是多巴胺羟化酶催化的氧化反应,氧化发生在β碳原子上,此酶不存在于胞浆而是附于囊泡内壁,属于含Cu++的蛋白质,并需要维生素C为辅助因子。
从以上各酶的亚细胞水平分布可以了解,合成NE的最后一步只能在囊泡内进行,NE合成量不仅受酪氨酸羟化酶限速调节,而且当神经末梢胞浆中游离的NE浓度过高时,还可以因反馈性抑制酪氨酸羟化酶的作用而减少NE的合成。
苯乙醇胺-N-甲基转移酶主要见于肾上腺髓质细胞,可使NE甲基化生成肾上腺素。此酶在脑内虽有少量存在,但一般认为正常时哺乳类脑内的肾上腺素含量极少。有人认为,如果苯乙醇胺N甲基转移酶活性过高,可以使多巴胺直接变成N甲基多巴胺等物,造成这些递质的代谢紊乱,这可能是精神分裂症的原因之一。
(二)去甲肾上腺素(NE)
1.贮存和释放 NE在囊泡内合成后就地贮存。它和ATP、嗜铬颗粒蛋白等疏松地结合在一起,这样,就使NE不易渗入胞浆而遭单胺氧化酶的破坏。当神经冲动到达末梢时,突触前膜附近的囊泡便与前膜融合,破裂并生成小孔。这时囊泡内的NE连同嗜铬颗粒蛋白等一起被释放入突触间隙。
2.突触间隙中NE的去向 释放入突触间隙的NE能与突触后膜上的NE受体结合,产生生理效应。然后,约有3/4的NE重新被突触前膜所摄取。摄入胞浆后的NE又可进入囊泡贮存。重摄取是一种耗能过程,与突触前膜上的Na+,K+ATP酶系统及囊泡膜上的Mg++-ATP酶系统有关。另外一部分NE则为后膜所摄取,并在那里被分解灭活。还有一部分是在突触间隙中被破坏或逸入血液。除了被突触前膜和囊泡重摄取的NE可再供利用外,其余的NE大都遭到酶促降解而灭活。NE的酶促降解如图14?所示,单胺氧化酶(MAO)和儿茶酚-O-甲基转移酶(catecholotransmethylase,COMT)是催化儿茶酚胺分解的两种主要的酶,它们不仅存在于神经组织内,而且广泛地分布于非神经组织,神经元的线粒体膜上也很多。NE受MAO作用,首先氧化脱氨基生成醛,后者再变成醇或酸。3-甲氧基-4-羟基苯乙二醇(MHPG)是中枢内NE的主要降解产物。在外周则以氧化成香草基扁桃酸(VMA)为主。血液循环中的NE(主要是激素),则在肝、肾等组织经COMT作用变成甲氧基代谢产物而排泄。现在,临床上常测定尿中VMA含量,作为了解交感神经功能的指标,患嗜铬细胞瘤和神经母细胞瘤时,由于肿瘤组织也产生NE或E,其代谢产物VMA相应增多,故在诊断上颇有意义。
关于NE在突触部位的动态可用图14-8表示。
图14-7 去甲肾上腺素的分解代谢
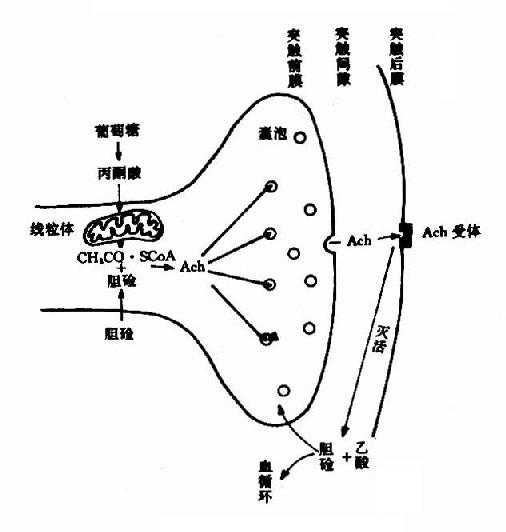
图14-8 突触部位NE的动态
中枢神经系统内的去甲肾上腺素能神经元胞体集中在延脑和桥脑,其通路都已研究明确。但是NE在中枢究竟是抑制性还是兴奋性的递质,目前尚不能肯定,可能随部位不同而异。NE所引起的生理效应也很难用简单的术语“兴奋”、“抑制”来表达。根据一些动物实验观察到,NE可引起动物嗜睡,体温降低,出现摄食行为。有人认为,脑内NE减少,可表现出精神抑郁;反之,过量可表现出狂躁。总之,脑内NE的功能可能和体温、摄食行为、镇痛、心血管系统和精神状态的调节有密切关系。
(三)多巴胺(DA)
在儿茶酚胺类递质的生物合成过程中,多巴胺是去甲肾上腺素的前体。体内凡有NE的组织,其中必然也有DA。由于DA在中枢某些部位中浓度很高,而且它的分布又与NE不平行,所以一般认为它本身也是一种独立的神经递质。
脑内多巴胺的作用是多方面的,它可能和躯体运动功能的加强,垂体内分泌机能的加强以及精神活动的调节都有关系。
多巴胺能神经末梢中的囊泡是贮存DA的场所。这种囊泡不同于NE囊泡,前者不含多巴胺β羟化酶,所以不致将DA羟化成NE。此外,在去甲肾上腺素能纤维中,NE囊泡对贮存物的要求是β位置上有羟基,而DA结构上没有β羟基。DA的贮存、释放和酶促降解都和NE十分相似,而更新速度则较NE快。脑内DA的代谢产物主要是3-甲氧基-4-羟基苯乙酸(homovanillic acid简写HVA,又名同型香草酸)
三、5-羟色胺(5-ydroxytryptamine 简写5-HT)
5-羟色胺又名血清紧张素(serotonin),最早是从血清中发现的。中枢神经系统存在着5-色胺能神经元,但在脊椎动物的外周神经系统中至今尚未发现有5-羟色胺能神经元。
由于5-羟色胺不能透过血脑屏障,所以中枢的5-羟色胺是脑内合成的,与外周的5-羟色胺不是一个来源。用组织化学的方法证明,5-羟色胺能神经元的胞体在脑内的分布主要集中脑干的中缝核群,其末梢则广泛分布在脑和脊髓中。
(一)合成、贮存和释放
5-羟色胺的前体是色氨酸。色氨酸经两步酶促反应,即羟化和脱羧,生成5-羟色胺。此过程在某种程度上和儿茶酚胺的生成相似。
图14-9 5-HT的生成
色氨酸羟化酶象酪氨酸羟化酶一样,需要O2、Fe++以及辅酶四氢生物蝶呤。但脑内这种酶的含量较少,活性较低,所以它是5-HT生物合成的限速酶。此外,脑内5-HT的浓度影响色氨酸羟化酶的活性,从而对5-HT起着反馈性自我调节作用。血中游离色氨酸的浓度也影响脑内5-HT的合成,当血清游离色氨酸增多时(例如给大鼠腹腔注射色氨酸后),进入脑的色氨酸就增多,从而加速了5-HT的合成。
(二)重摄取和降解
和儿茶酚胺类递质一样,释放到突触间隙的5HT,大部分被突触前神经末梢重摄取,而且重摄取后,部分进入囊泡再贮存,部分则被线粒体膜上的单胺氧化酶(MAO)所氧化:
这就是脑内5-HT降解的主要方式,5-羟吲哚乙酸(5-hydroxyindolacetic acid)无生物活性。
检查5-HT对各种神经元的作用时发现,5-HT可使大多数交感节前神经元兴奋,而使付交感节前神经元抑制。损毁动物的中缝核或用药物阻断5-HT合成,都可使脑内5-HT含量明显降低,并引起动物睡眠障碍,痛阈降低,同时,吗啡的镇痛作用也减弱或消失。如果电刺激大鼠的中缝核,可影响其体温升高;另一方面,也观察到室温升高时大鼠脑内5-HT更新加速。这些现象揭示脑内5-HT与睡眠、镇痛、体温调节都有关系。还有人报导,5-HT能改变垂体的内分泌机能。此外,有人提出5-HT能神经元的破坏是精神性疾病时出现幻觉的原因。可见精神活动也与5HT有一定的关系。
四、氨基酸和寡肽
脑内到处都存在着氨基酸。过去只认为它们是合成蛋白质的原料,或是蛋白质分解的产物。近年来,注意到某些氨基酸在中枢的突触传递中起着递质的作用。而且发现,凡是中性氨基酸,如γ氨基丁酸、甘氨酸、β丙氨酸等对中枢神经元表现抑制作用,而酸性氨基酸如谷氨酸、天门冬氨酸则表现为兴奋作用。
有一些小分子肽类在中枢神经系统中也具有神经递质同的作用。1975年发现的脑啡肽(enkephalin)是由五个氨基酸残基构成的寡肽,从猪脑中分离出来的脑啡肽又分为两型。
蛋氨酸型(蛋脑啡肽,Met-enkephalin):
H-酪-甘-甘-苯丙-蛋-OH
亮氨酸型(亮脑啡肽,Leu-enkephalin)
H-酪-甘-甘-苯丙-蛋-OH
它们是由脑细胞内合成的具有吗啡样作用的肽,故名脑啡肽。已知吗啡(morphine)要先与脑内的吗啡受体结合才能产生镇痛、欣快作用,而脑啡肽之所以有吗啡样作用也是因为它们能与吗啡受体结合。吗啡是外来的物质,而脑啡肽是内源性的。此外,已知脑内还有一些能与吗啡受体结合并产生吗啡样作用的其它的肽类,称之为内啡肽(endorphin),虽然还不能十分肯定这些肽类都是真正的神经递质(即完全符合前述神经递质的条件),但是,研究它们的作用对阐明脑的功能,特别对阐明痛觉原理是很有意义的。
第十五章 核酸的结构与功能The Structure and Function of Nucleic Acid
1868年,瑞士的内科医生Friedrich Miescher从外科医院包扎伤口的绷带上的脓细胞核中提取到一种富含磷元素的酸性化合物,将其称为核质(nuclein);后来他又从鲭鱼精子中分离出类似的物质,并指出它是由一种碱性蛋白质与一种酸性物质组成的,此酸性物质即是现在所知的核酸(nucleic acid)。1944年Oswald Avery,Colin Macleod和Maclyn McCarty发现,一种有夹膜、具致病性的肺炎球菌中提取的核酸桪NA(deoxyribonucleic acid,脱氧核糖核酸),可使另一种无夹膜,不具致病性的肺炎球菌的遗传性状发生改变,转变为有夹膜,具致病性的肺炎球菌,且转化率与DNA纯度呈正相关,若将DNA预先用DNA酶降解,转化就不发生。该项实验彻底纠正了蛋白质携带遗传信息这一错误认识,确立了核酸是遗传物质的重要地位;DNA遗传作用的进一步肯定来自Alfred Hershey和Martha Chase对一个感染大肠杆菌的病毒的研究。即用放谢性同位素32P标记噬菌体DNA,35S标记其蛋白质外壳,再用标记的噬菌体去感染培养的大肠杆菌,结果发现进入细菌体内,使细菌生长、繁殖发生变化的是32P标记的DNA,而不是35S标记的蛋白质,并且新繁殖生成的噬菌体不含35S,只含32P。1953年Watson和Crick创立的DNA双螺旋结构模型,不仅阐明了DNA分子的结构特征,而且提出了DNA作为执行生物遗传功能的分子,从亲代到子代的DNA复制(replication)过程中,遗传信息的传递方式及高度保真性,为遗传学进入分子水平奠定了基础,成为现代分子生物学发展史上最为辉煌的里程碑。后来的研究又发现了另一类核酸桼NA(ribonucleic acid,核糖核酸),RNA在遗传信息的传递中起着重要的作用。从此,核酸研究的进展日新月异,如今,由核酸研究而产生的分子生物学及其基因工程技术已渗透到医药学、农业、化工等领域的各个学科,人类对生命本质的认识进入了一个崭新的天地。
第一节 核酸的化学组成
核酸是生物体内的高分子化合物,包括DNA和RNA两大类。
一、元素组成
组成核酸的元素有C、H、O、N、P等,与蛋白质比较,其组成上有两个特点:一是核酸一般不含元素S,二是核酸中P元素的含量较多并且恒定,约占9~10%。因此,核酸定量测定的经典方法,是以测定P含量来代表核酸量。
二、化学组成与基本单位
核酸经水解可得到很多核苷酸,因此核苷酸是核酸的基本单位。核酸就是由很多单核苷酸聚合形成的多聚核苷酸。核苷酸可被水解产生核苷和磷酸,核苷还可再进一步水解,产生戊糖和含氮碱基(图15-1)。
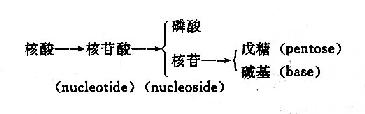
图15-1 核酸的组成
核苷酸中的碱基均为含氮杂环化合物,它们分别属于嘌呤衍生物和嘧啶衍生物。核苷酸中的嘌呤碱(purine)主要是鸟嘌呤(guanine,G)和腺嘌呤(adenine,A),嘧啶碱(pyrimidine)主要是胞嘧啶(cytosine,C)、尿嘧啶(uracil,U)和胸腺嘧啶(thymine,T)。DNA和RNA都含有鸟嘌呤(G)、腺嘌呤(A)和胞嘧啶(C);胸腺嘧啶(T)一般而言只存在于DNA中,不存在于RNA中;而尿嘧啶(U)只存在于RNA中,不存在于DNA中。它们的化学结构请参见图示。
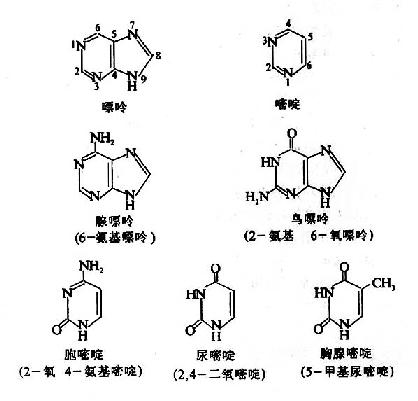
核酸中五种碱基中的酮基和氨基,均位于碱基环中氮原子的邻位,可以发生酮式一烯醇式或氨基亚氨基之间的结构互变。这种互变异构在基因的突变和生物的进化中具有重要作用。
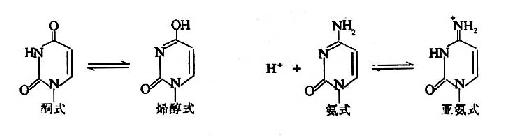
有些核酸中还含有修饰碱基(modifiedcomponent),(或稀有碱基,unusual component),这些碱基大多是在上述嘌呤或嘧啶碱的不同部位甲基化(methylation)或进行其它的化学修饰而形成的衍生物。一般这些碱基在核酸中的含量稀少,在各种类型核酸中的分布也不均一。DNA中的修饰碱基主要见于噬菌体DNA,如5-甲基胞嘧啶(m5C),5-羟甲基胞嘧啶hm5C;RNA中以tRNA含修饰碱基最多,如1-甲基腺嘌呤(m1A),2,2一二甲基鸟嘌呤(m22G)和5,6-二氢尿嘧啶(DHU)等。
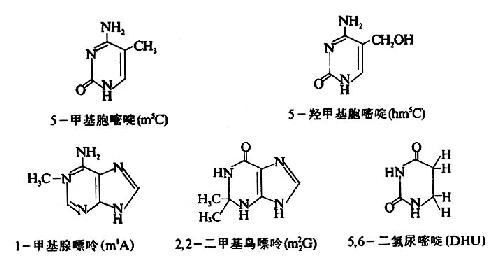
嘌呤和嘧啶环中含有共轭双键,对260nm左右波长的紫外光有较强的吸收。碱基的这一特性常被用来对碱基、核苷、核苷酸和核酸进行定性和定量分析。
核酸中的戊糖有核糖(ribose)和脱氧核糖(deoxyribose)两种,分别存在于核糖核苷酸和脱氧核糖核苷酸中。为了与碱基标号相区别,通常将戊糖的C原子编号都加上“′”,如C1′表示糖的第一位碳原子。
戊糖与嘧啶或嘌呤碱以糖苷键连接就称为核苷,通常是戊糖的C1′与嘧啶碱的N1或嘌呤碱的N9相连接。
核苷中戊糖的羟基与磷酸以磷酸酯键连接而成为核苷酸。生物体内的核苷酸大多数是核糖或脱氧核糖的C5′上羟基被磷酸酯化,形成5′核苷酸。核苷酸在5′进一步磷酸化即生成二磷酸核苷和三磷酸核苷。以核糖腺苷酸为例,除AMP外,还有二磷酸腺苷(ADP,adenosine 5′-diphosphate)和三磷酸腺苷(ATP,adenosine 5′-triphosphate)两种形式。核苷酸的二磷酸酯和三磷酸酯多为核苷酸有关代谢的中间产物或者酶活性和代谢的调节物质,以及作为核苷酸有关代谢的中间产物或者酶活性和代谢的调节物质,以及作为生理储能和供能的重要形式。
核苷酸还有环化的形式。它们主要是3′,5′-环化腺苷酸(cAMP,adenosine 3′,5′-cyclicmonophosphate)和3′,5′-环化鸟苷酸(cGMP,guanosine 3′,5′-cyclic monophosphate),化学结构如下。环化核苷酸在细胞内代谢的调节和跨细胞膜信号中起着十分重要的作用。
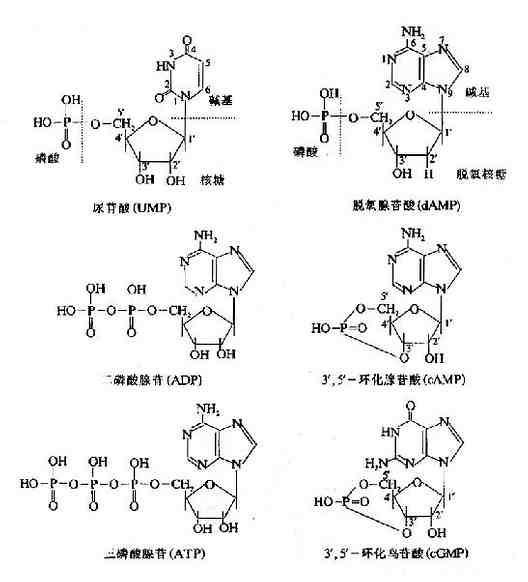
表15-1 核苷酸及相应的核苷、碱基名称中英文对照表
| 核苷酸 | 核苷 | 碱基 |
| 腺苷酸(AMP) | 腺苷 | 腺嘌呤(A) |
| adenosine monophosphate | adenosine | adenine |
| 脱氧腺苷酸(dAMP) | 脱氧腺苷 | |
| deoxydenosine monophosphate | deoxyadenosine | |
| 鸟苷酸(GMP) | 鸟苷 | 鸟嘌呤(G) |
| guanosine monophosphate | guanosine | guanine |
| 脱氧鸟苷酸(dGMP) | 脱氧鸟苷 | |
| deoxyguanosine monophosphate | deoxyguanosine | |
| 胞苷酸(CMP) | 胞苷 | 胞嘧啶(C) |
| cytidine monophosphate | cytidine | cytosine |
| 胞氧胞苷酸(dCMP) | 脱氧胞苷 | |
| deoxycytidine monophosphate | deoxycytidine | |
| 胸苷酸(TMP/dTMP) | 胸苷 | 胸腺嘧啶(T) |
| thymidine monophate | thymidine | thymine |
| 尿苷酸(UMP) | 尿苷 | 尿嘧啶(U) |
| uridine monophosphate | uridine | uracil |
第二节 DNA的一级结构与功能
(一)DNA的一级结构
核酸是由很多单核苷酸聚合形成的多聚核苷酸(polynucleotide),DNA的一级结构即是指四种核苷酸(dAMP、dCMP、dGMP、dTMP)按照一定的排列顺序,通过磷酸二酯键连接形成的多核苷酸,由于核苷酸之间的差异仅仅是碱基的不同,故又可称为碱基顺序。核苷酸之间的连接方式是:一个核苷酸的5′位磷酸与下一位核苷酸的3′-OH形成3′,5′磷酸二酯键,构成不分支的线性大分子,其中磷酸基和戊糖基构成DNA链的骨架,可变部分是碱基排列顺序。核酸是有方向性的分子,即核苷酸的戊糖基的5′位不再与其它核苷酸相连的5′末端,以及核苷酸的戊糖基3′位不再连有其它核苷酸的3′末端,两个末端并不相同,生物学特性也有差异。
寡核苷酸(oligonucleotide)是指二至十个甚至更多个核苷酸残基以磷酸二酯键连接而成的线性多核苷酸片段。目前多由仪器自动合成而用作DNA合成的引物(Primer)、基因探针(probe)等,在现代分子生物学研究中具有广泛的用途。
表示一个核酸分子结构的方法由繁至简有许多种(图15-2)。由于核酸分子结构除了两端和碱基排列顺序不同外,其它的均相同。因此,在核酸分子结构的简式表示方法中,仅须注明一个核酸分子的哪一端是5′末端,哪一端是3′末端,末端有无磷酸基,以及核酸分子中的碱基顺序即可。如未特别注明5′和3′末端,一般约定,碱基序列的书写是由左向右书写,左侧是5′末端,右侧为3′末端。
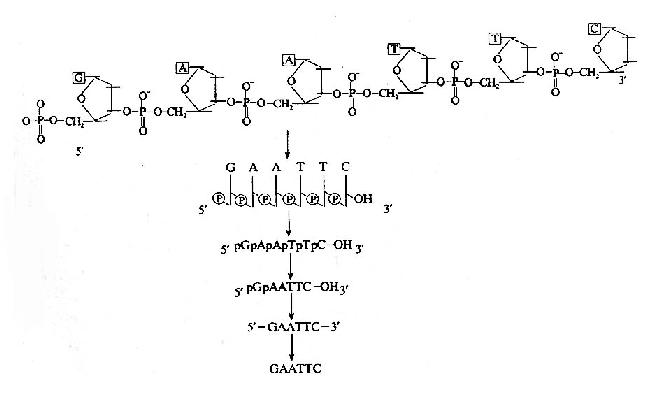
图15-2 核酸分子结构的表示方式
(二)基因组DNA
自然界绝大多数生物体的遗传信息贮存在DNA的核苷酸排列顺序中。DNA是巨大的生物高分子,一般将细胞内遗传信息的携带者枣染色体所包含的DNA总体称为基因组(genome)。同一物种的基因组DNA含量总是恒定的,不同物种间基因组大小和复杂程度则差异极大,一般讲,进化程度越高的生物体其基因组构成越大、越复杂,见(表15-2)。
表15-2 某些有代表性的生物体内DNA大小
| 分子量 | 碱基对(bp) | 千碱基对(kb) | ||
| 最简单的微生物 | SV40病毒 | 3×106 | 5×103 | 5 |
| λ噬菌体 | 3.4×107 | 5×104 | 50 | |
| 细菌 | 大肠杆菌 | 2.2×109 | 4.6×106 | 4600 |
| 哺乳动物 | 小鼠 | 1.5×1012 | 2.3×109 | 230万 |
| 人 | 1.8×1012 | 2.8×109 | 280万 |
DNA分子中不同排列顺序的DNA区段构成特定的功能单位,即基因(gene)。基因的功能取决于DNA的一级结构。一个DNA分子能携带多少基因呢?如果以1000~1500bp编码一个基因计算,猿猴病毒SV40基因组DNA有5000碱基对(base pair,bp),可编码5种基因,人类基因组含3×109bp DNA,理论上可编码200万以上的基因,然而,由于哺乳动物的基因含有内含子(intorn),因而每个基因可长达5000~8000bp,少数可达20,000bp。按这样大小的基因进行推算,人类基因组相当于40~60万个基因。这可能吗?虽然现在还不知道确切数字,但利用核酸杂交已测得哺乳类细胞含50,000~100,000种mRNA,由此推论整个基因组所含基因不会超过10万个,只占全部基因组的6%,另外5~10%为rRNA等重复基因,其余80~90%属于非编码区,没有直接的遗传学功能。DNA的复性动力学研究发现这些非编码区往往都是一些大量的重复序列,这些重复序列或集中成簇,或分散在基因之间,可能在DNA复制、调控中具有重要意义,并与生物进化、种族特异性有关。可见原核细胞由于DNA分子较小,必须充分利用有限的核苷酸序列,这是真核基因组与原核基因组显然不同之处。
真核基因组与原核基因组在结构上还有很多不同的特点,归纳如下:
1.真核生物基因组结构特点
①真核生物基因组DNA与蛋白质结合形成染色体,储存于细胞核内,除配子细胞外,体细胞内的基因组是双份的(即双倍体,diploid),即有两份同源的基因组。
②真核细胞基因转录产物为单顺反子(monocistron),即一个结构基因转录、翻译成一个mRNA分子,一条多肽链。
③存在大量重复序列,即在整个DNA中有许多重复出现的核苷酸顺序,重复序列长度可长可短,短的仅含两个核苷酸,长的多达数百、乃至上千。重复频率也不尽相同;高度重复序列重复频率可达106次,包括卫星DNA、反向重复序列和较复杂的重复单位组成的重复序列;中度重复序列可达103~104次,如为数众多的Alu家族序列,KpnI家族,Hinf家族序列,以及一些编码区序列如rRNA基因、tRNA基因、组蛋白基因等;单拷贝或低度重复序列,指在整个基因组中只出现一次或很少几次的核苷酸序列,主要是编码蛋白质的结构基因,在人基因组中占约60~65%,因此所含信息量最大。
④基因组中不编码的区域多于编码区域。
⑤基因是不连续的,在真核生物结构基因的内部存在许多不编码蛋白质的间隔序列(interveningsequences),称为内含子(intron),编码区则称为外显子(exon)。内含子与外显子相间排列,转录时一起被转录下来,然后RNA中的内含子被切掉,外显子连接在一起成为成熟的mRNA,作为指导蛋白质合成的模板。
⑥基因组远大于原核生物的基因组,具有许多复制起点,而每个复制子的长度较小。
2.原核生物基因组结构特点
①基因组较小,没有核膜包裹,且形式多样,如病毒基因组可能是DNA,也可能是RNA,可能是单链的,也可能是双链的,可能是闭环分子,也可能是线性分子;细菌染色体基因组则常为环状双链DNA分子,并与其中央的RNA和支架蛋白构成一致密的区域,称为类核(nucleoid)。
②功能相关的结构基因常常串连在一起,并转录在同一个mRNA分子中,称为多顺反子mRNA(polycistronic mRNA),然后再加工成各种蛋白质的模板mRNA。
③DNA分子绝大部分用于编码蛋白质,不编码部分(又称间隔区)通常包含控制基因表达的顺序。例如,噬菌体ψx 174中只有5%是非编码区。
④基因重叠是病毒基因组的结构特点,即同一段DNA片段能够编码两种甚至三种蛋白质分子。
⑤除真核细胞病毒外,基因是连续的,即不含内含子序列。
(三)限制性片段长度多态性
随着对基因认识的不断深入,发现在同种生物的不同个体之间,尽管其蛋白质产物的结构和功能完全相同或仅存在着细微的差异,但在DNA水平却存在着差异,尤其在不编码蛋白质的区域以及没有重要调节功能的区域表现更为突出。这种不影响生物体表型的DNA突变被称为中性突变。
分子生物学技术的不断发展已使得从DNA水平直接分析这类突变成为可能。
目前应用较多且成熟的方法是限制性片段长度多态性(Restriction fragment length polymorphism,RFLP)。即当DNA序列中某一个碱基发生突变,使突变所在部位的DNA序列获得或丢失某种限制性核酸内切酶位点;或当DNA分子内部发生较大的顺序突变如缺失、重复、插入,或DNA高变区内某串联重复顺序的拷贝数不同致使其两侧限制性核酸内切酶位点发生相对位移时,利用相应的限制性核酸内切酶消化此DNA,便会产生与正常不同的限制性片段。这样,在同种生物的不同个体中就会出现不同长度的限制性片段类型。
因为DNA的中性突变常以孟德尔显性遗传方式遗传给下一代,所以对这类突变检测已广泛用于遗传病的诊断、产前诊断、亲子鉴定以及法医学上对罪犯的确认等。
(四)DNA序列分析(DNa sequencing)
DNA的一级结构决定了基因的功能,欲想解释基因的生物学含义,首先必须知道其DNA顺序。因此DNA序列分析是分子遗传学中一项既重要又基本的课题。
1986年由美国学者提出的,目前正在实施的人类基因组计划(human genome project),则是要通过对人类基因组3×109bp全序列的序列分析和人类基因的染色体图谱制定达到了解其结构,认识其功能,即从分子遗传学水平来认识人类自身的结构和功能特征的目的。
核酸的核苷酸序列测定方法已经过近20年的发展,因而测序的具体方法五花八门、种类繁多。但是究其所依据的基本原理,不外乎Sanger的核酸链合成终止法及Maxam和Gilbert的化学降解法两大类。虽然原理不同,但这两种方法都同样生成互相独立的若干组带放射性标记的寡核苷酸,每组寡核苷酸都有固定的起点,但却随机终止于特定的一种或多种残基上。由于DNA链上每一个碱基出现在可变终止端的机会均等,因而上述每一组产物都是一些寡核苷酸的混合物,这些寡核苷酸的长度由某一种特定碱基在原DNA片段上的位置所决定。然后在可以区分长度仅相差一个核苷酸的不同DNA分子的条件下,对各组寡核苷酸进行电泳分析,只要把几组寡核苷酸加样于测序凝胶中若干个相邻的泳道之上,即可从凝胶的放射自显影片上直接读出DNA上的核苷酸顺序。以下分别介绍。
1.Sanger双脱氧链终止法
DNA的合成总是从5′端向3′端进行的。DNA的合成需要模板以及相应的引导核酸链。DNA的合成过程中,在合成的DNA链的3′末端,依据碱基配对的原则,通过生成新的3′,5′-磷酸二酯键,使DNA链合成终止,产生短的DNA链。具体测序工作中,平行进行四组反应,每组反应均使用相同的模板,相同的引物以及四种脱氧核苷酸;并在四组反应中各加入适量的四种之一的双脱氧核苷酸,使其随机地接入DNA链中,使链合成终止,产生相应的四组具有特定长度的、不同长短的DNA链。这四组DNA链再经过聚丙烯酸胺凝胶电泳按链的长短分离开,经过放射自显影显示区带,就可以直接读出被测DNA的核苷酸序列(图15-3)。
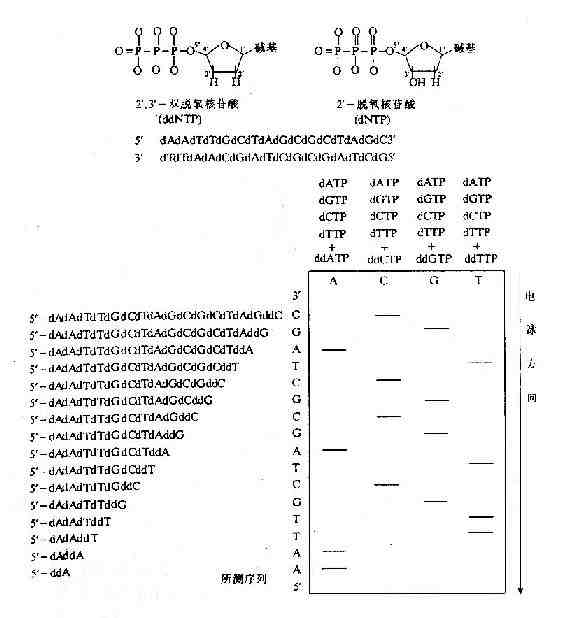
图15-3 双脱氧链终止法测定DNA序列原理示意
2.MaxamGilbert DNA化学降解法
这一方法的基本步骤为(1)先将DNA的末端之一进行标记(通常为放射性同位素32P;(2)在多组互相独立的化学反应中分别进行特定碱基的化学修饰;(3)在修饰碱基位置化学法断开DNA链;(4)聚丙烯酰胺凝胶电泳将DNA链按长短分开;(5)根据放射自显影显示区带,直接读出DNA的核苷酸序列(图15-4)。
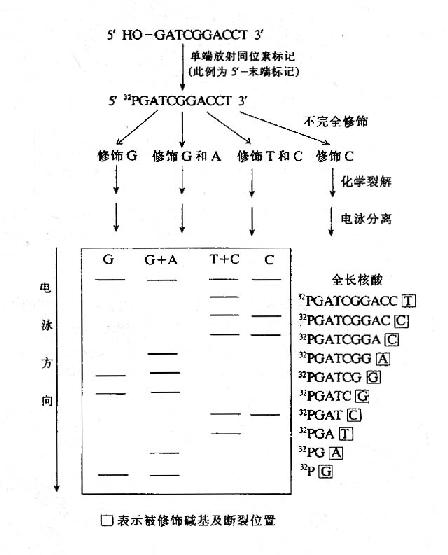
图15-4 化学裂解法测定DNA的核苷酸序列
第三节 DNA的二级结构与功能
(一)DNA的二级结构双螺旋结构模型(double helixmodel)
1953年,Watson和Crick提出了著名的DNA分子的双螺旋结构模型,揭示了遗传信息是如何储存在DNA分子中,以及遗传性状何以在世代间得以保持。这是生物学发展的重大里程碑。
在DNA双螺旋结构模型建立之前,早在1868年,Miescher已经从脓细胞提取到核酸与蛋白质的复合物,当时称为核素(nuclein)。但核酸在生命活动中的重要地位,却迟至本世纪50年代才被认识。
本世纪20年代,Levene研究了核酸的化学结构并提出四核苷酸假说;40年代末,Avery,Hershey和Chase的实验严密地证实了DNA就是遗传物质;50年代初,Chargaff应用紫外分光光度法结合纸层析等简单技术,对多种生物DNA作碱基定量分析,发现DNA碱基组成有如下规律(表15-3)。
表15-3 不同生物来源的DNA四种碱基比例关系
| DNA来源 | 腺嘌呤(A) | 胸腺嘧啶(T) | 鸟嘌呤(G) | 胞嘧啶(C) | (A+T)/(G+C) |
| 大肠杆菌 | 25.4 | 24.8 | 24.1 | 25.7 | 1.01 |
| 小麦 | 26.8 | 28.0 | 23.2 | 22.7 | 1.21 |
| 鼠 | 29.7 | 25.6 | 21.9 | 22.8 | 1.21 |
| 猪:肝 | 29.4 | 29.7 | 20.5 | 20.5 | 1.43 |
| 胸腺 | 30.0 | 28.9 | 20.4 | 20.7 | |
| 脾 | 29.6 | 29.2 | 20.4 | 20.8 | |
| 酵母 | 31.3 | 32.9 | 18.7 | 17.5 | 1.079 |
(1)同一生物的不同组织的DNA碱基组成相同;
(2)一种生物DNA碱基组成不随生物体的年龄、营养状态或者环境变化而改变;
(3)几乎所有的DNA,无论种属来源如何,其腺嘌呤摩尔含量与胸腺嘧啶摩尔含量相同(A]=[T),鸟嘌呤摩尔含量与胞嘧啶摩尔含量相同(G]=[C),总的嘌呤摩尔含量与总的嘧啶摩尔含量相同([A+G]=[C]+[T)。
(4)不同生物来源的DNA碱基组成不同,表现在A+T/G+C比值的不同;
这些结果后来为DNA的双螺旋结构模型提供了一个有力的佐证。
Watson和Crick以立体化学原理为准则,对Wilkins和Franklin的DNa X射线衍射分析结果加以研究,提出了DNA结构的双螺旋模式,其主要内容如下:
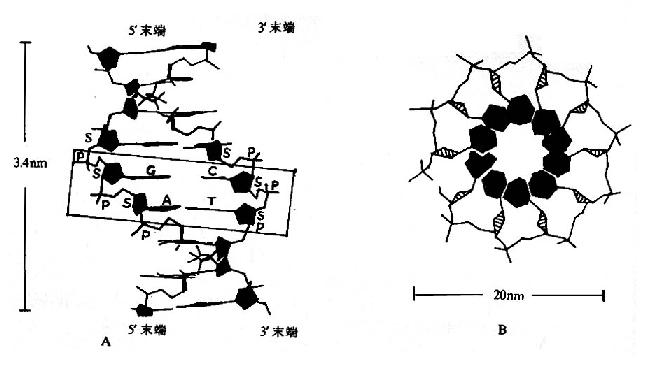
图15-5 DNA的双螺旋结构模式
A.正面观:长方框内有详细说明,S代表脱氧核糖。
B.俯视:涂黑的是碱基,此处全部碱基都是嘧啶,只看到糖的侧面略呈三角形,最外围是磷酸及其酯键。
(1)在DNA分子中,两股DNA链围绕一假想的共同轴心形成一右手螺旋结构,双螺旋的螺距为3.4nm,直径为2.0nm。(图15-5,A,B)。
(2)链的骨架(backbone)由交替出现的、亲水的脱氧核糖基和磷酸基构成,位于双螺旋的外侧。
(3)碱基位于双螺旋的内侧,两股链中的嘌呤和嘧啶碱基以其疏水的、近于平面的环形结构彼此密切相近,平面与双螺旋的长轴相垂直。一股链中的嘌呤碱基与另一股链中位于同一平面的嘧啶碱基之间以氢链相连,称为碱基互补配对或碱基配对(base pairing),碱基对层间的距离为0.34nm。碱基互补配对总是出现于腺嘌呤与胸腺嘧啶之间(A=T),形成两个氢键;或者出现于鸟嘌呤与胞嘧啶之间(G=C),形成三个氢键。(图15-6)。
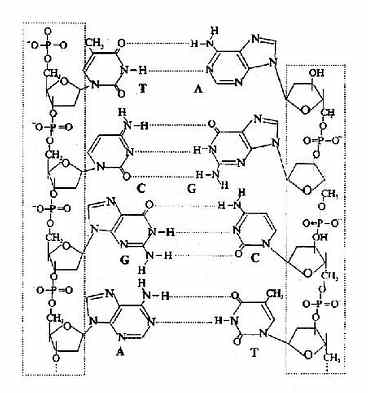
图15-6 A-T,G-C间的氢键形成
(4)DNA双螺旋中的两股链走向是反平行的,一股链是5′→3′走向,另一股链是3′→5′走向。两股链之间在空间上形成一条大沟(major groove)和一条小沟(minor groove),这是蛋白质识别DNA的碱基序列,与其发生相互作用的基础。
DNA双螺旋的稳定由互补碱基对之间的氢键和碱基对层间的堆积力(basestacking force)维系。DNA双螺旋中两股链中碱基互补的特点,逻辑地预示了DNA复制过程是先将DNA分子中的两股链分离开,然后以每一股链为模板(亲本),通过碱基互补原则合成相应的互补链(复本),形成两个完全相同的DNA分子。因为复制得到的每对链中只有一条是亲链,即保留了一半亲链,将这种复制方式称为DNA的半保留复制(semiconservativereplication)。后来证明,半保留复制是生物体遗传信息传递的最基本方式。
DNA双螺旋是核酸二级结构的重要形式。双螺旋结构理论支配了近代核酸结构功能的研究和发展,是生命科学发展史上的杰出贡献。
(二)DNA结构的多态性
Watson和Crick提出的DNA双螺旋结构属于B型双螺旋,它是以在生理盐溶液中抽出的DNA纤维在92%相对湿度下进行X-射线衍射图谱为依据进行推测的,这是DNA分子在水性环境和生理条件下最稳定的结构。然而以后的研究表明DNA的结构是动态的。在以钾或绝作反离子,相对湿度为75%时,DNA分子的X-射线衍射图给出的是A构象,A-DNA每螺旋含11个碱基对,而且变成A-DNA后,大沟变窄、变深,小沟变宽、变浅。由于大沟、小沟是DNA行使功能时蛋白质的识别位点,所以由B-DNA变为A-DNA后,蛋白质对DNA分子的识别也发生了相应变化。
一般说来,A-T丰富的DNA片段常呈B-DNA。采用乙醇沉淀法纯化DNA时,整个过程中,大部分DNA由B-DNA经过C-DNA,最终变构为A-DNA。若DNA双链中一条链被相应的RNA链所替换,会变构成A-DNA。当DNA处于转录状态时,DNA模板链与由它转录所得的RNA链间形成的双链就是A-DNA。由此可见A-DNA构象对基因表达有重要意义。此外,B-DNA双链都被RNA链所取代而得到由两条RNA链组成的双螺旋结构也是A-DNA。除A-DNA、B-DNA螺旋外,还存在B′-DNA、C-DNA、D-DNA等,其结构参数见表15-4。
表15-4 不同右手双螺旋DNA的结构参数
| 双螺旋 | 碱基倾 | 碱基夹 | 碱基间距 | 螺距 | 每轮碱 | 小沟宽/nm× | 大沟宽nm× |
| 角/(°) | 角(°) | /nm | /nm | 基数 | 小沟宽nm | 大沟宽nm | |
| B-DNA | 36.0 | 0.337 | 3.4 | 10 | 0.57×0.75 | 1.17×0.85 | |
| C-DNA | 6 | 38.0 | 0.331 | 3.1 | 9.3 | 0.48×0.79 | 1.05×0.75 |
| D-DNA | 45.0 | 0.303 | 0.13×0.67 | 0.89×0.58 | |||
| A-DAN | 20 | 32.7 | 0.256 | 2.8 | 11 | 1.10×0.28 | 0.27×1.35 |
总之,DNA的双螺旋结构永远处于动态平衡中,DNA分子构象的变化与糖基和碱基之间空间相对位置有关。
1979年,Wang和Rich等人在研究人工合成的CGCGCG单晶的X-射线衍射图谱时出人意料地发现这种六聚体的构象与上面讲到的完全不同。它是左手双螺旋,与右手螺旋的不同是螺距延长(4.5nm左右),直径变窄(1.8nm),每个螺旋含12个碱基对,分子长链中磷原子不是平滑延伸而是锯齿形排列,有如“之”字形一样,因此叫它Z构象(英文字Zigzag的第一个字母)。还有,这一构象中的重复单位是二核苷酸而不是单核苷酸;而且ZDNA只有一个螺旋沟,它相当于B构象中的小沟,它狭而深,大沟则不复存在(图15-7)。进一步的分析还证明,Z-DNA的形成是DNA单链上出现嘌呤与嘧啶交替排列所成的。比如CGCGCGCG或者CACACACA。
图15-7 Z-DNA和B-DNA
Z-DNA有什么生物学意义呢?应当指出Z-DNA的形成通常在热力学上是不利的。因为Z-DNA中带负电荷的磷酸根距离太近了,这会产生静电排斥。但是,DNA链的局部不稳定区的存在就成为潜在的解链位点。DNA解螺旋却是DNA复制和转录等过程中必要的环节,因此认为这一结构与基因调节有关。比如SV40增强子区中就有此结构,又如鼠类微小病毒DNS复制区起始点附近有GC交替排列序列。此外,DNA螺旋上沟的特征在其信息表达过程中起关键作用。调控蛋白都是通过其分子上特定的氨基酸侧链与DNA双螺旋沟中的碱基对一侧的氢原子供体或受体相互作用,形成氢键从而识别DNA上的遗传信息的。大沟所带的遗传信息比小沟多。沟的宽窄和深浅也直接影响到调控蛋白质对DNA信息的识别。ZDNA中大沟消失,小沟狭而深,使调控蛋白识别方式也发生变化。这些都暗示ZDNA的存在不仅仅是由于DNA中出现嘌呤一啶嘧交替排列之结果,也一定是在漫漫的进化长河中对DNA序列与结构不断调整与筛选的结果,有其内在而深刻的含意,只是人们还未充分认识而已。
DNA构象的可变性,或者说DNA二级结构的多态性的发现拓宽了人们的视野。原来,生物体中最为稳定的遗传物质也可以采用不同的姿态来实现其丰富多采的生物学功能。
多年来,DNA结构的研究手段主要是X射线衍射技术,其结果是通过间接观测多个DNA分子有关结构参数的平均值而获得的。同时,这项技术的样品分析条件使被测DNA分子与天然状态相差甚远。因此,在反映DNA结构真实性方面这种方法存在着缺陷。1989年,应用扫描隧道显微镜(scanning tummelingmicroscopy,STM)研究DNA结构克服了上述技术的缺陷。这种先进的显微技术,不仅可将被测物放大500万倍,且能直接观测接近天然条件下单个DNA分子的结构细节。STM技术的应用是DNA结构研究中的重要进展,可望在探索DNA结构的某些未知点上展示巨大潜力。
(三)DNA结构的不均一性(heterogeneity)
在DNA的一级结构中,四种碱基A,T,C,G远非均匀分布,尽管双螺旋的构型大体相同,但沿着DNA链各处的物理结构不完全相同,各处双螺旋的稳定性也就显示出差别,充分体现了DNA一级结构决定高级结构的原理。其不均一性主要有:
1.反向重复序列(inverted repeats)
又称回文序列(palindrome),它能在DNA或RNA中形成发夹结构。这种回文结构通常是作为一种特别信号,如限制性核酸内切酸(restriction encl闩迥onuclease)及调节蛋白的识别位点,转录终止信号等。
2.富含A/T的序列
在高等生物中,A+T与G+C的含量差不多相等,然而在它们的染色体某一区域,A·T含量可能相当高。如在很多有重要调节功能的DNA区段都富含A·T,特别是在复制起点和启动子的Pribnow框(真核生物为TATA框)的序列中,其对于复制和起始十分重要。因为A-T对只有二条氢键,此处的双链较G-C对处易于解开,有利于起始复合物的形成。
3.嘌呤和嘧啶的排列顺序对双螺旋结构稳定性的影响。
人们考察了十种相邻的二核苷酸对(nearestneighbor doublets),发现一个非常有趣的现象,那就是碱基组成相同,但嘌呤和嘧啶的排列顺序不同,双螺旋的稳定性具有显著的差异。例如5′Gc3′ 3′G 5′和5′GC 3′ 3′GC 5′的稳定性相差很大,前者的稳定性远大于后。它们的氢键数目是相同的,它们的差别在于相邻碱基之间的堆集力不同。即从嘌呤到嘧啶的方向的碱基堆集作用显著地大于同样组成的嘧啶到嘌呤方向的碱基堆集作用。(这里的方向就是常规的从5′端到3′端的方向)。这是因为前者的嘌呤环和嘧啶环重迭面积大于后者的嘧啶环和嘌呤环的重迭面积,这在B型DNA中确是如此。
根据Gotoh 1981年的研究,十种相邻二核苷酸对的Tm值如表15?所示,单位为℃,所用离子强度为19.5mmol/l Na+。
表15-5 相邻二核苷酸对Tm值
| 3′ | |||||
| A | T | G | C | ||
| 5′ | A | 54.50 | 57.02 | 58.42 | 97.73 |
| T | 36.73 | 54.50 | 54.71 | 86.44 | |
| G | 86.44 | 97.73 | 85.97 | 136.12 | |
| C | 54.71 | 58.42 | 72.55 | 85.97 | |
由表15-5可以看到,5′TA 3′ 3′AT5′的Tm值最低。在真核生物中,常可以在19到27的位置上看到一个叫做TATA框的结构(又称Hogness框),这是RNA聚合酶的结合位点。在这里RNA聚合酶和有关蛋白质因子形成转录起始复合物。
又如,生命有机体选择UAA作为最有效的终止密码子绝不是偶然的,因为64个三联体密码子中,它与反密码子(假定有的话)形成的互补产物5′UAA3′3′AUU5′的Tm值是最低的一个,即使在生理温度下也是不稳定的。当初有人花了很多工夫去寻找一个不携带氨基酸的专供肽链终止用的tRNA,其实并不存在这种tRNA。肽链的释放是由释放因子RF在起作用。在三种终止密码子中,UAG和UGA常会为突变型的tRNA无义抑制,而UAA则很少发生无义抑制也可能就是这个道理。这也就说明了为什么在肽链终止处常常会出现双重终止密码子。
(四)DNA的变性、复性与分子杂交
DNA双螺旋结构模型,不仅与其生物功能有密切关系,还能解释DNA的重要特性枣变性与复性,这对于深入了解DNA分子结构与功能的关系又有重要意义。
1.DNA变性(denaturation)
指DNA分子由稳定的双螺旋结构松解为无规则线性结构的现象。变性时维持双螺旋稳定性的氢键断裂,碱基间的堆积力遭到破坏,但不涉及到其一级结构的改变。凡能破坏双螺旋稳定性的因素,如加热、极端的pH、有机试剂甲醇、乙醇、尿素及甲酰胺等,均可引起核酸分子变性。变性DNA常发生一些理化及生物学性质的改变:
溶液粘度降低。DNA双螺旋是紧密的刚性结构,变性后代之以柔软而松散的无规则单股线性结构,DNA粘度因此而明显下降。
溶液旋光性发生改变。变性后整个DNA分子的对称性及分子局部的构性改变,使DNA溶液的旋光性发生变化。
15-8 核酸的解链曲线
增色效应(hyperchromiceffect)。指变性后DNA溶液的紫外吸收作用增强的效应。DNA分子中碱基间电子的相互作用使DNA分子具有吸收260nm波长紫外光的特性。在DNA双螺旋结构中碱基藏入内侧,变性时DNA双螺旋解开,于是碱基外露,碱基中电子的相互作用更有利于紫外吸收,故而产生增色效应。
对双链DNA进行加热变性,当温度升高到一定高度时,DNA溶液在260nm处的吸光度突然明显上升至最高值,随后即使温度继续升高,吸光度也不再明显变化。若以温度对DNA溶液的紫外吸光率作图,得到的典型DNA变性曲线呈S型(图158)。可见DNA变性是在一个很窄的温度范围内发生的。通常将核酸加热变性过程中,紫外光吸收值达到最大值的50%时的温度称为核酸的解链温度,由于这一现象和结晶的融解相类似,又称融解温度(Tm,meltingtemperature)。在Tm时,核酸分子内50%的双螺旋结构被破坏。特定核酸分子的Tm值与其G+C所占总碱基数的百分比成正相关,两者的关系可表示为:
Tm=69.3+0.41(%G+C)
一定条件下(相对较短的核酸分子),Tm值大小还与核酸分子的长度有关,核酸分子越长,Tm值越大;另外,溶液的离子强度较低时,Tm值较低,融点范围也较宽,反之亦然,因此DNA制剂不应保存在离子强度过低的溶液中。
2.DNA复性(renaturation)
指变性DNA在适当条件下,二条互补链全部或部分恢复到天然双螺旋结构的现象,它是变性的一种逆转过程。热变性DNA一般经缓慢冷却后即可复性,此过程称之为退火(annealing)。这一术语也用以描述杂交核酸分子的形成(见后)。DNA的复性不仅受温度影响,还受DNA自身特性等其它因素的影响:
温度和时间。一般认为比Tm低25℃左右的温度是复性的最佳条件,越远离此温度,复性速度就越慢。复性时温度下降必须是一缓慢过程,若在超过Tm的温度下迅速冷却至低温(如4℃以下),复性几乎是不可能的,核酸实验中经常以此方式保持DNA的变性(单链)状态。这说明降温时间太短以及温差大均不利于复性。
DNA浓度。溶液中DNA分子越多,相互碰撞结合的机会越大。
DNA顺序的复杂性。简单顺序的DNA分子,如多聚(A)和多聚(U)这二种单链序列复性时,互补碱基的配对较易实现。而顺序复杂的序列要实现互补,则困难得多。在核酸复性研究中,定义了一个Cot的术语,(Co为单链DNA的起始浓度,t是以秒为单位的时间),用以表示复性速度与DNA顺序复杂性的关系。在探讨DNA顺序对复性速度的影响时,将温度、溶剂离子强度、核酸片段大小等其它影响因素均予以固定,以不同程度的核酸分子重缔合部分(在时间t时的复性率)对Cot作图,可以得到如图15-9所示的曲线。曲线上方为示复杂性的核酸分子的非重复碱基对数。如多聚(A)的复杂性为1,重复的(ATGC)n组成的多聚体的复杂性为4,分子长度是105核苷酸对的非重复DNA的复杂性为105。原核生物基因组均为非重复顺序,故以非重复核苷酸对表示的复杂性直接体现基因组大小(图上方的箭头所指为基因大小),对于真核生物基因组中的非重复片段也是如此。在标准条件下(一般为0.18ml/L阳离子浓度,400核苷酸长的片段)测得的复性率达0.5时的Cot值(称Cot1/2),与核苷酸对的复杂性成正比。对于原核生物核酸分子,此值可代表基因组的大小及基因组中核苷酸对的复杂程度。真核基因组中因含有许多不同程度的重复序列(repetitive sequence),所得到的Cot曲线更为复杂。
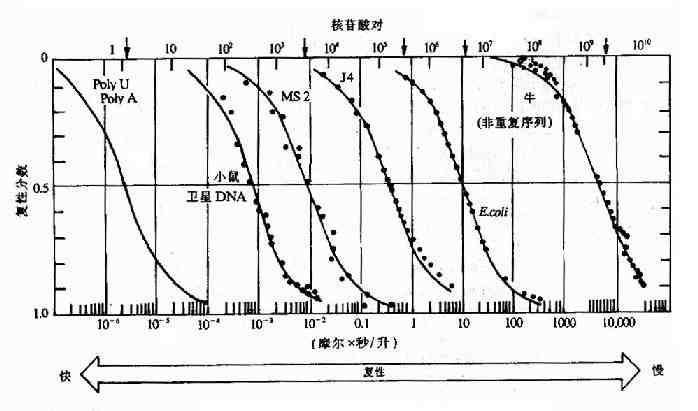
图15-9 不同物种核酸的Cot曲线
DNA的变性和复性原理,现已在医学和生命科学上得到广泛的应用。如核酸杂交与探针技术,聚合酶链反应(polymerasechain reaction,PCR)技术等。
3.分子杂交:(hybridization)
不同来源的核酸变性后,合并在一处进行复性,这时,只要这些核酸分子的核苷酸序列含有可以形成碱基互补配对的片段,复性也会发生于不同来源的核酸链之间,形成所谓的杂化双链(heterodup lex),这个过程称为杂交(hybridization)图15-10,I)。杂交可以发生于DNA与DNA之间,也可以发生于RNA与RNA之间和DNA与RNA之间。例如,一段天然的DNA和这段DNA的缺失突变体(假定这种突变是DNA分子中部丢失了若干碱基对)一起杂交,电子显微镜下可以看到杂化双链中部鼓起小泡。测量小泡位置和长度,可确定缺失突变发生的部位和缺失的多少。核酸杂交技术是目前研究核酸结构、功能常用手段之一,不仅可用来检验核酸的缺失、插入,还可用来考察不同生物种类在核酸分子中的共同序列和不同序列以确定它们在进化中的关系。其应用当然远不止于确定突变位置这一例(图15-10Ⅱ)。
图15-10 核酸杂交及其应用示意图
Ⅰ.变性、复性和杂交。粗细线分别代表不同DNA。A是杂化双链
Ⅱ.突变体的鉴别。B代表天然DNA;C是B的缺失突变体;虚线框内是已缺失的部分;
D是显示从天然DNA链鼓出小泡 Ⅲ.粗线代表探针,粗线上的X表示放射性标记
在核酸杂交的基础上发展起来的一种用于研究和诊断的非常有用的技术称探针技术(Probe)。一小段(例如十数个至数百个)核苷酸聚合体的单链,有放射性同位素如32P、35S或生物素标记其末端或全链,就可作为探针。把待测DNA变性并吸附在一种特殊的滤膜,例如硝酸纤维素膜上。然后把滤膜与探针共同培育一段时间,使发生杂交。用缓冲液冲洗膜。由于这种滤膜能较牢固地吸附双链的核酸,单链的在冲洗时洗脱了。带有放射性的探针若能与待测DNA结合成杂化双链,则保留在滤膜上。通过同位素的放射自显影或生物素的化学显色,就可判断探针是否与被测的DNA发生杂交。有杂交现象则说明被测DNA与探针有同源性(homogeneity),即二者的碱基序列是可以互补的。例如:想知道某种病毒是否和某种肿瘤有关,可把病毒的DNA制成探针。从肿瘤组织提取DNA,与探针杂交处理后,有杂化双链的出现,就说明两种DNA之间有同源性。这不等于可以说这种病毒引起肿瘤,但至少这是可以继续深入研究下去的一条重要线索。
探针技术(图15-10Ⅲ)在遗传性疾病诊断上已开始应用。例如诊断地中海贫血或血红蛋白病,可以由已确诊的病人白细胞中提取DNA,这就是诊断探针。用诊断探针检查,不但可以对有症状患者进行确诊,还可以发现一些没有症状的隐性遗传性疾病。从胎儿的羊水也可以提取到少量DNA。由于探针技术比较灵敏,就使遗传性疾病的产前诊断较为容易办得到了。杂交和探针技术是许多分子生物学技术的基础,在生物学和医学的研究中,以及临床诊断中得到了日益广泛的应用。
第四节 DNA的三级结构与功能
(一)DNA超螺旋
双螺旋DNA进一步扭曲盘绕则形成其三级结构,超螺旋是DNA三级结构的主要形式。自从1965年Vinograd等人发现多瘤病毒的环形DNA的超螺旋以来,现已知道绝大多数原核生物都是共价封闭环(covalentlyclosed circle,CCC)分子,这种双螺旋环状分子再度螺旋化成为超螺旋结构(superhelix或supercoil),如图15-11所示。有些单链环形染色体(如φ×174)或双链线形染色体(如噬菌体入),在其生活周期的某一阶段,也必将其染色体变为超螺旋形式。对于真核生物来说,虽然其染色体多为线形分子但其DNA均与蛋白质相结合,两个结合点之间的DNA形成一个突环(loop)结构,类似于CCC分子,同样具有超螺旋形式。超螺旋按其方向分为正超螺旋和负超螺旋两种。真核生物中,DNA与组蛋白八聚体形成核小体结构时,存在着负超螺旋。研究发现,所有的DNA超螺旋都是由DNA拓扑异构酶产生的。
图15-11 Opencircular(a) andsupercoiled (b) forms of PM2 virus DNA,Bar
represents 0.2μm.(By courtesy ofDr Lesley Coggins)
(二)染色质和核小体
1.染色质
真核生物的染色体(chromasome)在细胞生活周期的大部分时间里都是以染色质(chromatin)的形式存在的。染色质是一种纤维状结构,叫做染色质丝,它是由最基本的单位枣核小体(nucleosome)成串排列而成的。DNA是染色体的主要化学成分,也是遗传信息的载体,约占染色体全部成分的27%,另外组蛋白和非组蛋白占66%,RNA占6%。
组蛋白(histones)是一种碱性蛋白质,等电点一般在PH10.0以上,其特点是富含二种碱性氨基酸(赖氨酸和精氨酸),根据这两种氨基酸在蛋白质分子中的相对比例,将组蛋白分为五种类型(表15-6)。
表15-6 五种组蛋白分子的基本参数
| 种类 | 类型 | 碱性氨基酸 | 酸性 氨基酸 |
碱性氨基酸/酸性氨基酸 | 氨基酸 残基数 |
分子量 | 核小体 上位置 |
||
| Lys | Arg | Lys/Arg | |||||||
| H1 | 极度富含Lys | 29% | 1% | 29 | 5% | 5.4 | 215 | 23 000 | 连接* |
| H2A | 11% | 9% | 1.2 | 15% | 1.4 | 129 | 14 500 | 核心 | |
| H2B | ″ | 16% | 6% | 2.7 | 13% | 1.7 | 125 | 13 774 | ″ |
| H3 | 极度富含Lys+富含Arg | 10% | 13% | 0.78 | 13% | 1.8 | 135 | 15 324 | ″ |
| H4 | ″ | 11% | 14% | 0.79 | 10% | 2.5 | 102 | 11 282 | ″ |
*现已证明:H1是与核小体的核心颗粒相当靠近的,认为它位于连接DNA上,只是一种习惯说法。
五种组蛋白在同一生物的不同组织中完全一样,在不同的真核生物中也很相似。组蛋白对染色体中DNA的包装有十分重要的作用。
2.核小体
图15-12A DNA的高级结构
核小体是构成染色质的基本结构单位,使得染色质中DNA、RNA和蛋白质组织成为一种致密的结构形式。核小体由核心颗粒(core particle)和连接区DNA(linker DNA)二部分组成,在电镜下可见其成捻珠状,前者包括组蛋白H2A,H2B,H3和H4各两分子构成的致密八聚体(又称核心组蛋白),以及缠绕其上一又四分之三圈长度为146bp的DNA链;后者包括两相邻核心颗粒间约60bp的连接DNA和位于连接区DNA上的组蛋白H1(图15-12),连接区使染色质纤维获得弹性。核小体是DNA紧缩的第一阶段,在此基础上,DNA链进一步折叠成每圈六个核小体,直径30nm的纤维状结构,这种30nm纤维再扭曲成襻,许多襻环绕染色体骨架(Scaffold)形成棒状的染色体,最终压缩将近一万倍。这样,才使每个染色体中几厘米长(如人染色体的DNA分子平均长度为4cm)的DNA分子容纳在直径数微米(如人细胞核的直径为6-7μm)的细胞核中。
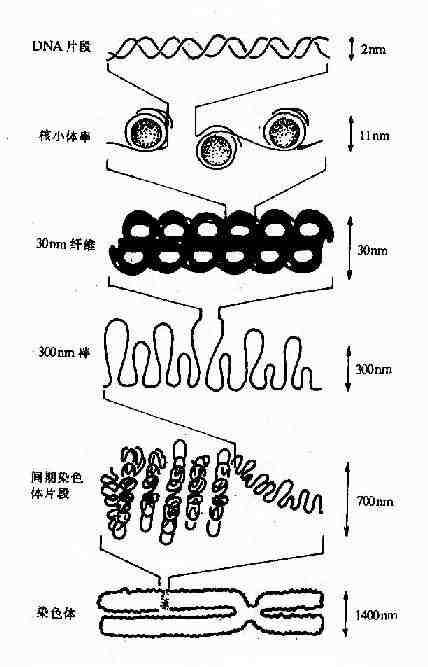
图15-12B DNA的高级结构-从核小体至染色体
核小体的形成以及DNA超螺旋结构与功能的关系还不十分清楚,可能与基因的转录调节控制有关。
第五节 RNA的结构与功能
DNA是遗传信息的载体,遗传信息的作用通常由蛋白质的功能来实现,但DNA并非蛋白质合成的直接模板,合成蛋白质的模板是RNA。正常细胞遗传信息的流向是:
![]()
与DNA相比,RNA种类繁多,分子量相对较小,一般以单股链存在,但可以有局部二级结构,其碱基组成特点是含有尿嘧啶(uridin,U)而不含胸腺嘧啶,碱基配对发生于C和G与U和A之间,RNA碱基组成之间无一定的比例关系,且稀有碱基较多。此外,tRNA还具有明确的三级结构。
表15-7 RNA的分类
| 细胞核和胞液 | 线粒体 | 功能 | |
| 核蛋白体RNA | rRNA | mt tRNA | 核蛋白体组成成分 |
| 信使RNA | mRNA | mt mRNA | 蛋白质合成模板 |
| 转运RNA | tRNA | mt tRNA | 转运氨基酸 |
| 不均一核RNA | hnRNA | 成熟mRNA的前体 | |
| 小核RNA | snRNA | 参与hnRNA的剪接、转运 | |
| 小胞浆RNA | scRNA/7SL-RNA | 蛋白质内质网定位合成的信号识别体的组成成分 |
注:原核细胞不含后3种RNA
(一)信使RNA(mRNA)与不均一核RNA(hnRNA)
遗传信息从DNA分子抄录到RNA分子中的过程称为转录(transcription)。在真核生物中,最初转录生成的RNA称为不均一核RNA(heterogeneous nuclearRNA,hnRNA),然而在细胞浆中起作用,作为蛋白质的氨基酸序列合成模板的是mRNA(messengerRNA)。hnRNA是mRNA的未成熟前体。两者之间的差别主要有两点:一是hnRNA核苷酸链中的一些片段将不出现于相应的mRNA中,这些片段称为内含子(intron),而那些保留于mRNA中的片段称为外显子(exon)。也就是说,hnRNA在转变为mRNA的过程中经过剪接,被去掉了一些片段,余下的片段被重新连接在一起;二是mRNA的5′末端被加上一个m7pGppp帽子,在mRNA3′末端多了一个多聚腺苷酸(polyA)尾巴。mRNA从5′末端到3′末端的结构依次是5′帽子结构,5′末端非编码区,决定多肽氨基酸序列的编码区,3′末端非编码区,和多聚腺苷酸尾巴。多聚腺苷酸尾一般由数十个至一百几十个腺苷酸连接而成。随着mRNA存在时间的延续,这段聚A尾巴慢慢变短。因此,目前认为这种3′末端结构可能与增加转录活性以及使mRNA趋于相对稳定有关。原核生物的mRNA没有这种首、尾结构。
![]()
图15-13 hnRNA与mRNA的结构比较
(涂斜线者为外显子,空白者为内含子)
1961年,Jacob和Monod首先提出了mRNA的概念。在真核细胞中,由于蛋白质是在胞浆中而不是在核内合成,因此显然要求有一个中间物将DNA上的遗传信息传递至胞浆中。后来的研究证实,这种中间物即信使RNA。mRNA的核苷酸序列与DNA序列相应,决定着合成蛋白质的氨基酸序列。它如何指导氨基酸以正确的顺序连接起来呢?不同的mRNA碱基组成和排列顺序都不同,但都只有A,G,C,U4种碱基。如果一个碱基就可以决定一个氨基酸,则只有四种变化方式,如果两个碱基决定一个氨基酸,则只有16种变化方式,都不能满足20种氨基酸的需要。1961年Crick和Brenner的实验得出了三个核苷酸编码一个氨基酸的结论,并将这种三位一体的核苷酸编码称做遗传密码(genetic code)或三联体密码,这样就可以有64种不同的密码,但此情况下必须假定有一些氨基酸使用两个以上的密码。这一假定很快就被证明是对的。遗传密码具有下列特征:
(1)三个核苷酸组成一个密码子,每个密码子由三个前后相联的核苷酸组成,一个密码子只为一种氨基酸编码。共有64个密码子;
(2)密码子之间不重叠使用核苷酸,也无核苷酸间隔;
(3)一种氨基酸可有多个密码子,这个特点称为密码子的简并性;
(4)密码子的通用性,所有生物从最低等的病毒直至人类,蛋白质合成都使用同一套密码子表(表15-8),仅有极少的例外,如特殊细胞器线粒体,叶绿体所用的密码稍有不同。(表15-9)。
表15-8 通用遗传密码及相应的氨基酸
| 第一个核苷酸5′ | 第二个核苷酸 | 第三个核苷酸3′ | |||
| U | C | A | G | ||
| U | 苯丙氨酸 | 丝氨酸 | 酪氨酸 | 半胱氨酸 | U |
| 苯丙氨酸 | 丝氨酸 | 酪氨酸 | 半胱氨酸 | C | |
| 亮氨酸 | 丝氨酸 | 终止码 | 终止码 | A | |
| 亮氨酸 | 丝氨酸 | 终止码 | 色氨酸 | G | |
| C | 亮氨酸 | 脯氨酸 | 组氨酸 | 精氨酸 | U |
| 亮氨酸 | 脯氨酸 | 组氨酸 | 精氨酸 | C | |
| 亮氨酸 | 脯氨酸 | 谷氨酰胺 | 精氨酸 | A | |
| 亮氨酸 | 脯氨酸 | 谷氨酰胺 | 精氨酸 | G | |
| A | 异亮氨酸 | 苏氨酸 | 天冬酰胺 | 丝氨酸 | U |
| 异亮氨酸 | 苏氨酸 | 天冬酰胺 | 丝氨酸 | C | |
| 异亮氨酸 | 苏氨酸 | 赖氨酸 | 精氨酸 | A | |
| 蛋氨酸 | 苏氨酸 | 赖氨酸 | 精氨酸 | G | |
| G | 缬氨酸 | 丙氨酸 | 天冬氨酸 | 甘氨酸 | U |
| 缬氨酸 | 丙氨酸 | 天冬氨酸 | 甘氨酸 | C | |
| 缬氨酸 | 丙氨酸 | 谷氨酸 | 甘氨酸 | A | |
| 缬氨酸 | 丙氨酸 | 谷氨酸 | 甘氨酸 | G | |
表15-9 通用遗传密码与线粒体遗传密码之间的一些差异
| 密码子 | 通用编码 | 线粒体编码 | |||
| 哺乳动物 | 果蝇 | 酵母菌 | 植物 | ||
| UGA | 终止码 | 色氨酸 | 色氨酸 | 色氨酸 | 终止码 |
| AUA | 异亮氨酸 | 蛋氨酸 | 蛋氨酸 | 蛋氨酸 | 异亮氨酸 |
| CUA | 亮氨酸 | 亮氨酸 | 亮氨酸 | 苏氨酸 | 亮氨酸 |
| AGA | 精氨酸 | 终止码 | 丝氨酸 | 精氨酸 | 精氨酸 |
| AGA | |||||
注:下标横线者为与通用编码不同的编码
究竟哪一个密码子为哪一种氨基酸编码,即密码子与氨基酸之间的对应关系已在60年代研究解决了。1964年Nirenberg用一种RNA聚合酶体外合成了多聚尿苷酸、多聚腺苷酸等多聚核苷酸,将这些多聚核苷酸分别用于蛋白质的体外合成。发现,当所用的多聚核苷酸为多聚尿苷酸时,只有多聚苯丙氨酸合成,这意味着UUU为苯丙氨酸编码;用其它多聚核苷酸进行相应的实验后发现,CCC为脯氨酸编码,而AAA为赖氨酸编码;其后,有人又用核苷酸比例为已知,但是核苷酸序列随机的多聚核苷酸,以及用已知序列的含两种或两种以上核苷酸的多聚核苷酸进行相应的实验,将结果加以数理统计处理,又解读了一批密码子,其中包括三个终止码,最后,还有一些密码子是通过合成已知序列的三聚核苷酸与核蛋白体和载有放射性同位素标记的氨基酸的tRNA共沉淀原理予以解读的。在所有密码子中,AUG不仅为蛋氨酸编码,而且又是翻译(translation,以mRNA上的遗传信息指导核蛋白体上多肽链合成的过程)的起始信号,UAA、UAG和UGA不为任何氨基酸编码,而是作为翻译的终止信号,统称为终止码(stop codon),又常被叫作无意义码(nonsense codon)。
大多数氨基酸是由一个以上的密码子所编码。这个事实提出了一个问题:编码同一种氨基酸的一组密码子的使用频率是否都相同?细致的分析表明,无论是原核生物,还是高等真核生物,密码子的使用频率并不是平均的,有些密码子的使用率很高,有些则几乎不使用,其使用频率主要与细胞内tRNA含量呈正相关。
(二)转运RNA(tRNA)
tRNA(transfer RNA)是蛋白质合成中的接合器分子。tRNA分子有100多种,各可携带一种氨基酸,将其转运到核蛋白体上,供蛋白质合成使用。tRNA是细胞内分子量最小的一类核酸,由70~120核苷酸构成,各种tRNA无论在一级结构上,还是在二、三级结构上均有一些共同特点。tRNA中含有10%~20%的稀有碱基(rare bases),如:甲基化的嘌呤mG、mA,双氢尿嘧啶(DHU)、次黄嘌呤等等。此外,tRNA内还含有一些稀有核苷,如:胸腺嘧啶核糖核苷,假尿嘧啶核苷(Ψ,pseudouridine)等。胸腺嘧啶一般存在于DNA中;在假尿嘧啶核苷中,不是通常嘧啶环中1位氮原子,而是嘧啶环中的5位碳原子与戊糖的1′位碳原子之间形成糖苷键。
tRNA分子内的核苷酸通过碱基互补配对形成多处局部双螺旋结构,未成双螺旋的区带构成所谓的环和襻。现发现的所有tRNA均可呈现图15-14所示的这种所谓的三叶草样(clover leafpattern)二级结构。在此结构中,从5′末端起的第一个环是DHU环,以含二氢尿嘧啶为特征;第二个环为反密码子环,其环中部的三个碱基可以与mRNA中的三联体密码子形成碱基互补配对,构成所谓的反密码子(anticodon),在蛋白质合成中起解读密码子,把正确的氨基酸引入合成位点的作用;第三个环为TΨ环,以含胸腺核苷和假尿苷为特征;在反密码子环与TΨ环之间,往往存在一个襻,由数个乃至二十余个核苷酸组成,所有tRNA3′末端均有相同的CCA-OH结构,tRNA所转运的氨基酸就连接在此末端上。(图15-14A)
图15-14 tRNA的二级与三级结构
A.二级结构(a示反密码环及反密码)
B.三级结构(数字示可能的非常见核苷酸对相互作用)
通过X-射线衍射等结构分析方法,发现tRNA的共同三级结构均呈倒L形(图15-14B),其中3′末端含CCAOH的氨基酸臂位于一端,反密码子环位于另一端,DHU环和TΨ环虽在二级结构上各处一方,但在三级结构上却相互邻近。tRNA三级结构的维系主要是依赖核苷酸之间形成的各种氢键。各种tRNA分子的核苷酸序列和长度相差较大,但其三级结构均相似,提示这种空间结构与tRNA的功能有密切关系。
(三)核蛋白体RNA(rRNA)
核蛋白体RNA(ribosomalRNA)是细胞内含量最多的RNA,约占RNA总量的80%以上,是蛋白质合成机器枣核蛋白体(核糖体)(ribosome)的组成成分。核糖体蛋白(ribosmal protein,rp)有数十种,大多是分子量不大的多肽类,分布在核蛋白体大亚基的蛋白称为rpl,在小亚基的称rps。
原核生物和真核生物的核蛋白体均由易于解聚的大、小亚基组成。对大肠杆菌核蛋白体的研究发现其质量中三分之二是rNRA,三分之一是蛋白质。rRNA分为5S、16S、23S三种。S是大分子物质在超速离心沉降中的一个物理学单位,可反映分子量的大小。小亚基由16SrRNA和21种rps构成,大亚基由5S、23s rRNA和31种 rpl构成。真核生物核蛋白体小业基含18S rRNA和30多种rps,大亚基含28S、5.8S、5S三种rRNA,近50种rpl。各种生物核蛋白体小亚基中的rRNA具有相似的二级结构(图15-15)。
图15-15 原核生物与真核生物核蛋白体的结构比较
(线粒体核蛋白体的结构与原核相似)
无论在试管内或细胞内,大、小亚基都易于组成核蛋白体整体或分离成两部分。几十种多肽是如何互相联结,又怎样与几种rRNA相连的呢?用提纯了的亚基所有的肽和rRNA在试管内混合,发现不需加入酶或ATP就可以自动组装成为有活性的亚基,但rRNA之间却不能互相替代,也即说这种自我组装过程是以rRNA为主导的。虽然所有多肽在组装中也是缺一不可的,但不同的肽可能有酶的作用或起别构效应。现已证明某些核糖体蛋白具有酶的功能,但基中大多数还未弄清其具体作用。
(四)其它RNA分子
小核RNA(snRNA,smallnuclear RNA)存在于真核细胞的细胞核内,是一类称为小核核蛋白体复合体(snRNP)的组成成分,有U1,U2,U4,U5,U6snRNA等,均为小分子核糖核酸,长约106?89个核苷酸,其功能是在hnRNA成熟转变为mRNA的过程中,参与RNA的剪接,并且在将mRNA从细胞核运到细胞浆的过程中起着十分重要的作用(表15-10)。
表15-10 snRNA的种类与功能
| snRNA | 分子大小(核苷酸数) | 功能 |
| U1 | 165 | 结合5′-剪接点 |
| U2 | 185 | 结合于分支点 |
| U5 | 116 | 结合于3′-剪接点 |
| U4 | 145 106 |
装配剪接颗粒 |
| U6 |
小胞浆RNA(scRNA,smallcytosol RNA)又称为7SLRNA,长约300个核苷酸,主要存在于细胞浆中,是蛋白质定位合成于粗面内质网上所需的信号识别体(signal recognization particle)的组成成分。
小结
核酸是由核苷酸聚合而成的高分子化合物,是所有生物遗传信息的携带者。根据核苷酸分子中戊糖的类型,将核酸分为脱氧核糖核酸(DNA)和核糖核酸(RNA)两大类。
核苷酸由磷酸基、戊糖和含氮碱基组成,碱基包括嘌呤和嘧啶两大类。DNA一般含A、C、G、T四种碱基,RNA含A、C、G、U四种碱基。
四种核苷酸按照一定的排列顺序,通过3′,5′磷酸二酯键相连形成的线形多核苷酸即DNA的一级结构。不同排列顺序的DNA区段构成的特定功能单位即基因,DNA的一级结构决定了基因的功能。
一般将细胞内染色体包含DNA的总体称为基因组。同一物种的基因组DNA含量总是恒定的,不同物种间基因组大小和复杂程度差异极大。真核生物具有复杂的染色体结构,其基因组DNA上存在着单一序列和大量重复序列,大多数真核基因都是不连续的,在成熟RNA中出现的部分称为外显子,在DNA拼接过程中被删除的部分称为内含子。原核生物没有核膜,其DNA与RNA和蛋白质一起形成一个相对集中的区域即类核。原核生物基因组上功能相关的基因常常串连在一起并转录在同一mRNA分子中,形成多顺反子结构。某些病毒中会出现基因重叠。
在进化过程中DNA可能发生突变,不影响生物体表型的DNA突变称为中性突变,中性突变常以孟德称显性遗传方式遗传给下一代,其中的限制性片段长度多态性已被广泛用于遗传病的诊断、产前诊断、亲子鉴定以及法医学上对罪犯的确认等。
双螺旋结构是DNA的二级结构,由戊糖和磷酸基构成的两条主锭以反平行的方式和右手方向相互缠绕,构成双螺旋的骨架。主链由于其亲水性而处于双螺旋的外表面,碱基由于其一定程度的疏水性而位于双螺旋的内部。两条链上的碱基按A:T和G:C的互补规律相互以氢链连接,构成遗传信息可靠传递、DNA半保留复制的基础。两条主链并不充满双螺旋的空间,而在表面形成大沟和小沟。大沟是调控蛋白质识别DNA信息的主要场所。
DNA分子结构并非一成不变,而是在不同条件下可以有所不同,即DNA结构的多态性。在生理状态下DNA主要为B构象,并可能有少量的A构象和Z构象。Z构象是唯一存在的左手双螺旋构象。
DNA链上的四种碱基也非均匀分布,因而产生了一些特异的序列。回文序列是许多限制性核酸内切酶和调控蛋白的识别位点;富含A/T序列则是许多分子遗传学过程所不可缺少的;嘌呤和嘧啶的排列顺序对双螺旋的稳定性也有重大影响。
DNA在热或其他变性剂的作用下,双螺旋结构遭到破坏,双链发生分离,即变性。变性DNA的某些理化性质和生物学性质随之改变,如增色效应。核酸加热变性过程中紫外光吸收值达到最大值的50%时的温度称为核酸的解链温度(Tm),Tm值的大小与核酸分子大小和G+C所占总碱基数的百分比成正相关。变性的DNA单链在适当条件下又能恢复双螺旋结构,即复性作用。不同来源的变性核酸一起复性,则可能发生杂交,杂交是许多分子生物学技术的基础。
双螺旋DNA进一步扭曲而成的超螺旋称为DNA的三级结构。真核生物中,DNA与组蛋白形成核小体结构时,存在着负超螺旋。核小体是构成染色质的基本结构单位,每个核小体单位包括200bp左右的DNA和一个组蛋白八聚体以及一个分子的组蛋白H1。
RNA包括mRNA、hnRNA、rRNA、tRNA、snRNA和scRNA,它们均与遗传信息的表达有关。mRNA是遗传信息的携带者,其核苷酸序列决定着合成蛋白质的氨基酸序列;hnRNA是mRNA的前体,含有转录的、但不出现于成熟mRNA中的核苷酸片段(内含子);tRNA识别密码子,将正确的氨基酸转运至蛋白质合成位点;rRNA是蛋白质合成机器——核蛋白体的组成成分;snRNA在hnRNA向mRNA转变过程的剪接中起十分重要的作用。
复习题
1.比较RNA和DNA在结构上的异同点。
2.简述DNA双螺旋结构模式的要点及其与DNA生物学功能的关系。
3.原核生物与真核生物在基因组结构上有何不同?
4.什么是限制性片段长度多态性?
5.简述两种DNA序列测定方法的基本原理。
6.试述DNA结构的不均一性与其生物学功能的关系。
7.什么是核酸变性?简述影响特定核酸分子Tm的因素有哪些。
8.什么是分子杂交,何为探针?
9.试述RNA的种类及其生物学作用。
第十六章 DNA的生物合成(TheBiosynthesis of DNA)
脱氧核糖核酸(DNA)是生物界遗传的主要物质基础。生物有机体的遗传特征以密码(code)的形式编码在DNA分子上,表现为特定的核苷酸排列顺序-即遗传信息,在细胞分裂前通过DNA的复制(Replication),将遗传信息由亲代传递给子代,在后代的个体发育过程中,遗传信息自DNA转录(Transcription)给RNA,并指导蛋白质合成,以执行各种生命功能,使后代表现出与亲代相似的遗传性状,这种遗传信息的传递方向,是从DNA到RNA再到蛋白质,即所谓的生物学“中心法则”,80年代以后在某些致癌RNA病毒中发现遗传信息也可存在于RNA分子中,由RNA通过逆转录(reversetranscription)的方式将遗传信息传递给DNA。这为中心法则加入了新的内容。目前认为生物界遗传信息传递的中心法则为:
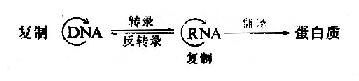
本章的内容主要涉及DNA生物合成的三个方面,第一,DNA复制,第二,RNA反转录为DNA,第三,细胞内DNA受到损伤时进行的修复作用。
第一节 DNA的复制
DNA做为遗传物质的基本特点就是在细胞分裂前进行准确地自我复制(selfreplication),使DNA的量成倍增加,这是细胞分裂的物质基础。1953年Watson和Crick提出DNA双螺旋结构模型指出,DNA是由二条互补的脱氧核苷酸链组成,所以一条DNA链上的核苷酸排列顺序是由图16-1双螺旋DNA的复制另一条决定的。这就说明DNA的复制是由原来存在的分子为模板来合成新的链。曾经有过多种关于DNA复制方式的学说,包括半保留复制,全保留复制以及分散复制等(图16-1)。
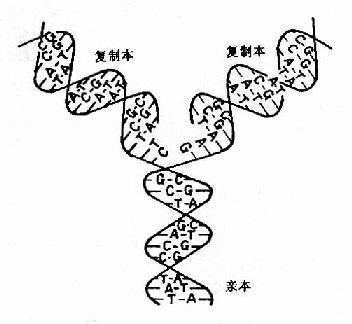
图16-1 双螺旋DNA的复制
一、DNA复制的方式及一般过程:
(一)DNA的半保留复制(semiconservative replication)
Watson和Crick在提出DNA双螺旋结构模型时即推测,DNA在复制时首先两条链之间的氢键断裂两条链分开,然后以每一条链分别做模板各自合成一条新的DNA链,这样新合成的子代DNA分子中一条链来自亲代DNA,另一条链是新合成的,这种复制方式为半保留复制。
1958年Meselson和Stahl利用氮标记技术在大肠杆菌中首次证实了DNA的半保留复制,他们将大肠杆菌放在含有15N标记的NH4Cl培养基中繁殖了15代,使所有的大肠杆菌DNA被15N所标记,可以得到15N桪NA。然后将细菌转移到含有14N标记的NH4Cl培养基中进行培养,在培养不同代数时,收集细菌,裂介细胞,用氯化铯(CsCl)密度梯度离心法观察DNA所处的位置。由于15N桪NA的密度比普通DNA(14N-DNA)的密度大,在氯化铯密度梯度离心(density gradientcentrifugation)时,两种密度不同的DNA分布在不同的区带。
实验结果表明:在全部由15N标记的培养基中得到的15N桪NA显示为一条重密度带位于离心管的管底。当转入14N标记的培养基中繁殖后第一代,得到了一条中密度带,这是15N桪NA和14N-DNA的杂交分子。第二代有中密度带及低密度带两个区带,这表明它们分别为15N14N-DNA和14N14N-DNA。随着以后在14N培养基中培养代数的增加,低密度带增强,而中密度带逐渐减弱,离心结束后,从管底到管口,CsCl溶液密度分布从高到低形成密度梯度,不同重量的DNA分子就停留在与其相当的CsCl密度处,在紫外光下可以看到DNA分子形成的区带。为了证实第一代杂交分子确实是一半15N-DNA-半14N-DNA,将这种杂交分子经加热变性,对于变性前后的DNA分别进行CsCl密度梯度离心,结果变性前的杂交分子为一条中密度带,变性后则分为两条区带,即重密度带(15N-DNA)及低密度带(14N-DNA)。它们的实验只有用半保留复制的理论才能得到圆满的解释(图16-2和16-3)。
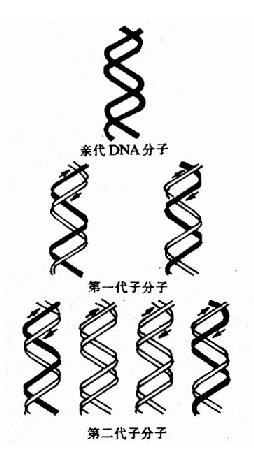 |
 |
| 图16-2 DNA的半保留复制第一代分子含有一条亲代的链(用黑色素示),与另一条新合成的链(用白色表示)配对。在以后的连续复制过程中,原来亲代的两条链仍然保持完整,因此总有两个分子各具有一条原来亲代的链。 | 图16-3 DNA的半保留复制-MeslsonStahl实验密度梯度离心后的DNA位置:左三管为对照;右三管为实验结果 |
(二)DNA复制的一般过程:
DNA双螺旋是由两条方向相反的单链组成,复制开始时,双链打开,形成一个复制叉(replicative fork,从打开的起点向一个方向形成)或一个复制泡(replicative bubble,从打开的起点向两个方向形成。)两条单链分别做模板。各自合成一条新的DNA链。由于DNA一条链的走向是5′→3′方向,另一条链的走向是3′→5′方向,但生物体内DNA聚合酶只能催化DNA从5′→3′的方向合成。那么,两条方向不同的链怎样才能做模板呢?这个问题由日本学者岗崎先生解决。
原来,在以3′→5′方向的母链为模板时,复制合成出一条5′→3′方向的前导链(leadingstrand),前导链的前进方向与复制叉打开方向是一致的,因此前导链的合成是连续进行的,而另一条母链DNA是5′→3′方向,它作为模板时,复制合成许多条5′→3′方向的短链,叫做随从链(lagging strand),随从链的前进方向是与复制叉的打开方向相反的。随从链只能先以片段的形式合成,这些片段就叫做岗崎片段(Okazaki fragments),原核生物岗崎片段含有1000-2000核苷酸,真核生物一般100?00核苷酸。最后再将多个岗崎片段连接成一条完整的链。由于前导链的合成是连续进行的,而随从链的合成是不连续进行的,所以从总体上看DNA的复制是半不连续复制(图16-4)。
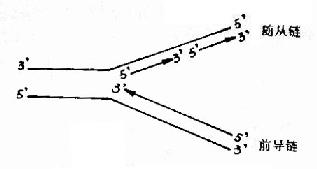
图16-4 DNA的半不连续复制
DNA复制的全部过程可以人为地分成三个阶段,第一个阶段为DNA复制的起始阶段,这个阶段包括起始点,复制方向以及引发体的形成,第二阶段为DNA链的延长,包括前导链及随从链的形成和切除RNA引物后填补空缺及连接岗崎片段。第三阶段为DNA复制的终止阶段。在DNA复制的整个过程中需要30多种酶及蛋白质分子参加,我们将在DNA复制的各个阶段中着重介绍它们的作用。
二、DNA复制的起始阶段:
(一)DNA复制的起始点
很多实验都证明:复制是从DNA分子上的特定部位开始的,这一部位叫做复制起始点(originof replication)常用ori或o表示。细胞中的DNA复制一经开始就会连续复制下去,直至完成细胞中全部基因组DNA的复制。DNA复制从起始点开始直到终点为止,每个这样的DNA单位称为复制子或复制单元(replicon)。在原核细胞中,每个DNA分子只有一个复制起始点,因而只有一个复制子,而在真核生物中,DNA的复制是从许多起始点同时开始的,所以每个DNA分子上有许多个复制子。
DNA复制起始点有结构上的特殊性,例如:大肠杆菌染色体DNA复制起始点Oric由422个核苷酸组成,是一系列对称排列的反向重复序列,即回文结构(palindrome),其中有9个核苷酸或13个核苷酸组成的保守序列,这些部位是大肠杆菌中DnaA蛋白识别的位置,大肠杆菌染色体DNA是环状双链DNA,它的复制是典型的“θ”型复制(由于形状像希腊字母θ)。从一个起点开始,同时向两个方向进行复制,当两个复制方向相遇时,复制就停止。而有些生物的DNA复制起始区是一段富含A·T的区段。这些特殊的结构对于在DNA复制起始过程中参与的酶和许多蛋白质分子的识别和结合都是必须的。
(二)DNA复制的方向:
(1)定点开始双向复制:
这是原核生物和真核生物DNA复制最主要的形式,从一个特定位点解链,沿着两个相反的方向各生长出两条链,形成一个复制泡,用电子显微镜可以观察到复制泡的存在(图16-5)。
图16-5 SV40DNA;复制泡生长的电镜图谱
(2)定点开始单向复制:
质粒colE1是个典型的例子,复制从一个起始点开始,以同一方向生长出两条链,形成一个复制叉(replication fork)。
(3)两点开始单向复制:
腺病毒DNA的复制是从两个起点开始的,形成两个复制叉,各以一个单一方向复制出一条新链(图16-6)。
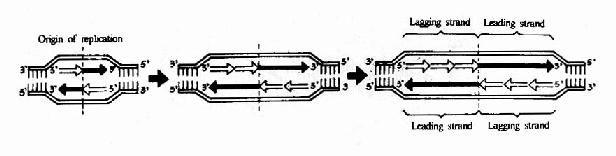
图16-6 DNA的半不连续复制和复制泡的形成
总之DNA复制的起点及方向不仅原核细胞与真核细胞不同,就是同属于原核生物和真核生物的不同种属也有相当大的差异(图16-7)。
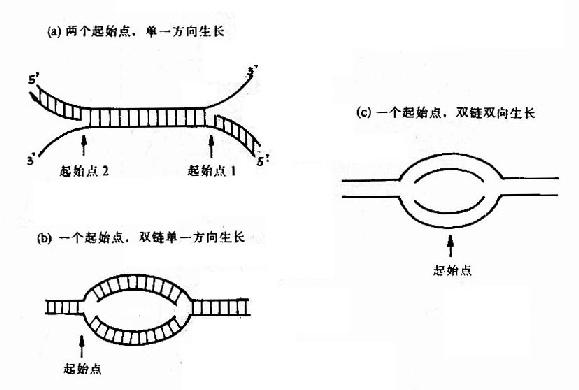
图16-7 DNA链生长方向的三种机制
(三)DNA复制起始引发体的形成及所参与的酶和蛋白质:
1.解链酶(helicase)
DNA开始复制时首先在起始点处解开双链,反应是在一种解链酶(helicase)的催化下进行的。解链酶需要ATP分解供给能量。大肠杆菌中DnaB蛋白就有介链酶活性,与随从链的模板DNA结合,沿5′→3′方向移动,还有一种叫做Rep蛋白和前导链的模板DNA结合沿3′→5′方向移动。解链酶的作用就是打开DNA双链之间的氢键。
2.单链结合蛋白:(single strand binding proteins,SSBP)
它与解开的单链DNA结合,使其稳定不会再度螺旋化并且避免核酸内切酶对单链DNA的水解,保证了单链DNA做为模板时的伸展状态,SSBP可以重复利用(图16-8)。
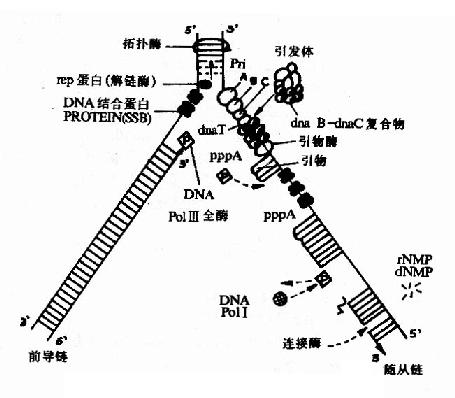
图16-8 大肠杆菌DNA复制叉中复制过程简图
3.引发体的形成:
DNA复制起始的关健步骤是前导链DNA的合成,一旦前导链DNA的聚合作用开始,随从链DNA的合成也随着开始。由于前导链的合成是连续进行的,所以它的起始相对简单,而随从链的合成是不连续进行的,所以引发阶段比较复杂。大肠杆菌的引发前体由Dna B. Dna C和单链结合蛋白组成。
(1)引物酶(primase)
它是一种特殊的RNA聚合酶,可催化短片段RNA的合成。这种短RNA片段一般十几个至数十个核苷酸不等,它们在DNA复制起始处做为引物。RNA引物的3′桹H末端提供了由DNA聚合酶催化形成DNA分子第一个磷酸二酯键的位置。
(2)引发体(primosome)
高度解链的模板DNA与多种蛋白质因子形成的引发前体促进引物酶结合上来,共同形成引发体,引发体主要在DNA随从链上开始,它连续地与引物酶结合并解离,从而在不同部位引导引物酶催化合成RNA引物,在引物RNA的3′桹H末端接下去合成DNA片段,这就是随从链不连续合成的开始。
三、DNA复制的延长阶段以及参与的酶和蛋白质分子:
DNA的复制实际上就是以DNA为模板在DNA聚合酶作用下,将游离的四种脱氧单核苷酸(dATP,dGTP,dCTP,dTTP,简写为dNTP)聚合成DNA的过程。
这是一个非常复杂的酶促反应,需要许多种酶和蛋白质参与,现分别叙述它们在DNA复制中作用。
(一)DNA的聚合反应和DNA聚合酶
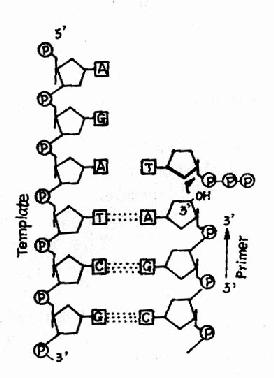
图16-9 DNA聚合酶的作用
1957年,Arthur kornberg首次在大肠杆菌中发现DNA聚合酶Ⅰ,(DNa polymerase Ⅰ,简写DNA polⅠ)后来又相继发现了DNA聚合酶Ⅱ和DNA聚合酶Ⅲ。(DNa polymerase Ⅱ,Ⅲ,简写DNA polⅡ,DNA polⅢ)实验证明大肠杆菌中DNA复制的主要过程靠DNa polⅢ起作用,而DNA polⅠ和DNA polⅡ在DNA错配的校正和修复中起作用。见表16-1。
这种酶的共同性质是:①需要DNA模板,因此这类酶又称为依赖DNA的DNA聚合酶(DNa dependent DNA polymerase, DDDP)。②需要RNA或DNA做为引物(primer),即DNA聚合酶不能从头催化DNA的起始。③催化dNTP加到引物的3′桹H末端,因而DNA合成的方向是5′→3′。图16-9。④三种DNA聚合酶都属于多功能酶,它们在DNA复制和修复过程的不同阶段发挥作用。由于DNA聚合酶Ⅰ是研究得最清楚而且代表了其他DNA聚合酶的基本特点,所以我们着重介绍DNa polⅠ的作用并指出另外二种DNA pol的特殊性:
1.DNA聚合酶Ⅰ:
DNA polⅠ是由一条多肽链组成,分子量为109KD。酶分子中含有一个Zn++,是聚合活性必须的。
大肠杆菌每个细胞中约有400个酶分子,每个酶分子每分钟在37℃下能催化667个核苷酸参入到DNA链中,用枯草杆菌蛋白酶可将此酶水介成两个片段,大片段分子量为76KD,通常称为klenow片段,小片段为34KD。大小片段具有不同的酶活性。
(1)DNA聚合酶的5′→3′聚合活性:
这是DNA聚合酶最主要的活性,按模板DNA上的核苷酸顺序,将互补的dNTP逐个加到引物RNA3′桹H末端,并促进3′桹H与dNTP的5′桺O4形成磷酸二酯键,酶的专一性表现为新进入的dNTP必须与模板DNA碱基配对时才有催化作用,5′→3′聚合活性存在于klenow片段上(图16-9和图16-10)。
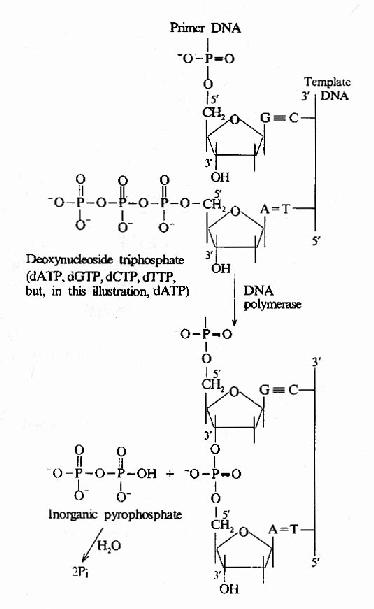
图16-10 DNA聚合酶催化的DNA链延长
(2)DNA聚合酶的3′→5′外切核酸酶活性:
这种酶活性的主要功能是从3′→5′方向识别并切除DNA生长链末端与模板DNA不配对而游离的核苷酸,这种功能称为校对功能,这是保证其聚合作用的正确性不可缺少的,因此对于DNA复制中极高的保真性是至关重要的。
(3)DNA聚合酶的5′→3′外切核酸酶活性:
这种酶活性是从DNA链的5′端向3′末端水解已配对的核苷酸,本质是切断磷酸二酯键,每次能切除10个核苷酸。因此,这种酶活性在DNA损伤的修复中可能起重要作用,对完成的DNA片段去除5′端的RNA引物也是必须的。
DNA polⅠ的5′→3′聚合活性和5′→3′外切酶活性协同作用,可以使DNA一条链上的切口从5′→3′方向移动,这种反应叫做缺刻平移(nick translation),利用此反应可在体外对DNA片段进行放射性磷(α-32PdNTP)的标记制成探针(probe),进行核酸的分子杂交实验,是现代分子生物学的一项重要技术(图16-11)。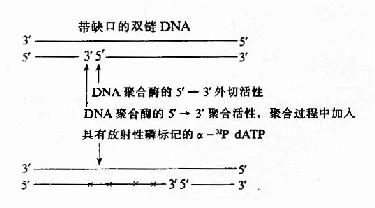
图16-11 缺刻平移标记DNA探针
许多实验证实DNA polⅠ并不是DNA复制过程中的主要酶,它的作用主要与DNA损伤后的修复有关。
2.DNA聚合酶Ⅱ(DNA polⅡ)
此酶分子量为120KD,每个细胞约有100个酶分子,但活性只有DNa polⅠ的5%,它具有5′→3′聚合活性和3′→5′外切活性,而没有5′→3′外切活性,它的作用可能与DNA损伤修复有关。
3.DNA聚合酶Ⅲ(DNA polⅢ)
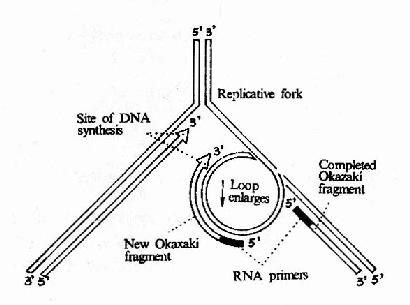
图16-12 DNA聚合酶Ⅲ催化先导链和随从的合成
这是在DNA复制过程中起主要作用的聚合酶,它是由一个多亚基组成的蛋白质分子,其分子量>600kDa整个酶分子形成一个不对称的二聚体,每个大肠杆菌细胞中只有10?0个酶分子,但催化dNTP参入DNA链的速率却是最快的,约为9000核苷酸/每分钟/每个酶分子。这也证明DNa polⅢ是DNA复制过程中主要发挥作用的酶。在大肠杆菌染色体DNA进行复制时,DNA聚合酶Ⅲ全酶并不是单独起作用的,而是与引发体,介链酶等构成一个复制体(replisome)。由于复制体的存在,先导链和随从链可以同时复制。DNa polⅢ是由多亚基组成的不对称二聚体,它可能同时负责先导链和随从链的复制,在φ×174的复制中观察到引发体总是伴随着DNA噜噗(loop)的存在。图16?2可以看到,由于随从链的模板DNA在DNA聚合酶Ⅲ全酶上绕转了180°而形成一个噜噗,因此岗崎片段的合成方向能够与先导链的合成方向以及复制体移动方向保持一致。
随着DNA polⅢ向前移动,先导链的合成逐渐延长的同时,岗崎片段也在不断延长,这一噜噗也在不断扩大。当岗崎片段合成到前一个片段的5′端时,这一大噜噗就释放出来,由于复制叉向前移动又可将另一部分随从链的模板置换出来,由引发体合成新的引物,然后再形成一个小的噜噗,进行新的岗崎片段的合成。由此模型不难看出:随从链的合成需要周期性的引发,因此其合成进度总是与前导链相差一个岗崎片段的长度。岗崎片段完成后,其5′端的RNA引物由DNa polⅠ的5′→3′外切酶活性切除,由此造成的空隙再由DNA polⅠ的5′→3′聚合活性催化dNTP得到填补。所以DNA的复制是在DNa polⅢ和DNApolⅠ互相配合下完成的。
下面列表说明三种大肠杆菌DNA聚合酶的特性
表16-1 大肠杆菌DNA聚合酶特征
| DNA聚合酶Ⅰ | DNA聚合酶Ⅱ | DNA聚合酶Ⅲ | |
| 分子量 | 109KD | 120KD | >600KD |
| 每个细胞中的分子数 | 400 | 17-100 | 10-20 |
| 5′→3′聚合活性 | + | + | + |
| 37℃转化率核苷酸数/酶分子·分钟 | 600 | 30 | 30,000 |
| 5′→3′外切活性 | + | - | - |
| 5′→3′外切活性 | + | + | + |
| 切刻平移活性 | + | - | - |
| 对dNTP亲和力 | 低 | 低 | 高 |
| 功能 | 修复 | 不详 | 复制 |
| 去除引物 | |||
| 填补空缺 |
真核生物DNA聚合酶
真核生物DNA聚合酶有α、β、γ、δ及ε。它们的基本特性相似于大肠杆菌DNA聚合酶,其主要活性是催化dNTP的5′→3′聚合活性,基本特征见表16-2。
表16-2 真核生物DNA聚合酶
| α | β | γ | δ | ε | |
| 亚基数 | 4 | 4 | 4 | 2 | 5 |
| 分子量(KD) | >250 | 36-38 | 160-300 | 170 | 256 |
| 细胞内定位 | 核 | 核 | 线粒体 | 核 | 核 |
| 5′→3′聚合活性 | + | + | + | + | + |
| 3′→5′外切活性 | - | - | - | - | - |
| 功能 | 复制、引发 | 修复 | 复制 | 复制 | 复制 |
真核细胞在DNA复制中起主要作用的是DNA polα,主要负责染色体DNA的复制。DNa polβ的模板特异性是具有缺口的DNA分子,被认为它与DNA修复有关。DNa polγ在线粒体DNA的复制中起作用。DNA polδ不但有5′→3′聚合活性,而且还具有3′→5′外切酶活性,据认为真核生物DNA复制是在DNa polα和DNA polδ协同作用下进行的,前导链的合成靠DNA polδ催化,并且还需要一种细胞周期调节因子椩鲋诚赴丝乖?proliferatingcell nucleus antigen, PCNA)参与。而随从链的合成靠DNA polα和引发酶配合作用完成。
(二)与超螺旋松驰有关的酶:
DNA复制从起始点开始向一个方向复制时,局部的DNA双链必须打开,主要靠解链酶的作用,打开后的单链还需要单链结合蛋白与其结合,在复制叉向前移动时造成其前方DNA分子所产生的正超螺旋,必须由拓扑异构酶来解决。下面分别介绍它们的作用。
拓扑异构酶(topoisomerase)是一类改变DNA拓扑性质的酶。在体外可催化DNA的各种拓扑异构化反应,而在生物体内它们可能参与了DNA的复制与转录。在DNA复制时,复制叉行进的前方DNA分子部分产生有正超螺旋,拓扑酶可松驰超螺旋,有利于复制叉的前进及DNA的合成。DNA复制完成后,拓扑酶又可将DNA分子引入超螺旋,使DNA缠绕、折叠,压缩以形成染色质。DNA拓扑异构酶有Ⅰ型和Ⅱ型,它们广泛存在于原核生物及真核生物中。表16-3
表16-3 大肠杆菌和真核生物中的拓扑异构酶
| 类型 | 作用 | 对超螺旋的作用 |
| Ⅰ型拓扑异构酶 | ||
| 大肠杆菌 | 切开一股DNA链 | 松驰负超螺旋 |
| 真核生物 | 切开一股DNA链 | 松驰正,负超螺旋 |
| Ⅱ型拓扑异构酶 | ||
| 大肠杆菌 | 切开二股DNA链 | 构驰正超螺旋; |
| 依赖ATP | 引入负超螺旋, | |
| 解环连等 | ||
| 真核生物 | 切开二股DNA链 | 松驰正超旋, |
| 依赖ATP | 但不能引入负超螺旋 |
拓扑异构酶Ⅰ(TopoⅠ)的主要作用是将环状双链DNA的一条链切开一个口,切口处链的末端绕螺旋轴按照松驰超螺旋的方向转动,然后再将切口封起来。这就使DNA复制叉移动时所引起的前方DNA正超螺旋得到缓解,利于DNA复制叉继续向前打开。拓扑异构酶Ⅰ除上述作用外,对环状单链DNA还有打结或解结作用,对环状双链DNA的环连或解连以及使环状单链DNA形成环状双链DNA都有作用(图16-13)。
图16-13 拓扑酶Ⅰ及Ⅱ的作用特点
(a)大肠杆菌拓扑酶Ⅰ催化的4种拓扑异构化作用 (b)拓扑酶Ⅱ的作用
拓扑异构酶Ⅱ(TopoⅡ)是在大肠杆菌中发现的,曾被称为旋转酶(gyrase),它们作用特点是切开环状双链DNA的两条链,分子中的部分经切口穿过而旋转,然后封闭切口,TopoⅡ还可使DNA分子从超螺旋状态转变为松驰状态,此反应不需要ATP参与。DNA复制完成后,TopoⅡ在ATP参与下,DNA分子从松驰状态转变为负超螺旋。此外,TopoⅡ催化的拓扑异构化反应还有环连或解环连,以及打结或解结。
四、DNA复制的终止阶段
DNA在复制过程中,合成出的前导链为一条连续的长链。随从链则是由合成出许多相邻的片段,在连接酶的催化下,连接成为一条长链。连接作用是在连接酶催化下进行的。
连接酶(ligase)的作用是催化相邻的DNA片段以3′、5′-磷酸二酯键相连接。连接反应中的能量来自ATP(或NAD+)。连接酶先与ATP作用,以共价键相连生成E桝MP中间体。中间体即与一个DNA片段的5′-磷酸相连接形成E-AMP-5′-DNA。然后再与另一个DNA片段的3′-OHH末端作用,E和AMP脱下,两个DNA片段以3′、5′磷酸二酯键相连接。随从链的各个DNA片段就是这样连接成一条DNA长链(图16-14)。
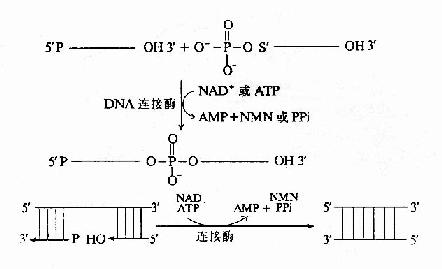 |
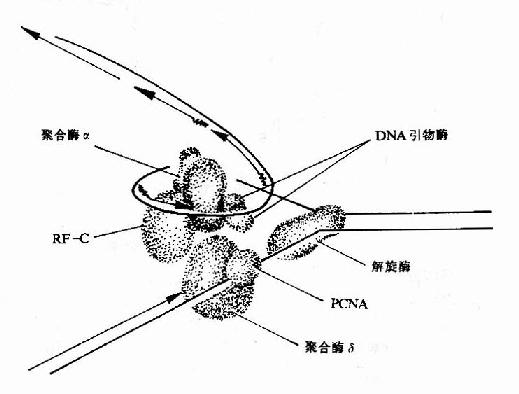 |
| 图16-14 连接酶的催化反应 | 图16-15 真核生物DNA复制叉结构示意图 |
已有研究证明大肠杆菌染色体DNA具有复制终止位点,此处可以结合一种特异的蛋白质分子叫做Tus,这个蛋白质可能是通过阻止解链酶(Helicase)的解链活性而终止复制的。详细的机制还不完全清楚。
DNA复制完成后,靠拓扑酶将DNA分子引入超螺旋结构。
五、真核生物DNA复制的特点:
DNA复制的研究最初是在原核生物中进行的,有些原核生物的DNA复制已经搞得很清楚。真核生物比原核生物复杂得多,但DNA复制的基本过程还是相似的。在这里我们主要讨论一些重要的区别。
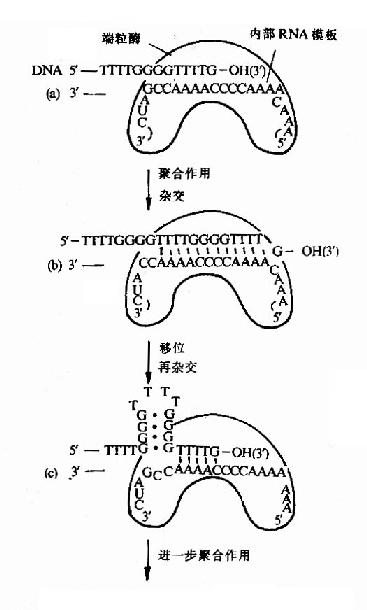
图16-16 端粒酶催化端区TG链的合成
1.与原核生物不同,真核生物DNA复制有许多起始点,例如酵母S.cerevisiae的17号染色体约有400个起始点,因此,虽然真核生物DNA复制的速度(60核苷酸/每秒钟)比原核生物DNA复制的速度(E.coli1700核苷酸/每秒钟)慢得多,但复制完全部基因组DNA也只要几分钟的时间。
2.SV40病毒DNA主要依靠宿主细胞中的DNA复制体系进行DNA的复制,这是了解真核生物DNA复制的体外模型。在真核生物DNA复制叉处,需要两种不同的酶。DNA聚合酶α(polα)和DNA聚合酶δ(polδ)。polα和引物酶紧密结合,在DNA模板上先合成RNA引物,再由polα延长DNA链,这种活性还要复制因子C参与。同时结合在引物模板上的PCNA(增殖细胞核抗原Proliferating cell nuclear antigen)此时释放了polα,然后由polδ结合到生长链3′末端,并与PCNA结合,继续合成前导链。而随从链的合成靠polα紧密与引物酶结合并在复制因子C帮助下,合成岗崎片段(图16-15)。
3.由于真核生物染色体是线性DNA,它的两端叫做端区(telomeres),端区是由重复的寡核苷酸序列构成的。例如酵母的端区重复序列是5′G(1?)T(3)3′。前面讲到所有生物DNA聚合酶都只能催化DNA从5′→3′的方向合成,因此当复制叉到达线性染色体末端时,前导链可以连续合成到头,而由于随从链是以一种不连续的形式合成岗崎片段,所以不能完成线性染色体末端的复制,如果这个问题不解决,真核生物在细胞分裂时DNA复制将产生5′末端隐缩,使DNA缩短,近十多年的研究表明,真核生物体内都存在一种特殊的反转录酶叫做端粒酶(telomerase),它是由蛋白质和RNA两部分组成的,它以自身的RNA为模板,在随从链模板DNA的3′桹H末端延长DNA,再以这种延长的DNA为模板,继续合成随从链(图16-16)。
由此可见端粒酶在保证染色体复制的完整性上有重要意义。
第二节 反转录作用(reverse transcription)
1970年Temin等在致癌RNA病毒中发现了一种特殊的DNA聚合酶,该酶以RNA为核板,根据碱基配对原则,按照RNA的核苷酸顺序(其中V与A配对)合成DNA。这一过程与一般遗传信息流转录的方向相反,故称为反转录,催化此过程的DNA聚合酶叫做反转录酶(reverse transcriptase)。后来发现反转录酶不仅普遍存在于RNA病毒中,哺乳动物的胚胎细胞和正在分裂的淋巴细胞中也有反转录酶。
反转录酶的作用是以dNTP为底物,以RNA为模板,tRNA(主要是色氨酸tRNA)为引物,在tRNA3′桹H末端上,按5′→3′方向,合成一条与RNA模板互补的DNA单链,这条DNA单链叫做互补DNA(complementary DNA, cDNA),它与RNA模板形成RNA桪NA杂交体。随后又在反转录酶的作用下,水解掉RNA链,再以cDNA为模板合成第二条DNA链。至此,完成由RNA指导的DNA合成过程(图16-17)。
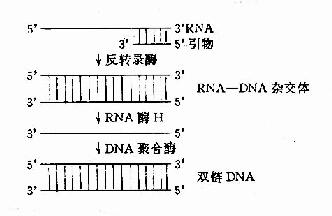
图16-17 反转录酶催化的反转录作用
携带反转录酶的病毒又称为反转录病毒,它侵入宿主细胞后先以病毒RNA为模板靠反转录酶催化合成DNA,随后这种DNA环化并整合到宿主细胞的染色体DNA中去,以原病毒(provirus)的形式在宿主细胞中一代代传递下去。以后又发现许多反转录病毒基因组中都含有癌基因(oncogene),如果由于某种因素激活了癌基因就可使宿主细胞转化为癌细胞。(将在专门一章中叙述)。
大多数反转录酶都具有多种酶活性,主要包括以下几种活性。①DNA聚合酶活性;以RNA为模板,催化dNTP聚合成DNA的过程。此酶需要RNA为引物,多为色氨酸的tRNA,在引物tRNA3′-末端以5′→3′方向合成DNA。反转录酶中不具有3′→5′外切酶活性,因此没有校正功能,所以由反转录酶催化合成的DNA出错率比较高。②RNase H活性;由反转录酶催化合成的cDNA与模板RNA形成的杂交分子,将由RNaseH从RNA5′端水解掉RNA分子。③DNA指导的DNA聚合酶活性;以反转录合成的第一条DNA单链为模板,以dNTP为底物,再合成第二条DNA分子。除此之外,有些反转录酶还有DNA内切酶活性,这可能与病毒基因整合到宿主细胞染色体DNA中有关。反转录酶的发现对于遗传工程技术起了很大的推动作用,目前它已成为一种重要的工具酶。用组织细胞提取mRNA并以它为模板,在反转录酶的作用下,合成出互补的DNA(cDNA),由此可构建出cDNA文库(cDNa library),从中筛选特异的目的基因,这是在基因工程技术中最常用的获得目的基因的方法,详见基因工程一章。
小结
DNA是携带遗传信息的载体,细胞分裂前,通过DNA的复制作用,遗传信息从亲代DNA分子传到子代DNA分子中。DNA复制时,是从一个特定的起始点开始的,两条DNA链分别做模板,在DNA聚合酶等许多酶和蛋白质分子的参与下,以四种脱氧单核苷酸为原料(dNTP),以碱基配对为原则合成新一代的DNA分子,合成方向是5′→3′。经过复制后的DNA分子中,一条链来自亲代DNA分子,另一条链是新合成的,这种复制方式叫做半保留复制。由于DNA分子复制时,两条链分别做模板,有一条链是连续合成的,这条链为前导链,而另一条链合成时只能以5′→3′方向先合成岗崎片段,然后再靠连接酶将这些片段连接起来,形成随从链,所以DNA复制是半不连续的合成。
DNA复制时,先要由DNA拓扑异构酶作用于DNA分子双螺旋,使之松驰,然后才能由解链酶作用,解开双链,此时引物酶合成一段RNA分子做为引物,在DNA聚合酶Ⅲ催化下,连续地合成DNA链。随从链的合成靠多种酶和蛋白质因子参与,在引物酶作用下合成RNA引物,在DNA聚合酶Ⅲ作用下合成DNA片段,它们共同形成了岗崎片段,RNA引物是靠DNA聚合酶Ⅰ的5'→3'外切活性切除的,切除引物后的空隙,再靠DNA聚合酶Ⅰ填补,最后在连接酶作用下,形成长链。
真核生物中DNA的复制靠DNA聚合酶,它有多种不同的形式(α、β、γ、δ等)此外,还有像PCNA等多种蛋白质因子参与。
DNA复制中的准确性很高,因为原核细胞靠DNA聚合酶Ⅰ而真核细胞靠DNA聚合酶δ,都具有3′→5′外切酶活性,可以校正复制中出现的碱基错配。DNA的合成也可以靠反转录酶的催化而完成,这是以RNA分子为模板,合成DNA分子的过程,在致癌的RNA病毒中,有反转录酶的存在,真核生物中的端粒酶就是一种反转录酶,它催化染色体端区DNA的合成。
思考题
1.DNA复制起始有哪些特点?
2.原核生物与真核生物中的DNA聚合酶有哪些种类,它们各自的功能是什么?
3.DNA复制时前导链与随从链的合成有哪些不同?
4.DNA拓扑异构酶的作用如何?
5.连接酶催化的连接反应与DNA聚合酶5′→3′聚合活性有何异同?
6.什么是反转录,有什么生物学意义?
第三节 DNA的损伤与修复
DNA存储着生物体赖以生存和繁衍的遗传信息,因此维护DNA分子的完整性对细胞至关重要。外界环境和生物体内部的因素都经常会导致DNA分子的损伤或改变,而且与RNA及蛋白质可以在胞内大量合成不同,一般在一个原核细胞中只有一份DNA,在真核二倍体细胞中相同的DNA也只有一对,如果DNA的损伤或遗传信息的改变不能更正,对体细胞就可能影响其功能或生存,对生殖细胞则可能影响到后代。所以在进化过程中生物细胞所获得的修复DNA损伤的能力就显得十分重要,也是生物能保持遗传稳定性之所在。在细胞中能进行修复的生物大分子也就只有DNA,反映了DNA对生命的重要性。另一方面,在生物进化中突变又是与遗传相对立统一而普遍存在的现象,DNA分子的变化并不是全部都能被修复成原样的,正因为如此生物才会有变异、有进化。
一、DNA的损伤
(一)DNA损伤的原因
1.DNA分子的自发性损伤
(1)DNA复制中的错误 以DNA为模板按碱基配对进行DNA复制是一个严格而精确的事件,但也不是完全不发生错误的。碱基配对的错误频率约为10-1-10-2,在DNA复制酶的作用下碱基错误配对频率降到约10-5-10-6,复制过程中如有错误的核苷酸参入,DNA聚合酶还会暂停催化作用,以其3′-5′外切核酸酶的活性切除错误接上的核苷酸,然后再继续正确的复制,这种校正作用广泛存在于原核和真核的DNA聚合酶中,可以说是对DNA复制错误的修复形式,从而保证了复制的准确性。但校正后的错配率仍约在10-10左右,即每复制1010个核苷酸大概会有一个碱基的错误。
(2)DNA的自发性化学变化 生物体内DNA分子可以由于各种原因发生变化,至少有以下类型:
a.碱基的异构互变 DNA中的4种碱基各自的异构体间都可以自发地相互变化(例如烯醇式与酮式碱基间的互变),这种变化就会使碱基配对间的氢键改变,可使腺嘌呤能配上胞嘧啶、胸腺嘧啶能配上鸟嘌呤等,如果这些配对发生在DNA复制时,就会造成子代DNA序列与亲代DNA不同的错误性损伤,如图16-18所示。
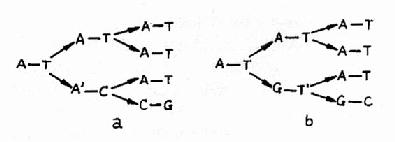
图16-18 腺嘌呤的稀有互变异体与胞嘧啶
(a),或胸腺嘧啶的稀有互变异构体与鸟嘌呤
(b)的氢链形成导致下一世代中G-C配对取代A-T配对
b.碱基的脱氨基作用 碱基的环外氨基有时会自发脱落,从而胞嘧啶会变成尿嘧啶、腺嘌呤会变成次黄嘌呤(H)、鸟嘌呤会变成黄嘌呤(X)等,遇到复制时,U与A配对、H和X都与C配对就会导致子代DNA序列的错误变化。胞嘧啶自发脱氨基的频率约为每个细胞每天190个。
c.脱嘌呤与脱嘧啶 自发的水解可使嘌呤和嘧啶从DNA链的核糖磷酸骨架上脱落下来。一个哺乳类细胞在37℃条件下,20h内DNA链上自发脱落的嘌呤约1000个、嘧啶约500个:估计一个长寿命不复制繁殖的哺乳类细胞(如神经细胞)在整个生活期间自发脱嘌呤数约为108,约占细胞DNA中总嘌呤数的3%。
d.碱基修饰与链断裂 细胞呼吸的副产物O2、H2O2等会造成DNA损伤,能产生胸腺嘧啶乙二醇、羟甲基尿嘧啶等碱基修饰物,还可能引起DNA单链断裂等损伤,每个哺乳类细胞每天DNA单链断裂发生的频率约为5万次。此外,体内还可以发生DNA的甲基化,结构的其他变化等,这些损伤的积累可能导致老化。
由此可见,如果细胞不具备高效率的修复系统,生物的突变率将大大提高。
2.物理因素引起的DNA损伤 射线引起的DNA损伤是最引人注意的。
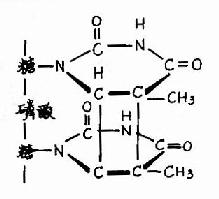
图16-19 胸腺嘧啶二聚体的形成
(1)紫外线引起的DNA损伤 DNA分子损伤最早就是从研究紫外线的效应开始的。当DNA受到最易被其吸收波长(~260nm)的紫外线照射时,主要是使同一条DNA链上相邻的嘧啶以共价键连成二聚体,相邻的两个T、或两个C、或C与T间都可以环丁基环(cyclobutane ring)连成二聚体,其中最容易形成的是TT二聚体,如图16-19所示。
人皮肤因受紫外线照射而形成二聚体的频率可达每小时5×104/细胞,但只局限在皮肤中,因为紫外线不能穿透皮肤。但微生物受紫外线照射后,就会影响其生存。紫外线照射还能引起DNA链断裂等损伤。
(2)电离辐射引起的DNA损伤 电离辐射损伤DNA有直接和间接的效应,直接效应是DNA直接吸收射线能量而遭损伤,间接效应是指DNA周围其他分子(主要是水分子)吸收射线能量产生具有很高反应活性的自由基进而损伤DNA。电离辐射可导致DNA分子的多种变化:
a.碱基变化 主要是由OH-自由基引起,包括DNA链上的碱基氧化修饰、过氧化物的形成、碱基环的破坏和脱落等。一般嘧啶比嘌呤更敏感。
b.脱氧核糖变化 脱氧核糖上的每个碳原子和羟基上的氢都能与OH-反应,导致脱氧核糖分解,最后会引起DNA链断裂。
c.DNA链断裂 这是电离辐射引起的严重损伤事件,断链数随照射剂量而增加。射线的直接和间接作用都可能使脱氧核糖破坏或磷酸二酯键断开而致DNA链断裂。DNA双链中一条链断裂称单链断裂(single strand broken),DNA双链在同一处或相近处断裂称为双链断裂(doublestrand broken)。虽然单链断裂发生频率为双链断裂的10-20倍,但还比较容易修复;对单倍体细胞来说(如细菌)一次双链断裂就是致死事件。
d.交联 包括DNA链交联和DNA-蛋白质交联。同一条DNA链上或两条DNA链上的碱基间可以共价键结合,DNA与蛋白质之间也会以共价键相连,组蛋白、染色质中的非组蛋白、调控蛋白、与复制和转录有关的酶都会与DNA共价键连接。这些交联是细胞受电离辐射后在显微镜下看到的染色体畸变的分子基础,会影响细胞的功能和DNA复制。
3.化学因素引起的DNA损伤
化学因素对DNA损伤的认识最早来自对化学武器杀伤力的研究,以后对癌症化疗、化学致癌作用的研究使人们更重视突变剂或致癌剂对DNA的作用。
(1)烷化剂对DNA的损伤 烷化剂是一类亲电子的化合物,很容易与生物体中大分子的亲核位点起反应。烷化剂的作用可使DNA发生各种类型的损伤:
a.碱基烷基化。烷化剂很容易将烷基加到DNA链中嘌呤或嘧啶的N或O上,其中鸟嘌呤的N7和腺嘌呤的N3最容易受攻击,烷基化的嘌呤碱基配对会发生变化,例如鸟嘌呤N7被烷化后就不再与胞嘧啶配对,而改与胸腺嘧啶配对,结果会使G-C转变成A-T。
b.碱基脱落。烷化鸟嘌呤的糖苷键不稳定,容易脱落形成DNA上无碱基的位点,复制时可以插入任何核苷酸,造成序列的改变。
c.断链。DNA链的磷酸二酯键上的氧也容易被烷化,结果形成不稳定的磷酸三酯键,易在糖与磷酸间发生水解,使DNA链断裂。
d.交联。烷化剂有两类,一类是单功能基烷化剂,如甲基甲烷碘酸,只能使一个位点烷基化;另一类是以双功能基烷化剂,化学武器如氮芥、硫芥等,一些抗癌药物如环磷酰胺、苯丁酸氮芥、丝裂霉素等,某些致癌物如二乙基亚硝胺等均属此类,其两个功能基可同时使两处烷基化,结果就能造成DNA链内、DNA链间,以及DNA与蛋白质间的交联。
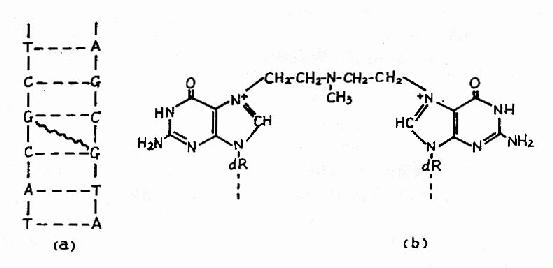
图16-20 氮芥引起DNA分子两条链在鸟嘌呤上的交联
(a)交联附近的总图;(b)交联部分结构图
(2)碱基类似物、修饰剂对DNA的损伤 人工可以合成一些碱基类似物用作促突变剂或抗癌药物,如5-溴尿嘧啶(5-BU)、5-氟尿嘧啶(5-FU)、2-氨基腺嘌呤(2-AP)等。由于其结构与正常的碱基相似,进入细胞能替代正常的碱基参入到DNA链中而干扰DNA复制合成,例如5-BU结构与胸腺嘧啶十分相近,在酮式结构时与A配对,却又更容易成为烯醇式结构与G配对,在DNA复制时导致A-T转换为G-C。
还有一些人工合成或环境中存在的化学物质能专一修饰DNA链上的碱基或通过影响DNA复制而改变碱基序列,例如亚硝酸盐能使C脱氨变成U,经过复制就可使DNA上的G桟变成A桾对;羟胺能使T变成C,结果是A桾改成C桮对;黄曲霉素B也能专一攻击DNA上的碱基导致序列的变化,这些都是诱发突变的化学物质或致癌剂。
(二)DNA损伤的后果
上述损伤会最终导致DNA分子结构的变化,这种DNA分子水平上的突变(mutation)是整体遗传突变的基础。
归纳DNA损伤后分子最终的改变,有以下几种类型:
1.点突变(point mutation) 指DNA上单一碱基的变异。嘌呤替代嘌呤(A与G之间的相互替代)、嘧啶替代嘧啶(C与T之间的替代)称为转换(transition);嘌呤变嘧啶或嘧啶变嘌呤则称为颠换(transvertion)。
2.缺失(deletion) 指DNA链上一个或一段核苷酸的消失。
3.插入(insertion) 指一个或一段核苷酸插入到DNA链中。在为蛋白质编码的序列中如缺失及插入的核苷酸数不是3的整倍数,则发生读框移动(reading frame shift),使其后所译读的氨基酸序列全部混乱,称为移码突变(frameshift mutaion)。
4.倒位或转位(transposition) 指DNA链重组使其中一段核苷酸链方向倒置、或从一处迁移到另一处。
5.双链断裂 已如前述,对单倍体细胞一个双链断裂就是致死性事件。
突变或诱变对生物可能产生4种后果:①致死性;②丧失某些功能;③改变基因型(genotype)而不改变表现型(phenotype);④发生了有利于物种生存的结果,使生物进化。
二、DNA修复
DNA修复(DNA repairing)是细胞对DNA受损伤后的一种反应,这种反应可能使DNA结构恢复原样,重新能执行它原来的功能;但有时并非能完全消除DNA的损伤,只是使细胞能够耐受这种DNA的损伤而能继续生存。也许这未能完全修复而存留下来的损伤会在适合的条件下显示出来(如细胞的癌变等),但如果细胞不具备这修复功能,就无法对付经常发生的DNA损伤事件,就不能生存。所以研究DNA修复也是探索生命的一个重要方面,而且与军事医学、肿瘤学等密切相关。对不同的DNA损伤,细胞可以有不同的修复反应。
(一)回复修复
这是较简单的修复方式,一般都能将DNA修复到原样。
1.光修复 这是最早发现的DNA修复方式。修复是由细菌中的DNA光解酶(photolyase)完成,此酶能特异性识别紫外线造成的核酸链上相邻嘧啶共价结合的二聚体,并与其结合,这步反应不需要光;结合后如受300-600nm波长的光照射,则此酶就被激活,将二聚体分解为两个正常的嘧啶单体,然后酶从DNA链上释放,DNA恢复正常结构。后来发现类似的修复酶广泛存在于动植物中,人体细胞中也有发现。
2.单链断裂的重接 DNA单链断裂是常见的损伤,其中一部分可仅由DNA连接酶(ligase)参与而完全修复。此酶在各类生物各种细胞中都普遍存在,修复反应容易进行。但双链断裂几乎不能修复。
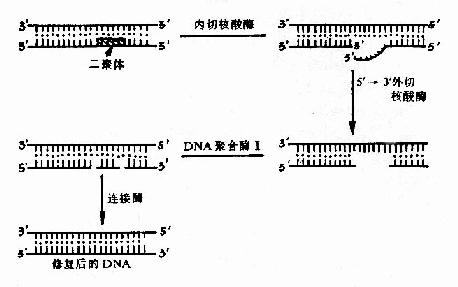
图16-21 损伤DNA的切除修复
3.碱基的直接插入 DNA链上嘌呤的脱落造成无嘌呤位点,能被DNA嘌呤插入酶(insertase)识别结合,在K+存在的条件下,催化游离嘌呤或脱氧嘌呤核苷插入生成糖苷键,且催化插入的碱基有高度专一性、与另一条链上的碱基严格配对,使DNA完全恢复。
4.烷基的转移 在细胞中发现有一种O6甲基鸟嘌呤甲基转移酶,能直接将甲基从DNA链鸟嘌呤O6位上的甲基移到蛋白质的半胱氨酸残基上而修复损伤的DNA。这个酶的修复能力并不很强,但在低剂量烷化剂作用下能诱导出此酶的修复活性。
(二)切除修复(excision repair)是修复DNA损伤最为普遍的方式,对多种DNA损伤包括碱基脱落形成的无碱基位点、嘧啶二聚体、碱基烷基化、单链断裂等都能起修复作用。这种修复方式普遍存在于各种生物细胞中,也是人体细胞主要的DNA修复机制。修复过程需要多种酶的一系列作用,基本步骤如图16?1所示,①首先由核酸酶识别DNA的损伤位点,在损伤部位的5′侧切开磷酸二酯键。不同的DNA损伤需要不同的特殊核酸内切酶来识别和切割。②由5′→3′核酸外切酶将有损伤的DNA片段切除。③在DNA聚合酶的催化下,以完整的互补链为模板,按5′→3′方向DNA链,填补已切除的空隙。④由DNA连接酶将新合成的DNA片段与原来的DNA断链连接起来。这样完成的修复能使DNA恢复原来的结构。
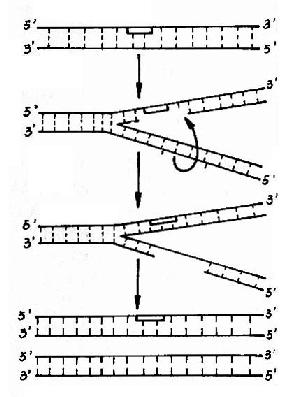
图16-22 DNA损伤后重组修复
(三)重组修复(recombinational repair)
上述的切除修复在切除损伤段落后是以原来正确的互补链为模板来合成新的段落而做到修复的。但在某些情况下没有互补链可以直接利用,例如在DNA复制进行时发生DNA损伤,此时DNA两条链已经分开,其修复可用图16?2所示的DNA重组方式:①受损伤的DNA链复制时,产生的子代DNA在损伤的对应部位出现缺口。②另一条母链DNA与有缺口的子链DNA进行重组交换,将母链DNA上相应的片段填补子链缺口处,而母链DNA出现缺口。③以另一条子链DNA为模板,经DNA聚合酶催化合成一新DNA片段填补母链DNA的缺口,最后由DNA连接酶连接,完成修补。
重组修复不能完全去除损伤,损伤的DNA段落仍然保留在亲代DNA链上,只是重组修复后合成的DNA分子是不带有损伤的,但经多次复制后,损伤就被“冲淡”了,在子代细胞中只有一个细胞是带有损伤DNA的。
(四)SOS修复
“SOS”是国际上通用的紧急呼救信号。SOS修复是指DNA受到严重损伤、细胞处于危急状态时所诱导的一种DNA修复方式,修复结果只是能维持基因组的完整性,提高细胞的生成率,但留下的错误较多,故又称为错误倾向修复(errorprone repair),使细胞有较高的突变率。
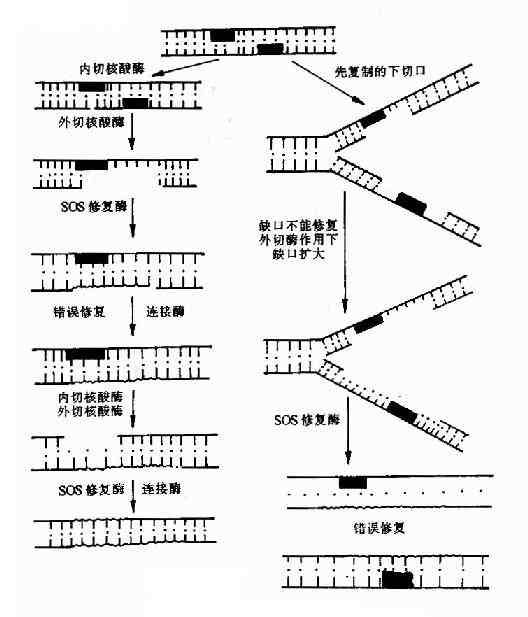
图16-23 SOS修复
如图16-23所示,当DNA两条链的损伤邻近时,损伤不能被切除修复或重组修复,这时在核酸内切酶、外切酶的作用下造成损伤处的DNA链空缺,再由损伤诱导产生的一整套的特殊DNA聚合酶桽OS修复酶类,催化空缺部位DNA的合成,这时补上去的核苷酸几乎是随机的,但仍然保持了DNA双链的完整性,使细胞得以生存。但这种修复带给细胞很高的突变率。
应该说目前对真核细胞的DNA修复的反应类型、参与修复的酶类和修复机制了解还不多,但DNA损伤修复与突变、寿命、衰老、肿瘤发生、辐射效应、某些毒物的作用都有密切的关系。人类遗传性疾病已发现4000多种,其中不少与DNA修复缺陷有关,这些DNA修复缺陷的细胞表现出对辐射和致癌剂的敏感性增加。例如着色性干皮病(xerodermapigmentosum)就是第一个发现的DNA修复缺陷性遗传病,患者皮肤和眼睛对太阳光特别是紫外线十分敏感,身体暴光部位的皮肤干燥脱屑、色素沉着、容易发生溃疡、皮肤癌发病率高,常伴有神经系统障碍,智力低下等,病人的细胞对嘧啶二聚体和烷基化的清除能力降低。
小结
环境和生物体内的因素都经常会使DNA的结构发生改变。DNA的复制会发生碱基的配对错误;体内DNA会有自发性结构变化,包括DNA链上的碱基异构互变、脱氨基、碱基修饰、DNA链上的碱基脱落等。外界射线的照射等物理因素,烷化剂、碱基类似物、修饰剂等化学因素都能损伤DNA的结构,变化包括有相邻嘧啶共价二聚体的形成、碱基、脱氧核糖和磷酸基团的烷基化和其它修饰、碱基脱落、DNA单链断裂、双链断裂、DNA链内交联、链间交联、DNA与周围的蛋白质交连等。最后能导致DNA的点突变、DNA核苷酸的缺失、插入或转位、DNA链的断裂等,结果可能影响生物细胞的功能和遗传特性,这些改变可能会导致细胞死亡、也有机会使细胞获得新的功能或进化,也可能细胞只有DNA结构的遗传性改变而没有表型变化,视DNA结构变化的部位、类型和范围不同而异。
生物在进化过程中获得的DNA修复功能,对生物的生存和维持遗传的稳定性是至关重要的。对有些DNA的损伤,细胞能将其完全修复到原样,如可将嘧啶二聚体切开、DNA单链断裂可重新连接、碱基缺失可再配对插入、加成的烷基可以移除、一条链上的碱基或核苷酸的错误可以切除并依赖互补链作模板而复制重新修复等。对DNA较严重的损伤,细胞可采取重组修复、SOS修复等方式进行反应,以期提高细胞的存活率,但不能完全消除DNA的损伤,会带给细胞较高的突变率。
DNA的损伤和修复与遗传、突变、寿命、衰老、辐射效应、肿瘤发生、某些毒剂的作用、以及某些遗传性疾病等有密切的关系。目前对DNA损伤修复的认识还不透彻。
复习思考题
1.为什么说细胞对DNA损伤的修复能力对细胞的生存是至关重要的?
2.体内那些因素会导致DNA结构的变化?细胞能采取那些办法保持DNA结构的稳定性?
3.那些环境因素容易损伤生物体内的DNA?损伤有那些方式和类型?结果对生物细胞会有些什么影响?
4.现在所知生物细胞对DNA损伤修复有那些方式?修复反应的结果会如何?
第十七章 RNA的生物合成(TheBiosynthesis of RNA)
执行生命功能、表现生命特征的主要物质是蛋白质分子。DNA贮存着决定生物特征的遗传信息,只有通过蛋白质才能表达出它的生命意义,直接决定蛋白质合成及蛋白质特征的不是RNA而是DNA,因而人们确定DNA是遗传信息贮存者后就推测DNA是通过RNA去决定蛋白质合成的。50年代末RNA聚合酶的发现开始证实了这一推测。
以DNA为模板合成RNA的过程称为转录(transcription)。转录是生物界RNA合成的主要方式,是遗传信息朋DNA向RNA传递过程,也是基因表达的开始(图17-1)。转录也是一种酶促的核苷酸聚合过程,所需的酶叫做依赖DNA的RNA聚合酶(DNA-dependentRNA polynerase ,DDRP)。转录产生初级转录物为RNA前体(RNa precursor),它们必须经过加工过程变为成熟的RNA,才能表现其生物活性。
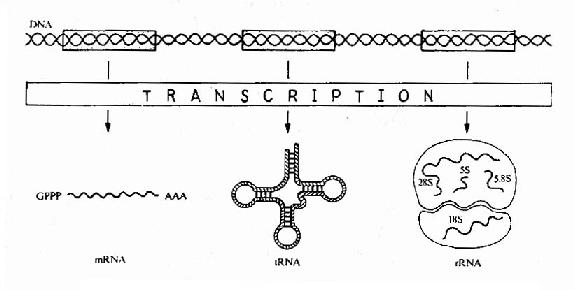
图17-1 Expression of genetic information bytranscription.[Note:RNAs shown are eukaryotic.]
第一节 转录作用
RNA的转录合成从化学角度来讲类似于DNA的复制,多核苷酸链的合成都是以5’→3’的方向,在3’-OH末端与加入的核苷酸磷酸二酯键,但是,由于复制和转录的目的不同,转录又具有其特点:(1)对于一个基因组来说,转录只发生在一部分基因,而且每个基因的转录都受到相对独立的控制(图17-2);(2)转录是不对称的。(3)转录时不需要引物,而且RNA链的合成是连续的。
一、依赖DNA的RNA聚合酶
真核和原核细胞内都存在有DDRP,迄今发现的DDRP的有以下特点:①以DNA为模板;在DNA的两条多苷酸链中只有其中一条链作为模板,这条链叫做模板链(templatestrand),又叫做无意义链。DNA双链中另一条不做为模板的链叫做编码链,又叫做有意义链,编码链的的序列与转录本RNA的序列相同,只是在编码链上的T在转录本RNA为U,由于RNA的转录合成是以DNA的一条链为模板而进行的,所以这种转录方式又叫做不对称转录。②都以四种三磷酸核苷的底物,原料;③都遵循DNA与RNA之间的碱基配对原由,A=U,T=A,C=G,合成与模板DNA序列互补的RNA链。④RNA链的延长方向是5’→3’的连续合成。⑤需要Mg2+或Mn2+离子。⑥并不需要引物。RNA聚合酶缺乏3’→5’外切酶活性,所以没有校正功能。
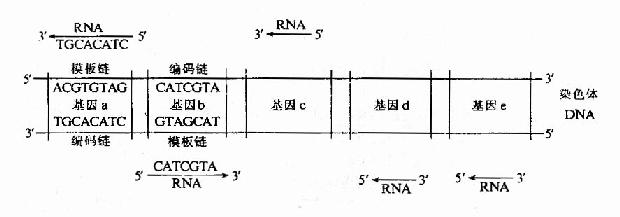
图17-2 细菌染色体上几个基因转录的方向及所用模板
RNA聚合酶催化下列反应:
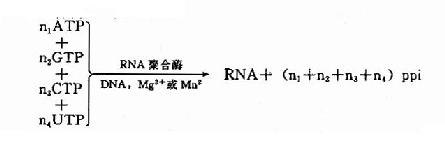
大肠杆菌RNA聚合酶的研究得比较透彻的,这是一个分子量达50多万,全酶由五咱亚基组成,去掉δ亚基的部分称为核心酶,核心酶本身就能催化苷酸间磷酸二酸键形成。利福平和利福霉素能结合在β亚基上而对此酶发生强烈的抑制作用。β亚基似乎是酶和核苷酸底物结合的部位。细胞内转录是在DNA特定的起始点上开始的,δ亚基的功能是辨认转录起始点的。β’亚基是酶与DNA模板结合的主要成分。α亚基可能与转录基因的类型和种类有关。
表17-1 大肠杆菌RNA聚合酶
| 亚单位 | 分子量 | 亚单位数目 | 功能 |
| α β β δ |
36512 150618 155613 70263 |
2 1 1 1 |
决定哪此基因被转录 与转录全过程有关 结合DNA模板 辨认起始点 |
真核生物中已发现有四种RNA聚合酶,分别称为RNA聚合酶Ⅰ、Ⅱ、Ⅲ和线粒体RNA聚合酶,分子量大致都在50万道尔顿左右,它们专一性地转录不同的基因,因此由它们催化的转录产物也各不相同。RNA聚Ⅰ合成RNA的活性最显著,它位于核仁中,负责转录编码rRNA的基因。而细胞内绝大部分RNA是rRNA是RNA。RNA聚合酶Ⅱ,位于核质中,负责核内不匀一RNA的合成,而hnRNA是mRNA的前体。RNA聚合酶Ⅲ负责合成tRNA和许多小的核内RNAs。鹅膏蕈碱是真核生物RNA聚合酶特异性抑制剂,三种真核生物RNA聚合酶对鹅膏蕈碱的反应不同,见表17-2,原核生物靠RNA聚合酶就可完成从起始、延长、终止的转录全过程,真核生物转录除RNA聚合酶外还需另一此叫做转录因子的蛋白质分子参与转录的全过程,见后叙。
表17-2 真核生物的RNA聚合酶
| 种类 | 分布 | 合成的RNA类型 | 对α-鹅膏蕈碱的敏感性 |
| Ⅰ Ⅱ Ⅲ Mt |
核仁 核质 核质 线粒体 |
rRNa hnRNA tRNA,5sRNA 线粒体RNAs |
不敏感 低浓度敏感 高浓度敏感 不敏感 |
二、RNA的转录过程
转录的主要过程见图17-3,为研究和叙述方便,可将RNA合成分为识别与起始、延长和终止三个阶段。
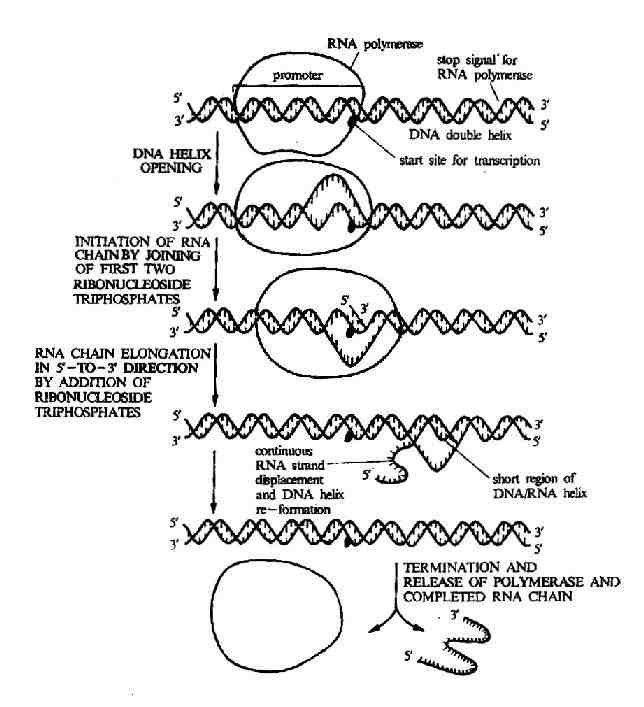
图17-3 转录的主要过程
(一)识别
转录是从DNA分子的特定部位开始的,这个部位也是RNA聚合酶全酶结合的部信这就是启动子。为什么RNA聚合酶能够仅在启动子处结合呢?显然启动子处的核苷酸序列具有特殊性,为了方便,人们将在DNA上开始转录的第一个碱基定为+1,沿转录方向顺流而下的核苷酸序列均用正值表示;逆流而上的核苷酸序列均用负值表示。
对原核行物的100多个启动子的序列进行了比较后发现;在RNA转录起始点上游大约-10bp和-35bp处有两个保守的序列,在-10bp附近,有一组5’-TATAATpu的序列,这是Pribnow首先发现的称为Pribnow框,RNA聚合酶就结合在互部位上。-35bp附近,有一组5’-TTGACG-的序列;已被证实与转录起始的辨认有关,是RNA聚合酶中的δ亚基识别并结合的位置。-35序列的重要性还在于在很大程度上决定了启动子的强度。
由于RNA聚合酶分子很大,大约能覆盖70bp的DNA序列,因此酶分子上的一个适合部位就能占据从-35到-10序列区域(图17-4)。
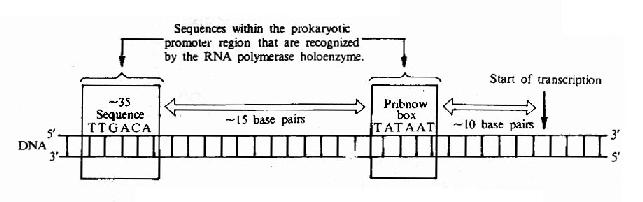
图17-4 Structure of the prokaryotic promoter region.
真核生物的启动子有其特殊性,真核生物有三种RNA聚合酶,每一咱都有自己的启动子类型。以RNA聚合酶Ⅱ的启动子结构为例,人们比较了上百个真核生物RNA聚合酶Ⅱ的启动子核苷酸序列伯发现;在-25区有TATA框,又称为Hogness框或Goldberg-Hogness框。其一致序列为T28A97A93A85A63T37A83A50T37,基本上都由A,T碱基所组成,离体转录实验表明,TATA框决定了转录起点的选择,天然缺少TATA框的基本可以从一个以上的位点开始转录。在-75区有CAAT框,其一致的序列为GGTCAATCT。有实验表明CAAT框与转录起始频率有关,例如缺失GG,兔子的β珠蛋白基因转录效率只有原来的12%(图17-5)。
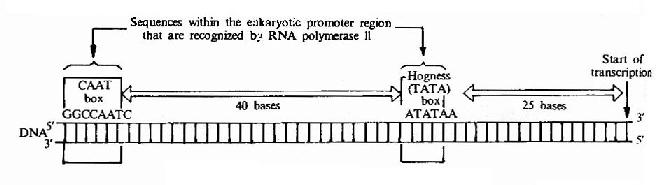
图17-5 Eukaryotic gene promoter sequences
除启动子外,真核生物转录起始点上游处还有一个称为增强子的序列,它能极大地增强启动子的活性,它的位置往往不固定,可存在于启动子上游或下游,对启动子来说它们正向排列和反向排列均有效,对异源的基因也起到增强作用,但许多实验证实它仍可能具有组织特异性,例如免疫球蛋白基因的增强子只有在B淋巴细胞内活性最高,胰岛素基因和胰凝乳蛋白酶基因的增哟子也都有很高的组织的特异性。
(二)转录起始和延伸
在原核生物中,当RNA聚合酶的δ亚基发现其识别位点时,全酶就与启动子的-35区序列结合形成一个封闭的启动子复合物。由于全酶分子较大,其另一端可在到-10区的序列,在某种作用下,整个酶分子向-10序列转移并与之牢固结合,在此处发生局部DNA12-17r 的解链形成全酶和启动子的开放性复合物。在开放性启动子复合物中起始位点和延长位点被相应的核苷酸前体充满,在RNA聚合酶β亚基催化下形成RNA的第一个磷酸二酸键。RNA合成的第一个核苷酸总有GTP或ATP,以GTP常见,此时δ因子从全酶解离下来,靠核心酶在DNA链上向下游滑动,而脱落的δ因子与另一个核心酶结合成全酶反复利用。
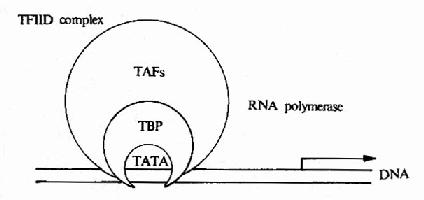
图17-6 转当起始复合物的模式
真核生物转录起始十分复杂,往往需要多种蛋白因子的协助,已经知道,在所有的细胞中有一类叫做转录因子的蛋白质分子,它们与RNA聚合酶Ⅱ形成转录起始复合物,共同参与转录起始的过程。
真核生物基因中,有专门为蛋白质编码的基因,这些基因由RNA聚合酶Ⅱ负责进行转录起始关键性作用。根据这些转录因子的作用特点可大致分为二类;第一类为普遍转录因子它们与RNA聚合酶Ⅱ共同组成转录起始复合物,转录才能在正确的位置上开始。普遍转录因子是由多种蛋白质分子组成的,其中包括特异结合在TATA盒上的蛋白质,叫做TATA盒结合蛋白,还有至成一组复合物叫做转录因子ⅡD。TFⅡD再与RNA聚合酶Ⅱ结合完成转录起始复合物的形成。(图17-6)
除TFⅡD以外,在细胞核提取物中还发现TFⅡA,TFⅡF,TFⅡE,TFⅡH等,它们在转录起始复合物组装的不同阶段起作用,像TFⅡH就有旋转酶活性,它可利用ATP分解产生的能量,介导起始点双螺旋的打开,使RNA聚合酶得以发挥作用。从中也不难看出真核细胞中基因转录的起始是基因的表达调控的关键,这么多蛋白质分子之间相互作用,以及这些蛋白质分子DNA调控无件相结合,构成控制基因转录开始的复杂体系。
第二类转录因子为组织细胞特异性转录因子或者叫可诱导性转录因子,这此TF是在特异的组织细胞或是受到一些类固醇激素,生长因子或其它刺激后,开始表达某些特异蛋白质分子时,才需要的一类转录因子。
例如:激活剂蛋白-1就是一类可诱导的转录因子,它是由多蛋白质成份组成的复合物,可发由fos基因和jun基因家庭的蛋白质产物组成。当某些生长因子细胞因子和某些化学物质在细胞外刺激这些细胞时,使细胞内JUN蛋白和FOS蛋白发生磷酸化,特异地结合到c-jun基因和c-fos基因的启动子部位,使这些基因转录并翻译出相应的c-JUN蛋白和c-FOS蛋白,这些蛋白质就可组成二聚体的AP-1,AP-1就会结合到细胞核中靶基因的调控部位,促进或激活靶基因的转录活性,产生出由于细胞外刺激因素作用下,这些细胞做出的特异反应一表达出的特异蛋白须分子。有关详细内容见信号转录一章。
RNA链的延长靠核心酶的催化,在起始复合物上第一个GTP的核糖3’-OH上与DNA模板能配对的第二个三磷酸核苷起反应形成磷酸二酯键。聚合进去的核苷酸又有核糖3’-OH游离,这样就可按模板DNA的指引,一个接一个地延长下去。因此RNA链的合成方面也是5’--3。由于DNA链与合成的RNA链具有反平行关系,所以RNA聚合酶是沿着DNA链3’--5’方向移动。整个转录过程是由同一个RNA聚合酶来完成的一个连续下断的反应,转录本RNA生成后,暂时与DNA模板链形成DNA·RNA杂交体,长度约为12个碱基对,形成一个转录泡(图17-7)。转录速度大允是每秒钟30-50个核苷酸,但并不是以恒定速度进行的。在电子显微镜下观察转录现象,可以看到同一DNA模板上,有长短不一的新合成的RNA链散开成羽毛状图形,这说明在同一DNA基因上可以有很鑫的RNA聚合酶在同时催化转录,生成相应的RNA链。而且较长的RNA链上已看到核糖体附着,形成多聚核糖体。说明某些情况下,转录过程未完全终止,即已开始进行翻译。
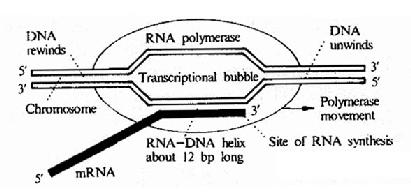
图17-7 Diagrammatic representation of DNA transcription by E.coli RNApolymerase.The polymerase unwinds a stretch of DNA about 17base pairs in lengthforming a transcriptional bubble thatprogresses along thd DNA.The DNA has tounwind ahead of the polymerase and rewind behind it .The newly formed RNA formsa RNA-DNA double helix about 12 bae pairs long.
转录的延长阶段,原核生物与真核生物之间没有太大差别。
(三)转录的终止(Termination)
转录是在DNA模板某一位置上停止的,人们比较了若干原核生物RNA转录终止位点附近的DNA序列,发现DNA模板上的转录终止信号有两种情况,一类是不依赖于蛋白质因子而实现的终止作用,另一类是依赖蛋白质辅因子才能实现终止作用,这种蛋白质辅因子称为释放因子,通常又称ρ因子。两类终止信号有共同的序列特征,在转录终止之前有一段回文结构,回文序列是一段方向相反,碱基互补的序列,在这段互补序列之间由几个碱基隔开,不依赖ρ因子的终止序列中富含G·C碱基对,其下游6-8个A;而依赖ρ因子的终止序列中G·C碱基对含量较少,其少游也没有因固定的特征,其转录生成的RNA可形成二级结构即柄一噜噗结构,又称发夹结构,这样的二级结构可能与RNA聚合酶某种特定的空间结构相嵌合,阻碍了RNA聚合酶进一步发挥作用(图17-8)。除DNA模板本身的终止信号外,在入噬菌体中,发现一些蛋白质有协助RNA聚合酶跨越终止部位的作用,叫做抗转录终止蛋白,例如入噬菌体的N基因产物。
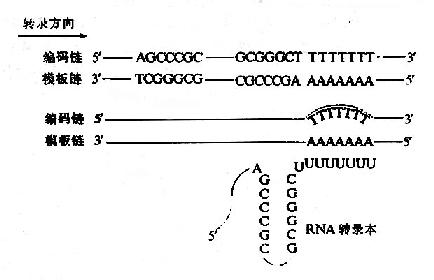
图17-8 原核生物转录作用的终止信号
真核生物由于RNA转录后很快就进行了加工,因此很难确定原初转录物的3’末端。病毒SV40的终止位点经过研究发现,很像大肠杆菌的不依赖ρ因子的终止子,转录后的RNA可形成一个发夹结构,3’末端带有一连串的U。爪蟾5sRNA的3’末端有4个U,它们前后的序列为富含G·C的序列,这是所有真核生物RNA聚合酶Ⅲ转录的终止信号。这种序列特征高度保守,从酵母到人都很相似,任何改变这种序列特征的突变都将导致转录终止位置的改变。
第二节 RNA转录后的加工与修饰
不论原核或真核生物的rRNAs都是以更为复杂的初级转录本形式被合成的,然后再加工成为成熟的RNA分子。然而绝大多数原核生物转录和翻译是同时进行的,随着mRNA开始的DNA上合成,核蛋白体即附着在mRNA上并以其为模板进行蛋白质的合成,因此原核细胞的mRNA并无特殊的转录后加工过程,相反,真核生物转录和翻译在时间和空间上是分天的,刚转录出来的mRNA是分子很大的前体,即核内不均一RNA。hnRNA分子中大约只有10%的部分转变成成熟的mRNA,其余部分将在转录后的加工过程中被降解掉。
(一)mRNA的加工修饰
原核生物中转录生成的mRNA为多顺反子,即几个结构基因,利用共同的启动子和共同终止信号经转录生成一条mRNA,所以此mRNA分子编码几种不同的蛋白质。例如乳糖操纵子上的Z、Y及A基因,转录生成的mRNA可翻译生成三种酶,即半乳糖苷酶,透过酶和乙酰基转移酶。原核生物中没有核模,所以转录与翻译是连续进行的,往往转录还未完成,翻译已经开始了,因此原核生物中转录生成的mRNA没有特殊的转录后加工修饰过程。
真核生物转录生成的mRNA为单顺反子,即一个mRNA分子只为一种蛋白质分子编码。
真核生物mRNA的加工修饰,主要包括对5’端和3’端的修饰以及对中间部分进行剪接。
1.在5’端加帽
成熟的真核生物mRNA,其结构的5’端都有一个m7G-PPNmN结构,该结构被称为甲基鸟苷的帽子。如图17-9所示。鸟苷通过5’-5’焦磷酸键与初级转录物的5’端相连。当鸟苷上第7位碳原子被甲基化形成m7G-PPNmN时,此时形成的帽子被称为“帽0”,如果附m7G-PPNmN外,这个核糖的第“2”号碳上也甲基化,形成m7G-PPNm,称为“帽1”,如果5’末端N1和N2中的两个核糖均甲基化,成为m7G-PPNmPNm2,称为“帽2”。从真核生物帽子结构形成的复杂可以看出,生物进化程度越高,其帽子结构越复杂。
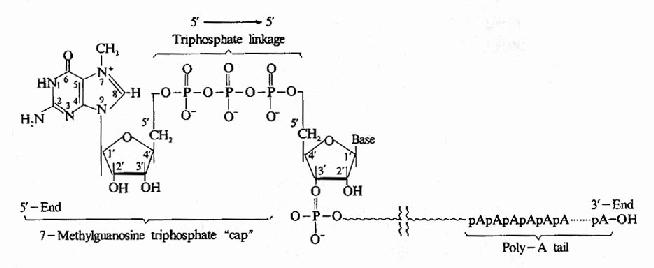
图17-9 Post-transcriptional modification of mRNa showing the7-methylguanosine cap and poly-A tail.
真核生物mRNA 5’端帽子结构的重要性在于它是mRNa 做为翻译起始的必要的结构,对核糖体对mRNA的识别提供了信号,这种帽子结构还可能增加mRNA的稳定性,保护mRNa 免遭5’外切核酸酶的攻击。
2.在3’端加尾
大多数的真核mRNA 都有3’端的多聚尾巴(A),多聚(A)尾巴大约为200bp。
多聚(A)屠巴不是由DNA编码的,而是转录后在核内加上去的。受polyA聚合酶催化,该酶能识别,mRNa 的游离3’-OH端,并加上约200个A残基。

近年来已知,在大多数真核基因的3’一端有一个AATAA序列,这个序列是mRNa 3’-端加polyA尾的信号。靠核酸酶在此信号下游10-15碱基外切断磷酸二酯键,在polyA聚合酶催化下,在3’-OH上逐一引入100-200个A碱基。关于polyA尾巴的功能问题尽管经过极其广泛的探索,但还不完全清楚。有人推测polyA可能与mRNA从细胞核转送到细胞质有关,但是相当数量,的没有polyA屠巴的mRNA如组蛋白mRNA,也照样通过核膜进入细胞质。还有人认为这种结构对真核mRNA的翻译效率具有某种作用,并能稳定mRNA结构,保持一定的生物半衰期。
3.mRNA前体(hnRNA)的拼接
原核生物的结构基因是连续编码序列,而真核生物基因往往是断裂基因,即编码一个蛋白质分子的核苷酸序列被多个插入片断所隔开,一个真核生物结构基因中内含子的数量,往往与这个基因的大小有关,例如胰岛素是一个很小的蛋白质,它结构基因只有两个内含子,而有些很大的蛋白质,它的结构基因中可以有几十个内含子。经过复杂的过程后,切去内元,将有编码意义的核苷酸片段(Extron外元也叫外显子)连接起来(图17-10)。
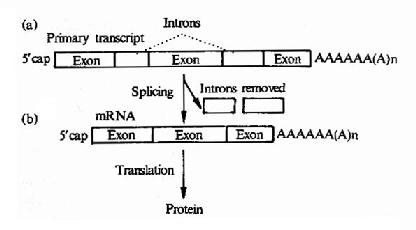
图17-10 Primary polymerase 11transcript of a eukaryote gene showing(a)introns after capping and addition of polyA tail.(b)Excision of introns toform the mature mRNA is called splicing.
真核生物的结构的基因中具有可表达活性的外显子,也含有无表达活性的内含子,但内含子序列下是无意义的,越来越多的实验证明有许多基因中的内含子参与基因表达调控,在转录时,外显子及内含子均转录到hnRNA中。在细胞核中hnRNA进行剪接作用,首先在核酸内切酶作用下剪切掉内含子;然后在连接酶作用下,将外显子各部分连接起来,而变为成熟的mRNA,这就是剪接作用,也有少数基因的hnRNA不需进行剪接作用,例如α-干扰素基因,图17-11以卵清蛋白基因为例,介绍一个典型的转录及加工过程。
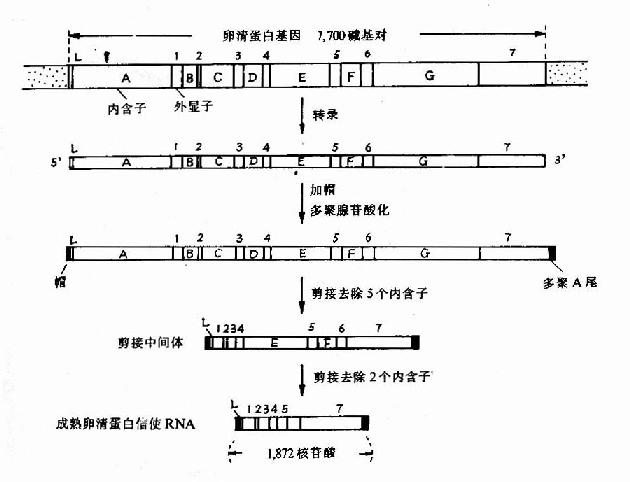
图17-11 卵清蛋白基因转录及加工过程
图中外显示以1、2、3、4……表示,内含子以A、B、C、D…表示
mRNA的拼接,需要在拼接部位有供拼接识别的保守性强的一致顺序,通过对100多种真核细胞基因的分析,发现外元和内元拼接部位部分碱基顺序有一定的规律(见表17-4)。
表17-4 含有内元的转录产物其拼接处的碱基顺序
| 基因区域 | Exon | Intron | Exon |
| 卵清蛋白内元2 | UAAG GUGA | ~~~~~~~ | ACAGGUUG |
| 卵清蛋白内元3 | UCAG GUAC | ~~~~~~~ | UCAGUCUG |
| β-珠蛋白内元1 | GCAG GUUG | ~~~~~~~ | UCAGGCUG |
| β-珠蛋白内元2 | CAGG GUGA | ~~~~~~~ | ACAGUCUC |
| Igλ内含子1 | UCAG GUCA | ~~~~~~~ | GCAGGGGC |
| SV40病毒早期T抗原 | UAAG GUAA | ~~~~~~~ | UUAGAUUC |
表中划线的碱基对拼接识别有重要作用,如将兔的β-珠蛋白的拼接部位的GT改为AT后,拼接反应即受到影响。
mRNA前体拼机制
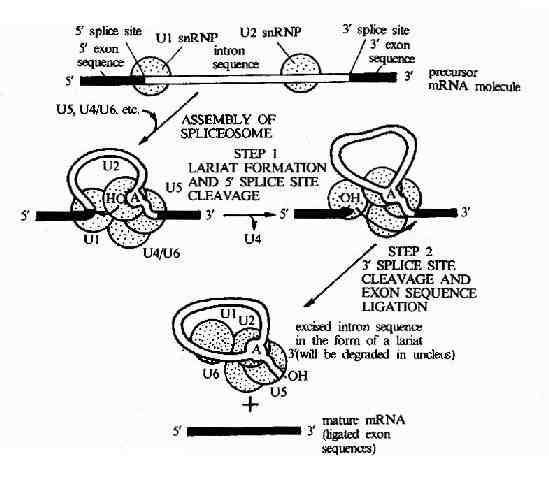
图17-12 The RNA splicing mechanism.RNA splicing is catalyzed by aspliceosome formed from the assembly of U1,U2,U5,and sn RNPs(shown as greencircles )plus other components (not shown).After assembly of the spliceosome,the reaction occures in two speps:in step 1the branch-point A nucleotide inthe intron sequence,which is located colse to the 3'splice site ,attacks the5'splice site and cleaves it;the cut 5'end of the intron sequence therebybecomes covalently linked to this A nucleotide,forming the branched nucleotideshown in Figure 8-55.In step 2 the 3'-OH end of the first exon sequence,whichwas created in the first step,adds to the beginning of the second exonsequence,cleqving the RNA molecule at the 3'splice site;the two exon sequencesare thereby joined to each other and the intron sequence is released ad aribosone.These splicing reactions occur im the nucleus and gengerate mRNamolecules from primary RNA transcripts (mRNA precursor molecules).
mRNA拼接反应需要有核内小分子RNA参与它们与蛋白质形成的复合物称为小核糖核蛋白颗粒,SnRNA分别被命名为U1,U2,U3,U4,U5,和U6RNA。SnRNA中的U2RNA由与内元右端拼接部位附近的UACUAA顺序高度互补,形成一个环状结构,由特定的酶来识别切除该环状结构,完成拼接过程,如图17-12所示。
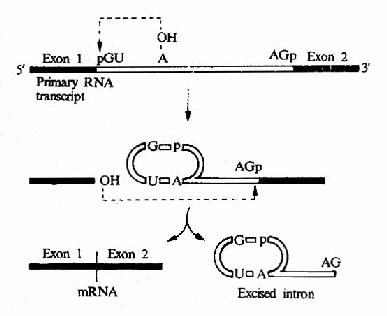
图17-13 Mechanim of mRNa splicing.Note that,for clarity,the process is shownin two stages;energy is not required for the process since transesterificationreactions are involved.
真核生物 mRNA前体在剪接过程中,还可以形成套索样的结构,在内含子序列中常有一个分支部位的腺苷酸残基,它的2’-OH可以自动攻击内含子5’端与外显子1连接的磷酸二酯键,切开了外噗子1,而腺苷酸原来已有3’,5’--磷酸二酯键相连的两个相邻的核苷酸残基,加上此3’,5’-磷酸二酯键连接后,在腺苷酸处出现了一个套索,已被切下的外显子1的3’-OH攻击内含子3’末端与外显子2之间的3’,5’-磷酸二酯键,键断裂后,内含子以套索的形式被节下来,此时外显子1和外显子2可以连接起来(图17-13)。
不论拼接过程如何,拼接必须极为精确,否则会导致遗传信息传递障碍,合成的蛋白质可能丧失其正常的功能。我国南方广大地区是β-地中海贫血的高发区,这是由于β-珠蛋白链的合成受到部分或完全抑制所引起的一种血红蛋白病。实验表明β-珠蛋白基因元1中核苷酸的点突变改变了正常拼接部位的碱基顺序,结果造成错误部位的拼接。加工成熟的mRNA虽能翻译,但产物不是正常的β-珠蛋白,结果引起血红蛋白级结构和功能的改变。
(二)rRNA转录后加工
原核生物rRNA转录后加工,包括以下几方面:①rRNA前体被大肠杆菌RNaseⅢ,RNaseE等剪切成一定链长的rRNA分子;②rRNA在修饰酶催化下进行碱基修饰;③rRNA与蛋白质结合形成核糖体的大、小亚基(见图17-14)
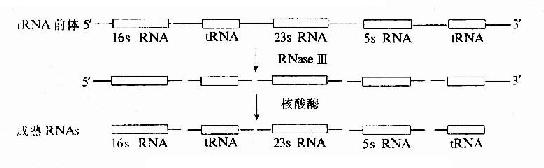
图17-14 大肠杆菌rRNA前体的加工
真核生物rRNA前体比原核生物大,哺乳动物的初级转录产物为45s,低等真核生物的rRNA前体为38s,真核生物5sRNA前体独立于其他三种rRNA的基因转录(图17-15)。
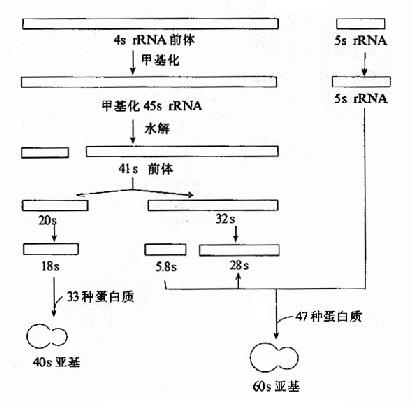
图17-15 真核生物rRNA前体的加工
真核生物rRNA前体中含有插入顺序,rRNA前体要形成成熟的rRNA,需要经过拼接反应。例如,四膜虫的rRNA前体的拼接是一种无酶催化的自动拼接过程。四膜虫基因组内,26srRNA编码的区域内有413bp的插入顺序。该插放序列可以不消耗能量从rRNA前体中被除掉。用SDS煮沸和用蛋白酶外理等破坏酶活性办法,都不能破坏拼接活性,但反应中Mg2+和鸟嘌呤核苷酸是必在的。用32P-GTP进行追踪实验表明,起始过程是GTP在插入顺序5’端发生亲核反应,同时GMP与5’端切点的切除段形成磷酸二酯键并使原RNA断开。第二步是5’切点的外元3’-OH与3’切点的外元5’-P共价连接,获得成熟的rRNA,被切除部分最后环化,形成一个环状结构,同时从5’端去掉一个15核苷酸啐片。剩余部分连接成399核苷酸的环状产物,再经过几步,最后切下一个19个核苷酸的线性内含子序列即L-19,它具有催化活性,上面的剪接作用,是由内含子本身的催化性质决定的(图17-16)。
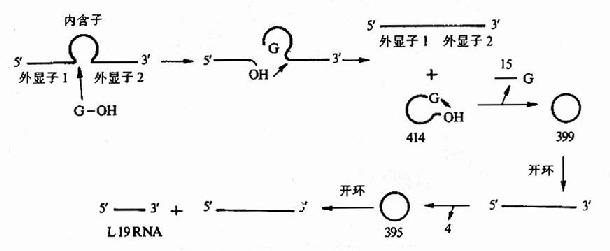
图17-16 四膜虫rRNA前体的自我剪接
这种rRNA的自身剪接反应给人们一个提示:即RNA分子也有酶的催化活性。这向酶的化学本质是蛋白质这一传统概念提出了挑战。这种有酶催化活性的RNA分子命名为Ribozyme。T.Cech和S.Altman各自分别发现RNA具有催化作用,他们的发现对于了解生命进行过程有重要意义。很可能在原始生命中,RNA所催化的断裂一连接反应是最早出现的催化过程。为此,他们共同获得了1989年Nobel化学奖。
从大多数Ribozymw的结构中发现一些特征,例如:锤头状结构的RNA分子有13个保守的核苷酸序列,如果它们中的碱基改变会使这种催化活性失去作用。根据这种特片,科学家们在体外没计并人工合成这种RNA分子,用于抗肿瘤及抗病毒的实验中(图17-17)。
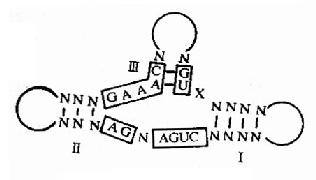
图17-17 锤头结构模式图
(三)tRNA转录后的加工修饰
原核生物和真核生物刚转录生成的tRNA前体一般无生物活性,需要进行①剪切和拼接②碱基修饰③3’-OH连接-ACC结构(图17-18)。
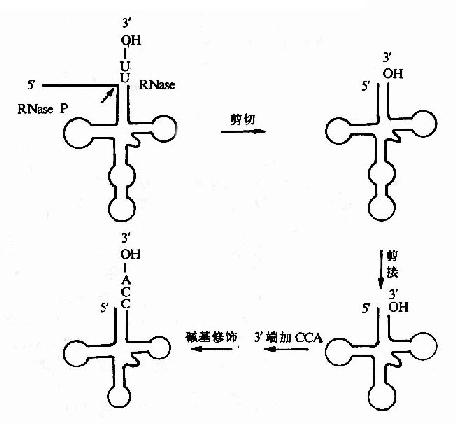
图17-18 tRNA前体的加工
①tRNA前体在tRNA剪切酶的作用下,切成一定在小的tRNA分子。大肠杆菌RNase P可特异剪切tRNA前体的5’旁顺序,因此,该酶被称为tRNA5’成熟酶。除了RNaseP外,tRNA前体的剪切尚需要一个3’-核酸内切酶,这可将tRNA前体3’端的一段核苷酸序列切下来。此外RNaseD是tRNA3’端成熟酶。近年来的研究表明大肠杆菌RNaseP是一种非常特殊的酶分子,它是由RNA和蛋白质组成,最近发现RNAaseP分子中的RNA部分在某些条件下,可以单独地催化tRNA前体的加工成熟,这个发现和四膜虫tRNA能自我拼接被认为是近十年来生化领域内最令人鼓舞的发现之一。说明RNA分子确具有酶的催化活性。经过剪切后的tRNA分子还要在拼接酶作用下,将成熟tRNA分子所需的片段拼起来。
②成熟的tRNA分子中有许多的稀有碱基,因此tRNA在甲基转移酶催化下,某些嘌呤生成甲基嘌呤如A→mA,G→mA。有些尿嘧啶还原为双氢尿嘧啶。尿嘧啶核苷转变不假尿嘧啶核苷。某些腺苷酸脱氨基为成为次黄嘌呤核苷酸(Ⅰ)
③3’末端加上CCA:在核苷酸转移酶作用下,3’--末端除去个别碱基后,换上tRNA分子统一的CCA-OH末端,完成tRNA分子中的氨基酸臂结构。
第四节 RNA的复制
以DNA为模板合成RNA是生物界RNA合成的主要方式,但有些生物像某些病毒,噬菌体它们的遗传信息贮存在RNA分子中,当它们进入宿细胞后,靠复制而传代,它们在RNA指导的RNA聚合酶催化下合成RNA分子,当以RNA模板时,在RNA复制酶作用下,按5'→3'方向合成互补的RNA分子,但RNA复制酶中缺乏校正功能,因此RNA复制时错误率很高,这与反转录酶的特点相似.RNA复制酶只对病毒本身的RNA起作用,而不会作用于宿主细胞中的RNA分子。
小结
转录是以DNA为模板合成RNA的过程,经过转录DNA分子中的贮存信息传递到RNA分子中,再由mRNA做为模板合成蛋白质分子,转录也是从DNA的一个特定位置开始的,以DNA分子中的一条链为模板,在RNA聚合酶作用下,以四种单核苷酸为原料,合成方向仍是5'→3',完成RNA的合成.
大肠杆菌的RNA聚合酶由五个亚基构成,α2ββ'构成核心酶,再加上σ因子是全酶。RNA聚合酶识别并特异结合的DNA一段区域叫做启动子,启动子的序列中一10区和一35区很保守,决定了启动子的强度是转录正确起点的关键,真核生物中位于--20的TATA盒和--70--110区域的元件是控制真核生物RNA的转录的关键。真核生物的RNA聚合酶有Ⅰ、Ⅱ、ⅢTMtn几种,它们分别催化rRNA、mRNAt、tRNa Usn RNA、tRNA、以及线粒体RNA的合成。转录作用停止于DNA模板的终止信号,蛋白质ρ因子可识别此信号,终止区常常转录出一段反向重复序列。
转录生成的RNA分子为前体RNA,必须经过必在的加工修饰,才能成为有功能的RNA分子,但真核生物的RNA转录后加工修饰比原生物复杂的多。原核生物转录生成的mRNA属于多顺反子形式,由于原核生物没有核膜,转录与翻译的过程没有明显的屏障。而真核生物转录生成的mRNA为单顺反子,而且具有复杂的转录加工修饰,包括5’端加幅,3’端加尾,剪切内含子,连接外显子等等,人们在研究rRNA前体的加工过程中发现了具有催化作用的RNA分子,称为酶RNA,从而打破了酶的本质是蛋白质的传统观念。
思考题
1、RNA转录有哪此特点?
2、RNA聚合酶的组成及其作用?
3、原核生物与真核生的中的启动子结构特点及功能
4、真核生物mRNA转录后加工包括哪些内容?
5、什么是酶RNA,它们的发现有何意义?
第十八章 蛋白质的生物合成(The Biosynthesis of protein)
蛋白质分子是由许多氨基酸组成的,在不同的蛋白质分子中,氨基酸有着特定的排列顺序,这种特定的排列顺序不是随机的,而是严格按照蛋白质的编码基因中的碱基排列顺序决定的。基因的遗传信息在转录过程中从DNA转移到mRNA,再由mRNA将这种遗传信息表达为蛋白质中氨基酸顺序的过程叫做翻译。翻译的过程也就是蛋白质分子生物合成的过程,在此过程中需要200多种生物大分子参加,其中包括核糖体、mRNA、tRNA及多种蛋白质因子。翻译基本过程如图18-1。
图18-1 翻译过程的基本原理
第一节 参与蛋白质生物合成的物质
(一)合成原料
自然界由mRNA编码的氨基酸共有20种,只有这些氨基酸能够作为蛋白质生物合成的直接原料。某些蛋白质分子还含有羟脯氨酸、羟赖氨酸、γ-羧基谷氨酸等,这些特殊氨基酸是在肽链合成后的加工修饰过程中形成的。
(二)mRNA是合成蛋白质的直接模板
原核细胞中每种mRNA分子常带有多个功能相关蛋白质的编码信息,以一种多顺反子的形式排列,在翻译过程中可同时合成几种蛋白质,而真核细胞中,每种mRNA一般只带有一种蛋白质编码信息,是单顺反子的形式。mRNA以它分子中的核苷酸排列顺序携带从DNA传递来的遗传信息,作为蛋白质生物合成的直接模板,决定蛋白质分子中的氨基酸排列顺序。不同的蛋白质有各自不同的mRNA,mRNA除含有编码区外,两端还有非编码区。非编码区对于mRNA的模板活性是必需的,特别是5’端非编码区在蛋白质合成中被认为是与核糖体结合的部位。见图18-2。
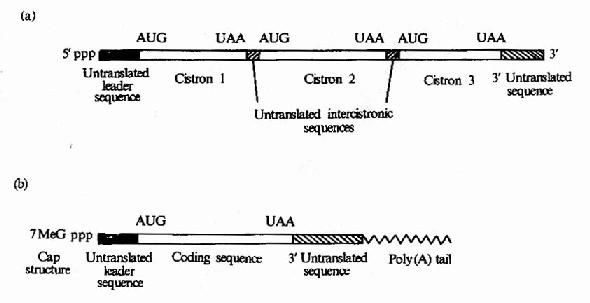
图18-2 (a)原核生物mRNA)为多顺反子(b)真核生物mRNA为单顺反子
mRNA分子上以5'→3'方向,从AUG开始每三个连续的核苷酸组成一个密码子,mRNA中的四种碱基可以组成64种密码子。这些密码不仅代表了20种氨基酸,还决定了翻译过程的起始与终止位置。每种氨基酸至少有一种密码子,最多的有6种密码子。从对遗传密码性质的推论到决定各个密码子的含义,进而全部阐明遗传密码,是科学上最杰出的成就之一,科学家们设计了十分出色的遗传学和生物化学实验,于1966年编排出了遗传密码字典。见表18-1。
表18-1 氨基酸的密码(code)
| 5’末端(第1位碱基) | 中间碱基(第二位碱基) | 3’末端(第三位碱基) | |||
| U | C | A | G | ||
| U | 苯丙(Pne)F | 丝(Ser)S | 酪(Tyr)Y | 半胱(Cys)C | U |
| 苯内(Pne) | 丝(Ser) | 酪(Tyr) | 半胱(Cys) | C | |
| 亮(Leu)L | 丝(Ser) | 终止信号 | 终止信号 | A | |
| 亮(Leu) | 丝(Ser) | 终止信号 | 色(Trp) | G | |
| C | 亮(Leu) | 脯(Pro)P | 组(His)H | 精(Arg)R | U |
| 亮(Leu) | 脯(Pro) | 组(His) | 精(Arg) | C | |
| 亮(Leu) | 脯(Pro) | 谷胺(Gin)Q | 精(Arg) | A | |
| 亮(Leu) | 脯(Pro) | 谷胺(Gin) | 精(Arg) | G | |
| A | |||||
| 异亮(ILe)I | 苏(Thr)T | 天胺(Asn)N | 丝(Ser)S | U | |
| 异亮(ILe) | 苏(Thr) | 天胺(Asn) | 丝(Ser) | C | |
| 异亮(ILe) | 苏(Thr) | 赖(Lys)K | 精(Arg)R | A | |
| *蛋(Met)M(起动信号) | 苏(Thr) | 赖(Lys) | 精(Arg) | G | |
| G | |||||
| 缬(Val)V | 丙(Ala)A | 天(Asp)D | 甘(Gly)G | U | |
| 缬(Val) | 丙(Ala) | 天(Asp) | 甘(Gly) | C | |
| 缬(Val) | 丙(Ala) | 谷(Glu)E | 甘(Gly) | A | |
| 缬(Val) | 丙(Ala) | 谷(Glu) | 甘(Gly) | G | |
*位于mRNA起动部位AUG为氨基酸合成肽链的起动信号。以哺乳动物为代表的真核生物,此密码子代表蛋氨酸;以微生物为代表的原核生物则代表甲酰蛋氨酸。
遗传密码具有以下几种特点:
(1)起始码与终止码(Initiation codon and termination codon):
密码子AUG是起始密码,代表合成肽链的第一个氨基酸的位置,它们位于mRNA5′末端,同时它也是蛋氨酸的密码子,因此原核生物和真核生物多肽链合成的第一个氨基酸都是蛋氨酸,当然少数细菌中也用GUG做为起始码。在真核生物CUG偶尔也用作起始蛋氨酸的密码。密码子UAA,UAG,UGA是肽链成的终止密码,不代表任何氨基酸,它们单独或共同存在于mRNA3’末端。因此翻译是沿着mRNA分子5′→3′方向进行的。
(2)密码无标点符号:两个密码子之间没有任何核苷酸隔天,因此从起始码AUG开始,三个碱基代有一个氨基酸,这就构成了一个连续不断的读框,直至终止码。如果在读框中间插入或缺失一个碱基就会造成移码突变,引起突变位点下游氨基排列的错误。
(3)密码的简并性(Degemeracy):
一种氨基酸有几组密码子,或者几组密码子代表一种氨基酸的现象称为密码子的简并性,这种简并性主要是由于密码子的第三个碱基发生摆动现象形成的,也就是说密码子的专一性主要由前两个碱基决定,即使第三个碱基发生突变也能翻译出正确的氨基酸,这对于保证物种的稳定性有一定意义。如:GCU,GCC,GCA,GCG都代表丙氨酸。
(4)密码的通用性:
大量的事实证明生命世界从低等到高等,都使用一套密码,也就是说遗传密码在很长的进化时期中保持不变。因此这张密码表是生物界通用的。然而,出乎人们预料的是,真核生物线粒体的密码子有许多不同于通用密码,例如人线粒体中,UGA不是终止码,而是色氨酸的密码子,AGA,AGG不是精氨酸的密码子,而是终止密码子,加上通用密码中的UAA和UAG,线粒体中共有四组终止码。内部甲硫氨酸密码子有两个,即AUG和AUA;而起始甲硫氨酸密码子有四组,即AUN。
密码子结构与氨基酸侧链析性之间也有一定关系。①氨基酸侧链极性性质在多数情况下由断面子的第二个碱基决定。第二个碱基为嘧啶(Y)时,氨基酸侧链为非极性,第二个碱基为嘌呤时,氨基酸侧链则有极性。②当第一个碱基为U或A,第二个碱基为C,第三个碱基无特异性时,所决定的氨基酸侧链为极性不带电。③当第一个碱基不是U,第二个碱基是P时,氨基酸侧链则带电。在此前提下,若是一个是C或A时,表示带正电的氨基酸,第一、二个碱基分别是G、A时,此种氨革酸带负电,但上述关系也有个别例外。
一种氨基酸由多种密码子所编码的事实使人想到:同一种氨基酸的一组密码子的使用频率是否相同?许多实验证实,在原核生物和高等真核生物中同一组密码子的使用频率是不相同的。高频密码子多出现在那些表达量高的蛋白质基因中,例如,核糖体蛋白质基因,RecA蛋白质基因等。表18-2。这种使用频率与细胞内一组tRNA中的不同tRNA含量有关。
(三)tRNA是氨基酸的运载工具:
tRNA在蛋白质生物合成过程中起关键作用。mRNA推带的遗传信息被翻译成蛋白质一级结构,但是mRNA分子与氨基酸分子之间并无直接的对应关系。这就需要经过第三者“介绍”,而tRNA分子就充当这个角色。tRNA是类小分子RNA,长度为73-94个核苷酸,tRNA分子中富含稀有碱基和修饰碱基,tRNA分子3’端均为CCA序列,氨基酸分子通过共价键与A结合,此处的结构也叫氨基酸臂。每种氨基酸都有2-6种各自特异的tRNA,它们之间的特异性是靠氨基酰tRNA合成酶来识别的。这样,携带相同氨基酸而反密码子不同的一组tRNA称为同功tRNA,它们在细胞内合成量上有多和少的差别,分别称为主要tRNA和次要tRNA。主要tRNA中反密码子识别tRNA中的高频密码子,而次要tRNA中反密码子识别mRNA中的低频密码子。每种氨基酸都只有一种氨基酰tRNA合成酶。因此细胞内有20种氨基酰tRNA合成酶。
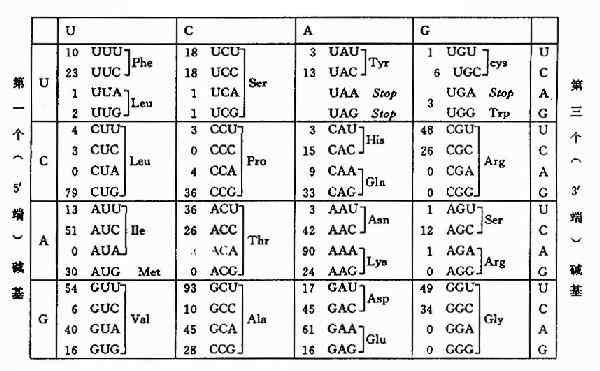
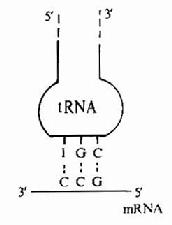
图18-3 密码子和反密码子的相互作用
tRNA分子中还有一个反密码环,此环上的三个反密码子的作用是与mRNA分子中的密码子靠碱基配对原则而形成氢键,达到相互识别的目的。但在密码子与反密码子结合时具有一定摆动性,即密码子的第3位碱基与反密码子的第1位碱基酸对时并不严格,见图18-3。配对摆动性完全是由tRNA反密码子的空间结构所决定的。反密码的第1位碱基常出现次黄嘌呤I,与A、C、U之间皆可形成氢键而结合,这是最常见的摆动现象。这种摆动现象使得一个tRNA所携带的氨基酸可排列在2-3个不同的密码子上,因此当密码子的第3位碱基发生一定程度的突变时,并不影响tRNA带入正确的氨基酸。
表18-3 反密码与密码碱基配对时的摇摆现象
| 反密码第1位碱基 | A | C | G | U | 1 |
| 密码第3位碱基 | U | G | C,U | A,G | A,C,U |
在蛋白质生物合成过程中,特异识别mRNA上起始密码子的tRNA被称为起始tRNA,它们参加多肽链合成的起始,其它在多肽链延伸中运载氨基酸的tRNA,统称为延伸tRNA。
(四)核糖核蛋白体
核蛋白体是由rRNA和几十种蛋白质组成的亚细胞颗粒,位于胞浆内,可分为两类,一类附着于粗面内质网,主要参与白蛋白、胰岛素等分泌性蛋白质的合成,另一类游离于胞浆,主要参与细胞固有蛋白质的合成。核糖体是细胞中的主要成分之一,在一个生长旺盛的细菌中大约不20000个核糖体,其中蛋白质占细胞总蛋白质的10%,RNA占细胞总RNA的80%。
任何生物的核糖体都是由大、小两个亚基组成,现将大肠杆菌核糖体和大鼠肝细胞核糖体的蛋白质组分和RNA组成列表于18-4。1968年已在体外对大肠杆菌小亚基进行了自我装配研究,加入16s rRNA和21种蛋白质,即可形成有天然活性的30s小亚基。通过这些研究使人们能够进一步认识小亚基和大亚基中rRNA与蛋白质的特异功能。核糖体是高度复杂的体系,它的任何个别组分或局部组分都不能起整体的作用,因此必须研究核糖体中蛋白质和RNA的空间结构和位置,才能更完全地了解蛋白质合成的具体过程。过去一直认为rRNA主要起着结构上的作用,蛋白质发挥催化功能,但现在认为rRNA与蛋白质共同的构成的核糖体功能区是核蛋白体表现功能的重要部位,如GTP酶功能区,转肽酶功能区以及mRNA功能区等等。
表18-4 核蛋白体的组成及特性
| 来源 | 直径(毫微米) | 重量(道尔顿) | 含rRNA(%) | 含蛋白质(%) | 沉降系数 | 亚基 | 含rRNA | 含蛋白质种数 | 每个细胞内含有的个数 | |
| 种类 | 分子量 | |||||||||
| 真核细胞胞液 | 20~22 | 3.6×106 | 55 | 45 | 77S~80s | 40S(小) | 18S | -70万 | ~34 | 106~107 |
| 60S(大) | 5s 5.8S 28S~29S |
3万 4万 140~180万 |
~40 | |||||||
| 原核细胞胞液 | 18 | 2.6×106 | 60~65 | 30~35 | 70S | 30S(小) | 16S | 55万 | ~34 | 1.5×104 |
| 50S(大) | 5s 23S |
4万 110万 |
||||||||
注:真核细胞线粒体的核蛋白体组成及特性与原核细胞胞液的相同
核蛋白体作为蛋白质的合成场所具有以下几种作用:
(1)mRNA结合位点:位于30s小亚基头部,此处有几种蛋白质构成一个上的结构域,负丙与mRNA的结合,特别是16srRNA3’端与mRNa AUG之前的一段序列互补是这种结合必不可少的,见表18-5。
表18-5 大肠杆菌mRNA起始密码上游区域SD序列和16srRNA的互补
| MS2外壳蛋白 MS2复制酶 MS2A蛋白 λCro galE β-内酰氨酶 脂蛋白 核糖体蛋白S12 RNA聚合酶β trpE |
3’HOAU UCCUCCACUAG……5’ 5’……UCAACC GGAGUUUGAAUCAUG…3’ 5’……CAAACAU GAGGAUUACCCAUG …3’ 5’…… UCCU AGGAGGUUUGACCUGUG…3’ 5’…… AUGUAC UAAGGAGGUUGUAUG…3’ 5’…… AGCCUAAU GGAGCGAAUUAUG…3’ 5’…… UAUUGAAA AAGGAAGAGUAUG…3’ 5’…… AUCUA GAGGGUAUUAAUAAUG…3’ 5’…… AAAACCAGGAGCUAUUUAAUG…3’ 5’…… AGCGAGCU GAGGAACCCUAUG…3’ 5’…… CAAAAUUAGAGAAUAACAAUG…3’ |
(2)P位点:(peptidyl tRNA site)
又叫做肽酰基tRNA位或给位。它大部分位于小亚基,小部分位于大亚基,它是结合起始tRNA 并向A位给出氨基酸的位置(图18-4)。
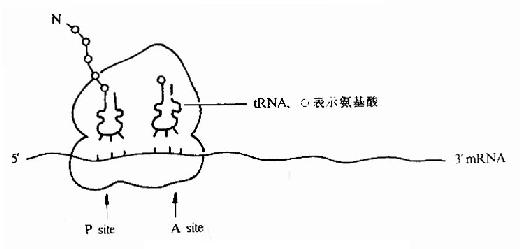
图18-4 翻译过程中的核糖体图解
(3)A位点:(Aminoacyl-tRNA site)
叫做氨基酰 tRNa 位或受位。它大部分位于大亚基而小部分位于小亚基,它是结合一个新进入的氨基酰tRNA 的位置(见后节叙述)。
(4)转肽酶活性部位:
位于P位和A位的连接处。
(5)结合参与蛋白质合成的起始因了(Initiation Factor,IF)、延长因子(ElengationFactor,EF)和终止因子或释放因子(Release Factor,RF)。
第二节 蛋白质生物合成过程
蛋白质生的合成亦称为翻译(Translation),即把mRNA分子中碱基排列顺序转变为蛋折质或多肽链中的氨基酸排列顺序过程。这也是基因表达的第二步,产生基因产物蛋白质的最后节段。不同的组织细胞具有不同的生理功能,是因为它们表达不同的基因,产生具有特殊功能的蛋白质,参与蛋白质生物合成的成份至少有200种,其主要体第主要由mRNA、tRNA、核糖核蛋白体以及有关的酶和蛋白质因子共同组成。
原核生物与真核生物的蛋白质合成过程中有很多的区别,真核生物此过程更复杂,下面着重介绍原核生物蛋白质合成的过程,并指出真核生物与其不同这处。
蛋白质生物合成可分为五个阶段,氨基酸的活化、多肽链合成的起始、肽链的延长、肽链的终止和释放、蛋白质合成后的加工修饰。
(一)氨基酰-tRNA的生成
氨基酸在进行合成多肽链之前,必须先经过活化,然后再与其特异的tRNA结合,带到mRNA相应的位置上,这个过程靠氨基酰tRNA合成酶催化,此酶催化特定的氨基酸与特异的tRNA相结合,生成各种氨基酰tRNA.每种氨基酸都靠其特有合成酶催化,使之和相对应的tRNA结合,在氨基酰tRNA合成酶催化下,利用ATP供能,在氨基酸羧基上进行活化,形成氨基酰-AMP,再与氨基酰tRNA合成酶结合形成三联复合物,此复合物再与特异的tRNA作用,将氨基酰转移到tRNA的氨基酸臂(即3'-末端CCA-OH)上(图18-5和图18-6)。
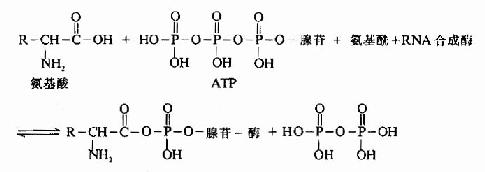
图18-6 氨基酰-tRNA的生成
原核细胞中起始氨基酸活化后,还要甲酰化,形成甲酰蛋氨酸tRNA,由N10甲酰四氢叶酸提供甲酰基。而真核细胞没有此过程。
前面讲过运载同一种氨基酸的一组不同tRNA称为同功tRNA。一组同功tRNA由同一种氨酰基tRNA合成酶催化。氨基酰tRNA合成酶对tRNA和氨基酸两者具有专一性,它对氨基酸的识别特异性很高,而对tRNA识别的特异性较低。
氨基酰tRNA合成酶是如何选择正确的氨基酸和tRNA呢?按照一般原理,酶和底物的正确结合是由二者相嵌的几何形状所决定的,只有适合的氨基酸和适合的tRNA进入合成酶的相应位点,才能合成正确的氨酰基tRNA。现在已经知道合成酶与L形tRNA的内侧面结合,结合点包括接近臂,DHU臂和反密码子臂(图18-7)。
图18-7 氨基酰-tRNA合成酶与tRNA的相互作用,可见氨酸接受柄、
D柄、反密码子和可变环与酶反应
乍看起来,反密码子似乎应该与氨基酸的正确负载有关,对于某些tRNA也确实如此,然而对于大多数tRNA来说,情况并非如此,人们早就知道,当某些tRNA上的反密码子突变后,但它们所携带的氨工酸却没有改变。1988年,候稚明和Schimmel的实验证明丙氨酸tRNA酸分子的氨基酸臂上G3:U70这两个碱基发生突变时则影响到丙氨酰tRNA合成酶的正确识别,说明G3:U70是丙氨酸tRNA分子决定其本质的主要因素。tRNA分子上决定其携带氨基酸的区域叫做副密码子。一种氨基酰tRNA合成酶可以识别以一组同功tRNA,这说明它们具有共同特征。例如三种丙氨酸tRNA(tRNAAlm/CUA,tRNAAim/GGC,tRNAAin/UGC都具有G3:U70副密码子。)但没有充分的证据说明其它氨基酰tRNA合成酶也识别同功tRNA组中相同的副密码子。另外副密码子也没有固定的位置,也可能并不止一个碱基对。
(二)多肽链合成的起始
核蛋白体大小亚基,mRNA起始tRNA和起始因子共同参与肽链合成的起始。
1、大肠杆菌细胞翻译起始复合物形成的过程:
(1)核糖体30S小亚基附着于mRNA起始信号部位:原核生物中每一个mRNA都具有其核糖体结合位点,它是位于AUG上游8-13个核苷酸处的一个短片段叫做SD序列。这段序列正好与30S小亚基中的16s rRNA3’端一部分序列互补,因此SD序列也叫做核糖体结合序列,这种互补就意味着核糖体能选择mRNA上AUG的正确位置来起始肽链的合成,该结合反应由起始因子3(IF-3)介导,另外IF-1促进IF-3与小亚基的结合,故先形成IF3-30S亚基-mRNA三元复合物。
(2)30S前起始复合物的形成:在起始因子2作用下,甲酰蛋氨酰起始tRNA与mRNA分子中的AUG相结合,即密码子与反密码子配对,同时IF3从三元复合物中脱落,形成30S前起始复合物,即IF2-3S亚基-mRNA-fMet-tRNAfmet复合物,此步需要GTP和Mg2+参与。
(3)70S起始复合物的形成:50S亚基上述的30S前起始复合物结合,同时IF2脱落,形成70S起始复合物,即30S亚基-mRNA-50S亚基-mRNA-fMet-tRNAfmet复合物。此时fMet-tRNAfmet占据着50S亚基的肽酰位。而A位则空着有待于对应mRNA中第二个密码的相应氨基酰tRNA进入,从而进入延长阶段,以上过程见图18-8和图18-9。

图18-8 大肠杆菌起始复合物的形成
2、真核细胞蛋白质合成的起始
真核细胞蛋白质合成起始复合物的形成中需要更多的起始因子参与,因此起始过程也更复杂。
(1)需要特异的起始tRNA即,-tRNAfmet,并且不需要N端甲酰化。已发现的真核起始因子有近10种(eukaryote Initiation factor,eIF)
(2)起始复合物形成在mRNA5’端AUG上游的帽子结构,(除某些病毒mRNA外)
(3)ATP水解为ADP供给mRNA结合所需要的能量。真核细胞起始复合物的形成过程是:翻译起始也是由eIF-3结合在40S小亚基上而促进80S核糖体解离出60S大亚基开始,同时eIF-2在辅eIF-2作用下,与Met-tRNAfmet及GTP结合,再通过eIF-3及eIF-4C的作用,先结合到40S小亚基,然后再与mRNA结合。
mRNA结合到40S小亚基时,除了eIF-3参加外,还需要eIF-1、eIF-4A及eIF-4B并由ATP小解为ADP及Pi来供能,通过帽结合因子与mRNA的帽结合而转移到小亚基上。但是在mRNA5’端并未发现能与小亚基18SRNA配对的S-D序列。目前认为通过帽结合后,mRNA在小亚基上向下游移动而进行扫描,可使mRNA上的起始密码AUG在Met-tRNAfmet的反密码位置固定下来,进行翻译起始。
图18-9 Initiationof translation im E.cole.The initiating tRNA,tRNAMetf,is represented by theblue line,the anticodon being the horizontal short line.The fMet-tRNAMetf isdelivered to the 30s subunit by IF2.NNN represents any codon (N for anynucleotie).Note.The ribosome also has an exit site not shown in thediagram.This site will be discussed later.
通过eIF-5的作用,可使结合Met-tRNAfmet·GTP及mRNAR40S小亚基与60S大亚基结合,形成80S复合物。eIF-5具有GTP酶活性,催化GTP水解为GDP及Pi,并有利于其它起始因子从40S小亚基表面脱落,从而有利于40S与60S两个亚基结合起来,最后经eIF-4D激活而成为具有活性的80SMet-tRNAfmet·mRNA起始复合物。
真核细胞翻译起始复合物的生成见图18-10和图18-11。
图18-10 真核细胞翻译起始复合物的形成
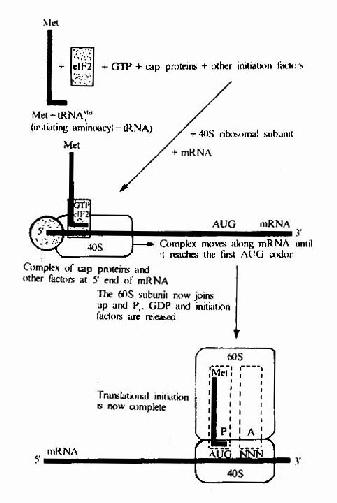
图18-11 Simplified diagram of initiation in eukaryotes.Note that severaleukaryote initiation factors besides elF2 are involved .tRNAMeti,initiatingRNA.e1F2 is the eukaryotic initiation factor corresponding to IF2 inprokaryotes.
(三)多肽链的延长:
在多肽链上每增加一个氨基酸都需要经过进位,转肽和移位三个步骤。
(1)为密码子所特定的氨基酸tRNA结合到核蛋白体的A位,称为进位。氨基酰tRNA在进位前需要有三种延长因子的作用,即,热不稳定的EF(Unstable temperature,EF)EF-Tu,热稳定的EF(stable temperature EF,EF-Ts)以及依赖GTP的转位因子。EF-Tu首先与GTP结合,然后再与氨基酰tRNA结合成三元复合物,这样的三元复合物才能进入A位。此时GTP水解成GDP,EF-Tu和GDP与结合在A位上的氨基酰tRNA分离(图18-12)。
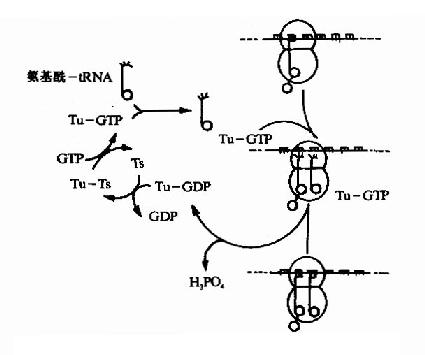
图18-12 原核生物肽链延长因子EFTu与EFTs的作用原理
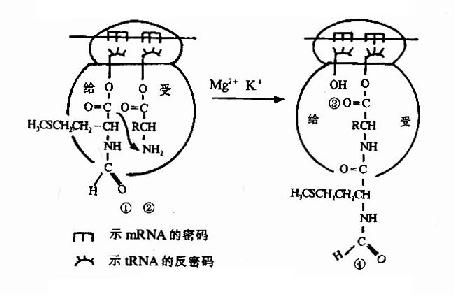
图18-13 肽键的形成
①核蛋白体“给位”上携甲酰蛋氨酰 基(或肽酰)的tRNA
②核蛋白体“受体”上新进入的氨基酰tRNA;
③失去甲酰蛋氨酰基(或肽酰)后,即将从核蛋白体脱落的tRNA;
④接受甲酰蛋氨酰基(或肽酰)后已增长一个氨基酸残基的肽键
(2)转肽--肽键的形成(peptide bond formation)
在70S起始复合物形成过程中,核糖核蛋白体的P位上已结合了起始型甲酰蛋氨酸tRNA,当进位后,P位和A位上各结合了一个氨基酰tRNA,两个氨基酸之间在核糖体转肽酶作用下,P位上的氨基酸提供α-COOH基,与A位上的氨基酸的α-NH2形成肽键,从而使P位上的氨基酸连接到A位氨基酸的氨基上,这就是转肽。转肽后,在A位上形成了一个二肽酰tRNA(图18-13)。
(3)移位(Translocation)
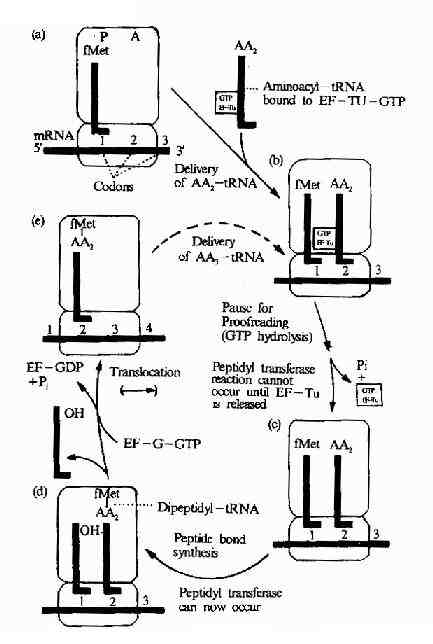
图18-14 Diagram of the elongation process in protein synthesis followinginitation.tRNAs are shown as lue lines;AA,aamicoacyl group.The positioningshown of the EF-Tu-GTP on the tRNA and on the ribosome are arbitraty .Thisdiagram does not make evident why the ribosomal enzyme catalysing the peptidebond synthesis is called peptidyl transferase .However,if you do the next roundof synthesis yourself(see text),you will see that in all subsequent rounds ofsynthesis it is a peptide that is transferred to the incoming aminoacyltRNA-hence the name.
转肽作用发生后,氨基酸都位于A位,P位上无负荷氨基酸的tRNA就此脱落,核蛋白体沿着mRNA向3’端方向移动一组密码子,使得原来结合二肽酰tRNA的A位转变成了P位,而A位空出,可以接受下一个新的氨基酰tRNA进入,移位过程需要EF-2,GTP和Mg2+的参加(图18-14)。
以后,肽链上每增加一个氨基酸残基,即重复上述进位,转肽,移位的步骤,直至所需的长度,实验证明mRNA上的信息阅读是从5’端向3’端进行,而肽链的延伸是从氮基端到羧基端。所以多肽链合成的方向是N端到C端(图18-15)。
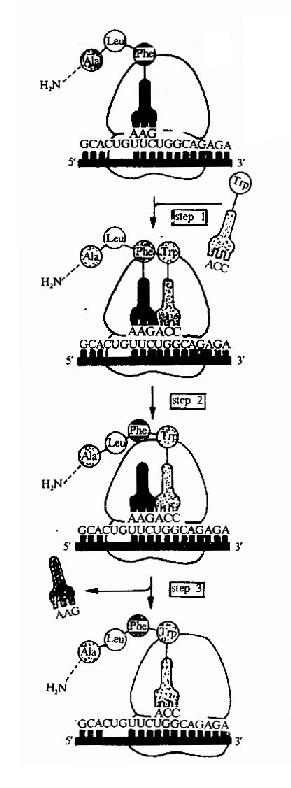 |
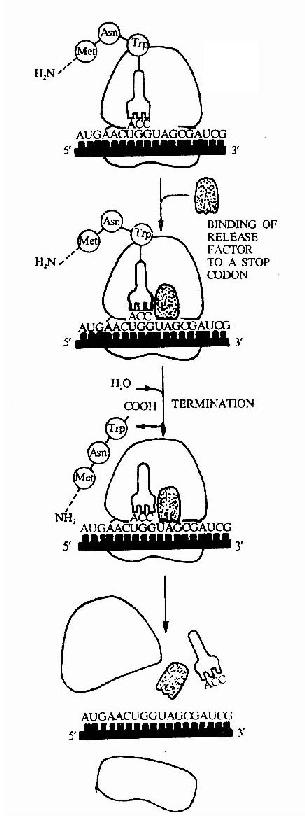 图18-16 The final phase of protein synthesis .The binding of release factor to a stop codon terminates translation.The completed polypeptide is released,and the ribosome dissociates into two separte subunits. 图18-16 The final phase of protein synthesis .The binding of release factor to a stop codon terminates translation.The completed polypeptide is released,and the ribosome dissociates into two separte subunits. |
| 图18-15 The elongation phase of protein synthesis on a ribosome.The three-step cycle shown is repeated over and over during the synthesos of a protein chain.An aminoacyl-tRNA moleculie binds to the A-site on the rebosome is step l,a new peptide bond is formed in sted 2,and the ribosome moves a distance of three nucleotides along the mRNA chain in step 3,ejecting an old tRNA molecule and "resetting" the ribosome so that the next aminoacyl-tRNA molecule can bind.As indicated in Figure 6-21,the p-site is drawn on the left side of the ribosome,with the A-site on the right. |
(四)翻译的终止及多肽链的释放:
无论原核生物还是真核生物都有三种终止密码子UAG,UAA和UGA。没有一个tRNA能够与终止密码子作用,而是靠特殊的蛋白质因子促成终止作用。这类蛋白质因子叫做释放因子,原核生物有三种释放因子:RF1,RF2t RF3。RF1识别UAA和UAG,RF2识别UAA和UGA。RF3的作用还不明确。真核生物中只有一种释放因子eRF,它可以识别三种终止密码子。
不管原核生物还是真核生物,释放因子都作用于A位点,使转肽酶活性变为水介酶活性,将肽链从结合在核糖体上的tRNA的CCA末凋上水介下来,然后mRNA与核糖体分离,最后一个tRNA脱落,核糖体在IF-3作用下,解离出大、小亚基。解离后的大小亚基又重新参加新的肽链的合成,循环往复,所以多肽链在核糖体上的合成过程又称核糖体循环(ribosome cycle)(图18-16)。
(五)多核糖体循环:
上述只是单个核糖体的翻译过程,事实上在细胞内一条mRNA链上结合着多个核糖体,甚至可多到几百个。蛋白质开始合成时,第一个核糖体在mRNA的起始部位结合,引入第一个蛋氨酸,然后核糖体向mRNA的3’端移动一定距离后,第二个核糖体又在mRNA的起始部位结合,现向前移动一定的距离后,在起始部位又结合第三个核糖体,依次下去,直至终止。两个核糖体之间有一定的长度间隔,每个核糖体都独立完成一条多肽链的合成,所以这种多核糖体可以在一条mRNA链上同时合成多条相同的多肽链,这就大大提高了翻译的效率(图18-17)。
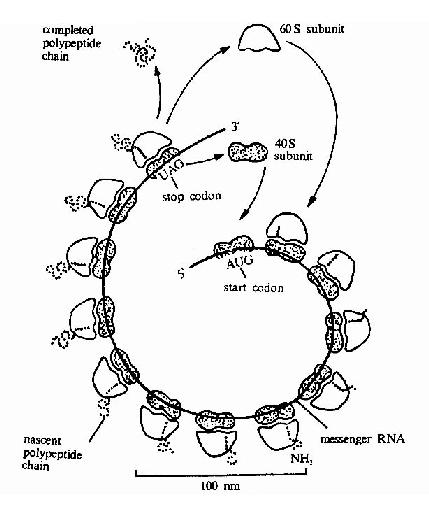
图18-17 A polyribosome.Schematicdrawing showing how a series of ribosomes can simultaneously translate the samemRNA molecule.
多聚核糖体的核糖体个数,与模板mRNA的长度有关,例如血红蛋白的多肽链mNRA编码区有450个核苷酸组成,长约150nm。上面串连有5-6个核糖核蛋白体形成多核糖体。而肌凝蛋白的重链mRNA由5400个核苷酸组成,它由60多个核糖体构成多核糖体完成多肽链的合成。
第三节 蛋白质合成后的分泌及加工修饰
不论是原核还是真核生物,在细胞浆内合成的蛋白质需定位于细胞特定的区域,有些蛋白质合成后要分泌到细胞外,这些蛋白质叫做分必蛋白。在细菌细胞内起作用的蛋白质一般靠扩散作用而分布到它们的目的地。如内膜含有参与能量代谢和营养物质转运的蛋白质;外膜含有促进离子和营养物质进入细胞的蛋白质;在内膜与外膜之间的间隙称为周质,其中含有各种水解酶以及营养物质结合蛋白。
真核生物细胞结构更为复杂,而且有多种不同的细胞器,它们又具有各不相同的膜结构,因此合成好的蛋白质还要面临跨越不同的膜而到达细胞器械,有些蛋白质在翻译完成后还要经过多种共价修饰,这个过程叫做翻译后处理。
(一)细菌中蛋白质的越膜
细胞的内膜蛋白,外膜蛋白和周质蛋白是怎样越过内膜而到其目的地的呢?绝大多数越膜蛋白的N端都具有大约15-30个以疏水氨基酸为主的N端信号序列或称信号肽。信号肽的疏水段能形成一段α螺旋结构。在信号序列之后的一段氨基酸残基也能形成一段α螺旋,两段α螺旋以反平行方式组成一个发夹结构,很容易进入内膜的脂双层结构,一旦分泌蛋白质的N端锚在膜内,后续合成的其它肽段部分将顺利通过膜。疏水性信号肽对于新生肽链跨膜及把它固定的膜上起一个拐掍作用。之后位于内膜外表面的信号肽酶将信号肽序列切除。当蛋白质全部翻译出来后,羧端穿过内膜,在周质中折叠成蛋白质的最终构象(图18-18)。
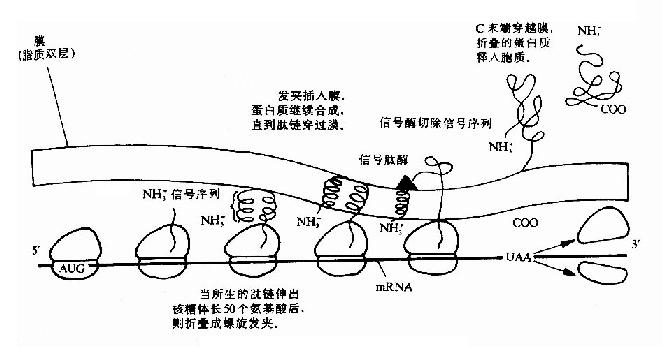
图18-18 蛋白质合成后的分泌过程
(二)真核生物蛋白质的分泌
真核生物不但有细胞核、细胞质和细胞膜,而且还有许多膜性结构的细胞器,在细胞须内合成的蛋白质怎样的到达细胞的不同部位呢?了解比较清楚的是分泌性蛋白质的转运。
像原核细胞一要,真核细胞合成的蛋白质N端也有信号肽也能形成两个α螺旋的发夹结构,这个结构可插入到内质网的膜中,将正在合成中的多肽链带和内质网内腔。80年代中期在胞浆中发现一种由小分子RNA和蛋白质共同组成的复合物,它能特异地与信号肽识别而命名为信号肽识别颗粒。它的作用是识别信号肽与核糖体结合并暂时阻断多肽链的合成。内质网外膜上的SRP受体,当ARP与受体结合后,信号肽就可插入内质网进入内腔,被内质网内膜壁上的信号肽酶水解除去SRP与受体结合后,信号肽就可插入内质网进入内腔,被内质网内腔壁上的信号肽酶水解除去SRP与受体解离并进入新的循环,而信号肽后序肽段也进入内质网内腔,并开始继续合成多肽链(图18-19)。
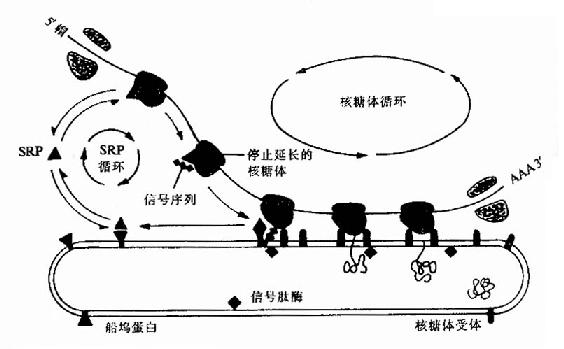
图18-19 在蛋白质越过内质网的转运过程中,SRP和船坞蛋白(或SRP受体)的作用
SRP对翻译阶段作用的重要生理意义在于:分泌性蛋白及早进入细胞的膜性细胞,能够正确的折叠、进行必要的后期加工与修饰并顺利分泌出细胞。
现以哺乳动物的胰岛素为例说明这种分泌过程。胰岛素由51个氨基酸残基组成,但胰岛素mRNA的翻译产和在兔网织红细胞无细胞翻译体系中为86个氨基酸残基,称为胰岛素原,在麦胚无细胞翻译系统中为110个氨基酸残基组成的前胰岛素原,后来证明,在前胰岛素原的N末端有一段富含疏水氨基酸的肽段做为信号肽,使前胰岛素原能穿越内质网膜进入内质网内腔,在内腔壁上信号肽被水介。所以在哺乳动物细胞内,当多肽链合成完成时,前胰岛素原已成为胰岛素原。然后胰岛素原被运到高尔基复合体,切去C肽成为成熟的胰岛素,最终排出胞外。像真核细胞的前清蛋白,免疫球白轻链,催乳素等都有相似的分必方式。
(三)蛋白质翻译后加工修饰
从核糖体上释放出来的多肽链,按照一级结构中氨基酸侧链的性质,自竹卷曲,形成一定的空间结构,过去一直认为,蛋白质空间结构的形成靠是其一级结构决定的,不需要另外的信息。近些年来发现许多细胞内蛋白质正确装配都需要一类称做“分了伴娘”的蛋白质帮助才能完成,这一概念的提出并未否定“氨基酸顺序决定蛋白空间结构”这一原则。而是对这一理论的补充,分子伴娘这一类蛋白质能介导其它蛋白质正确装配成有功能活性的空间结构,而它本身并不参与最终装配产物的组成。目前认为“分子伴娘”蛋白有两类,第一类是一些酶,例如蛋白质二硫键异构酶可以识别和水解非正确配对的二硫键,使它们在正确的半胱氨酸残基位置上重新形成二硫键,第二类是一些蛋白质分子,它们可以和部分折叠或没有折叠的蛋白质分子结合,稳定它们的构象,免遭其它酶的水解或都促进蛋白质折叠成正确的空间结构。总之“分子伴娘”蛋白质合成后折叠成正确空间结构中起重要作用,对于大多数蛋白质来说多肽链翻译后还要进行下列不同方式的加工修饰才具有生理功能。
1.氨基端和羧基端的修饰
在原核生物中几乎所有蛋白质都是从N-甲酰蛋氨酸开始,真核生物从蛋氨酸开始。甲酰基经酶水介而除去,蛋氨酸或者氨基端的一些氨基酸残基常由氨肽酶催化而水介除去。包括除去信号肽序列。因此,成熟的蛋白质分子N-端没有甲酰基,或没有蛋氨酸。同时,某些蛋白质分子氨基端要进行乙酰化在羧基端也要进行修饰。
2.共价修饰
许多的蛋白质可以进行不同的类型化学基团的共价修饰,修饰后可以表现为激活状态,也可以表现为失活状态。
(1)磷酸化:
磷酸化多发生在多肽链丝氨酸,苏氨酸的羟基上,偶尔也发生在酪氨酸残基上,这种磷酸化的过程受细胞内一种蛋白激酶催化,磷酸化后的蛋白质可以增加或降低它们的活性,例如:促进糖原分解的磷酸化酶,无活性的磷酸化酶b经磷酸化以后,变居有活性的磷酸化酶a。而有活性的糖原合成酶I经磷酸化以后变成无活性的糖原合成酶D,共同调节糖元的合成与分介。
(2)糖基化:
质膜蛋白质和许多分泌性蛋白质都具有糖链,这些寡糖链结合在丝氨酸或苏氨酸的羟基上,例如红细胞膜上的ABO血型决定簇。也可以与天门冬酰胺连接。这些寡糖链是在内质网或高尔基氏体中加入的(图18-20)。
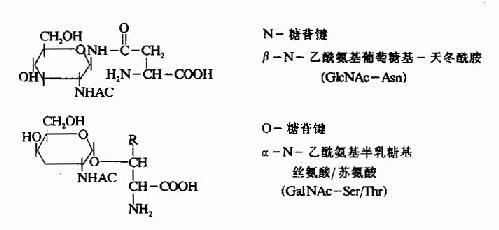
图18-20 糖蛋白中常见的糖一肽连接键
(3)羟基化:
胶原蛋白前α链上的脯氨酸和赖氨酸残基在内质网中受羟化酶、分子氧和维生素C作用产生羟脯氨酸和羟赖氨酸,如果此过程受障碍胶原纤维不能进行交联,极大地降低了它的张力强度。
(4)二硫键的形成:
mRNA上没有胱氨酸的密码子,多肽链中的二硫键,是在肽链合成后,通过二个半胱氨酸的疏基氧化而形成的,二硫键的形成对于许多酶和蛋白质的活性是必需的。
3.亚基的聚合:
有许多蛋白质是由二个以上亚基构成的,这就需这些多肽链通过非共价键聚合成多聚体才能表现生物活性。例如成人血红蛋白由两条α链,两条β链及四分子血红素所组成,大致过程如下:α链在多聚核糖体合成后自行释下,并与尚未从多聚核糖体上释下的β链相连,然后一并从多聚核糖体上脱下来,变成α、β二聚体。此二聚体再与线粒体内生成的两个血红素结合,最后形成一个由四条肽链和四个血红素构成的有功能的血红蛋白分子。
4.水介断链:
一般真核细胞中一个基因对应一个mRNA,一个mRNA对应一条多肽链,但也有少数的情况,即一种三思而行翻译后的多肽链经水介后产生几种不同的蛋白质或多肽。例如哺乳动物的鸦片样促黑皮激素原初翻译产物为265个氨基酸,它在脑下垂体前叶细胞中,POMC初切割成为N-端片断和C端片段的β-促脂解激素。然后N端片段又被切割成较小的N端片断和工9肽的促肾上腺皮质激素。而在脑下垂体中叶细胞中,β-促脂解激素再次被切割产生β-内啡肽;ACTH也被切割产生13肽的促黑激素(α-melanotropin)(图18-21)。
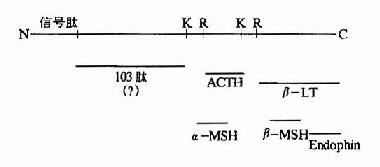
图18-21 POMC作为多种活性物质的前体
第一行为POMC前体,K、R为赖氨酸和精氨酸残基
第四节 蛋白质合成的抑制剂
影响蛋白质生物合成的物质非常多,它们可以作用于DNA复制和RNA转录,对蛋白质的生物合成起间接作用,本节主要讨论抑制蛋白质生物合成翻译过程的阻断剂。
(一)抗生素类阻断剂:
许多抗生素都是以直接抑制细菌细胞内蛋白质合成而对人体副作用最小为目的而设计的,它们可作用于蛋白质合成的各个环节,包括抑制起始因子,延长因子及核糖核蛋白体的作用等等。
1、链霉素、卡那霉素、新霉素等:
这类抗生素属于基甙类,它们主要抑制革兰氏阴性细菌蛋白质合成的三个阶段:①S起始复合物的形成,使氨基酰tRNA从复合物中脱落;②在肽链延伸阶段,使氨基酰tRNA与mRNA错配;③在终止阶段,阻碍终止因了与核蛋白体结合,使已合成的多肽链无法释放,而且还抑制70S核糖体的介离。
2、四环素和土霉素:
①作用于细菌内30S小亚基,抑制起始复合物的形成,②抑制氨西藏酰tRNA进入核糖体的A位,阻滞肽链的延伸;③影响终止因子与核糖体的结合,使已合成的多肽链不能脱落离核糖体。四环素类抗生素除对菌体70S核糖体有抑制作用外,对人体细胞的80S核糖体也有抑制作用,但对70S核糖体的敏感性更高,故对细菌蛋白质合成抑制作用更强。
3、氯霉素:
属于广谱抗生素。①氯霉素与核糖体上的A位紧密结合,因此阻碍氨基酰tRNA进入A位,②抑制转肽酶活性,使肽链延伸受到影响,菌体蛋白质不能合成,因此有较哟的抑菌作用。
4、嘌呤霉素(Puromycin)
结构与酪氨酰-tRNA相似,从而取代一些氨基酰tRNA进入核糖体的A位,当延长中的肽转入此异常A位时,容易脱落,终止肽链合成。由于嘌呤霉素对原核和真核生物的翻译过程均有干扰干扰作用,故难于用做抗菌药物,有人试用于肿瘤治疗(图18-22)。
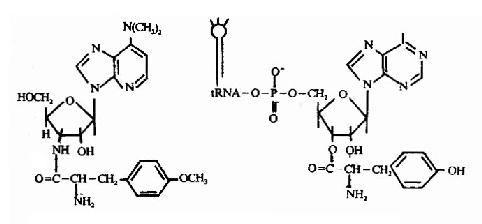
图18-22 嘌呤霉素(左)与tyr-tRNAtyr(右)
5、白喉霉素(diphtheria toxin)
由白喉杆菌所产生的白喉霉素是真核细胞蛋白质合成抑制剂。白喉霉素实际上是寄生于白喉杆菌体内的溶源性噬菌体β基因编码的由白喉杆菌转运分泌出来,进入组织细胞内,它对真核生物的延长因子-2(EF-2)起共价修饰作用,生成EF-2腺苷二磷酸核糖衍生物,从而使EF-2失活,它的催化效率很高,只需微量就能有效地抑制细胞整个蛋白质合成,而导致细胞死亡(图18-23)。
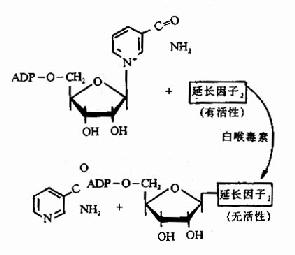
图18-23 白喉毒素的作用
(二)干扰素对病毒蛋白合成的抑制
干扰素(interferon)是病毒感染后,感染病毒的细胞合成和分泌的一种小分子蛋白质。从白细胞中得到α-干扰素,从成纤维细胞中得到β-干扰素,在免疫细胞中得到γ-干扰素。干扰素结合到未感染病毒的细胞膜上,诱导这些细胞产生寡核苷酸合成酶、核酸内切酶和蛋白激酶。在细胞未被感染时,不合成这三种酶,一旦被病毒感染,有干扰素或双链RNA存在时,这些酶被激活,并以不同的方式阻断病毒蛋白质的合成。干扰素和dsRNA激活蛋白激酶,蛋白激酶使蛋白质合成的起始因子磷酸化,使它失活,另一种方式是mRNA的降介,干扰素dsRNA激活2,5腺嘌呤寡核苷酸合成的酶的合成,2,5腺嘌呤寡核苷酸激活核酸内切酶,核酸内切酶水介mRNA(图18-24)。
由于干扰素具有很强的抗病毒作用,因此在医学上有重大的实用价值,但组织中含量很少,难于从生物组织中大量分离干扰素。现在已难应用基因工程合成干扰素以满足研究与临床应用的需要。
小结
蛋白质分子是由一个个氨基酸通过肽键连接起来的,在细胞内这种连接必须依靠核蛋白体循环来完成。mRNA携带合成蛋白质分子中氨基酸排列顺序遗传的信息。这是由每3个碱基组成一个密码来体现的,遗传密码共有64个密码子。UAA、UAG、UGA代表终止信号,AUG不仅代表起始信号,还代表蛋氨酸。tRNA携带特异的氨基酸,同时它的反密码子可识别mRNA上的密码子,核糖体上受位和给位结合的氨基酸在转肽酶的作用下形成肽键。
合成蛋白质分子的每个氨基酸首先要在特异的氨基酰tRNA合成的酶的作用下,与特异的tRNA结合,形成氨基酰tRNA,这就是氨基酸的活化。核蛋白循环过程中的起动阶段,首先要形成由起始因子,GTP、mRNA和大、小亚基构成的70S起始复合物,肽链延长时,每进入一个氨基酸,就按进位,转肽、脱落、移位、重复这四个步骤。终止时,在终止因子参与下,转肽酶将合成的肽链水解离开核糖体,核蛋白体也从mRNA脱落,重新进入又一个循环,蛋白质合成时,在一条mRNA链上,同时结合着多个核糖体,同时合成相同的多条肽链。
蛋白质合成也有许多加工修饰过程,剪切一部分肽段,加入糖、脂,进行磷酸化,羟化等等。多聚体构成的蛋白质还要经过聚合过程。
蛋白质合成的阻断剂很多,作用部位也各不相同,利用这些理论,对于研制各种抗生素有重要意义。
思考题
1、遗传密码表有哪些特点?
2、核蛋白体的主要组成及工作原理?
3、氨基酰tRNA合成酶的特点?
4、肽链合成时起始复合物的形成过程。
5、真核生物与原核生物蛋白质合成的主要异同。
6、分泌蛋白质的结构特点及加工后分泌过程是怎样进行的。
第十九章 基因表达调控(Gene Expression and Its Regulation)
第一节 基因表达调控的现象和概念
一、基因表达调控是生命的必需
基因表达(gene expression)是指储存遗传信息的基因经过一系列步骤表现出其生物功能的整个过程。典型的基因表达是基因经过转录、翻译,产生有生物活性的蛋白质的过程。rRNA或tRNA的基因经转录和转录后加工产生成熟的rRNA或tRNA,也是rRNA或tRNA的基因表达,因为rRNA或tRNA就具有在蛋白质翻译方面的功能。
基因组(genome)是指含有一个生物体生存、发育、活动和繁殖所需要的全部遗传信息的整套核酸。但生物基因组的遗传信息并不是同时全部都表达出来的,即使极简单的生物(如最简单的病毒),其基因组所含的全部基因也不是以同样的强度同时表达的。大肠杆菌基因组含有约4000个基因,一般情况下只有5-10%在高水平转录状态,其它基因有的处于较低水平的表达,有的就暂时不表达。哺乳类基因组更复杂,人的基因组约含有10万个基因,但在一个组织细胞中通常只有一部分基因表达,多数基因处在沉静状态,典型的哺乳类细胞中开放转录的基因约在1万个上下,即使蛋白质合成量比较多、基因开放比例较高的肝细胞,一般也只有不超过20%的基因处于表达状态。
生物个体的各种组织细胞一般都有相同的染色体数目,每个细胞含的DNA量基本相近。最初经典的遗传学认为只有生殖细胞能够繁衍后代,随着科学的发展,能将植物的一些体细胞(如叶细胞)培育成为完整的植株,成年山羊的乳腺细胞在适当的条件下也能分化发育成山羊个体(克隆羊),表明这些体细胞也像生殖细胞一样含有个体发育、生存和繁殖的全部遗传信息。但这些遗传信息的表达是受到严格调控的,通常各组织细胞只合成其自身结构和功能所需要的蛋白质。不同组织细胞中不仅表达的基因数量不相同,而且基因表达的强度和种类也各不相同,这就是基因表达的组织特异性(tissue specificity)。例如肝细胞中涉及编码鸟氨酸循环酶类的基因表达水平高于其它组织细胞,合成的某些酶(如精氨酸酶)为肝脏所特有;胰岛β细胞合成胰岛素;甲状腺滤泡旁细胞(C细胞)专一分泌降血钙素等。细胞特定的基因表达状态,就决定了这个组织细胞特有的形态和功能。如果基因表达调控发生变化,细胞的形态与功能也会随之改变,例如正常组织细胞转化为癌瘤细胞的过程,就首先有基因表达方面的改变;人肝细胞在胚胎时期合成甲胎蛋白(alfafetal protein, AFP),成年后就很少合成AFP了,但当肝细胞转化成肝癌细胞时编码AFP的基因又会开放,合成AFP的量会大幅度提高,成为肝癌早期诊断的一个重要指标;人肺组织并不合成降血钙素,但某些肺组织细胞癌变时,合成降血钙素的基因会开放,能分泌降血钙素,引起血钙降低的症状。
细胞分化发育的不同时期,基因表达的情况是不相同的,这就是基因表达的阶段特异性(stagespecificity)。一个受精卵含有发育成一个成熟个体的全部遗传信息,在个体发育分化的各个阶段,各种基因极为有序地表达,一般在胚胎时期基因开放的数量最多,随着分化发展,细胞中某些基因关闭(turn off)、某些基因转向开放(turn on),胚胎发育不同阶段、不同部位的细胞中开放的基因及其开放的程度不一样,合成蛋白质的种类和数量都不相同,显示出基因表达调控在空间和时间上极高的有序性,从而逐步生成形态与功能各不相同、极为协调、巧妙有序的组织脏器。即使是同一个细胞,处在不同的细胞周期状态,其基因的表达和蛋白质合成的情况也不尽相同,这种细胞生长过程中基因表达调控的变化,正是细胞生长繁殖的基础。
从上所述,不难看出:生物的基因表达不是杂乱无章的,而是受着严密、精确调控的,尽我们现在对调控机理的奥妙所知还不多,但已经可以认识到,不仅生命的遗传信息是生物生存所必需的,而且遗传信息的表达调控也是生命本质所在。
二、基因表达适应环境的变化
生物只有适应环境才能生存。当周围的营养、温度、湿度、酸度等条件变化时,生物体就要改变自身基因表达状况,以调整体内执行相应功能蛋白质的种类和数量,从而改变自身的代谢、活动等以适应环境。生物体内的基因调控各不相同,仔细观察基因表达随环境变化的情况,可以大致把基因表达分成两类:
①组成性表达(constitutiveexpression)指不大受环境变动而变化的一类基因表达。其中某些基因表达产物是细胞或生物体整个生命过程中都持续需要而必不可少的,这类基因可称为看家基因(housekeeping gene),这些基因中不少是在生物个体其它组织细胞、甚至在同一物种的细胞中都是持续表达的,可以看成是细胞基本的基因表达。组成性基因表达也不是一成不变的,其表达强弱也是受一定机制调控的。
②适应性表达(adaptiveexpression)指环境的变化容易使其表达水平变动的一类基因表达。应环境条件变化基因表达水平增高的现象称为诱导(induction),这类基因被称为可诱导的基因(inducible gene);相反,随环境条件变化而基因表达水平降低的现象称为阻遏(repression),相应的基因被称为可阻遏的基因(repressible gene)。
改变基因表达的情况以适应环境,在原核生物、单细胞生物中尤其显得突出和重要,因为细胞的生存环境经常会有剧烈的变化。例如:周围有充足的葡萄糖,细菌就可以利用葡萄糖作能源和碳源,不必更多去合成利用其它糖类的酶类,当外界没有葡萄糖时,细菌就要适应环境中存在的其它糖类(如乳糖、半乳糖、阿拉伯糖等),开放能利用这些糖的酶类基因,以满足生长的需要。即使是内环境保持稳定的高等哺乳类,也经常要变动基因的表达来适应环境,例如与适宜温度下生活相比较,在冷或热环境下适应生活的动物,其肝脏合成的蛋白质图谱就有明显的不同;长期摄取不同的食物,体内合成代谢酶类的情况也会有所不同。所以,基因表达调控是生物适应环境生存的必需。
第二节 原核基因表达调控
细菌能随环境的变化,迅速改变某些基因表达的状态,这就是很好的基因表达调控的实验型。人们就是从研究这种现象开始,打开认识基因表达调控分子机理的窗口的。
一、操纵元的提出
大肠杆菌可以利用葡萄糖、乳糖、麦芽糖、阿拉伯糖等作为碳源而生长繁殖。当培养基中有葡萄糖和乳糖时,细菌优先使用葡萄糖,当葡萄糖耗尽,细菌停止生长,经过短时间的适应,就能利用乳糖,细菌继续呈指数式繁殖增长(图19-1)。
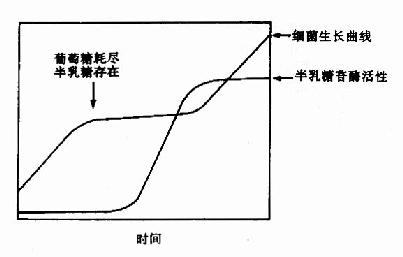 |
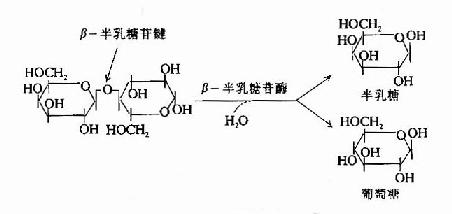 |
| 图19-1 大肠杆菌二阶段生长现象 | 图19-2 β-半乳糖苷酶的作用 |
大肠杆菌利用乳糖至少需要两个酶:促使乳糖进入细菌的乳糖透过酶(lactose permease)催化乳糖分解第一步的β-半乳糖苷酶(β-galactosidase)(图19-2)。
在环境中没有乳糖或其他β-半乳糖苷时,大肠杆菌合成β-半乳糖苷酶量极少,加入乳糖2-3分钟后,细菌大量合成β-半乳糖苷酶,其量可提高千倍以上,在以乳糖作为唯一碳源时,菌体内的β-半乳糖苷酶量可占到细菌总蛋白量的3%。在上述二阶段生长细菌利用乳糖再次繁殖前,也能测出细菌中β-半乳糖苷酶活性显著增高的过程。这种典型的诱导现象,是研究基因表达调控的极好模型。
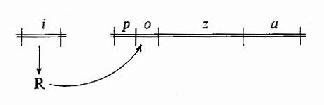
图19-3 Jacob和Monod提出的lacoperon模
针对大肠杆菌利用乳糖的适应现象,法国的Jacob和Monod等人做了一系列遗传学和生化学研究实验,于1961年提出乳糖操纵元(lac operon)学说,如图19-3所示。图19-3中z、a和b型是大肠杆菌编码利用乳糖所需酶类的基因,p是转录z、a、b所需要的启动子,调控基因i编码合成调控蛋白R,R能与o结合而阻碍从p开始的基因转录,所以o就是调节基因开放的操纵序列,乳糖能改变R结构使其不能与o结合,因而乳糖浓度增高时基因就开放,转录合成所编码的酶类,这样大肠杆菌就能适应外界乳糖供应的变化而改变利用乳糖的状况,这个模型是人们在科学实验的基础上第一次开始认识基因表达调控的分子机理。
二、操纵元(operon)的基本组成
乳糖操纵元模型被以后的许多研究实验所证实,对其有了更深入的认识,并且发现其他原核生物基因调控也有类似的操纵元组织,操纵元是原核基因表达调控的一种重要的组织形式,大肠杆菌的基因多数以操纵元的形式组成基因表达调控的单元。下面就以半乳糖操纵元为例子说明操纵元的最基本的组成组件(elements)。
(一)结构基因群
操纵元中被调控的编码蛋白质的基因可称为结构基因(structural gene, SG)。一个操纵元中含有2个以上的结构基因,多的可达十几个。每个结构基因是一个连续的开放读框(open reading frame),5′端有翻译起始码(DNA存储链上是ATG,转录成mRNA就是AUG),3′端有翻译终止码(DNA存储链上是TAA、TGA或TAG,转录成mRNA就是UAA、UGA或UAG)。各结构基因头尾衔接、串连排列,组成结构基因群。至少在第一个结构基因5′侧具有核糖体结合位点(ribosome binding site, RBS),因而当这段含多个结构基因的DNA被转录成多顺反子mRNA,就能被核糖体所识别结合、并起始翻译。核糖体沿mRNA移动;在合成完第一个编码的多肽后,核糖体可以不脱离mRNA而继续翻译合成下一个基因编码的多肽,直至合成完这条多顺反子mRNA所编码的全部多肽。
乳糖操纵元含有z、y和a三个结构基因。z基因长3510bp,编码含1170个氨基酸、分子量为135,000的多肽,以四聚体形式组成有活性的β-半乳糖苷酶,催化乳糖转变为别乳糖(allolactose),再分解为半乳糖和葡萄糖;y基因长780bp,编码由260个氨基酸组成、分子量30000的半乳糖透过酶,促使环境中的乳糖进入细菌;a基因长825bp,编码含275氨基酸、分子量为32000的转乙酰基酶,以二聚体活性形式催化半乳糖的乙酰化。z基因5′侧具有大肠杆菌核糖体识别结合位点(ribosome binding site, RBS)特征的ShineDalgarno(SD)序列,因而当乳糖操纵元开放时,核糖体能结合在转录产生的mRNA上。由于z、y、a三个基因头尾相接,上一个基因的翻译终止码靠近下一个基因的翻译起始码,因而同一个核糖体能沿此转录生成的多顺反子(polycistron)mRNA移动,在翻译合成了上一个基因编码的蛋白质后,不从mRNA上掉下来而继续沿mRNA移动合成下一个基因编码的蛋白质,一气依次合成基因群所编码的所有蛋白质。
(二)启动子
启动子(promoter,P)是指能被RNA聚合酶识别、结合并启动基因转录的一段DNA序列。操纵元至少有一个启动子,一般在第一个结构基因5′侧上游,控制整个结构基因群的转录。用RNA聚合酶与分离的一段DNA双链混合,再加入外切核酸酶去水解DNA,结果只有被RNA聚合酶识别结合而被保护的那段DNA不被水解,由此可以测出启动子的范围及其序列。虽然不同的启动子序列有所不同,但比较已经研究过的上百种原核生物的启动子的序列,发现有一些共同的规律,它们一般长40-60bp,含A桾碱基对较多,某些段落是很相似的,这些相似的保守性段落称为共有性序列(consensus sequences)。如图19-4所示,启动子一般可分为识别(R,recognition)、结合(B,binding)和起始(I, initiation)三个区段。转录起始第一个碱基(通常标记位置为+1)最常见的是A;在-10bp附近有TATAAT一组共有序列,因为这段共有序列是Pribnow首先发现的,称为Pribnow盒(Pribnow box);在-35bp处又有TTGACA一组共有序列 。
| 启动子名称 | -35区 | -10区 | +1 |
| P trp | ……TTGACA…… | N17……TTAACT… | N7……A…… |
| P tyr-tRNA | ……TTTACA…… | N16……TATGAT… | N7…G…… |
| P lac | ……TTGACA…… | N17……TATGTT… | N7…A…… |
| P recA | ……CTGATG…… | N17……TATAAT… | N7…A…… |
| P ara | ……TTGACA…… | N17……TACTGT… | N7…A…… |
| λPR | ……TTGACA…… | N17……GATAAT… | N6…A…… |
| λPL | ……TTGACA…… | N17……GATACT… | N6…A…… |
| T7 A2 | ……TTGACA…… | N17……TACGAT… | N6…A…… |
| fd Ⅷ | ……TTGACA…… | N17……TATAAT… | N6…G…… |
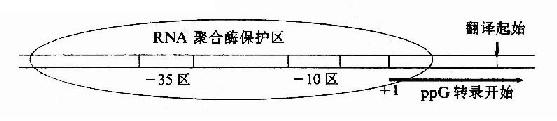
图19-4 原核生物基因转录起始区
不同的启动子序列不同,与RNA聚合酶的亲和力不同,启动转录的频率高低不同,即不同的启动子起动基因转录的强弱不同,例如:PL、PR、PT7属强启动子,而P1ac则是较弱的启动。
(三)操纵子
操纵子(operator)是指能被调控蛋白特异性结合的一段DNA序列,常与启动子邻近或与启动子序列重叠,当调控蛋白结合在操纵子序列上,会影响其下游基因转录的强弱。以前许多书中将操纵子称为操纵基因(operator gene)。但现在基因定义是为蛋白质编码的核酸序列,而操纵序列并不是编码蛋白质的基因,却是起着调控基因表达强弱的作用,正如启动序列不叫启动基因而称为启动子一样,操纵序列就可称为操纵子。以前将operon译为操纵子则可改译为操纵元,即基因表达操纵的单元之意。
举乳糖操纵元中的操纵子为例,如图19-5所示,其操纵子(o)序列位于启动子(p)与被调控的基因之间,部分序列与启动子序列重叠。仔细分析该操纵子序列,可见这段双链DNA具有回文(palindrome)样的对称性一级结构,能形成十字形的茎环(stem loop)构造。不少操纵子都具有类似的对称性序列,可能与特定蛋白质的结合相关。
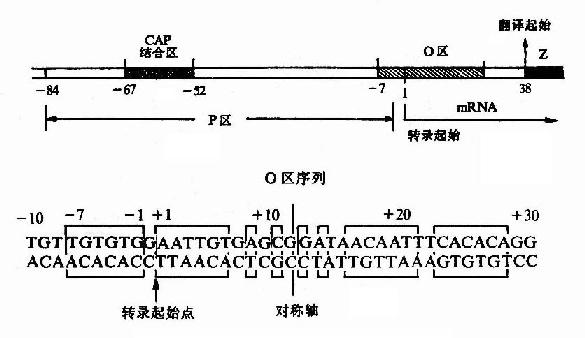
图19-5 乳糖操纵元的P-O区及O区序列
阻遏蛋白与操纵子结合,就妨碍了RNA聚合酶与启动子的结合及其后β-半乳糖苷酶等基因的转录起始,从而阻遏了这群基因的表达。最早只把与阻遏蛋白结合、起阻遏作用的序列称为操纵子,但其后发现有的操纵元中同一操纵序列与不同构像的蛋白质结合,可以分别起阻遏或激活基因表达的作用,阿拉伯糖操纵元中的序列就是典型的例子。因而凡能与调控蛋白特异性结合、从而影响基因转录强弱的序列,不论其对基因转录的作用是减弱、阻止或增强、开放,都可称为操纵子。
(四)调控基因
调控基因(regulatorygene)是编码能与操纵序列结合的调控蛋白的基因。与操纵子结合后能减弱或阻止其调控基因转录的调控蛋白称为阻遏蛋白(repressive protein),其介导的调控方式称为负性调控(negativeregulation);与操纵子结合后能增强或起动调控基因转录的调控蛋白称为激活蛋白(activatingprotein),所介导的调控方式称为正性调控(positive regulation)。
某些特定的物质能与调控蛋白结合,使调控蛋白的空间构像发生变化,从而改变其对基因录的影响,这些特定物质可称为效应物(effector),其中凡能引起诱导发生的分子称为诱导剂(inducer),能导致阻遏发生的分子称为阻遏剂或辅助阻遏剂(corepressor)。
例如在乳糖操纵元中,调控基因1acI位于P1ac邻近,有其自身的启动子和终止子,转录方向和结构基因群的转录方向一致,编码产生由347个氨基酸组成的调控蛋白R,在环境没有乳糖存在的情况下,R形成分子量为152000的活性四聚体,能特异地与操纵子o紧密结合,从而阻止利用乳糖的酶类基因的转录,所以R是乳糖操纵元的阻遏蛋白;当环境中有足够的乳糖时,乳糖受β-半乳糖苷酶作用转变为别乳糖,别乳糖与R结合,使R的空间构像变化,四聚体解聚成单体,失去与操纵子特异性紧密结合的能力,从而解除了阻遏蛋白的作用,使其后的基因得以转录合成利用乳糖的酶类。在这过程中乳糖(实际起作用的是别乳糖)就是诱导剂,与R结合起到去阻遏作用(derepression),诱导了利用乳糖的酶类基因转录开放。
许多调控蛋白都是变构蛋白(allostericprotein),通过与上述类似的方式与效应物结合变空间构像,从而改变活性,起到调节基因转录表达的作用。
(五)终止子
终止子(terminatorT)是给予RNA聚合酶转录终止信号的DNA序列。在一个操纵元中至少在构基因群最后一个基因的后面有一个终止子。
终止子按其作用是否需蛋白因子的协助至少可以分为两类:一类是不依赖ρ因子(蛋白性终止因子)的终止子,这类终止子在序列上有一些共通的特点,即有一段富含GC的反向重复序列(inverted repeat sequence),其后跟随一段富含AT的序列(见图19-6),因而转录生成的mRNA的序列中能形成发夹式结构,后继一连串U,正是RNA聚合酶转录生成的这段mRNA的结构阻止RNA聚合酶继续沿DNA移动,并使聚合酶从DNA链上脱落下来,终止转录。另一类是依赖ρ因子的终止子,即其终止转录的作用需要ρ因子的协同,或至少是受ρ因子的影响。
图19-6 原核生物终止子的结构
不同的终止子的作用也有强弱之分,有的终止子几乎能完全停止转录;有的则只是部分终止转录,一部分RNA聚合酶能越过这类终止序列继续沿DNA移动并转录。如果一串结构基因群中间有这种弱终止子的存在,则前后转录产物的量会有所不同,这也是终止子调节基因群中不同基因表达产物比例的一种方式。有的蛋白因子能作用于终止序列,减弱或取消终止子的作用,称为抗终止作用(antitermination),这种蛋白因子就称为抗终止因子(antiterminator)。
以上5种元件是每一个操纵元必定含有的。其中启动子、操纵子位于紧邻结构基因群的上游,终止子在结构基因群之后,它们都在结构基因的附近,只能对同一条DNA链上的基因表达起调控作用,这种作用在遗传学实验上称为顺式作用(cisaction),启动子、操纵子和终止子就属于顺式作用元件(cisacting element)。调控基因可以在结构基因群附近、也可以远离结构基因,它是通过其基因产物棗调控蛋白来发挥作用的,因而调控基因不仅能对同一条DNA链上的结构基因起表达调控作用,而且能对不在一条DNA链上的结构基因起作用,在遗传学实验上称为反式作用(transaction),调控基因就属于反式作用元件(transacting element),其编码产生的调控蛋白称为反式调控因子(transacting factor)。
由此也可窥测到,基因表达调控机理的关键在蛋白质与核酸的相互作用上。
三、乳糖操纵元的表达调控
如上所述乳糖操纵元的结构及其基因表达调控可综合于图19-7。
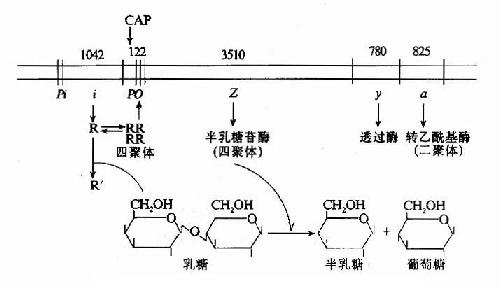
图19-7 乳糖操纵元的结构及调控示意图
(一)阻遏蛋白的负性调控
当大肠杆菌在没有乳糖的环境中生存时,1ac操纵元处于阻遏状态。i基因在其自身的启动子Pi控制下,低水平、组成性表达产生阻遏蛋白R,每个细胞中仅维持约10个分子的阻遏蛋白。R以四聚体形式与操纵子o结合,阻碍了RNA聚合酶与启动子P1ac的结合,阻止了基因的转录起动。R的阻遏作用不是绝对的,R与o偶尔解离,使细胞中还有极低水平的β-半乳糖苷酶及透过酶的生成。
当有乳糖存在时,乳糖受β-半乳糖苷酶的催化转变为别乳糖,与R结合,使R构象变化,R四聚体解聚成单体,失去与o的亲和力,与o解离,基因转录开放,β-半乳糖苷酶在细胞内的含量可增加1000倍。这就是乳糖对1ac操纵元的诱导作用。
一些化学合成的乳糖类似物,不受β-半乳糖苷酶的催化分解,却也能与R特异性结合,使R构象变化,诱导1ac操纵元的开放。例如异丙基硫代半乳糖苷(isopropylthiogalactoside,IPTG)就是很强的诱导剂,不被细胞代谢而十分稳定。X-gal(5-溴-4-氯-3-吲哚-β-半乳糖苷)也是一种人工化学合成的半乳糖苷,可被β-半乳糖苷酶水解产生兰色化合物,因此可以用作β-半乳糖苷酶活性的指示剂。IPTG和Xgal都被广泛应用在分子生物学和基因工程的工作中。
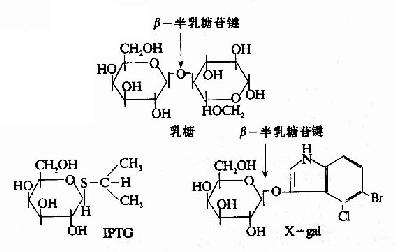
图19-8 乳糖,IPTG和Xgal的结构
(二)CAP的正性调控
细菌中的cAMP含量与葡萄糖的分解代谢有关,当细菌利用葡萄糖分解供给能量时,cAMP生成少而分解多,cAMP含量低;相反,当环境中无葡萄糖可供利用时,cAMP含量就升高。细菌中有一种能与cAMP特异结合的cAMP受体蛋白CRP(cAMp receptor protein),当CRP未与cAMP结合时它是没有活性的,当cAMP浓度升高时,CRP与cAMP结合并发生空间构象的变化而活化,称为CAP(CRPcAMp activated protein),能以二聚体的方式与特定的DNA序列结合。
在1ac操纵元的启动子P1ac上游端有一段与Plac部分重叠的序列,能与CAP特异结合,称为CAP结合位点(CApbinding site)。CAP与这段序列结合时,可增强RNA聚合酶的转录活性,使转录提高50倍。相反,当有葡萄糖可供分解利用时,cAMP浓度降低,CRP不能被活化,1ac操纵元的结构基因表达下降。
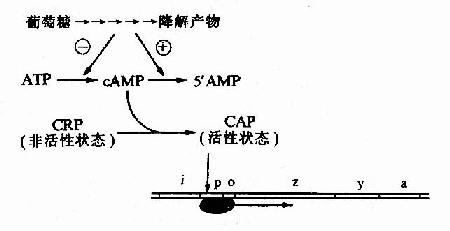
图19-9 葡萄糖利用对乳糖操纵元的影响
由于P1ac是弱启动子,单纯因乳糖的存在发生去阻遏使1ac操纵元转录开放,还不能使细胞很好利用乳糖,必须同时有CAP来加强转录活性,细菌才能合成足够的酶来利用乳糖。1ac操纵元的强诱导既需要有乳糖的存在,又需要没有葡萄糖可供利用。通过这种机制,细菌优先利用环境中的葡萄糖,只有无葡萄糖而又有乳糖时,细菌才去充分利用乳糖。
细菌对葡萄糖以外的其他糖(如阿拉伯糖、半乳糖、麦芽糖等)的利用上也有类似对乳糖利的情况,在含有编码利用阿拉伯糖的酶类基因群的阿拉伯糖操纵元(araoperon)、半乳糖操纵元(gal operon)中也有CAP结合位点,CAP也起类似的正性调控作用。所以CAP的通用名称是分解代谢基因激活蛋白(catabolic gene activator protein)。
不难看出:CAP结合位点就是一种起正性调控作用的操纵子,CAP则是对转录起正性作用的控蛋白棗激活蛋白,编码CRP的基因也是一个调控基因,不过它并不在1ac操纵元的附近,CAP可以对几个操纵元都起作用。
从上所述,乳糖操纵元属于可诱导操纵元(inducible operon),这类操纵元通常是关闭的,当受效应物作用后诱导开放转录。这类操纵元使细菌能适应环境的变化,最有效地利用环境能提供的能源底物。
四、色氨酸操纵元
色氨酸是构成蛋白质的组分,一般的环境难以给细菌提供足够的色氨酸,细菌要生存繁殖通常需要自己经过许多步骤合成色氨酸,但是一旦环境能够提供色氨酸时,细菌就会充分利用外界的色氨酸、减少或停止合成色氨酸,以减轻自己的负担。细菌所以能做到这点是因为有色氨酸操纵元(trp operon)的调控。
(一)色氨酸操纵元的结构与阻遏蛋白的负性调控
如图19-10所示,合成色氨酸所需要酶类的基因E、D、C、B、A等头尾相接串连排列组成结构基因群,受其上游的启动子Ptrp和操纵子o的调控,调控基因trpR的位置远离P-o-结构基因群,在其自身的启动子作用下,以组成性方式低水平表达分子量为47000的调控蛋白R。R并没有与o结合的活性,当环境能提供足够浓度的色氨酸时,R与色氨酸结合后构象变化而活化,就能够与o特异性亲和结合,阻遏结构基因的转录,因此这是属于一种负性调控的、可阻遏的操纵元(repressible operon),即这操纵元通常是开放转录的,当有效应物(色氨酸为阻遏剂)作用时,则阻遏关闭转录。细菌不少生物合成系统的操纵元都属于这种类型,其调控可使细菌处在生存繁殖最经济最节省的状态。
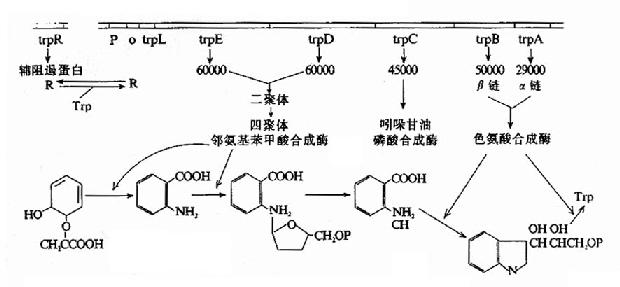
图19-10 色氨酸操纵元的结构和调控示意图
(二)衰减子及其作用
实验观察表明:当色氨酸达到一定浓度,但还没有高到能够活化R使其起阻遏作用的程度时,产生色氨酸合成酶类的量已经明显降低,而且产生的酶量与色氨酸浓度呈负相关。仔细研究发现这种调控现象与色氨酸操纵元特殊的结构有关。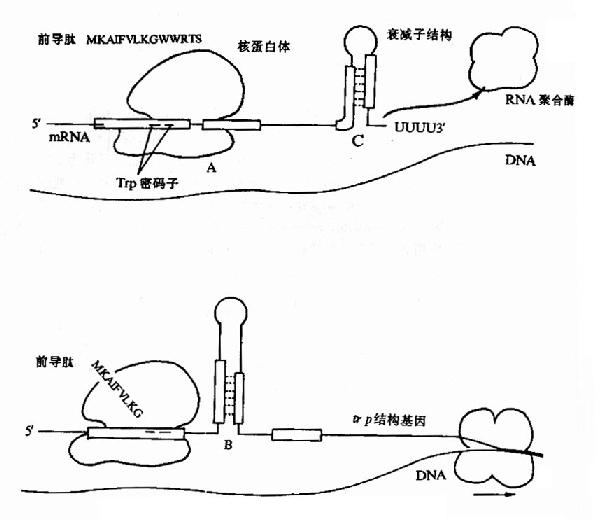
图19-11 色氨酸操纵元中的衰减子结构及其调控示意图
在色氨酸操纵元Ptrp-o与第一个结构基因trpE之间有162bp的一段先导序列(leadingsequence,L)实验证明当色氨酸达一定浓度时,RNA聚合酶的转录会终止在这里。这段序列中含有编码由14个氨基酸组成的短肽的开放读框,其序列中有2个色氨酸相连,在此开放读框前有核糖体识别结合位点(RBS)序列,提示这段短开放读框在转录后是能被翻译的。在先导序列的后半段含有3对反向重复序列(图19?1中A、B及C),在被转录生成mRNA时都能够形成发夹式结构,但由于B的序列分别与A和C重叠,所以如果B形成发夹结构,A和C都不能再形成发夹结构;相反,当A形成发夹结构时,B就不能形成发夹结构,却有利于C生成发夹结构。C后面紧跟一串A(转录成RNA就是一串U),C实际上是一个终止子,如果转录mRNA时它形成发夹结构,就能使RNA聚合酶停止转录而从mRNA上脱离下来。
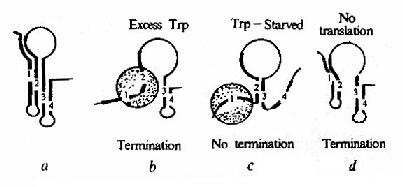
图19-12 三种不同情况下A、B、C形成发夹结构的状态
在色氨酸未达到能起阻遏作用的浓度时,从Ptrp起始转录,RNA聚合酶沿DNA转录合成mRNA,同时核糖体就结合到新生成的mRNA核糖体结合位点上开始翻译。当色氨酸浓度低时,生成的tRNAtrp色氨酸量就少,能扩散到核糖体mRNA形成的翻译复合体中供给合成短肽的几率低,使核糖体沿mRNA翻译移动的速度慢,赶不上RNA聚合酶沿DNA移动转录的速度,这时核糖体占据短开放读框的机会较多,使A不能生成发夹结构,于是B就形成发夹结构,阻止了C生成终止信号的结构,RNA聚合酶得以沿DNA前进,继续去转录其后trpE等基因,trp操纵元就处于开放状态。当色氨酸浓度增高时,tRNAtrp色氨酸浓度随之升高,核糖体沿mRNA翻译移动的速度加快,占据到B段的机会增加,B生成发夹结构的机会减少,C形成终止结构的机会增多,RNA聚合酶终止转录的的几率增加,于是转录减弱。如果当其他氨基酸短缺(注意:短开放读框编码的14肽中多数氨基酸能由环境充分供应的机会是不多的)或所有的氨基酸都不足时,核糖体翻译移动的速度就更慢,甚至不能占据A的序列,结果有利于A和C发夹结构的形成,于是RNA聚合酶停止转录,等于告诉细菌:“整个氨基酸都不足,即使合成色氨酸也不能合成蛋白质,不如不合成以节省能量”。
由此可见,先导序列起到随色氨酸浓度升高降低转录的作用,这段序列就称为衰减子attenuator)。在trp操纵元中,对结构基因的转录阻遏蛋白的负调控起到粗调的作用,而衰减子起到细调的作用。细菌其他氨基酸合成系统的许多操纵元(如组氨酸、苏氨酸、亮氨酸、异亮氨酸、苯丙氨酸等操纵元)中也有类似的衰减子存在。
第三节 真核基因表达调控
一、真核基因组的复杂性
与原核生物比较,真核生物的基因组更为复杂,可列举如下。
▲真核基因组比原核基因组大得多,大肠杆菌基因组约4×106bp,哺乳类基因组在109bp数量级,比细菌大千倍;大肠杆菌约有4000个基因,人则约有10万个基因。
▲真核生物主要的遗传物质与组蛋白等构成染色质,被包裹在核膜内,核外还有遗传成分(如线粒体DNA等),这就增加了基因表达调控的层次和复杂性。
▲原核生物的基因组基本上是单倍体,而真核基因组是二倍体。
▲如前所述,细菌多数基因按功能相关成串排列,组成操纵元的基因表达调控的单元,共同开启或关闭,转录出多顺反子(polycistron)的mRNA;真核生物则是一个结构基因转录生成一条mRNA,即mRNA是单顺反子(monocistron),基本上没有操纵元的结构,而真核细胞的许多活性蛋白是由相同和不同的多肽形成的亚基构成的,这就涉及到多个基因协调表达的问题,真核生物基因协调表达要比原核生物复杂得多。
▲原核基因组的大部分序列都为基因编码,而核酸杂交等实验表明:哺乳类基因组中仅约10%的序列为蛋白质、rRNA、tRNA等编码,其余约90%的序列功能至今还不清楚。
▲原核生物的基因为蛋白质编码的序列绝大多数是连续的,而真核生物为蛋白质编码的基因绝大多数是不连续的,即有外显子(exon)和内含子(intron),转录后需经剪接(splicing)去除内含子,才能翻译获得完整的蛋白质,这就增加了基因表达调控的环节。
▲原核基因组中除rRNA、tRNA基因有多个拷贝外,重复序列不多。哺乳动物基因组中则存在大量重复序列(repetitive sequences)。用复性动力学等实验表明有三类重复序列:①高度重复序列(highly repetitive sequences),这类序列一般较短,长10-300bp,在哺乳类基因组中重复106次左右,占基因组DNA序列总量的10-60%,人的基因组中这类序列约占20%,功能还不明了。②中度重复序列(moderatelyrepetitive sequences),这类序列多数长100-500bp,重复101-105次,占基因组10-40%。例如哺乳类中含量最多的一种称为Alu的序列,长约300bp,在哺乳类不同种属间相似,在基因组中重复3-×105次,在人的基因组中约占7%,功能也还不很清楚。在人的基因组中18S/28SrRNA基因重复280次,5SrRNA基因重复2000次,tRNA基因重复1300次,5种组蛋白的基因串连成簇重复30-40次,这些基因都可归入中度重复序列范围。③单拷贝序列(single copy sequences)。这类序列基本上不重复,占哺乳类基因组的50-80%,在人基因组中约占65%。绝大多数真核生物为蛋白质编码的基因在单倍体基因组中都不重复,是单拷贝的基因。
从上述可见真核基因组比原核基因组复杂得多,至今人类对真核基因组的认识还很有限,使现在国际上制订的人基因组研究计划(human gene project)完成,绘出人全部基因的染色体定位图,测出人基因组109bp全部DNA序列后,要搞清楚人全部基因的功能及其相互关系,特别是要明了基因表达调控的全部规律,还需要经历很长期艰巨的研究过程。
二、真核基因表达调控的特点
尽管我们现在对真核基因表达调控知道还不多,但与原核生物比较它具有一些明显的特点。
(一)真核基因表达调控的环节更多
如前所述,基因表达是基因经过转录、翻译、产生有生物活性的蛋白质的整个过程。同原核生物一样,转录依然是真核生物基因表达调控的主要环节。但真核基因转录发生在细胞核(线粒体基因的转录在线粒体内),翻译则多在胞浆,两个过程是分开的,因此其调控增加了更多的环节和复杂性,转录后的调控占有了更多的分量。图19-13扼要地列出真核基因表达的各个可能的环节。
图19-13 真核生物基因表达调控的可能环节
图19-13总结了以前章节叙述过的基因表达过程,并作了一些新补充。图中标出了真核细胞在分化过程中会发生基因重排(gene rearrangement),即胚原性基因组中某些基因会再组合变化形成第二级基因。例如编码完整抗体蛋白的基因是在淋巴细胞分化发育过程中,由原来分开的几百个不同的可变区基因经选择、组合、变化,与恒定区基因一起构成稳定的、为特定的完整抗体蛋白编码的可表达的基因。这种基因重排使细胞可能利用几百个抗体基因的片段,组合变化而产生能编码达108种不同抗体的基因,其中就有复杂的基因表达调控机理。
此外,真核细胞中还会发生基因扩增(geneamplification),即基因组中的特定段落在某些情况下会复制产生许多拷贝。最早发现的是蛙的成熟卵细胞在受精后的发育过程中其rRNA基因(可称为rDNA)可扩增2000倍,以后发现其他动物的卵细胞也有同样的情况,这很显然适合了受精后迅速发育分裂要合成大量蛋白质,需要有大量核糖体。又如MTX(methotrexate)是叶酸的结构类似物,一些哺乳类细胞会对含有利用叶酸所必需的二氢叶酸还原酶(dihydrofolate reductase, DHFR)基因的DNA区段扩增40?00倍,使DHFR的表达量显著增加,从而提高对MTX的抗性。基因的扩增无疑能够大幅度提高基因表达产物的量,但这种调控机理至今还不清楚。
(二)真核基因的转录与染色质的结构变化相关
真核基因组DNA绝大部分都在细胞核内与组蛋白等结合成染色质,染色质的结构、染色质中NA和组蛋白的结构状态都影响转录,至少有以下现象:
1.染色质结构影响基因转录 细胞分裂时染色体的大部分到间期时松开分散在核内,称为常染色质(euchromatin),松散的染色质中的基因可以转录。染色体中的某些区段到分裂期后不像其他部分解旋松开,仍保持紧凑折叠的结构,在间期核中可以看到其浓集的斑块,称为异染色质(heterochromatin),其中从未见有基因转录表达;原本在常染色质中表达的基因如移到异染色质内也会停止表达;哺乳类雌体细胞2条X染色体,到间期一条变成异染色质者,这条X染色体上的基因就全部失活。可见紧密的染色质结构阻止基因表达。
2.组蛋白的作用 早期体外实验观察到组蛋白与DNA结合阻止DNA上基因的转录,去除组蛋基因又能够转录。组蛋白是碱性蛋白质,带正电荷,可与DNA链上带负电荷的磷酸基相结合,从而遮蔽了DNA分子,妨碍了转录,可能扮演了非特异性阻遏蛋白的作用;染色质中的非组蛋白成分具有组织细胞特异性,可能消除组蛋白的阻遏,起到特异性的去阻遏促转录作用。
发现核小体后,进一步观察核小体结构与基因转录的关系,发现活跃转录的染色质区段,有富含赖氨酸的组蛋白(H1组蛋白)水平降低,H2A·H2B组蛋白二聚体不稳定性增加、组蛋白乙酰化(acetylation)和泛素化(ubiquitination),以及H3组蛋白巯基化等现象,这些都是核小体不稳定或解体的因素或指征。转录活跃的区域也常缺乏核小体的结构。这些都表明核小体结构影响基因转录。
3.转录活跃区域对核酸酶作用敏感度增加 染色质DNA受DNase Ⅰ作用通常会被降解成00、400……bp的片段,反映了完整的核小体规则的重复结构。但活跃进行转录的染色质区域受DNase Ⅰ消化常出现100-200bp的DNA片段,且长短不均一,说明其DNA受组蛋白掩盖的结构有变化,出现了对DNase Ⅰ高敏感点(hypersensitive site)。这种高敏感点常出现在转录基因的5′侧区(5′flanking region)、3′末端或在基因上,多在调控蛋白结合位点的附近,分析该区域核小体的结构发生变化,可能有利于调控蛋白结合而促进转录。
4.DNA拓扑结构变化 天然双链DNA的构象大多是负性超螺旋。当基因活跃转录时,RNA聚合酶转录方向前方DNA的构象是正性超螺旋,其后面的DNA为负性超螺旋。正性超螺旋会拆散核小体,有利于RNA聚合酶向前移动转录;而负性超螺旋则有利于核小体的再形成。
5.DNA碱基修饰变化 真核DNA中的胞嘧啶约有5%被甲基化为5甲基胞嘧啶(5methylcytidine,m5C),而活跃转录的DNA段落中胞嘧啶甲基化程度常较低。这种甲基化最常发生在某些基因5′侧区的CpG序列中,实验表明这段序列甲基化可使其后的基因不能转录,甲基化可能阻碍转录因子与DNA特定部位的结合从而影响转录。如果用基因打靶的方法除去主要的DNA甲基化酶,小鼠的胚胎就不能正常发育而死亡,可见DNA的甲基化对基因表达调控是重要的。
由此可见,染色质中的基因转录前先要有一个被激活的过程,但目前对激活机制还缺乏认识。
(三)真核基因表达以正性调控为主
真核RNA聚合酶对启动子的亲和力很低,基本上不依靠自身来起始转录,需要依赖多种激活蛋白的协同作用。真核基因调控中虽然也发现有负性调控组件,但其存在并不普遍;真核基因转录表达的调控蛋白也有起阻遏和激活作用或兼有两种作用者,但总的是以激活蛋白的作用为主。即多数真核基因在没有调控蛋白作用时是不转录的,需要表达时就要有激活的蛋白质来促进转录。换言之:真核基因表达以正性调控为主导。
三、真核基因转录水平的调控
真核细胞的三种RNA聚合酶(Ⅰ、Ⅱ和Ⅲ)中,只有RNA聚合酶Ⅱ能转录生成mRNA,以下主要讨论RNA聚合酶Ⅱ的转录调控。
(一)顺式作用组件(cisacting elements)
真核基因的顺式调控组件是基因周围能与特异转录因子结合而影响转录的DNA序列。其中主要是起正性调控作用的顺式作用组件,包括启动子(promoter)、增强子(enhancer);近年又发现起负性调控作用的组件枣沉寂子(silencer)。
1.启动子 与原核启动子的含义相同,是指RNA聚合酶结合并起动转录的DNA序列。但真核同启动子间不像原核那样有明显共同一致的序列,而且单靠RNA聚合酶难以结合DNA而起动转录,而是需要多种蛋白质因子的相互协调作用,不同蛋白质因子又能与不同DNA序列相互作用,不同基因转录起始及其调控所需的蛋白因子也不完全相同,因而不同启动子序列也很不相同,要比原核更复杂、序列也更长。真核启动子一般包括转录起始点及其上游约100-200bp序列,包含有若干具有独立功能的DNA序列元件,每个元件约长7-30bp。最常见的哺乳类RNA聚合酶Ⅱ启动子中的元件序列见表19-1。
表19-1 哺乳类RNA聚合酶Ⅱ启动子中常见的元件
| 元件名称 | 共同序列 | 结合的蛋白因子 | ||
| 名称 | 分子量 | 结合DNA长度 | ||
| TATAbox | TATAAAA | TBP | 30,000 | ~10bp |
| GC box | GGGCGG | SP-1 | 105,000 | ~20bp |
| CAA box | GGCCAATCT | CTF/NF1 | 60,000 | ~22bp |
| Octamer | ATTTGCAT | Oct-1 | 76,000 | ~10bp |
| Oct-2 | 53,000 | ~20bp | ||
| kB | GGGACTTTCC | NFkB | 44,000 | ~10bp |
| ATF | GTGACGT | AFT | ? | 20bp |
启动子中的元件可以分为两种:
①核心启动子元件(core promoter element) 指RNA聚合酶起始转录所必需的最小的DNA序列,包括转录起始点及其上游-25/-30bp处的TATA盒。核心元件单独起作用时只能确定转录起始位点和产生基础水平的转录。
②上游启动子元件(upstream promoter element) 包括通常位于-70bp附近的CAAT盒和GC盒、以及距转录起始点更远的上游元件。这些元件与相应的蛋白因子结合能提高或改变转录效率。不同基因具有不同的上游启动子元件,其位置也不相同,这使得不同的基因表达分别有不同的调控。图19-14以人金属硫蛋白基因为例子,说明真核基因上游启动子元件的组织情况和各元件相应结合的转录因子。
图19-14 人金属硫蛋白基因的调控区
2.增强子 是一种能够提高转录效率的顺式调控元件,最早是在SV40病毒中发现的长约200bp的一段DNA,可使旁侧的基因转录提高100倍,其后在多种真核生物,甚至在原核生物中都发现了增强子。增强子通常占100-200bp长度,也和启动子一样由若干组件构成,基本核心组件常为8-12bp,可以单拷贝或多拷贝串连形式存在。增强子的作用有以下特点:
①增强子提高同一条DNA链上基因转录效率,可以远距离作用,通常可距离1-4kb、个别情况下离开所调控的基因30kb仍能发挥作用,而且在基因的上游或下游都能起作用。
②增强子作用与其序列的正反方向无关,将增强子方向倒置依然能起作用。而将启动子倒就不能起作用,可见增强子与启动子是很不相同的。
③增强子要有启动子才能发挥作用,没有启动子存在,增强子不能表现活性。但增强子对动子没有严格的专一性,同一增强子可以影响不同类型启动子的转录。例如当含有增强子的病毒基因组整合入宿主细胞基因组时,能够增强整合区附近宿主某些基因的转录;当增强子随某些染色体段落移位时,也能提高移到的新位置周围基因的转录。使某些癌基因转录表达增强,可能是肿瘤发生的因素之一。
④增强子的作用机理虽然还不明确,但与其他顺式调控元件一样,必须与特定的蛋白质因结合后才能发挥增强转录的作用。增强子一般具有组织或细胞特异性,许多增强子只在某些细胞或组织中表现活性,是由这些细胞或组织中具有的特异性蛋白质因子所决定的。
3.沉寂子 最早在酵母中发现,以后在T淋巴细胞的T抗原受体基因的转录和重排中证实这种负调控顺式元件的存在。目前对这种在基因转录降低或关闭中起作用的序列研究还不多,但从已有的例子看到:沉寂子的作用可不受序列方向的影响,也能远距离发挥作用,并可对异源基因的表达起作用。
(二)反式作用因子(transactingfactors)
以反式作用影响转录的因子可统称为转录因子(transcription factors, TF)。RNA聚合酶是一种反式作用于转录的蛋白因子。在真核细胞中RNA聚合酶通常不能单独发挥转录作用,而需要与其他转录因子共同协作。与RNA聚合酶Ⅰ、Ⅱ、Ⅲ相应的转录因子分别称为TFⅠ、TFⅡ、TFⅢ,对TFⅡ研究最多。表19-2列出真核基因转录需要基本的TFⅡ。
表19-2 RNA聚合酶Ⅱ的基本转录因子
| 转录因子 | 分子量(kD) | 功能 |
| TBP | 30 | 与TATA盒结合 |
| TFⅡ-B | 33 | 介导RNA聚合酶Ⅱ的结合 |
| TFⅡ-F | 30,74 | 解旋酶 |
| TFⅡ-E | 34,37 | ATP酶 |
| TFⅡ-H | 62,89 | 解旋酶 |
| TFⅡ-A | 12,19,35 | 稳定TFⅡ-D的结合 |
| TFⅡ-I | 120 | 促进TFⅡ-D的结合 |
以前认为与TATA盒结合的蛋白因子是TFⅡ-D,后来发现TFⅡ-D实际包括两类成分:与TATA盒结合的蛋白是TBP(TATAbox binding protein),是唯一能识别TATA盒并与其结合的转录因子,是三种RNA聚合酶转录时都需要的;其他称为TBP相关因子(TBPassociated factors TAF),至少包括8种能与TBP紧密结合的因子。转录前先是TFⅡ-D与TATA盒结合;继而TFⅡ-B以其C端与TBP-DNA复合体结合,其N端则能与RNA聚合酶Ⅱ亲和结合,接着由两个亚基组成的TFⅡ-F加入装配,TFⅡ-F能与RNA聚合酶形成复合体,还具有依赖于ATP供给能量的DNA解旋酶活性,能解开前方的DNA双螺旋,在转录链延伸中起作用。这样,启动子序列就与TFⅡ-D、B、F及RNA聚合酶Ⅱ结合形成一个“最低限度”能有转录功能基础的转录前起始复合物(preintitiationcomplex, PIC),能转录mRNA。TFⅡ-H是多亚基蛋白复合体,具有依赖于ATP供给能量的DNA解旋酶活性,在转录链延伸中发挥作用;TFⅡ-E是两个亚基组成的四聚体,不直接与DNA结合而可能是与TFⅡ-B联系,能提高ATP酶的活性;TFⅡ-E和TFⅡ-H的加入就形成完整的转录复合体(图19?5),能转录延伸生成长链RNA,TFⅡ-A能稳定TFⅡ-D与TATA盒的结合,提高转录效率,但不是转录复合体一定需要的。
图19-15 RNA聚合酶Ⅱ转录复合体的形成示意图
以上所述是典型的启动子上转录复合体的形成,但有的真核启动子不含TATA盒或不通过TATA盒开始转录。例如有的无TATA盒的启动子是靠TFⅡ-I和TFⅡ-D共同组成稳定的转录起始复合体开始转录的。由此可以看到真核转录起始的复杂性。
不同基因由不同的上游启动子元件组成,能与不同的转录因子结合,这些转录因子通过与基础的转录复合体作用而影响转录的效率。现在已经发现有许多不同的转录因子,看到的现象是:同一DNA序列可被不同的蛋白因子所识别;能直接结合DNA序列的蛋白因子是少数,但不同的蛋白因子间可以相互作用,因而多数转录因子是通过蛋白质-蛋白质间作用与DNA序列联系并影响转录效率的(见图19-16)。转录因子之间或转录因子与DNA的结合都会引起构象的变化,从而影响转录的效率。
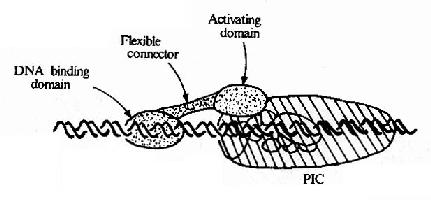
图19-16 转录因子与转录复合体相互作用模式图
图19-16所示,作为蛋白质的转录因子从功能上分析其结构可包含有不同区域,①DNA结合域(DNa binding domain),多由60-100个氨基酸残基组织的几个亚区组成;②转录激活域(activating domain),常由30-100氨基酸残基组成,这结构域有富含酸性氨基酸、富含谷氨酰胺、富含脯氨酸等不同种类,以酸性结构域最多见;③连接区,即连接上两个结构域的部分。不与DNA直接结合的转录因子没有DNA结合域,但能通过转录激活域直接或间接作用于转录复合体而影响转录效率。
与DNA结合的转录因子大多以二聚体形式起作用,与DNA结合的功能域常见有以下几种:
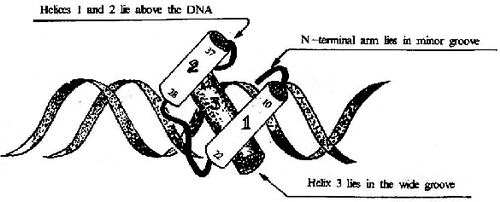
图19-17 HTH结构及其与DNA的结合
①螺旋转角螺旋(helixturnhelix, HTH)及螺旋-环-螺旋(helixloophelix,HLH) 这类结构至少有两个α螺旋,其间由短肽段形成的转角或环连接,两个这样的motif结构以二聚体形式相连,距离正好相当于DNA一个螺距(3.4nm),两个α螺旋刚好分别嵌入DNA的深沟(图19-17)。
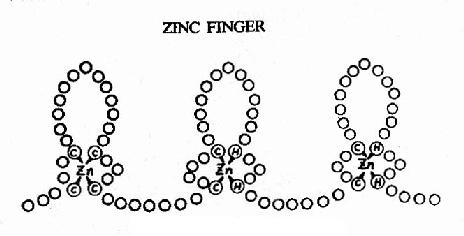
图19-18 蛋白质的锌指结构
②锌指(zinc finger) 其结构如图19-18所示,每个重复的“指”状结构约含23个氨基酸残基,锌以4个配价键与4个半胱氨酸、或2个半胱氨酸和2个组氨酸相结合。整个蛋白质分子可有2?个这样的锌指重复单位。每一个单位可以其指部伸入DNA双螺旋的深沟,接触5个核苷酸。例如与GC盒结合的转录因子SP1中就有连续的3个锌指重复结构。
③碱性-亮氨酸拉链(basic leucine zipper, bZIP),该结构的特点是蛋白质分子的肽链上每隔6个氨基酸就有一个亮氨酸残基,结果就导致这些亮氨酸残基都在α螺旋的同一个方向出现。两个相同结构的两排亮氨酸残基就能以疏水键结合成二聚体,该二聚体的另一端的肽段富含碱性氨基酸残基,借其正电荷与DNA双螺旋链上带负电荷的磷酸基团结合。若不形成二聚体则对DNA的亲和结合力明显降低。在肝脏、小肠上皮、脂肪细胞和某些脑细胞中有称为C/EBP家族的一大类蛋白质能够与CAAT盒和病毒增强子结合,其特征就是能形成bZIP二聚体结构。
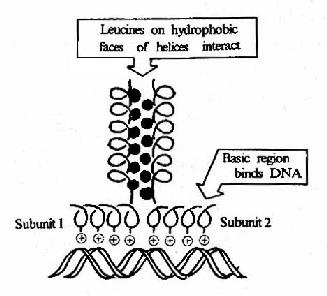
图19-19 碱性亮氨酸拉链结构及其与DNA的结合
从上述可见:转录调控的实质在于蛋白质与DNA、蛋白质与蛋白质之间的相互作用,构象的变化正是蛋白质和核酸“活”的表现。但对生物大分子间的辨认、相互作用、结构上的变化及其在生命活动中的意义,人们的认识和研究还只在起步阶段,其中许多内容甚至重要的规律我们可能至今还一无所知,有待于努力探索。
本章提要
基因表达是基因经过一系列步骤表现出其生物功能的整个过程,是受着严密、精确调控的。基因组含有生物体生存、发育、活动和繁殖所需要的全部遗传信息,但这些遗传信息并不同时全部都表达出来。不同的组织细胞、细胞分化发育不同时期,基因表达的种类和强度各不相同,决定着细胞的形态和功能;生物体能适应环境变化改变自身的基因表达以利生存,因而基因表达调控也是生命本质之所在。某些基因表达不大受环境影响,称为组成性表达;其中某些基因表达产物是细胞或生物体整个生命过程中都持续需要而必不可少的,这类基因称为看家基因。另一类基因表达易随环境信号而变化,称为适应性表达。环境变化,使基因表达水平提高者称为诱导,使基因表达水平降低者称为阻遏。
基因表达调控可以在复制、扩增、基因激活、转录、转录后、翻译和翻译后等多级水平上行,但mRNA转录起始是基因表达调控的基本控制点。转录起始调控的实质是DNA-蛋白质/蛋白质蛋白质间的相互作用对RNA聚合酶活性的影响。调控结果使基因表达水平提高的称为正性调控(上调),使基因表达水平降低者为负性调控(下调)。在同一条核酸链上起调控基因表达作用的核酸序列称为顺式作用元件;能对不同核酸链上的基因表达起调控作用的蛋白质称反式作用因子或转录因子。核酸链上的顺式作用元件与反式作用蛋白因子相互作用而调控基因表达。
多数原核生物的基因按功能相关性串连排列共同组成一个转录调控单位棗操纵元。第一个阐明的操纵元是1ac操纵元。操纵元最基本的组成元件有:受调控的结构基因群、启动子、操纵子、调控基因和终止子。有的操纵元还含有衰减子。在同一启动子控制下,从结构基因群转录合成多顺反子mRNA,实现协调表达。由调控基因编码合成的调控蛋白作用于操纵子序列,起到阻遏基因表达作用的称阻遏蛋白,起促进基因表达者为激活蛋白。调控蛋白可受特定的小分子作用发生变构而改变其对操纵子的作用,这是许多原核基因适应内外环境变化,改变表达水平的机理所在。
真核基因组比原核大得多,结构更复杂,含有许多重复序列,基因组的大部分序列不是为蛋白质编码的,而为蛋白质编码的基因绝大多数是不连续的。真核生物基本上是采取逐个基因调控表达的形式。真核基因表达调控的环节更多,转录前可以有基因的扩增或重排,并涉及染色质结构的改变、基因激活过程。转录后调控的方式也很多,但仍以转录起始调控为主。正性调控是真核基因调控的主导方面,RNA聚合酶的转录活性依赖于基本转录因子,在转录前先形成转录复合体,其转录效率受许多蛋白因子的影响,协调表达更为复杂。目前对真核基因表达调控的认识和研究还只处在初级阶段。
复习思考题
1.什么是基因表达?试述基因表达变化的特点及其调控对生物体的重要性。
2.为什么说转录起始的调控是基因表达调控的中心环节?
3.举实际例子说明操纵元的组成组件及其作用,并分析可阻遏的操纵元和可诱导的操纵元的调控方式。
4.比较真核和原核生物的基因表达和基因表达调控相似和不同之处。
5.论述启动子、增强子和转录因子的概念、结构、功能及其相互关系。
(陈苏民)
第二十章 DNA重组与基因工程DNARecombination and Genetic engineering
基因工程(geneticengineering)和遗传工程的英语中是同一个词汇。从字面上看,遗传工程就是按人们的意思去改造生物的遗传特性、或创建具有新遗传物性的生物。遗传是由基因决定的,改建生物的遗传性,就是改建生物的基因,因此狭义的遗传工程就是基因工程。
对多数生物来说,基因本质是DNA,基因工程就是要改建DNA,涉及DNA序列的重新组合和建造,所以基因工程的核心就是人工的DNA重组(DNa recombination)。
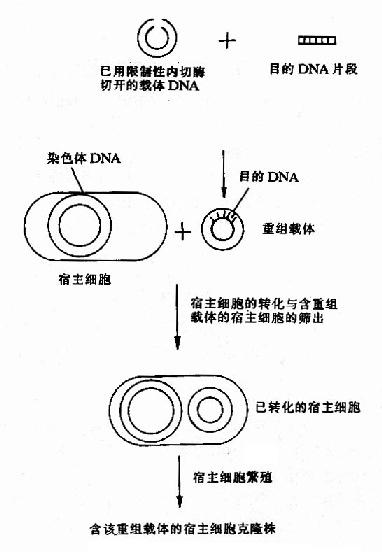
图20-1 基本工程的基本程序
重组、建造的DNA分子只有纯化繁殖才有意义。纯的无性繁殖系统称为克隆。纯化繁殖DNA就称为DNA克隆或分子克隆,基因的纯化繁殖就称为基因克隆。所以DNA重组和分子克隆是与基因工程密切不可分的,是基因工程技术的核心和主要组成部分。重组DNA、分子克隆甚至成了基因工程的代名词。
只有当人类对遗传现象本质和规律有深入的认识,才能按人类的意志去改造或创建生物的遗传特性。20世纪50-60年代分子遗传学的迅速发展,确定了主要遗传物质DNA的双螺旋结构、阐明了遗传信息传递的中心法则、破译了遗传密码,为基因工程奠定了理论基础;同时酶学、细菌学、病毒学的发展,为基因工程提供了必要的工具。1972-1973年Boyer、Cohn和Berg等创立了DNA克隆技术,打破了种属的界限,第一次使本来只存在于真核细胞中的蛋白质能够在大肠杆菌中合成,这是基因工程诞生的里程碑。科学界公认基因工程的出现是20世纪最重要的科学成就这一。标志人类主动改造生物界的能力进入新的阶段。分子生物学的成就是DNA重组技术和基因工程出现和发展的基础,而DNA重组技术和基因工程的发展又有力地推动着分子生物学的进步。
基因工程属于生物技术范畴,生物技术(biotechnology)不是一个独立的学科而是一套技术或手段。广义的生物技术指任何利用活的生物体或其一部分生产产品或改良生物品质的技术;狭义的生物技术是专指以DNA重组技术和单克隆技术为标志发展起来的新技术。如无特别说明,通常生物技术一词就专指新的生物技术而言。一般认为这新的生物技术包括基因工程、细胞工程、酶工程和发酵工程几方面的内容。基因工程是生物技术的核心和关键,是主导技术;细胞技术是生物技术的基础;酶工程是生物技术的条件;发酵工程是生物技术获得最终产品的手段,四个方面相互联系的。生物技术是一个综合技术体系,其中基因工程和细胞融合技术最为突出。蛋白质工程(protein engineering)则是在基因工程基础上综合蛋白质化学、蛋白质晶体学、计算机学辅助设计等知识和技术发展起来的研究新领域,开创了按人类意愿设计和研制人类需要的蛋白质的新时期,被称为第二代基因工程。
基因工程的基本程序见图20-1所示。
第一节 工具酶
DNA重组技术中对核酸的“精雕细刻”主要用酶作为工具。分子生物学研究过程中发现的酶,许多都用作工具,表20-列出最常用的几种工具酶。限制性核酸内切酶(restrictionendonuclease)在重组DNA技术中有重要地位,在此较详细介绍。
一、限制性核酸内切酶的概念
核酸酶可分为两类:核酸外切酶(exonuclease)是从核酸的一端开始,一个接一个把核苷酸水解下来;核酸内切酶(endonuclease)则从核酸链中间水解3’,5’磷酸二酯键,将核酸链切断。很多细菌和细胞中都能识别外来的核酸并将其分解,1962年发现这是因为细菌中含有特异的核酸内切酶,能识别特定的核酸序列而将核酸切断;同时又伴随有特定的核酸修饰酶,最常见的是甲基化酶,能使细胞自身核酸特定的序列上碱基甲基化,从而避免受内切酶水解,外来核酸没有这种特异的甲基化修饰,就会被细胞的核酸酶所水解.这样细胞就构成了限制一修饰体系,其功能就是保护自身的DNA,分解外来的DNA,以保护和维持自身遗传信息的稳定,这对细菌的生存和繁衍具有重要意义。这就是限制性核酸内切酶名称中“限制”二字概念的由来。
二、限制性核酸内切酶的命名
按酶的来源的属、种名而定,取属名的第一个字母与种名的头两个字母组成的三个斜体字母作略语表示;如有株名,再加上一个字母,其后再按发现的先后写上罗马数字。例如:从流感嗜血杆菌d株(Haemophilus influenzae d)中先后分离到3种限制酶,则分别命名为HindⅠ、HindⅡ和HindⅢ。
三、限制性核酸内切酶的分类
按限制酶的组成、与修饰酶活性关系,切断核酸的情况不同,分为三类:
Ⅰ类限制性核酸内切酶 由3种不同亚基构成,兼具有修饰酶活性和依赖于ATP的限制性内切酶活性,它能识别和结合于特定的DNA序列位点,去随机切断在识别位点以外的DNA序列,通常在识别位点周围400-700bp。这类酶的作用需要Mg2+,S腺苷甲硫氨酸及ATP。
Ⅱ类限制性核酸内切酶 与Ⅰ类酶相似,是多亚蛋白质,既有内切酶活性,又有修饰酶活性,切断位点在识别序列周围25-30bp范围内,酶促反应除Mg2+外,也需要ATP供给能量。
Ⅲ类限制性核酸内切酶 只由一条肽链构成,仅需Mg2+,切割DNA特异性最强,且就在识别位点范围内切断DNA。是分子生物学中应用最广的限制性内切酶。通常在重组DNA技术提到的限制性核酸内切酶主要指Ⅱ类酶而言。
表20-1 DNA重组技术中最常用的工具酶
| 酶 | 主要用途 |
| 限制性核酸内切酶 | 识别DNA特定序列,切断DNA链 |
| DNA聚合酶Ⅰ或其大片段(Klenow) | ①缺口平移制作标记DNA探针 ②合成cDNA的第二链 ③填补双链DNA3’凹端 ④DNA序列分析 |
| 耐热DNA聚合酶(Taq DNA聚合酶等) | 聚合酶链反应(PCR) |
| DNA连接酶 | 连接两个DNA分子或片段 |
| 多核苷酸激酶 | 催化多核苷酸5’羟基末端磷酸化,制备末端标记探针 |
| 末端转移酶 | 在3’末端加入同质多聚物尾 |
| SI核酸酶,绿豆核酸酶 | 降解单链DNA或RNA,使双链DNA突出端变为平端 |
| DNA端酶Ⅰ | 降解DNA,在双链DNA上产生随机切口 |
| RNA酶A | 降解除RNA |
| 磷酸酶 | 切除核酸末端磷酸基 |
四、限制性核酸内切酶的作用
大部分限制性核酸内切酶识别DNA序列具有回文结构特征,切断的双链DNA都产生5’磷酸基和3’羟基末端。不同限制性核酸内切酶识别和切割的特异性不同,结果有三种不同的情况:
①产生3’突出粘性末端(cohesive end):以Eoor 为例:
5’…G↓AATT C…3’→5’…Gp OHTTAAC…3’
3’…C ATAA↑G…5’EooP Ⅰ 3'… CTTAAOH pG…5'
②产生5’突出的粘性末端:以PstⅠ为例:
5’…CTGCA↓G…3’→5’…CTGCAp OHG…3’
3’…G↑ACGTC…5’PstⅠ 3’…GOH pACGTC…5
③产生平末端(blunt end):Nru Ⅰ为例:
5’…TCG↓CGA…3’→5’…TCGp OHCGA…3’
3’…AGC↑GCT…5’Nru Ⅰ3’…AGCOhpGCT…5’
不同有限制性核酸内切酶识别的DNA序列可以不相同。有的识别四核苷酸序列,有的识别六或八核苷酸序列。如果DNA中的核苷酸序列是随机排列的,则一个识别四核苷酸序列的内切酶平均每隔256bp出现一次该酶的识别切割位点,同样的对识别六或八核苷酸序列的内切酶则大致上分别是每隔4kb或65kb出现一次识别切割位点。按此可大致估计一个未知的DNA分子限制性内切酶可能具有切点频率,以便选用合适的内切酶。
限制性核酸内切酶的种类很多,至今已发现近800多种,可以根据它们对DNA有不同的识别序列和切割特征选用,从而为基因工程提供了有力的工具。表20-2列出了几种最常用的限制性核酸内切酶的识别序列和切割点。
表20-2 几种最常用的限制性核酸内切酶
| 限制性核酸内切酶名称 | 识别序列和切割点 |
| BamHⅠ Cla Ⅰ EooR Ⅰ Hind Ⅲ HindⅡ KpnⅠ Not Ⅰ Pst Ⅰ Sal Ⅰ Sau3A Ⅰ Sfi Ⅰ Sma Ⅰ Xba Ⅰ Xho Ⅰ |
G↓GATCc AT↓CGAT G↓AATTC A↓AGCTT GTPy↓PuAC GGTAC↓C GC↓GGCCGC CTGCA↓G G↓TCGAC ↓GATC GGCCNNNN↓NGGCC CCC↓GGG T↓CTAGA C↓TCGAG |
第二节 基因工程载体
基因工程是要按人们的意愿去有目的地改造,创建生物遗传性,因此其最基本的工程就是要得到目的基因或核酸序列的克隆。分离或改建的基因和核酸序列自身不能繁殖,需要载体携带它们到合适的细胞中复制和表现功能。对理想的基因工程载体一般至少有以下几点要求:
①能在宿主细胞中复制繁殖,而且最好要有较高的自主复制能力。
②容易进入宿主细胞,而且进入效率越高越好。
③容易插入外来核酸片段,插入后不影响其进入宿主细胞和在细胞中的复制。这就要求载体DNA上要有合适的限制性核酸内切酶位点。
④容易从宿主细胞中分离纯化出来,这才便于重组操作。
⑤有容易被识别筛选的标志,当其进入宿主细胞、或携带着外来的核酸序列进入宿主细胞都能容易被辨认和分离出来。这才介于克隆操作。
常用的载体有质粒,噬菌体和病毒等。
一、质粒载体
质粒(plasmid)是细菌或细胞染色质以外的,能自主复制的,与细菌或细胞共生的遗传成分。其特点如下:
①是染色质外的双链共价闭合环形DNA(covalentlyclosed circuar DNA,cccDNA),可自然形成超螺旋结构,不同质粒大小在2-300kb之间,<15kb的小质粒比较容易分离纯化,>15kb的大质粒则不易提取。
②能自主复制,是能独立复制的复制子(autonomous replicon)。一般质粒DNA复制的质粒可随宿主细胞分裂而传给后代。按质粒复制的调控及其拷贝数可分两类:严紧控制(stringent control)型质粒的复制常与宿主的繁殖偶联,拷贝数较少,每个细胞中只有1个到十几个拷贝;另一类是松弛控制(relaxed control)型质粒,其复制宿主不偶联,每个细胞中有几十到几百个拷贝。每个质粒DNA上都有复制的起点,只有ori能被宿主细胞复制蛋白质识别的质粒才能在该种细胞中复制,不同质粒复制控制状况主要与复制起点的序列结构相关。有的质粒的可以整合到宿主细胞染色质DNA中,随宿主DNA复制,称为附加体,例如细菌的性质粒就是一种附加体,它可以质粒形式存在,也能整合入细菌的DNA,又能从细菌染色质DNA上切下来。F因子携带基因编码的蛋白质能使两个细菌间形成纤毛状细管连接的接合(conjugation),通过这细管遗传物质可在两个细菌间传递。
③质粒对宿主生存并不是必需的。这点不同于线粒体,线粒体DNA也是环状双链分子,也有独立复制的调控,但线粒体的功能是细胞生存所必需的。线粒体是细胞的一部分,质粒也往往有其表型,其表现不是宿主生存所必需的,但也不妨碍宿主的生存。某些质粒携带的基因功能有利于宿主细胞的特定条件下生存,例如,细菌中许多天然的质粒带有抗药性基因,如编码合成能分解破坏四环素、氯霉素、氨芐表霉素等的酶基因,这种质粒称为抗药性质粒,又称R质粒,带有R质粒的细菌就能在相应的抗生素存在生存繁殖。所以质粒对宿主不是寄生的,而是共生的。医学上遇到许多细菌的抗药性,常与R质粒在细菌间的传播有关,F质粒就能促使这种传递。
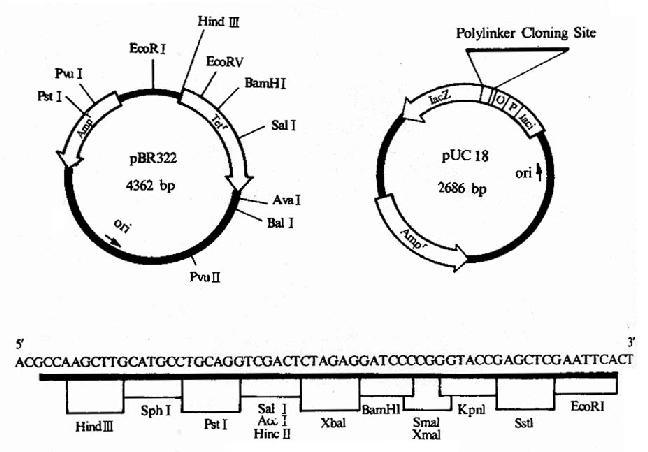
图20-2 pBR322及pUC18图谱
现在分子生物学使用的质粒载体都已不是原来细菌或细胞中天然存在的质粒,而是经过了许多的人工的改造。从不同的实验目的出发,人们设计了各种不同的类型的质粒载体,近年来发展很快,新的有特定用途的质粒不断被创建。图20-2给出最常用的大肠杆菌克隆用质粒pUC19的图谱,此质粒的复制起点处序列经过改造,能高频率起动质粒复制,使一个细菌pUC19的拷贝数可达500-700个;质粒携带一个抗氨芐青霉素基因,编码能水解β-内酰胺环,从而被坏氨芐青霉素的酶,当用pUC19转化细菌后放入含氨芐青霉素的培养基中,凡不含pUC19者都不能生长,结果长出的细菌就是都含有pUC19的;pUC19还携带细菌lac操纵元中的lacI和lacZ基因编码,β-半乳糖苷酶N端状146个氨基酸的段落,当培养基中含有诱导物IPTG和Xgal时,lacz ' 基因被诱导表达产生的β-半乳糖苷酶N端肽与宿主菌表达的C端肽互补而具有β-半乳糖苷酶活性(质粒和宿主编码的肽段各自都没有酶活性,两都融为一体而具酶活性,称为α-互补,α-complementation),半乳糖苷酶水解Xgal而使菌落呈现蓝色;在lacz '中间又插入了一段人工设计合成的DNA序列,其中密集多个常用的限制性核酸内切酶的位点,使外来的基因和序列能很方便地被插入此位置,当外来序列插入后则破坏了lacz '编码的半乳糖苷酶活性,生长的菌落就呈白色,这种颜色标志的变化就很容易区分和挑选含有和不含有插入序列或基因的转化菌落,称为蓝白筛选法。
除常用的大肠杆菌质粒载体外,近年来发展了许多人工构建的其它能用于微生物、酵母、植物等的质粒载体。含有不止一个ori、能携带插入序列在不同种类宿主细胞中繁殖的载体称为穿梭载体(shuttlevectors)。
二、噬菌体载体
噬菌体(phage)是感染细菌的一类病毒,有的噬菌体基因组较大,加入λ噬菌和T噬菌体等;有的则较小,如M13、f1、fd噬菌体等。用感染大肠杆菌的λ噬菌体改造成的载体应用最为广泛。
λ噬菌体由头和尾构成,其基因组是长约49kb的线性双链DNA分子,组装在头部蛋白质外壳内部,其序列已被全部测出。λ噬菌体感染时,通过尾管将基因组DNA注入大肠杆菌,而将其蛋白质外壳留在菌外。DNA进入大肠杆菌后以其两端12bp的互补单链粘末端环化成环状双链,可以两种不同的方式繁殖(图20-3):①溶菌性方式(lyticpathway):在营养充足,条件适合细菌繁殖时,利用宿主菌中的酶类和原料,λDNA上基因可按调控的顺序表达合成构成噬菌体头、尾和尾丝所需的各种蛋白质,λDNA经多次复制合成许多子代λDNA,于是装配成许多子代的λ噬菌体,最后裂菌,释放出许多新的λ噬菌体。②溶原性方式(lysogenic pathway):进入细菌的λDNA可整合(integrate)入细菌的染色质DNA中,随细菌染色体DNA复制,传给细菌后代,这个稳定潜伏在细菌染色质DNA中的λDNA称为原噬菌体(prophage),含有原噬菌体的细菌称为溶源菌(lysogen)。λDNA的整合是可逆的,原噬菌体可从宿主DNA中切出,进入溶菌性方式的繁殖。
图20-3 λ噬菌体的溶菌和溶原繁殖方式
λ噬菌体整个基因组如图20-4所示,可分为三个部分,①左臂:从A到J长约20kb,其中的基因编码构成头部、尾部、尾丝对组装完整噬菌体所需要的蛋白质。②中段:长约20kb,是λDNA整合和切出,溶原生长所需的序列。③右臂:长约10kb,是调控区,控制溶菌和溶原生长最重要的调控基因和序列、以及λDNA复制起始均在这区域内。左右臂包含λDNA复制、噬菌体结构蛋白合成、组装成熟噬菌体、溶菌生长所需全部序列;对溶菌生长来说,中段是非必需的。
利用λ噬菌体作载体,主要是将外来目的DNA替代或插入中段序列,使其随左右臂一起包装成噬菌体,去感染大肠杆菌,并随噬菌体的溶菌繁殖而繁殖。现在广泛使用的λ噬菌体载体也是已作过许多人工改造的,主要的改造是:①设计去除λDNA上的一些限制性酶切点。这是因为λDNA较大,序列中的限制性酶切点过多,妨碍其应用。②在中段非必需区,替换插入某些标志基因如上述的可供蓝白筛选lacI-lacZ’序列,和多克隆位点等。由此可构建出两类λ噬菌体作载体;一类是插入型载体,可将外来序列插中段,常用的λgt系列载体,一般容许插入5-7kb外来DNA;另一类是转换型载体,即可用外来DNA替代中段,如IMBL系列载体。
图20-4 野生型λ噬菌体DNA及相应的λ噬菌体DNA图谱
插入或置换中段外来的DNA长度是有一定限制的,当噬菌体DNA长度大于野生型λ噬菌体基因组105%或小于78%时,包装而成的噬菌体存活力显著下降。所以λ噬菌体载体可插入长5-20kb的外来DNA,这比质粒载体能插入的DNA长得多;而且包装的λ噬菌体感染大肠杆菌要比质粒转化细菌的效率高得多,所以λ噬菌体载体常用于构建cDNA文库或基因组文库。但λ噬菌体载体的克隆操作要比质粒载体复杂。
如果将左右臂和中段都去除,仅留下λDNA而端包装噬菌体所必需的cos序列,再加上质粒的复制序列、标志基因、多克隆位点等,就可构成cos质粒或称为粘粒的载体。粘粒可插入45kb长的外源DNA,然后用λ噬菌体外壳蛋白包装成噬菌体,感染大肠杆菌后,粘粒的DNA能以质粒的形式在细菌中繁殖而被克隆。所以粘粒主要用于DNA文库的构建。
三、动物病毒载体
质粒和噬菌体载体只能在细菌中繁殖,不能满足真核DNA重组需要。感染动物的病毒可改造用作动物细胞的载体。由于动物细胞的培养和操作较复杂、花费也较多,因而病毒载体构建时一般都把细菌质粒复制起始序列放置其中。使载体及其携带的外来序列能方便地在细菌中繁殖和克隆,然后再引入真核细胞。目前病毒载体常用者有改造来自猴肾病毒SV40(Simian Virus 40)、逆转录病毒和昆虫杆状病毒等,使用这些病毒载体的目的多为将目的基因或序列放入动物细胞中表达或试验其功能、或作基因治疗等(见后)。
人基因组十分庞大,约含4×109bp,建立和筛选人的基因组文库,要求有容量更大的载体,酵母人工染色体(yeast artificial chromosome,YAC)载体应运而生。YAC含有酵母染色体端粒(telesome)、着丝点(centromere)及复制起点等功能序列,可插入长度达200-500kb的外源DNA,导入酵母细胞可以随细胞分裂周期复制繁殖供作克隆,成为人基因组研究计划的重要
第三节 目的序列与载体的连接
将目的基因或序列插入载体,主要靠DNA连接酶和双链DNA粘末端单链序列互补结合的配合使用。有以下主要的方式。
一、粘性末端连接
如果目的序列两端有与载体上相同的限制性核酸内切酶位点,则同一限制酶切开产生的粘末端,在降低温度退火时,能重新互补结合,在DNA连接酶催化下,目的序列就与载体DNA链相连接(见图20-5)。
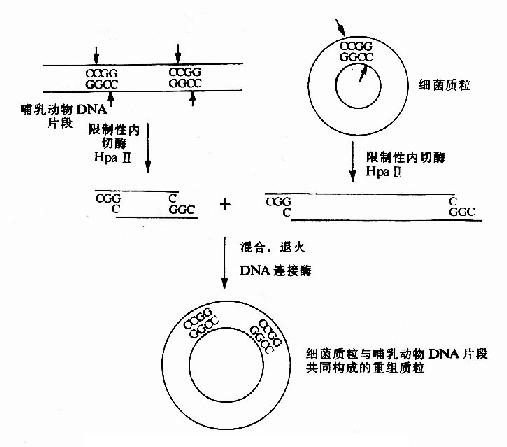
图20-5 同一限制酶切割DNA粘性末端的连接
不同的限制性内切酶切,如果产生的DNA的粘末端相同,也同样可用此法连接,如识别6bp序列的BamHⅠ和识别4bp序列的Sau3aⅠ切割DNA后都产生5’突出粘性末端GATC,可以互补结合连接。
如果在连接的两个DNA片段没有能互补的粘性末端,可用末湍核苷酸转移酶催化脱氨单核苷酸添加DNA的3’末端,例如一般DNA3’端加上polyG,另一股DNA加上polyC,这样人工在DNA两端做出能互补的共核苷酸多聚物粘性末端,退炎后能结合连接(图20-6),这样方法称为同聚物加尾法。
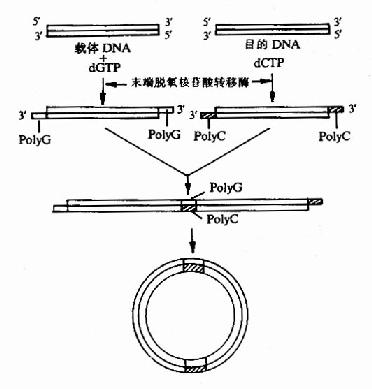
图20-6 同聚物加尾连拉法
对平末端的DNA,也可先连上人工设计合成的脱氧寡核苷酸双链接头,使DNA末端产生新的限制内切酶位点,经内切酶割后,即可按粘性末端相连(图20-7)。
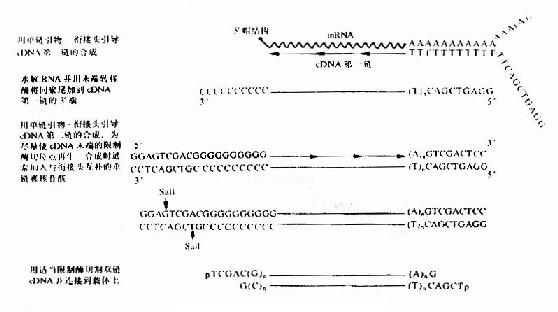
图20-7 人工接头连接法
二、平末端连接
T4DNA连接酶也能催化限制性内切酶切割产生DNA平末端的连接。如果目的序列和载体上没有相同的限制性内切酶位点可供利用,用不同的限制性内切酶切割后的粘性末端不能互补结合,则可用适当的酶将DNA突出的末端削平或补齐成平末端,再用T4DNA连接酶连接,但平末端连接要比粘性末端连接的效率低得多。
第四节 目的基因序列的来源和分离
一、基因组DNA文库
从生物组织细胞提取出全部DNA,用物理方法(超声波、搅拌剪力等)或酶法(限制性核酸内切酶的不完全酶解)将DNA降解成预期大小的片段,然后将这些片段与适当的载体(常用噬菌体、粘粒或YAC载体)连接,转入受体细菌或细胞,这样每一个细胞接受了含有一个基因组DNA片段与载体连接的重组DNA分子,而且可以繁殖扩增,许多细胞一起组成一个含有基因组各DNA片段克隆的集合体,就称为基因组DNA文库(genomic DNA library)。如果这个文库足够大,能包含该生物基因组DNA全部的序列,就是该生物完整的基因组文库,能从这文库中钓取该生物的全部基因或DNA序列。从基因组含有生物生存、活动和繁殖的全部遗传信息的概念出发,基因组文库是具有生物种属特异性的。
构建基因组文库,再用分子杂交等技术去钓取基因克隆的方法,称为鸟枪法或散弹射击法,意味着从含有众多的基因序列克隆群中去获取目的基因或序列。当生物基因组比较小时,此法较易成功;当生物基因组很大时,构建其完整的基因组文库就非易事,从庞大的文库中去克隆目的基因工程量也很大。
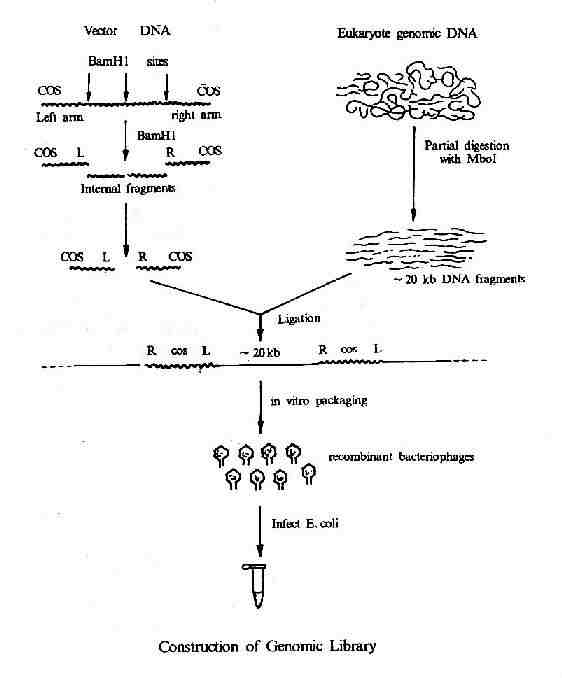
图20-8 基因组DNA文库的构建
二、cDNA文库
以mRNA为模板,经反转录酶催化合成DNA,则此DNA序列与mRNA互补,称为互补DNA或cDNA。提取出组织细胞的全部mRNA,在体外反转录成cDNA,与适当的载体常用噬菌体或质粒载体连接后转化受体菌,则每个细菌含有一段cDNA,并能繁殖扩增,这样包含着细胞全部mRNA信息的cDNA克隆集合称为该组织细胞的cDNA文库,基因组含有的基因在特定的组织细胞中只有一部分表达,而且处在不同环境条件、不同分化时期的细胞其基因表达的种类和强度也不尽相同,所以cDNA文库具有组织细胞特异性。cDNA文库显然比基因组DNA文库小得多,能够比较容易从中筛选克隆得细胞特异表达的基因。但对真核细胞来说,从基因组DNA文库获得的基因与从cDNA文库获得的不同,基因组DNA文库所含的是带有含子和外显子的基因组基因,而从cDNA文库中获得的是已经过剪接、去除了内含子的cDNA。
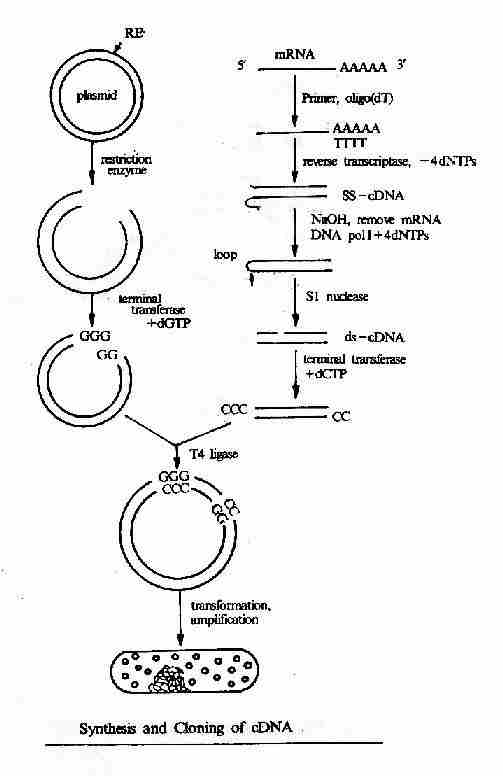
图20-9 cDNA文库的构建
三、聚合酶链式反应(PCR)
如果已经知道目的基因的序列,就能很方便地用PCR聚合酶链式反应,polymerase chain reaction,从基因组DNA或cDNA中获得目的基因,可不必要经过复杂的DNA文库构建过程。PCR是70年代中期创立的技术,其基本原理如图20-10所示。
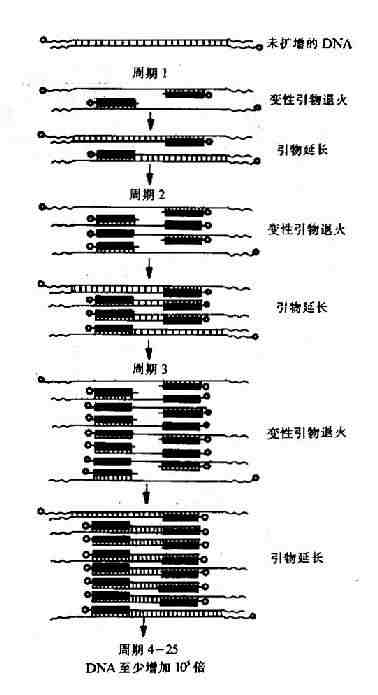
图20-10 PCR基本原理示意图
PCR反应系统包括含有目的基因或序列的DNA模板,对热稳定的DNA聚合酶,一对脱氧寡核苷酸引物、DNA合成所需要的4种脱氧核苷三磷酸以及保证聚合酶催化反应的Mg2+及缓冲液等。人工合成引物的序列设计是PCR成功的关键,一般两条引物的序列反应分别与欲获得的双链DNA两条链3’端的序列互补。先升高温度使模板DNA变性、双链分开;再降低温度退火使引物与模板DNA配对互补结合;然后升温到聚合酶反应适宜的温度,此时在聚合酶催化下,从引物3’羟基端开始,与模板DNA上的碱基配对逐个加上核苷酸,合成新的DNA链。其后再按高温变性、低温退火、适温合成三步反复循环,新合成的DNA在下一循环中又作为模板使用,每循环一次,合成的目的序列扩增一倍,而且很快扩增的序列主要限制在所设计的一对引物规定的模板序列范围内,一般循环30-40次,按理论计算,目的序列可扩增230-240倍,而实际上由于底物和引物的消耗,酶的失活等因素,产物量并不是始终以指数增加的,但通常实验获得目的序列106-108倍的扩增产物并不困难,因而PCR具有很高度的灵敏度,由于引物与模板的配对互补结合的特异的,因而PCR也具有高度的特异性。所以可以方便地用PCR在成千上万的基因序列中获得只有极微含量的特定目的基因或序列,PCR获得的目的序列产物连接在适当的载体上,转化受体细胞,经筛选就能得到目的序列的克隆。
现在PCR技术还在不断发展,已知部分序列或未知序列的基因有的也能设计PCR来扩增和克隆,模板核酸可用双链DNA,单链DNA,甚至RNA。由于PCR的高灵敏度和特异性,在基因诊断上有更广泛的应用,后面的章节还要叙述。
四、人工化学合成
随化学合成技术的发展,现在计算机控制的全自动核酸合成仪已被广泛应用,按人们设计好的序列一次合成100-200bp长的DNA片段已不成问题。可能用这些合成的片段组合连接成完整的基因。但目前人工合成基因最大的限制是人们并未掌握怎样的核酸序列能具有生命功能的规律,例如1kb长的DNA最通常编码功能蛋白质的基因长度就可以有~10600种不同的序列,随意合成的DNA绝大多数肯定是不具有生物功能或无法知道它会有什么功能的,因而只能模仿自然界生物中已知的基因序列来合成,而化学合成这样长的基因DNA序列,其价格远高于用PCR法获得基因,所以目前很少全部用化学方法去合成基因。但人工设计化学合成核酸片段作为引物、接头等已经是分子生物学和基因工程中必不可少的、十分重要的手段。
第五节 基因序列导入细胞
目的基因序列与载体连接后,要导入细胞中才能繁殖扩增,再经过筛选,才能获得重组DNA分子克隆,不同的载体在不同的宿主细胞中繁殖,导入细胞的方法也不相同。
一、转化
由于外源DNA的进入而使细胞遗传性改变称为转化,早在1943年,Avery等就发现有毒肺炎双球菌的DNA与无毒肺炎双球菌共培养后产生有毒性的肺炎双球菌后代的转化现象。但DNA进入细胞的效率很低,在分子生物学和基因工程工作中可采取一些方法处理细胞,经处理后的细胞就容易接受外界DNA,称为感受态细胞,再与外源DNA接触,就能提高转化效率。例如大肠杆菌经冰冷CaCl2的处理,就成为感受态细菌,当加入重组质粒并突然由4℃转入42℃作短时间处理,质粒DNA就能进入细菌;用高电压脉冲短暂作用于细菌也能显着提高转化效率,这称为电穿孔(electroporation)转化法。
二、感染
噬菌体进入宿主细菌,病毒进入宿主细胞中繁殖就是感染(infection)。用经人工改造的噬菌体活病毒作载体,以其DNA与目的序列重组后,在体外用噬菌体或病毒的外壳蛋白将重组DNA包装成有活力的噬菌体或病毒,就能以感染的方式进入宿主细菌或细胞,使目的序列得以复制繁殖。感染的效率很高,但DNA包装成噬菌体或病毒的操作较麻烦。
三、转染
重组的噬菌体DNA也可象质粒DNA的方式进入宿主菌,即宿主菌先经过CaCl2,电穿孔等处理成感受态细菌再接受DNA,进入感受态细菌的噬菌体DNA可以同样复制和繁殖,这种方式称为转染(transfection)。M13噬菌体DNA导入大肠杆菌就常用转染的方法。重组DNA进入宿主细胞也常用转染方式。最经典的是1973年建立的磷酸钙法,其利用的基本现象是:DNA如以磷酸钙-DNA共沉淀物形式出现时,培养细胞摄取DNA的效率会显着提高。用电穿孔法处理培养的哺乳类细胞也能提高细胞摄取DNA能力,但所用外加电场的强度、电脉冲的长度等条件与处理细菌者都很不相同。近年来用人工脂质膜包裹DNA,形成的脂质体(Liposome)可以通过与细胞膜融合而将DNA导入细胞,方法简单而有效,现有商售的脂质体试剂,使用日益广泛。
第六节 目的基因序列克隆的筛选与鉴定
目的序列与载体DNA正确连接的效率、重组导入细胞的效率都不是百分之百的,因而最后生长繁殖出来的细胞并不同都带有目的序列。一般一个载体只携带某一段外源DNA,一个细胞只接受一个重组DNA分子。最后培养出来的细胞群中只有一部分、甚至只有很小一部分是含有目的序列的重组体(recombinant)。将目的重组体筛选出来就等于获得了目的序列的克隆,所以筛选(dcreening)是基因克隆的重要步骤。在构建载体,选择宿主细胞、设计分子克隆方案时都必须仔细考虑筛选的问题。以下就常用技术的基本原理加以介绍。
一、根据重组载体的标志作筛选
最常见的载体携带的标志是抗药性标志,如抗氨芐青霉素(anpr)、抗四环素(terr)、抗卡那霉素(kanr)等。当培养基中含有抗生素时,只有携带相应抗药性基因载体的细胞才能生存繁殖,这就把凡未能接受载体DNA的细胞全部筛除掉了。如果外源目的序列是插入在载体的抗药性基因中间使这抗药性基因失活,这个抗药性标志就会消失。例如质粒pBR322含有anpr、和terr两个抗药基因,若将目的序列插入terr基因序列中,转化大肠杆菌,让细菌放在含氨芐青霉素或四环素培养基中,凡未接受质粒DNA的细胞都不能生长;凡在含氨芐青霉素和四环素中都能生长的细菌是含有质粒pBR322的,但其pBR322未插入目的序列,凡在氨芐青霉素中能生长、而在四环素中不能生长的细菌就很可能是含有目的序列的重组质粒。
载体含有lacZ’的蓝白筛选法,近年更被广泛应用。例如将目的序列插入前面述及的质粒pUC19的多克隆位点,转化大肠杆菌,放入含氨芐青霉素、IPTG、X-gal的培养基中培养,凡能生长并呈白色的菌落,其细菌中就很可能含有插入目的序列的重组质粒,这样就很容易获得目的序列的克隆。
根据重组载体的标志来筛选,可以筛选去大量的非目的重组体,但还只是粗筛,例如细菌可能发生变异而引起抗药性的改变,却并不代表目的序列的插入,所以需要做进一步细致的筛选。
二、核酸杂交法
利用标记的核酸做探针与转化细胞的DNA进行分子杂交,可以直接筛选和鉴定目的序列克隆。常用的方法是将转化后生长的菌落复印到硝酸纤维膜上,用碱裂菌,菌落释放的DNA就吸附在膜上,再与标记的核酸探针温育杂交,核酸探针就结合在含有目的序列的菌落DNA上而不被洗脱。核酸探针可以用放射性核素标记,结合了放射性核酸探针的菌落集团可用放射性自显影(auroradiography)法指示出来,核酸探针也可以用非放射性物质标记,通常是经颜色呈现指示位置,这样就可以将含有目的序列的菌落挑选出来。
三、PCR法
PCR技术的出现给克隆的筛选增加了一个新手段。如果已知目的序列的长度和两端的序列,则可以设计合成一对引物,以转化细胞所得的DNA为模板进行扩增,若能得到预期长度的PCR产物,则该转化细胞就可能含有目的的序列。
四、免疫学方
利用特定抗体与目的基因表达产物特异性结合的作用进行筛选。此法不是直接筛选目的基因,而是通过与基因表达产物的反应指示含有目的基因的转化细胞,因而要求实验设计要使目的基因进入受体细胞后能够表达出其编码产物。抗体可用特定的酶常用过氧化物酶、碱性磷酸酶等标记,结合酶标抗体处,酶可催化特定的底物分解而呈现颜色,从而指示出含有目的的基因的细胞集落位置。免疫学方法特异性强、灵敏度高,适用于从大量转化细胞集合体中筛选很少几个含目的基因的细胞克隆。
五、DNA限制性内切酶图谱分析
这是在上述筛选后的进一步分析。目的序列插入载体会使载体DNA限制性酶图谱(restriction map)发生变化,例如一个长600bp的目的序列利用它两端的EooR I和SalI切后的粘末端连接插入pUC19的多克隆点,则重组质粒就增大为3.3kb,用Eoor I和SalI双酶切后会出现600bp和-2.7kb两个DNA片段,提取转化细菌的质粒DNA作酶切后做电泳观察其酶切图谱,就能分析得结果;如插入的目的序列中有其它限制性内切酶位点,也能在酶切电泳图谱上观察到。这就可以进一步鉴定重组体是不是所要的目的克隆。
六、核苷酸序列测定
所得到的目的序列或基因的克隆,都要用其核酸序列测定来最后鉴定。已知序列的核酸克隆要经序列测定确证所获得的克隆准确无误;未知序列的核酸克隆要测定序列才能确知其结构、推测其功能,用进一步的研究。因此核酸序列测定是分子克隆中必不可少的鉴定步骤。核酸序列测定的原理和方法在实验教材中有详细的叙述。
第七节 克隆基因的表达
使克隆的基因在细胞中表达对理论的研究和实验的应用都是十分重要的意义的。克隆的基因只有通过表达才能探索和研究基因的功能以及基因表达调控的机理,克隆基因表达出所编码的蛋白质可供作结构与功能的研究。有些具有特定生物活性的蛋白质在医学上、以至在工业上都是很有应用价值的,可以克隆其基因使之在宿主细胞中大量表达而获得。要使克隆基因在宿主细胞中表达,就要将它放入带有基因表达所需要的各种组件的载体中,这种载体就称为表达载体(expression vector)。克隆基因可以放在不同的宿主细胞中表达,可用大肠杆菌、枯草杆菌、酵母、昆虫细胞、培养的哺乳类动物细胞、以至整体动物。对不同的表达系统,需要构建不同的表达载体。克隆基因在不同的系统中表达成功的把握性,取决于我们对这些系统中基因表达调控规律的认识程度。
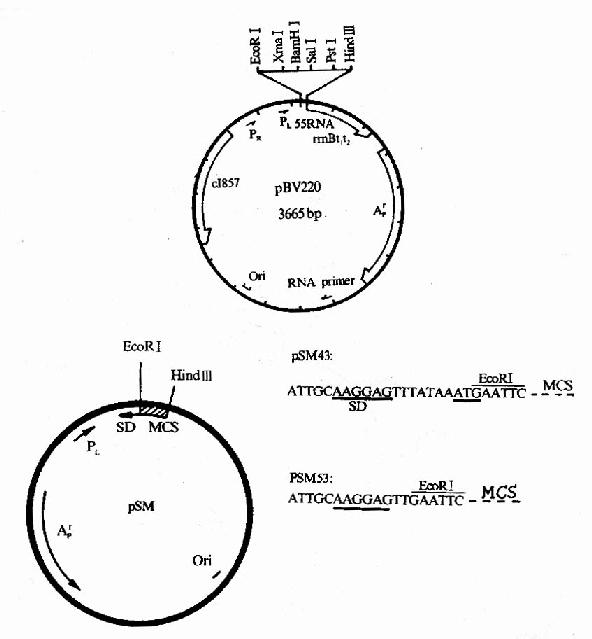
图20-11 几种常用的大肠杆菌表达载体
人类对大肠杆菌经过长期的研究,对其特性和遗传背景了解得最清楚,大肠杆菌培养操作简单、生长繁殖快、价格低廉,人们用大肠杆菌用外源基因的表达工具已有二十多年的经验积累,大肠杆菌表达外源基因产物的水平远高于其它基因表达系统,表达的目的蛋白量甚至能超过细菌总蛋白量的80%。因此大肠杆菌是目前应用最广泛的蛋白质表达系统。设计外源基因在大肠杆菌表达就需要外源基因在大肠杆菌中表达所需要的元件,包括转录起始必需的启动子、翻译起始所必需的核糖体识别序列等;外源基因表达的产物可能会对大肠杆菌有毒害作用,会影响细菌的生存繁殖,所以大多数表达载体都带有诱导性表达所需要的元件,即有操纵子序列以及与之配套的调控基因等;外源基因还应当插入到适合于表达的位置,所以表达载体中要设有适合的多克隆位点;此外还应具备基因克隆筛选的条件,包括在细胞中复制必需的复制起始序列、筛选标志如抗药性基因等。图20-12中绘出几种常用的表达载体例子。pBV220是我国科学工用者自己构建的表达载体,使用了很强的PRPL双启动子,含有编码温度敏感性阻遏蛋白的cI857基因,在30-32℃时产生的阻遏蛋白能阻止PRPL的转录起始,细菌可以正常生长繁殖,42摄氏度时该阻遏蛋白发生构像变化而失活,基因开始转录而表达。
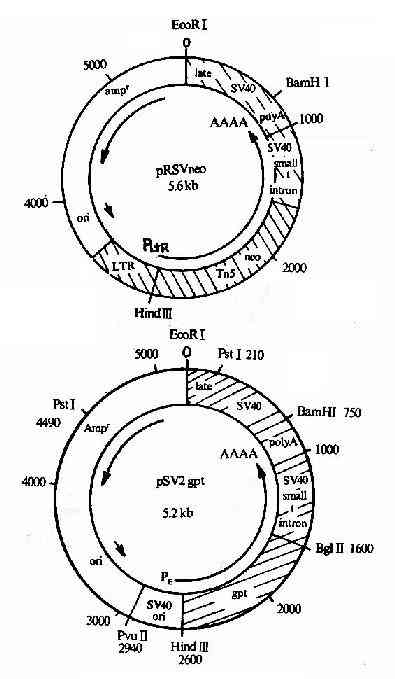
图20-12 真核表达载体pSV2-neo
当要将真核基因放入原核细胞中表达产生蛋白质时,原核系统就表现出许多缺陷:①没有真核转录后加工的功能,不能进行mRNA的剪接,所以只能表达cDNA而不能表达真核的基因组基因;②没有真核翻译后加工的功能,表达产生的蛋白质,不能进行糖基化、磷酸化等修饰,难以形成正确的二硫键配对和空间构像折叠,因而产生的蛋白质常没有足够的生物学活性;③表达的蛋白质经常是不溶的,会在细菌内聚集成包涵体(inclusiion body),尤其当表达目的蛋白量超过细菌体总蛋白量10%时,就很容易形成包涵体。生成包涵体的原因可能有是蛋白质合成快速太快,多肽链相互缠绕,缺乏使多肽链正确折叠的因素,导致疏水基因外露等。细菌裂解后,包涵体的离心后的沉淀中,虽然有利于目的蛋白的初步纯化,但无生物活性的不溶性蛋白,要经过复性(renaturation),使其重新散开、重新折叠成具有天然蛋白构象和良好生物活性的蛋白质,常常是一件很困难的事情。也可以设计载体使大肠杆菌分泌表达出可溶性目的蛋白,但表达量往往不高。
要表达真核生物的蛋白质,采用真核表达系统自然应比原核系统优越,常用的酵母、昆虫、动物和哺乳类细胞等表达系统。真核表达载体至少要含两类序列:①原核质粒的序列,包括在大肠杆菌中起作用的复制起始序列、能用在细菌中筛选克隆的抗药性基因标志等,以便插入真核基因后能先在很方便操作的大肠杆菌系统中筛选获得目的重组DNA克隆、并复制繁殖得到足够使用的数量。②在真核宿主细胞中表达重组基因所需要的元件,包括启动子、增强子、转录终止和加poly-A信号序列、mRNA剪接信号序列、能在宿主细胞中复制或增殖的序列,能用在宿主细胞中筛选的标志基因、以及供外源基因插入的单一限制性内切酶识别位点等。图20-12举出一个真核表达载体的例子。
第八节 DNA重组及基因工程技术对医学和生命科学发展的贡献
作为分子生物学发展的重要组成部分,DNA重组及基因工程技术给生命科学带来了革命性变化,促进着生命科学各学科研究和应用的进步,对推动医学各领域的发展同样起着重要的作用。
一、对人类遗传信息的认识
遗传信息决定生物的形态和特征,是生物生存之本。估计人类的基因组DNA约有4×109bp,含有约5-10万个基因,但至今人类对自己赖以生存繁衍的这个庞大的遗传信息库还知之甚少,目前已经知道的人基因只占估计数的百分之几,已搞清楚其表达调控者更寥寥无几,对占基因组80-90%不为蛋白质编码序列的认识更少,因而实际上我们现在对自己生存的基础和实质只有很表面的肤浅认识,设想如果人类掌握了自身全部遗传信息的结构、功能、表达和调控,无疑将能够深刻认识人的生长、发育、生存、繁衍的整个生老病死历程,将能对疾病的诊断、治疗和预防提出极有效的措施,将能真正掌握自己生存和发展的命运。
DNA重组技术的出现和发展,就使人们有可能去深入探索这个重大的课题。1985年提出的人基因组研究计划(Human Genome Project)很快得到世界科学的响应,这个研究计划的目标是要阐明人类遗传信息的组成和表达,是迄今全球性生物学、医学领域最引人注目的巨大研究工程。DNA重组是完成这个任务的主要手段,其中包括大片段DNA克隆、DNA的大尺度分析、全自动DNA序列测定,基因组信息数据库的建立等新思维和新技术的不断出现和发展,再加上大规模引入其它领域先进的科学技术,原预定21世纪头10年绘制出完整的人类染色体基因定位图、测定出人类基因组全部DNA序列,有望按期或提前完成。当然在这基础上要搞清楚全部人类基因的功能、各基因间的关系,基因表达调控、人类遗传信息的多样性等还要经历更长期和更艰苦的努力。但DNA重组技术促进了分子生物学迅速发展,给人类探索自身生命的奥秘展示了光明的前景。
生命关键的基础在于蛋白质与蛋白质、蛋白质与核酸相的相互作用,生物大分子的结构与功能的联系正是生命“活”的本质所在。凭借基因工程人们可以克隆获得天然的或任意设计的核酸序列,可以大量获得过去难以得到的生物体内极微量的活性蛋白质、可以设计获得任意定点突变(site-directed mutagenesis)的基因和蛋白质,这就为研究蛋白质与核酸的结构与功能、揭露生命的本质提供了很有力的手段。
二、基因工程药物与疫苗
利用基因工程技术生产有应用价值的药物是当今医药发展一个重要的方向,现在世界上已有几千家生物技术公司,其中多数都生产医药或医药研究所需的试剂。利用基因工程技术生产药物有两个不同的途径:一是利用基因工程技术改造传统的制药工业,例如用DNA重组技术改造制药所需要的菌种或创建的菌种,提高抗菌素、维生素、氨基酸产量等;二是用克隆的基因表达生产有用的肽类和蛋白质药物或疫苗,虽然基因诊断和医药研究试剂的基因工程产品已经很多,但目前基因工程药物还只处在发展的早期,至今真正被卫生部门正式批准投放市场的基因工程肽或蛋白类治疗药物现在还不多,但正在开发的基因工程治疗药物却有几百种,且而逐年迅速增加,可见其具有的巨大潜力。基因工程药物不仅用于医药上,还能用于工农业上,促进生产的发展,已经投放市场或近期可望投放市场的基因中程药物可举出以下例子。
1、基因工程疫菌 乙型肝炎是常见的传染病,过去从病人血液中分离乙肝病毒的表面抗原作为疫苗,来源有限,价格昂贵,有潜在交叉感染的危险。现在克隆得病毒编码的HbsAg基因,使其表达获得大量HbsAg用作疫苗。1986年美国正式批准基因工程乙肝疫苗投放市场,我国的科学工作者也克隆得在我国流行常见乙肝病毒亚型的HbsAg基因,研制得适用于我国乙肝基因工程疫苗,并已生产和使用。近期可能投放市场的还有甲型肝炎、巨细胞病毒、流行性出血热、轮状病毒、细菌性腹泻等基因工程疫苗。我军事医学科学院研制的仔畜腹泻基因工程疫苗,使仔畜免遭大肠杆菌腹泻之害,保护率达90%以上,为我国的肉食供应做出了贡献。
2、基因工程肽类药物 由免疫细胞和其它细胞分泌的细胞因子是具有很高活动性的肽类分子,在调节细胞生长分化、调节免疫功能、参与炎症反应和创伤修复中起重要作用,其中许多很有应用价值,但其生成量极微,难以提取获得,基因工程则可克隆其基因,使之表达获得大量产物供用。传统的肽类激素,血液中的微量活性成分、酶类同样可用基因工程手段获得。表20-3列出一些已上市的正在研制的基因工程多肽药物。
表20-3 基因工程肽类药物
| 名称 | 作用 |
| 各种干扰素(interferon IFN) | 抗病毒、抗肿瘤、免疫调节 |
| 各种细胞介素(interleukins ,IL) | 免疫调节、促进造血 |
| 各种集落刺激因子(colony stimulating factors ,CSF) | 刺激造血 |
| 红细胞生成素(erythropopoetin EPO) | 促进红细胞生成,治疗贫血 |
| 肿瘤坏死因子(tumor necrosis factor,TNF) | 杀伤肿瘤细胞、免疫调节、参与炎症和全身性反应 |
| 表皮生长因子(epidermal growth factor, EGF) | 促进细胞分裂、创伤愈合、胃肠道溃疡防治 |
| 神经生长因子(nerve growth factor ,NGF) | 促进神经纤维再生 |
| 骨形态形成蛋白(bone morphogenetic protein ,BMP) | 骨缺损修复、促进骨折愈合 |
| 组织纤溶酶激活剂(tissue-type plasminogen activator ,t-PA) | 溶解血栓、治疗血栓疾病 |
| 血凝因子Ⅷ、Ⅸ | 治疗血友病 |
| 生长激素(rgowth hormone ,GH) | 治疗侏儒症 |
| 胰岛素(insulin) | 治疗糖尿病 |
| 超氧化物歧化酶(superoxide dismutase ,SOD) | 清除自由基、抗组织损伤、抗衰老 |
3、基因工程抗体 用传统细胞融合杂交瘤技术制备的单克隆抗多数是鼠源性抗体,用于人体会产生免疫排斥反应,用杂交瘤方法制备人源性抗体又遇到难以克服的困难。用基因工程的方法可以不经过杂交瘤技术而直接获得特定的人的抗体基因克隆。也可以计算机辅助设计,用DNA重组技术将鼠源性抗体基因人源化,然后放入表达载体,表达产生人源化抗体。我国已成功克隆得到多种肿瘤、抗病毒、抗细胞因子、抗细胞受体等不同单克隆的基因,鼠源性抗人肝癌、抗人黑色素瘤、抗人纤维蛋白抗体基因的人源化工作正在进行,并已成功直接获得人源性抗乙型肝炎病毒抗体基因。不同类型的抗体基因已分别在细菌、昆虫细胞、培养的哺乳细胞和植物中表达。基因工程抗体被称为第三代抗体,其研制虽然刚起步,但已展示出良好的应用前景。
三、转基因动物和植物
克隆的基因不仅导入细菌和培养的细胞,而且能转入动植物体内、改变其遗传特性。转基因动物(transgenic animals)就是指在其基因组内稳定地整合有外源基因、并能遗传给后代的动物。1979年Mintz等将SV40病毒NDA导入小鼠早期胚胎的囊胚腔,第一次得到载有人工导入外源基因的嵌合体小鼠(chimeicmorse)。1982年Palmiter等将克隆的生长激素基因用显微注射(microinjection)的方法直接导入小鼠受精卵细胞核内,所得转基因的小鼠的肝、肌、心等组织都能产生生长激素,小鼠比原个体大几倍,称为“巨鼠”,使人们意识到转基因技术的巨大潜力及其在遗传育种方面的划时代意义,除受精卵外,从胚胎中分离的多潜能干细胞(ES细胞,embryonic stem cells)也能接受外源基因发育成个体,外源基因的导入还可以采取逆转录病毒载体感染等方法。目前已经得到的转基因动物除鼠外还有转基因兔、羊、猪等。
利用转基因动物可以建立人类疾病的动物模型,为对人类疾病病因研究,以及测试新治疗方法提供了有力手段。例如用导入各种癌基因、致瘤病毒基因或其调控序列等的转基因小鼠,可以观察肿瘤发生的历程和影响因素;导入相关突变基因的转基因动物可以造出糖尿病、镰刀形细胞贫血、白内障等疾病模型;用肝炎病毒基因的转基因动物可以研究肝炎病毒基因在肝炎病中的作用,利用导入各种细胞因子基因、免疫功能基因、以及特定核酸序列的转基因动物可以从整体研究细胞因子、免疫调控、基因表达调控等问题。
近年来转基因动物技术又有新的发展。ES细胞导入与目的基因同源的序列,则在体内可以经同源重组使用的基因发生突变,这样成长起来的动物有目的基因的缺陷,这种技术称为基因打靶(gene targetting)。用基因打靶可以在整体水平上研究基因的功能,并能制造出遗传缺陷的疾病模型。
用转基因动物还能获得治疗人类疾病的重要的蛋白质。例如导入了凝血因子Ⅸ基因的转基因绵羊分泌的乳汁中含有丰富的凝血因子Ⅸ,能在效地用于血友病的治疗。
转基因技术在遗传育种上闯出了新路。成功获得“巨鼠”,激起了人们的创造优良品持家畜的热情。我国水生生物研究所将生长激素基因转入鱼受精卵,得到的转基因鱼生长显著加快、个体增大;转基因猪也正在研制中。
转基因植物在育种上也获得成绩。1994年比普遍西红柿保鲜时间更长的转基因西红柿投放市场,1996年转基因玉米、转基因大豆相继投入商品生产。美国最早研制得抗虫棉花,我国科学家将自己发展的蛋白酶抑制剂基因转入棉花获得抗棉铃虫的棉桦株。到1996年全世界已有250万公顷土地种植转基因植物。与按传统孟德尔遗传规律育种比较,转基因技术显出其优越和更大的潜力,提高光合作用、扩大固氮能力、提高营养价值、抗虫、抗病、抗旱等转基因植物都在研究中。将人的基因转入植物还可能获得医学上的治疗用途的药物,例如将人抗体基因转入烟草,从烟叶中就能提取得人的抗体蛋白。
四、基因诊断与基因治疗
基因克隆和基因分析的手段得到与人类疾病有关的基因异常变化、以及致病微生物基因结构方面的知识,就可能用检测和分析基因的方法去诊断疾病。对与疾病相关的基因及其调控了解,就有可能导入外源目的基因去纠正基因缺陷或改变基因表达调控以期达到治疗疾病的目的。这些都是分子生物学进展在医学上重要的应用。因而本书列出两章专门讨论,在此不再重复叙述。
NDA重组技术和基因工程使人类进入了能动改造的生物界的新纪元,使医学发展到分子医学的新阶段。但由于人类对生物基因组的结构、基因表达调控等认识还很有限,因而分子生物学的成果在医学上的应用还处在初级阶段。新的基因工程药物虽然不断涌现,但已应用的还是少数,而且由于对基因产物的整体效应等研究还不够充分,即使已批准投入市场的基因工程药物,有的疗效还不很理想。基因诊断应用的范围尚有待扩大,基因治疗理想成功的例子还不多。转基因的工作还由于基因导入后在基因组上的定位整合等知识和技术尚不成熟,因而现在转基因的工作还很盲目、成功率还很低。这些都有待于进行许多扎实的基础研究,了解更多分子遗传学方面规律,并改进和创建新的技术,才能得到提高。然而探索着生命本质的分子生物学已经指出了光明的前程,随着科学的进步,肯定将逐步实现能按人们的意志去获得理想的结果,可以说“前途光明灿烂,道路曲折而遥远”。
小结
基因工程又称遗传工程,是生物工程的主导技术。DNA重组技术或分子克隆是基因工程的核心。分子生物学研究中发现的许多核酸酶类都可用作基因工程的工具。其中能识别特定的回文序列并切割DNA双链的Ⅱ类限制性核酸内切酶在DNA重组技术中被广泛应用。
当前目的基因序列主要来源于自然界的生物,无性繁殖的纯基因称为基因克隆,目的基因或核酸序列必须由载体携带进入宿主细胞复制繁殖才能分离到克隆。常用的载体有质粒、噬菌体、病毒、酵母人工染色体等,载体必须能携带目的序列有效地进入宿主细胞复制繁殖,并应当具有良好的标志可供识别和筛选,常用有抗药性和α互补蓝白筛选标志等。为获得目的基因克隆,可构建生物的基因组文库,完整的基因组文库是含有该生物全部遗传信息的克隆集合体,从基因组文库中可以克隆得该生物的基因组基因;以mRNA为模板经反转录酶催化合成与NRA序列互补的DNA称为cDNA,可以从组织细胞提取mRNA构建cDNA文库,完整的cDNA文库可以获得特定基因的cDNA构隆。目的基因也可以用PCR或人工合成核酸的方法得到,但还离不开从生物基因组和cDNA获得基因序列知识。要设计严密的方案,借助工具酶的作用,将目的基因或序列以适当的连接方式插放载体,用转化、感染或转染的方法导入宿主细胞繁殖,经抗药生长、呈色显示,核酸分子杂交、PCR、免疫学亲和结合或限制性酶谱分析等方法筛选获得克隆,最后要经过核酸序列分析鉴定。
克隆的基因可以插入表达载体中带有宿主细胞中表达,这是研究目的基因功能和获取基因产物必需步骤。表达载体应当具备在宿主细胞中复制繁殖、筛选、目的基因插入、以及基因表达所需要的各种元件。大肠杆菌遗传背景清楚、操作容易、经济、表达水平高,是最常用的表达系统,但它不适用于真核基因组基因的表达并缺乏真核转录后加工、翻译后加工等功能。
DNA重组技术和基因工程是分子生物学发展的突出领域,开创了人类能动改造生物界的新阶段,推动了医学和整个生命科学的进步,为基因诊断、基因治疗、基因工程药物的发展开辟了道路,是分子生物学走向广泛应用的重要方面,目前基因工程还只是发展的初阶段,它将依赖于分子生物学的进步而发展。
复习思考题
1、什么是DNA重组技术?它包含那些内容?
2、列举常用的基因工程工具酶的特性和用途。
3、叙述常用的基因工程载体的种类、特点和用途。
4、怎样获得目的基因或核酸序列的克隆?有那些方法?要经过那些基本步骤?
5、怎样能在大肠杆菌中获得真核基因的表达产物?
第二十一章 细胞通讯与细胞信号转导的分子机理Cell Communication and Cell Signal Transduction
高等生物所处的环境无时无刻不在变化,机体功能上的协调统一要求有一个完善的细胞间相互识别、相互反应和相互作用的机制,这一机制可以称作细胞通讯(Cell Communication)。在这一系统中,细胞或者识别与之相接触的细胞,或者识别周围环境中存在的各种信号(来自于周围或远距离的细胞),并将其转变为细胞内各种分子功能上的变化,从而改变细胞内的某些代谢过程,影响细胞的生长速度,甚至诱导细胞的死亡。这种针对外源性信号所发生的各种分子活性的变化,以及将这种变化依次传递至效应分子,以改变细胞功能的过程称为信号转导(Signal Transduction),其最终目的是使机体在整体上对外界环境的变化发生最为适宜的反应。在物质代谢调节一章中曾涉及到神经-内分泌系统对代谢途径在整体水平上的调节,其实质就是机体内一部分细胞发出信号,另一部分细胞接收信号并将其转变为细胞功能上的变化的过程。所以,阐明细胞信号转导的机理就意味着认清细胞在整个生命过程中的增殖、分化、代谢及死亡等诸方面的表现和调控方式,进而理解机体生长、发育和代谢的调控机理。近年来,随着分子生物学技术手段的改进,人们对细胞内信号转导机理的认识也日益深入。现已知道,细胞内存在着多种信号转导方式和途径,各种方式和途径间又有多个层次的交叉调控,是一个十分复杂的网络系统。科学家们相信,将来他们会绘制出一个类似于代谢网络图的细胞信号传递的网络图,不过这个网络图可能较代谢图更为复杂。
第一节 细胞通讯方式
单细胞生物仅与环境交换信息,高等生物则根据自然需求进化出一套精细的调控通讯系统,以保持所有细胞行为的协调统一。细胞间主要以如下三种方式进行联络(图21-1)。
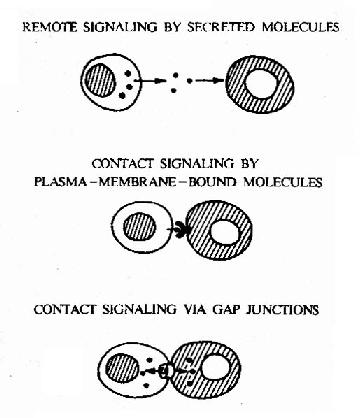
图21-1 三种细胞通讯的基本方式
(一)细胞间隙连接
细胞间隙连接(Gap Junction)是一种细胞间的直接通讯方式。两个相邻的细胞间存在着一种特殊的由蛋白质构成的结构-连接子(Connexon),其结构见图21-2和图21-3。连接子两端分别嵌入两个相邻的细胞,形成一个亲水性孔道。这种孔道允许两个细胞间自由交换分子量为1500道尔顿以下的水溶性分子。这种直接交换的意义在于,相邻的细胞可以共享小分子物质,因此可以快速和可逆地促进相邻细胞对外界信号的协同反应。
连接子为一个多基因家庭,现已发现12个成员。在肿瘤生长和创伤愈合等过程中都观察到某些类型连接子表达的变化。因此,连接子可能对细胞的生长、分化、定位及细胞形态的维持具有重要意义。
(二)膜表面分子接触通讯
每个细胞都有众多的分子分布于膜的外表面。这些分子或为蛋白质,或为糖蛋白。这些表面分子作为细胞的触角,可以与相邻细胞的膜表面分子特异性地相互识别和相互作用,以达到功能上的相互协调。这种细胞通讯方式称为膜表面分子接触通讯(Contact signaling by plasmamembranebound molecules)。膜表面分子接触通讯也属于细胞间的直接通讯,最为典型的例子是T淋巴细胞与B淋巴细胞的相互作用(图21-4)。
 |
 |
| 图21-2 间隙连接功能示意图,荧光标记的不同大小的分子注入细胞后,依靠间隙连接进入另外一个细胞,图中数字表示分子量。 | 图21-3 间隙连接结构示意图 |
图21-4 膜表面分子接触通讯举例
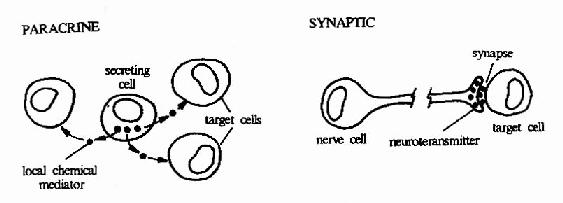
图21-5 化学信号的三种形式
(三)化学通讯
细胞可以分泌一些化学物质-蛋白质或小分子有机化合物至细胞外,这些化学物质作为化学信号(chemical signaling)作用于其它的细胞(靶细胞),调节其功能,这种通讯方式称为化学通讯。化学通讯是间接的细胞通讯,即细胞间的相互联系不再需要它们之间的直接接触,而是以化学信号为介质来介导的。根据化学信号分子可以作用的距离范围,将其分为三类(图21-5)。
1.内分泌(endocrine)系统以激素为主,它们是由内分泌器官分泌的化学信号,并随血流作用于全身靶器官。
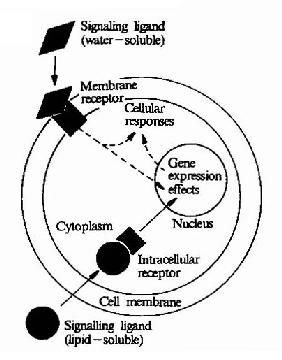
图21-6 水溶性和脂溶性化学信号的转导
2.旁分泌(paracrine)系统以细胞因子为主,它们主要作用于局部的细胞,作用距离以毫米计算。
3.自分泌(autocrine)系统神经介质为主,其作用局限于突触内,作用距离在100nm以内。
化学信号还可以根据其溶解性分为脂溶性化学信号和水溶性化学信号两大类。所有的化学号都必须通过与受体结合方可发挥作用,水溶性化学信号不能进入细胞,其受体位于细胞外表面。脂溶性化学信号可以通过膜脂双层结构进入胞内,其受体位于胞浆或胞核内(图21-6)。下面分别介绍这两种受体转导生物信号的特点。
第二节 细胞内受体的信号转导机理
脂溶性化学信号(如类固醇激素、甲状腺素、前列腺素、维生素A及其衍生物和维生素D及其衍生物等)的受体位于细胞浆或细胞核内。激素进入细胞后,有些可与其胞核内的受体相结合形成激素-受体复合物,有些则先与其在胞浆内的受体结合,然后以激素-受体复合物的形式进入核内。
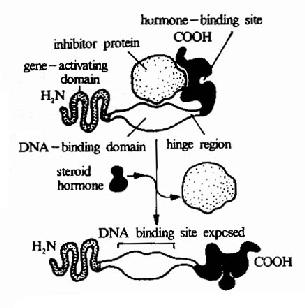
图21-7 类固醇激素及其受体的作用机理示意图
这些受体均属于转录因子,并具有锌指结构作为其DNA结合区(见第十九章)。在没有激素作用时,受体与热休克蛋白(Heat shock proteins, Hsps,见第一章)形成复合物,因此阻止了受体向细胞核的移动及其与DNA的结合。当激素与受体结合后,受体构象发生变化,导致热休克蛋白与其解聚,暴露出受体核内转移部位及DNA结合部位,从而激素受体复合物向内转移,并结合于DNA上特异基因邻近的激素反应元件(hormone response element, HRE)上(图21-7)。
不同的激素-受体复合物结合于不同的激素反应元件(表21-1)。结合于激素反应元件的激素-受体复合物再与位于启动子区域的基本录因子及其它的转录调节分子作用,从而开放或关闭其下游基因(见图17-6)。
表21-1 激素反应元件·(HRE)
| 激 素 | DNA序列(双股) |
| 糖皮质激素 | 5′AGAACA×××TGTTCT3′ |
| 3′TCTTGT×××ACAAGA5′ | |
| 雌激素 | 5′AGGTCA×××TGACCT3′ |
| 3′TCCAGT×××ACTGGA5′ | |
| 甲状腺素 | 5′AGGTCATGACCT3′ |
| 3′TCCAGTACTGGA5′ |
* X代表任一核苷酸
第三节 膜受体介导的信号转导
与脂溶性的化学信号不同,亲水性信号分子(所有的肽类激素、神经递质和各种细胞因子等)均不能进入细胞。它们的受体位于细胞表面。这些受体与信号分子结合后,可以诱导细胞内发生一系列生物化学变化,从而使细胞的功能如生长、分化及细胞内化学物质的分布等发生改变,以适应微环境的变化和机体整体需要。这一过程可以称之为跨膜信号转导。在这一信号转导过程中,信号分子不进入细胞。虽然有些信号分子与受体结合后可以发生内化(internalization),但这不是主要的作用方式。这种位于膜表面的受体所介导的信号传递主要表现为,各种参与信号传递的信号分子的构象、浓度或分布发生变化,各种信号分子之间发生相互识别和相互作用。
一、膜受体的分类
随着越来越多的膜表面受体被纯化,其结构及转导信号的方式逐步得以阐明。目前,按照受体的结构及其作用方式可将其分为三大类。这三大类受体在配体种类、受体的一般结构和功能及细胞对之发生反应的方式上有所不同,见表21-2。
Table 21-2 Classification of MembraneReceptors:Characteristics of Three Groups of Receptors
| Characteristics | Ion Channel Receptors | G-Protein-Linked receptors | Recetpors with a Single Transmembrane Domain |
| Endogenous ligands | Neurotransmitter | Neurotransmitter | Growth factor hormone |
| Hormone | Cytokine | ||
| Auloacoid | |||
| Chemotactic factor | |||
| Exogenous stimulant | |||
| Structure | Oligomer with a pore | Probably monomer | Monomer of oligoner |
| with (±)catalytic | |||
| domain | |||
| Number of transmem | Four per subunit | Seven | One per subunit |
| bane segments | |||
| Function | Ion channel | Activation of G proteins | Tyrosine kinase |
| Giuanylate cyclase(?) | |||
| Cellular responses | Depolarization or | Depolarization or | Regulation of function |
| hyperpolarization | hyperpolarization | and expression of | |
| Regulation of function | proteins | ||
| and expression of | Proliferation or | ||
| proteins | differentiation |
二、膜受体信号转导的分子机理
(一)离子通道型受体及其信号转导
离子通道型受体是一类自身为离子通道的受体。这种离子通道与受电位控制的离子通道及受化学修饰调控的离子通道不同,它们的开放或关闭直接受配体的控制,其配体主要为神经递质。
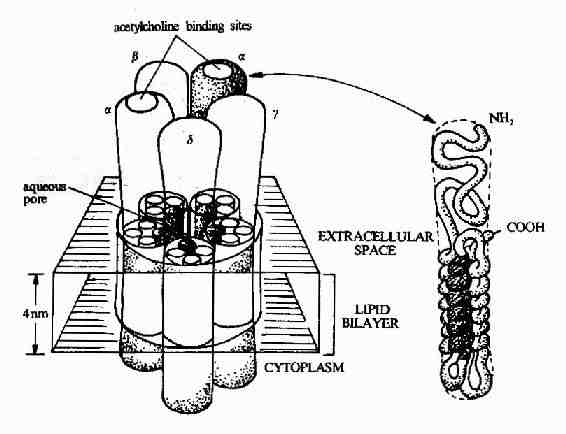
图21-8 乙酰胆碱受体的结构模式图
图21-8显示了作为离子通道受体的典型代表-乙酰胆碱受体的结构模式。乙酰胆碱受体是由5个同源性很高的亚基构成,包括2个α亚基,1个β亚基,1个γ亚基的和1个δ亚基。每一个亚基都是一个四次跨膜蛋白,分子量约60kd,约由500个氨基酸残基构成。推测跨膜部分为四条α螺旋结构,其中一条α螺旋含较多的极性氨基酸,就是由于这个亲水区的存在,使五个亚基共同在膜中形成一个亲水性的通道。乙酰胆碱的结合部位位于α亚基上。
乙酰胆碱受体可以以三种构象存在(图21-9)。两分子乙酰胆碱的结合可以使之处于通道开放构象,但即使有乙酰胆碱的结合,该受体处于通道开放构象状态的时限仍十分短暂,在几十毫微秒内又回到关闭状态。然后乙酰胆碱与之解离,受体则恢复到初始状态,做好重新接受配体的准备。
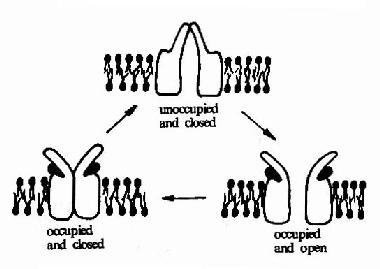
图21-9 乙酰胆碱受体的三种构象示意图
离子通道受体信号转导的最终作用是导致了细胞膜电位的改变,可以认为,离子通道受体是通过将化学信号转变成为电信号而影响细胞的功能的。
离子通道型受体可以是阳离子通道,如乙酰胆碱、谷氨酸和五羟色胺的受体,也可以是阴离子通道,如甘氨酸和γ-氨基丁酸的受体。
(二)G蛋白偶联型受体及其信号转导
G蛋白偶联型受体包括多种神经递质、肽类激素和趋化因子的受体,在味觉、视觉和嗅觉中接受外源理化因素的受体亦属G蛋白偶联型受体。这类受体在结构上均为单体蛋白,氨基末端位于细胞外表面,羧基末端在胞膜内侧。完整的肽链要反复跨膜七次(图21-10),因此亦有人将此类受体称为七次跨膜受体。由于肽链反复跨膜,在膜外侧和膜内侧形成了几个环状结构,它们分别负责与配体(化学、物理信号)的结合和细胞内的信号传递。其胞浆部分可以与一种GTP结合蛋白(简称G蛋白)相互作用,这种G蛋白是该信号传递途径中的第一个信号传递分子,这也是这类受体被称为G蛋白偶联型受体的原因。
图21-10 七次跨膜受体-G蛋白偶联型受体跨膜结构示意图
G蛋白偶联受体的信号传递过程包括(1)配体与受体结合,(2)受体活化G蛋白;(3)G蛋白激活或抑制细胞中的效应分子;(4)效应分子改变细胞内信使的含量与分布,(5)细胞内信使作用于相应的靶分子,从而改变细胞的代谢过程及基因表达等功能。本节将逐一介绍这一过程的主要环节。
1.G蛋白的循环或活化(G Protein Cycle)
G蛋白偶联型受体的信号转导途径中的第一个信号传递分子是G蛋白,其活化过程称为G蛋白循环。
G蛋白以α、βγ亚基三聚体的形式存在于细胞质膜内侧。α亚基已发现有20余种,分子量为36~52kd。α亚基具有多个活化位点,其中包括可与受体结合并受其活化调节的部位、与βγ亚基相结合的部位、GDP或GTP结合部位以及与下游效应分子相互作用的部位等等。α亚基还具有GTP酶活性。α亚基结合GDP时是无活性状态,而与GTP结合时则为有活性状态,GTP的水解又使其返回无活性状态。
G蛋白中的β和γ亚基亦有数种,但不及α亚基种类多。在细胞内,β和γ亚基形成紧密结合的二聚体,只有在蛋白变性条件下方可解离,因此可以认为它们是功能上的单体。βγ亚基的主要作用是与α亚基形成复合体并定位于质膜内侧。近年来的研究表明,βγ亚基亦可作用于其下游效应分子。
图21-11 G蛋白循环示意图
G蛋白循环的具体过程可见图21-11。当物理或化学信号刺激受体时,受体活化G蛋白使之发生构象改变。α亚基与GDP的亲和力下降,结合的GDP为GTP所取代。α亚基结合了GTP后即与βγ亚基发生解离,成为活化状态的α亚基。活化了的α亚基此时可以作用于下游的各种效应分子。这种活化状态将一直持续到GTP被α亚基自身具有的GTP酶水解为GDP。一旦发生GTP的水解,α亚基又再次与βγ亚基形成复合体,回到静止状态,重新接受新的化学信号。
由于G蛋白的种类不同,因此G蛋白可以作用于不同的效应分子,或对同一效应分子进行不同的调节。
2.效应分子及细胞内信使
G蛋白活化之后,可作用于腺苷酸环化酶和磷脂酶C等效应分子(Effector)上。有的α亚基(Gs)可以激活腺苷酸环化酶;有的α亚基(αi)可以抑制腺苷酸环化酶。腺苷酸环化酶催化ATP生成环状AMP(cAMP)的反应,因此细胞内的cAMP水平在配体与受体结合后,可受G蛋白α亚单位的作用而升高或降低,从而将细胞外信号转变为细胞内信号。这种细胞内信号可再作用于下游分子。这种细胞内信号的传递方式是G蛋白偶联型受体传递信号的主要方式,这些细胞内信号分子被称为细胞内信使。细胞内信使亦被称为第二信使。已知的细胞内信使包括cAMP、cGMP、甘油二酯(DAG)、IP3、和Ca2+等等(图21-12、13、14)。G蛋白的α亚基种类、其作用的效应分子及所调节的细胞内信使可参见表21-3。
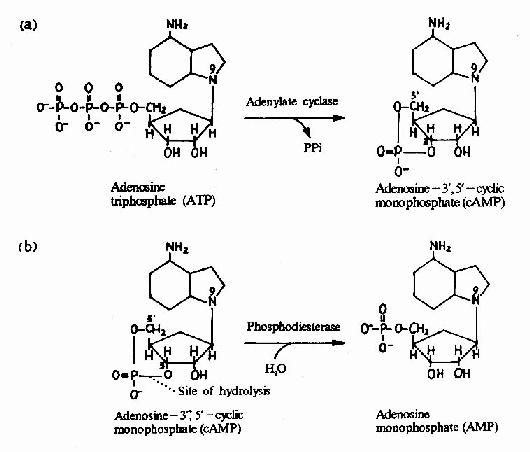
图21-12 cAMP的生成与水解
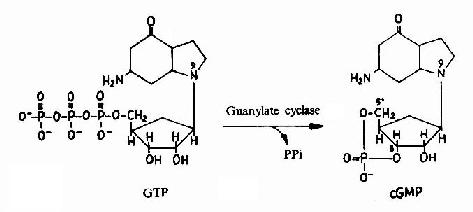
图21-13 cGMP的生成
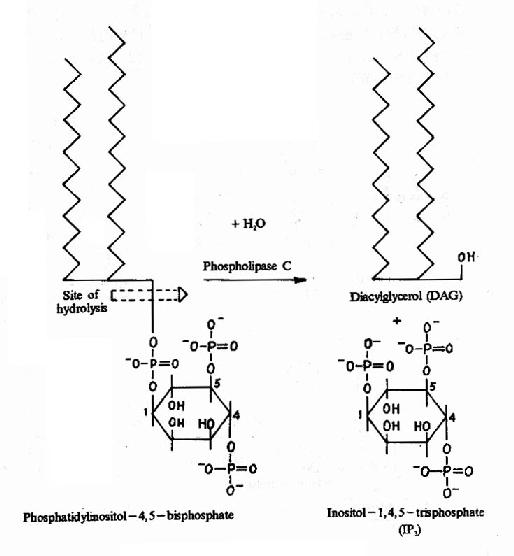
图21-14 DAG和IP3的生成
细胞内信使一般具有以下三个特点:(1)多为小分子,且不位于能量代谢途径的中心;(2)在细胞中的浓度或分布可以迅速地改变;(3)作为变构效应剂可作用于相应的靶分子,已知的靶分子主要为各种蛋白激酶。
表21-3 G蛋白的α亚基及其效应分子
| Ca种类 | 效应分子 | 细胞内信使 | 靶分子 |
| as | 腺苷酸环化酶活性急↑ | cAMP↑ | 蛋白激酶A活性↑ |
| ai | 腺苷酸环化酶活性↓ | cAMP↓ | 蛋白激酶A活性↓ |
| aq | 磷脂酶C活性↑ | Ca2+IP↑3DAG | 蛋白激酶C活化↑ |
| at | cGMP磷脂二酯酶↑活性 | cGMP↓ | Na+通道关闭 |
cAMP是第一个被发现的细胞内信使,催化它生成的腺苷酸环化酶为一重要的Gαi和Gαs的效应分子。cAMP是很多激素的细胞内信使。另一类重要的细胞内信使是在磷脂酰肌醇特异性磷脂酶C作用下,由PIP2(二磷酸磷脂酰肌醇)水解生成的三磷酸肌醇(IP3)和甘油二酯(DAG)。
需要指出的是,除G蛋白偶联型受体在其信号转导过程中需细胞内信使作为信号的传递者外,细胞内还存在受其它的信号转导方式调控的细胞内信使。九十年代以来,越来越多的以小分子物质作为细胞内信使参与细胞功能调控的过程得以阐明。
G蛋白偶联型受体在G蛋白介导下的信号传递过程可见图21-15和图21-16。
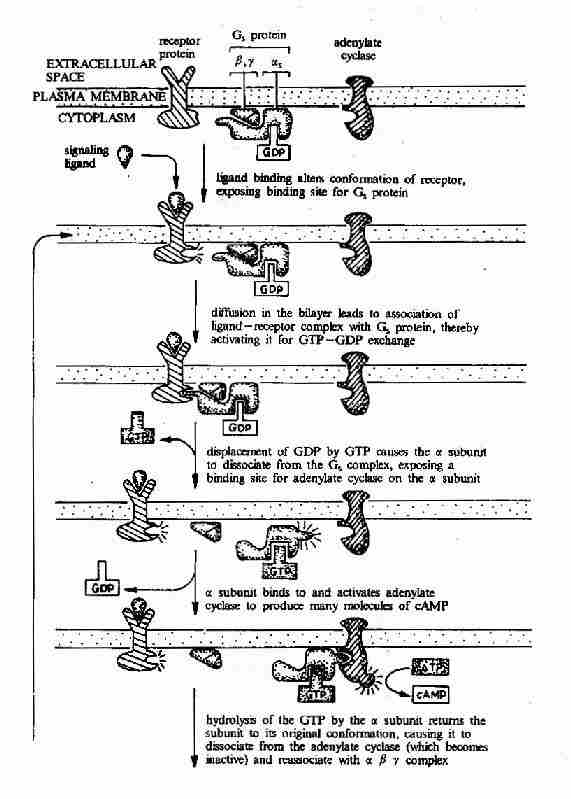
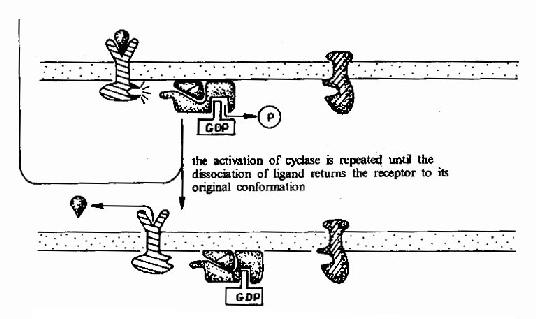
图21-15 G蛋白偶联型受体-G蛋白-腺苷酸环化酶信号转导途径示意图
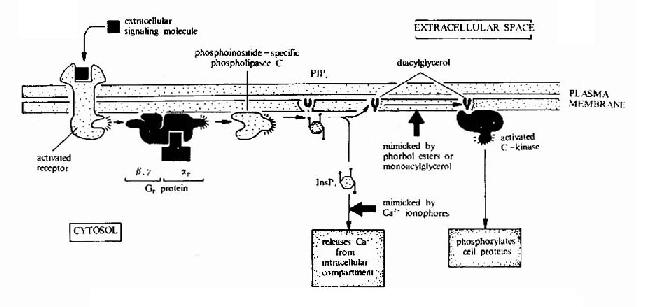
图21-16 G蛋白偶联型受体-G蛋白-磷脂酶C信号转导途径示意图
3.细胞内信使作用的主要靶分子
活化的Gα可作用于相应的效应分子,从而使相应的细胞内信使浓度发生迅速的改变。这些细胞内的信使可分别作用于相应的靶分子,从而使得细胞中的各种酶类和蛋白分子的活性发生改变。这些细胞内信使所作用的靶分子主要为各种蛋白激酶(表21-3)
(1)蛋白激酶A
cAMP作用于cAMP依赖性蛋白激酶(cAMP-dependent Protein Kinase,简称为cAPK),亦称为蛋白激酶A(Protein Kinase A, PKA),目前后一种命名较为公认。cAMP可以作为该激酶的变构激活剂,使无活性的蛋白激酶A转变为有活性的蛋白激酶A(详见第十一章,图11-4)。活化了的蛋白激酶A可作用于多种与糖脂代谢相关的酶类、一些离子通道和某些转导因子,使它们发生磷酸化并改变其活性状态。
(2)蛋白激酶G
细胞内的另一种环核苷酸信使为环鸟苷酸-cGMP。cGMP作用于cGMP依赖性蛋白激酶-cGMPdependent Protein Kinase, cGPK),亦称为蛋白激酶G(Protein Kinase G、PKG)。与PKA一样,PKG是目前较为公认的命名。蛋白激酶G以cGMP作为变构效应剂,在脑和平滑肌中含量较丰富。1997年,人们发现,PKG的基因突变与果蝇的觅食行为有关。我们可以推测,PKG很有可能在神经系统的信号传递过程中具有重要作用。
(3)蛋白激酶C
另外一些重要的细胞内信使还包括磷脂酰肌醇的衍生物如DAG、PIP3(三磷酸磷脂酰肌醇)、磷脂酰胆碱的衍生物、鞘磷脂的衍生物以及Ca2+等等。这些小分子信使的一个重要靶分子是蛋白激酶C(Protein KinaseC、PKC)。
PKC有多种同工酶形式,均以希腊字母排列,有PKCα、PKCβI、PKCβⅡ和PKCγ等等。不同的同功酶在结构和组织分布上各有不同,其对辅助因子(包括上述细胞内小分子信使)的需求亦有差别,并且对底物有选择性。
PKC在细胞的生长分化的调控中及其它多种细胞功能上具有关键性的调节作用,是一类非常重要的信号转导分子。细胞信号转导过程中的多条途径都可以导致PKC的活化。已经有很多实验研究证明,PKC的抑制剂可以使细胞失去对生长分化刺激信号的反应,表明这些功能都依赖于PKC的调控。例如,肥大细胞的脱颗粒反应(释放出大量组织胺等血管活性物质)是机体变态反应的重要形式之一。体外实验表明,如果用PKC抑制剂预先处理细胞,细胞就不会对刺激信号再发生脱颗粒反应。如果用改变细胞膜通透性的方式使胞内的PKC漏出,细胞也会失去发生脱颗粒反应的能力,此时若再加入PKC使之回到细胞中,则又可恢复细胞的脱颗粒反应。其它很多类似的实验亦表明,细胞的很多其它功能也受到PKC的调控。
(三)单次跨膜受体及其信号转导
多种生长因子和细胞因子的受体为一类结构上为单次跨膜的糖蛋白。与七次跨膜受体(G蛋白偶联型受体)相对应,将其称为单次跨膜受体,即它们的跨膜区仅为单向一次性的,而不像七次跨膜受体那样有反复的跨膜区段。
单次跨膜受体依照其结构特点可进一步分成多个家族和亚家族,其分类见表21-4及图21-7。
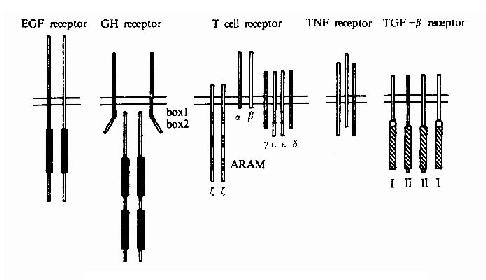
图21-17 各类单次跨膜受体的代表性举例
Table21-4Families of ReceptorsActivated by Dimerization or Oligomerization
| Receptor Type | Family | Examples | Characteristics |
| PDGF receptor | PDGFR-α,PDGFR-βSCFR | Five immunoglobulin-like | |
| family | (Kit),CSF-R(Fms),Flk-2 | domains extracellularly | |
| EGF receptor family | EGFR(ErbB),ErbB2(Neu),ErbB3,ErbB4 | Two cysteine-rich | |
| IGF receptor family | insulin R,IGF-1R | domains extracllularly | |
| HGF receptor family | HGFR(Met),MSPR(Ron) | Disulphide-bound heteroteramer of a and βchain | |
| VEGF receptor family | Flt-1,Flk-1(KDR) | Seven immunolobulin-like domains extracellularly | |
| Neurotrophin receptor family | Trk,TrkB,TrkC | ||
| Eph receptor family | Eph ,E1k,Eck,Cck5,Sek,Erk | Two FNIII-like domains and a cysteinerichdomain extracellularly | |
| Class 1 cytokine receptor family | |||
| CH receptor subfamily | GHR,EPOR,PRLR,G-CSFR | Form homodimers | |
| IL-3 receptor subfamily | IL-3R,GM-CSFR,IL-5R | Form complexes with the cβ subunit | |
| IL-6 receptor subfamily | IL-6R,LIFR,CNTFR,IL-11R | Form complexs with gp 130 | |
| IL-2receptor subfamily | IL-2R,IL-2Rβ,IL-4R,IL-7R | Form complexes with il-2Rγ | |
| IFN-α/βR,IFN-γRα,IFN-γRβIL-10R | |||
| TNF receptor family | TNFR-1,TNFR-11MLNGFR,CD40,OX-40,Fas,CD27,CD30 | Form trimers | |
| TCR | Complex of α,β,γ,δ,ε,ζandηsubunits | ||
| BCR | Complex of IgM and heterodimers ofα/βsubunits | ||
| Serine/threonine kinase receptor family | Type Ⅱ receptor family | TGFβR-Ⅱ,ActR-Ⅱ,ActR-ⅡB | Form hetero-oligomers with type Ireceptors,i, e,TGFβ-I,ActR-1,ActR-1B,BMPR-1A,BMPR-1B,ALK-1 |
Receptorfamilies and subfamilies discussed in the text are presented .Abbreviationsused: R, receptor; R, receptor; PDGF,platelet-derived growth factor; SCF, stemcell factor; CSF, colony-stimulationg factor; EGF,epidermal growth factor; FGF,fibroblast growth factor; IGF, insulin-like growth factor;HGF, hepatocytegrowth factor;MSP,macrophage-stimulating protein;VEGF,vascular endothelialgrowth factor;FN,fibronectin;GH,growthhormone;EPO,erythropoietin;PRL,prolactin;IL,interleukin;LIF,leukemia inhibitoryfactor;CNTR,ciliary neurotrophic factore;IFN,interferon;TNF,tumor necrosisfactor;Lngfr,low affinity nerve growth factor rcecptor;TCR,T ,cellrcecptor;BCR,B cell rcecptor;receptor;TGFR,transfoming growth factorβAct,activin;BMP,bone morphogenic protein,Alternative desingations are givenwithin parentheses.
单次跨膜受体所介导的信号传递与转换过程与G蛋白偶联型受体介导的信号转导有着很大差别。我们已经知道,G蛋白偶联型受体所介导的主要是经由G蛋白的激活,然后作用于相应的效应分子,接下来最主要的是导致细胞内信使含量及分布的迅速改变从而调节靶分子的活性并改变细胞的功能状态。单次跨膜受体介导的信号转导过程则主要是蛋白分子的相互作用,并且有蛋白酪氨酸激酶的广泛参与。对这些信号转导途径的了解在九十年代中取得了许多重要的进展。为跟踪和理解这些信号转导过程,我们首先需要知道参与这一过程的重要信号转导分子和其中的一些特殊结构。
1.几类重要的介导单次跨膜受体信号转导的蛋白分子的结构及功能
(1)蛋白激酶
蛋白激酶是指能够将γ-磷酸基因从磷酸供体分子上转移至底物蛋白的氨基酸受体上的一大类酶。磷酸供体可以是ATP,也可以是其它类三磷酸核苷酸。由于蛋白激酶常常是多底物的,因此蛋白激酶是根据底物中氨基酸残基的特异性而不是根据底物蛋白的特异性来分类的。国际生化学会命名委员会建议将蛋白激酶分为五大类:
| 激 酶 | 磷酸基团的受体 |
| 蛋白丝氨酸/苏氨酸激酶 | 丝氨酸/苏氨酸羟基 |
| 蛋白酪氨酸激酶 | 酪氨酸的酚羟基 |
| 蛋白组/赖/精氨酸激酶 | 咪唑环,胍基,ε-氨基 |
| 蛋白半胱氨酸激酶 | 巯基 |
| 蛋白天冬氨酸/谷氨酸激酶 | 酰基 |
前两类激酶目前了解的较多,很多已经获得了cDNA克隆,但对后两者的了解仍很有限。
蛋白丝/苏氨酸激酶和蛋白酪氨酸激酶的分类见表21-5。
表21-5 蛋白激酶分类
| 1.蛋白丝氨酸/苏氨酸激酶 |
| (1) Cyclic nucleotide regulated |
| A. PKA α cAMPdependent protein kinase catalytic,α form |
| B. PKA βcAMPdependent protein kinase catalytic, β form |
| C. PKA γcAMPdependent protein kinase catalytic,γ form |
| D. cGPKα cGMPdependent protein kinase α form |
| E. cGPKβ cGMPdependent protein kinase β form |
| (2) Diacylglycerol regulated:[BH] |
| PKC α protein kinase C α |
| PKC β protein kinase C β |
| PKC γ protein kinase C γ |
| PKC δ protein kinase C δ |
| PKC ε protein kinase C ε |
| PKC ζ protein kinase C ζ |
| PKC η protein kinase C η |
| (3)Calcium/calmodulin regulated[BH] |
| CaMⅠ Calcium/calmodulindependent protein kinase Ⅰ |
| CaMⅡα Calcium/calmodulindependent protein kinase Ⅱα |
| CaMⅡβ Calcium/calmodulindependent protein kinase Ⅱβ |
| CaMⅡγ Calcium/calmodulindependent protein kinase Ⅱγ |
| CaMⅢCalcium/calmodulindependent protein kinase Ⅲ |
| CaMⅣCalcium/calmodulindependent protein kinase Ⅳ |
| PSKHI Putative proteinserine kinase |
| (4) Ribosomal S6 protein kinase |
| S6kⅠ,S6KⅡ,70kDaS6 |
| (5) Serpentine receptor kinase |
| ① β ARK βAdrenergic receptor protein kinase |
| ② β ARKrelated protein kinase |
| ③ Rhodopsin kinase |
| (6) Casein kinase Ⅱ |
| (7) Glycogen synthase kinase 3 |
| (8) cdc 2 family |
| (9) cdc 2 related protein kinase |
| (10)MAP kinase (mitogen activated protein kinases) |
| EPK-1, ERK-2, ERK-3, ERK-5(extracellular signal-regulated kinase) |
| JNK(c-Jun N-terminal kinase), P38, etc. |
| (11)MOS/Raf protein kinase |
| 2.蛋白酪氨酸激酶 |
| (1) Growth factor receptors |
| EGFR: EGFR.erbB2,erbB3 |
| INSR:INSR, IGF1R |
| FGFR:FGFR, FGFR2, ckit |
| DGFR:PDGFR, CSFIR |
| (2) Nonreceptor tyrosine kinase |
| src family: src,Yes,Lyn,Fyn,Lck,etc |
| Syk family:Syk, ZAP70 |
| JAK family: JAK1,JAK2, JAK3 |
| Tec family: Btk,Itk,etc |
表中列出的多种蛋白激酶都属于重要的信号转导分子,在此不可能一一介绍。在这些蛋白激酶中,对于细胞功能影响较大的有PKA、PKG、PKC、MAPK和PTK等。PKA、PKG和PKC已在G蛋白偶联受体中提及,因此这里仅介绍MAPK和PTK。
①MAP激酶(Mitogen Activated Protein Kinase, MAPK)
MAPK属于蛋白丝/苏氨酸激酶,是接受膜受体转换与传递的信号并将其带入细胞核内的一类重要分子,在多种受体信号传递途径中均具有关键性作用。在未受刺激的细胞内,MAPK为静止型,当其接收上游分子棗MAPKK(MAp Kinase Kinase)的磷酸化调控信号后,MAPK中相邻的苏氨酸和酪氨酸均被磷酸化,从而成为活化形式的MAPK(图21-18)。目前在MAPK的上游存在着一个
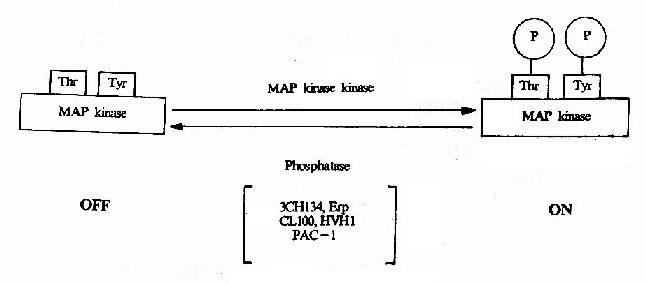
图21-18 MAPK的活化
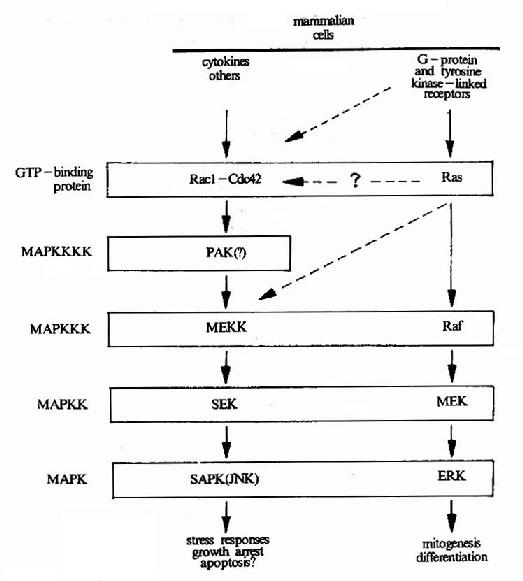
图21-19 MAPK的逐级激活
由蛋白激酶构成的MAPK逐级激活系统。上述使MAPK磷酸化的MAPKK又受到MAPKKK(MApKinase Kinase Kinase)的调节。这种逐级激活系统又再受其上游分子的调控(图21-19)。
MAPK被激活以后,转移至细胞核内。在核内,它可以使一些转录因子发生磷酸化从而改变胞内基因表达的状态。另外,它也可以使一些其它的酶发生磷酸化使之活性发生改变。目前已经知道,MAPK参与多种细胞功能的调控,尤其是在细胞增殖、分化及凋亡过程中,它具有关键性作用。
MAPK途径在果蝇中已发现了7种不种类型,在哺乳动物细胞中已证实至少有三种MAPK成员,即ERK、JNK和P38。它们的调控机制和作用的靶分子均有所差异。
②蛋白酪氨酸激酶(Protein Tyrosine Kinase, PTK)
蛋白酪氨酸激酶作用于蛋白质中的酪氨酸残基使之磷酸化,很多细胞信号转导的最早期事即为多种蛋白质的酪氨酸磷酸化。在细胞的生长与分化过程中,酪氨酸磷酸化大部分具有正向调节作用,无论是生长因子作用后正常细胞的增殖、恶性肿瘤细胞的增殖,还是T细胞、B细胞或肥大细胞的活化都伴随着瞬间发生的多种蛋白分子的酪氨酸磷酸化。蛋白酪氨酸激酶的抑制剂可以阻断上述细胞的应答反应。
根据蛋白酪氨酸激酶在细胞内的位置可以将其分为三类:
A.蛋白酪氨酸激酶受体
这一类蛋白酪氨酸激酶为跨膜蛋白,其胞外部分为配体结合区,中间有跨膜区,胞内部分含有蛋白酪氨酸激酶的催化结构域(图21-17)。
蛋白酪氨酸激酶受体与配体结合后往往形成二聚体,继而发生酶活性的增高,使受体胞内部分的酪氨酸磷酸化增强,磷酸化的受体酶活性进一步增强。此外更重要的是,磷酸化的受体可以慕集含有SH2结构域(见后)的信号分子,从而将信号传递至下游分子。
B.位于胞浆部分的蛋白酪氨酸激酶
胞浆内亦含有多种PTKs,这些蛋白激酶或接受受体传递的激活信号,或受其它蛋白质的调节而发生活性改变,其主要作用是作为受体和最终效应分子之间的中间介导分子。已知的主要种类有:
(1)src家族:src、Fyn、Lck、Lyn等,与受体结合存在,当配体与受体结合后被激活;
(2)Tec家族:Btk、Itk、Tec等,与受体结合或不结合存在,配体结合后被激活;
(3)ZAP70家族:ZAP70和Syk,与磷酸化的受体结合后被激活;
(4)JAK家族:JAK1、JAK2、JAK3等。
这些PTKs或者直接与受体形成复合物,或者间接地依次被激活,在传递受体信号过程中起着接力棒的作用。它们的结构见图21-20。
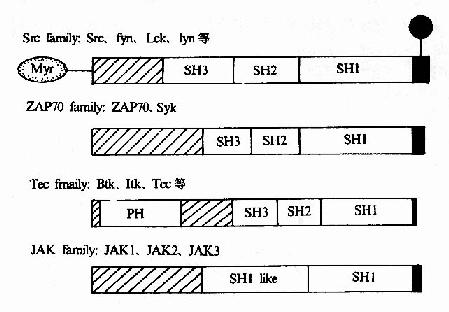
图21-20 胞浆PTK的结构
C.核内蛋白酪氨酸激酶
大部分的酪氨酸蛋白激酶位于胞膜上或胞浆内,近年来却发现核内也存在着酪氨酸蛋白激酶,这对于信号在核内的传递有重要意义。重要的核内PTKs有Abl和Wee。Abl既存在于胞核内,也存在于胞浆中,已发现它参与转录过程和细胞周期的调节;Wee只存在于核内,它可调节Cyclin-2的活性,抑制其磷酸化,对细胞进入有丝分裂期具有调节作用。
(2)蛋白磷酸酶(Protein Phosphotase)
蛋白磷酸(酯)酶是指具有催化已经磷酸化的蛋白分子发生去磷酸化反应的一类酶分子。它们与蛋白激酶相对应存在,共同构成了磷酸化与去磷酸化这一重要的蛋白质活性的开关系统。正如蛋白激酶催化的磷酸化由于底物不同,有的表现为活性增高,有的表现为活性降低一样,蛋白磷酸酶所催化的去磷酸化反应也对于不同的底物有不同的反应(图21-21)。
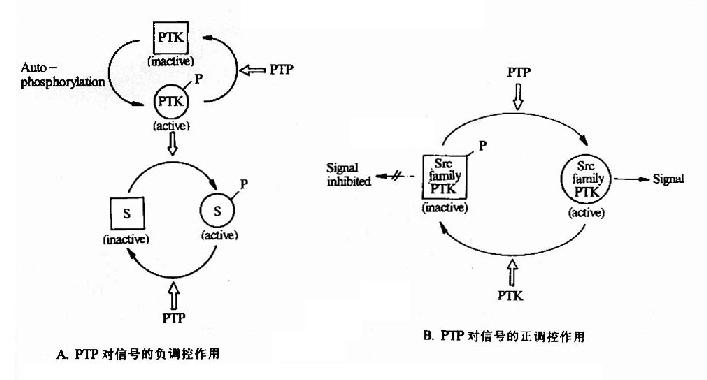
图21-21 蛋白酪氨酸磷酸酶对蛋白酪氨酸激酶的调控作用
PTK:Protein Tyrosine Kinase PTP:Protein Tyrosine Phosphotase S:Substrate
蛋白磷酸酶的分类也与蛋白激酶类似,是根据它所作用的氨基酸残基决定的。目前已知的蛋白磷酸酶包括蛋白丝氨酸/苏氨酸磷酸酶和蛋白酪氨酸磷酸酶两大类,另外还有个别的蛋白磷酸酶具有双重作用,即可同时作用于酪氨酸和丝氨酸残基。
蛋白激酶和蛋白磷酸酶均作用于有限的底物,它们的催化作用的特异性及其在细胞内的分布特异性决定了信号转导途径的精确性。
(3)低分子量G蛋白(Small G Protein)
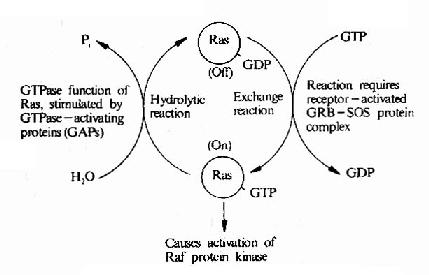
图21-22 Ras的活化及其调控因子
低分子量GTP结合蛋白在多种细胞反应中具有开关作用,它们位于MAPK系统的上游,是一类重要的信号转导分子。第一个被发现的低分子量G蛋白是Ras,因此这一类蛋白质被称为Ras超家族成员。由于它们均由一个GTP酶结构域构成,亦将之称为Ras样GTP酶。
低分子量G蛋白的共同特点是,当结合了GTP时即成为活化形式,这时可作用于下游分子使之活化,而当GTP水解成为GDP时(自身为GTP酶)则回复到非活化状态。这一点与Gα类似,但是Ras家族的分子量明显低于Gα。
在细胞中存在着一些专门控制低分子量G蛋白活性的低分子量G蛋白调节因子,这些调节因子受膜受体信号的影响,调节低分子量G蛋白活性,低分子量G蛋白再作用于MAPK系统。在这些调节因子中,有的可以增强低分子量G蛋白的活性,如鸟嘌呤核苷酸交换因子(GEF)和鸟嘌呤核苷酸解离抑制因子(GDI),有的可以降低低分子量G蛋白活性,如GTP酶活化蛋白(GAP)等(图21-22)。
目前已知的Ras超家族成员已超过50种,它们又可以分为数个亚家族,在细胞内分别控制不同的信号转导途径,每一个成员都有其各自的特点。
(4)介导信号转导分子相互作用的结构元件
细胞中存在着众多的信号转导分子,它们是如何相互识别、相互作用而构成不同的细胞转导途径的呢?90年代以来,人们逐步发现了在信号转导分子中存在着一些特殊的结构域。这些结构域大约由50~100个氨基酸构成,它们在不同的信号转导分子中具有很高的同源性。这些结构域的作用是在细胞中介导信号转导分子的相互识别,共同形成不同的信号传递链或称为信号转导途径(Signal Transduction Pathway),并进而形成信号转导的网络(SignalTransduction Network)。换句话讲,这些结构域像电路中的接头元件一样把不同的信号分子连接起来。这些结构域被称为调控结合元件(Modular Binding Domain)。目前已经知道了近十种这样的结构域,例如:
SH2 domain (src Homology 2domain)
SH3 domain(src Homology 3 domain)
PH domain (Pleckstrin Homology domain)
PTB domain(Protein TyrosineBinding domain)
A.SH2结构域:由约100个氨基酸组成,介导信号分子与含磷酸酪氨酸蛋白分子的结合。这种结合依赖于酪氨酸残基的磷酸化及其周围的氨基酸残基所构成的基序(motif)。
例:YEEI与src family的SH2结合
YMXM与growth factor receptor、P13Kp85的SH2结合
YVIP与PLCγ的SH2结合
YXNX与Grb2的SH2结合
B.SH3结构域:由50~100个氨基酸组成,介导信号分子与富含脯氨酸的蛋白分子的结合,其亲和力亦与脯氨酸残基及邻近氨基酸残基所构成的基序序列相关。
例:RKLPPRPSK与P13K的亲和力为9.1μM
PALPPLPRY与P13K的亲和力为17μM
C.PH结构域:由100~120个氨基酸组成,其功能尚未完全确定。目前已知它可以与磷脂类分子PIP2、PIP3、IP3等结合。同时也发现,一些蛋白分子,如PKC和G蛋白的βγ亚单位也可以与PH结构域结合。
D.PTB结构域:由约160个氨基酸组成,与SH2一样,PTB结构域也可以识别一些含磷酸酪氨酸的基序,但其结合基序与SH2结构域有所差别。
作为调控结合元件,它们在结构和功能上有如下特点:
①一个信号分子可以含有两种以上的调控结合元件(图21-23),因此可以同时与两种以上的其它信号分子相结合,例如,在蛋白酪氨酸激酶Btk中即有PH结构域、SH3结构域和SH2结构域等3个调控结合元件。
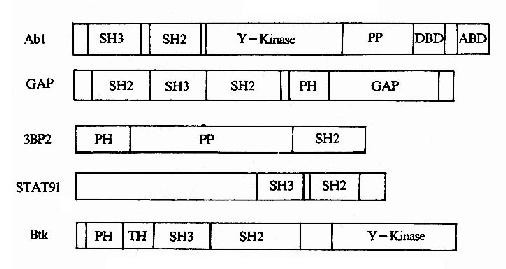
图21-23 信号转导分子中的调控结合元件
Y-Kinase:tyrosine kinaseDBD:DNA binding domain PP:Prorich
ABD:actinbinding domainGAP: GTPase activating domain
②同一类调控结合元件可存在于多种不同的信号转导分子中,例如,PH结构域存在于某些蛋白激酶、低分子量G蛋白调节分子及细胞骨架蛋白等多种信号转导分子中。这些调控结合元件的一级结构仍然是不同的,因此对所结合的信号分子具有选择性,这是保证信号分子相互作用具有特异性的基础。
③这些结构域本身均为非催化结构域。
2.两条典型的信号转导途径
(1)表皮生长因子受体介导的信号转导途径
表皮生长因子与其受体-表皮生长因子受体结合后可引发一系列细胞内变化,最终使细胞发生分化或增殖。表皮生长因子受体是一种受体酪氨酸蛋白激酶,而受体酪氨酸蛋白激酶→Ras→MAPK级联途径是表皮生长因子刺激信号传递到细胞核内的最主要途径。它由以下成员组成:表皮生长因子受体→含有SH2结构域的接头蛋白(如Grb2)→鸟嘌呤核苷酸释放因子(如SOS)→Ras蛋白→MAPKKK(如Raf1)→MAPKK→MAPK→转录因子等(图21-24)。
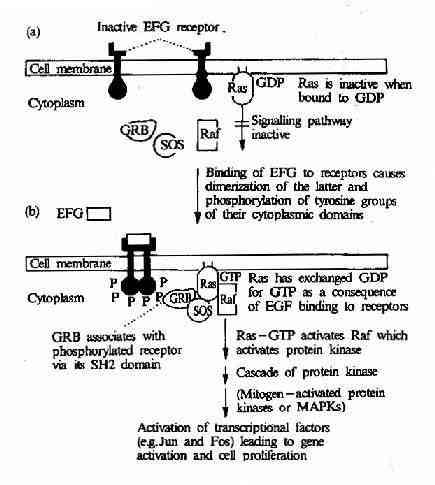
图21-24 EGF受体介导的信号转导过程
表皮生长因子与受体结合后,可以使受体发生二聚体化,从而改变了受体的构象,使其中的蛋白酪氨酸激酶活性增强,受体自身的酪氨酸残基发生磷酸化,磷酸化的受体便形成了与含SH2结构域的蛋白分子Grb2结合的位点,导致Grb2与受体的结合。Grb2中有两个SH3结构域,该部位与一种称为SOS的鸟苷酸交换因子结合,使之活性改变,SOS则进一步活化Ras,激活的Ras作用于MAPK激活系统,导致ERK的激活。最后ERK转移到细胞核内,导致某些转录因子的活性改变从而改变基因的表达状态及细胞的增殖与分化过程。
(2)γ-干扰素受体介导的信号转导
γ-干扰素是由活化T细胞产生的,它具有促进抗原提呈和特异性免疫识别的作用,并可促进B细胞分泌抗体。γ-干扰素与受体结合以后,也可以导致受体二聚体化,二聚体化的受体可以激活JAK-STAT系统,后者将干扰素刺激信号传入核内。JAK(Janus Kinase)为一种存在于胞浆中的蛋白酪氨酸激酶,它活化后可使干扰素受体磷酸化。STAT(Signal Transducerand Activator of Transcription)可以通过其SH2结构域识别磷酸化的受体并与之结合。然后STAT分子亦发生酪氨酸的磷酸化,酪氨酸磷酸化的STAT进入胞核形成有活性的转录因子,影响基因的表达(图21-25)。
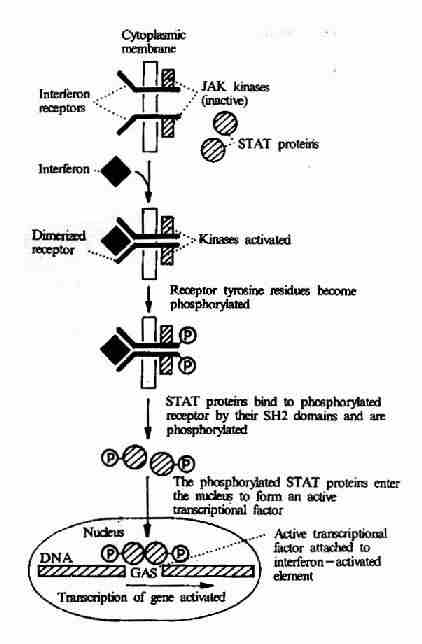
图21-25 γ-干扰素受体介导的信号转导过程
JAK:Janus kinase
STAT: Signal Transducer andActivator of Transcription
GAS: γinterferonactivated sequenceelement
上述两条信号转导途径仅仅是多种信号转导途径的代表,尽管90年代以来科学家们在细胞信号转导的分子机理研究方面已经取得了一些成就,但距离阐明细胞中存在的全部传递网络系统还十分遥远,有待科学家们不断努力,在下个世纪实现人类认识自我的愿望。
第二十二章 癌基因与抑癌基因(Oncogene and anti-oncogene)
癌基因(oncogene)一般可定义为某种基因,它的异常表达或表达产物的异常直接决定细胞恶性表型的产生。
抑癌基因或称抗癌基因(anti-oncogene)与肿瘤抑制基因(tumor suppressor gene)属同义词,是指某种基因当其受阻抑、失活、丢失、或其表达产物丧失功能可导致细胞恶性转化;反之,在实验条件下,若导入或激活它则可抑制细胞的恶性表型。
一、癌基因的发现
现已知道在肿瘤发生中,作为环境因素的病毒、化学致癌物和射线,它们作用于机体内的靶分子都是DNA,在研究肿瘤病毒如何使宿主细胞转化和研究肿瘤DNA能否使培养的经两条实验途径中,殊途同归,发现了癌基因,早在本世纪初,Rockefeller研究所的Rous医生将鸡肉瘤组织匀浆后的无细胞滤液皮下注射于正常鸡,发现可以引起肿瘤,可惜当时对病毒还缺乏认识,直到五十年代才重新发现原来致瘤的因素是病毒,并以Rous医生的名字命名为罗氏肉瘤病毒(Rous Sarcoma Virus ,RSV)。1975年,Bishop从RSV中分离到第一个病毒癌基因src,该基因编码分子量为60kDa的磷蛋白质,以pp60src表示。
1976年Stehelin以实验证明正常鸡成纤维细胞基因组中存在有与病毒癌基因src的同源序列。此后陆续发现许多禽类和鼠类病毒部基因也有类似情况,即宿主细胞基因组中含有病毒癌基因的同源序列,称之为细胞癌基因(c-oncogene,c-onc)。
那么,v-onc与c-onc的关系如何?这可从二者结构的比较和逆转录病毒感染宿主后的生活史或复制周期两方面加以分析。
首先,从结构上看c-onc是间断的,这是真核基因的特点,即有内含子因而基因的跨度较大。然而v-onc却是连续的,没有内含子,所以基因跨度较小,以v-onc和c-src为例如图22-1。再从逆转录病毒感染宿主细胞后的复制周期(图22-2)分析。
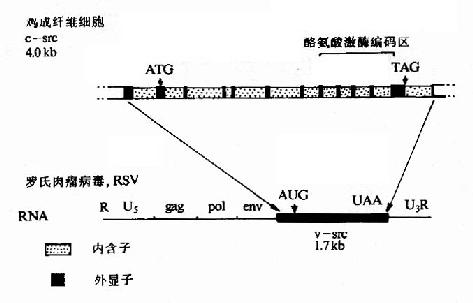
图22-1 c-src和v-src结构的比较
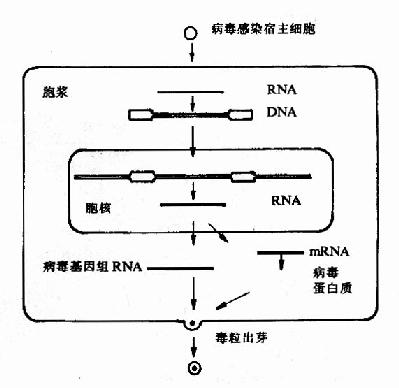
图22-2 逆转录病毒正常复制周期主要步骤
不难看出,v-onc原本不是病毒的基因,而是动物细胞正常基因的一个复本。当病毒在宿主细胞内复制时,由于DNA重组而将宿主细胞基因中带有v-onc的序列重组到病毒的基因组内。所以说c-onc是v-onc原型,又称为原癌基因(proto-oncogene)。
病毒癌基因对病毒本身无关紧要,却可使宿主细胞转化,引起肿瘤,而细胞癌基因对细胞的生长、分化和功能活动却是至关紧要的。正常的细胞癌基因并不致癌,只是当它们异常表达或其表达产物异常时才会导致细胞的恶性转化,迄今发现的细胞癌基因都是一些有十分重要的功能“看家基因”,而且是高度保守的,例如人与小鼠的K-ras基因产物K-Ras的氨基酸序列相差仅为1%,人与大鼠的H-ras基因产物H-Ras的氨基酸序列完全相同。
逆转录病毒属于RNA肿瘤病毒,在DNA肿瘤病毒的基因组也存在着能使宿主细胞转化的基因,例如腺病毒的E1A、E1B基因,多瘤病毒的大T、中T基因。人乳头瘤病毒的E6、E7基因,以及DV40中的大T基因。它们为病毒复制所必需,同时又有使宿主细胞转化的作用,故沿用原名,不另以癌基因命名。
细胞癌基因可按其表达产物的功能和定位分类如表22-1。
表22-1 细胞癌基因按其产物定位和功能分类
| 定位 | 功能 | 癌基因,产物 |
| 分泌蛋白 | 生长因子 | sis PDGFβ链 |
| 跨膜蛋白 | 受体型酪氨酸激酶 | erb B ,EGF受体 erb B2 ,EGF样受体 (neu) fms ,CSF-1受体 |
| 膜结合蛋白 | G-蛋白 非受体型酪氨酸激酶 |
ras p21ras src pp60src |
| 胞浆可溶性蛋白 | 非受体型酪氨酸激酶 丝氨酸/苏氨酸激酶 信号转导连接蛋白 |
ab1 raf crk,SH2/SH3调节蛋白 vav ,SH2调节蛋白 |
| 胞核蛋白 | 转录因子 | myc myb fos jun erb A,T3受体 |
从上表可以看出,所有细胞癌基因均在信号转导中扮演着重要角色。正因为如此,它们的异常或“变质”--表达失控或表达产物异常--对细胞的危害就很大,既然v-onc只是c-onc的一个复本,那么为什么c-onc本不致癌而v-onc又会致癌呢?实验证明,v-onc的致癌或由于表达的失控,或由于基因的突变,导致产物的量的增多或质的改变。
已知从自然发生的人肿瘤组织提取的DNA可以转化HIH/3T3细胞,尽管只有10%的人的肿瘤DNA具有转化此种细胞的能力,但癌基因已在所有主要类型人肿瘤中检出,最先是从T24/EJ膀胱癌细胞系检查到的,属于ras家族成员,以后又用核酸探针检测出正常人的细胞基因组中有ras同源序列存在,与T24细胞中的ras不同,无转化能力,二者差别仅仅在于一个点突变(第12位氨基酸密码子的G突变为T)。
二、细胞癌基因的激活
细胞癌基因的激活是指原本不致癌c-onc在特定的情况下转变成致癌性的,大体上有以下几种激活方式。
1、插入激活 例如逆转录病毒MoSV感染鼠类成纤维细胞后,病毒基因组的LTR整合到细胞癌基因c-mos邻近处,使c-mos处于LTR的强启动子和增强子作用之下而被激活,导致成纤维细胞转化为肉瘤细胞,又如禽类白细胞增生病毒ALV的E成分整合到鸡细胞基因组c-myc附近。可使c-myc激活。因此在基因治疗中使用逆转录病毒载体时必需考虑细胞癌基因的插入激活问题。
2、突变激活 典型的是各种ras基因的激活,参看表22-2。
表22-2 正常Ras蛋白和转化Ras蛋白中氨基酸的变异
| ras基因 | 氨基酸的位置 | |||
| 12 | 13 | 59 | 61 | |
| H-ras-1来源的 正常人c-H-ras-1 人EJ膀胱癌症 人HS242乳癌 鼠Harvey病毒v-H-ras |
Gly GGC Val GTC Arg CGC |
Gly | Ala Thr |
Gln CAG Leu CTG |
| K-ras-2来源的 正常人c-K-ras-2 人Caalu肺癌 人SW480结肠癌 鼠Kirsten病毒v-K-ras |
Gly Lys TGT Val GTT Ser |
Gly | Ala Thr |
Gln |
| N-ras来源的 正常人N-ras 人神经母细胞瘤 人早幼粒细胞白血病细胞系 人纤维肉瘤 人AML33 |
Gly | Gly Asp |
Ala | Gln Lys Lys Lys |
ras基因的表达产物Ras是一种小分子G蛋白,在信号转导中起重要作用,正常Ras的作用因其自身的GTP酶活性而受到严格控制,而突变了的Rad其GTP酶活性下降或丧失,失去了原有控制,致使增殖信号持续作用,细胞发生恶性转化,如图22-3所示。
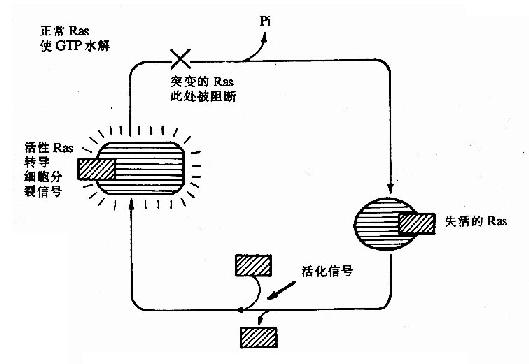
图22-3 Ras与GTP/GDP的相互作用及突变的RasR的作用
3、基因扩增 已发现人类肿瘤细胞中扩增的细胞癌基因如下表。
表22-3 人类肿瘤细胞中扩增的细胞癌基因
| c-onc | 肿瘤 | 扩增倍数 | DM/HSR* |
| c-myc | 早幼粒白血病细胞系HL60 | 20× | + |
| 小细胞肺癌细胞系 | 5-30× | ? | |
| N-myc | 原发神经母细胞瘤Ⅲ-Ⅳ级及神经母细胞瘤细胞系 | 5-1000× | + |
| 视网膜母细胞瘤 | 10-200× | + | |
| 小细胞肺癌 | 50× | + | |
| L-myc | 小细胞肺癌 | 10-20× | ? |
| c-myb | 急粒AML | 5-10× | ? |
| 结肠癌细胞系 | 10× | ? | |
| c-erbB | 类表皮癌细胞系,原发胶质瘤 | 30× | ? |
| c-K-ras | 原发肺癌,结肠癌,膀胱癌,直肠癌 | 4-20× | ? |
| N-ras | 乳癌细胞系 | 5-10× | ? |
*DM:双微体;HSR:均匀染色区
4、基因重排/染色体易位
典型的如伯基特淋巴瘤细胞的染色体易位t(8:14),致使c-myc激活,参看表22-4和图22-4。
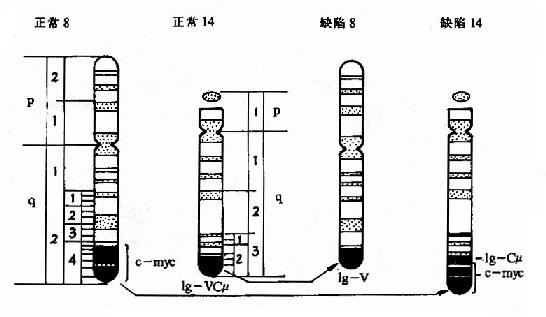
图22-4 Burkitt淋巴瘤常见的染色体易位t(8:14)
表22-4 染色体异常与癌基因重排
| 癌基因 | 染色体定位 | 异常 | 人类肿瘤 |
| c-myc | 8q24 | t(8:14),t(8:22) | Burkitt淋巴瘤 |
| t(2:8) | |||
| bcl-1 | 11q13 | t(11:14) | B细胞淋巴瘤 |
| bcl-2 | 18q21 | t(14:18) | |
| tcl-2 | 11q13 | t(11:14) | T细胞淋巴瘤 |
| c-abI | 9q34 | t(9:22) | 慢粒CML |
| bcr | 22q11 | ph | |
| c-mos | 8q22 | t(8:21) | 急粒AML |
| c-myb | 6q22-24 | t(6:14) | 卵巢癌 |
| c-sis | 22q12 | t(11:22) | Erwing网瘤 |
| blym | 1q32-ter | 缺失,HSR | 神经纤维瘤 |
| c-K-ras | 6q21 | 断裂 | ANLL |
| 6q三体性 | 视网膜母细胞癌 | ||
| c-erbA | 17q21 | 断裂 | ANLL |
已知B淋巴细胞中免疫球蛋白重链基因表达十分活跃,其启动子为强启动子,且在CH-VH之间还有增强子区,c-myc易位后与IG重链基因的调控区为邻,因而被激活。正常情况下,位于c-myc5’端的两个启动子受到c-myc产物的反馈抑制,由此重排时5’端序列有丢失,结果摆脱了抑制而表达增强。
不同的癌基因有不同的激活方式,一种癌基因也可有几种激活方式。例如c-myc的激活就有基因扩增和基因重排两种方式,很少见c-myc的突变;而ras的激活方式则主要是突变,1985年Slamon检测了20种54例人类肿瘤中的15种癌基因,发现所有肿瘤都不止一种癌基因发生改变。细胞转化实验证明,各种癌基因之间存在协同作用。例如,单独v-myc或EJ-ras都不能使大鼠胚胎成纤维细胞转化,但是若将二者共转染PEF,8天后80%的细胞发生变化,那么为什么单独EJ-ras又可使Rat-1细胞转化呢?原因是该细胞并非正常,而是已经永生化了的细胞,如果先用化学诱癌物或射线使正常大鼠原代成纤维细胞永生化,然后再用EJ-ras转染,则可使之转化,因此Weingerg按转染细胞表型的变化将癌基因分为两个类,一类是核内作用的能使细胞永生化的癌基因,例如myc,fos等,另一类是引起细胞恶性表型变化的定位于质膜和胞浆的癌基因,例如ras、erbB、src等。事实表明肿瘤的发生是多步骤,多因素的,不同的癌基因作用于肿瘤发生的不同阶段。
不仅癌基因之间有协同作用,癌基因与抑癌基因之间也存在协同作用。
三、抑癌基因
抑癌基因又称肿瘤抑制基因,它的发现较癌基因晚,迄今克隆到的抑癌基因的数目亦较少,这并不意味着客观存在的抑癌基因就一定比癌基因少,只是由于技术上的原因,要想分离、鉴定、确认一个抑癌基因比较困难。
早在六十年代,有人将癌细胞与同种正常双倍体成纤维细胞融合,所获杂种细胞的后代只要保留某些正常亲本染色体时就可表现为正常表型。然而,随着染色体的丢失又可重新出现恶变细胞。这一现象表明,正常染色体内可能存在某些抑制肿瘤发生的基因,它们的丢失、突变或失去功能,好可使潜在的致癌因素如激活的癌基因发挥作用而致癌。
遗传学分析表明,人类的许多肿瘤细胞都有隐性遗传损害,已在染色体上定位的损害见表22-5。
表22-5 人类肿瘤的隐性遗传损害
| 肿 瘤 | 受损害的染色体 |
| 神经母细胞瘤、黑色素瘤、甲状腺癌嗜铬细胞瘤、MEN2 | 1p |
| 乳癌 | 1p |
| 小细胞肺癌、宫颈癌、肾细胞癌、肺腺癌 | 3p |
| 结直肠癌、家族性息肉 | 5p |
| 膀胱癌 | 9p |
| 星状细胞瘤、MEN2 | 10p |
| 膀胱癌、乳癌、横纹肌肉瘤、肝母细胞瘤胚胎瘤、肾母细胞瘤(Wilm's Tumor)肺癌 | 11p |
| MEN1 | 11p |
| 视网膜母细胞瘤、成骨肉瘤、小细胞肺癌、胃癌、结肠癌、乳癌 | 13p |
| 小细胞肺癌、结肠癌、乳癌、成骨肉瘤、星状细胞瘤、肺磷癌 | 17p |
| NF1 | 17p |
| 结肠癌 | 18p |
| 听神经瘤、脑膜瘤、NF2、嗜铬细胞瘤 | 22p |
抑癌基因概念是在研究视网膜母细胞瘤(Retinoblastoms ,RB)的遗传损害时提出来的。RB有家族性和散发性两种类型,其发闰机制不同。前者有先天的隐性遗传损害,其种系基因是有缺陷的,患RB的频率可高达80-90%,且往往是双侧,散发性RB,两次体细胞突变发生在同一个细胞,机率很小,患病也是单侧,Kundson早在1971年就提出RB发病的“两次击中学说”。现代分子遗传学分析手段的发展充分支持这一学说(图22-5)。1986年Draper统计,RB携带者发生第二原发癌的机率比一般人群要高数百倍。
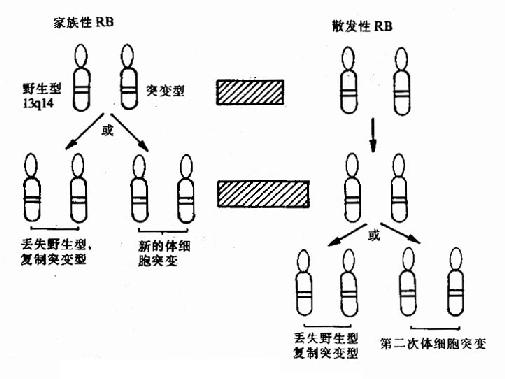
图22-5
关于抑癌基因如何起作用所知甚少,总体上总对生长起着控制作用,是一类生长控制基因或负调控基因,若功能丧失则失去负调控,细胞只能接受正调控信号,抑癌基因产物的功能多种多样,已确定的几中抑癌基因产物及其功能如表22-6。
表22-6 已确定的几种抑癌基因
| 基因 | 染色体定位 | 相关肿瘤 | 基因产物及功能 |
| RB | 13q14 | RB、成骨肉瘤、胃癌、SCLC、乳癌、结肠癌 | p105,控制生长 |
| WT | 11p13 | WT、横纹肌肉瘤、肺癌、膀胱癌、乳癌、肝母细胞瘤 | WT-ZFP,负调控转录因子 |
| NF-1 | 17p12 | 神经纤维瘤、嗜铬细胞瘤、雪旺氏细胞瘤、神经纤维肉瘤 | GAP,拮抗p21rasB |
| DCC | 18q21.3 | 结肠瘤 | P192, 细胞粘附分子 |
| p538 | 17p13 | 星状细胞瘤、胶质母细胞瘤、结肠癌、乳癌、成骨肉瘤、SCLC、胃癌、磷状细胞肺癌 | P53 控制生长 |
| erb A | 17q21 | ANLL | T3受体,含锌指结构的转录因子 |
(*p53的野生型是抑癌基因,而其突变型属癌基因)
提要
癌基因可分为病毒癌基因和细胞癌基因,前者包括DNA肿瘤病毒的转化基因和RNA肿瘤病毒的癌基因,而细胞癌基因又称为原癌基因,因为它是病毒癌基因的原型。病毒癌基因能使宿主细胞发生恶性转化,形成肿瘤,而正常的细胞癌基因无此能力。当细胞癌基因的表达失控,或因结构改变而致表达产物的活性改变时,则可导致细胞转化,进而形成肿瘤,此种情况叫做癌基因的激活。癌基因的激活的大体上有以下几种方式,即(1)插入强启动子或增强子,(2)基因突变(3)基因扩增(4)基因重排或染色体易位。肿瘤的发生与发展往往涉及多种癌基因的激活。
已发现的细胞癌基因大都是一些与正常细胞生长增殖、分化和凋亡密切相关的非常保守的“看家基因”。它们的表达产物或是生长因子、生长因子受体,或是小分子G蛋白、蛋白激酶,或是转录因子,总之都是各种信号转导途径中的关键分子,有极重在的生理功能。正因如此,它们的表达是受到严密而精细的调控的。
抑制基因是一类生长控制基因或负调控基因,它们的缺失或突变从而丧失功能时,将会导致细胞的恶性转化反之,在实验条件下,若将基导入转化的细胞则可抑制其恶性表型。某些抑癌基因,例如P53和erbA,突变后不仅丧失原有功能,而且还可促进肿瘤的发生,亦即变成了癌基因。
复习题
1、什么叫做癌基因、原癌基因和抑癌基因?
2、什么叫做细胞癌基因的激活?举例说明癌基因的激活有哪几种方式?
3、为什么说细胞癌基因与细胞信号转导有密切关系?
