一、细胞内酶的分隔分布
从物质代谢过程中可知,酶在细胞内是分隔着分布的。代谢上有关的酶,常常组成一个酶体系,分布在细胞的某一组分中,例如,糖酵解酶系和糖元合成、分解酶系存在于胞液中;三羧酸循环酶系和脂肪酸β-氧化酶系定位于线粒体;核酸合成的酶系则绝大部分集中在细胞核内。这样的酶的隔离分布为代谢调节创造了有利条件,使某些调节因素可以较为专一地影响某一细胞组分中的酶的活性,而不致影响其他组分中的酶的活性,从而保证了整体反应的有序性。一些代谢物或离子在各细胞组分间的穿梭移动也可以改变细胞中某些组分的代谢速度。例如,在胞液中生成的脂酰辅酶A主要用于合成脂肪;但在肉毒碱的作用下,经肉毒碱脂酰转移酶的催化,脂酰辅酶A可进入线粒体,参与β-氧化的过程。又如,Ca++从肌细胞线粒体中出来,可以促进胞液中的糖元分解,而Ca++进入线粒体则有利于糖元合成。
物质代谢实质上是一系列的酶促反应,代谢速度的改变并不是由于代谢途径中全部酶活性的改变,而常常只取决于某些甚至某一个关键酶活性的变化。此酶通常是整条通路中催化最慢一个反应的酶,称为限速酶。它的活性改变不但可以影响整个酶体系催化反应的总速度,甚至还可以改变代谢反应的方向。如,细胞中ATP/AMP的比值增加,可以抑制磷酸果糖激酶(和丙酮酸激酶)的活性,这不但减慢了糖酵解的速度,还可以通过激活果糖-1,6-二磷酸酶而使糖代谢方向倾向于糖异生。因此,改变某些关键酶的活性是体内代谢调节的一种重要方式。
人体代谢的细胞水平调节,从速度方面来说有两种方式,一种是快速调节,一般在数秒或数分钟内即可发生。这种调节是通过激活或抑制体内原有的酶分子来调节酶促反应速度的,是在温度、pH、作用物和辅酶等因素不变的情况下,通过改变酶分子的构象或对酶分子进行化学修饰来实现酶促反应速度的迅速改变的。另一种是迟缓调节,一般经数小时后才能实现。这种方式主要是通过改变酶分子的合成或降解速度来调节细胞内酶分子的含量。现将这两类调节作用分述如下:
二、酶分子结构的调节
(一)变构调节
1.变构调节的概念 某些物质能与酶分子上的非催化部位特异地结合,引起酶蛋白的分子构象发生改变,从而改变酶的活性,这种现象称为酶的变构调节或称别位调节(allosteric regulation)。受这种调节作用的酶称为别构酶或变构酶(allostericenzyme),能使酶发生变构效应的物质称为变构效应剂(allosteric effector);如变构后引起酶活性的增强,则此效应剂称为激活变构剂(allosteric activator)或正效应物;反之则称为抑制变构剂(allostericinhibitor)或负效应物。变构调节在生物界普遍存在,它是人体内快速调节酶活性的一种重要方式。现将某些代谢途径的变构效应剂列表如下:
表9-1 糖和脂肪代谢酶系中某些变构酶及其变构效应剂
| 代谢途径 | 变构酶 | 激活变构剂 | 抑制变构剂 |
| 糖氧化分解 | 已糖激酶 | G-6-P | |
| 磷酸果糖激酶 | AMP、ADP、FDP、Pi | ATP、柠檬酸 | |
| 丙酮酸激酶 | FDP | ATP、乙酸CoA | |
| 异柠檬酸脱氢酶 | AMP | ATP、长链脂酰CoA | |
| 柠檬酸合成酶 | ADP、AMP | ATP | |
| 糖异生 | 果糖-1,6-二磷酸酶 | AMP | |
| 丙酮酸羟化酶 | 乙酰CoA、ATP | ||
| 脂肪酸合成 | 乙酰CoA羟化酶 | 柠檬酸、异柠檬酸 | 长链脂酰CoA |
2.变构调节的生理意义 变构效应在酶的快速调节中占有特别重要的地位。在前面已经提及,代谢速度的改变,常常是由于影响了整条代谢通路中催化第一步反应的酶或整条代谢反应中限速酶的活性而引起的。这些酶对底物不遵守米曼氏动力学原则。它们往往受到一些代谢物的抑制或激,这些抑制或激活作用大多是通过变构效应来实现的。因而,这些酶的活力可以极灵敏地受到代谢产物浓度的调节,这对机体的自身代谢调控具有重要的意义。例如,变构酶对于人体能量代谢的调节具有重要意义。在休息状态下,机体能量消耗降低,ATP在细胞内积聚,而ATP是磷酸果糖激酶的抑制变构剂,所以导致F-6-P和G-6-P的积聚,G-6-P又是已糖激酶的抑制变构剂,从而减少葡萄糖的氧化分解。同时,ATP也是丙酮酸激酶和柠檬酸合成酶的抑制变构剂,更加强了对葡萄糖氧化分解的抑制,从而减少了ATP的进一步生成。反之,当体内ATP减少而ADP或AMP增加时,AMP则可抑制果糖1,6-二磷酸酶,降低糖异生,同时激活磷酸果糖激酶和柠檬酸合成酶等酶,加速糖的分解氧化,利于体内ATP的生成。这样,通过变构调节,使体内ATP的生成不致过多或过少,保证了机体的能源被有效利用。
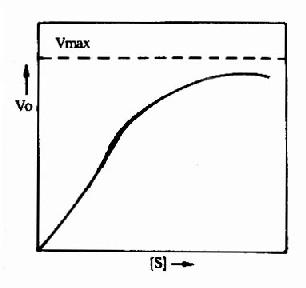
图9-1 变构酶的底物浓度曲线
3.变构调节的机理 目前已知,能受变构调节的酶,常常是由两个以上亚基组成的聚合体。有的亚基与作用物结合,起催化作用,称为催化亚基;有的亚基与变构剂结合,发挥调节作用,称调节亚基。但也可在同一亚基上既存在催化部位又存在调节部位。变构剂与调节亚基(或部位)间是非共价键的结合,结合后改变酶的构象(如,变为疏松或紧密),从而使酶活性被抑制或激活。变构酶与米-曼氏酶不同,其动力学不符合米曼氏方程式:酶促反应速度和作用物浓度的关系曲线不呈矩形而常常呈S形,S形曲线与氧合血红蛋白的解离曲线相似(图9-1)。
当变构剂与调节亚基(或部位)结合后,变物剂对酶分子的构象发生什么样的影响呢?下面以果-1,6-二磷酸酶为例阐述这一过程。果糖-1,6-二磷酸酶是由四个结构相同的亚基所组成,每个亚基的分子量约为310,000Da。每个亚基上既有催化部位也有调节部位。在催化部位上能结合一分子FDP,在调节部位上能结合一分子变构剂。此酶有两种存在形式,即紧密型(T型、高活性)与松弛型(R型、低活性)。AMP是此酶的抑制变构剂。当酶处于T型时,因其调节部位转至聚合体内部而难以与AMP结合,故对AMP不敏感而表现出较高的活性。在第一个AMP分子与调节部位结合后,T型逐步转变成R型,各亚基构象相继发生改变,调节部位相继暴露,与AMP的亲和力逐步增加,酶的活性逐渐减弱,这就是果糖-1,6-二磷酸酶由紧密型变成松弛型的变构过程。抑制变构剂促进高活性型至低活性型的转变,激活变构剂则促进低活性型至高活性型的转变。这一变构过程是可逆的(图9-2)。图中3-磷酸甘油醛和脂肪酸-载体蛋白可使活性型转变为高活性型。
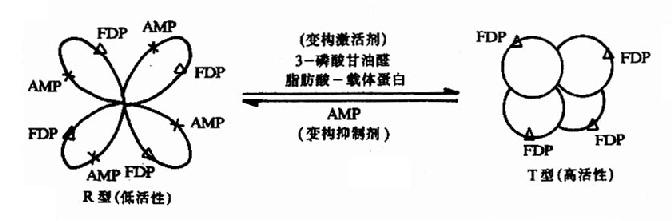
图9-2 果糖-1,6二磷酸酶的变构效应
△:酶亚基上的催化部位 X:酶亚基上的调节部位 FDP:果糖-1,6-二磷酸
变构效应剂可以是酶的底物,也可以是酶系的终产物,还有的是与它们结构不同的其他化合物,一般说,都是小分子物质。一种酶可有多种变构效应剂存在。
果糖-1,6-二磷酸酶的变构过程是T型与R型的可逆转变。有些酶的变构效应还可表现为酶分子的聚合或解聚,如乙酰CoA羧化酶,它是脂肪酸合成过程中的关键酶。它是由四种不同亚基构成的原聚体,每个亚基有不同的功能,分别是:生物素载体蛋白,它能结合辅基生物素;生物素羧化酶,它能催化生物素发生羧化反应;羧基转移酶,它能将生物素上的羧基转移给乙酰CoA形成丙二酰CoA;和调节亚基,它能与柠檬酸或异柠檬酸结合,使原聚体聚合为多聚体。Kieinschmidt等已在电子显微镜下看到了由柠檬酸和异柠檬酸使原聚体聚合形成的纤维状的多聚体(图9-3)。只有多聚体酶才有催化活性。ATPMg++可使多聚体解聚为原聚体而使酶失活。长链脂酰CoA可拮抗柠檬酸的促聚合作用,因此,它们都是该酶的变构抑制剂。
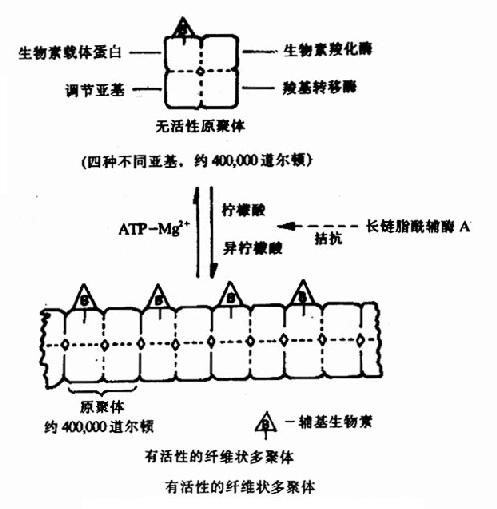
图9-3 乙酰CoA羧化酶聚合解聚示意图
(二)酶分子化学修饰调节
1.酶分子化学修饰的概念
酶分子肽链上的某些基团可在另一种酶的催化下发生可逆的共价修饰,从而引起酶活性的改变,这个过程称为酶的酶促化学修饰(chemical modification)。如磷酸化和脱磷酸,乙酰化和去乙酰化,腺苷化和去腺苷化,甲基化和去甲基化以及-SH基和-S-S-基互变等,其中磷酸化和脱磷酸作用在物质代谢调节中最为常见。
细胞内存在着多种蛋白激酶(ProteinKinase),它们可以将ATP分子中的γ-磷酸基团转移至特定的蛋白分子底物上,使后者磷酸化(phosphorylation)。磷酸化反应可以发生在丝氨酸、苏氨酸或酪氨酸残基上。催化丝氨酸或苏氨酸残基磷酸化的酶统称为蛋白丝氨酸/苏氨酸激酶(Protein Serine/Threonine Kinase)。催化酪氨酸残基磷酸化的酶统称为蛋白酪氨酸激酶(ProteinTyrosine Kinase)。与此相对应的,细胞内亦存在着多种蛋白丝氨酸/苏氨酸磷酸酶(ProteinSerine/Threonine Phosphotase)和蛋白酪氨酸磷酸酶(Protein Tyrosine Phosphotase),它们可将相应的磷酸基团移去。酶的化学修饰如变构调节一样,也是机体物质代谢中快速调节的一种重要方式,表9?列出了一些酶的酶促化学修饰的实例。
表9-2 某些酶的酶促化学修饰调节
| 酶类 | 反应类型 | 效应 |
| 糖无磷酸化酶 | 磷酸化/脱磷酸 | 激活/抑制 |
| 磷酸化酶b激酶 | 磷酸化/脱磷酸 | 激活/抑制 |
| 磷酸化酶磷酸酶 | 磷酸化/脱磷酸 | 抑制/激活 |
| 糖元合成酶 | 磷酸化/脱磷酸 | 抑制/激活 |
| 丙酮酸脱羟酶 | 磷酸化/脱磷酸 | 抑制/激活 |
| 脂肪酶(脂肪细胞) | 磷酸化/脱磷酸 | 激活/抑制 |
| 谷氨酰胺合成酶(大肠杆菌) | 腺苷化/脱腺苷 | 抑制/激活 |
| 黄嘌呤氧化(脱氢)酶 | -SH/-S-S- | 脱氢/氧化 |
2.酶促化学修饰的机理
肌肉糖元磷酸化酶的酶促化学修饰是研究得比较清楚的一个例子。该酶有两种形式,即无活性的磷酸化酶b和有活性的磷酸化酶a。磷酸化酶b是二聚体,分子量约为85,000Da。它在酶的催化下,使每个亚基分别接受ATP供给的一个磷酸基团,转变为磷酸化酶a,后者具有高活性。两分子磷酸化酶a二聚体可以再聚合成活性较低的(低于高活性的二聚体)磷酸化酶a四聚体(图9-4)。
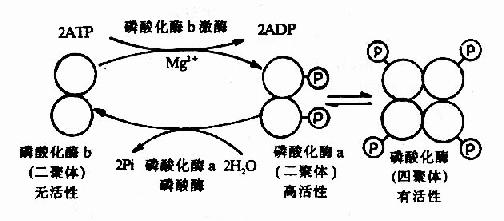
图9-4 肌肉磷酸化酶的酶促化学修饰作用
3.酶促化学修饰的特点
(1)绝大多数酶促化学修饰的酶都具有无活性(或低活性)与有活性(或高活性)两种形式。它们之间的互变反应,正逆两向都有共价变化,由不同的酶进行催化,而催化这互变反应的酶又受机体调节物质(如激素)的控制。
(2)存在瀑布式效应。由于酶促化学修饰是酶所催化的反应,故有瀑布式(逐级放大)效应。少量的调节因素就可通过加速这种酶促反应,使大量的另一种酶发生化学修饰。因此,这类反应的催化效率常较变构调节为高。
(3)磷酸化与脱磷酸是常见的酶促化学修饰反应。一分子亚基发生磷酸化常需消耗一分子ATP,这与合成酶蛋白所消耗的ATP相比,显然是少得多;同时酶促化学修饰又有放大效应,因此,这种调节方式更为经济有效。
(4)此种调节同变构调节一样,可以按着生理的需要来进行。在前述的肌肉糖元磷酸化酶的化学修饰过程中,若细胞要减弱或停止糖元分解,则磷酸化酶a在磷酸化酶a磷酸酶的催化下即水解脱去磷酸基而转变成无活性的磷酸化酶b,从而减弱或停止了糖元的分解。
此外,酶促化学修饰与变构调节只是两种主要的调节方式。对某一种酶来说,它可以同时受这两种方式的调节。如,糖元磷酸化酶受化学修饰的同时也是一种变构酶,其二聚体的每个亚基都有催化部位和调节部位。它可由AMP激活,并受ATP抑制,这属于变构调节。细胞中同一种酶受双重调节的意义可能在于,变构调节是细胞的一种基本调节机制,它对于维持代谢物和能量平衡具有重要作用,但当效应剂浓度过低,不足以与全部酶分子的调节部位结合时,就不能动员所有的酶发挥作用,故难以应急。当在应激等情况下,若有少量肾上腺素释放,即可通过cAMP,启动一系列的瀑布式的酶促化学修饰反应,快速转变磷酸化酶b成为有活性的磷酸化酶a,加速糖元的分解,迅速有效地满足机体的急需。
三、酶含量调节
除通过改变酶分子的结构来调节细胞内原有酶的活性外,生物体还可通过改变酶的合成或降解速度以控制酶的绝对含量来调节代谢。要升高或降低某种酶的浓度,除调节酶蛋白合成的诱导和阻遏过程外,还必须同时控制酶降解的速度,现分述如下:
(一)酶蛋白合成的诱导和阻遏
酶的底物或产物、激素以及药物等都可以影响酶的合成。一般将加强酶合成的化合物称为诱导剂(inducer),减少酶合成的化合物称为阻遏剂(repressor)。诱导剂和阻遏剂可在转录水平或翻译水平影响蛋白质的合成,但以影响转录过程较为常见。这种调节作用要通过一系列蛋白质生物合成的环节,故调节效应出现较迟缓。但一旦酶被诱导合成,即使除去诱导剂,酶仍能保持活性,直至酶蛋白降解完毕。因此,这种调节的效应持续时间较长。
1.底物对酶合成的诱导作用 受酶催化的底物常常可以诱导该酶的合成,此现象在生物界普遍存在。高等动物体内,因有激素的调节作用,底物诱导作用不如微生物体内重要,但是,某些代谢途径中的关键酶也受底物的诱导调节。例如,若鼠的饲料中酪蛋白含量从8%增至70%,则鼠肝中的精氨酸酶的活性可增加2?倍。在食物消化吸收后,血中多种氨基酸的浓度增加,氨基酸浓度的增加又可以诱导氨基酸分解酶体系中的关键酶,如苏氨酸脱水酶和酪氨酸转氨酶等酶的合成。这种诱导作用对于维持体内游离氨基酸浓度的相对恒定有一定的生理意义。
2.产物对酶合成的阻遏 代谢反应的终产物不但可通过变构调节直接抑制酶体系中的关键酶或起催化起始反应作用的酶,有时还可阻遏这些酶的合成。例如,在胆固醇的生物合成中,β-羟-β-甲基戊二酰辅酶A(HMgCoA)还原酶是关键酶,它受胆固醇的反馈阻遏。但这种反馈阻遏只在肝脏和骨髓中发生,肠粘膜中胆固醇的合成似乎不受这种反馈调节的影响。因此摄食大量胆固醇,浆胆固醇仍有升高的危险。此外,如δ-氨基-γ-酮戊酸(ALA)合成酶,它是血红素合成酶系中的起始反应酶,它受血红素的反馈阻遏。
3.激素对酶合成的诱导作用 激素是高等动物体内影响酶合成的最重要的调节因素。糖皮质激素能诱导一些氨基酸分解代谢中起催化起始反应作用的酶和糖异生途径关键酶的合成,而胰岛素则能诱导糖酵解和脂肪酸合成途径中的关键酶的合成。
4.药物对酶合成的诱导作用
很多药物和毒物可促进肝细胞微粒体中单加氧酶(或称混合功能氧化酶)或其他一些药物代谢酶的诱导合成,从而促进药物本身或其他药物的氧化失活,这对防止药物或毒物的中毒和累积有着重要的意义。其作用的本质,也属于底物对酶合成的诱导作用。另一方面,它也会因此而导致出现耐药现象。如,长期服用苯巴比妥的病人,会因苯巴比妥诱导生成过多的单加氧酶而使苯巴比妥药效降低。氨甲喋呤治疗肿瘤时,也可因诱导叶酸还原酶的合成而使原来剂量的氨甲喋呤不足而出现药物失效现象。
(二)酶分子降解的调节
细胞内酶的含量也可通过改变酶分子的降解速度来调节。饥饿情况下,精氨酸酶的活性增加,主要是由于酶蛋白降解的速度减慢所致。饥饿也可使乙酰辅酶A羧化酶浓度降低,这除了与酶蛋白合成减少有关外,还与酶分子的降解速度加强有关。苯巴比妥等药物可使细胞色素b5和NADPH-细胞色素P450还原酶降解减少,这也是这类药物使单加氧酶活性增强的一个原因。
酶蛋白受细胞内溶酶体中蛋白水解酶的催化而降解,因此,凡能改变蛋白水解酶活性或蛋白水解酶在溶酶体内分布的因素,都可间接地影响酶蛋白的降解速度。有关情况尚了解不多。总之,通过酶降解以调节酶含量的重要性不如酶的诱导和阻遏作用。
