通过对补体系统的蛋白结构进一步探查,表现了一些颇具特色的结构功能域(module),并根据它们在氨基酸序列上的同源性,将它们归为几个不同的蛋白家族。同一家族中的各个成员通常具有相类似的结构和功能。此外,根据不同补体蛋白基因间的同源性,提示每个家族的成员可能是由一个共同的祖基因复制而来,出现结构上的多样性,进而使各种补体蛋白又具有各自特定的功能。
(一)C1q与其相关的分子
C1q与其相关的分子:甘露糖结合蛋白(mannose-binding protein,MBP)、肺表面活性物质脱辅基蛋白A和D(surfactantprotein A and D,SP-A,SP-D)、类风湿因子(RF)和胶固素(conglutinin)等,为具有以胶原样蛋白和凝集素区结构为特征的一组蛋白。因此有人将collagen与lectin两字缩合,归纳称为“collectin”(可暂译为胶凝素)。这些相关分子均能以抗体依赖或非依赖的方式被激活,再激活补体系统,或具有结合C1q-R的能力,从而模拟和放大C1q的功能作用。
(二)丝氨酸蛋白酶补体分子
在补体固有成分和调节蛋白中,共有6个丝氨酸蛋白酶(原)。即:C1r、Cls、C2、B因子(Bf)、D因子和I因子。它们除彼此在氨基酸序列上有同源性外,还与非补体性丝氨酸蛋白酶(如胰蛋白酶和糜蛋白酶)高度同源。但C2和Bf的催化部位比常见的丝氨酸蛋白酶约多210个氨基酸残基。在6个补体性丝氨酸蛋白酶中,C1r和C1s,C2和Bf又具有更大的相似性。
C1r和C1s均为单链长形结构,两端呈球形似哑铃状,分子量均为85kDa。二者除在C端有共同的丝氨酸蛋白酶结构功能域外,其N端有约450个氨基酸彼此同源。均含有2个拷贝的SCR和1个拷贝的EGF前体结构功能域(图5-18)。
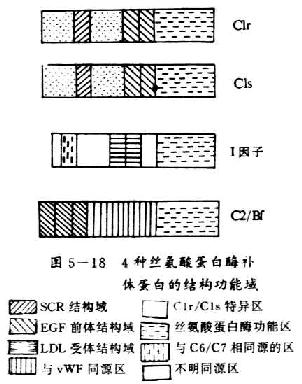
图5-18 4种丝氨酸蛋白酶补体蛋白的结构功能域
C2和Bf均为单肽链糖蛋白,它们除在形成两条补体激活途径中和C3转化酶方面十分相似外,在合成部位、合成途径、分子大小、亚单位结构、半胱氨酸位置及数目,以及保守残基替代及活性部位等方面也有很大的相似性(表5-4)。C2和Bf分子中相同的结构功能域是均有3个CSR、1个与von Willebrand因子(vWF)共同的氨基酸序列和1个丝氨酸蛋白酶结构功能域。
表5-4 C2与Bf的特性比较
| C2 | Bf | |
| 分子量 | 110kDa | 93kDa |
| C2a:75kDa | Bb:63kDa | |
| C2b:35kDa | Ba:35kDa | |
| 血清含量 | ~15mg/L | 150~200mg/L |
| 相得益彰活性部位 | C端侧(C2a) | C端侧(Bb) |
| 氨基酸 | 723 | 733 |
| C2a:509 | Bb:505 | |
| C2b:234 | Ba:234 | |
| 电镜形态 | 3个球状结构 | 3个球状结构 |
| mRNA | 2.9kb | 2.6kb |
| 基因长度 | 18kb | 6kb |
| 3个SCR | 1~65,66~127,128~186 | 4~74,75~136,137~194 |
| 形成的C3转化酶 | C42a | C3bBb |
(三)末端补体分子
末端补体分子C6,C7,C8和C9是构成膜攻击复合体(MAC)引起靶细胞溶解破坏的重要组成成分。功能上的相似性反映了它们结构上的共同性。均具有420kDa的I型凝血敏感蛋白重复序列(thrombospondin type Irepeat,TSP-1),而且与TSP-1特有的β片层、和β螺旋结构的立体配体也是类似的。此种结构单位也存在于备解素(properdin)和疟原虫的羧箕末端。除TSP-1外,它们还具有1个拷贝的低密度脂蛋白受体结构功能域(low density lipoprotein receptor module,LDL-R),1个表皮生长因子前体结构功能域(EGf precusor module)。在肽链的中央还有1个半胱酸贫乏区与细胞毒性细胞和NK细胞释放的perforin的结构具有相似性(图5-19)。其中C6和C7具有更大的同源性。二者除上述的结构功能域外,在C端还存在着富含半胱氨酸的重复序列,即为2个CSR和2个与I因子重链中有一个区具有同源性的结构功能域(factor I module,FIM)。二者的分子量也相近似,分别为128kDa和121kDa。显著的差别仅仅是C6的N端多1个由59个氨基酸组成的TSP-1。
图5-19 末端补体分子的结构功能域
(四)具有SCR的6种补体调节蛋白
补体活化调节蛋白(requlatorof complement activation,RCA)包括:CR1、CR2、H因子、C4bp、DAF和MCP。它们共同的结构特征是均具有多个类似的短同源重复序列(SCR)。SCR也称Shushi单位。一个SCR约由60-70个氨基酸残基所组成,大小为4.5nm。SCR之间有20-40%的同源性。所有的SCR均具有固定的保守骨架序列(其中有4个半胱氨酸形成两个二硫键),并与脯氨酸、色氨酸、酪氨酸/丙氨酸、甘氨酸相维系而形成一独特的结构单位(图5-20)。这一结构单位在CR1中有32个,CR2中有15-16个,H因子中有20个,C4b中有12个,DAF和MCP中各有4个,而且是构成这些补体蛋白肽甸的主要结构。SCR在RCA中的功能是与C3、C4和C5结合,发挥其调节作用。在前述的C1r、Cls、C2、Bf、C6和C7中也含有几种非补体性蛋白如IL-2R、β2糖蛋白1(β2-1)、内皮细胞-白细胞粘附分子-1(ELAM-1)、淋巴细胞的归位受体和凝血因子Ⅻ的b亚单位中也含有SCR,但其意义不详。值得注意的是,牛痘病毒具有SCR的编码DNA,且与C4bp的SCR相类似,可逃避补体经典途径对其发挥作用。
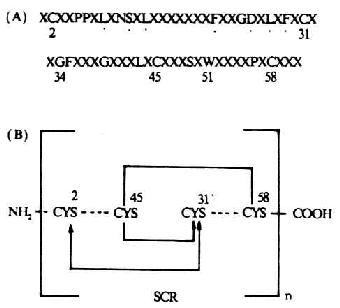
图5-20 SCR的结构(模式图)
注:(A)SCR结构;有44%的SCR是保守的,
包括形成链内二硫键的4个半胱氨酸
(B)具有重迭链内二硫键(……)的SCR
此外,在补体的膜性调节分子中,DAF、MCP、C8bp和CD59四种分子者是以糖基磷酯酰肌醇锚(GPI)而固定在细胞膜上的。锚的核心结构是:protein-CO-NH-CH2-PO4-6-man-α1,2-man-α1,6-man-α1,4-G1CN--α1,6MYO-inositol-1-PO4-Lipid。此种结构还存在于多种非补体蛋白中,如碱性磷酸酶、乙酰胆碱酯酶、Thy-1及布氏锥虫的变异体表面糖蛋白等。补体蛋白DAF、MCP、CD59和C8bp(HRF)可借助于这样的结构而使补体对自身细胞的损伤减至最小。这就是近日逐渐阐明的补体同源限制性(homologous restriction)。阵发性血红蛋白尿(PNH)之所以对补体攻击敏感,正是由于其红细胞膜上缺乏含有GPI锚的分子,因而使机体的正常同源限制性作用失去效能所致。
