根据CD28阳性或阴性可将CD8+细胞分为细胞毒性T细胞(CD8+CD28+)和抑制性T细胞(CD28+CD28-)。CD28McAb能与60-80%T细胞发生反应,包括全部CD4细胞和部分CD8细胞。
1.Tc(CTL) 在人类CTL表型为CD3+CD4-8+CD28+。小鼠CTL表型为Thy-1+、Lyt-1+、Lyt-2+/Lyt-3+。
(1)CTL的分化:静止的CTL以前体细胞(precursor)(CTL-P)形式存在,外来抗原进入机体被抗原提呈细胞(APC)加工处理,形成外来抗原与APC自身MHc I类抗原的复合物,被相应CTL克隆细胞膜表面TCR/CD3所识别,抗原刺激信号和APC释放IL-1共同存在的条件下,CTL-p被活化,并表达IL-2R、IL-4R、IL-6R等多种细胞因子受体,在IL-2、IL-4、IL-6、IFN-γ等细胞因子诱导下,迅速增殖,并分化为成熟的效应杀伤性T细胞(effector CTL)。CTL具有识别抗原的特异性,即能杀伤具有特定的外来抗原(如病毒感染靶细胞膜表面的病毒抗原)与自身MHc I类抗原结合的复合物的靶细胞。有关CTL杀伤靶细胞受到MHC I类抗原的限制,参见第五章“主要组织相容性复合体”第四节。从肿瘤组织周围分离获得的CTL称为肿瘤浸润淋巴细胞(tumor infiltrating lymphocyte , TIL)。TIL在体外加IL-2培养后,具有很高的杀伤肿瘤作用,目前已用于临床的肿瘤治疗。
(2)CTL的识别机制:多种粘附分子参与CTL对靶细胞的识别和粘附,主要有:①LFA-1/ICAM-1、ICAM-2、ICAM-3,可溶性ICAM-1(sICAM-1)可抑制CTL杀伤肿瘤细胞;②CD2/LFA-3(CD58),抗CD2McAb或抗CD58McAb均可抑制CTL效应细胞对靶细胞的杀伤;③CD8/MHcI类抗原的非多态性结构域。
(3)CTL的杀伤机制:TCL杀伤靶细胞的机理目前认为主要通过释放多种的介质和因子介导的。
①穿孔素(perforin):又称成孔蛋白(pore-foming protein,PFP)、C9相关蛋白(C9 related protein)或溶细胞素(cytolysin),贮存于电子稠密胞浆颗粒(electron-densecytoplasmic granules),成熟的穿孔素分子由534个氨基酸残基组成,分子量为56-75kDa,IP为6.4,穿孔素分子中央部位170-390之间的氨基酸序列与C9328-560氨酸酸序列约有20%同源性,这个区域与穿孔素和C9的多聚化和以管状形式插入到细胞膜有关。在杀伤相时,CTL细胞脱颗粒,穿孔素从颗粒中释放,在Ca2+存在下,插入靶细胞膜上,并多聚化形成管状的多聚穿孔素(polyperforin),约含12-16个穿孔素分子,分子量可达1000kDa。多聚穿孔素在靶细胞膜上形成穿膜的管状结构,内径平均16nm。这种异常的通道使Na+、水分进入靶细胞内,K+及大分子物质(如蛋白质)从靶细胞内流出,改变细胞渗透压,最终导致细胞溶解。此过程与补体介导的溶细胞过程类似,溶解细胞过程比较迅速。CTL本身可能释放A型硫酸软骨素蛋白聚糖(proteoglycans of chondroitinsulphate A type)、硫酸软骨素A限制因子(homologous restriction factor,HRF),因此可避免穿孔素对CTL自身细胞的攻击。
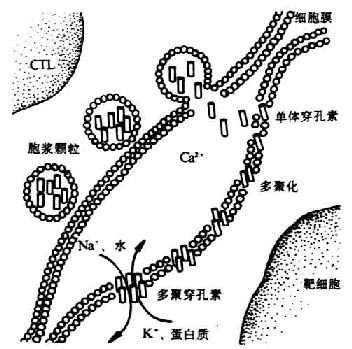
图7-3 CTL释放穿孔素杀伤靶细胞机理示意图
②丝氨酸酯酶(serine estersse):活化CTL释放多种丝氨酸酯酶,如CTLA-1(又称CCP1或granzyme B)、CTLA-3(又称H因子或granzyme A),其作用可能类似补体激活过程中的酯酶作用,通过活化穿孔素而促进杀伤作用。
③淋巴毒素(lymphotoxin,LT):又称肿瘤坏死因子-β(TNF-β),LT可直接杀伤靶细胞,但杀伤过程较慢,其杀伤机理参见第四章“细胞因子及其受体”第二节中肿瘤坏死因子。
2.Ts和Ts亚群 抑制性T细胞(suppressor T lymphocyte,Ts)对免疫应答有重要的负调节功能,抑制性T细胞功能的异常,常与T自身免疫性疾病、第I型超敏反应等疾病发生有关。
(1)抑制性T细胞的证实:绵羊红细胞(sheep red blood cell , SRBC)对于小鼠是良好的免疫原,合适剂量的SRBC可诱导小鼠产生高效价的抗SRBC抗体。当过高剂量SRBC免疫小鼠时,则抗体合成水平反而明显下降,称为高剂量免疫耐受。动物实验研究发现,将高剂量免疫耐受小鼠脾细胞转移到免疫原剂量刺激的小鼠体内时,则小鼠抗体应答水平明显下降。如高剂量免疫耐受小鼠脾细胞经抗Thy-1和补体处理后再转移到免疫原剂量免疫的小鼠体内,则高剂量免疫耐受小鼠脾细胞的抑制作用消失。实验证明了在高剂量免疫耐受小鼠的脾细胞中存在有抑制作用的T细胞。
表7-9 抑制性T细胞的证实
| (1) | 免疫原剂量---→抗体应答+++ |
| SRBS免疫小鼠 | |
| (2)高剂量SRBC---------------------------------→抗体应答+ | |
| 免疫耐受小鼠 | |
| (3)高剂量免疫-→转移未处理脾细胞-→免疫原剂量-→抗体应答+ | |
| 耐受小鼠 免疫小鼠 | |
| (4)高剂量免疫-→转移抗Thy-1+ ----→免疫原剂量-→抗体应答+++ | |
| 耐受小鼠 补体处理脾细胞 免疫小鼠 | |
进一步研究证明,这种抑制细胞的表型为CD3+CD4-CD8+(小鼠CD8单抗常用Lyt-2)。人的抑制性T细胞表型为CD3+CD4-CD8+CD28-。Ts细胞不仅对B细胞合成和分泌抗体有抑制作用,而且对Th辅助作用、迟发型超敏反应以及Tc介导的细胞毒作用都有负调节作用。
(2)Ts细胞的亚群:Ts细胞还可分为Ts1、Ts2和Ts3不同亚群,分别起着诱导抑制、转导抑制和发挥抑制效应的作用。它们之间相互作用的确切机理还不十分清楚,可能是通过释放可溶性介质相互作用的。Ts1(Tsi,抗原特异性抑制性T细胞)分泌TsF1(TsiF,抑制诱导因子)→作用于Ts2(Tst,抑制转导细胞),分泌TsF2(Tst F)→作用于Ts3(Tse,抑制效应细胞),分泌Ts3F(TseF),作用于Th细胞,通过对Th的抑制作用,从而对各种免疫功能起负调节作用。Ts细胞群具有高度异质性,除Ts1、Ts2、Ts3亚群外,还有一群反抑制性T细胞亚群(contra-suppressor T cel,Tcsl)。Tcs活化后分泌反抑制性T细胞因子TcsF,直接作用于Th细胞,解除Ts细胞的抑制作用,使Th细胞恢复辅助活性。
