一、p56[SB]lck[/SB]
p56lck属于以p60v-src/c-src为代表的蛋白酪氨酸激酶家族成员。同这个家族的其它成员一样都具有酪氨酸激酶活性。目前发现,p56lck相对特异地存在于淋巴细胞中,尤其是成熟的静止T淋巴细胞中。p56lck可能在T细胞活化信号转导以及分化调节过程中起着重要的作用。
(一)p56lck结构和功能特点
1.p56lck的结构 p56lck是由lck基因编码的分子量为56kDa的单链分子,由509个氨基酸残基组成。在小鼠,lck基因定位于4号染色体,人lck基因定位于1号染色体的1p32-35区间。同其它具有PTK活性的生长因子受体如EGF-R和PDGF-R等比较,p56lck分了属于非受体型蛋白酪氨酸激酶,无胞膜外区,其N-端通过豆蔻酸(myristic acid)与细胞膜内侧面相连。p56lck分子结构可以分为四个功能区:(1)膜接触区,位于N-端,N-端第2位Gly能结合豆蔻酸,通过豆蔻酸与细胞膜内侧面相连;(2)底物作用区,该区的氨基酸结构不同于src家族的大部分其它成员;(3)催化区或激酶区,这一区域在氨基酸组成上与其它src家族成员高度同源;(4)调节区,位于羧基端,可能与p56lck的PTK活性的特异调节有关(图8-6)。

图8-6 p56lck分子的功能区
2.p56lck的功能特点 p56lck底物作用区存在几个位置尚不明确的Ser磷酸化位点;催化区Lys273是ATP结合点,Tyr394为自身磷酸化位点;调节区Tyr505是调性磷酸化位点。在静止细胞中,p56lck在Tyr505上发生磷酸化,但当细胞活化时这个残基则发生去磷酸化,随之发生激酶的活化以及Tyr394的自身磷酸化。目前研究认为,CD45通过使Tyr505去磷酸化对p56lck起正调控作用;而p50csk是使Tyr505发生磷酸化对p56lck则起负调控作用。CD45和p50csk对其它src家族PTKs也发挥着同样的调节作用。
(二)p56lck与CD4/CD8分子
1.p56lck的分布 CD4和CD8以共受体形式(coreceptor)表达于成熟的T淋巴细胞,尽管CD4和CD8跨膜分子都属于免疫球蛋白超家族,但它们之间仅存在有限的同源性。CD4和CD8分子分别与MHCⅡ类和MHc I类分子的恒定区决定簇相互作用。CD4是分子量为55-60kDa的糖蛋白,以单体形式表达。CD8是由二致辞体组成,有两种形式:一种是由两条α链(32-34kDa)组成的同源二聚体;另一种形式是由α链和β链(25-26kDa)组成的异源二聚体。CD4和CD8分子中胞浆内部分子不具有激酶功能区,因此它们与受体酪氨酸激酶如EGF-R或PDGF-R无同源性。目前已经证实CD4和CD8均与信号转导成份p56lckPTK相连接。p56lck几乎在所有淋巴细胞中表达,包括全部成熟T细胞和胸腺细胞,提示它可能在T细胞活化和分化调节过程中起作用。有关p56lck在T细胞活化信号中正调节作用的最初发现是p56lck直接同CD4或CD8复合受体分子胞浆内功能域相连接,在体外具有酪氨酸激酶活性,在体内,T细胞受到刺激后酪氨酸磷酸化水平增加。即使在静止的鼠CD4-T细胞中也有大约50%细胞内p56lck是同CD4糖蛋白相连接。
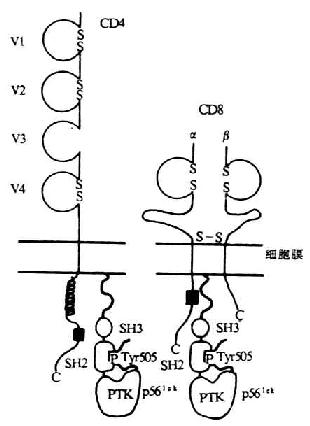
图8-7 p56lck同CD4、CD8作用的模式图
2.p56lck与CD4/CD8分子的连接 p56lck同CD4/CD8相互作用的区域位于分子的氨基端的底物作用区(图8-7),此区域在src相关PTKs中是独特的,含有4个半胱氨酸,这对于p56lck与CD4和CD8相互作用是必须的。底物作用区中6个带负电荷的氨基酸可使p56lck与CD4/CD8结合位点内相对应的碱性氨基酸残基相结合。在CD4和CD8α分子的胞浆内有一个含13个氨基酸的相似区域,经突变研究和肽竞争分析法证实此区域可能为p56lck结合区域。CD4和CD8α含有两个对于p56lck结合起关键作用的半胱氨酸以及与p56lck氨基末端负电荷相互作用的5个带正电荷的氨基酸。证实此区域中有6个氨基酸直接与p56lck结合有关,如果把这6个氨基酸残基从CD8α胞浆功能域转移到一个非相关蛋白水泡性口炎病毒糖蛋白(VSV-G)胞浆功能区域上,p56lck即可结合到这个杂交分子上去。
3.p56lck参与T细胞活化 用蛋白激酶C激活剂刺激T淋巴细胞可引起p56lck从CD4分子上解离下来,随后发生CD4内化。CD8分子在这方面不同于CD4,CD8+T淋巴细胞经PKC激活剂刺激事对CD8分子内化以及CD8-p56lck的解离影响极微。现已提示,p56lck可能以生长因子PTK受体相同方式起作用,即TCR结合与MHC相连的抗原后,CD4中CD8与MHC相互作用,与CD4或CD8相连接的p56lck补充到TCR多肽胞浆内部分靠得很近的区域,然后发生PTK的活化以及TCR内底物(?)和/或其邻近分子(PLCγ1?)的磷酸化。p56lck除参与抗原诱导的淋巴细胞活化外,还可能参与T细胞的分化和成熟。在T细胞分化的所有阶段,包括CD4、CD8双阳性胸腺细胞都可检测到p56lck与CD4和CD8形成的复合物。
(三)p56lck与非CD4/CD8分子
p56lck除了同CD4和CD8形成复合体外,还可能同另外一些参与信号转导的细胞受体分子形成稳定的复合物。
1.p56lck与IL-2R的关系 IL-2R由α、β、γ三条肽链组成。三条肽的不同组合即αβγ,βγ以及单独α分别构成IL-2的高、中、低三种亲和力的受体。由于IL-2Rα链在胞浆内仅有一个较短的功能域(13个氨基酸残基),所以介导IL-2R信号转导主要为β和γ链。IL-2Rβ链胞浆内有两个结构域:其中一个靠近细胞膜,富含丝氨酸,对于IL-2诱导的增殖信号具有重要作用;另一结构域远离细胞膜,富含酸性氨基酸,为酪氨酸激酶物理连接部位。经IL-2Rβ链免疫沉淀后进行免疫印迹也证实了IL-2Rβ链同p56lck相连。体外系统中也发现IL-2结合到IL-2R后可促进p56lck活性,引起IL-2Rβ链的酪氨酸磷酸化。IL-2Rγ链胞浆内含86个氨基酸,无激酶功能区,但具有一个与SH-2同源的区域,可能参与IL-2R介导的信号转导。最近研究表明,IL-2Rγ链为IL-4、IL-7、IL-9、IL-13等细胞因子受体所共用(common chain,γC)。
2.p56lck与其它分子的关系 同p56lck相互作用的其它一组分子有人T细胞糖磷脂酰肌醇(glycophosphatidylinositol,GPI)连接的蛋白包括CD59、CD55、CD48以及小鼠T细胞中的Thy-1。应用免疫沉淀方法均能使这些分子同p56lck发生共免疫沉淀。此外,将T淋巴细胞同针对GPI连接的膜分子特异性抗体孵育,然后加入二抗使其交联,均发生几种内源性底物的酪氨酸磷酸化。
许多GPI连接的细胞表面分子可能以两种不同的形式表达在T细胞中,这是由相应分子mRNA不同拼接所致。一种形式是通过GPI附着在细胞膜上,另一种形式具有跨膜区和胞浆的PLC去掉所有GPI相连的膜蛋白后进行免疫沉淀,并分析它们相连的激酶活性,发现大多数酪氨酸磷酸化活性已丧失,表明GPI连接物对于同p56lck相结合是必需的。
采用烷基化试剂或金属离子结合试剂进一步证实了CD4/CD8多肽和GPI连接膜蛋白是分别通过两种不同的机理与p56lck相互作用的。这些试剂可以干扰p56lck同CD4或CD8分子的相互作用,因为p56lck同CD4或CD8的相互作用依赖游离半胱氨酸的存在,并需要金属离子使之稳定这种结合;而p56lck与GPI相连结的蛋白的结合则不受这些试剂影响。这些结果表明,p56lck通过两种或更多不同相互作用机理,直接或间接地同多种细胞表面蛋白形成复合物。
二、p59[SB]fyn[/SB]的
1.p59fyn的分布和结构 p59fyn为非受体PTKs src家庭的一个成员,见于多种细胞中。由于基因拼接的差异产生了两种不同形式的p59fyn。一种以高水平表达于大脑中(p59fyn),另一种主要存在于T淋巴细胞中(p59fyn)。p59fyn基本结构类似于p59fyn和p60src。它通过氨基末端豆蔻酸的基团共价结合于胞浆膜内面,羧基末端有一个负调控功能域,包括含有一个酪氨酸磷酸化位点Tyr528,与p59lckTyr505和p60srcTyr527所起的功能相似。此外,p59fyn还一个自身磷酸化位 点Tyr417。
2.p59fyn的功能 p59fyn可能与T细胞活化调节有关的证据最初来自对带有lpr(lymphoproliferation)或gld(generalizedlymphoproliferative disease)常染色体隐性基因小鼠T淋巴细胞特性的研究,这些T细胞可以表达高于正常T细胞10倍的p59fyn活性。由于大量不成熟T细胞扩增,lpr和gld纯合子小鼠可发生严重的淋巴结病和自身免疫性疾病。进一步研究发现,这些T细胞存在着固有的酪氨酸磷酸化的TCR-ζ链,并提示ζ链磷酸化可能是由p59fyn所介导的。lpr小鼠的T细胞不能经TCR/CD3途径对刺激剂产生应答,可能是由于ζ链磷酸化可能是由p59fyn所介导的。1pr小鼠的T细胞不能经TCR/CD3途径以刺激剂产生应答,可能是由于ζ链内在的磷酸化而使TCR与PLCγ1脱偶联有关。p59fyn同TCR/CD3复合物相连结,用温和去垢剂抽取细胞膜后与抗CD3ε体一起孵育时,p59fyn可与CD3组份发生共免疫沉淀。上述所有推测表明,p59fyn是TCR连接的信号结构所必需的,与p59fyn相连TCR/CD3亚单位是CD3ε。
不成熟CD4+CD8+胸腺细胞中p59fyn表达水平相对较低,当分化为CD4+CD8-或CD4-CD8+成熟T细胞时,p59fyn表达水平增加了10倍。表明p59fyn有利于T细胞的分化。用fyn cDNA同lck启动子融合后建立的转基因小鼠,p59fyn表达水平升高约20倍,并对T细胞系具有严格的限制性。虽然转基因小鼠胸腺细胞静脉型类似于正常鼠胸腺细胞,但对TCR介导的刺激应答增强,同时伴有酪氨酸磷酸化、细胞内钙离子浓度、IL-2产生和细胞增殖水平明显升高。
三、SH-2结构域的调节作用
(一)SH-2结构域的结构特点
前已所述,PTKs src家族包括p59lck和p59fyn,这两个分子的氨基端有三个同源的区域。其中一区域对于豆蔻酸的附着是必需的,豆蔻酸可以通过疏水的相互作用和/或同一种胞浆膜蛋白结合的方式使得激酶定位于质膜上,这种胞浆膜结合蛋白实际上是豆蔻酸化多肽特异性受体。第二区域称为src同源区3(src homology3,SH-3),为一个保守的氨基酸序列,约含50个氨基酸,可见于多种胞浆信号蛋白(signaling protein)以及肌动蛋白结合蛋白中,如肌球蛋白、血影蛋白以及酵母细胞骨架蛋白。目前研究发现SH-3识别的部位是一些富含脯氨酸的区域。但对于SH-3结构域的功能研究还不太清楚,可能与以下几种功能有关:(1)在信号转导过程中调节蛋白与蛋白之间相互作用;(2)调节src相关PTKs与细胞骨架中某些成份相互作用;(3)连接酪氨酸激酶途径与小G蛋白(smallG protein)所调控的途径。第三区域称为src同源区2(src homology2,SH-2),能够识别蛋白中磷酸化的酪氨酸残基,是一个保守的蛋白序列,约有100氨基酸残基组成。通过X光衍射晶体分析法发现SH-2的中心为反平行β片层结构,为SH-2同磷酸化酪氨酸残基作用部位,两侧为α螺旋结构。SH-2主要存在于多种胞浆信号蛋白中(见图8-8),如IP2特异的PLC、磷脂酰肌醇3激酶(phosphatidylinositol 3 kinase,PI-3K)的调节亚单位(P85),调节ras活性的ras-GTP酶激活蛋白(GTPase activating protein,GAP)以及crk、abl和vav原癌基因产物等。
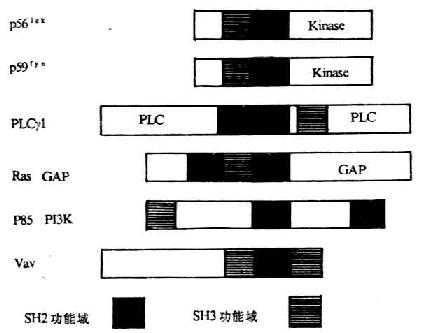
图8-8 参与T细胞活化并含SH-2、SH-3结构域分子的模式图
注:GAP:GTPaseactivating protein,GTP酶激酶活蛋白
SH-2:src homology region2,src同源区2
SH-3:src homology region 3,src同源区3
PLC:phospholipase C,磷脂酶C
(二)SH-2结构域的功能
SH-2的主要功能是介导胞浆内多种信号蛋白的相互连接,形成蛋白异聚体复合物,从而调节信号转导途径中的信号传递。信号蛋白的相互连接是通过的一个多肽分子上SH-2结构域与另一分子磷酸化的酪氨酸残基直接相互作用而完成的,并通过酪氨酸残基的磷酸化或去磷酸化而得到调控。胞浆内信号蛋白分子中SH-2作为一种具有识别功能的结构可以同具有PTK活性的细胞因子受体或PTK相关分子相结合(图8-9)。如小鼠血小板衍生的生长因子受体β(PDGF-βR)本身具有酪氨酸激酶活性,当与配体PDGF结合后,受体本身可以发生二聚体化(dimeration),形成二聚体的两条链互相交叉催化导致受体自身酪氨酸磷酸化,某特定位点的磷酸化的酪氨酸可以同胞浆内某些信号蛋白中的SH-2结合,使得具有PTK活性的激酶接近信号蛋白,然后使信号蛋白发生酪氨酸磷酸化,从而启动多种信号转导途径。例如(1)PLC中γ发生酪酸磷酸化后激活PLC,水解PIP2产生DAG和IP3第二信使物质,进一步发挥信号转导作用;(2)GAP的激活可以提高GTP酶活性;(3)PI-3K中的酪氨酸残基磷酸化后即被激活,提高PI-3K产物水平[PtdIns3P、PtdIms(3、4)P2、PtdIns(3、4、5)P3],进而在信号转导过程中发挥重要作用。
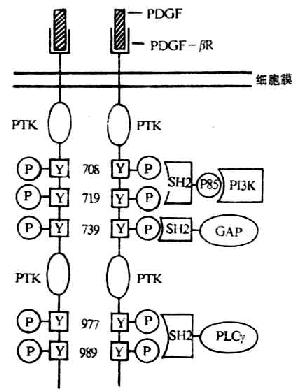
图8-9 胞浆内信号蛋白通过其SH-2与生长因子受体中磷酸化的酪氨酸残基相互作用模式图
注:Y:酪氨酸残基
(三)Vav蛋白
Vav癌基因产物是T细胞活化过程中另一种含SH-2蛋白。Vav蛋白含一个SH-2和两个SH-3结构以及其它一些常见于转录因子中的结构,包括一个碱性区域螺旋-环-螺旋亮氨酸拉链结构域,可使蛋白形成二聚体并具有DNA结合活性的锌指结构以及一个核定位信号(nuclear localizationsignal)。TCR发生交联后的T细胞以及经EGF-R、PDGF-R、IgE-R以及IgM-R刺激途径的其它细胞类型如成纤维细胞、嗜碱性粒细胞、B淋巴细胞均有Vav蛋白酪氨酸磷酸化的发生。Vav酪氨酸磷酸化可能使Vav从膜附着的受体复合物中释放出来并进入细胞核内,通过直接结合琶DNA上调节基因的转录。因此Vav代表了一个独特的酪氨酸磷酸化底物,它可以通过把细胞表面受体与转录调控连接起来的方式,在信号转导中发挥独特的作用。
综上所述,在信号转导过程中涉及到多种信号蛋白的相互作用,这些信号蛋白的相互作用通常是由信号蛋白中某些特殊功能域来实现的,除以上提到的SH-2、SH-3功能域外,还有一些信号蛋白中GAP、PLCγ等,含有一同源区域,此区域约由100氨基酸残基组成,由于它最初发现于pleckstrin中,因而被称为pleckstrin homology(PH)。PH功能域可用同G蛋白相互作用,如β肾上腺素能受体激酶(β-adrenergicreceptor kinase,βARK)中PH功能域可以同G蛋白中β和γ亚单位相结合,目前对PH在信号转导过程中的确切作用还不清楚。
