一、PKC的亚类及其结构特点
(一)PKC亚类
到目前为止,在哺乳动物组织内已确定10种PKC亚类(8-3),分为A、B、C三组,A组称为典型或传统的PKC(classicalor conventional PKC,CPKC),包括α、βI、βⅡ和 γ亚类,其中βI和βⅡ有高度的同源性,是由同一mRNA的不同剪接而成,A组成员分子量在76-78kDa。B组为新型PKC(atypical PKC,aPKC),包括δ、ε、η(L)和θ亚类,分子量在77-83kDa。C组为非典型PKC(atypicalPKC,aPKC),由ζ和λ亚类组成,分子量较小为67kDa。
(二)PKC的结构
PKC的所有亚类都由一条单肽链组成(图8-11),分子量大约为67-83kDa,其结构可分为四个保守区C1-C4(mPKC和aPKC缺少C2区)和五个可变区V1-V5。基中C1区可能是膜结合区,并且含有富含半胱氨酸的随机重复序列Cys-X2-Cys-X13(14)-Cys-X2-Cys-X7-Cys-X7-Cys(X代表任何一种氨基酸),这段顺序与在许多金属-蛋白质及转录调节有关的DNA结合蛋白中的半胱氨酸-锌-DNA结合指形区(cysteine-Zinc-DNabinding finger)保守顺序Cys-X2-Cys-X13-Cys-X2-Cys相似。最近对PKC的多肽片段进行分析发现,该序列与佛波酯和二酰基甘油(DAG)的结合有关。C2区与PKC对Ca2+的敏感性有关。C1和C2在结构上不同于其它蛋白激酶,能结合Ca2+、磷脂、DAG和TPA,因此C1和C2区又称为调节区。C3区包括一个ATP结合序列Gly-X-Gly-X-X-Gly-Lys,该区域与其它蛋白激酶的ATP结合位点具有很高的同源性,又称催化区。C4区包含一个底物结合区,是识别磷酸化底物所必需的。
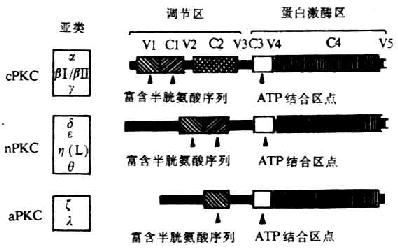
图8-11 PKC亚类的分子结构
二、PKC的转位与激活
1.PKC的转位 PKC广泛分布于多种组织、器官和细胞,静止细胞中PKC主要存在于胞浆中,当细胞受到刺激后,PKC以Ca2+依赖的形式从胞浆中移位到细胞膜上,此过程称之为转位(translocation)。一般将PKC的转位作为PKC激活的标志。
2.PKC的激活 PKC的活性依赖于钙离子和磷脂的存在,但只有在磷脂代谢中间产物二酰基甘油(DAG)存在下,生理浓度的钙离子才起作用,这是由于DAG能增加PKC对底物亲和力的缘故。磷脂酰肌醇-4,5-二磷酸(PIP2)在磷脂酶-C作用下水解生成DAG和IP3。IP3促进细胞内钙离子的释放,在激活PKC过程中与DAG起协同作用。乙酸豆塞外佛波酯(12-o-tertradecanoylphordol-13-acetate,TPA;或phorbol-12-myristate-13-acetate,PMA)是一种促肿瘤剂,由于基结构与DAG相似(图8-12),可在很低尝试下模拟DAG,活化PKC,使PKC亲和力增至10-7M。PKC是TPA的受体,当TPA插入细胞膜后可以替代DAG而直接活化PKC。当过高剂量TPA处理细胞可使靶细胞中PKC迅速耗竭,反而影响细胞的信号传递。
我种化学物持或抗生素对PKC活性具有抑制作用,根据抑制剂作用PKC靶部位的不同可以将抑制剂分为二组:一组是作用于催化区的抑制剂,它们可与蛋白激酶的保守残基结合,因此对PKC无明显的选择性;另一组是作用于调节区的抑制剂,它们可与Ca2+、磷脂和二酰基甘油/佛波酯相结合,因而有较高的选择性(图8-4)。
表8-4 蛋白激酶C的抑制剂
| 靶部位 | 抑 制 剂 | 来 源 |
| 催化区 | staurosporine | 放线菌属 |
| UCN-01 | 放线菌属 | |
| UCN-02 | 放线菌属 | |
| K252a | 放线菌属 | |
| H-7 | 合 成 | |
| 氨基吖啶 | 合 成 | |
| 桑吉瓦霉素 | 放线菌属 | |
| 调节区 | 氯丙嗪 | 合 成 |
| 三氟拉嗪 | 合 成 | |
| 三苯氨胺 | 合 成 | |
| 多粘菌素B | 细 菌 | |
| 阿霉素 | 放线菌属 | |
| calphostin | 真 菌 | |
| cercosporin | 真 菌 |
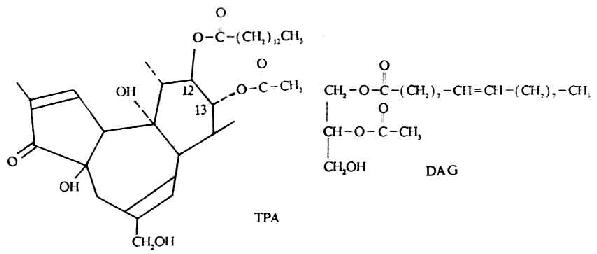
图8-12 TPA与DAG结构的比较
