一、MHC与胸腺对胸腺细胞的选择作用
成熟的、有功能的T细胞必须经过在胸腺中阳性选择和阴性选择,MHC在这两种选择中起关键作用。
(一)阳性选择过程(positive selection)
早期的胸腺细胞前体(prothymocyte)不足3%,为CD4-CD8-双阴性细胞(double negative cells),随后发CD4+CD8+双阳性细胞(double positive cells),并受一以严格的选择。假如一个双阳性细胞表面能与胸腺皮质上皮细胞表面MHc I类或Ⅱ类分子发生有效结合,就可被选择而继续发育,否则会发生程序性的细胞死亡(programmed cell death)。MHC I类分子选择CD8复合受体(coreceptor),而使双阳性细胞表面CD4复合受体减少;MHCⅡ类分子选择CD4复合受体,而使CD8复合受体减少。这种选择过程赋于成熟CD8+CD4-T细胞具有识别抗原与自身MHc I类分子复合物的能力,CD4+CD8-T细胞具有识别抗原与自身MHCⅡ类分子复合物的能力,成为T细胞MHC限制现象的基础。
(二)阴性选择过程(negativeselection)
经过阳性选择后的T细胞还必须经过一个阴性选择过程,才能成为成熟的、具有识别外来抗原能力的T细胞。位于皮质与髓质交界外的树突状细胞(DC)和巨噬细胞(Mφ)表达高水平的MHc I类抗原和Ⅱ类抗原,在胚胎发育过程中,机体自身抗原成分与DC或Mφ表面MHc I类、Ⅱ类抗原形成复合物。经过阳性选择后的胸腺细胞如能识别DC或Mφ细胞表面自身抗原与MHC抗原复合物,即发生自身耐受(self tolerance)而停止发育,而不发生结合的胸腺细胞才能继续发育为识别外来抗原CD4+CD8-或CD4-CD8+单阳性细胞,迁移到外周血液中去(图6-13)。
二、MHC对免疫应答的遗传控制
人们早已观察到各种不同品系动物的免疫应答是由遗传控制的,如豚鼠对白喉毒素结核菌素的易感性在不同品系间有很大差异人类变态反应性疾病的发生与遗传因素有关。但对这一问题的深入研究主要归功于60年代后免疫化学研究中合成多肽抗原的应用,对H-2的深入了解以及同类系和H-2内重组株小鼠的建立。
(一)MHC对免疫应答遗传控制研究的基本条件
1.人工合成多肽抗原 化学合成多肽抗原主要有以下两类:
(1)合成分枝多肽抗原:它是以线状的多聚赖氨酸(L)联上多聚丙氨酸(A)的侧链,形成A-L骨架结构,然后再在丙氨酸链上偶联不同的氨基酸,形成具有不同抗原特异性的分枝多肽抗原。最常用的是(T,G)-A-L,(H,G)-A-L和(φ,G)-A-L等(图6-14)。抗原特异性由末端氨基酸所决定,侧枝和主干起载体的作用。
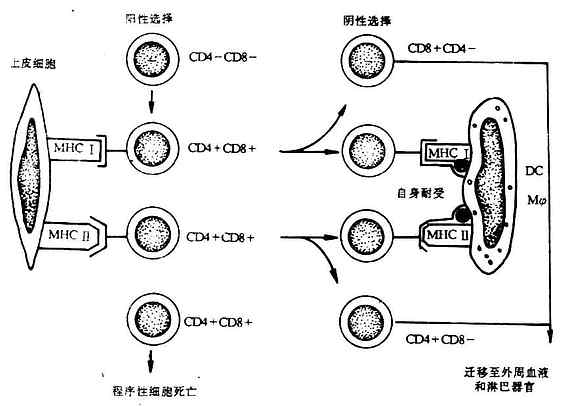
图6-13 MHC与胸腺的选择作用
(2)线状多肽抗原:这是几种氨基酸按不同比例和数量结合而成的线状多肽,具有较强的抗原性,如GLφ等。单种氨基酸组成的均一多肽抗原性很弱,但偶联上半抗原后则是很好的免疫原,例如多聚赖氨酸(PLL)与DNP偶联形成的DNP-PLL被广泛用于豚鼠免疫应答遗传控制的研究。
2.同类系小鼠(congenic mice)是遗传北景完合相同,只是所需研究的那个基因不同的小鼠。建立同类系小鼠是诺贝尔获得者Snell对免疫遗传学作用出的突出贡献。有了同类系小鼠和人工合成多肽抗原,就可以深入研究免疫应答的基因控制以及与MHC的关系。同类系小鼠的培育的方法见图6-15。
首先近交系(inbredstrain)A品系小鼠与另一个近交系B品系小鼠进行交配,A品系MHC是a/a纯合(homozygous)的,B品系MHC是b/b纯合的。A与B品系杂交的子一代(F1)全部是a/b杂合状态的。然后将F1小鼠与亲本A品系进行回交(backcross),其子代一半为a/a,另一半为a/b,a/b杂合状态小鼠的皮片移植到A品系小鼠后迅速被排斥,而a/a子代小鼠的皮片移植到A品系小鼠后并不迅速被排斥。将通过皮片移植后发生迅速排所鉴定的a/b杂合小鼠又与A品系小鼠进行回交,其子代一半为a/a,另一半为a/b,再用上述皮片移植排斥反应的方法鉴定出a/a或a/b,将a/b杂合不再与A品系小鼠进行回交。如此继续20代后,a/b杂合小b等位基因仍然保留,但原来B品系小鼠中其它的遗传座位都消失了,正如连续稀释(serial dilution)一样,F1小鼠保留了B品系基因的50%,回交后第一代平均只保留了B品系基因的25%,这样经过20次回交后除了保留B品系的MHC等位基因(b)以外,其余B品系的基因(非MHC基因)都消失。也就是说,经过如此20代回交后a/b小鼠,除了第17号染色体上的MHC是a/b杂合以外,其余的遗传背景(除17号染色体MHC以外和其余39对染色体)均与A品系相同。将经过20代回交的a/b小鼠进行品种间杂交(interbreed)或称史妹交配,其子代的MHC基因25%是a/a纯合,25%是b/b纯合,50%是a/b杂合的。其中b/b纯合小鼠皮片移植的A品系小鼠后即发生迅速的排斥。用b/b纯合小鼠进行品种间杂交,培育出一个新的品系即MHC基因位点上与B品系相同,而其它所有的遗传背景与A品系相同,我们可称作这个品系小鼠与A品系是同类系(congenic to strain A),或者叫做在A遗传背景的B MHC。常用同类系小鼠单体型见表6-7。
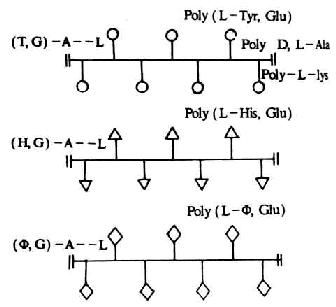
图6-14 合成分枝多肽抗原示意
注:(T,G)-A--L:(多聚酪氨酸,多聚谷氨酸)-多聚丙氨酸-多聚赖氨酸
(H,G)-A--L:(多聚酪氨酸,多聚谷氨酸)-多聚丙氨酸-多聚赖氨酸
(φ,G)-A--L:(多聚酪氨酸,多聚谷氨酸)-多聚丙氨酸-多聚赖氨酸
L:L型,D:D型
3.H-2内重组株 通过不同的同类系杂交,根据交换重组定律,在杂交后代中选择新的H-2内重组体(interH-2recombinants)。不同的重组株在H-2内的一些基因位点具有不同的等位基因,即H-2单体型(haplotype)不同。
例如品系A,B10.A单体型为a,它是由H-2k和H-2d两个双亲单体型的I-E亚区和S区之间发生交换重组而产生(表6-8)。H-2内重组株(举例)参见表6-9。
表6-7 常用同类系小鼠的单体型(标准品系,type strains)
| 品系 | 单体型 | K | I-A | S | D |
| B10(C57BL/10) | H-2b | b | b | b | b |
| B57BL/6 | H-2b | b | b | b | b |
| DBA/2 | H-2d | d | d | d | d |
| Balb/c | H-2d | d | d | d | d |
| B10.D2 | H-2d | d | d | d | d |
| C3H | H-2k | k | k | k | k |
| CBA | H-2k | k | k | k | k |
| B10.BR | H-2k | k | k | k | k |
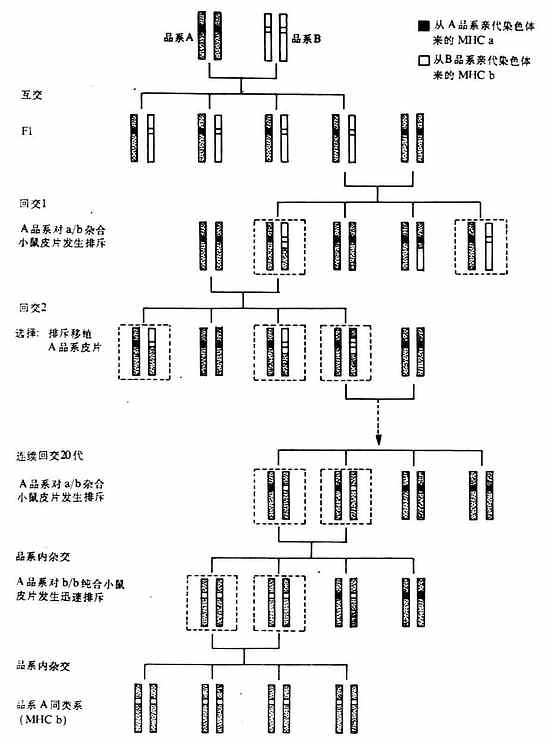
图6-15 同类系小鼠培育的方法
表6-8 A.B10.AH-2内重组株的产生
| 单体型 | K | I-A | I-E | S | G | D | |
| 亲代1 | k | k | k | k | k | k | k |
| 亲代2 | d | d | d | d | d | d | d |
| A.B10·A | a | k | k | k | d | d | d |
表6-9 H-2内重组株(举例)
| 品系 | 单体型 | 双亲单体型 | K | I区 | S | G | D | |
| A | E | |||||||
| A.B10.A | a | k/d | k | k | k | d | d | d |
| A.AL | a1 | k/d | k | k | k | k | k | d |
| C3H.OL | o1 | d/k | d | d | d | k | k | k |
| C3H.OH | o2 | d/k | d | d | d | d | d | k |
| B10.A(4R) | h4 | a/b | k | k | b | b | b | b |
| B10.AM | h5 | k/b | k | k | k | k | k | b |
| B10.A(3R) | i3 | b/a | b | b | k | d | d | d |
| B10.A(5R) | i5 | b/a | b | b | k | d | d | d |
| A.TL | t1 | s/al | s | k | k | k | k | d |
| A.Th,B10.S(7R) | t2 | s/a | s | s | s | s | s | d |
| BSVS | ts | s/a2 | s | s | s | d | d | d |
| B10.M(17R) | ag1 | s/f | k | k | k | d | d | f |
| B10.M(11R) | ap1 | s/f | f | f | f | f | f | d |
(二)Ir基因
1.免疫应答基因的发现 Benacerraf等(1963)首先证实豚鼠对人工合成抗原PLL(聚-L-赖氨酸)等的抗体应答能力受单个常染色体显性基因(单基因)的控制(表6-10)。实验表明,2和13两个品系豚鼠对不同人工合成抗原的应答能力不同。两个品系杂交的子一代(F1)对三种抗原全部有应答能力,说明应答基因为显性。再将F1和隐性亲本进行回交,所得下一代对抗原的应答表现出孟德尔定律的分离现象,应答与无应答个体呈1:1之比,说明遗传是由单基因控制的。F1代与显性亲本进行回交,下一代中全部对抗原发生应答。Benacerraf将控制免疫应答的基因称为免疫应答基因(immune responesgene ,Ir基因)。具有Ir基因的动物对相应抗原呈高应答者(responder),缺乏核基因者呈无应答或低应答者(non-responder)。
表6-10 豚鼠免疫应答基因的发现
| 抗原 | 2 | 13 | (2*13)F1 | (2*13)F1*13 | (2*13)F1*2 | ||
| 50% | 50% | 50% | 50% | ||||
| DNP-PLL | + | - | + | + | - | + | + |
| Glutamyl alanine copolymer(GA) | + | - | + | + | - | + | + |
| Glytamyl tyrosine copolymer(CT) | - | + | + | + | + | + | - |
注:DNP-PLL:二硝基苯—多聚赖氨酸 GA:谷氨酰丙氨酸多聚体 CT:谷氨酰酪氨酸多聚体
2.小鼠Ir基因位一地H-2 I区内
(1)小鼠Ir-1基因与MHC连锁基因:60年代中期,McDevitt和Sela等发现小鼠有类似针对合成分枝多肽(T,G)-A-L抗原的基因,称Ir-1基因,并证明该基因与MHC存在着连锁关系;如C57BL小鼠对(T,G)-A-L有高抗体应答,而CBA小鼠则为低应答;对(H,G)-A-L的反应则CBA小鼠为高应答,而C57BL为低应答。以后又检了一系列对特定抗原高应答、中应答或低应答的小鼠品系(表6-11)。并用回交试验证实小鼠Ir基因为单个常染色体显性遗传(图6-16)。
表6-11 不同品系小鼠对三种人工合成抗原的抗体应答
| 小鼠品系 | H-2 | 抗体产生应答 | ||
| 单体型 | 抗(T,G)-A-L | 抗(H,G)-A-L | 抗(φ,G)-A-L | |
| A/J | a | 低 | 高 | 高 |
| A.BY | b | 高 | 低 | 高 |
| C57BL | b | 高 | 低 | 高 |
| B1,LP | b | 高 | 低 | 高 |
| C3H,SW | b | 高 | 低 | 高 |
| BALB/c | d | 中 | 中 | 高 |
| DBA/2 | d | 中 | 中 | 高 |
| CBA | k | 低 | 高 | 高 |
| C3H/HeJ | k | 低 | 高 | 高 |
| B10.BR | k | 低 | 高 | 高 |
| AKR | k | 低 | 高 | 高 |
| DBA/1 | q | 低 | 低 | 高 |
| SJL | s | 低 | 低 | 低 |
| A.SW | s | 低 | 低 | 低 |
(2)Ir-1基因定位于H-2 I区内:70年代初,McDevitt等又利用同类系和H-2内重组系小鼠,将1r-1基因定位于H-2 I区内(表6-12)。
Milich等(1982)应用同类系小鼠证实对HBsAg a和d决定簇的体液免疫应答也受MHC内的基因所调节。单倍H-2q产生高应答,H-2s.f产生低或无应答,H-2a.b.d.k单倍型为中等应答。进一步用H-2内重组系小鼠的实验表明,控制上述体液免疫应答的基因可能位于K区和I-A亚区。
![应用回交试验证实小鼠对(多聚苯丙氨酸,多聚谷氨酸)-多聚丙氨酸-多降赖氨酸[φG)-A-L]应答的Ir基因为单个常染色体显性遗传](/lilunshuji/xibaohefenzimianyixue/xibaohefenzimianyixue069.jpg)
图6-16 应用回交试验证实小鼠对(多聚苯丙氨酸,多聚谷氨酸)-多聚丙氨酸-多降赖氨酸[φG)-A-L]应答的Ir基因为单个常染色体显性遗传
表6-12 位H-2 I区内Ir基因位置(举例)
| 抗原 | Ir基因 | 亚区位置 | H-2I区以外 | |
| I-A | I-E | 的影响基因 | ||
| (T,G)-A-L | Ir-1A | + | +(Ig) | |
| (H,G)-A-L | Ir-(H,G)-A-L | + | ||
| GL Pro | Ir-GLPro | + | ||
| GL Leu | Ir-GL leu | +(β) | +(α) | |
| GL Phe | Ir-GL Phe | +(β) | +(α) | |
注:T酪氨酸 G-谷氨酸 A-丙氨酸
L赖氨酸 H-组氨酸 Pro-脯氨酸
Leu-亮氨酸 Phe-苯丙氨酸
(3)H-2对DHR的遗传控制:对人工合成抗原诱导的迟发型超敏应答(DHR)同样受MHC的遗传控制。H-2a.b.d.f.j.k.r.u.v单倍单倍型小鼠对多聚体GAT(谷氨酸60-丙氨酸90-酪氨酸10)的刺激表现为DHR应答品系(R),H-2n.p.q.s单倍型属于无应答品系(NR)。R品系与NR品系杂交,F1为R品系,F1与NR回交,后代1/2为R,1/2为NR,符合单个常染色体显性遗传的规律。DHR可以通过致敏T细胞传递给同基因小鼠,而不能传递给不同基因之小鼠,DHR也可传递给有一个单体型相同之小鼠,如杂交子一代,但超敏反应程度介于前两者之间。杂交子一代的致敏T细胞亦可把DHR传递给亲代。Miller等又进一步证明,对GAT迟发型超敏应答的补动传递不要求供体与受体基因型完全相同,而只有I-A亚区相同。
3.人的免疫应答基因 胡蜀山等(1985)请用3H-TdR法,以体外诱导淋巴细胞增殖刺激指数为指标,发现在无关志愿者中对(H,G)-A-L、(T、G)-A-L、(Phe、G)-A-L、GLPhe和GAT抗原应答的百分率分别为64%、54%、30%、36%和76%。通过家系调查表明:(1)人类对人工合成抗原泊应答也符合孟德尔单染色体显性遗传的规律;(2)控制(T、G)-A-L和(H,G)-A-L和Ir基因是不同的;(3)通过HLA内重组家系的HLA抗原的分析,提示控制(T、G)-A-L和(H、G)-A-L的Ir基因Ir-TGAL和Ir-HGAL位于HLA-A与B位点之间而与D/DR无关。
Ir基因与MHC连锁的现象,除豚鼠、小鼠和人外,也见于大鼠、恒河猴等多种动物,表明这种现象具有普遍的生物学意义。
4.免疫应答基因的作用模式 对某些抗原不起应答或呈低免疫应答,可能是由于Ir基因缺陷,Ir基因所编码的Ia抗原不能与该抗原结合,或对抗原的提呈能力低,不能激活Th,或只能引起低免疫应答。有关Ir基因通过其基因产物Ia抗原在Mφ与Th间传递抗原的水平上起作用的模式主要有Benacerraf(1978)提出的决定基选择模型(determinant selectionmodel)(图6-17),该模式认为的Mφ表面的Ir基因产物有数量不限的特异性结合点,能特异地与一定的氨基酸顺序结合,这些特异的氨基酸顺序约由3~4个氨基酸组成,使一个复杂的外来抗原物。T细胞抗原受体(TCR)只能识别复合物分子才发生免疫应答反应。如果某个外来抗原结构中不具备这种特定的氨基酸顺序,或Mφ表面Ir基因产物不能与外来抗原特定的决定簇结合,都不能被TCR所识别,表现出对这种抗原的无应答状态。
5.Is基因和Ts细胞 Debre(1975)发现GT抗原可在某些小鼠体内诱导Ts细胞而抑制对GT-MBSA(甲基化的牛血清白蛋白)的免疫应答。这种控制抑制诱导的基因是显性遗传的,与H-2基因复合体有关。为了与位于H-2的Ir基因相区别,Debre等称之为Is基因。开始有人认为Is基因位于I-J亚区,最近的研究表明,Is基因可能位于I-A亚区内,而目前I-J亚区并未得到证实。某些小鼠对一些抗原(如CT,GAT)的无应答性是由于这些抗原诱导产生了Ts细胞的结果,小鼠接受这些抗原诱导的能力受Is基因控制。如选择性地除去Ts细胞后,无应答者可变不应答者。
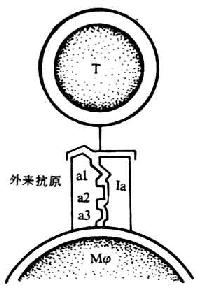
图6-17 决定基选择模型
免疫应答基因已逐渐超出原来的概念:一是在MHC内除与Ⅱ类基因有关外,还与I类基因有关,如流感病与HLA-B7亲和性高,DNFB与HLA-A2亲和性高,HLA-B34、B22者对风疹疫苗接种所产生的抗体效价较高,而HLA-B16者对流感疫苗无免疫应答。杂合个体比纯合个体有更多可能性对多种抗原发生应答,即有更强的抗感染能力,称之为“杂交优势”。二是Ir基因还可能与非MHC基因相连锁,如免疫球蛋白VH基因、X染色体以及其它基因等。
三、MHC参与免疫细胞识别抗原
(一)抗原/MHC复合物的形成
外源性蛋白质被APC摄入细胞内,在溶酶体内被水解成肽段。同时,MHc Ⅱ类分子在内质网中装配成αβ异二聚体,由高尔基器转送到溶酶体,与该处带有免疫原性或主导师决定簇的抗原肽相结合形成抗原肽/MHC复合物,补转送到APC表面,被CD4+T细胞所识别。
内源性抗原以病毒抗原为例。病毒DNA整合到细胞核DNA中,通过转录和翻译,在胞浆内生成特异的病毒蛋白质抗原,继而被蛋白酶体(proteasome)摄取并酶解成肽段。与此同时,内质网腔中合成MHc I类抗原及β2微球蛋白。加工处理后的肽段进入内质网腔与MHc I类抗原结合形成稳定的聚合体之后,被高尔基器运往细胞表面,被CD8+T细胞所识别。HLa Ⅱ类基因DQ和DP之间的蛋白酶体相关基因(proteasome-relatedgenes,)和ABC转运物基因(ABCtransporter genes)基因产物参与内源性抗原的处理和抗原片段的转运。
(二)T细胞识别抗原/MHC复合物
T细胞是一类重要的免疫活性细胞。T细胞本身的活化及效应功能的发挥,不仅与外来抗原和丝裂原和丝裂刺激和多种细胞因子的调节密切相关,而且有赖于T细胞与抗原提呈细胞(APC)之间、不同T细胞亚群相互之间以及T细胞与靶细胞之间的直接接触。CD4+阳性T细胞TCR/CD3识别外来抗原与MHc Ⅱ类抗原(多态部分)的复合物,CD8+T细胞TCR/CD3识别外来抗原与MHc I类抗原(多态部分)复合物。此外在T细胞识别过程中还有赖于多种细胞表面分子的辅助,这些分子包括CD4、CD8、MHc I类、Ⅱ类抗原,LFA-1(CD11a/CD18)、ICAM-1(CD54)、LFA-2(CD2)和LFA-3(CD58)等。其中CD4和CD8分子分别与MHCⅡ类抗原和I类抗原的非多态部分(即Ⅱ类分子上α2和β2结构和I类分子上重链α3结构域)结合。有关内容请参考“白细胞分化抗原”和“粘附分子”两章。
四、MHC对免疫应答中免疫细胞相互作用的限制(约束)作用
MHC另一个重要的生物学功能是约束免疫应答过程中各类免疫细胞的相互作用,又称为MHC的约束性(MHc restriction),包括免疫应答感应阶段Mφ-Th之间,反应阶段Th-B之间,以及效应阶段Tc-靶细胞之间的相互作用。MHc I类和Ⅱ类抗原分别对不同细胞起约束作用。
(一)Mφ、T、B细胞相互作用过程中的MHC约束性
Rosenthal和Shevach(1973)首先在豚鼠中观察到T细胞只能被具有相同MHc I区基因(Ⅱ类基因)的抗原提呈细胞所激活(表6-13)。同年Katz等人也发现Th与B细胞相互作用时,只有在两者MHc I区(Ⅱ类基因)相同的条件才会出现协作应(表6-14)。
表6-13 豚鼠T细胞对胸腺信赖抗原的免疫应答中Mφ提呈抗原与Ia抗原的关系
| OVA预处理T细胞 | OVA加Mφ | DNA合成的增加 |
| 品系2 | 品系2 | ++++ |
| 品系13 | 品系13 | ++++ |
| 品系2 | 品系13 | — |
| 品系13 | 品系2 | — |
| (2*13)F1 | 品系2 | +++ |
| (2*13)F1 | 品系13 | +++ |
| (2*13)F1 | (2*13)F1 | ++++ |
注:豚鼠用卵清蛋白(OVA)加完全弗氏佐剂(CFA)免疫,腹腔渗出物分离的T细胞即为OVA预处理T细胞,在体 外与OVA加Mφ-起培养,用3H-胸腺嘧啶核苷掺入法作为T细胞特异性免疫应答。品系2和13仅在MHC的I区不同
表6-14 小鼠T-B细胞协作中受I区基因限制
| DNP-KLH抗原预致敏B细胞的品系 | BGG载体预致敏T细胞的品系 | 受照射(a*b)F1受体对DNP-BGG抗体应答再次反应 |
| a | a | ++++ |
| b | b | ++++ |
| a | b | - |
| b | a | - |
| b | (a*b)F1 | ++++ |
| a | (a*b)F1 | ++++ |
| (a*b)F1 | a | ++++ |
| (a*b)F1 | b | ++++ |
注:(1)DNP-DLH:二硝基苯酚-钥孔墄血兰素;DGG:牛r球蛋白。
(2)DNP-KLH预致敏B细胞为DNP-KLH免疫小鼠的脾细胞经抗Thy-1加补体处理去除T细胞而获得。
(3)BGG免疫小鼠脾细胞除去B细胞后为BGG载体预致敏T细胞。
(4)将DNP-KLH预致敏B细胞和BGG预致敏T细胞输入经照射后(a*b)F1受体,再用DNP-BGG抗原刺激,检测机体对DNP抗体应答的再次反应。
(二)MHC对Tc杀伤病毒感染靶细胞的约束
1.Zinkernagel-Doherty现象 Zinkernagel和Doherty(1974)道德证明受牛痘病毒感染的CBA(H-2k)小鼠中的Tc只能杀伤H-2单体型相同的病毒感染靶细胞,而不能杀死牛痘苗病毒感的H-2b细胞,称为“Zinkernagel-Dohertyphenomenon”。1975年Doherty用淋巴细胞脉络膜脑膜炎病毒(lymphocyte-choriomeningitis virus,LCM病毒)感染H-2d小鼠,取出Tc在体外只能杀伤LCM病毒感染的H-2d单体型细胞,不能杀伤LCM病毒感染的H-2k细胞(见图6-18)。上述实验表明,Tc对于只具有MHC抗原或病毒抗原中单独一种抗原的靶细胞都不起杀伤作用。
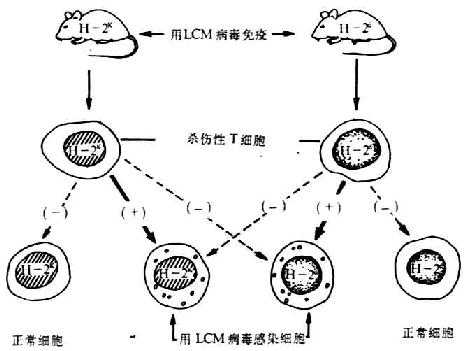
图6-18 MHC对Tc杀伤病毒感染靶细胞的约束作用
2. MHC I类抗原对Tc杀伤靶细胞的限制作用 参与免疫应答杀伤相(效应相)的H-2抗原是由K、D区决定的,I区并不参与,这不同于前述的免疫应答感应阶段中Mφ-Th,Th-B细胞之间相互作用受I区控制(表6-15)。
用三硝基苯(TNP)修饰自体的脾细胞为靶细胞也同样证实了MHC对Tc杀伤TNP修饰靶细胞的约束现象。在人类杀伤病毒感染或半抗原修饰的靶细胞也同样受到I类抗原的约束,如McMicheal等(1977)发现杀伤流感病毒感染的靶细胞主要受HLA-B位点抗原的约束,Dickmeiss(1977)实验表明杀伤DNFB致敏淋巴细胞诱导Tc杀伤靶细胞中,HLA-A抗原必须一致。
由于自身MHC约束Tc细胞杀伤靶细胞的特异性,使体内受病毒感染或癌肿恶变的靶细胞得以迅速有效地清除,从这个意义上来讲,MHC参与机体抗感染及免疫监视功能。
Tc对同种异体靶细胞的杀伤作用不受自身MHC的约束,Longo(1982)认为体内存在着两类不同的T应答细胞:一类针对外来抗原+自身MHC抗原发生免疫应答;另一类对同种异体细胞发生免疫应答。
表6-15 小鼠特异性Tc细胞的杀伤作用与靶细胞H-2的关系
| 靶细胞感染的病毒 | 靶细胞H-2遗传背景 | 杀伤作用 | ||
| K | I | D | ||
| LCM | s | k | d | + |
| LCM | q | p | q | - |
| LCM | s | s | s | + |
| LCM | d | d | d | + |
| LCM | k | k | k | - |
| 仙台病毒 | s | k | d | - |
注:小鼠特异性Tc细胞取自受LCM病毒致敏、H-2型别为KsIkDd小鼠的脾脏
八十年代初,采用基因转染技术,将H-2b及H-2d的I类基因转染小鼠白血病细胞系(L细胞系)。这些受I类基因转染的细胞表面有I类抗原的表达。特异性Tc不能杀伤未经I类基因转染的病毒感染L细胞,但可杀伤经I类基因转染的病毒感染L细胞,表明转染后所表达的I类抗原起约束作用。Ozato等切割I类基因的不同片断进行基因杂交,并将其转染到L细胞系,成功地得到嵌合I类抗原分子,如α1及α2结构域取自与杀伤细胞I类基因相同的基因片段,而α3、穿膜及胞浆区取自与杀伤细胞I类基因不同基因片段,则杀伤细胞可杀伤病毒感染的靶细胞,所之则不然。上述试验证明,α1及α2结构域是参与杀伤和约束的有效部位。
利用突变品系小鼠研究发现靶细胞I类抗原突变分子的微小变化便能改变Tc细胞对它的识别。使如H-2kbml突变株(b为单倍体,m为突变)来自H-2Kb突变品系,只有个别氨基酸的差异,Kb约束病毒抗原特异性的CTL就不能识别和裂解多种病毒感染的Kb突变的bm1靶细胞,表明1~3个氨基酸的变化足以使I类抗原失去原有的约束作用(表6-16)。
3.MHC对Tc杀伤病毒感染靶细胞约束的机制 目前关于MHC对Tc细胞杀伤病毒感染靶细胞约束的机制一般认为是通过联合识别(associativerecognition),即Tc表面一个受体识别MHC编码的抗原与病毒抗原的复合物。
Benacerraf认为MHC I类Ⅱ类抗耕牛具有双重功能,在诱导阶段通过其结合部位选择抗原决定基,激活Th、Ts、Tc等效应细胞;在效应阶段,靶细胞上的I类和Ⅱ类抗原又约束Th、Ts、Tc发挥效应。
(三)载体效应(cerriereffect)
Benacerraf认为载体不是单纯起运载半抗原的作用,还具有载体特异性。载体处于耐受状态的动物,虽给予半抗原载体复合物,也不能诱导产生抗半抗原的抗体。对半抗原再次应答的发生有赖于对半原记忆的B细胞和对载体记忆T细胞同时存在时才能发生(图6-19)。
表6-16 K(b)-约束的CTL(a)对Kb(b)突靶细胞上抗原的识别
| CTL针对病毒抗原 | 对Kb突变靶细胞的裂解 | ||||||
| bm5(1)(c) | bm6(2) | bm9(3) | bm3(2) | bm8(3) | bm11(1) | bm1(3) | |
| LCM病毒 | ++ | ++ | ++ | + | - | ||
| 小鼠脱脚病病毒 | ± | + | + | - | |||
| SV40 | ++ | ++ | + | + | - | ||
| Moloney氏病毒 | ++ | ++ | ++ | ++ | - | ++ | - |
| Seudai病毒 | ++ | ++ | ++ | + | + | - | - |
| 痘苗病毒 | ++ | + | + | - | |||
| VSV | ++ | (+) | + | - | |||
| 甲型流感病毒 | ++ | (+) | - | - | |||
注:(a)CTL是Tc细胞,取自各种病毒致敏的小鼠脾,其本身的H-2型别为Kb;
(b)所有品系自B6突变而来,b为单倍型,m为突变;
(c)突变后氨基酸结构改变的数目
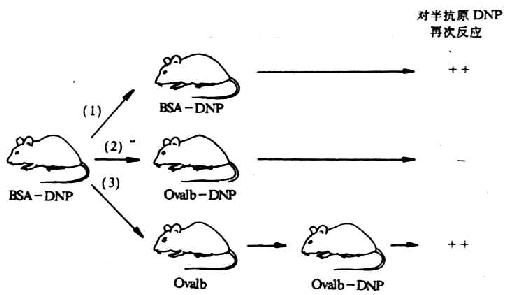
图6-19 载体效应
注:①第二次注射与第一次相同的半抗原(DNP)和载体(牛血清白蛋白BSA) ,结果产生对DNP的再次反应。
②第二次反注射的抗原中,半抗原与第一次相同,载体(卵白蛋白ovalbumin)与第一次注射抗原的载体不同,结果不产生再次反应;
③第一次注射后,单独注射卵白蛋白,经过一定时间后再注射载体为卵白蛋白、半抗原为DNP的抗原,结果产生再次反应。
Mitchison等载体效应的过继转移(adoptive transfer of carrier effect)试验,证实了上述关于载体效应的结论(图6-20)。
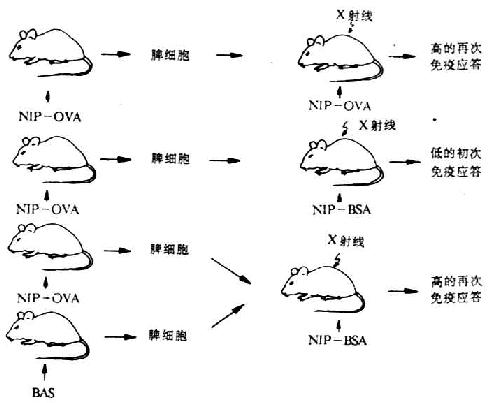
图6-20 载体效应的过继转移试验(Mitchison)
Raff等载体效应阻断实验进一步证实T细胞是载体特异的载体反应细胞(carrier-reactivecell),B细胞是半抗原反应细胞(hapten-reactivecell)(图6-21)。
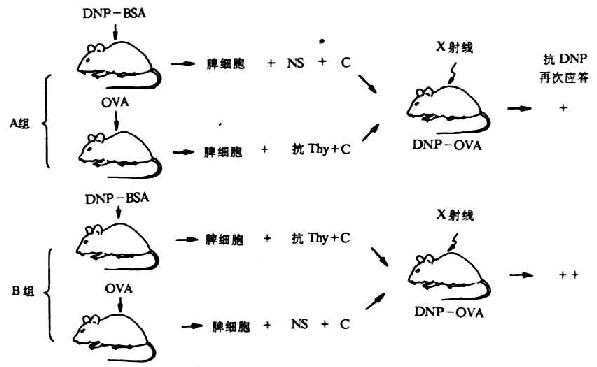
图6-21 半抗原、载体反应淋巴细胞的鉴定(Raff等)
