酶标抗体与荧光色素标记抗体不同,它需借助桥-偶联剂的作用,将酶连结在抗体分子上。偶联剂是一种双功能试剂,具备3个基本特征:①偶联剂与抗体和酶之间的连结,必须是不可逆的,即借共价键连结;②偶联剂不应影响酶和抗体的活性;③不能因偶联剂的加入,使酶与组织成分了生非特异结合。
在HRP标记抗体中,常用的偶联剂有戊二醛、过碘酸钠及Maleimide等,现简介如下。
1.戊二 醛标记法戊二醛为制备各种酶标抗体最常用的偶联剂。市售戊二醛往往含有戊二酸、丙烯释及戊二醛自身聚合本等杂质,故需纯化后使用。戊二醛的纯度用含杂质的二醛的单体戊二醛的OD比值表示,它们的最大吸收光波长分别为235nm 和280nm,二者的OD比值(235/280)小于3时,制备酶标抗体的效果较好,大于3时,需经蒸馏或Sephadex G-10柱层析或活性碳吸附等处理,除去杂质后应用。其制备方法分一步法和两步法;基本原理相同,是使戊二醛的两个醛基之一与酶蛋白的赖氨酸结合,另一醛基与免疫球蛋白上的氨基结合,将酶连结于抗体上。
(1)一步法:将酶、抗体、戊二醛按一定比例混合,经透析除去标记物中剩余的戊二醛,制得酶标抗体。优点是简单省时,缺点是反应程度不易被控制,因为酶蛋白分子和抗体蛋白分子同戊二醛间的反应速率不同,抗体蛋白的氨基数远较HRP为多,与戊二醛反应快,因此在戊二醛的作用下,抗体蛋白易通过分子内和分子间的彼此交联,形成较大的聚合体,而与酶蛋白分子间的交联相应减少,影响酶的标记。据Nakane等推算,加入的HRP仅20%与抗体连结,标记率较低(约1%~5%)很难获得理想的酶标抗体。
(2)二步法:首先用过量的戊二醛与HRP反应(HRP:戊二醛为1:105),以保证酶分子仅与戊二醛的一个醛基结合,另一个醛基游离;然后用层析法除去多余的戊二醛,制成活性HRP(HRP-戊二醛复合物),再加入过量的抗体,使活化HRP上剩余的醛基与抗体蛋白分子上的氨基结合,制成酶标抗体。过量的抗体可以保证酶与抗体间均匀连结,避免酶本身聚合。根据所用的HRP与抗体(IgG)比例不同,酶标记率各异,平均为5%~25%。标记步骤如下:
①10~15mgHRP(RZ=3.0),溶解于0.2ml 1.25%戊二醛中(0.1mol/L磷酸缓冲液配制),18h室温。
②透析或 SephadexG-25柱层析(0.15mol/l NaCl平衡),去除过量的戊二醛,收集活化HRP。
③浓缩活化HRP至10mg/ml左右,加入抗体5mg(1.0ml 0.15mol/L NaCl 溶解)。
④碳酸盐缓冲液(pH9.5)调整pH至9.0~9.5,使抗体与活化HRP结合,4℃24h。
⑤加入0.1ml赖氨酸缓冲液,阻断未反应的醛基,4℃,2h。
⑥用半饱和硫酸铵沉淀5次,对PBS透析24h,4℃,换3次PBS,除去硫酸铵(10000rpm/min,30min)。
⑦或用凝胶色谱法(SephadexG-200/Sephacryl S-200) 等分离标记抗体。
注意:该方法要求HRP的RZ值在3.0左右,游离氨基较少,与戊二醛反应后,制成的酶标抗体大部分为单体;而RZ值小于2.8的HRP,含有较多的游离氨基,与戊二醛反应后,易形成多聚体,使方法的敏感性下降。
2.过碘酸盐氧化法严格地讲,过碘酸钠(Sudium periodate)不是一种真正的偶联剂,其本身并非作为桥连结在抗体和酶之间,而是借助于过碘酸钠的氧化作用,将酶连结在抗体上。该方法仅适于含糖较丰富的酶(如HRP)的标记。我们知道,HRP分子的糖本身与酶活性无关,利用过碘酸钠氧化这部分糖分子内的-CH基,使之生成-CHO基,再与抗体蛋白的游离氨基反应,生成Shiff’s碱。此Shiff’碱在pH降低时呈可逆性解离,所以经氢硼化钠(NaBH4)还原,形成稳定的酶标抗体复合物(图4-1)。为防止生成的-CHO基与酶蛋白氨基自身交联,预先可用二硝基氟苯(Dintro-fluorobenzene)处理HRP,阻断分子内的ε-、α-氨基。
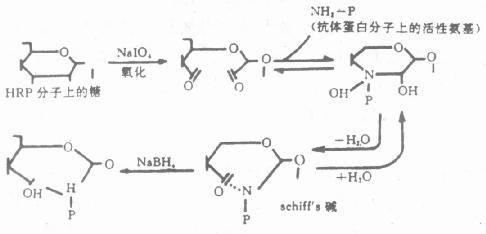
图4-1 过碘酸盐氧化原理
过碘酸盐氧化法,酶的RZ值≥3时较佳;RZ<3时,糖含量较少,游离氨基较多,氧化时酶易发生本身聚合,影响酶标抗体的产量,据报告,适当地控制过碘酸盐溶液及反应条件,几乎所加入的HRP和抗体均形成酶标抗体,其标记率为70%左右。具体步骤为:
(1)4mgHRP(RZ=3.0)溶于1.0ml双蒸水中。
(2)加0.2ml新鲜配制的0.1mol/LNaIO4,轻轻摇动混合20min,肉眼可见液体内棕黄变成深绿色。
(3)对0.1mol/L醋酸盐缓冲液(pH4.4)透析,20h,4℃。
(4)调整HRP液体的pH至9.5(一般加入20μl0.2mol/L碳酸盐缓冲液pH9.5),立即加入抗体(IgG)8.0mg/Fab 3.0mg (0.01mol/L碳酸盐缓冲液溶解),轻轻混匀后,置室温2h。PH≤8.5时,抗体的NH2基被氧化生成NH3+,后者不能与CHO基反应,所以,保持pH9.0~9.5非常重要。
(5)加入0.1ml新鲜配制的0.4%NaBH4 溶液,置1~4℃2h,以稳定酶标抗体复合物。
(6)经透析等去除未反应的NaBH4,避免还原过度。然后经盐析或柱层析等方法分离酶标抗体(方法同戊二醛法)。
如此制得的酶标抗体,加入终浓度1%牛血清白蛋白(Bovine Serum Albumin, BSA)分装后于-80℃可保存数年;亦可加入6%等量甘油,混匀置-20℃/4℃保存1年左右。上述两种标记法是ICC研究中最常用的酶标抗体制备方法。
3.Maleinmide法上述酶标抗体(IgG)的分子量较大,对抗体的穿透性有一定影响,而在制备过程中,需经两次纯化,即多聚体与单体及单体与非标记抗体的分离。已知单体(1个HRP分子标记1个IgG分子)的分子量为190~200kD,非标记抗体为146~150kD,用凝胶过滤法很难将二者分开。所以,Sternberger等进行了抗体片段Fab的标记。用植物性蛋白酶---木瓜酶(Papain)水解抗体蛋白,可获得一个无抗体活性稳定的Fc段结晶和两个相同的抗原结合片段(Fab),此Fab段为单价,分子量50kD,HRP标记后,单体分子量为90kD,较容易将单体和非标记的Fab段分离。在此基础上,Imagawa(1982)又进行了改良,引入了N-羟基丁二酰酯(Maleinmide),标记抗体的特定部位---Maleinmide法。该方法的主要原理是:(1)借助双功能试剂Maleinmide活化HRP,使其具有与—Hs 基反应的能力;(2)利用胃蛋白酶水解IgG,IgG重链在近羧基端被切断,这样在绞链区(Hinge region)至少可以保留一个S-S键,从而得到一个具有双价抗体活性的F(ab')2段。该S-S键与抗体活性无关。可以通过加入硫基乙醇(2(β)-Mercapto ethanol, HSCH2CH2OH)使其断裂,被还原成—HS基 。如此双价抗体活性的F(ab')2片段即变为带有—Hs 基的单价Fab’片段,后者再与活化的HRP结合,便制成了酶标抗体Fab'。由于空间遮蔽的关系,绞链区即使存在两个—HS基,也只能有一个能与酶结合,另一个—HS基不能与酶反应,即酶与抗体Fab’段结合比例为1:1,因此酶标抗体Fab’段绝大多数是单体,很少形成多聚体。在标记过程中,应用过量的活化HRP,还能避免非标记抗体Fab'段的存在。Fab'段的分子量与Fab段相似(50kD左右),所以酶标后Fab'亦较容易与未标记的Fab'分离。此标记方法多用于酶免疫分析研究,其步骤为:
①6mg HRP溶于1.0ml PBS(pH7.0)中。
②4mg Maleinmide 溶于0.5ml N, N二甲基酰胺(N,N-dimethylformamide)中。
③将上述两种液体充分混合,持续搅拌1h,30℃。
④离心取上清,经0.1mol/lPB(pH6.0)平衡的Sephadex G-25柱层析,收集含有蛋白部分的洗脱液,浓缩,制得活化HRP。
⑤每1.8mg活化HRP,加入已被还原的Fab'2mg,4℃20h持续搅拌。
⑥ Sephadex G-200/Sephacryl S-200分离酶标抗体Fab'片段,保存同前。
