载脂蛋白E是一种富含精氨酸的碱性蛋白,人ApoE299个氨基酸残基组成,分子量为34145D,含32个Arg和12个Lys存在于血浆的CM、VLDL及其残粒和β-VLDL中均含有ApoE,一部分ApoE在血液中与ApoAⅡ形成复合体。
Shore于1973年首先发现ApoE,Rall等于1982年测出ApoE的蛋白质一级结构,其后Taylor建立ApoE的cDNA序列,Breslow 和Zannis首先测出ApoE有3个等位基因异构体以及基因在染色体上的定位。据推算和测定,在介质中ApoE有62%的α-螺旋,9%的β-片层,11%的β-转角和18%无规则线团。ApoE分子可以被凝血酶水解为二个区域,N-端区(1~191)为22kD的可溶性球蛋白,此区域较稳定,该片段的136~158位肽段为受体结合位点,富含碱性氨基酸(赖氨酸和精氨酸),也属于肝素结合区。此片段为一个反平行的四螺旋束,是α-螺旋蛋白的一般折叠方式。C端区(216~299)分子量为10kD,螺旋程度很高,不稳定,是与脂蛋白的结合区。用截去了末端的变异体及合成多肽片段进行ApoE羧基末端的检测表明,191残基以外羧基端存在三个螺旋,其中两个为A型(203~223和225~266),第三个(268~289)为一种G型螺旋。与脂类或不同的脂质微粒或二甲基磷脂酰胆碱结合的结果说明,G螺旋和第二螺旋的末端在脂质连结,在ApoE的四聚体化过程中起重要的作用。更精确地说是263~286片段可能在脂连结ApoE与VLDL的结合中起有关键作用。ApoE主要由肝脏合成,近年来发现脑,肾,骨骼,肾上腺及巨噬细胞也能合成。ApoE其结构如图3-2所示。
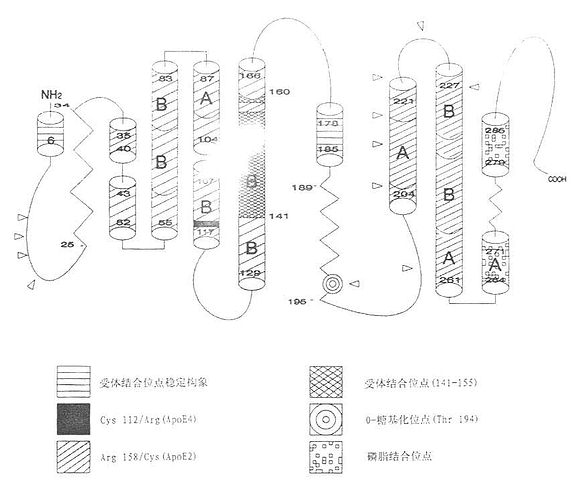
图3-2 载脂蛋白E结构示意图
