比较不同种类包括人类脂肪组织、牛乳腺、鼠巨噬细胞、猪脂肪组织和禽类的LPL一级结构,发现人类LPL氨基酸序列与哺乳类动物有87%~94%同源性,与禽类比较也有70%同源性,表明LPL在进化过程中的高度保守性。人类LPL、肝脂酶(HL)以及胰脂酶(PL)具有高度相似的氨基酸序列,推测三者可能起源于同一个基因家族,具有共同的作用机制。
目前人类LPL二级结构尚未阐明,推测LPL分子可能由两个结构区域构成:N端区的和C端区,N端区包括1~315位氨基酸,形成一个以β折叠为主的近球形结构,它是LPL重要的功能区,催化活性中心就位于此区。构成LPL催化活性中心的三个氨基酸分别为Ser132、His241和Asp156,用中性氨基酸取代活性中心附近的氨基酸,LPL活性明显下降或消失。Asn43是N端区一重要的糖基化位点,它起着维持LPL正常三维结构的作用。对正常分泌的LPL活性功能具有重要意义。此外,N端区第279~282位和292~309位氨基酸介导LPL与肝素结构。C端区呈一个折叠的柱状连接在球形的N端区,C端区的功能尚有争议,多数认为与介导酶与底物接触,形成活性的LPL同源二聚体以及间接参与酶解过程。
LPL在实质细胞的粗面内质网合成,新合成的LPL留在核周围内质网,属于无活性酶,由mRNA翻译合成的无活性LPL,称为酶前体,再糖基化后,才转化成活性LPL酶,如图5-1所示。从细胞中如何分泌;目前认为有两种机制,其一是细胞合成的LPL后直接分泌,不贮存于细胞内,即称为基本型分泌;其二是调节型分泌,某些细胞新合成LPL贮存于分泌管内,一旦细胞受到一个合适的促分泌剌激。LDL即分泌,此时分泌往往大于合成。所有细胞都具备基本型分泌,只有少部分细胞兼有两种分泌形式。Vannier提出,LPL是结合在插入细胞内分泌器并存在于细胞膜外表面的硫酸肝素糖蛋白(heparin sulphate protoglycans, HSPG),致使酶保持一种无活力的浓缩状态,然后通过一个尚未阐明的机制由肝素促使分泌,即肝素后血浆中得到活化的LPL,分布在含甘油三酯的脂蛋白中,并主要是分解CM和VLDL的甘油三酯并结合附着在这些脂蛋白残粒中,可能形成肝摄取这些颗粒的信号。
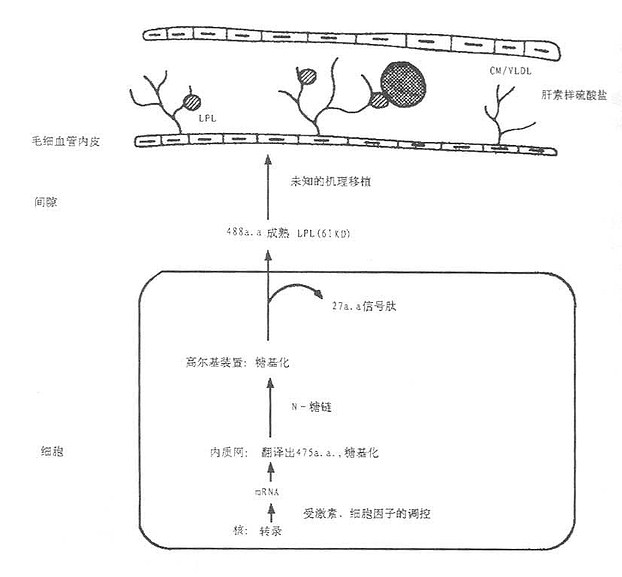
图5-1 LPL的合成
