心室肌的收缩是面临着动脉压(后负荷)的阻挡进行的。等容收缩相内,心室肌收缩首先引起室内压升高,只有当室内压升高到超过动脉压时,心肌纤维才能缩短,心室容积才能缩小,血液才能射出。由此可见,在心率恒定情况下,心室每次收缩的射血量取决于心肌纤维缩短的程度和速度,这决定了心肌收缩产生张力(表现为心室内血液的压力)的程度和速度。凡是能影响心肌收缩强度和速度的因素都能影响搏出量,而搏出量的调节正是通过改变心肌收缩的强度和速度来实现的。
1.心肌收缩的“全或无”现象心肌细胞和骨骼肌细胞一样,收缩反应是由肌膜的兴奋通过兴奋~收缩耦联触发引起的;但是,从整块肌肉来看,在骨骼肌,一个细胞产生的兴奋不能扩布到另一个细胞,只有在支配一个肌细胞有神经纤维发放神经波动时,才会出现收缩效应;若发放冲动的神经纤维数目增加,可以引起更多的肌细胞兴奋和收缩,整块肌肉的收缩增强。因此,如果骨骼肌作单收缩,其收缩强度的改变可以来自两个方面,一是由于单个肌细胞收缩强度的改变,另一原因是参与收缩活动的肌细胞数目发生变化。心肌则不同,相邻的心肌细胞是由闰盘的特殊结构和特性,兴奋可以通过它由一个心肌细胞传播到另一个心肌细胞。因此,整个心室(或整个心房)可以看成是一个功能上互相联系的合胞体,产生于心室某一处的兴奋可以在心肌细胞之间迅速传递,引起组成心室的所有心肌细胞几乎同步收缩。从参与活动的肌细胞数目上看,心肌的收缩是“全或无”的。这就是说,心肌据要么不产生,一旦产生则全部心肌细胞都参与收缩。由此可见,心肌收缩的强度,不象骨骼肌那样可以因参加活动的细胞数目的不同而改变;各个心肌细胞收缩强度的变化是整块心肌收缩强度发生的唯一原因。所以搏出量的调节可以从单个心肌细胞收缩功能调控的角度来探讨。
2.搏出量的调节搏出量和搏功的调节,是心脏生理中最基本最重要地课题之一,从世纪末、本世纪初以来,众多学者对此进行了大量实验研究。50年代中期,Sarnoff对这些研究资料进行详细分析之后,将搏出量和搏功的调节归纳为:①由初长度改变引起的异长调节,以及②由心肌收缩能力改变引起的等长调节等方式。
(1)异长调节:前已述,控制骨骼股收缩强度和速度的一个重要因素就是肌肉本身的初长度,而初长度是被动地由该肌肉收缩前所随的负荷(前负荷)所决定的。前负荷和初长度对肌肉收缩强度和作功能力的影响是双相的,构成的长度~张力曲线类似抛物线,在前负荷和初长度达最适水平之前,肌肉收缩强度和作功能力随前负荷~初长度的增加而增加;超过最适水平,收缩效果将随前负荷~初长度的继续增加而降低(图4~3)。
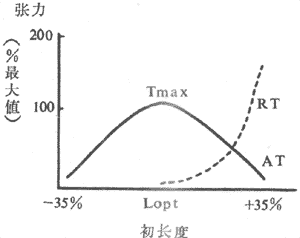
图4~3 骨骼肌的长度~张力曲线
AT:主动张力 RT:静息张力(被动张力)
Tmax:最大张力 Lopt:最适初长
在心肌,初长度同样是控制收缩功能最重要的因素,不过,初长度和收缩功能的关系具有某些特殊性。为了分析前负荷和初长度对心脏泵血功能的影响,可以在实验中逐步改变心室舒张末期压力(亦称充盈压)和容积(相当于前负荷或初长),并测量射血心室的搏功或等容心室的室内峰压,将一系列搏功或室内峰压数据对应心室舒张末期压力和容积,绘制成坐标图,即为心室功能曲线(图4~4)。心室功能曲线大致可分为三段:①充盈压1.6~2kPa(12~15mmHg)是人体心室最适前负荷,位于其左侧的一段为功能曲线升支,它与骨骼肌长度~长力曲张升支段相似;均表明当前负荷~初长度未达最适水平之前,搏功或等容峰压随初长度的增加而增加,通常情况下,左室充压约0.7~0.8kPa(5~6mmHg),可见正常心室是在功能曲线的升支段工作,前负荷~初长度尚远离其适水平.这一特征表明心室具有较大程度的初长度贮备,心室通过前负荷~初长度的增加即异长调节机制使泵血功能增强的容许范围是很宽的.而体内骨骼肌的自然长度已经接近最适长度,前负荷~初长度贮备很小,通过初长度调节其收缩功能的范围也很小;②充盈压2~2.7kPa(15~20mmHg)范围内,曲线逐渐平坦,说明前负荷在上限范围内变动时对泵血功能的影响不大;③随后的曲线呈平坦状,或轻度下倾,并不出现明显的降支,这一点明显不同于骨骼,说明正常心室充压即使超过2.7kPa(20mmHg),搏功不变或仅轻度减少,只有在民生严重病理变化的心室,功能曲线才出现降支。
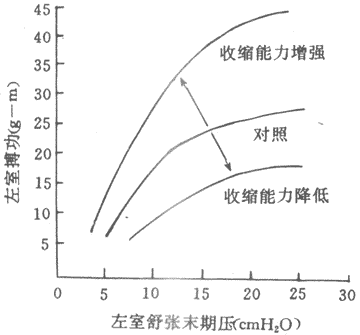
图4~4 心室功能曲线(lcmH2O=0.098kPa)
在一组心肌肌小节标本上的研究表明,在心室最适前负荷和最适初长度时,肌小节初长度为2.0~2.2μm,这正是肌小节的最适初长度,粗细肌丝处于最佳重叠状态。这种情况下,肌小节等长收缩产生的张力最大。达最适水平之前,随着前负荷和肌小的初长度的增加,粗细肌丝有效地重叠的程度增加,激活时可能形成的横桥联接的数目相应增加,肌小节以至整个心室的收缩强度增加,搏出量和搏功增加。由此可见,心室功能曲线的升支正是肌小节初长度~主动张力关系的升支在整个心室功能上的一种反映。在搏出量的这种调节机制中,引起调节的因素是心肌细胞本身初长度的改变,其效应是心肌细胞收缩强度的改变,因些将这种形式的调节称为异长调节。
为什么骨骼肌的长度~张力曲线出现降支,而正常心室的功能曲缍不再现降支?已知,一个具有弹性的物质受到外力作用时,一方面可被拉长,随之产生弹性张力,与此同时,这一个弹性张力又具有阻止它本身被进一步拉长的作用。当骨骼肌处于最适长度即肌小节初长度为2.0~2.2μm的状态下,所产生的静息张力较小,继续增加前负荷,肌细胞可被进一步延伸,肌小节初长度可大大超过2.2μm,肌丝重叠程度明显减小,收缩能力因此下降。但是,由于心肌细胞外间内含有大量劲度较大的胶原纤维,因而心肌的伸展性较小,处于最适初长度时,产生的静息张力已经很大,从而阻止心肌细胞继续被拉长。实验证明,即使在前负荷很大的情况下,心肌肌小节初长度一般也不会超过2.25~2.30μm。心肌细胞这种抵抗过度延伸的特性,对心脏泵血功能具有重要生理意义,它使心脏不致于被在前负荷明显增加时,引起搏出师长作功能力的下降。心室功能曲线不再现降支,并不是心肌初长度超过最适水平之后心肌的收缩功能依然不受影响,而只是在这种情况下初长度不再与前负荷呈平行关系。而在慢性过度扩张的病理心脏上观察到的功能曲线降支,是由于室壁心肌发生了组织学改变,心室容积扩大,心肌细胞收缩功能又严重损伤的缘故。
既然前负荷~初长度是调节搏出量的主要因素,那么在体情况下有哪些因素可以影响心室的前负荷和初长度?在心室其它条件(主要是心室肌的顺应性)不变的情况下,心室前负荷~舒张末期压是由心室舒张末期充盈的血液量来决定的,充盈量大,舒张末期容积也较大。可以设想,凡是影响心室充盈量的因素,都能够通过异长调节机制来使搏出量发生改变。
心室充盈的血量,是静脉回心血量和心室射血剩余血量两者的总和。静脉回心血量又受下述因素的影响:①心室舒张充盈期持续时间。例如,心率增快时,充盈期缩短,心室充盈不完全,充盈压降低,搏出量减少;②静脉回流速度。在充盈期持续时间不变的情况下,静脉内血液通过惊讶进入心室的速度愈快,充盈量愈大,搏出量相应增加。静脉加流速度取决于外周静脉压与心房压和心室压之差。外周静脉增高(如循环血量增加、外周静脉管壁张力增高等情况下)和(或)心房心室压力降低时,可促进静脉回流。心脏每次射血之后的剩余血液量,也影响心室的充盈量,但是,这种影响是多方面的;如果静脉回心血量不变,心室剩余血量的增加将导致部充盈量增加,充盈压增高,搏出量随之增加;但另一方面,当心室剩余血量增加时,心室舒张期内室压增高,静脉回心血量将因此减少,总充盈量不一定增加。总之,在心室射血功能不为的情况下,心室剩余血量的增减对搏出量是否有影响以及发生何种影响,取决于心室总充盈量是否改变以及发生何种改变。
早在1914~1918年,生理学家Starling在哺乳动物身上就观察到肌纤维初长度对心脏的功能的影响,因此异长调节也称为Starling机制,心室功能曲线也可称为Starling曲线。通常,心室射血量与静脉回心血量相平衡,从而维持心室舒张末期压力和容积于正常范围,如果因某种原因造成静脉回心血量超过射血量,则充盈压将增高,通过Starling机制增加搏出量使之与回流量重新达到平衡,否则舒张末期压力和容积将持续增高而得不到纠正。但Starling机制的主要作用是对搏出量进行精细的调节。例如,当体位改变以及当左右心室搏出量不平衡等情况下所出现的充盈量的微小变化,是通过异长调节机制来改变搏出量使之与充盈量达到平衡的;而对于持续的、剧烈的循环功能变化,例如体力劳动时搏出量持久且大幅度的增高,主要靠心肌收缩能力的变化来调节,这时异长调节机制的作用不大。
(2)等长调节:人们进行强体力劳动时,搏出量和搏功可成倍增加,而此时心脏舒张末期容积不一定增大,甚至有所减小;相反,心力衰竭病人,心脏容积扩大而其作功能力反而降低。由此推测,对于心脏的泵血功能,除异长调节处,还有另一种与心肌初长度无关的调节机制存在。精确的实验研究表明,将离体心有保持在最适长度情况下,支甲肾上腺素促使心肌等长收缩产生的最大张力和张力上升速率都增加,等张收缩的幅度增大,缩短速度加快,将一系列等长收缩或等张收缩的实验结果绘制成长度~张力曲线和张力~速度曲张,可以看到,在去甲肾上腺素作用下,长度~张力曲线升支向左上方移位,张力~速度曲张向右上方移位。这些结果表明,处于任何一种初长度下(不只是最适初长度)的心肌,在有去甲肾上腺素的情况下,等长收缩产生的张力都比没有去甲肾上腺素时为高;后一结果表明,任何一种后负荷情况下,受去甲肾腺素作用的心肌等张收缩的缩短速度增快。完整心室的结果类似:给予去甲肾上腺素后,心肺功能曲线左上移位,表明有同一前负荷~舒末容积条件下,等容心室的峰压增高,射血心室容积缩小程度增加;室内压上升速率和射血期容积缩小的速度也能增加。其结果,搏出量和搏功增加,心脏泵血功能明显加强。另一些因素,如乙酰胆碱,则引起相反效应。很明显,上述干预因素引起心肌收缩功能和心脏泵血功能改变的原因并不是初长度的变化,而是通过心肌另一种功能变数起作用的。这种功能变数称之为心肌收缩能力(myocardial contractility)。心肌收缩能力一般地定义为:心肌不依赖于负荷而改变其力学活动(包括收缩活动的强度和速度)的一种内在特性,因此,心肌收缩能力又称为心肌变力状态(inotropic state)。在某些因素作用下,心肌收缩能力发生改变,从而影响心肌细胞学活动的强度和速度,使心脏搏出量和搏功相应发生改变(图4~4)。心脏泵血功能的这种调节是通过收缩能力这个与初长度无关的、心肌内在功能变数的改变而实现的,故称等长调节。
心肌收缩能力受多种因素的影响,兴奋~收缩耦联过程中各个环节(参看第二章)都能影响收缩能力,其中活化横桥数和肌凝蛋白的ATP酶活性是控制收缩能力的主要因素,已知,粗肌丝上的横桥,只有与细肌丝的肌纤蛋白结合形成横桥联接并活化,才能导致肌丝滑行并产生力。在一定初长度的条件下,粗细肌丝的重叠区提供了可以形成横桥联接的最大横桥数,然而不是所有横桥都会形成活化横桥。海参化横桥数与最大横桥数的比例,取决于兴奋后胞浆Ca2+浓度的升高程度和肌钙蛋白对Ca2+的亲和力;凡能增加兴奋后胞浆Ca2+浓度(或)肌钙蛋白Ca2+亲和力的因素,均可增加活化横桥的比例,导致收缩能力的增强。例如儿茶酚胺增加收缩能力的原因之一,就是它通过激活β~肾上腺素能受体,增加胞浆cANP浓度,使肌膜Ca2+通道和肌浆网Ca2+的通道的开放程度增加,导致心肌兴奋后胞浆Ca2+浓度升高程度增加。一些钙增敏剂,如茶碱,可以增加肌钙蛋白对Ca2+的亲和力使肌钙蛋白结合形成活化横桥,肌凝蛋白的ATP酶就被激活,它分解ATP以提供肌丝滑行的能量。甲状腺激素和体育锻炼能提高肌凝蛋白ATP酶活性,促进心肌收缩能力增强;相反,老年人的心脏和甲状腺功能减退患者的心脏,心肌肌凝蛋白分子结构发生改变,其ATP酶的活性较低,收缩能力减弱。
心肌收缩能力的评定:
泵血功能反映的是心室前负荷的后负荷(见后文)、心肌收缩能力及及心率等变数的综合效果,而心肌收缩能力直接反映心肌本身的功能状态,收缩能力的改变具有极其重要的生理和病理意义。因此,理论研究和临床实践中都需要对收缩能力进行定量测量和评定,以了解收缩能力的水平和变化。由于收缩能力并不是某种可测量的单一变数,因此,对收缩能力的具体度量是比较困难的。衡量泵血功能的指标(如搏出量、搏功等)受前、后负荷影响,并不能直接反映收缩能力的水平,只有根据心肌长度~张力曲线或心室功能曲线的移位来判断收缩能力的变化(左上移位提示收缩能力增强,右下移位表明收缩能力低下,图4~4)。但这种评定方法具有操作繁杂、敏感性较低的缺点。目前,常用的方法是采用一系列速度指标来定量评定收缩能力。在离体心肌,最常采用的是张力变化速率(Dt/dt)和长度变化速率(Dl/dt);对完整心室,常采用的指标有:等容相室内压变化速率(Dp/dt)、射血相心室容积变化速率(dV/dt)或心室直径变化速率(dD/dt)等,以及心肌纤维收缩成分的缩短程度(VCE)等。这些速度指标受负荷改变的影响较小,对收缩能力的变化比较敏感,为国内外心脏学研究工作者广泛采用。
(3)后负荷对搏出量的影响:已知,离体肌肉的后负荷对收缩过程产生一定的影响,对心室而言,动脉压起着后负荷的作用,因此,动脉压的变化将影响心室肌的收缩过程,影响搏出量。在心率、心肌初长度和收缩能力不变的情况下,如果动脉压增高,等容收缩相室内压峰值必然也增高,从而使等容收缩相延长而射血相缩短,同时,射血相心室肌纤维缩短的程度和速度均减小,射血速度减慢,搏出量因此减少。应该看到,后负荷对心肌收缩活动的上述影响,是一种单纯机械效应,并不是某种功能调节机制进行调节的结果。从心肌收缩释放的能量的分配比例上,可以很容易理解这个问题。当心肌收缩能力不变时,收缩释放的能量是恒定的。如果室内压力升高,表示心肌产生张力消耗的能量相对增加,用于心肌纤维缩短将相对减少;如果肌肉作等长收缩,释放的能量几乎全部用于产生张力。另一方面,也应该看到,由于动脉压影响了搏出量,又常常继发地引起一些调节机制的活动。如上述,动脉压的突然升高首先导致搏出量减少,结果造成心室内剩余血量增加,充盈量增加,后者又再引起异长调节机制的调节,搏出量可以恢复正常水平,即通过异长调节可以使动脉压增高所招致的搏出量减少的现象得到纠正。但是,既然通过异长调节,搏出量已经恢复原有水平,那么,心室的充盈一不是将同时恢复原水平,异长调节的作用被取消,搏出量不是又因高动脉压状态的存在而减少了吗?这就是说,搏出量是否会出现时而降低、时而恢复的现象?许多实验都证明,随着搏出题的恢复,心室舒张末期容积确实也恢复到原水平,但此时,搏出量仍然维持高水平,并不出现再次减少的现象。进一步分析发现,后一情况的出现乃是心肌收缩能力增强所致。尽管此时产生的张力随负荷的增加而有所增加,但缩短的程度不但可以不降低,反而可能增加。至于这种情况下心肌收缩能力为什么增强,原因尚不十分清楚,可能是神经机液机制调节的结果。
综上所述,心室后负荷的本身直接着搏出量,随后通过异长和等长调节机制,使前负荷和心肌收缩能力与后负荷相匹配,从而使机体得在在动脉压增高的情况下,能够维持适当的心输出量。这种情况对于机体是有重要生理意义的。但也应看到,此时搏出量的维持,是心肌加强收缩的结果,如果动脉压持续增高,心室肌将因处于收缩强状太而逐渐肥厚,即发生了病理性改变,随后将导致泵血功能减退。
