纯净的胃液是一种无色而呈酸性反应的液体,Pho 0.9-1.5。正常人每日分泌的胃液量约为1.5-2.5L。胃液的成分包括无机物如盐酸、钠和钾的氯化物等,以及有机物如粘蛋白、消化酶等。与唾液相似,胃液的成分也随分泌的速率而变化,当分泌率增加时,氢离子浓度升高,钠离子浓度下降,但氯和钾的浓度几乎保持恒定(图6-10)。
1.盐酸 胃液中的盐酸也称胃酸,其含量通常以单位时间内分泌的盐酸mmol表示,称为盐酸排出量。正常人空腹时盐酸排出量(基础酸排出量)约为0-5mmol/h。在食物或药物(胃泌素或组胺)的刺激下,盐酸排出量可进一步增加。正常人的盐酸最大排出量可达20-25mmol/h。男性的酸分泌多于女性;盐酸的排出量反映胃的分泌能力,它主要取决于壁细胞的数量(图6-11),但也与壁细胞的功能状态有关。
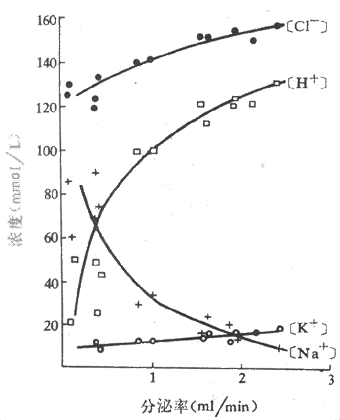
图6-10 人胃液中电解质浓度与分泌率的关系胃液分泌是用组胺静脉注射引起的
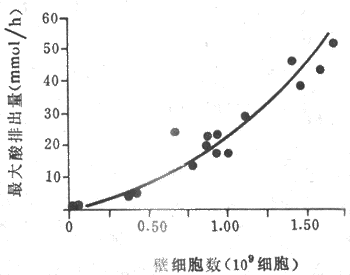
图6-11 胃酸最大排出量与壁细胞数目的关系
由17个人胃的切除部分计算出最大酸排出量和壁细胞数目的关系。
由图显示每100万个壁细胞可产酸约25mEp/h
胃液中H+的最大浓度可达150mmol/L,比血液中H+的浓度高三、四百万倍,因此,壁细胞分泌H+是逆着巨大的浓度梯度进行的,需要消耗大量的能量,能量来源于氧代谢。
泌酸所需的H+来自壁细胞浆内的水。水解离产生H+和OH-,任借存在于壁细胞上分泌小管膜上的H+、K+-ATP酶的作用,H+被主动地转运入小管腔内。
壁细胞分泌小管膜上的H+、K+-ATP酶又称质子泵(proton pump)或称酸泵。H+-K+交换是壁细胞质子泵区别于体内任何其它细胞上的质子泵的显著特征。H+、K+-ATP酶每催化一分子的ATP分解为ADP和磷酸所释放的能量,可驱动一个H+从壁细胞浆进入分泌小管腔和一个K+从小管腔进入细胞浆。H+的分泌必须在分泌小管内存在足够浓度的K+的条件下才能进行。
年来,选拔性干扰胃壁细胞的H+、K+-ATP酶的药物已被用来有效地抑制胃酸分泌,成为一代新型的抗溃疡药物。
已知壁细胞内含有丰富的碳酸酐酶,在它的催化下,由细胞代谢产生的CO2和由血浆中摄取的CO2可迅速地水合而形成H2CO3,H2CO3随即又解离为H+和HCO3。这样,在H+分泌后,留在细胞内的OH-便和由
H2CO3解离的H+结合而被中和,壁细胞内将不致因OH-的蓄积而使pH升高。由H2CO3产生的HCO3则在壁细胞的底侧膜,与CI-并换而进入血液。因此,餐后与大量胃酸分泌的同时,血和尿的pH往往升高而出现“餐后碱潮”。与HCO3交换而进入壁细胞内的CI-则通过分泌小管膜上特异性的CI-通道进入小管腔,与H+形成HCi (图6-12)。
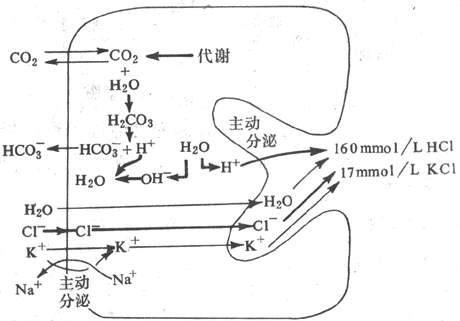
图6-12 壁细胞分泌盐酸的一种假设
胃内的盐酸有许多作用,它可杀死随食物进入胃内的细菌,因而对维持胃和小肠内的无菌状态具有重要意义。盐酸还能激活胃蛋白酶原,使之转变为有活性的胃蛋白酶,盐酸并为胃蛋白酶作用提供了必要的酸性环境。盐酸进入小肠后,可以引起促胰液素的释放,从而促进胰液、胆汁和小肠液的分泌。盐酸所造成的酸性环境,还有助于小肠对铁和钙的吸收。但若盐酸分泌过多,也会对人体产生不利影响,。一般认为,过高的胃酸对胃和十二指肠粘膜有侵蚀作用,因而溃疡病发病的重要原因之一。
2.胃蛋白酶原 胃蛋白酶原是由主细胞合成的,并以不具有活性的酶原颗粒形式贮存在细胞内。当细胞内充满酶原颗粒时,它对新的酶原的全盛2产生负反馈作用。持续的刺激可使主细胞内的颗粒历释放而完全消失,便分泌仍继续进入,说明酶原也可以不经过颗粒的形式直接释放出来。
分泌入胃腔内的胃蛋白酶原在胃酸的作用下,从分子中分离出一个小分子的多肽,转变为具有活性的胃蛋白酶。已激活的胃蛋白酶对胃蛋白酶原也有激活作用。
胃蛋白酶能水解食物中的蛋白质,它主要作用于蛋白质及多肽分子中含苯丙氨酸或酪氨酸的肽键上,其主要分解产物是胨,产生多肽或氨基酸较少。胃蛋白酶只有在酸性较强的环境中才能发挥作用,其最知pH为2。随着pH的升高,胃蛋白酶的活性即降低,当pH升至6以上时,此酶即发生不可逆的变性。
3.粘液和碳酸氢盐 胃的粘液是由表面上皮细胞、泌酸腺的粘液颈细胞,贲门腺和幽门腺共同分泌的,其主要成分为糖蛋白。糖蛋白是由4个亚单位通过二硫键连接形成的(图6-13)。由于糖蛋白的结构特点,粘液具有较高的粘滞性和形成凝胶的特性。在正常人,粘液覆盖在胃粘膜的表面,形成一个厚约500μm的凝胶层,它具有润滑作用,可减少粗糙的食物对胃粘膜的机械性损伤。
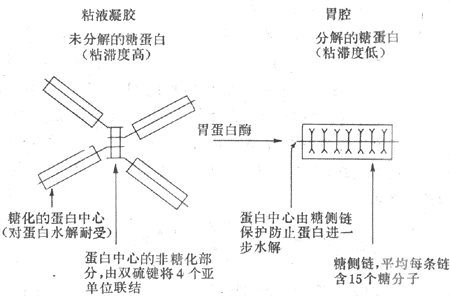
图6-13 胃粘液糖蛋白结构的示意图
胃内HCO3主要是由胃粘膜的非泌酸细胞分泌的,仅有少量的HCO3是从组织间液渗入胃内的。基础状态下,胃HCO3分泌的速率仅为H+分泌速率的5%。进食时其分泌速率的增加通常是与H+分泌速率的变化平行的。由于H+和HCO3在分泌速率和浓度上的巨大差距,分泌的HCO3对办内pH显然不会有多大影响。
长期以来人们一直在思索:胃粘膜处于高酸和胃蛋白酶的环境中,为什么不被消化?近年来“粘液-碳酸氢盐屏障”概念的提出,至少部分地回答了这个问题。这主要是因为。胃粘液的粘稠度约为水的30-260倍,H+和HCO3等离子在粘液层内的扩散速度明显减慢,因此,在胃腔同内的H+向粘液凝胶深层弥散过程中,它不断地与从粘液层下面的上皮细胞分泌并向表面扩散的HCO3遭遇,两种离子在粘液层内发生中和。用pH测量电极测得,在胃粘液层存在一个pH梯度,粘液层靠近胃腔面的一侧呈酸性,pH为7左右(图6-14)。因此,由沾液和碳酸氢盐共同构筑的粘液-碳酸氢盐屏障。能有效地阻挡H+的逆向弥散,保护了胃粘液免受H+的假侵蚀;粘液深层的中性pH环境还使胃蛋白酶丧失了分解蛋白质的作用。
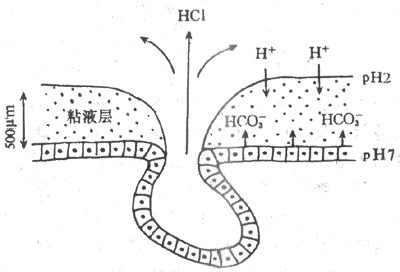
图6-14 胃粘液-碳酸氢盐屏障模式图
正常情况下,胃粘液凝胶层临近胃腔一侧的糖蛋白容易受到胃蛋白酶的作用而水解为4个亚单位,这样,粘液便从凝胶状态变为溶胶状态而进入胃液。但一般来讲,水解的速度与粘膜上皮细胞分泌液的速度相等,这种粘液分泌与降解裼动态平衡,保持了粘液屏障功能的完整性和连续性。
4.内因子泌酸腺的壁细胞除分泌盐酸外,还分泌一种分子量在50000-60000之间的糖蛋白,称为内因子。内因子可与进入胃内的维生素B12结合而促进其吸收。
