第二信使学说是Sutherland等于1965年提出来的。Sutherland学派在研究糖原酵解第一步所需限速酶枣磷酸化酶的活性时,发胰高血糖素与肾上腺素可使肝匀浆在APT、Mg2+与腺苷酸环化酶(adenylate cyclase,AC)的作用下产生一种新物质,这种物质具有激活磷酸体酶从而催化糖原酵解的作用。实验证明,它是环-磷腺苷(cyclic AMP,cAMP),在Mg2+存在的条件下,腺苷酸化酶促进ATPA转变为cAMP。CAMP在磷酸二酯酶(phosphodiesterase)的作用下,降解为5ˊAMP。随后,进一步发现cAMP之所以能激活磷酸化酶,是由于cAMP激活了另一种酶,即依赖cAMP的蛋白激酶(cAMP-dependent protein kinase,cAMP-PK,PKA)而完成的。
Sutherland综合这些资料提出第二信使学说,其主要内容包括:①激素是第一信使,它可与靶细胞膜上具有立体构型的专一性受体结合;②激素与受体结合后,激活漠上的腺苷酸环化酶系统;③在mg2+楔存在的条件下,腺苷酸环化酶促使ATP转变为cAMP,cAMP是第二信使,信息由第一信使传递给第二信使;④cAMP是使无活性的蛋白激酶(PKA)激活。PKA具有两个亚单位,即调节亚单位与催化亚单位。CAMP与PKA的调节亚单位结合,导致调节亚单位与催化亚脱离而使PKA激活,催化细胞内多种蛋白质发生磷酸化反应,包括一些蛋白发生磷酸化,从而引起靶细胞各种生理生化反应(图11-2)。
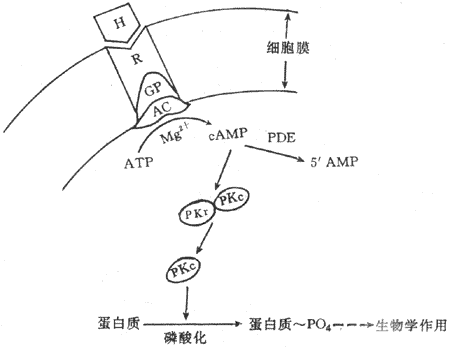
图11-2 含氧激素作用机制示意图
H:激素 R:受体 GP:G蛋白 AC:腺苷酸环化酶PDE:磷酸 二酯酶
RKr :蛋白激酶调节亚单位 PKc:蛋白激酶催化亚单位
以cAMP为第二信使学说的指出,推动了激素作用机制的研究工作迅速深入发展。近年来的研究资料表明,cAMP并不是唯一的第二信使,可能作为第二信使的化学物质还有cGMP、三磷酸肌醇、二酰甘油、Ca2+等。另外,关于细胞表现受体调节、腺苷酸环化酶活化机制、蛋白激酶C的作用等方面的研究都取得了很大进展,现概述如下:
1.激素与受体的相互作用 激素有膜受体多为糖蛋白,其结构一般分为三部分:细胞膜外区段、质膜部分和细胞膜内区段。细胞膜外区段含有许多糖基,是识别激素并与之结合的部位。激素分子和靶细胞受体的表现,均由许多不对称的功能基团构成极为复杂而又可变的立体构型。激素和受体可以相互诱导而改变本身的构型以适应对方的构型,这就为激素与受体发生专一性结合提供了物质基础。
激素与受体的结合力称为亲和力(affinity)。一般来说,由于相互结合是激素作用的第一步,所以亲和力与激素的生物学作用往往一致,但激素的类似物可与受体结合而不表现激素的作用,相反却阻断激素与受体相结合。实验证明,亲和力可以随生理条件的变化而发生改变,如动物性周期的不同阶段,卵巢颗粒细胞上的的卵泡刺激素(FSH)受体的亲和力是不相同的。某一激素与受体结合时,其邻近受体的亲和力也可出现增高或降低的现象。
受体除表现亲和力改变外,其数量也可发生变化。有人用淋巴细胞膜上胰岛素受体进行观察发现,如长期使用大剂量的胰岛素,将出现胰岛素受体数量减少,亲和力也降低;当把胰岛素的量降低后,受体的数量和亲和力可恢复正常。许多种激素(如促甲状腺激素、绒毛膜促性腺激素、黄体生成素、卵泡刺激素等)都会出现上述情况。这种激素使其特异性受体数量减少的现象,称为减衰调节或简称下调(down regulation0)。下调发生的机制可能与激素-受体复合物内移入胞有关。相反,有些激素(多在剂量较小时)也可使其特异性受体数量增多,称为上增调节或简称上调(up regulation),如催乳素、卵泡刺激素、血管紧张素等都可以出现上调现象。下调或上调现象说明,受体或上调现象说明,受体的合成与降解处于动态平衡之中,其数量是这一平衡的结果,它的多少与激素有量相适应,以调节靶细胞对激素有敏感性与反应强度。
2.G蛋白在信息传递中的作用激素受体与腺苷酸环化酶是细胞膜上两类分开的蛋白质。激素受体结合的部分在细胞膜的外表面,而腺苷环化酶在膜的胞浆面,在两者之间存在一种起耦联作用的调节蛋白——鸟苷酸结合蛋白(guanine nucleotide-bindingregulatory protein),简称G蛋白。G蛋白由α、β和γ三个亚单位组成,α亚单位上有鸟苷酸结合位点。当G蛋白上结合的鸟苷酸为GTP时则激活而发挥作用,但当G蛋白上的GTP水解为GDPA时则失去活性。当激素与受体结合时,活化的受体便与G蛋白的α亚单位结合,并促使其与β、γ亚单位脱离,才能对腺苷酸环化酶起激活或抑制作用。
G蛋白可分为兴奋型G蛋白(Gs)和抑制型G蛋白 Gi。Gs的作用是激活腺苷酸环化酶,从而使cAMP生成增多;Gi的作用则是抑制腺苷酸环化酶的活性,使cAMP生成减少。有人提出,细胞膜的激素受体也可分为兴奋型(Rs)与抑制型(Ri)两种,它们分别与兴奋性激素(Hs)或抑制性激素(Hi)发生结合,随后分别启动Gs或Gi,再通过激活或抑制腺苷酸环化酶使cAMP增加或减少而发挥作用。
3.三磷酸肌醇和二酰甘油为第二信使的信息传递系统许多含氮激素是以cAMP为第二信使调节细胞功能活动的,但有些含氮激素的作用信息并不以cAMP为媒介进行传递,如胰岛素、催产素、催乳素、某些下丘脑调节肽和生长因子等。实验证明,这些激素作用于膜受体后,往往引起细胞膜磷脂酰肌醇转变成为三磷酸肌醇(inositol-1,4,5,triphosphate,IP3)和二酰甘油(diacylglycerol,DG),并导致胞浆中Ca2+浓度增高。近年来,有人提出IP3和DG可能是第二信使的学说引起人们的重视,并且得到越来越我的实验证实。这一学说认为,在激素的作用下,可能通过G蛋白的介导,激活细胞膜内的磷脂酶C(phosphinositol-specificphospholipase C.PLC),它使由磷脂酰肌醇(PI)二次磷酸化生成的磷脂酰二磷肌醇(PIP2)分解,生成IP3和DG。DG生成后仍留在膜中,IP3则进入胞浆。在未受到激素作用时,细胞膜几乎不存在游离的DG,细胞内IP3的含量也极微,只有在细胞3受到相应激素作用时,才加速PIP2的降解,大量产生IP3和DG。IP3的作用是促使细胞内Ca2+贮存库释放Ca2+进入胞浆。细胞内Ca2+主要贮存在线粒体与内质网中。实验证明,IP3引起Ca2+的释放是来自内质网而不是线粒体,因为在内质网膜上有IP3受体,IP3与其特异性受体结合后,激活Ca2+通道,使Ca2+从内质网中进入胞浆。IP3诱发Ca2+动员最初发反应是引起暂短的内质网释放Ca2+,随后是由Ca2+释放诱发作用较长的细胞外Ca2+内流,导致胞浆中Ca2+浓度增加。Ca2+与细胞内的钙调蛋白(calmodulin,CaM)结合后,可激活蛋白酶,促进蛋白质磷酸化,从而调节细胞的功能活动。
DG的作用主要是它能特异性激活蛋白激酶C(protein kinase C,PKC)PKC的激活依赖于Ca2+的存在。激活的PKC与PKA一样可使多种蛋白质或酶发生磷酸化反应,进而调节细胞的生物效应。另外,DG的降解产物花生四烯酸是合成前列腺素的原料,花生四烯酸与前列腺素的过氧化物又参与鸟苷酸环化酶的激活,促进cGMP的生成。CGMP作为另一种可能的第二信使,通过激活蛋白激酶G(PKG)而改变细胞的功能(图11-3)。
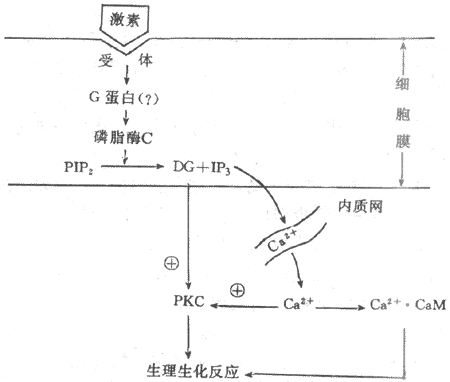
图11-3 磷脂酰肌醇信息传递系统示意图
PIP2:磷脂酰二磷肌醇 DG:二酰甘油 IP3:三磷酸肌醇PKC:蛋白激酶C CaM:钙调蛋白
