一、出血
虽然DIC病人典型的病理变化是微血栓形成,但是病人最初的临床现表现为出血,引起出血的机制有以下可能:
(一)凝血物质的消耗
在DIC发生发展过程中,各种凝血因子和血小板大量消耗,特别是纤维蛋白原、凝血酶原、因子Ⅴ、Ⅷ、Ⅹ、Ⅷ的血小板普遍减少。因此曾有人将DIC称为消耗性凝血病(consrmptive coagulopathy)。此时。因凝血物质大量减少,因而凝血过程受阻。
(二)纤溶系统的激活
DIC时在凝血系统激活后,常有继发性纤溶系统的激活。这主要是由于在凝血过程中,通过酶性激活(蛋白酶作用造成酶性水解)由Ⅻa形成Ⅻf,Ⅻf使激肽释放酶原转变成激肽释放酶,后者使纤溶酶原变为纤溶酶。一些富含纤溶酶原激活物的器官(如子宫、前列腺、肺等)因血管内凝血而发生变性坏死时,激活物便大量释放入血而激活纤溶系统。血管内皮细胞受损、缺氧、应激等也皆可激活纤溶系统,导致纤溶酶增多。纤溶酶除能使纤维蛋白(原)降解外,还能水解凝血因子Ⅴ、Ⅷ和凝血酶原等,故这些凝血因子进一步减少,从而引起凝血障碍和出血。
(三)纤维蛋白(原)降解产物的形成
凝血过程的激活以及继发性纤溶过程的启动使血中纤溶酶增多,纤维蛋白(原)被降解。纤维蛋白原在纤溶酶作用下先从其分子的Bβ链上裂解出一个小肽,然后又在Aα链上裂解出碎片A、B、C和H,留下的片段即X(分子量240~260KD),后者再在纤溶酶作用下不断裂解先后产生Y(分子量150KD)、D(分子量100KD)及E(分子量50KD)片段。它们统称为纤维蛋白原降解产物(FgDP)。纤维蛋白在纤溶酶作用下形成X'、Y’、D、E’片段,各种二聚体、多聚体及复合物,统称其为纤维蛋白降解产物(FDP)。两类FDP的功能特性基本相似,其中X,Y碎片可与纤维蛋白单体聚合,从而抑制纤维蛋白多聚体生成;Y、E碎片有抗凝血酶作用;D碎片抑制纤维蛋白单体聚合;大部分FDP均抑制血小板的粘附和聚集,因此FDP可通过强烈的抗凝作用引起出血。
临床上一般常用血浆鱼精蛋白副凝试验(plasma protamineparacoagulation test,3P试验)检查FDP存在,其主要原理为纤维蛋白原在凝血酶作用下形成许多纤维蛋白单体,后者在凝因血因子Ⅻ(纤维蛋白稳定因子)作用下形成纤维蛋白。纤维蛋白在纤溶酶作用下分解为X'、Y'、D、E'碎片,这些碎片(主要是X’碎片)可与纤维蛋白单体形成可溶性纤维蛋白单体复合物(soluble fibrinmonomer complex, SFMC)病人血浆中如有SFMC存在,则在体外加入鱼精蛋白后,此种现象称副凝现象。DIC病人血浆中由于有SFMC的存在,3P试验常呈阳性,所以此试验主要是反映SFMC和纤维蛋白降解产物中X'片段的试验。晚期DIC病人血浆中X'片段减少,D、E'明显增多,因此3P试验反而呈阴性。
临床上DIC病人可有轻重不等的多部位出血倾向(图9-4)。病理形成上既可有血管内凝血,也可有出血的表现。实验室检查有凝血时间和凝血酶原时间延长,纤维蛋白原和血小板减少等发现。出血发生在皮肤时,常可见到出血斑或局部坏死,它与周围皮肤分界清楚,边缘不规则,这种现象反映了皮肤下阻塞的终末微动脉的分布,如果较大的血管发生阻塞,则这些病变可发展形成出血性大疱或融合成片,但治疗及时、恰当,也可吸收。在重症病例,出血特别严重时,可以表现为手指或脚趾的坏疽,有时可出现对称性坏死性病变。
出血也可在静脉穿剌部位。血尿常见。此外也可出现牙龈和鼻出血。出血严重而剧烈时可引起死亡,而且用一般止血药物治疗无效。出血常可成为DIC的最初或主要症状,所以有人强调,如病人患有可能引起DIC的原发疾病,病程中出血症状又难以用其它原因解释时,应考虑到DIC的可能。
二、微血管栓塞引起脏器功能障碍
DIC病人尸检或活检时,常发现微血管(特别是毛细血管与微静脉)内有微血栓存在。它可由血小板组成,但典型的是纤维蛋白性微血栓。它们可以在局部形成,也可来自别处,从而阻塞微血管。在某些情况下,患者虽然有典型的DIC临床表现,但病理检查却未能发现阻塞性微血栓,这可能是由于体内凝血系统发动后纤溶系统同时被激活,使微血栓在生前或死后被溶解所致,也可能是纤维蛋白微血栓尚未完全形成,只有在电镜下才能见到。曾有人在研究猴的内毒素性休克与DIC关系时,获得这方面的证据。
微血管中形成的微血栓,可阻塞相应部位的微循环血流,严重时可造成实质脏器的局灶性坏死(图9-4)。严重或持续过久的坏死性病变可成为受累脏器功能衰竭的原因(图9-4)如果微血栓在肾脏形成,则病变可累及入球小动脉或肾小球毛细血管,严重时可出现双侧肾皮质坏死和急性肾功能衰竭,临床上表现为少尿、蛋白尿、血尿等。在肺部,可引起呼吸困难、肺出血,从而导致呼吸衰竭。消化系统的病变可导致恶心、呕吐、腹泻、消化道出血。肝脏受累时可出现黄疸及肝功能衰竭。内分泌腺的病变常见者为肾上腺皮质出血性坏死造成的急性肾上腺皮质功能衰竭,称华-佛氏综合征(Waterhorst-Friderichsen syndrome)。垂体坏死可导致席汉氏综合征(Sheehan's syndrome)。神经系统的病变可导致神志模糊,嗜睡、昏迷、惊厥等非特异症状,这些症状的出现并非是由一个孤立的局部病灶引起,而可能是由蛛网膜下腔出血以及微血管阻塞、脑皮质和脑干的多处出血所致。
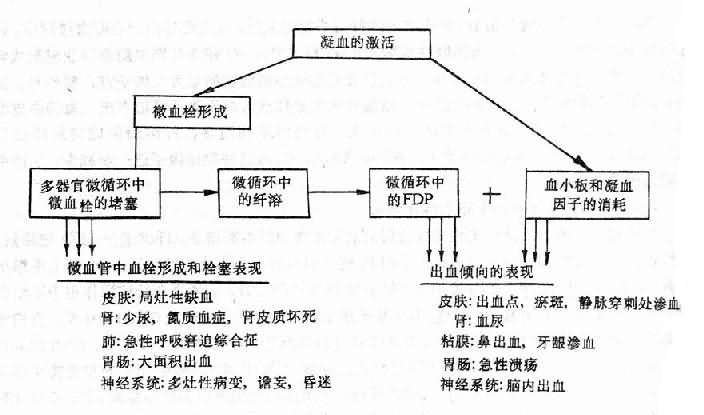
图9-4 DIC的主要临床表现及其机制
DIC时由于凝血及纤溶的轻重程度不一,在不同的病人及病程的不同阶段可有不同的表现,此外,DIC范围大小不一所造成的后果也不同,轻者仅影响个别脏器的部分功能,重者可引起一个或多个脏器的功能衰竭即多器官功能衰竭,甚至造成死亡。
三、循环功能——休克
DIC,特别是急性DIC,常伴有休克。重度及晚期休克又可能促进DIC的形成,二者互为因果,形成恶性循环。
急性DIC常伴发休克,是由于毛细血管和微静脉中有广泛血小板聚集和/或纤维蛋白性微血栓形成,以致回心血量严重不足,再加上心肌损伤,广泛出血所引起的血容量减少等因素,使有效循环血量严重下降,心输出量减少,出现全身微循环障碍。与此同时,中心静脉压也往往降低,若肝和肺内有广泛微血栓阻塞,则又可相应地引起门静脉和肺动脉压升高。前者的临床表现为胃肠道瘀血、水肿,后者为右心排血障碍。此外,在DIC的形成过程中,由于凝血因子Ⅻ被激活,凝血酶增多和继发性纤溶的启动,可使循环血中Ⅻf、凝血酶和纤溶酶增多,它们均能激活补体和激肽系统,使激肽和某些补体成分(如C3a、C5a等)生成增多,激肽能使微动脉和毛细血管前括约肌舒张,从而使外周阻力显著降低;C3a、C5a等则可使肥大细胞和嗜碱性粒细胞脱颗粒,从而通过释放组胺而发挥与激肽类似的作用。这是急性DIC时动脉血压下降的重要原因。FDP的形成,加重了微血管扩张及通透性升高,这是因为FDP的某些部分(如裂解碎片A、B等)能增强组胺和激肽的作用,能使微血管舒张,因而更易产生休克。(图9-5)。
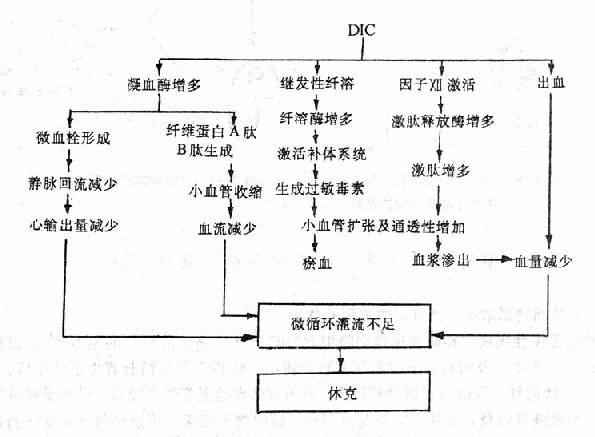
图9-5 DIC产生休克的机理
各种休克发展到一定阶段也往往可以伴发DIC(参阅《休克》)。
四、红细胞机械性损伤引起的微血管病性溶血性贫血
在DIC中有时可伴发一种特殊类型的贫血,即微血管病性溶血性贫血(microangiopathic hemolytic anemia)这种贫血除具备溶性贫血的一般特征外,外周血涂片中发现有某些形态特殊的变形的红细胞如裂体细胞(schistocyte),其外形呈盔甲形、星形、新月形等,统称其为红细胞碎片。这些碎片由于脆性高,故容易发生溶血。
目前认为产生红细胞碎片的原因虽然很多,但DIC是主要因素。其机制是当微血管中有纤维蛋白性微血栓形成时,在早期,纤维蛋白丝在微血管腔内形成细网;当循环中的红细胞流过由纤维蛋白丝构成的网孔时,常会粘着、滞留或挂在纤维蛋白丝上。这样由于血流的不断冲击,引起红细胞破裂(图9-6、图9-7)。在微血流通道发生障碍时,红细胞还可能通过肺组织等的微血管内皮细胞间的裂隙,被“挤压”到血管外组织中去。这种机械损伤同样也可使红细胞扭曲、变形和碎裂。这样就形成了上述各种畸形的红细胞碎片。所以在DIC病人中有时可以有溶血的一系列表现和实验室检查异常,外周血涂片中可出现较多的上述各种红细胞碎片。
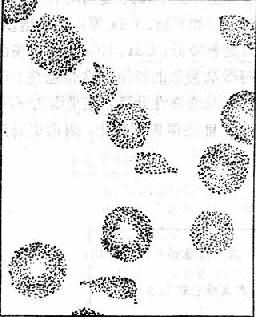
图9-6 微血管病性溶血性贫血血片中能见到裂体细胞
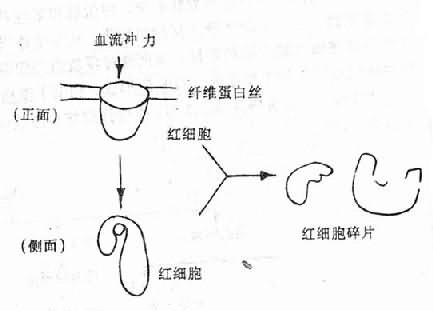
图9-7 红细胞碎片的形成机制
