一、高血压的分类
根据不同的标准可将高血压进行不同的分类。
(一)根据病因分类
最常用,可分为原发性高血压(essential hypertension)和继发性高血压(secondary hypertension)。前者是指病因尚不清楚而以血压高为主要表现的一种独立性疾病,故又称高血压病;因它的发生与多种因素有关,故亦称多原因性高血压,多见于肾脏疾患、神经内分泌障碍、血流机械受阻以及妊娠中毒等时,其发生原因比较简单而清楚,故又称单原因性高因压。
(二)根据收缩压和舒张压升高的情况分类
1.收缩期高血压:即仅出现收缩压升高,而舒张压正常甚至低于正常,多见于老年人大动脉硬化、动脉壁顺应性降低时。
2.舒张期高血压:见于外周血管硬化、阻力较高时。
但大多数情况下舒张压升高往往伴有收缩压的升高。
(三)根据高血压病的发展速度分类
1.缓进型或良性高血压:起病隐匿,病程发展缓慢,开始时多无症状,往往是在体检或因其它病就医时才被发现,此后随着病情的进展,才相继出现有关临床症状和体征。
2.急进型或恶性高血压:少数高血压病起病急骤,发展迅速,血压明显升高,舒张压多在17.3kPa(130mmHg)以上,病情严重,如不及时采取治疗措施,多在一年内死于心、脑、肾等器官功能的严重损害。本病多见于青年人。
此外,根据临床表现及器官受损情况,可将高血压分为三期:一期,即血压达到诊断高血压的水平,尚无器官的损害;二期,已有器官损伤,但其功能还可代偿;三期,即器官的功能受损严重,已失去代偿。
二、高血压的原因和机制
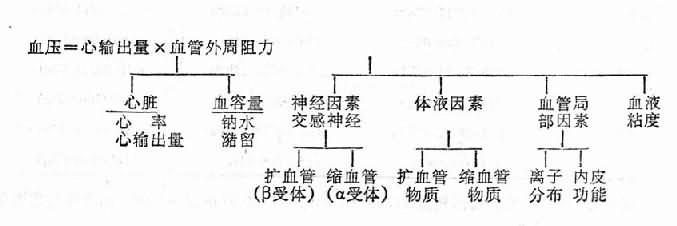
血压是由心输出量和外周血管阻力两个基本因素决定的,心输出量又受心脏舒缩功能、心率、血容量和回心血量等因素的影响,而外周血管阻力主要决定于血管口径和血液粘度,血管口径又受神经、体液和血管本身等各种复杂因素的影响。上述各种因素就其对血压的作用而言,可大致分为两类,一是通过增加外周阻力和/或心输出量,使血压升高;二是通过降低外周阻力和/或心输出量,使血压下降。在正常情况下,两者保持着动态平衡,使血压维持在正常波动范围之内,如上述某种或多种因素导致加压作用大于减压作用时,就会发生高血压。
(一)原发性高血压
原发性高血压发生的原因和机制,尚不完全清楚,目前认为是多种因素参与的。
1.精神、神经因素 临床观察和动物实验各方面的资料证明,本病的发生与精神应激和高级神经活动过度紧张有关:①长期从事与精神紧张有关的职业或处于过度精神应激的环境中的人,本病发病率高;②高血压的发生与忧郁、恐惧、悲伤等不良情绪有关;③给犬造成高级神经活动过度紧张状态,可促进高血压的发生和发展;④在本病早期,单纯消除精神应激,常可使血压恢复正常;使自发性高血压大鼠(spontaneous hypertension rat, SHR)脱离应激环境,也可明显推迟高血压的发生。
精神应激引起高血压的机缺可能是由于大脑皮层在各种精神应激长期作用下,通过兴奋下丘脑神经内分泌中枢而使交感神经系统兴奋,儿茶酚胺释放增多。
已有许多事实证明,原发性高血压时交感系统的活动加强;如①SHR大鼠内脏大神经放电率较正常鼠高;②某些本病患者,尤其是青年患者血浆中儿茶酚胺(主要是去甲肾上腺素)含量较高;③临界高血压时中枢和外周交感神经活动性都较血压正常者高;④应用交感神经或α-肾上腺素受体阻滞药可使血压下降。
交感神经引起血压升高的机制是多方面的:①使小动脉收缩,增大外周阻力;使静脉收缩,增加回心血量;②通过兴奋心脏的β受体使心脏收缩加强、加快,从而提高心输出量;③直接或间接激活肾素-血管紧张素系统(renin-angiotensinsystem, RAS),进而收缩血管和通过血管紧张素Ⅱ(angiotensinⅡ,A-Ⅱ)促进醛固酮分泌,增加血容量(图12-5)。
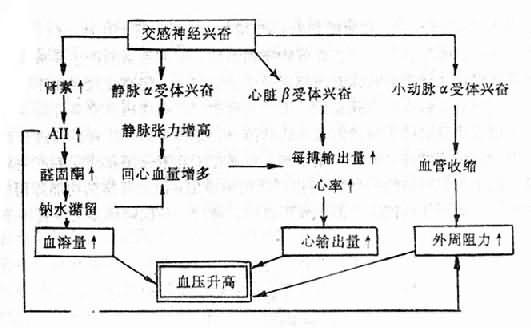
图12-5 交感神经引起血压升高的机制
但须指出,并非原发性高血压患者血中儿茶酚胺的含量都升高;而且,即使升高,其程度(一般升高20~25%)也远不足以导致高血压。说明交感-儿茶酚胺系统的活动增强在原发性高血压的发生中并非起决定性作用。现证明交感神经节后纤维有两类,一类是以神经肽Y(neuropeptide Y, NAY)和去甲肾上腺素为递质的缩血管纤维,另一类是以降钙素基因相关肽(calcitonin gene related peptide, CGRP)和P物质为递质的扩血管纤维。认为这两类纤维的功能失衡即前者功能强于后者才是交感社经参与高血压发生的重要机制。
精神-神经因素虽与高血压发生有关,但并非唯一重要因素,因为远非所有长期处于精神应激环境中的人都发生高血压病;反之,发生高血压病者也不一定有精神应激史。另外,由于本类因素引起的血压升高多为一时性的,目前多数人认为精神-神经因素在原发性高血压发生的始动机制中所起的作用较在维持机制中所起的作用为大。
2.肾素-血管紧张素系统(RAS)原发性高血压时血浆肾素活性升高者占20%,正常者60%,降低者10~20%。过去认为RAS只有在肾素升高组高血压的发生中可能起一定作用,而在其他两组不起作用。但晚近证明并不能排除RAS在其他两组中的作用,因为:①应用RAS抑制药,尤其是血管紧张素转换酶抑制药(angiotensin converting enzyme inhibitor ACEI)治疗高血压病时,不但对高肾素型有效,且对其它型都有效。目前已证明,除肾脏产生肾素影响血浆RAS水平外,心肌、血管平滑肌等组织也存在完整的局部RAS。血浆平滑肌的RAS也具较强的收缩血管加压作用。高血坟时局部RAS活性升高并不影响血浆肾素的水平,但对高血压的发生却起着一定作用;②因高血压病患者血管对加压物质(包括血管紧张素)反应性增高,故即使肾素活性正常甚至低于正常时,对本病患者仍可能起着加压作用。目前认为本系统在高血压病尤其对高血压的维持起着较重要的作用。
③钠、钾、钙与高血压临床与实验材料证明,食盐与高血压的发生有密切关系:例如①食盐摄入量与本病发病率呈正相关,摄取食盐多的地区(如日本本士和我国北京地区)发病率较食盐较少地区(如阿拉斯加的爱斯基摩人和我国广州地区)高;而牙买加某岛上居民食盐摄入量每人<2g/d,就无高血压发生。②给SHR大鼠喂低盐饮食,仅发生轻度高血压;但给予高盐饮食则迅速出现重度高血压。③限制食盐的摄入量或服用利尿药增加排钠量,对某原发性高血压患者有较好的降压作用。
关于食盐引起高血压的机制,尚不完全清楚,可能是多方面的:如①钠潴留导致细胞外液增加,从而可加大心输出量,而且血管壁的钠水溜留可使管腔狭窄,从而使外周阻力增大。②高盐负荷可促使下丘脑产生利钠因子(natriuretic factor, NF),又称下丘脑抑制因子(hypothalamic inhibitor factor, HI)具有所谓利钠激素样的特性,为一种低分子量(500)的非肽类物质。它可抑制细胞膜Na+-K+-ATP酶的活性,故又称Na+-K+-ATP酶抑制因子或钠泵抑制因子。NF也可被看成是一种内源性洋地黄样物质。这样,NF一方面可降低肾小管上皮细胞对钠的重吸收,引起利钠效应;另方面使血管平滑肌细胞等细胞内的钠潴留起来,进而加强Na+-Ca2+交换,致使细胞内Ca2+增加,血管收缩(图12-6)。③增高中枢和外周交感神经的活性;④高食盐可使扩血管物质如激肽、前列腺素的产生释放减少,使缩血管物质如血管紧张素产生增多并加强其与相应受体的亲和力。但高食盐引起高血压是有条件的。高食盐能否引起高血压,关键在于肾脏能否将摄入过多的钠排出。绝大多数人的肾脏通过排钠利尿机制(食盐过多,血Na+浓度增高,肾血容量增加,可通过①肾素分泌和醛固酮产生减少,和②肾内血压增高等机制加强对钠的排泄),可把过多的钠排出;但当肾排钠功能障碍时,由于不能把过多的钠排出,即可导致钠潴留而出现高血压。肾排钠功能障碍多与遗传因素有关。
流行病学调查证明,钾的摄入量与血压呈负相关;给高血压患者补充钾盐可使血压下降,并能提高限钠饮食疗法的降压效果。钾的降压机制可能是:①抑制血浆肾素活性,减少血管紧张素Ⅱ受体数目和降低其与血管素Ⅱ的亲和力;②抑制肾小管对钠的重吸收,促进钠排出;③减弱交感神经的敏感性。此外,高能尚能激活血管平滑肌细胞膜Na+-K+泵,防止钠、钙在细胞内蓄积([Na]i、[Ca]i)。
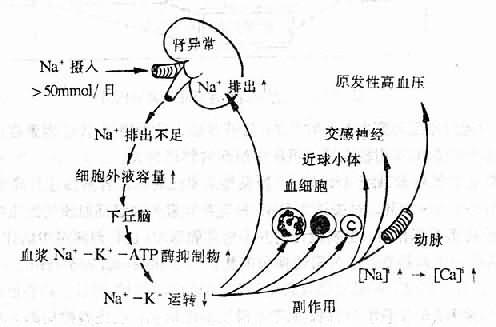
图12-6 高食盐和利钠因子引起高血压机制示意图
据调查,某些原发性高血压患者饮食钙摄入量较正常人低,其血清Ca+和肾素水平也低,对这些患者长期补充钙可使血压降低,并能对抗高盐所致的升压效应。实验也证明,减少饮食中的钙,可使自发高血压大鼠(SHR)血压明显升高;相反,如增加钙摄入量,可延缓SHR幼鼠血压的升高,并使SHR成年鼠血压降低。钙的降压机制可能是:①稳定细胞膜结构,控制膜离子通透性,使Ca+不致大量进入细胞内;②钙与钙调蛋白结合,激活细胞膜钙泵,增加钙的外流,使细胞内钙浓度降低。防止血管平滑肌细胞内Ca2+的积聚就可防止血管的收缩,从而防止血压的升高。
4.遗传因素已有充分证据说明高血压病与遗传基因有关:①有家族性:双亲都有高血压病史的子女发病率为50%,即两个子女一个发病;双亲之一有高血压史的子女,发病率为25%;双亲没有高血压病史的子女,发病率为5%。②自幼收领的养子和亲生子虽然生活环境完全相同,但后者的高血压病发病率与双亲的发病率更为接近。③对食盐敏感和不敏感的两种大鼠,虽然在同样高食的饲养条件下,前者发生高血压而后者则否。
遗传基因主要决定高血压病发生的易感性,而非高血压的本身。由于血压受多种因素控制,故遗传的“易感性”也是多基因决定的。其表现是多方面的。例如肾脏排钠的先天性缺陷,细胞膜的先天性功能异常和血管平滑肌对加压物质的敏感性高等,今分述如下:
(1)肾先天性排钠缺陷:在同样大量摄取食盐的条件下,对盐敏感鼠发生高血压,而对盐不敏感鼠则不发生高血压。如把对盐敏感鼠的两个肾脏移植给对盐不敏感鼠,又把对盐不敏感鼠的两个肾移植给对盐敏感鼠,则对盐不敏感鼠发生高血压而对盐敏感鼠不发生高血压。这说明对敏感鼠所以发生高血压,是由于肾排钠障碍,而肾排钠障碍是由遗传因素决定的。人类高血压病易感者也可能存在类似的遗传性肾排钠缺陷。
(2)细胞膜先天性功能异常:主要表现在膜的钠、钙离子运转异常。细胞对钠的运转有四个系统,即①Ca+-K+泵:为主动的运转系统;②被动性运转,决定于细胞内外K+、Na+离子梯度;③Na+-K+同向运转(co-transport)和④Na+-Li+逆向运转(counter-transpot)(图12-7)。
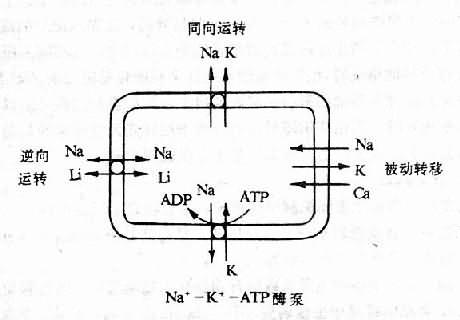
图12-7 细胞内钠运转的四个系统
上述的③和④两个运转系统,虽不需ATP水解供能,但需在特异的载体参与下使相应的离子进行跨膜的易化扩散。这两个系统都是协同运转系统,即一种离子与载体结合后又可提高载体与另一种高子的亲和力,进而使两种离子偶联协同扩散。除了Na+-K+泵的主动运转外,Na+-K+同向运转也是细胞用以防止细胞内Na+过度负荷的重要机制。Na+-Li+逆向运转与肾脏近曲小管对钠、水的重吸收呈正相关,即当Na+-Li+逆向运转加强时,近曲小管对钠、水的重吸收也加强。据报道,高血压病患者和SHR大鼠上述四种钠运转系统都有可能发生改变,主要是Na+-K+泵运转被抑制;同时,因膜通透性增高,故Na+被动转入细胞增加;此外还有Na+-Li+逆向运转加强和Na+-K+同向运转减弱。其结果是细胞内钠蓄积。研究结果也证明SHR大鼠和部分原发笥高血压患者细胞内的钠含量高于正常。细胞内钠的蓄积。可以导致:①血管壁钠水负荷增加,管壁增厚,血管腔狭窄,从而引起外周阻力增高;②Na+-Ca2+交换加强,使血管平滑肌细胞内Ca2+增加(可能还有其它机制),从而促使血管收缩。尤其是在管壁增厚的情况下,轻度的血管收缩就可产生较大的阻力。此外,由于机体的钠水潴留,又可促使利钠因子的分泌和释放,通过抑制Na+-K+泵,进一步加重钠在细胞内蓄积。
在双亲有高压病史而血压正常的子女中,约有一半有细胞膜对钠运转的异常。
原发性高血压患者细胞内Ca2+增多,除继发于细胞内钠升高外,还与膜对钙的运转系统异常有关,主要表现在:①SHR大鼠和原发性高血压者红细胞和血管平滑肌细胞膜对Ca2+的通透性增加,故Ca2+内流加强:②质膜对Ca2+的结合力决定于细胞膜表面多种Ca2+结合蛋白的量及其与Ca+的亲和力。SHR大鼠和原发性高血压患者可能由于结合蛋白量减少和/或亲和力降低,从而导致膜结合钙减少而胞浆中的游离钙增加;③ATP依赖性钙泵运转障碍:现证明SHR大鼠的血管平滑肌肌膜、心肌肌浆网以及红细胞等都有ATP依赖性钙泵的运转障碍,从而不能把胞浆中的Ca2+分别转运到细胞外和肌浆网中,结果使Ca2+在胞浆中增加。血管平滑肌细胞内游离钙的增多,被认为是原发性高血压发生机制的最后共同途径。现认为膜对钠、钙离子运转的障碍是遗传因素决定的膜功能异常的表现,而高血压病可能是一种细胞膜病。
此外,实验还证明SHR大鼠出生后血压升高之前,其血管壁的收缩成分较正常鼠多,对加压物质的收缩反应也远较正常鼠强。双亲有高血压病史的血压正常子女也存在有类似的现象。同时这类子女血中的利钠因子(NF)也明显升高,这提示血管的高反应性和NF的升高都与遗传有关。总之,高血压病遗传的易感性是多因素的,它在高血压病发生中的作用是和环境因素的作用相辅相成的,也即环境因素往往是在遗传易感性的基础上发挥致病作用的,而遗传易感性又是通过对环境因素的反应表现出来。例如食盐过多之所以能引起钠水潴留和血压升高,常是在肾脏先天性排钠障碍和膜对离子运转先天性异常的基础上发生的,而患者对高血压病的遗传易感性又是通过食盐过量才得以表现出来。
(二)继发性高血压
继发性高血压发生的原因和机制比较清楚,主要决定于原发疾病。
1.肾性高血压 肾疾患时出现的高血压谓之肾性高血压(renal hypertension),为继发性高血压中最常见者,发病的主要机制为:
(1)RAS激活:见于各种原因所致的肾动脉狭窄或阻塞时,例如肾动脉粥样硬化(多见于男性老年人)、肾动脉纤维增生性病变(fibroplsatic disease,多见于中青年)和肾动脉先天性发育不良(见于儿童)等。由于肾脏缺血促进肾素分泌,激活了RAS并进而引起高血压。其主要依据是:①手术缩窄犬一侧肾动脉后,与血压升高的同时,手术侧肾静脉血中肾素明显高于对侧,且近球小体中含肾素颗粒也明显增加;解除狭窄后,随着肾素含量的下降血压下降血压也降低;②用血管肾张素转换酶抑制剂可使血压下降;③大部分本类高血压患者血浆中的肾素活性增高。RAS在活性增高的升压机制主要是使血管收缩,使外周阻力增加。
(2)肾排水、排钠能力减弱或丧失:多见于急性或慢性肾实质广泛性病变时(如急性或慢性肾炎、肾盂肾炎、多囊肾等),由于大量肾单位丧失了排水、排钠能力,而剩余肾单位又不能充分代偿,结果导致钠水潴留、血容量增加和心输出量增大,产生高血压。此时血管外周阻力可正常甚至低于正常。采取利尿措施以减少血容量可有效地降低血压。
(3)肾减压物质生成减少:肾不但分泌加压物质,肾髓质间质细胞还分泌多种减压物质,如前列腺素E2(PGE2)和具有抗高血压作用脂质等物质。这些物质都具有排、扩血管和降低交感神经活性的作用,和RAS既互相对抗又维持着平衡。
现证明这些特质的消长与高血压的发生有密切关系,例如:①肾髓质乳头移植,可防止肾实质性高血压的发展,但移植肾皮质则无此作用:②在钠负荷的情况下,切除肾髓质可很快发生高血压,但不切除髓质则不易发生。所以当肾髓质受到破坏或其间质细胞产生减压物质减少(或被抑制)时,由于RAS与减压物质失去平衡,即可引起血压升高。
上述三种机制,在肾性高血压发病中的作用因肾疾患的种类、部位和程度不同而异。例如:肾血管疾患时以第一种机制为主。肾实质性病变尤其是伴有肾功能不全者以第二种机制为主;肾髓质破坏时则有第三种机制参与;但在慢性肾疾患时,由于病变性质和部位的复杂,三种机制常同时参与作用。
2.内分泌性高血压由内分泌紊乱引起的高血压谓之内分泌性高血压(endocrinic hypertension),主要见于:
(1)嗜铬细胞瘤:嗜铬细胞瘤(pheochromocytoma)多发生于肾上腺髓质。由于嗜铬瘤细胞大量分泌和释放去甲肾腺素和肾上腺素,使小血管收缩和心输出量增加,故可导致血压升高。这种血压升高多为阵发性的,即当缺氧、麻醉、肌肉活动、性活动或肾上腺部位受剌激时,就可激发瘤细胞释放这些物质而血压突然升高,并多伴有心悸、出汗、烦躁、头痛、胸前区痛和血糖升高等临床表现;当血中此类物质含量降低时,血压也随之下降。但也有少数患者血压呈持续性升高。应用α-肾上腺体拮抗剂可使血压恢复正常,用β肾上腺素受体拮抗剂可有效地控制心输出量增加和其它临床表现。
(2)原发性醛固酮增多症:原发性醛固酮增多症(primary aldosteronism),多见于肾上腺皮质球状带肿瘤或双侧肾上腺皮质增生时。血压升高主要是由于醛固酮分泌过多导致血容量和心输出量的增加。血容量增加可抑制肾近球小体细胞的肾素分泌,故血浆肾素低于正常,此和继发性醛固酮增多症有些不同(后者肾素活性升高)。另外,由于醛固酮促进肾曲小管的Na+-K+交换使排钾增加,故常导致低钾血症。
(3)皮质醇增多症;皮质醇增多症(hypercortionlism)是由于肾上腺皮质分泌过量的糖皮质激素(主要是皮质醇)所致。该症如由肾上腺皮质肿瘤所引起,称为Cushing综合征;本症约有80%伴有高血压。血压升高的主要机制是:糖皮质激素可①促进的潴留和增加血浆容量;②剌激肾素的合成,激活RAS;③加强血管对加压物质(如去甲肾上腺素)的加压反应。如果伴有盐皮质激素(脱氧皮质酮、醛固酮)增加时,则更使钠水潴留加重。
(4)肾上腺某些酶的先天性缺陷:常见的是11-β羟化酶和17-α羟化酶的缺乏。当前一种酶缺乏时,皮质醇生成减少,反馈性地促进ACTH分泌增加,使脱氧皮质酮(DOC)生成增多,结果是钠水潴留、血压升高;同时因17-羟孕烯醇酮增多,使雄性激素的生成也增多,故女性患者常出理男性化。当后一种酶缺乏时,因17-羟孕烯醇酮的减少,不但反馈性地促进ACTH分泌增加,从而引起高血压,并且雄性激素生成也减少,故男性患者出现女性化(图12-8)。
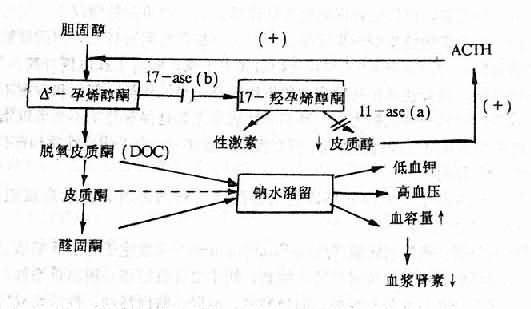
图12-8 11-β羟化酶(11-ase)和17-α 羟化酶(17-ase)缺乏时发生高血压机理示意图,
11-ase(a)示11-β羟化酸缺乏影响部位;
17-ase(b)示17-α羟化酶缺乏影响部位;(+)反馈性兴奋
3.妊娠高血压妊娠期发生和发展起来的高血压谓之妊娠高血压(pregenancy-induced hypertension)。由于正常妊娠期的血压较未妊娠时低,故判断妊娠高血压的血压水平也应较一般的诊断标准低。在妊娠4~6个月时舒张压超过10.7kPa(80mmHg)或妊娠7~9个月时超过11.3kPa(85mmHg)时,或者高于妊娠早期4.00/2.00kPa(30/15mmHg)时,即可视为高血压。包括①先兆子痫高血压(又称妊娠中毒性高血压);②慢性高血压,多来源于原发性或肾性高血压;和③子痫前合并慢性高血压。
先兆子痫高血压(preeclamptic hypertension)是妊娠期特发的高血压,多发生在妊娠的后期,伴有蛋白尿和/或水肿。主要是由于胎盘组织供血绝对减少(因血液循环障碍)和/或相对减少(因胎盘组织增大)从而导致胎盘缺血的结果。此时,①缺血的胎盘可产生较多的肾素和血管紧张素类物质(患者子宫和胎盘中含量较正常妊娠者高);②胎盘组织产生的抗RAS的减压物质减少。正常妊娠的胎盘所产生的减压物质(如前列腺素)能和RAS保持对抗性的动态平衡,从而抵消RAS的加压效应。先兆子痫高血压时,因胎盘减压物质产生减少,故可使两者失去平衡;③可产生和释放组织因子(凝血因子Ⅲ)而引起DIC,当肾小球微血管中出现DIC时,可导致小球滤过率严重减少而发生水潴留。
4.主动脉狭窄引起的高血压高血压可由于主动脉狭窄所引起。例如可见于先天性主动脉狭窄(coarctation of aorta)。此时,心脏收缩代偿性加强,而射出的血液又不能顺利通过狭窄部,致使大量血液蓄积在容量有限的狭窄部近心端的主动脉及其分支中,因而使狭窄部近心端的上肢以上的动脉血压升高,而下肢血压不高;尤其当运动时,由于心输出量的增加,可使其收缩压突然升高,此外,曾有人提出主动脉缩窄时,起源于缩窄部远心端的肾动脉可能因血灌流不足而引起肾缺血,从而促使肾素的分泌增多,但尚无有力的根据。
5.收缩期高血压 凡收缩压≥21.3kPa(≥160mmHg)而舒张压<12.7kPa(<95mmHg)者,则可定为收缩期高血压。单纯收缩期高血压在老年人最常见,尤其超过55岁的妇女。这是由于动脉硬化(主要是粥样硬化)使大动脉顺应性降低所致;主要表现是脉压增宽,左室射血速率和心脏指数降低,总血管外周阻力增高。少数收缩期高血压继发于主动脉瓣关闭不全、严重贫血和甲状腺机能亢进时,主要表现是左室射血速率和心脏指数增高,但总血管外周阻力正常。
总之,①继发性高血压发生的原因和机制比较简单,最先多是由于某个参与调压机制的环节(如肾、肾上腺或垂体)发生障碍的结果;②由于各种调压机制之间常是相互联系着,在高血压的发生中,一个加压机制的激活,常可导致另一个加压机制的激活(如交感神经兴奋→肾素分泌↑→血管紧张素↑)或者通过负反馈作用,一个加压机制的激活又对另一个加压机制起着抑制作用(如盐皮质激素↑→血容量↑→肾素↓);这样,继发性高血压一旦发生后,其发展过程又表现出一定的复杂性;③一般认为,不管引起继发性高血压的始动机制如何,肾对钠水排泄能力的降低,是维持各种继发性高血压的重要机制,故利尿,排钠对不同种类的继发性高血压都有明显的降压效果。
三、高血压时血液动力学的改变及其对机体的影响
(一)高血压时血液动力学改变
高血压时血液动力学的改变比较复杂,不但决定于高血压的发生原因和机制,还决定于高血压的发展速度、程度和发展阶段。
1.心输出量(CO)的改变高血压时心输出量可以升高,也可降低。
(1)心输出量增高:多见于原发性高血压早期和临床性高血压以及嗜铬细胞瘤、原发性醛固酮增多症和肾性高血压等继发性高血压。心输出量增高的机制各有不同。原发性醛固酮增多症和某些肾性高血压(如急性肾炎等引起的高血压)时主要是由于血容量增加;嗜铬细胞瘤时,是因为肾上腺髓质激素对心脏的正性肌力和正性变时作用;原发性高血压时心输出量增高的机制尚不清楚,可能与交感神经兴奋、肾上腺髓质激素分泌增多和/或血管对加压物质的敏感性增高,使外周容量血管收缩,促使回心血量增加有关。
(2)心输量降低:常见于严重高血压和高血压心脏病时。CO降低的原因,或者是因为心脏射血阻抗过大,或者是因为肥大心肌舒缩功能和/或顺应性降低,或者是由于冠脉供血不足使心肌收缩性减弱,可能是上述诸因素综合作用的结果。一旦CO降低,即可加重外周血管的代偿性收缩,外周血管阻力进一步增大,从而促进高血压的发展,并可进一步影响重要器官的血液供应。
2.血管阻力的改变 除因甲状腺机能亢进引起的血压升高外,其他各种高血压时外周血管阻力都呈不同程度的升高。血管阻力升高是外周血管功能和/或结构改变的结果。血管功能性改变主要是血管平滑肌对各种神经、体液加压因素作用的敏感性增高,多发生于血压升高之前,故为引起高血压的原因。待高血压发生后,由于血管的持续痉挛和高血压的长期作用,可发生血管结构改变,主要是小动脉和微动脉(arteriole)壁增厚和纤维化,从而进一步使外周阻力增高,使高血压进一步发展并减少各重要器官的血液供应。此外,较大血管的管壁在长期高压机械力的冲击之下,可发生内膜损伤、平滑肌细胞增生和胆固醇的沉积,从而促进较大血管粥样硬化病变的发生和发展。
外周血管阻力和心输出量的改变在高血压不同发展阶段也是不同的。例如原发性高血压的早期阶段心输出量增加,此时的外周血管阻力基本正常或稍高;随着高血压的发展,外周血管阻力逐渐增高,心输出量则逐渐降低甚至低于正常(图12-9)。
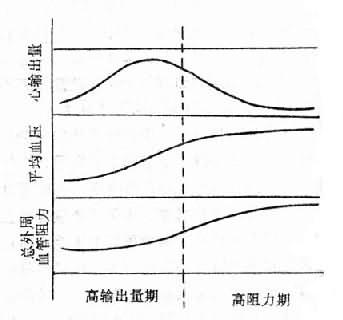
图12-9 原发性高血压时血液动力学的改变
3.细胞外液的改变某些高血压时细胞外液容量可以增多,例如在钠负荷过高、盐皮质激素过多、原发性醛固酮增多症以及肾实质病变所致的高血压,部分原发性高血压尤其是伴有心力衰竭时,细胞外液容量都可增加。血容量增加可通过加大心输出量而使血压升高。故此时利尿即可降压。
(二)高血压对机体的影响
高血压对机体的影响取决于血压升高和血液动力学改变的速度、程度、持续时间以及原发性疾病的情况等各种因素。其影响主要表现在心、脑、肾等重要器官的功能和结构的改变以及眼底血管的变化上。
1.对心脏的影响高血压对心脏的影响表现在两方面。一是适应代偿性改变,如心脏高功能状态和心肌的肥大;二是代偿失调性改变和损害,如冠状动脉粥样硬化、心力衰竭和心律失常等。开始时多为适应代偿性改变,随着高血压的发展逐渐转为代偿失调和损害性变化。
(1)心脏的高功能状态:为高血压时心脏最早发生的一种适应代偿性变化。主要表现是前负荷增加、心肌收缩力加强和心脏输出量增大,前负荷增加或者是由于血浆容量的增加,或者是因交感-儿茶酚胺系统的兴奋,使外周容量血管收缩,迫使回心血量增多。心脏收缩力加强主要是因为交感神经兴奋和肾上腺髓质激素的作用。心脏前负荷增中和肾上腺髓质激素的作用。心脏前负荷增神以兴奋和肾上腺髓质激素的作用。心脏前负荷增加和收缩力加强可使心输出量增大,从而使心脏能在较高的射血阻力下,保证各重要器官的血液供应。
(2)心肌肥大:是心脏长期对压力负荷过度发生的一种慢性适应代偿性改变。主要表现是向心性肥大,此时虽然单位重量心肌的收缩性在压力负荷过的情况下有所降低,但由于心脏肥大。总的心功能是提高了(参见本章心力衰竭节)。
早期的代偿性心肌肥大和心功能适应性改变一般是可逆的,即当血压恢复正常时,这些改变可恢复正常。
(3)心力衰竭:是高血压时常见的严重合并症。发生心力衰竭的主要原因是:①压力负荷过度、心肌耗氧量增多和冠脉供血减少(因小动脉硬化和冠状动脉粥样硬化使管腔狭窄和阻塞)导致心肌缺血缺氧和能量利用障碍;②心肌向心性肥大引起心脏舒张充盈障碍(参见本章心力衰竭节)。高血压所致的心力衰竭,多为慢性充血性心力衰竭,发生率随年龄的增长和血压升高程度而升高。约有50%伴发心力衰竭的患者在5年内死亡。
2.对大脑的影响大脑是最易受高血压影响的靶器官。对大脑的影响是通过高血压对脑血管损害(包括功能和结构)和压力本身的作用引起的。
(1)脑血管自身调节障碍(高血压脑病,hypertensive encephalopathy):是因脑血管在血压持续性升高时,发生自身调节失控而导致的一种可逆性脑血管综合征。主要临床表现是剧烈头痛、呕吐、抽搐、意识模糊、视力障碍等。
正常情况下,当血压升高时,脑血管即自动收缩;反之,血压下降时,脑血管又自动舒张。大脑通过脑血管的这种自身调节机制才能使脑血流量不受血压波动的影响,经常保持相对稳定状态。正常人脑血管的自身调节范围是8.00~16.00kPa(60~120mmHg)。高血压患者,由于对高血压产生了慢性适应,其调节范围可变为14.7~24.0kPa(110~180mmHg)。血压波动在上述范围内,通过脑血管的自身调节,可使脑血流量维持稳定;但若血压突然升高且超过此调节上限时,脑血管的自身调节机制就会失效,因而不再继续收缩发生被动扩张,结果脑血流量突然增加,毛细血管的压力急剧升高,体液外渗,引起水肿,甚至发生斑点出血等病理变化,从而引起高血压脑病。
(2)脑小血管阻塞:脑微动脉(内径50~200μm)在长期痉挛和高血压的机械性冲击的影响下,可发生纤维性坏死、管腔阻塞,其支配的脑组织乃因血供被阻断而发生梗塞,出现直径为0.5~15mm大小的小灶性空腔病变,即腔隙性脑梗塞(lacunar infarction)。好发于脑深部神经核如壳核、尾状核以及内囊后段等处。临床的表现取决于病变数目和部位,有的出现相应的临床症状,有的则无。因病灶较小,血管造影也往往难以发现。
(3)小动脉破裂:所引起的高血压性脑出血(hypertensivve hemorrhage),为高血压常见的致命脑并发症。脑小动脉和微动脉在高压长期作用下,发生机械性扩张,造成动脉瘤或动脉壁纤维性坏死,在此基础上,当血压突然升高时(如体力活动、精神激动或用力排便等),即可引起这小血管的破裂而出血。内囊附近出现的好发部位。发病前多无预兆,发病后常伴有剧烈头痛、呕吐和意识丧失等。
此外,有部分人,由于Willis环中等大小的动脉壁先天性内膜缺乏,在高血压的作用下,也易形成动脉瘤和破裂出血。
(4)动脉粥样硬化与脑血栓形成:主要发生于较大的脑血管,虽非高血压所引起,但高血压可促进本病变的发生和发展。由于动脉粥样硬化,致使管腔狭窄,可引起脑缺血。如在这些病变的基础上形成脑血栓堵塞血管,则出现支配区脑组织坏死,患者突然出现失语、偏瘫、半身感觉缺失、同侧偏盲等。
高血压合并症以脑合并症为最多,约占高血压总合并症的50~70%。
3.对肾的影响高血压与肾的相互关系,一是高血压引起肾脏病变,而肾病变又加重高血压;二是肾病变引起高血压,高血压又促进肾病变。
(1)高血压引起肾病变:见于非肾性高血压,尤其原发性高血压。持续性高血压可引起肾小动脉和微动脉的硬化、纤维组织增生,促进肾大血管的粥样硬化与血栓形成,从而使肾缺血、肾单位萎缩和纤维化。轻者可致肾功能降低,出现多尿,夜尿和等渗尿等;重者可导致肾功能衰竭。
肾病变发生后,可反过来加重高血压。这是由于:①肾缺血激活RAS;②当大量肾单位被破坏时,使肾小球滤过率降低,导致钠水潴留。
(2)肾病变引起高血压:见于肾性高血压。高血压发生后,又可通过肾小血管的功能和结构改变,加重肾缺血,促进肾病变和肾功衰竭。
因高血压而发生肾功衰竭者约占高血压合并症的5%。
4.对视网膜血管的影响高血压时视网膜血管出现不同程度的改变和损害如血管痉挛、硬化、渗出和出血等,有时还发生视神经乳头水肿。
视网膜血管痉挛是对血压升高的自身调节反应;渗出是小血管壁通透性增高和血管内压增高所致;出血则是小血管在高血压作用下管壁破坏的结果。关于高血压时发生视神经乳头水肿的原因尚不完全清楚,可能是因为高血压时脑血管自身调节失效引起脑水肿,水肿液沿视神经流出并蓄积于视神经乳头所致。
上述渗出、出血和视神经乳头水肿多在舒张压明显升高[>16.7kPa(>125mmHg)]或收缩压急剧增高的情况下出现,一旦出现这些改变则预示病情严重,故检查眼底血管的变化是评定高血压严重程度的重要参考指标。
四、高血压的防治原则
(一)、预防
原发性高血压是常见多发病,特别应当重视人群一级综合预防。要消除和控制与本病发生有关的危险因素,如调整人群的饮食、生活习惯、改善生活和工作劳动环境等等。对临界性高血压或有家族史的子女则应采取个体二级预防措施,如严密随访观察、控制饮食质量,避免精神应激、加强体育锻炼,必要时给予适当的调压药等等。对继发性高血压的预防,关键在于防治原发病。
(二)、治疗
已如前述,尽管引起高血压的原因很多,但其发病的基本环节是外周血管阻力升高和/或心输出量与血容量的增加。因此,治疗高血压的基本原则是降低外血管阻力和/或心输出量与血容量。
1.降低外周血管阻力降低外周血管为治疗高血压的基本措施。最常用的是交感神经阻断药、血管扩张以及抗RAS的药物等。它们可以通过不同环节降低外周血管阻力,以达到降压目的。
2.减少血浆容量 用利尿药减少血浆容量,对容量依赖性高血压有较好的降压效果。
3.联合措施 为了提高降压效果和减少药物副作用,不但应把药物和非药物性(如控制食盐摄入量、加强体育锻炼、心理精神疗法等)降压措施结合起来,而且必要时还应把各种降压物如利尿和不同的降低血管阻力的药物联合应用。
最后尚需指出:在高血压持续时间较久以后,尤其是在老年患者,机体的各种重要器官对高血压状态已经发生了适应,即器官的基本灌流量都是较高的血压水平的基础上维持的。在这种情况下,如果采用的措施使血压降得过急过剧,那么即便血压水平还高于正常人,但对高血压患者来说,已难以维持各重要器官的基本灌流量,以致可以发生缺血缺氧,甚至引起器官功能衰竭,故应特别加以注意。
