第一篇 免疫系统的组织结构
第一章 绪论--免疫学发展简史
免疫学是一门新兴的学科。它是研究机体免疫系统的组织结构和生理功能的科学。免疫系统的重要生理功能就是对“自己”和“非己”抗原的识别及应答。免疫系统在免疫功能正常的条件下,对“非己”抗原产生排异效应,发挥免疫保护作用,如抗感染免疫和抗肿瘤免疫。但在免疫功能失调的情况下,免疫应答可造成机体组织损伤,产生过敏性疾病。如打破对自身抗原的耐受,则可对自身抗原产生免疫应答,出现自身免疫现象,或造成组织损伤,就发生了自身免疫病。因此免疫系统以它识别和区分“自己”和“非己”抗原分子的能力,起着排导和维持自身耐受的作用。运用免疫学理论和方法对相关疾病进行预防、诊断和治疗的研究也是当代免疫学研究中的重要领域。免疫系统是机体的一个重要的功能系统,担负着免疫防御、免疫监视与免疫自稳的功能。人类应用免疫学方法预防传染病的历史,可以追溯到16世纪中国医学家用人痘苗预防天花的伟大实践。此后,免疫学经历了经典免疫学时期、近代免疫学时期,从本世纪60年代起进入了现代免疫学的发展阶段。
第一节 免疫学的经验时期
对人体免疫功能的认识首先从抗感染免疫开始。我国医学家通过对天花病长期临床实践过程中,对天花病的预防积累了丰富的经验,并创造性地发明了用人痘苗预防天花病的方法。这在天花病毒发现之前,在医学科学尚未发展之时,实是一项伟大贡献,也是认识机体免疫性的开端。
人痘法始于何时说法不一,但据我国医书考证,认为人痘法的文字记载见于宋真宗时代,即公元11世纪。但大量医书证明我国直到明代隆庆年间即公元16世纪人痘法才有重大改进。在《种痘心法》中记载有时苗和种苗之分,并认为后者更为安全可靠。在清代,即公元17世纪已在我国推广应用。
在17世纪,不但我国实行人痘苗预防天花而且也引起邻国的注意,并很快地传入了俄国、朝鲜、日本、土耳其和英国等国家。无疑,人痘法为以后英国医生Jenner发明牛痘苗和法国免疫学家Pasteur发明减毒疫苗都提供了宝贵经验。
第二节 经典免疫学时期
这一时期起始于18世纪末至20世纪中。其特点是人们对免疫功能的认识从人体现象的观察进入了科学实验时期。它的发展是与微生物学的发展密切相关的,并成为微生物学的一个分支。这一时期内的重要成就如下述。
1.牛痘苗的发明继人痘苗之后,免疫学的一个重要发展首推牛痘苗的发明。它不但弥补了人痘苗的不足,并且可在实验室大量生产,于1804年传入我国后很快代替了人痘苗。
牛痘苗的发明应归功于英国医生Jenner,他观察到挤奶女工在患过牛痘后不易得天花病的事实后,通过对牛痘苗人体的长期实验,确证接种牛痘苗后可以预防天花,并对人体无害。在1793年发表了他的牛痘苗著作,为人类传染病的预防开创了人工免疫的先声。
2.减毒疫苗的发明免疫学的发展自Jenner发明牛痘苗之后,停滞了将近一个世纪。进入19世纪后微生物学在法国免疫学家Pasteur和德国细菌学家Koch 等人的努力下得到了迅速发展。在方法学上创造性地解决了细菌的分离培养,从而能获得纯种细菌,为人工菌苗的制备创造了条件。Pasteur更有意识的研究获得减毒菌株的方法,通过系统的科学实验,终于发现了应用物理、化学以及生物学方法可获得减毒菌株。
在1881年 Pasteur应用高温培养法获得了减毒株,从而制备了炭疸菌苗。其后他又将狂犬病毒在兔体内经连续传代获得了减毒株,从而制备了炭疸菌苗。巴氏减毒菌苗的发明为实验免疫学建立了基础。
3.抗毒素的发明德国学者Behring和日本学者北里于1890年在Koch研究所应用白喉外毒素给动物免疫,发现在其血清中有一种能中和外毒素的物质,称为抗毒素。将这种免疫血清转移给正常动物也有中和外毒素的作用。这种被动免疫法很快应用于临床治疗。Behring于1891年应用来自动物的免疫血清成功地治疗了一个白喉患者,这是第一个被动免疫治疗的病例。为此他于1902年获得了诺贝尔医学奖。
4.补体的发现19世纪末,继抗毒素之后,又限快发现了免疫溶菌现象。Pfeiffer(1894)用新鲜免疫血清在豚鼠体内观察到对霍乱弧菌的溶菌现象。Bordet发现如将新鲜免疫血清加热60℃30分钟可丧失溶能力。他认为在新鲜免疫血清内存在二种不同物质与溶菌作用有关。一种对热稳定的物质称为溶菌素即抗体,有特异性,另一种对热不稳定的物质,可存在于正常血清中,为非特异性成分,称之为补体。它具有溶菌或溶细胞作用,但这种作用必需有抗体存在才能实现。
5.血清学方法的建立在抗毒素发现以后的10年中,相继在免疫血清中发现有溶菌素、凝集素、沉淀素等特异性组分,并能与其相应细胞或细菌发生反应。其后将多种不同的特异性反应物质统称之为抗体。将能引起抗体产生的物质统称之为抗原,自此建立了抗原、抗体的概念。在此期间建立了各种体外检测抗原、抗体反应的血清学技术如沉淀反应、凝集反应、补体结合反应等方法,为病原菌的鉴定和血清抗体的检查提供了可靠的方法。从而大大有助于传染病的诊断学和流行病学调查,而动物免疫血清的制备又开创了被动血清疗法。
6.免疫化学的研究抗体发现后一方面对临床医学的诊断、治疗和预防起到了巨大的推动作用;另一方面对抗原、抗体的理化性质,抗原和抗体反应特异性的化学基础等问题引起了人们的极大兴趣,逐渐形成了免疫化学的研究领域。
免疫化学研究初期首先从Landsteiner(1910)等人应用偶氮蛋白的人工结合抗原,研究抗原-抗体反应特异性的化学基础开始的。Heidelberger等人用肺炎球菌荚膜多糖抗原进行了抗原和抗体反应的定量研究。Marrack(1934)提出了关于抗原抗体反应格子学说,从理论上解释了血清学反应象。Tiselius和Kabat(1938)建立了血清蛋白电泳技术,从而证明了抗体活性存在于血清丙种球蛋白部分,其后建立了分离纯化抗体球蛋白的方法为抗体理化性质的进一步研究建立了基础。此后研究的重点转向对抗体分子的结构与功能的研究。
在40年代还建立了蛋白质抗原性分析的新方法,如Elek、Oudin及Ouchterlony等人建立的凝胶扩散法。Grubar(1953)等人建立的免疫电泳技术促进了对蛋白质抗原性的免疫化学分析,从而发现了抗体分子的不均一性。使抗体的纯化遇到了困难,因而对抗体分子结构与功能的研究进展缓慢,直到免疫生物学的进一步发展,对抗体分子不均一性有了本质的了解,改进了研究材料,才使抗体分子结构与功能研究取得了重大进展。
7.抗体生成理论的提出Ehrlich在Behring工作的基础上创造性地提出了关于抗体产生的学说。在1897年他首先提出了抗体生成的侧链学说,也是受体学说的首创者。他认为抗毒素分子存在于细胞表面上,当外毒素进入体内后与之特异结合,并刺激细胞产生更多的抗毒素分子,自细胞表面脱落入血流即是抗毒素。他的学说在当时未能得到大多数免疫学家的支持,并遭到一些学者的责难,致使他的学说长期淹没无闻。
在30年代Haurowitz等人认为抗体分子的结构是在抗原直接影响下形成的,并提出了抗体生成的模板学说(template theory)。在分子遗传学的影响下Pauling等人又进一步对模板学说进行了修正,认为抗原是通过干扰胞核DNA而间接影响下形成的,并提出了抗体生成的模板学说(tenplate theory)。在分子遗传学的影响Pauling等人又进一步对模板学说进行了修正,认为抗原是通过干扰胞核DNA而间接影响抗体分子的构型,提出了间接模板学说。总之这一学说不承认产生抗体的细胞在其膜上具有识别抗原的受体,而是以抗原为主导,决定了抗体的特异结构。这一学说主宰了以后近30年的免疫学进展。它比较片面地强调了抗原对机体免疫反应的作用,而忽视了机体免疫反应的生物学过程。回避了机体免疫反应的基本生物学规律棗“自己”与“非己”的识别作用,从而忽视了对免疫生物学应有的重视与研究。直到细胞系选择学说提出后才使免疫学又有了新的进展。
第三节 近代免疫学时期
由于在免疫学发展的早期形成了牢固的抗感染免疫的概念,以及模板学说的影响,使人们对机体免疫性的认识存在片面性,也使免疫学的进一步发展受到束缚。把机体免疫反应性视为单纯的化学过程,还是生物学过程?机体免疫反应是对外源抗原的特有反应,还是机体对“自己”与“非己”识别的普遍生物学现象?这是从认识免疫现象开始就存在着的分歧。由于近代免疫生物学的进展和细胞系选择学说的提出,才使这些问题获得比较正确的解答。同时对生物机体的免疫反应性也有了比较全面的认识,这一时期自20世纪中至60年代有下述一些主要发现。
1.细胞转移迟发型超敏性的成功Koch在发现结核杆菌之后,企图用结核杆菌给患者皮下再感染以期达到免疫治疗的目的,结果相反,却引起局部组织坏死,称之为Koch现象。这一现象具有特异性但与抗体产生无关。直到Chase 等人(1942)对Koch现象进行了深入研究,证明用致敏豚鼠血清转移给正常动物不能引起结核菌素反应,而用细胞转移则能引起阳性反应。首先证明了结核菌素反应不是由抗体引起,而是由致敏细胞引起,从而证明了机体免疫性除能产生体液免疫外还能形成细胞免疫。
2. 免疫耐受现象的发现Owen(1945)发现自异卵双生的二头小牛个体内有二种血型红细胞共存,称之为血型细胞镶嵌现象。这种不同血型细胞,在彼此体内互不引起免疫反应,把这种现象称之为天然耐受。这是一个重要的发现,同时也提出一个耐人深思的问题。为什么在胚胎期接受异种抗原刺激,不引起免疫反应而形成免疫耐受现象?Burnet从生物学角度提出了一种假说说明这个现象。他认为宿主淋巴细胞有识别“自己”与“非己”的能力。如在机体免疫功能成熟之前引入异物,可作为“自己”成分加以识别,故在成体后对该异物即不引起免疫反应。其后Billingham和Medawar等人(1953)在小鼠体内成功地进行了人工诱导耐受实验,给予Burnet学说以有力支持。自此经典免疫学的观点受到严重挑战,人们开始注意研究免疫生物学问题了。使免疫学的发展进入了一个新的时期,即免疫生物学时期。
3.抗体生成克隆(或细胞系)选择学说的提出澳大利亚免疫学家Burnet以生物学及分子遗传学的发展为基础,在Ehrlich侧链学说和Jerne等天然抗体选择学说的影响下,以及人工耐受诱导成功的启发下,于1958年提出了关于抗体生成的克隆选择学说。这一学说的基本观点是把机体的免疫现象建立在生物学的基础上,他的基本观点如下:①认为机体内存在有识别多种抗原的细胞系,在其细胞表面有识别抗原的受体;②抗原进入体内后,选择相应受体的免疫细胞使之活化、增殖最后成为抗体产生细胞及免疫记忆细胞;③胎生期免疫细胞与自己抗原相接触则可被破坏,排除或处于抑制状态,因之成体动物失去对“自己”抗原的反应性,形成天然自身耐受状态,此种被排除或受抑制的细胞系称为禁忌细胞系;④免疫细胞系可突变产生与自己抗原发生反应的细胞系因之可形成自身免疫反应。
此学说不仅阐明了抗体产生机制,同时对许多重要免疫生物学现象都做了解答。如对抗原的识别、免疫记忆的形成、自身耐受的建立以及自身免疫的发生等现象。此学说已被免疫学者所接受,促进了现代免疫学的发展。
4.免疫学技术的发展在此期间改进了血清学技术,建立了间接血凝反应,以及免疫标记技术等,大大促进了免疫学基础理论研究和临床应用。
第四节 现代免疫学时期
自天然耐受现象的发现,克隆选择学说的提出为免疫生物学的发展奠定了理论基础,使现代免疫学的发展方向发生了重大变化。使免疫学从抗感染免疫的概念中解脱出来,进而发展为生物机体对“自己”和“非己”的识别,藉以维持机体稳定性的生物学概念。这一发展时期自60年代迄今发现了胸腺的免疫功能,确认了淋巴细胞系是重要的免疫细胞,阐明了免疫球蛋白的分子结构与功能。从器官、细胞和分子水平揭示了机体另一重要生理系统,即免疫系统的存在。30余年来,对免疫系统结合与功能的研究不断取得突破性进展,对生物学和医学的发展都产生了深远的影响。在此阶段有下述一些重要进展。
一、60年代的重要发现
Glick(1957)发现早期摘除鸡的腔上囊组织可影响抗体的产生。首先证明了腔上囊组织的免疫功能。60年代初Miller和Good分别在哺乳类动物体内进行早期胸腺摘除,证明了胸腺的免疫功能。Gowan(1965)首先证明了淋巴细胞的免疫功能。Claman、Mitchell等人(1969)提出了T和B细胞亚群的概念。Cooper等人证明了免疫淋巴细胞在周围淋巴组织的分布。自此建立了在高等动物体内免疫系统的组织学和细胞学基础。在人体内,从先天无胸腺症患者和先天性无丙种球蛋白血症患者也证明了胸腺的免疫功能和存在二类淋巴细胞亚群。
在此期间对抗体分子的结构研究取得了突破性进展。自40年代确定了抗体的血清球蛋白性质后,便集中精力研究抗体的分子结构与生物功能。50年代Porter用木瓜蛋白酶水解抗体球蛋白分子,获得了具有抗体活性的片段和易结晶片段。其后Edelman用化学还原法证明抗体球蛋白是由多肽链组成,用抗原分析法证明了抗体分子的不均一性。60年代初统一了抗体球蛋白的名称,并建立了免疫球蛋白的分类,即IgG、IgM和IgA三类。Rowe(1965)自骨髓瘤患者的血清内发现了IgD,石板(1966)自枯草热患者的血清中发现了IgE。自此关于Ig分子的结构和生物活性的研究便成为免疫化学的中心课题。
二、70年代的重要发现
1.免疫应答细胞进入70年代Pernis等用免疫荧光法证明了淋巴细胞膜Ig受体存在并认为是B细胞的特征。Feldman等用半抗原载体效应证明了T和B细胞在抗体产生中的协同作用。Unanue等证明了巨噬细胞在免疫应答中的作用,它是参与机体免疫应答的第三类细胞。从而证明了机体免疫应答的发生是由多细胞相互作用的结果,并初步揭示了B细胞的识别、活化、分化和效应机制,使免疫学的研究进入细胞生物学和分子生物学的领域。
2. T细胞亚类的发现70年代还进一步证明在动物和人周围血循环内存在有功能相异的T细胞亚类。Mitchison等证明了辅助性T细胞的存在。Gershon等证明了抑制性T细胞的存在,它们对免疫应答的调节起着重要作用。Cantor等用小鼠细胞膜Ly异型抗原,可将细胞分成不同亚类,并证明它们具有不同生物学功能。这一发现提示用膜抗原分析法可用以鉴定不同T细胞亚类。
总之,以T细胞为中心的免疫生物学研究,是70年代免疫学研究最活跃的领域之一。对于T细胞的发生、分化与功能研究,对T细胞亚类的鉴别以及对T细胞抗原识别受体的研究都取得了较大的进展。
3.免疫网络学说的提出这一学说是Jerne(1972)根据现代免疫学对抗体分子独特型的认识而提出的。这一学说认为在抗原刺激发生之前,机体处于一种相对的免疫稳定状态,当抗原进入机体后打破了这种平衡,导致了特异抗体分子的产生,当达到一定量时将引起抗Ig分子独特型的免疫应答,即抗独特型抗体的产生。因此抗抗体分子在识别抗原的同时,也能被其抗独特型抗体分子所识别。这一点无论对血流中的抗体分子或是存在于淋巴细胞表面作为抗原受体的Ig分子都是一样的。在同一动物体内一组抗体分子上独特型决定簇可被另一组抗独特型抗体分子所识别。而一组淋巴细胞表面抗原受体分子亦可被另一组淋巴细胞表面抗独特型抗体分子所识别。这样在体内就形成了淋巴细胞与抗体分子所组成的网络结构。网络学说认为,这种抗独特型抗体的产生在免疫应答调节中起着重要作用。使受抗原刺激增殖的克隆受到抑制,而不至于无休止地进行增殖,藉以维持免疫应答的稳定平衡。
三、80年代的重要发现
1.抗体多样性遗传控制进入80年代在分子免疫学的研究方面取得了重大进展。首先是在抗体多样性遗传控制的研究取得了突破性进展。
关于Ig合成的遗传学问题早在60年代Dreyer和Bennet等曾提出一假设,他们认为编码Ig肽链的基因是由二种基因组成。并且在胚胎期是彼此分隔的,在B细胞分化发育过程中才彼此拼接在一起。他们是第一个推测真核细胞的基因可能是彼此分离的,必需在细胞分化过程中发生重排和拼接在一起才能表达。
日本学者利根川进和Leder等应用分子杂交技术证明并克隆出编码Ig分子V区和C区基因。同时应用克隆cDNA片段为探针证明了B细胞在分化发育过程中编码Ig基因结构阐明了Ig抗原结合部位多样性的起源,以及遗传和体细胞空变在抗体多样性形成中的作用,为此利根川进获得了1987年诺贝尔医学奖。
2.T细胞抗原受体的证明在80年代由于生物技术的发展,已能在体外建立抗原特异性T细胞克隆以及细胞和分子杂交技术的应用,为在分子水平和基因水平研究T细胞受体的性质创造了良好的条件。
首先是应用抗T细胞克隆型单克隆抗体结合免疫化学技术,Meur等人几乎同时(1983)证实了小鼠和人T细胞表面抗原受体的存在,并分离出这种受体分子。研究其化学性质,证明T细胞受体分子是由异二聚体肽链组成,由α和β链藉二硫链相连接在一起。通过对不同T细胞克隆受体肽图的比较研究,发现二条肽链均具有与Ig肽链相似的可变区(V)和稳定区(C)结构。Reinherz等应用抗人T细胞克隆抗体研究人T细胞受体也获得了相似的结果。他将这种被克隆型单克隆抗体识别的T细胞表面分子称为Ti分子,并证明它与抗原识别有关。故Ti分子被认为是人T细胞表面的抗原识别受体。据此Reinherz于1984年提出了关于人T细胞抗原受体构型设想,认为T细胞抗原受体是由异二聚体组成的单一受体,能同时识别异种抗原分子和自己MHC分子。
对T细胞抗原受体研究的另一突破性进展是应用分子杂交技术分离出编码T细胞受体的基因。Davis于1984年首先分离出小鼠T细胞受体的基因,并获得了一个cDNA克隆(TM36),从其预测的肽图分析与经免疫化学法分离的T细胞受体肽图(β链)相一致,从而认为它是鼠T细胞受体β链的基因。Yanagi等几乎同时自人T细胞白血病株获得一个cDNA克隆(YT35),经证明是人T细胞受体β链的基因。其后经核苷酸序列分析证明T细胞β受体基因与Ig重链相似,亦由Vβ、Dβ、Jβ、及Cβ基因片段组成,也存在基因重排现象。但Orcia证明人β链基因定位于第17对染色体,鼠则定位于第6对染色体上。而编码Ig的基因则定位于其它染色体上,所以编码Ig的基因与T细胞受体基因是二组完全不同的基因。
Chien和Saito于1984年分别从小鼠T细胞中分离出编码T细胞受体的另一组基因,即α基因,亦具有多样性和重排现象。其编码肽链也含有V区和C区。不难看出,应用抗T细胞克隆型单克隆抗体对T细胞受体在蛋白质分子水平的研究结果与用分子杂交技术在基因水平的研究结果是一致的。
3.细胞因子研究进展在过去的10年中对一系列细胞因子的鉴定及其分子生物学的研究进展。是80年代免疫学最为瞩目的成果之一。细胞因子是一组异质性肽类细胞调节因子。包括淋巴因子、单核因子、白细胞介素、干扰素、肿瘤坏死因子、集落刺激因子和转化生长因子等。它们是由体内各种免疫细胞和非免疫细胞产生。具有多种生理功能,如介导细胞的相互作用,促进和调节细胞的活化、增殖、分化和效应功能。它们也涉及相关疾病的病理生理作用,也具有临床治疗应用的潜在可能性。
仅在数年前,人们还只能从细胞培养液中提取有限数量的细胞因子进行功能和结构研究,而现在可通过基因工程技术在原核或真核细胞中进行表达,可以获得纯化的重组型细胞因子,并可进行批量生产,供实验研究和临床应用。
4.免疫学技术的发展在80年代开创了许多新的生物学技术用于免疫学研究,大大促进了免疫学发展。
⑴细胞融合技术:1975年Kohler和Milstein首先报道应用小鼠骨髓瘤细胞和经绵羊红细胞致敏的小鼠脾细胞融合。结果发现一部分融合的杂交细胞既能继续生长,又能分泌抗羊红细胞抗体,将这种杂交细胞系统称为杂交瘤。这是一项突破性生物技术,应用这种方法可制备单一抗原决定簇的单克隆抗体,为生物科学和医学的研究提供了广阔的应用前景。
⑵T细胞克隆技术的建立:Morgan等(1976)首先证明了T细胞生长因子在体外培养条件下可刺激T细胞克隆长期生长,在过去10年中应用T细胞克隆技术已建立了一系列抗原特T细胞克隆用以研究T细胞受体、淋巴因子的分泌以及细胞间协同作用等方面的研究,为细胞免疫学的发展做出了巨大贡献。
⑶转基因技术的应用:转基因技术也是近年来生物技术中一项重大突破成就。它的建立使动物不必通过有性杂交即能获得新的基因,开创了一条新途径。它的基本原因是将外源基因导入哺乳类动物的受精卵或其早期胚胎,然后分析胚胎或其后代组织中的基因表达。目前主要以小鼠为模型构建和培育不同性状的转基因鼠已在许多研究领域中得到应用。
⑷分子杂交技术的应用:分子杂交的原则是根据双链核酸分子经高温解链,可分开为二条互补的单链。恢复原温度又可使原来的双链结构聚合。二条不同单链分子根据碱基配对的原则,只要它们的碱基序列同源,即碱基完全互补或部分互补,就可发生全部或部分复性,此即核酸杂交。通常二种待杂交的分子之一是已知的,并可预先用放射性同位素或生物素进行标记,称为分子探针。以此探针识别或钓出另一种核酸分子中与其同源部分,即目的基因或靶基因。它有极高的特异性和敏感性,其实验方法可分为吸印杂交法(southern blot),斑点杂交法和原位杂交。这一方法已广泛用于分子生物学和分子遗传学的研究。
分子遗传学的理论和分子杂交技术也大大促进了分子免疫学的发展。目前已开展了对免疫球蛋白分子、T细胞受体分子、补体分子、细胞因子以及MHC分子等的基因结构、功能及其表达机制的研究。对一些细胞因子通过基因工程已获得了纯化和有活性的重组分子,为进一步研究免疫分子的结构与功能以及临床诊断和治疗提供了理想的制剂。
第五节 免疫学在生物学和医学发展中的作用
一、免疫学与医学
免疫学的发展及其向医学各学科的渗透,产生了许多免疫学分支学科和交叉学科,如免疫理学、免疫遗传学、免疫药理学、免疫毒理学、神经免疫学、肿瘤免疫学、移植免疫学、生殖免疫学、临床免疫学等。这些分支学科的研究极大地促进了现代生物学和医学的发展。免疫学的发展必将在恶性肿瘤的防治、器官移植、传染病的防治、免疫性疾病的防治、生殖的控制,以及延缓衰老等方面推动医学的进步。
二、免疫学与生物学
免疫系统对自己与非己的识别,以及对自己成分的免疫耐受和对非已成分的免疫应答,都涉及细胞间的信息传递、细胞内信号传导和能量转换等生命过程的基本特性。
免疫系统的功能受遗传控制。目前对机体各种生理功能的遗传控制还知之甚少。免疫遗传学的研究第一次揭开了机体生理功能系统的遗传控制机制。这对在基因水平研究机体的生理功能具有重要意义。
免疫细胞在发育成熟的过程中都伴随有膜表面标志的变化。在发育的任何阶段发生恶性变的免疫细胞,都具有其固有的、特定的膜标志。这些不同分化阶段的恶性肿瘤细胞是研究细胞恶性变机制的理想模型,对研究恶性肿瘤发生学具有重要意义。
MHC基因复合体的结构和功能研究、免疫球蛋白基因表达的等位排斥现象的研究、免疫球蛋白以及其他免疫分子基因的研究、对DNA结合蛋白调节细胞因子表达的研究等都大大地丰富了分子生物学的研究内容,促进了对真核细胞基因结构和表达调控的认识。免疫学技术的发展,为生命科学的研究提供了有力的手段。单抗的应用给生物科学的发展带来了突破性的变革;免疫组化技术与分子杂交技术的结合,使得对基因及其表达的研究可达到定量、定性、定位的程度。显然,免疫学在生物学的发展中具有重要作用。
三、免疫学与生物技术的发展
回顾免疫学的发展历史,可以清楚地看到,免疫学每一步重要进展都推动着生物技术的发展。上世纪末本世纪初,免疫学在抗感染方面的巨大成功,促进了生物制品产业的发展。人工主动免疫和被动免疫的应用,有力地控制了多种传染病的传播。在过去30年中,免疫学的巨大进展在更深的层次和更广阔的范围内,推动了生物高技术产业的发展。用细胞工程产生的单克隆抗体,用基因工程产生的细胞因子为临床医学提供了一大类具有免疫调节作用的新型药物。这些新型药物主要着重于调节机体的免疫功能,则副作用较少,因而在多种疾病的治疗上具有传统药物所不可替代的作用。目前以免疫细胞因子和单克隆抗体为主要产品的生物高技术产业,已成为具有巨大市场潜力的新兴产业部
第一篇 免疫系统的组织结构
随着现代免疫学的发展,已证明在高等动物和人体内存在一组复杂的免疫系统。它的生理功能主要是识别区分“自己”与“非已”成分,并能破坏和排斥“非已”成分,而对“自己”成分则能开成免疫耐受,不发生排斥反应,以维持机体的自身免疫稳定。
免疫系统是由免疫器官、免疫细胞和免疫分子组成。免疫器官根据它们的作用,可分为中枢免疫器官和周围免疫器官。禽类的法氏囊(腔上囊)、哺乳类动物和人的胸腺和骨髓属于中枢免疫器官。骨髓是干细胞和B细胞发育分化的场所,法氏囊是禽类B细胞发育分化的器官。胸腺是T细胞发育分化的器官。脾和全身淋巴结是周围免疫器官,它们是成熟T和B细胞定居的部位,也是发生免疫应答的场所。此外,粘膜免疫系统和皮肤免疫系统也是重要的局部免疫组织。
免疫细胞的广义的概念可包括造血干细胞、淋巴细胞系、单核吞噬细胞系、粒细胞系、红细胞以及肥大细胞和血小板等。
免疫分子可包括免疫细胞膜分子,如抗原识别受体分子、分化抗原分子、主要组织相容性分子以及一些其它受体分子等。也包括由免疫细胞和非免疫细胞合面和分泌的分子,如免疫球蛋白分子、补体分子以及细胞因子等。
表 免疫系统的组织结构
| 免疫器官 | 免疫细胞 | 免疫分子 | ||
| 中枢 | 周围 | 膜型分子 | 分泌型分子 | |
| 法氏囊 (禽类) |
脾 淋巴结 |
干细胞系 淋巴细胞系 |
T细胞抗原 识别受体(TCR) |
免疫球蛋白分子 (Ig分子) |
| 胸腺 | 粘膜免疫系统 | 单核吞细胞系 | B细胞抗原 识别受体(BCR) |
补体分子 (C分子) |
| 骨髓 | 皮肤免疫系统 | 其它免疫细胞 | 白细胞分化抗原(CD分子) 主要组织相容性分子(MHC分子) 其它受体分子 |
细胞因子(CKs) |
第二章 免疫球蛋白分子
抗体分子(antibody,Ab)是由浆细胞合成和分泌的,而每一种浆细胞克隆可以产生一种特异的抗体分子,所以血清中的抗体是多种抗体分子的混合物,它们的化学结构是不均一的,而且含量很少,不易纯化,是抗体分子结构分析的困难。
多发性骨髓瘤是由浆细胞无限增殖形成的细胞克隆,由于所有瘤细胞的遗传特性相同,因此它们合成和分泌的蛋白质分子在化学结构上是均一的。这种蛋白分子存在于血液中的称为骨髓瘤蛋白(meyloma protein,M)或M蛋白,亦可在尿液中发现称为本周蛋白(BenceJones,BJ)由于这种蛋白分子含量很高,极易纯化,故为Ig分子结构的展使得对Ig分子结构、理化性质、抗原性、生物学活性以及其基因结构等方面的研究者有了重大突破。
第一节 抗体的发现及其特性
一、抗体的发现
在免疫学发展的早期人们应用细菌或其外毒素给动物注射,经一定时期后用体外实验证明在其血清中存在一种能特异中和外毒素毒性的组分称之为抗毒素,或能使细菌发生特异性凝集的组分称之为凝集素。其后将血清中这种具有特异性反应的组分称为抗体(antibody,Ab),而将能刺激机体产生抗体的物质称之为抗原(antigen,Ag)。由此建立了抗原与抗体的概念。
1890年德国学者Behuing和日本学者北里用白喉杆菌外毒的组分称为抗毒素,这是在血清中发现的第一种抗体。这种含有抗体的血清称之为免疫血清。
二、抗体的理化性质
1.抗体是球蛋白 早在40年代初期Tiselius和Kabat就证实了抗体活性与血清丙种球蛋白组分相关。他们用肺炎球菌多糖免疫家兔,可获得高效价免疫血清。然后加入相应抗原吸收以除去抗体,将去除抗体的血清进行电泳图谱分析,发现丙种球蛋白(γ-G)组分明显减少,从而证明了抗体活性是存在于丙种球蛋白内。
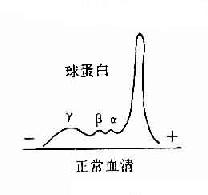
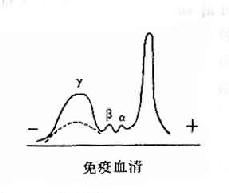
图2-1 兔血清电泳分离图
其后,经对不同免疫血清的电泳分析,超速离心分析和分子量测定等方法,发现大部分抗体活性存在于γ球蛋白内,但有小部分抗体活性可存在于β球蛋白内。它们的离心常数分别为7S和平共处9S,分子量分别为16万和万。因此它们分别被命名为7Sγ球蛋白分子(16万)19S,β2巨球蛋白分子(β2M,90万)和β2A球蛋白分子,所以从早期对抗体性质的研究证明抗体不是由均质性球蛋白组成,而是由异性球蛋白组成。
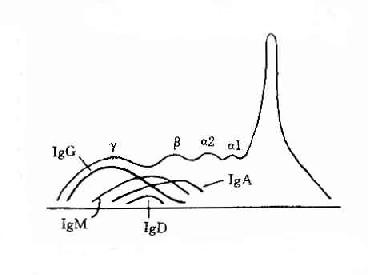
图2-2 不同类免疫球收白的电泳分离图
2.免疫球蛋白为了准确描述抗体蛋白的性质,在60年代初提出将具有抗体活性的球蛋白称为免疫球蛋分子(immunoglobulin,lg)。γ球蛋白则必称为IgG,β2M称为IgM,而β2A称为IgA。其后又相继发现二类Ig分子,分别称为IgE和IgD。故在血清中现已发现有五类免疫球蛋白分子,它们的结构与功能是各不相同的。
三、抗体的生物学活性
1.抗体与抗原的特异性结合刺激抗体产生的物质称为抗原,抗体分子与其相应的抗原发生结合称为特异性结合。例如,白喉抗毒素只能中和白喉杆菌外毒素,而不能中各破伤风外毒素,反之亦然。
2.抗体与补体的结合在一定条件下,抗体分子可以与存在于血清中的补体分子相结合,并使之活化,产生多种生物学效应,称之为抗体的补体结合现象,揭示了抗体分子与补体分子间的相互作用。
3.抗体的调理作用抗体的第三种功能是可增强吞噬细胞的吞噬作用。在体外的实验中,如将免疫血清中加入中性粒细胞的悬液中,可增强对相应细胞的吞噬作用,称这种现象为抗体的调理作用。自此揭示了抗体分子与免疫细胞间的相互作用。为了说明抗体分子这些生物学功能,必须进一步了解抗体分子的结构与功能的关系。
第二节 免疫球蛋白分子的结构与功能
一、免疫球蛋白分子的基本结构
Porter等对血清IgG抗体的研究证明,Ig分子的基本结构是由四肽链组成的。即由二条相同的分子量较小的肽链称为轻链和二条相同的分子量较大的肽链称为重链组成的。轻链与重链是由二硫键连接形成一个四肽链分子称为Ig分子的单体,是构成免疫球蛋白分子的基本结构。Ig单体中四条肽链两端游离的氨基或羧基的方向是一致的,分别命名为氨基端(N端)和羧基端(C端)。
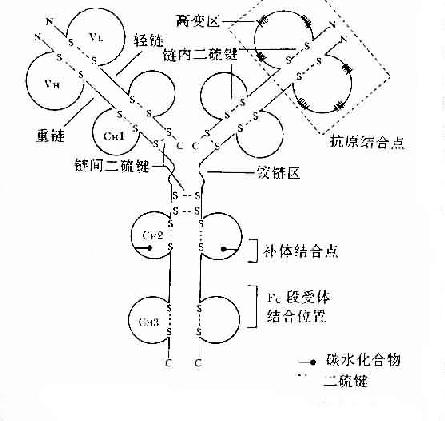
图2-3 免疫球蛋白分子的基本结构示意图
(一)轻链和重链
由于骨髓瘤蛋白(M蛋白)是均一性球蛋白分子,并证明本周蛋白(BJ)是Ig分子的L链,很容易从患者血液和尿液中分离纯化这种蛋白,并可对来自不同患者的标本进行比较分析,从而为Ig分子氨基酸序列分析提供了良好的材料。
1.轻链(lightchain,L) 轻链大约由214个氨基酸残基组成,通常不含碳水化合物,分子量约为24kD。每条轻链含有两个由链内二硫键内二硫所组成的环肽。L链共有两型:kappa(κ)与lambda(λ),同一个天然Ig分子上L链的型总是相同的。正常人血清中的κ:λ约为2:1。
2.重链(heavychain,H链) 重链大小约为轻链的2倍,含450~550个氨基酸残基,分子量约为55或75kD。每条H链含有4~5个链内二硫键所组成的环肽。不同的H链由于氨基酸组成的排列顺序、二硫键的数目和们置、含的种类和数量不同,其抗原性也不相同,根据H链抗原性的差异可将其分为5类:μ链、γ链、α链、δ链和ε链,不同H链与L链(κ或λ链)组成完整Ig的分子分别称之为IgM、IgG、IgA、IgD和IgE。γ、α和δ链上含有4个肽,μ和ε链含有5个环肽。
(二)可变区和恒定区
通过对不同骨髓蛋白或本周蛋白H链或L链的氨基酸序列比较分析,发现其氨基端(N-末端)氨基酸序列变化很大,称此区为可变区(V),而羧基末端(C-末端)则相对稳定,变化很小,称此区为恒定区。
1.可变区(variableregion,V区) 位于L链靠近N端的1/2(约含108~111个氨基酸残基)和H链靠近N端的1/5或1/4(约含118个氨基酸残基)。每个V区中均有一个由链内二硫键连接形成的肽环,每个肽环约含67~75个氨基酸残基。V区氨基酸的组成和排列随抗体结合抗原的特异性不同有较大的变异。由于V区中氨基酸的种类为排列顺序千变万化,故可形成许多种具有不同结合抗原特异性的抗体。
L链和H链的V区分别称为VL和VH。在VL和VH中某些局部区域的氨基酸组成和排列顺序具有更高的变休程度,这些区域称为高变区(hypervariable region,HVR)。在V区中非HVR部位的氨基酸组面和排列相对比较保守,称为骨架区(fuamework rugion)。VL中的高变区有三个,通常分别位于第24~34、50~65、95~102位氨基酸。VL和VH的这三个HVR分别称为HVR1、HVR2和HVR3。经X线结晶衍射的研究分析证明,高变区确实为抗体与抗原结合的位置,因而称为决定簇互补区(complementarity-determining regi-on,CDR)。VL和VH的HVR1、HVR2和HVR3又可分别称为CDR1、CDR2和CDR3,一般的CDR3具有更高的高变程度。高变区也是Ig分子独特型决定簇(idiotypic determinants)主要存在的部位。在大多数情况下H链在与抗原结合中起更重要的作用。
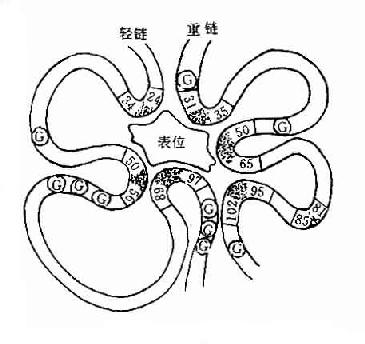
图2-4 与表位结合高变区示意图(G表示相对保守的甘氨酸)
2.恒定区(constantregion,C区) 位于L链靠近C端的1/2(约含105个氨基酸残基)和H链靠近C端的3/4区域或4/5区域(约从119位氨基酸至C末端)。H链每个功能区约含110多个氨基酸残基,含有一个由二锍键连接的50~60个氨基酸残基组成的肽环。这个区域氨基酸的组成和排列在同一种属动物Ig同型L链和同一类H链中都比较恒定,如人抗白喉外毒素IgG与人抗破伤风外毒素的抗毒素IgG,它们的V区不相同,只能与相应的抗原发生特异性的结合,但其C区的结构是相同的,即具有相同的抗原性,应用马抗人IgG第二体(或称抗抗体)均能与这两种抗不同外毒素的抗体(IgG)发生结合反应。这是制备第二抗体,应用荧光、酶、同位毒等标记抗体的重要基础。
(三)功能区
Ig分子的H链与L链可通过链内二硫键折叠成若干球形功能区,每一功能区(domain)约由110个氨基酸组成。在功能区中氨基酸序列有高度同源性。
1.L链功能区 分为L链可变区(VL)和L链恒定区(CL)两功能区。
2.H链功能区 IgG、IgA和IgD的H链各有一个可变区(VH)和三个恒定区(CH1、CH2和CH3)共四个功能区。IgM和IgE的H链各有一个可变区(VH)和四个恒定区(CH1、CH2、CH3和CH4)共五个功能区。如要表示某一类免疫蛋白H链恒定区,可在C(表示恒定区)后加上相应重链名称(希腊字母)和恒定区的位置(阿拉伯数字),例如IgG重链CH1、CH2和CH3可分别用Cγ1、Cγ2和Cγ3来表示。
IgL链和H链中V区或C区每个功能区各形成一个免疫球蛋白折叠(immunoglobulin fold,Ig fold),每个Ig折叠含有两个大致平行、由二硫连接的β片层结构(betapleated sheets),每个β片层结构由3至5股反平行的多肽链组成。可变区中的高变区在Ig折叠的一侧形成高变区环(hypervariable loops),是与抗原结合的位置。
3.功能区的作用
(1)VL和VH是与抗原结合的部位,其中HVR(CDR)是V区中与抗原决定簇(或表位)互补结合的部位。VH和VL通过非共价相互作用,组成一个FV区。单位Ig分子具有2个抗原结合位点(antigen-bindingsite),二聚体分泌型IgA具有4个抗原结合位点,五聚体IgM可有10个抗原结合位点。
(2)CL和CH上具有部分同种异型的遗传标记。
(3)CH2:IgGCH具有补体Clq结合点,能活化补体的经典活化途径。母体IgG借助CH2部分可通过胎盘主动传递到胎体内。
(4)CH3:IgGCH3具有结合单核细胞、巨噬细胞、粒细胞、B细胞和NK细胞Fc段受体的功能。IgMCH3(或CH3因部分CH4)具有补体结合位点。IgE的Cε2和Cε3功能区与结合肥大细胞和嗜碱性粒细胞FCεRI有关。
4.铰链区(hingeregion)铰链区不是一个独立的功能区,但它与其客观存在功能区有关。铰链区位于CH1和CH2之间。不同H链铰链区含氨基酸数目不等,α1、α2、γ1、γ2和γ4链的铰链区较短,只有10多个氨基酸残基;γ3和δ链的铰链区较长,约含60多个氨基酸残基,其中γ3铰链区含有14个半胱氨酸残基。铰链区包括H链间二硫键,该区富含脯氨酸,不形成α-螺旋,易发生伸展及一定程度的转动,当VL、VH与抗原结合时此氏发生扭曲,使抗体分子上两个抗原结合点更好地与两个抗原决定簇发生互补。由于CH2和CH3构型变化,显示出活化补体、结合组织细胞等生物学活性。铰链区对木瓜蛋白酶、胃蛋白酶敏感,当用这些蛋白酶水解免疫球蛋白分子时常此区发生裂解。IgM和IgE缺乏铰链区。
(四)J链和分泌成分
1.J链(joining chain) 存在于二聚体分泌型IgA和五聚体IgM中。J链分子量约为15kD,由于124个氨基酸组成的酸性糖蛋白,含有8个半胱氨酸残基,通过二硫键连接到μ链或α链的羧基端的半胱氨酸。J链可能在Ig二聚体、五聚体或多聚体的组成以及在体内转运中的具有一定的作用。
2.分泌成分(secretorycomponent,SC) 又称分泌片(secretory piece),是分泌型IgA上的一个辅助成分,分子量约为75kD,糖蛋白,由上皮细胞合成,以共价形式结合到Ig分子,并一起被分泌到粘膜表面。SC的存在对于抵抗外分泌液中蛋白水解酶的降解具有重要作用。
(五)单体、双体和五聚体
1.单体 由一对L链和一对H链组成的基本结构,如IgG、IgD、IgE血清型IgA。
2.双体 由J链连接的两个单体,如分泌型IgA(secretory IgA,SIgA)二聚体(或多聚体)IgA结合抗原的亲合力(avidity)要比单体IgA高。
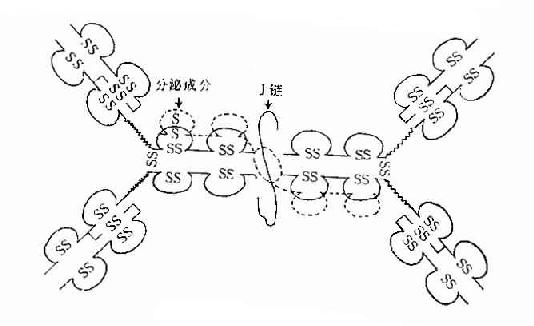
图2-5 分泌型IgA结构示意图
3.五聚体 由J链和二硫键连接五个单体,如IgM。μ链Cys414(Cμ3)和Cys575(C端的尾部)对于IgM的多聚化极为重要。在J链存在下,通过两个邻近单体IgMμ链Cys之间以及J链与邻μ链Cys575之间形成二硫键组成五聚体。由粘膜下浆细胞所合成和分泌的IgM五聚体,与粘膜上皮细胞表面pIgR(poly-Ig receptor,pIgR)结合,穿过粘膜上皮细胞到粘膜表面成为分泌型IgM(secretory IgM)。
(六)酶解片段
1.本瓜蛋白酶的水解片段Porter等最早用木瓜蛋白酶(papain)水解兔IgG,从而区划获知了Ig四肽链的基本结构和功能。
(1)裂解部位:IgG铰链区H链链间二硫键近N端侧切断。
(2)裂解片段:共裂解为三个片段:①两个Fab段(抗原结合段,fragmentof antigen binding),每个Fab段由一条完整的L链和一条约为1/2的H链组成,Fab段分子量为54kD。一个完整的Fab段可与抗原结合,表现为单价,但不能形成凝集或沉淀反应。Fab中约1/2H链部分称为Fd段,约含225个氨基酸残基,包括VH、CH1和部分铰链区。②一个Fc段(可结晶段,fragmentcrystallizable),由连接H链二硫键和近羧基端两条约1/2的H链所组成,分子量约50kD。Ig在异种间免疫所具有的抗原性主要存在于Fc段。
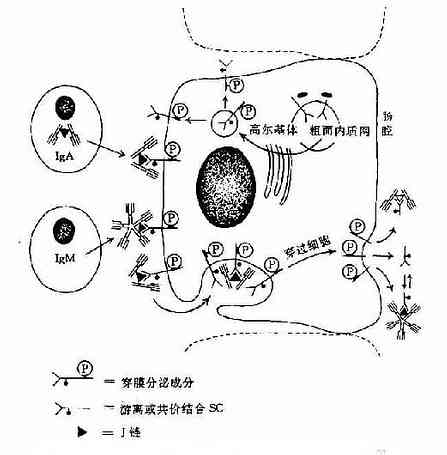
图2-6 人分泌型IgA和分泌型IgM的局部产生示意图
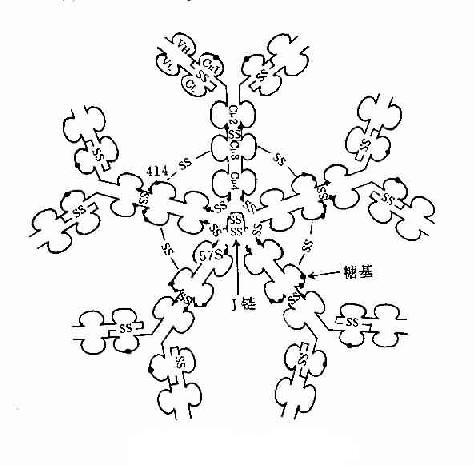
图2-7 IgM结构示意图
2.胃蛋白酶的水解片段Nisonoff等最早用胃蛋白酶(pepsin)裂解免疫球蛋白。
(1)裂解部位:铰链区H链链间二硫键近C端切断。
(2)裂解片段:
1)F(ab')2:包括一对完整的L链和由链间二硫键相连一对略大于Fab中Fd的H链,称为Fd',约含235个氨基酸残基,包括VH、VH1和铰链区。F(ab')2具有双价抗体活性,与抗原结合可发生凝集和沉淀反应。双价的F(ab')2与抗原结合的亲合力要大于单价的Fab。由于应用F(ab')2时保持了结合相应抗原的生物学活性,又减少或避免了Fc段抗原性可能引起的副作用,因而在生物制品中有较大的实际应用价值。虽然F(ab')2与抗原结合特性方面同完整的Ig分子一样,但由于缺乏Ig中部分,因此不具备固定补体以及与细胞膜表面Fc受体结合的功能。F(ab')2经还原等处理后,H链间的二硫可发生断裂而形成两个相同的Fab'片段。
2)Fc'可继续被胃蛋白酶水解成更小的片段,失去其生物学活性。
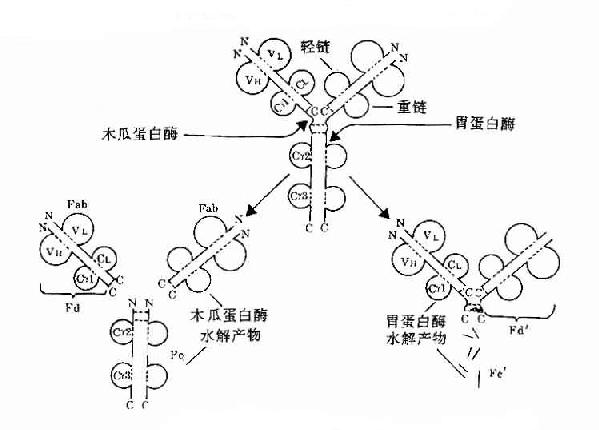
图2-8 Ig酶水解片段示意图
二、免疫球蛋白分子的功能
Ig是体液免疫应答中发挥免疫功能最主要的免疫分子,免疫球蛋白所具有的功能是由其分子中不同功能区的特点所决定的。
(一)特异性结合抗原
Ig最显着的生物学特点是能够特异性地与相应的抗原结合,如细菌、病毒、寄生虫、某些药物或侵入机体的其他异物。Ig的这种特异性结合抗原特性是由其V区(尤其是V区中的高变区)的空间构成所决定的。Ig的抗原结合点由L链和H链超变区组成,与相应抗原上的表位互补,借助静电力、氢键以及范德华力等次级键相结合,这种结合是可逆的,并受到pH、温度和电解浓度的影响。在某些情况下,由于不同抗原分子上有相同的抗原决定簇,或有相似的抗原决定簇,一种抗体可与两种以上的抗原发生反应,此称为交叉反应(cross reaction)。
抗体分子可有单体、双体和五聚体,因此结合抗原决定簇的数目(结合价)也不相同。Fab段为单价,不能产生凝集反应和沉淀反应。F(ab')2和单体Ig(如IgG、IgD、IgE)为双价。双体分泌型IgA有4价。五聚体IgM理论上应为10价,但实际上由于立体构型的空间位阻,一般只有5个结合点可结合抗原。
B细胞表面Ig(SmIg)是特异性识别抗原的受体,成熟B细胞主要表达SmIgM和SmIgD,同一B细胞克隆表达不同类SmIg其识别抗原的特异性是相同的。
(二)活化补体
1.IgM、IgG1、IgG2和IgG3可通过经典途径活化补体。当抗体与相应抗原结合后,IgG的CH2和IgM的CH3暴露出结合C lq的补体结合点,开始活化补体。由于Clq6个亚单位中一般需要2个C端的球与补体结合点结合后才能依次活化Clr和Cls,因此IgG活化补体需要一定的浓度,以保证两个相邻的IgG单体同时与1个Clq分子的两个亚单位结合。当Clq一个C端球部结合IgG时亲和力则很低,Kd为10-4M,当Clq两个或两个以上球部结合两个或多个IgG分时,亲合力增高Kd为10-8M。IgG与Clq结合点位于CH2功能区中最后一个β折叠股318~322位氨基酸残基(Glu-x-Lys-x-Lys)。IgM倍以上。人类天然的抗A和抗B血型抗体为IgM,血型不符合引韦的输血反应发生快而且严重。
2.凝聚的IgA、IgG4和IgE等可通过替代途径活化补体。
(三)结合Fc受体
不同细胞表面具有不同Ig的Fc受体,分别用FcγR、FcεR、FcαR等来表示。当Ig与相应抗原结合后,由于构型的改变,其Fc段可与具有相应受体的细胞结合。IgE抗体由于其Fc段结构特点,可在游离情况下与有相应受体的细胞(如嗜碱性粒细胞、肥大细胞)结合,称为亲细胞抗体(cytophilic antibody)。抗体与Fc受体结合可发挥不同的生物学作用。
1.介导I型变态反应变应原刺激机体产生的IgE可与嗜碱性粒细胞、肥大细胞表面IgE高亲力受体细胞脱颗粒,释放组胺,合成由细胞FcεRI结合。当相同的变应原再次进入机体时,可与已固定在细胞膜上的IgE结合,刺激细胞脱颗粒,释放组受,合成由细胞脂质来源的介质如白三烯、前列腺素、血小板活化因子等,引起Ⅰ型变态反应。
2.调理吞噬作用 调理作用(opsonization)是指抗体、补体C3b、C4b等调理素(opsonin)促进吞噬细菌等颗粒性抗原。由于补体对热不稳定,因此又称为热不稳定调理素(heat-labile opsonin)。抗体又称热稳定调理素(heat-stableopsonin)。补体与抗体同时发挥调理吞噬作用,称为联合调理作用。中性粒细胞、单核细胞和巨噬细胞具有高亲和力或低亲和力的FcγRI(CD64)和FcγRⅡ(CD32),IgG尤其是人IgG1和IgG3亚类对于调理吞噬起主要作用。嗜酸性粒细胞具有亲和力FcγRⅡ,IgE与相应抗原结合后可促进嗜酸性粒细胞的吞噬作用。抗体的调理机制一般认为是:①抗体在抗原颗粒和吞噬细胞之间“搭桥”,从而加强了吞噬细胞的吞噬作用;②抗体与相应颗粒性抗原结合后,改变抗原表面电荷,降低吞噬细胞与抗原之间的静电斥力;③抗体可中和某些细菌表面的抗吞噬物质如肺炎双球菌的荚膜,使吞噬细胞易于吞噬;④吞噬细胞FcR结合抗原抗体复合物,吞噬细胞可被活化。
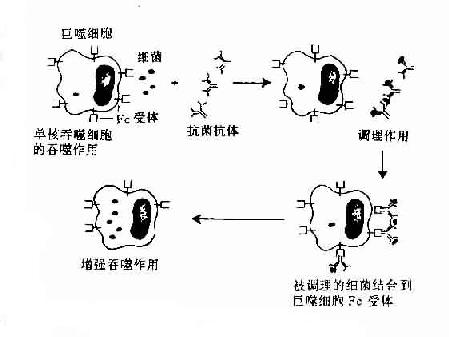
图2-9 抗体的调理吞噬作用
3.发挥抗体依赖的细胞介导的细胞毒作用 当IgG抗体与带有相应抗原的靶细胞结合后,可与有FcγR的中性粒细胞、单核细胞、巨噬细胞、NK细胞等效应细胞结合,发挥抗体依赖的细胞介导的细胞毒作用(antibodydependentcell-mediated cytotoxicity,ADCC)。目前已知。NK细胞发挥ADCC效应主要是通过其膜表面低亲和力FcγRⅢ(CD16)所介导的,IgG不仅起到连接靶细胞和效应细胞的作用,同时还刺激NK细胞合成和分泌肿瘤坏死因子和γ干扰素等细胞因子,并释放颗粒,溶解靶细胞。嗜酸性粒细胞发挥ADCC作用是通过其FcεRⅡ和FcαR介导的,嗜酸性粒细胞可脱颗粒释放碱性蛋白等,在杀伤寄生虫如蠕虫中发挥重要作用。
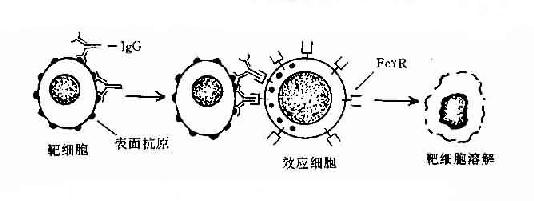
图2-10 抗体依赖的细胞介导的细胞毒作用(ADCC)
此外,人IgGFc段能非特异地与葡萄菌A蛋白(staphylococcus proteinA,SPA)结合,应用SPA可纯化IgG等抗体,或代替第二抗体用于标记技术。
(四)通过胎盘
在人类,IgG是唯一可通过胎盘从母体转移给胎儿的Ig。IgG能选择性地与胎盘母体一侧的滋养层细胞结合,转移到滋养层细胞的吞饮泡内,并主动外排到胎儿血循环中。IgG的这种功能与IgGFc片段结构有关,如切除Fc段后所剩余的Fab并不能通过胎盘。IgG通过胎盘的作用是一种重要的自然被动免疫,对于新生儿抗感染有重要作用。
三、免疫球蛋白分子的抗原性
Ig本身具有抗原性,将Ig作为免疫原免疫异种动物、同种异体或在自身体内可引起不同程度的免疫性。根据IgI不同抗原决定簇存在的不同部位以及在异种、同种异体或自体中产生免疫反应的差别,可把Ig的抗原性分为同种型、同种异型和独特型第三种不同抗原决定簇。
(一)同种型
同种型(isotype)是指同一种属内所有个体共有的Ig抗原特异性的标记,要异种体内可诱导产生相应的抗体,换句话说,同种型抗原特异性因种属(specics)而异。同种型的抗原性位于CH和CLH ,同种型主要包括Ig的类、亚类,型和亚型。
1.免疫球蛋的类和亚类(classesand subclasses)
(1)类:决定Ig不同类的抗原性差异存在于H链的恒定区(CH)。根据CH抗原性的差异(即氨基酸组成、排列、构型、二硫键等不同)H链可分为μ、γ、α、δ和ε五类,不同H链与L链组成完整Ig的分子别为IgM、IgA、IgD和IgE。在基因水平上,不同类的H链恒定区的是由不同的恒定区基因片段所编码。不同类Ig在理化性质及生物学功能上可有较大差异。
(2)亚类:同一类Ig中由于铰链区氨基酸组成和二硫键数目的差异,可分为不同的亚类,亚类间抗原性的差异要小于不同类之间的差异。目前已发现人的α重链有α1和α2两个亚类,分别与L链组成IgA1和IgA2。γ重链有4个亚类,但命名为IgG1、IgG2a、IgG2b和IgG3。IgM、IgD和IgG,目前尚未发现存在不同的亚类。Ig不同亚类也是由不同的恒定区基因片段编码。
2.免疫球蛋白的型和亚型(typesand subtypes)
(1)型:决定Ig型的抗原性差异存在于L链的恒定区(CL),根据CL抗原性的差异(氨基酸的组成、排列和构型的不同)分为κ和λ轻链之比约为2:1;而在小鼠,97%轻链为κ型,λ型只占3%左右。
(2)亚型:根据λ轻链恒定区(C2)个别氨基酸的差异又可分λ1、λ2、λ3和λ4四个亚型。λ1和λ2在λ轻链190位氨基酸的分别为亮氨酸和精氨酸,λ3和λ4在第154氨基酸分别为某氨酸和丝氨酸。
(二)同种异型
同种异型(allotype)是指同一种属不同个体间的Ig分子抗原性的不同,在同种异体间免疫可诱导免疫反应。同种异型抗原性的差别往往只有一个或几个氨基酸残基的不同,可能是由于编码Ig的结构基因发生点突变所致,并被稳定地遗传下来,因此Ig同种异型可作为一种遗传标记(genetic markers),这种标记主要分布在CH和CL上。
1.γ链上的同种异型 γ1、γ2γ3和λ4重链上均存在有同种异型标记,目前已发现:Glma、x、f、z;G2mn;G3mgl、g5、b0、b1、b3、b4、b5、c3、c5、s、t、u、v;G4m4a、4b。共20种左右。其中G表示λ链,1、2、3或4表示亚类λ1、λ2、λ3和λ4,m代表标记(marker)。
除Glmf和z位于IgG1分子的Cγ1区外,其余的Gm均位于Fc部位。一条γ链可能同时具有一个以上的Gm标志,如白种人常常在γ1H链Cγ1区有G1mz,Fc部位有G1ma。由于人第14号染色体编码四种IgG亚类的C区基因Cγ1、Cγ2、Cγ3和Cγ4是密切连锁的,因此IgGH链各亚类Gm标记可作为间倍体(haplotype)遗传给子代。
2.α链上的同种异型 α2H链已发现有A2m1和A2m2两种。A2m1在411、428、458和467位氨酸上分别为苯丙氨酸、天冬氨酸、亮氨酸、缬氨酸;A2m2则分别为苏氨酸、谷氨酸、异亮氨酸和丙氨酸。α1H链上尚未发现有同种异型存在。
3.ε链上的同种异型目前只发现Em1一种同种异型。
4.κ链上的同种异型旧称为Inv,现分为Km1、2和3。Km1在153位和191位氨基酸上分别为缬氨酸和亮氨酸,Km2分别为丙氨酸和亮氨酸,Km3分别为丙氨和缬氨酸。λ轻链上尚未发现有同种异型。
(三)独特型
独特型(idiotype)为每一种特异性IgV区上的抗原特异性。不同抗体形成细胞克隆所产生的IgV区具有与其客观存在抗体V区不同的抗原性,这是由可变区中成其是超变区的氨基酸组成、排列和构型所决定的。所以,在单一个体内所存在的独特型数量相当大,可达107以上。独特型的抗原决定簇称为独特位(idiotope),可在异种、同种异体以及自身体内诱产生相应在的抗体,称为抗独特型抗体(antiidiotypicantibody,αI d),独特型和抗独型抗体可形成复杂的免疫调节中占有得要地位。
表2-1 人免疫球蛋白分子上抗原决定簇的分类
| 分类 | 抗原性存在部位 | 举例 | |
| 同种型 | 类 亚类 型 亚型 |
CH CH CL CL(λ) |
IgM、IgG、IgA、IgD、IgE IgG1-4,IgA1、2 κ、λ λ1、λ2、λ3、λ4 |
| 同种异型 | CH(λ1) (λ2) (λ3) (λ4) CH(α2) CH(ε) CL(κ) |
G1ma(1)、x(2)、f(3)、z(17) G2mn(23) G3mb1(5)、c3(6)、b5(10)、b0、(11)b3(13)、b4(14)、s(15)、t(16)、g1(21)、c5(24)、u(26)、v(27)、g1(28) G4m4a(1)、4b(1) A2m1、2 Em1 Km1、2、3 |
|
| 独特型 | VHVL | 极多 | |
注:γ1~γ4同种异型的命名中,WHO1976年建议采用阿拉数字代号,但目前许多专业实验室仍沿用小写英文字母,在本表中将γ链同种异型阿拉伯数字代号列于相应英文字母代号后的括号中
四、免疫球蛋白分子的超家族
应用DNA序列分析和X晶体衍射分析等研究表明,许多细胞膜表面和机体某些蛋白质分子,其多肽链折叠方式与Ig折叠相似,在DNA水平和氨基酸序列上与IgV区或C区有较高的同源性,它们可能从同一原始祖先基因(primodial ancestral gene)经复制和突变衍生而来。编码这些多肽链的基因称为免疫球蛋白基因超家族(immunoglobulin gene superfamily),这一基因超家族所编码的产物称为免疫球蛋白超家族(immunogloblin superfamily,IGSF)。
(一)免疫球蛋白超家族的组成
由于细胞表面标记、单克隆抗体以及基因工程研究的进展,近年来发现属于IGSF的成员已达近百种,主要包括T细胞、B细胞抗原识别受体和信号传导分子,MHC及相关分子,Ig受体,某些细胞因子受体,神经系统功能相关分子,以及部分白细胞分化抗原(CD)(表2-2)。
表2-2 免疫球蛋白超家族的组成(成员举例)
| 主要功能 | 成员 |
| 抗原识别受体和信号传导分子 | IgH链:μ、γ、δ、ε和α链 IgL链:κ和λ链 SmIg复合物成分:MG-1(Ig-α,CD79a)、B29(Ig-β,CD79b) TCR:α、β、γ和δ链 CD3:γ、δ和ε链 |
| MHC及其相关分子 | MHCⅠ类抗原:α链、β2M MHCⅡ类抗原:α、β链 β2M相关分子:CD1、Qa、TL |
| 免疫球蛋白受体 | PolyIgR(pIgR) IgG Fc段受体:FcγRⅠ(CD64)、FcγRⅡ、FcγRⅢ(CD16) Ige Fc段受体:FcεRIα链 IgE Fc段受体:FcαR |
| 细胞因子受体 | IL-1R(CDw121a),IL-6R(CD126),M-CSFR(CD115),G-CSFR、SCFR(CD117),PDGFR |
| 白细胞分化抗原 | CD2,LFA-3(CD58),ICAM-1(CD54),ICAM-2(CD102)、ICAM-3(CD50),CD4,CD8α、β链,CD28,B7/BB1(CD80),CD7,CD22,CD33,CD48,CEA(CD66e),Thy-1(CDw90),PECAM-1(CD31),VCAM-1(CD106) |
(二)免疫球蛋白超家族的特点
1.IGSF的结构特点 IGSF的成员均含有1~7个Ig样功能区,第个Ig样功能区约含100(70~110)个氨基酸残基,功能区的二级结构是由3~5个股反平行β折叠股各自形成两个平行β片层的平面(anti-paralle β-pleated sheet),每个反平行β折叠股由5~10个氨基酸基组成,β片层内侧的疏水性氨基酸起到稳定Ig折叠的作用,大多数功能区内有一个二硫键,垂直连接两个β片层,形成二硫键的两个半胱氨酸间有55~75个氨基酸残基,使之成为一个球形结构,肽链的这种折叠方式称为免疫球蛋折叠(Ig fold)。
根据IGSF功能区中Ig折叠方式、两个半胱氨酸之间氨基酸残基的数目以及与IgV区或C区同源性的程度,IGSF功能区可分为V组、C1组和C2组。
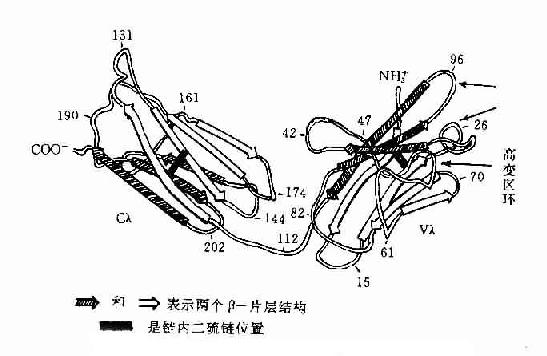
图2-11 人Ig轻链(λ)多肽折叠示意图
(1)V组:V组功能区的两个半胱氨酸之间含65~75个氨基酸残基,有9个反平行β折叠股,如IgH链和L链V区,TCRα、β、γ、δ链V区,CD4v区,CD8α、β链V区,Thy-1,pIgR和分泌成分(SC)N端四个功能区,CEAN端第一个功能区,PDGFR靠近胞膜的功能区等。
(2)C1组:又称C组。C1组功能区二个半胱氨酸之间约含50~60个氨基酸残基,有7个β折叠股,如IgH链和L链C区(γ、δ和α链的CH1~CH3或μ和ε链的CH1~CH4),TCRα、β、γ、δ链C区,MHc Ⅰ类分子重链α3功能区,β2M,MHCⅡ类分子α2和β2功能区,CD1、Qa和TL靠近胞膜功能区等。
(3)C2组:又称H组。C2组功能区的氨基酸排列的顺序类似V组,但形成二硫键的两个半胱氨酸之间所含氨基酸残基数约为50~60,有7个β折叠股,这种结构介于V组和C1组之间,如CD3γ、δ和ε链,CD2和LFA-3(CD58),pIgR靠近胞膜功能区,FcγRⅠ、FcγRⅡ、FcγRⅢ、FcεRⅠα链、FcαR,ICAM-1,CEA第2至7个功能区,IL-6R、M-CSFR、G-CSFR、SCFR。PDGFR第1至4功能区,以及N-CAM、CD22、CD48分子等。
2.IGSF功能特点 IGSF的功能是以识别为基础,因此又称为识别球蛋白超家族(cognoglobulinsuperfamily)。IGSF很可能最起源于原始的具有粘功能的基因,通过复制和突变衍生形成了识别抗原、细胞因子受体、IgFc段受体、细胞间粘附分子以及病毒受体等不同的功能区。IGSF识别的基本方式有以下几种。
(1)IGSF和IGSF相互识别:①同嗜性相互作用(heterophilicinteraction)如相同神经细胞粘附分子(N-CAM)之间的相互识别,血小板内皮细胞粘附分子-1(PECAM-1,CD31)的相互识别;②异嗜性相互作用( heterophilic interaction),如CD2与LFA-3,CD4与MHCⅡ类分子的单态部分(α2和β2),CD8与MHCⅠ类分子的单态部分(α3),poly IgR与多聚Ig,FcγRⅠ(CD64)、FcγRⅡ(CD32)、FcγRⅢ(CD16)与IgG Fc 段,FcγRⅠ与Ige Fc段,FcαR(CD89)与IgA Fc段,CD28与B7/BB1(CD80)等之间的相互识别。
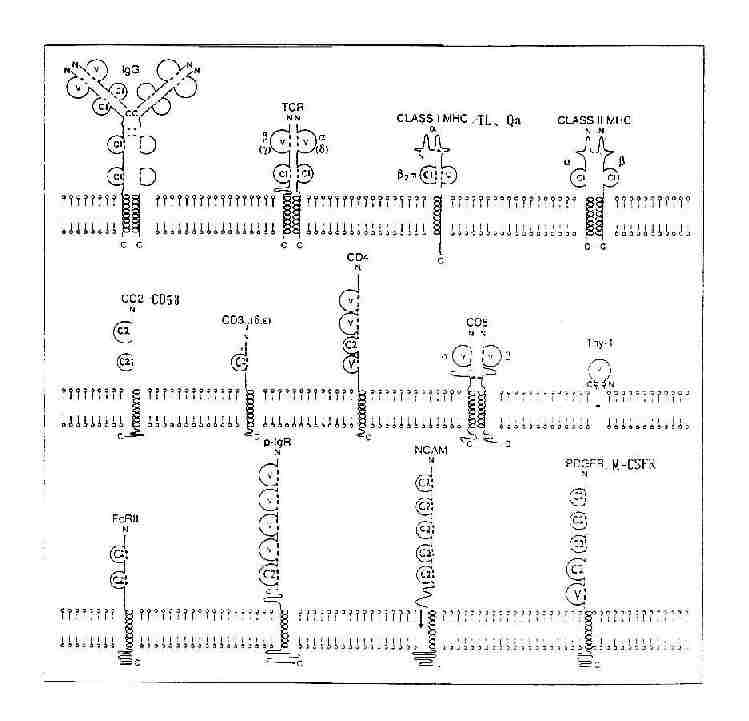
图2-12 免疫球蛋白超家族V组、C1组和C2组结构模式图
(2)IGSF和结合素(integrin)相互识别:如ICAM-1(CD54)、ICAM-2(CD102)与LFA-1(CD11a/CD18),VCAM-1(CD106)与VLA-4(CD49d/CD29)之间的相互作用。
(3)IGSF和其它分子的相互识别:包括TCR识别MHCⅠ类或Ⅱ类分子与抗原复合物,细胞因子受体识细胞因子等。
第三节 各类免疫球蛋白的生物学活性
不同Ig其合成部位、合成时间、血清含量、分布、半衰期以及生物学活性有所差别。
一、IgG
IgG主要由脾、淋巴结中的浆细胞合成和分泌,以单体形式存在。在个体发育过程中机体合成IgG的年龄要晚于 IgM,在出生后第3个月开始合成,3~5岁接近成年人水平。IgG是血清中主要的抗体成分,约占血清总Ig的75%。根据IgG分子中γ链抗原性差异,人IgG有4个亚类:IgG1、IgG2、IgG3和IgG4(小鼠4个亚类是IgG1、IgG2a、IgG2b和IgG3)。其中IgG3γ3铰链区含有62个氨基酸残基,具有4个重复γ1铰链区(15个氨基酸残基)的串连结构,重链间二硫键数量多,约10~15个,因此易被蛋白酶裂解,半衰期也较短。不同IgG亚类的生物学活性有所差异(表2-3)。IgG的半衰期相对较长,约为20~30天。IgG可通过经典途径活化补体,其固定补体的能力依次是IgG3>IgG1>IgG2,在小鼠为IgG2b>IgG2a>IgG3,人的IgG4和小鼠的IgG1无固定补体的能力。IgG是唯一能通过胎盘的Ig,在自然被动免疫中起重要作用。此外IgG还具有调理吞噬、ADCC和结合SPA等作用。由于IgG上述特点,IgG在机体免疫防护中起着主要的作用,大多数抗菌、抗病毒、抗毒素抗体都属于IgG类抗体。应用对麻疹、甲型肝炎等有免疫力的产妇或正常人丙种或胎盘球蛋白可进行人工被动免疫,能有郊地预防相应的传染性疾病。不少自身抗体如抗甲状腺球蛋白抗体、系统性红斑狼疮的LE因子(抗核抗体)以及引起Ⅲ型变态反应免疫复合物中的抗体大都也属于IgG。
表2-3 人IgG不同亚类理化性质和生物学特性比较
| 性质 | IgG1 | IgG2 | IgG3 | IgG4 |
| 重链及其分子量(kD) | γ1(52) | γ2(52) | γ3(58) | γ4(52) |
| 单体分子量(kD) | 146 | 146 | 170 | 146 |
| 铰链区氨基酸数目 | 15 | 12 | 62 | 12 |
| 血浆中半衰期(天) | 21~23 | 21~23 | 7~8 | 21~23 |
| 血清浓度(mg/dl) | 800 | 400 | 80 | 40 |
| 固定补体 | ++ | + | +++ | - |
| 结合FcR:FcγRⅠ FcγRⅡ FcγRⅢ |
+++ +++ ++ |
- + - |
+++ +++ ++ |
+ + - |
| 结合SPA | + | + | + | - |
| 通过胎盘 | ++ | + | ++ | ++ |
二、IgA
IgA主要由粘膜相关淋巴样组织产生,其中大部分是由胃肠淋巴样组织所合成,少部分由呼吸道、唾液腺和生殖道粘膜组织合成。哺乳期产妇腺组织含有大量IgA产生细胞,这些细胞主要来自胃肠。在人类,还有少量的IgA来自骨髓。人出生后4~6月开始合成IgA,4~12岁血清中含量达成人水平,血清型IgA总Ig的10%左右,半衰期约5~6天。IgA有IgA1和IgA2两个亚类。IgA1主要存在于血清中,约占血清中IgA的85%,α1链分子量为56kD;IgA2主要存在于外分泌液中,少部分以血清型IgA存在,约占血清中IgA的15%,α2链缺乏铰链区,分子量为52kD。血清中的IgA除单体形式外还有由J链共价相连的二聚体或三聚体等形式。分泌型IgA是由J连接的双体和分泌成分所组成,主要存在于初乳、唾液、泪液、胃肠液、支气管分泌等外分泌液中,是粘膜局部免疫的最重要因素,分泌型IgA通过与相应的病原微生物(如脊髓灰质炎病毒)结合,阻抑其吸附到易感细胞上,分泌型IgA还可中和毒素如霍乱弧菌毒素和大肠杆毒素等。新生儿易患呼吸道、胃肠道感染可能与IgA合成不足有关。慢性支气管炎发作与分泌型IgA的减少也有一定关系。产妇可通过初乳将分泌型IgA传递给婴儿,这也是一种重要的自然被动免疫。嗜酸性粒细胞、中性粒细胞和巨噬细胞表达FcαR,血清型单体IgA可介导调理吞噬和ADCC作用。此外,分泌型IgA具有免疫排除(immune exclusion)功能,即分泌型IgA结合饮食中大量的可溶性抗原以及肠道正常菌群或病原微生物所释放的热原物质,防止它们进入血液。
三、IgM
血清中IgM是由5个单体通过一个J链和二硫键连接成五聚体,分子量最大,为970kD,沉降系数为19S,称为巨球蛋白(macroglobulin)。在分子结构上IgM无铰链区,Cμ2可能替代了铰链区的功能。在生物进化过程中IgM是最早出现的免疫球蛋白,如八目鳗可产生IgM。在个体发育过程中,无论是B细胞膜表面Ig(SmIg),还是合成分泌到血清中的Ig,IgM都是最早出现的Ig,在胚胎发育晚期的胎儿即有能力产生IgM。在抗原刺激诱导体液免疫应答过程中,一般IgM也最先产生。IgM占血清总Ig的5%~10%。由于IgM在免疫应答早期产生,并在补体参与下的溶血作用比IgG强500倍以上,而且活化补体后通过C3B、C4b等片段发挥调理作用,因此IgM在机体的早期免疫防护中占有重要地位。天然的血型抗体(凝集素)为IgM,血型不符的输血,易发生严重的溶血反应。IgM不能过胎盘,脐血中如出现针对某种病原微生物的IgM,表示胚胎期有相应病原微生物如梅毒螺旋体、风疹或巨细胞毒等感染,称为胚胎感染或垂直感染。正常人血清中也含有产量单体IgM。
膜表面IgM是B细胞识别抗原受体中一种主要的SmIg。成熟B细胞有SmIgD,在正常人B细胞库(Bcell repretorire)中SmIgM+B细胞约占80%。在记忆B细胞中SmIgM逐渐消失,被SmIgG、SmIgA或SmIgE所替代。
四、IgD
IgD于1995年从人骨髓瘤蛋白中发现,分子量为175kD,主要由扁桃体、脾等处浆细胞产生,人血清中IgD浓度为3~40μg/ml,不到血清总Ig的1%,在个体发育中合成较晚。IgD铰链区很长,且对蛋白酶水解敏感,因此IgD半衰期很短,仅2.8天。血清中IgD确切的免疫功能尚不清楚。在B细胞分化到成熟B细胞阶段,除了表达SmIgD,抗原刺激后表现为免疫耐受。成熟B细胞活化后或者活化后或者变成记忆B细胞时,SmIgD逐渐消失。
五、IgE
IgE是1966年发现的一类Ig,分子量为188kD,血清中含量极低,仅占血清总Ig的0.002%,在个体发育中合成较晚。ε链有4个CH(Cε1~Cε4),无铰链区,含有较多的半胱氨酸和甲硫氨酸。对热敏感,56℃、30分钟可使IgE丧失生物学活性。IgE主要由鼻咽部、扁桃体、支气管、胃肠等粘膜固有层的浆细胞产生,这些部位常是变应原入侵和I型变态反应发生的场所。IgE为亲细胞抗体,Cε2和Cε3功能区可与嗜碱性粒细胞、肥大细胞膜上高亲和力FcεRⅠ结合。变应原再次进入机体与已固定在嗜碱性粒细胞、肥大细胞上IgE结合,可引起Ⅰ型变态反应。寄生虫感染或过敏反应发作时,局部的外分泌液和血清中IgE水平都明显升高。
表2-4 人各类免疫球蛋白主要的理化特性和生物学特性比较
| IgG | IgA | IgM | IgD | IgE | |
| 重链名称 | γ | α | μ | δ | ε |
| 重链功能区数目 | 4 (Vγ、Cγ1、Cγ2、Cγ3) |
4 (Vα 、Cα1、 Cα2、Cα3) |
5 (Cμ、Cμ1、Cμ2、Cμ3、Cμ4) |
4 (Vδ、Cδ1、Cδ2、Cδ3) |
5 (Vε、Cε1、Cε2、Cε3、Cε4) |
| 主要存在形式 | 单体 | 单体、双体 | 五聚体 | 单体 | 单体 |
| MW(Kd) | 146~170 | 160,400 | 970 | 175 | 188 |
| 平均含碳水化合物(%) | 4 | 10 | 12 | 18 | 12 |
| 成人血清浓度(mg/dl±SD) | 1150±300 | 210±50 | 150 | 0.3~4 | 0.002 |
| 占血清总Ig% | 75 | 10 | 5~10 | <1 | <0.001 |
| 存在于外分泌液中 | - | +++ | + | - | - |
| 经典途径活化补体 | ++(IgG> IgG>IgG2) |
- | +++ | - | - |
| 替代途径活化补体* | + | + | ? | + | + |
| 结合吞噬细胞 | ++(IgG3>IgG1) | + | - | - | +(嗜酸性粒细胞) |
| 结合肥大细胞和嗜碱性粒细胞 | - | - | - | - | +++ |
| 结合SPA | + | ± | ± | - | - |
| 半衰期(天) | 20~23(IgG3)为7~8 | 5.8 | 5.1 | 2.8 | 2.5 |
| 合成部位 | 脾、淋观点结浆细胞 | 粘膜相关 淋巴样组织 |
脾、淋巴结、浆细胞 | 扁桃体、脾浆细胞 | 粘膜固有层浆细胞 |
| 开始合成时间 | 生后3月 | 4~6月 | 胚胎后期 | 较晚 | 较晚 |
| 达成人水平时间 | 3~5岁 | 4~12岁 | 6月~1岁 | 较晚 | 较晚 |
| 通过胎盘 | + | - | - | - | - |
| 免疫作用 | 抗菌、抗病毒、抗毒素,自身抗体 | 粘膜局部免疫作用,抗菌、抗病毒,免疫排除功能 | 早期防御作用,溶菌,溶血,SmIgM,天然血型抗体,类风湿因子 | SmIgM+ SmIgD+ 正应答 |
抗寄生虫感染I型超敏反应 |
*聚合的Ig
第四节 免疫球蛋白基因的结构和抗体多样性
Ig分子是由三个不连锁的Igκ、Igλ和IgH基因所编码。Igκ、Igλ和IgH基因定位于不同的染色体上(表2-5)。编码一条Ig多肽链的基因是由在胚系中多个分隔的DNA片段(基因片段)经重排而形成的。1965年Dreyer和Bennet首先提出假说,认为Ig的V区和C区是由分隔存在的基因所编码,在淋巴细胞发育过程中这两个基因发生易位而重排在一起。1976年日本学者利根川进应用DNA重组技术证实了这一假说。利根川进由此获得1987年医学和生理学诺贝尔奖。
表2-5 免疫球蛋白基因定位
| 编码多肽链 | 基因符号(人) | 基因染色体定位 | ||
| 人 | 小鼠 | |||
| κ轻链 | Igκ | 2 | 6 | |
| λ轻链 | Igλ | 22 | 16 | |
| 重链 | IgH | 14 | 12 | |
一、Ig重链基因的结构和重排
(一)重键V区基因
H链V区是由V、D、J三种基因片段经重排后组成。
1.H链V区基因组成
(1)V基因片段:小鼠VH基因段约为250~1000,人的VH基因片段约为100。V基因片段编码VH的信号序列和V区靠N端98个氨基酸残基,包括CDR1和CDR2。
(2)D基因片段:D是指多样性(diversity)。D基因片段仅存在于H链,不存在于L链。小鼠DH共有12个片段,人的DH片段的数目还不完全清楚,可能有10~20个左右。D片段编码H链CDR3中大部分氨基酸残基。
(3)J基因片段:J是连接(joining)的意思。JH连接V基因片段和C基因片段。小鼠JH有4个,人有9个JH片段,其中6个是有功能的。J基因片段编码CDR3的其余部分氨基酸残基和第4个骨架区。
2.H链V区基因的移位 首先发生D与J基因片段的连接形成D-J,然后V基因片段与D-J基因片段连接。H链V区基因的易位和连接是通过七聚体-间隔序列-九聚体识别信号和重组酶而完成的。
(二)重链C区基因
1.C基因片段小鼠H链区基因片从5’端到3’排列的顺序是Cμ-Cδ-Cγ3-Cγ1-Cγ2b-Cε-Cα2,人H链C区基因的顺序为Cμ-Cδ-Cγ3-Cγ1-Cε2(pseudo基因)- Cα2- Cγ2-Cγ- Cε- Cα2(图2-13,14)。
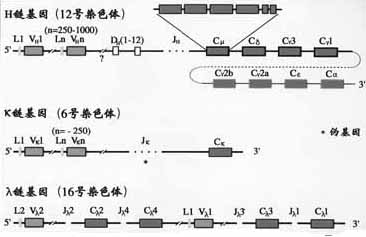
图2-13小鼠Ig基因结构
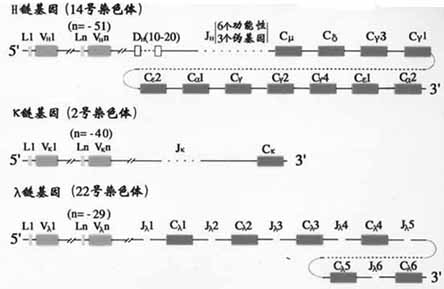
图2-14 人Ig基因结构
2.Ig类别转换(class switch) 是指一个B细胞克隆在分化过程中,V基因不变,而CH基因片段不同重排,比较CH基因片段重排后基因编码的产物,其V区相同,而C区不同,即识别抗原的特异性相同,而Ig的类或亚类发生改变。Ig可能是通过缺失模式(deletion model)和RNA剪接(splicing)两种机制来实现类别的转换。
(三)膜表面Ig重链基因
膜表面Ig(Sm Ig)是B细胞识别抗原的受体。(Sm Ig)和分泌性Ig的H链结构相类似,所不同的是smIgH名字的羧基端多含一段穿膜的疏水性氨基酸残基和胞浆区。因此SmIgH链的转录本(transcript)要比分泌性IgH链转录本多1~2个外显子。编码H链的羧基端部分,其氨基酸残基的的数目视H链不同而有差异,如在小鼠或人SmIgμ链的这一部分长约41个氨基酸残基,而小鼠SmIgε链此区域却有72个氨基酸残基。这个区域包括三个部分:①一个酸性间隔子,与H链最后一个CH功能区相同,位于胞膜外侧;②含26个氨基酸残基的疏水区,为穿膜部分;③胞浆内部分,3~28个氨基酸残基不等。
二、Ig轻链基因的结构和重排
在IgH链基因重排后,L链可变区基因片段随之发生重排。在L链中,κ链基因先发生重排,如果κ基因重排无效,随即发生λ基因的重排。L链匠CDR1、CDR2和大部分CDR3由Vκ或Vλ基因片段所编码(Vκ编码95个氨基酸残基),Jκ或Jλ基因片段编码CDR3的其余部分和第四个骨架区(Jλ编码从96位到108位氨基酸)。L链无D基因片段。
(一)κ链基因的结构和重排
κ链基因是V基因片段(Vκ)、J基因片段(Jκ)和C基因片段(Cκ)重排后组成。小鼠Vκ基因片段约有250,Jκ有5个(其中4个功能),Cκ只有1个。人Vκ基因片段约有100个,Jκ有5个。Cκ也只有1个。Vκ与Cκ之间以随机方式发生重排。
(二)λ链基因的结构和重排
κ链基因也是由Vλ、Jλ和Tλ基因片段经重排后组成。小鼠Vλ基因片段有3个:Vλ1、VλX;4个Jλ和4个Cλ基因片段,分为(Jλ2Cλ2,Jλ4Cλ和Jλ3Cλ3,Jλ1Cλ1)两组。它们的基因重排比较复杂。人Vλ约有100个,至少有6个Cλ与各自的J基因片段相连,人λ链确切的重排情况还不清楚。
三、抗体多样性的遗传学基础
机体对外界环境中种类众多抗原刺激可产生相应的特异性抗体,推算出抗体的多样性在107以上。抗体多样性主要由基因控制。
1.胚系(germ line)中众多的V、D、J基因片段 在胚系上,尚未重排的Ig基因片段数量相当多,这是生物在长期进化中形成的。表2-6例举了小鼠H链和L链重排的多样性以及H链和κ链相互随机配对所推算的多样性数目。
表2-6 小鼠Ig多样性(举例)
| 多肽链 | 基因片段数 | V区基因重组方式 | 经重排的随机配对后* 推算的多样性数目 |
|||
| V | J | |||||
| H链 | 1000 | 12 | 4 | V-D-J | 4.8×104 | 4.8×107 |
| κ链 | 250 | - | 4 | V-J | 1.0×103 | |
*多样性数目不包括VDJ连接多样性、N区插入和体细胞突变所增加的多样性数目
2.VDJ连接的多样性在L链基因重排过程中V-J连接位点有一定的变异范围,例如VL基因片段3'端5个核苷酸CCTCC和JL基因片段5'端4个核苷酸GTGG连接时,总共9个核苷酸中只有6个核苷酸编码L链第95、96位氨基酸,因此可产生8种不同的连接方式。在H链基因重排过程中K-J以及V-D-J连接时都可有连接多样性的存在。
3.体细胞突变(somaticmutation)体细胞在发育过程中可发生基因突变。以长期体外培养的B细胞前体为例,每个细胞每个碱基对的突变率约为1~43×10-5,这种点突变主要发生在V基因。体细胞突变扩展了原有胚系众多基因片段重排的多样性。
4.N区的插入在IgH链基因片段重排过程中,有时可通过无模板指导的机制(nontempletdirected mechanism),在重组后D基因片段的两侧即VH-DH或DH-JH连接处额外插入称为N区的几个核苷酸。N区不是由胚系基因所编码。在N区插入前,先通过外切酶切除VH-DH或DH-JH连接处几个碱基对,然后通过末端脱氧核苷酸转移酶(terminal deoxynucleotidyl transferase,TdT)连接上N区。由于额外插入了N区,可发生移码突变(fuame shift mutation),使插入部位以及下游的密码子发生改变,从而编码不同的氨基酸,大大地增加了抗体的多样性。
5.L链H链相互随机配对 如表2-6所示,小鼠H链和κ链随机配对后推算其多样性可达4.8×107,如果再加上H链与λ链的随机配对其多样性应更多了。
第五节 抗体的制备
为了研究抗体的理化性质、分子结构与功能,以及应用抗体于临床疾病的诊断、治疗及预防都需要人工制备抗体。目前,根据制备的原理和方法可分为多克隆抗体、单克隆抗体及基因工程抗体三类。
一、多克隆抗体
大多数抗原是由大分子蛋白质组成,但只是抗原上有限部位的特殊分子结构能与其相应抗体结合,称此部位为抗原决定簇(antigenic determinant)或表位(epitope)。
一种天然抗原性物质(如细菌或其分泌的外毒素以及各种组织成分等)往往具有多种不同的抗原决定簇,而每一决定簇都可刺激机体一种抗体形成细胞产生一种特异性抗体。
在机体淋巴组织内可存在千百种抗体形成细胞(即B细胞),每种抗体形成细胞只识别其相应的抗原决定簇,当受抗原刺激后可增殖分化为一种细胞群,这种由单一细胞增殖形成的细胞群体可称之为细胞克隆(clone)。同一克隆的细胞可合成和分泌在理化性质、分子结构、遗传标记以及生物学特性等方面都是完全相同的均一性抗体,亦可称之为单克隆抗体。
在早期传统的抗体制备方法是将一种天然抗原经各种途径免疫动物,由于抗原性物质具有多种抗原决定簇,故可刺激产生多种抗体形成细胞克隆,合成和分泌抗各种决定簇抗体分泌到血清或体液中,故在其血清中实际上是含多种抗体的混合物,称这种用体内免疫法所获得的免疫血清为多克隆抗体,也是第一代抗体。由于这种抗体是不均一的,无论是对抗体分子结构与功能的研究或是临床应用都受到很大限制,因此如何能获得均一性抗体成为关注的问题。
二、单克隆抗体
体内免疫法很难获得单克隆抗体(monoclonal antibody,McAb)。如能将所需要的抗体形成细胞选出并能在体外进行培养即可获得已知特异的单克隆抗体。1975年德国学者Kohler和英国学者Milstein将小鼠骨髓瘤细胞和经绵羊红细胞(sheep rue blood cell),SRBC)免疫的小鼠脾细胞在体外进行两种细胞融合,结果发现部分形成的杂交细胞既能继续在体外培养条件下生长繁殖又能分泌抗SRBC抗体,称这种杂交细胞系为杂交瘤(hybridoma)。这种杂交瘤细胞既具有骨髓瘤细胞能大量无限生长繁殖的特性,又具有抗体形成细胞合成和分泌抗体的能力。它们是由识别一种抗原决定簇的细胞克隆所产生的均一性抗体,故称之为单克隆抗体。应用杂交瘤技术可获得几乎所有抗原的单克隆抗体,只要这种抗原能引起小鼠的抗体应答。
这种用杂交瘤技术制备的单克隆抗体可视为第二代抗体。
单克隆抗体由于纯度高、特异性强、可以提高各种血清学方法检测抗原的敏感性及特异性,但单克隆抗体多为双价抗体,与抗原结合不易交联为大分子集团,故不易出现沉淀反应。单克隆抗体的应用大促进了对各种传染病和恶性肿瘤诊断的准确性。
单克隆抗体亦可与核素、各种毒素(如白喉外毒素或篦麻毒素)或药物通过化学偶联或基因重组制备成导向药物(targetting drug)用于肿瘤的治疗,是一种新型免疫治疗方法,有可能提高对肿瘤的疗效。
单克隆抗体亦可用于对各种免疫细胞及其它组织细胞表面分子的检测,这对免疫细胞的分离、鉴定及分类及研究各种膜表面分子的结构与功能都具有重要意义。
三、基因工程抗体
自1975年单克隆抗体杂交瘤技术问世以来,单克隆体在医学中被广泛地应用于痢疾的诊断及治疗。但目前绝大数单克隆抗体是鼠源的,临床重复给药时体内产生抗鼠抗体,使临床疗效减弱或消失。因此,临床应用理想的单克隆抗体应是人源的,但人-人杂交瘤技术目前尚未突破,即使研制成功,也还存在人-人杂交瘤体外传代不稳定,抗体亲合力低及产量不高等问题。目前较好的解决办未能是研制基因工程抗体,(genetically engineering antibody)以代替鼠源单克隆抗体用于临床。
基因工程抗体兴起于80年代早期。这一技术是将对Ig基因结构与功能的了解与DNA重组技术相结合,根据研究者的意图在基因水平对Ig分子进行切割、拼接或修饰,甚至是人工全合后导入受体细胞表达,产生新型抗体,也称为第三代抗体。
基因工程抗体包括嵌合抗体、重构抗体、单链抗体、单区抗体及抗体库等。其中以嵌合抗体研究的较多,也较成熟。单链抗体及单区抗体虽具有结构简单、分子小等优点但其临床应用的前景尚待证实。
第三章 补体系统
在血液或体液内除Ig分子外,还发现另一族参予免疫效应的大分子,称为补体分子。早在19世纪末,发现在新鲜免疫血清内加入相应细菌,无论进行体内或体外实验,均证明可以将细菌溶解,将这种现象称之为免疫溶菌现象。如将免疫血清加热60°C30分钟则可丧失溶菌能力。进一步证明免疫血清中含有二种物质与溶菌现象有关,即对热稳定的组分称为杀菌素,即抗体(complement,C)。其后又证实了抗各种动物红细胞的抗体加入补体成分亦可引起红细胞的溶解现象。自此建立了早期的补体概念。即补体为正常血清中的单一组分,它可被抗原与抗体形成的复合物所活化,产生溶菌和溶细胞现象。而单独的抗体或补体均不能引起细胞溶解现象。
第一节 补体系统的组成和理化性质
一、补体分子的组分和命名
进入60年代后,由于蛋白质化学和免疫化学技术的进步,自血液中分离、纯化补体成分成功,现已证明补体是单一成分的论点是不正确的,它是由三组球蛋白大分子组成。即第一组分是由9种补体成分组成,分别命名为C1、C2、C3、C4、C5、C6、C7、C8、C9。其中C1是由三个亚单位组成,命名为Clq、Clr、Cls,因此第一组分是由11种球蛋白大分子组成。在70年代又发现一些新的血清因子参予补体活化,但它们不是经过抗原抗体复合物的活化途径。而是通过旁路活化途径。这此些因子包括B因子、D因P因子,它们构成补体的第二组分。其后又发现多种参矛控制补体活化的抑制因子或灭活因子,如CI抑制物、I因子、H因子、C4结合蛋白、过敏毒素灭活因子等。这些因子可控制补体分子的活化,对维持补体在体内的平衡起调节作用,它们构成了补体的第三组分。
由于补体活化另一途径的深入研究,对补体系统的生物学意义有了新的识别,从而打破了对补体的传统观点,建立了新的概念。即补体系统是由将近20多种血清蛋白组成的多分子系统,具有酶的活性和自我调节作用。它至少有二种不同的活化途径,其生物学意义不仅是抗体分子的辅助或增强因子,也具有独立的生物学作用,对机体的防御功能、免疫系统功能的调节以及免疫病理过程都发挥重要作用。
1968年世界卫生组织(WHO)的补体命名委员会对补体进行了统一命名。分别以C1……C9命名,1981年对新发现的一些成分和因子也进行了统一命名。每一补体的肽链结构用希腊字母表示,如C3a和β链等。每一分子的酶解断片可用小写英文字母表示如C3a和C3b等酶解断片,具有酶活性分子可在其上画横线表示之,如C1为无酶活性分子,而C1为有酶活性分子。对具有酶活性的复合物则应用其断片表示,如C3转化酶可用C4b,2a表示。
表3-1 WHO对部分补体成分的命名(1981)
| 统一名称 | 曾用名称 |
| B因子 | C3激活剂前体,热稳定因子等 |
| D因子 | C3激活剂前体转化酶,GBGase等 |
| P因子 | 备解素 |
| H因子 | C3bINA促进因子 |
| I因子 | C3b灭活因子,KAF等 |
补体分子是分别由肝细胞、巨噬细胞以及肠粘膜上皮细胞等多种细胞产生的。其理化性质及其在血清中的含量差异甚大。全部补体分子的化学组成均为多糖蛋白,各补体成分的分子量变动范围很大,其中C4结合蛋白的分子量最大,为55万,D因子分子量最小仅为2.3万。大多数补体成分的电泳迁移率属β球蛋白,少数属a球蛋白及γ球蛋白。血清中补体蛋白约占总球蛋白的10%,其中含量最高的为C3,约含1mg/ml,而D因子仅含1μg/ml,二者相差约千倍。人类某些疾病其总补含量或单一成分含量可发生变化,因而对体液中补体水平的测定,或组织内补体定位观察,对一些疾病的诊断具有一定意义。
二、补体的理化性质
补体系统中各成分的理化性状概括列于表3-2。由表见,补体成分大多是β球蛋白,少数几种属a或γ球蛋白,分子量在25~390KD之间。在血清中的含量以C3为最高,达1300μg/ml,其次为C4、S蛋白和H因子,各约为C3含量的1/3;其他成分的含量仅为C3的1/10或更低。
补体成分的产生部位如表3-3所示,其中C7的产生部位尚不清楚。
表3-2 补体系统各成分的理化性状
| 补体成分 | 分子量(KD) | 电泳区带 | 肽链数目 | 血清含量 | 裂解片段 |
| Clq | 390 | γ2 | 18 | 70 | |
| Clr | 95 | β | 1 | 35 | |
| Cls | 85 | α | 1 | 35 | |
| C2 | 117 | β1 | 1 | 30 | C2a,C2b |
| C3(A因子) | 190 | β1 | 2 | 1300 | C3a,C3b C3c,C3d |
| C4 | 180 | β2 | 3 | 430 | C4a,C4b C4c,C4d |
| C5 | 190 | β1 | 2 | 75 | C5a,C5b |
| C6 | 128 | β2 | 1 | 60 | |
| C7 | 120 | β2 | 1 | 55 | |
| C8 | 163 | γ1 | 3 | 55 | |
| C9 | 79 | α | 1 | 200 | |
| B因子(C3PA) | 95 | β | 1 | 240 | Ba,Bb |
| D因子(C3PA酶原) | 25 | α | 1 | 2 | |
| P因子(备解素) | 220 | γ2 | 4 | 25 | |
| C1INH | 105 | α | 1 | 180 | |
| C4bp | 1100 | 6~8 | 250 | ||
| I因子(C3bINA) | 93 | β | 2 | 50 | |
| H因子(β1H) | 150 | β | 1 | 400 | |
| S蛋白 | 80 | α | 1 | 500 |
表3-3 补体系统各成分产生部位
| 补体成分 | 产生部位 |
| C1 | 小肠上皮细胞、脾、巨噬细胞 |
| C2 | 巨噬细胞 |
| C3 | 巨噬细胞、肝 |
| C4 | 巨噬细胞、肝 |
| C5 | 巨噬细胞 |
| C6 | 肝 |
| C7 | ? |
| C8 | 肝 |
| C9 | 肝 |
| B因子 | 巨噬细胞、肝 |
| D因子 | 巨噬细胞、血小板 |
| P因子 | 巨噬细胞 |
| I因子 | 巨噬细胞 |
| H因子 | 巨噬细胞、血小板 |
第二节 补体系统的激活
补体系统各成分通常多以非活性状态存在于血浆之中,当其被激活物质活化之后,才表现出各种生物学活性。补体系统的激活可以从C1开始;也可以越过C1、C2、C4,从C3开始。前一种激活途径称为经典途径(classical pathway)或替代途径。“经典”,“传统”只是意味着,人们早年从抗原体复合物激活补体的过程来研究补体激活的机制时,发现补体系统是从C1开始激活的连锁反应。从种系发生角度而言,旁路途径是更为古老的、原始的激活途径。从同一个体而言,在尚未形成获得性免疫,即未产生抗体之前,经旁路途径激活补体,即可直接作用于入侵的微生物等异物,作为非特异性免疫而发挥效应。由于对旁路途径的认识,远远晚在经典之后,加上人们先入为主观念,造成了命名的不合理。
一、经典激活途径
参与补体经典激活途径的成分包括C1~C9。按其在激活过程中的作用,人为地分成三组,即识别单位(Clq、Clr、Cls)、活化单位(C4、C2、C3)和膜攻击单位(C5~C9),分别在激活的不同阶段即识别阶段、活化阶段和膜功击阶段中发挥作用。
(一)识别阶段
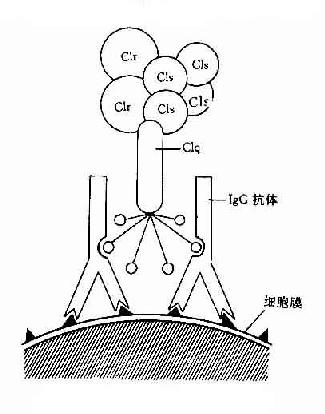
图3-1 CIq示意图
C1与抗原抗体复合物中免疫球蛋的补体结合点相结合至C1酯酶形成的阶段。
C1是由三个单位Clq、Clr和Cls依赖Ca+结合成的牢固的非活性大分子。
Clq:Clq分子有6个能与免疫球蛋白分子上的补体结合点相结合的部位。当两个以上的结合部位与免疫球蛋白分子结合时,即Clq桥联免疫球蛋白之后,才能激活后续的补体各成分(图3-1)IgG为单体,只有当其与抗原结合时,才能使两个以上的IgG分子相互靠拢,提供两个以上相邻的补体结合点不能与Clq接触,只有当IgM与抗原结合,发生构型改变,暴露出补体结合部位之后,才能与Clq结合。一个分子的IgM激活补体的能力大于IgG。Clq与补体结合点桥联后,其构型发生改变,导致Clr和Cls的相继活化。
Clr:Clr在C1大分子中起着连接Clq和Cls的作用。Clq启动后可引起Clr构型的改变,在活性的Clr,后者可使Cls活化。
Cls:Clr使Cls的肽链裂解,其中一个片段Cls具有酯酶活化,即CI的活性。此酶活性可被C1INH灭活。
在经典途径中,一旦形成Cls,即完成识别阶段,并进入活化阶段。
(二)活化阶段
CI作用于后续的补体成分,至形成C3转化酶(C42)和C5转化酶(C423)的阶段。
C4:C4是CI的底物。在Mg2+存在下,CI使C4裂解为C4a和C4b两个片段,并使被结合的C4b迅速失去结合能力。CI与C4反应之后能更好地显露出CI作用于C2的酶活性部位。
C2:C2虽然也是CI的底物,但CI先在C4作用之后明显增强了与C2的相互作用。C2在Mg2+存在下被CI裂解为两个片段C2a和C2b。当C4b与C2a结合成C4b2b(简写成C42)即为经典途径的C3转化酶。
C3:C3被C3转化酶裂解在C3a和C3b两个片段,分子内部的疏酯基(-S-CO-)外露,成为不稳定的结合部位。硫酯基经加水分解,成为-SH和-COOH也可与细菌或细胞表面的-NH2和-OH反应而共价结合。因此,C3b通过不稳定的结合部位,结合到抗原抗体复合物上或结合到C42激活C3所在部位附近的微生物、高分子物质及细胞膜上。这点,对于介导调理作用和免疫粘附作用具有重要意义。C3b的另一端是个稳定的结合部位。C3b通过此部位与具有C3b受体的细胞相结合(图3-2)。C3b可被I因子灭活。C3a留在液相中,具有过敏毒素活性,可被羟肽酶B灭活。
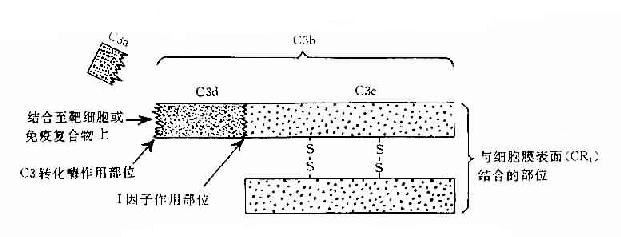
图3-2 C3分子及其裂解产物生物活性示意图
C3b与C42相结合产生的C423(C4b2b3b)为经典途径的C5转化酶。至此完成活化阶段。
(三)膜攻击阶段
C5转化酶裂解C5后,继而作用于后续的其他补体成分,最终导致细胞受损、细胞裂解的阶段。
C5:C5转化酶裂解C5产生出C5a和C5b两个片段。C5a游离于液相中,具有过敏毒素活性和趋化活性。C5b可吸附于邻近的细胞表面,但其活性极不稳定,易于衰变成C5bi。
C6~C9:C5b虽不稳定,当其与C6结合成C56复合物则较为稳定,但此C5b6并无活性。C5b6与C7结合成三分子的复合物C5b67时,较稳定,不易从细胞膜上解离。
C5b67即可吸附于已致敏的细胞膜上,也可吸附在邻近的,未经致敏的细胞膜上(即未结合有抗体的细胞膜上)。C5b67是使细胞膜受损伤的一个关键组分。它与细胞膜结合后,即插入膜的磷脂双层结构中。
若C5b67未与适当的细胞膜结合,则其中的C5b仍可衰变,失去与细胞膜结合和裂解细胞的活性。
C5b67虽无酶活性,但其分子排列方式有利于吸附C8形成C5678。其中C8是C9的结合部位,因此继续形成C5~9,即补体的膜攻击单位,可使细胞膜穿孔受损。
目前已经证明,不C5b、C6、C7结合到细胞膜下是细胞膜仍完整无损;只有在吸附C8之后才出现轻微的损伤,细胞内容物开始渗漏。在结合C9以后才加速细胞膜的损伤过程,因而认为C9是C8的促进因子。(图3-3)。
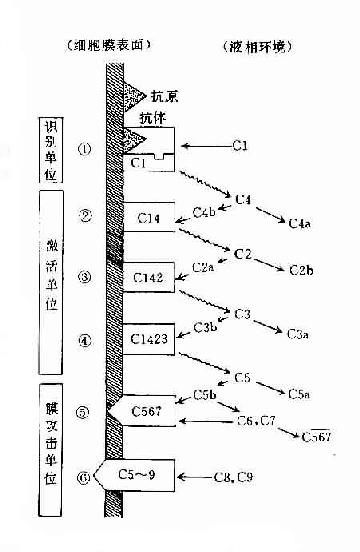
图3-3 经典途径的激活
二、旁路激活途径
旁路激活途径与经典激活途径不同之处在于激活是越过了C1、C4、C2三种成分,直接激活C3继而完成C5至C9各成分的连锁反应,还在于激活物质并非抗原抗体复合物而是细菌的细胞壁成分—脂多糖,以及多糖、肽聚糖、磷壁酸和凝聚的IgA和IgG4等物质。旁路激活途径在细菌性感染早期,尚未产生特异性抗体时,即可发挥重要的抗感染作用。
(一)生理情况下的准备阶段
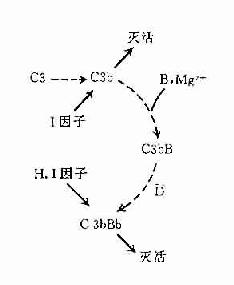
在正常生理情况下,C3与B因子、D因子等相互作用,可产生极少量的C3B和C3bBb(旁路途径的C3转化酶),但迅速受H因子和I因子的作用,不再能激活C3和后续的补体成分(图3-4,左)。只有当H因子和I因子的作用被阻挡之际,旁路途径方得以激活(图3-4,右)。
C3:血浆中的C3可自然地、缓慢地裂解,持续产生少量的C3b,释入液相中的C3b迅速被I因子灭活。
B因子:液相中缓慢产生的C3b在Mg2+存在下,可与B因子结合形成C3Bb。
D因子:体液中同时存在着无活性的D因子和有活性的D因子(B因子转化酶)。D因子作用于C3bB,可使此复合物中的B因子裂解,形成C3bBb和Ba游离于液相中。C3bBb可使C3裂解为C3a和C3b,但烊际上此酶效率不高亦不稳定,H因子可置换C3bBb复合物中的Bb,使C3b与Bb解离,解离或游离的C3b立即被I因子灭活。因此,在无激活物质存在的生理情况下,C3bBb保持在极低的水平,不能大量裂解C3,也不能激活后续补体成分。但是这种C3的低速度裂解和低浓度C3bBb的形成,具有重大意义。可比喻为处于“箭在弦上,一触即发”的状态。
(二)旁路途径的激活
旁路途径的激活在于激活物质(例如细菌脂多糖、肽聚糖;病素感染细胞、肿瘤细胞,痢疾阿米巴原虫等)的出现。目前认为,激活物质的存在为C3b或C3bBb提供不易受H因子置换Bb,不受Ⅰ因子灭活C3b的一种保护性微环境,使旁路激活途径从和缓进行的准备阶段过渡到正式激活的阶段(图3-4)。
·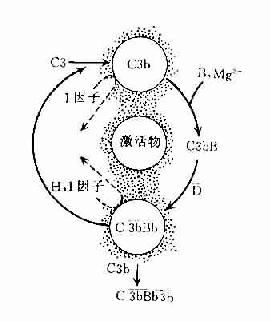
图3-4 旁路途径的激活
左:在正常后理情况下,可产生出少量C3bBb,但迅即被激活。
右:在激活物存在下,C3b不易被I因子灭活,C3bBb中的Bb不易被H因子置换,使激活过程得以进行。
P因子:P因子旧称备解素(properdin)。正常血浆中也有可以互相转换的两种P因子,P和P。C3bBb的半衰期甚短,当其与P因子结合成为C3bBbP时,半衰期可延长。这样可以获得更为稳定的、活性更强的C3转化酶。
C3bBb3b:C3bBb与其裂解C3所产生的C3b可进一步形成多分子复合物C3bBb3b。C3bBb3b像经典途径中的C5转化酶C423一样,也可使C5裂解成C5a和C5b。后续的C6~C9各成分与其相互作用的情况与经典途经相同。
(三)激活效应的扩大
C3在两条激活途径中都占据着重要的地位。C4是血清中含量最多的补体成分,这也正是适应其作用之所需。不论在经典途径还是在旁路途径,当C3被激活物质激活时,其裂解产物C3b又可在B因子和D因子的参与作用下合成新的C3bBb。后者又进一步使C3裂解。由于血浆中有丰富的C3,又有足够的B因子和Mg2+,因此这一过程一旦被触发。就可能激活的产生显著的扩大效应。有人称此为依赖C3Bb的正反馈途径,或称C3b的正反馈途径(图3-5)。
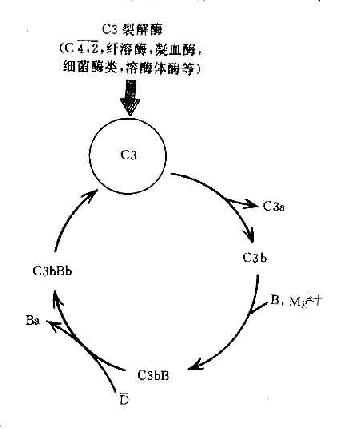
图3-5 C3b的正反馈途径
三、两条激活途径的比较
补体的两条激活途径有共同之处,又有各自的特点。在补体激活过程中,两条途径都是补体各成分的连锁反应,许多成分在相继活化后被裂解成一大一小两个片段;不同的片段或片段的复合物可在靶细胞表面向前移动,如C42,C423,C5b,C567,虽亦可原始的激活部位就地形成复合物,但仍以移动为主,在激活过程中,补体成分和(或)其裂解产物组成更大的复合物,同时又都在扩大其激活效应,这一过程可形象地比喻为“滚雪球”。
两条途径的不同之处参见表3-4及图3-6。
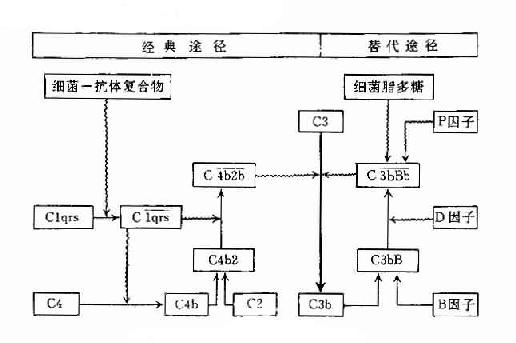
图3-6 两条激活途径的比较
表3-4 两条激活途径的主要不同点
| 比较项目 | 经典活途径 | 旁路激活途径 |
| 激活物质 | 抗原与抗体(IgM、IgG3、IgG1、IgG2)形成的复合物 | 细胞脂多糖、凝聚的IgG、IgA等 |
| 参与的补体成分 | C1~C9 | C3,C5~C9,B因子,D因子,P因子等 |
| 所需离子 | Ca2+,Mg2+ | Mg2+ |
| C3转化酶 | C42(C4b2b) | C3bBb |
| C5转化酶 | C423(C4b2b3b) | C3bBb3b |
| 作用 | 参与特异性体液体免疫的效应阶段 | 参与非特异性免疫,在感染早期即发挥作用 |
四、补体激活过程的调节
机体通过一系列的复杂的因素,调节补体系统的激活过程,使之反应适度。例如经C3b的正反馈途径即可扩大补体的生物学效应。但补体系统若过度激活,不仅无益地消耗大量补体成分,使机体抗感染能力下降;而且在激活过程中产生的大量行物活性物质,会使机体发生剧烈的炎症反应或造成组织损伤,引起病理过程。这种过度激活及其所造成的不良后果,可通过调控机制而避免。这种调控机制包括补体系统中某些成分的裂解产物易于自行衰变以及多种灭活因子和抑制物的调节作用。
(一)自行衰变调节
某些补体成分的裂解产物极不稳定,易于自行衰变,成为补体激活过程中的一种自控机制。例如C42复合物中的C2b自行衰变即可使C42不再能持续激活C3,从而限制了后续补体成分的连锁反应。C5b亦易于自行衰变,影响到C6~C9与细胞膜的结合。
(二)体液中灭物质的调节
血清中含有多种补体成分的抑制或灭活特定的补体成分。
CI抑制物:CI抑制物(Ci inhibitor,CIINH)可与CI不可逆地结合,使后者失去酯酶活性,不再裂解C4和C2,即不再形成C42(C3转化酶),从而阻断或削弱后续补体成分的反应。遗传性CIINH缺陷的患者,可发生多以面部为中心的皮下血管性水肿,并常以消化道或呼吸道粘膜的局限性血管性水肿为特征。其发生机制是CI未被抑制,与C4、C2作用后产生的C2a(旧称C2b的小片段)为补体激肽,或增强血管通透性,因而发生血管性肿。
CIINH缺陷时,C4、C2接连不断地被活化,故体内C4、C2水平下降;因其不能在固相上形成有效的C42(C3转化酶),所以C3及其后续成分不被活化。因此本病不像C3~C8缺陷那样容易发生感染。
大部分CIINH缺陷病人与遗传有关,另有约15%的病人无遗传史,其CIINH虽有抗原性但无活性(部分可产生正常CIINH,并非完全缺陷)。前者称为I型血管性水肿,后者称为Ⅱ型血管性水肿(Alsenz等,1987)。
血管性水肿可用提纯的CIINH治疗,据称有效,亦可给以男性激素制剂以促进肝合成CIINH,预防水肿的发生。
C4结合蛋白:C4结合蛋白(C4 binding protein, C4bp)能竞争性地抑制C4b与C2b结合,因此能抑制C42(C3转化酶)的形成。
I因子:I因子又称C3b灭活因子(C3b inactivator, C3b INA)能裂解C3b,使其成为无活性的C3bi,因而使C42及C3bBb失去与C3b结合形成C5转化酶的机会。
当遗传性I因子缺陷时,C3b不被灭活而在血中持续存在,可对旁路途径呈正反馈作用,陆续使C3裂解并产生出更多的C3b。因此血中C3及B因子的含量因消耗而降低。当发生细菌性感染时,因补体系统主要成分C3和B因子严重缺乏,削弱了抗感染作用,可因条件致病菌惹发严重的甚至致命性后果。
H因子:H因子虽能灭活C3b,但不能使C3bBb中的C3b灭活。H因子(factor H)不仅能促进I因子灭活C3b的速度,更能竞争性地抑制B因子与C3b的结合,还能使C3b从C3bBb中致换出来,从而加速C3bBb的灭活。由此可见,I因子和H因子在旁路途径中,确实起到重要的调节作用。
S蛋白:S蛋白(Sprotein)能干扰C5b67与细胞膜的结合。C5b67虽能与C8、C9结合,但它若不结合到细胞膜(包括靶细胞的邻近的其他细胞)上,就不会使细胞裂解。
C8结合蛋白:C8结合蛋白(C8binding protein,C8bp)又称为同源性限制因子(homologousrestriction factor,HRF)。C56与C7结合形成C567即可插入细胞膜的磷脂双层结构之中,但两者结合之前,可在体液中自由流动。因此,C567结合的细胞膜不限于引起补体激活的异物细胞表面,也有机会结合在自身的细胞上,再与后续成分形成C5~9大分子复合物,会使细胞膜穿孔受损。这样会使补体激活部位邻近的自身细胞也被殃及。
C8bp可阻止C5678中的C8与C9的结合,从而避危及自身细胞膜的损伤作用。C8分子与C8bp之间的结合有种属特异性,即C5678中的C8与同种C8bp反应;但与异性种动物的C8不反应,所以又称为HRF。据称C8bp也能抑制NK细胞和Tc细胞的杀伤作用,值得注意。
第三节 补体受体及其免疫学功能
补体成分激活后产生的裂解片段,能与免疫细胞表面的特异性受体结合。这对于补体发挥其生物学活性具有重要意义。
补体受体(complementruceptor,CR)曾按其所结合配体而命名为C3b受体、C3d受体等;但经详细研究后发现,补体受体并非仅与C3裂解产物反应,因而按其发现先后依次命名为CR1(CD35),CR2(CD21),CR3(CD11b/CD18),CR4(gp150,90:CD11c/CD18)。其主要特征列于表3-5。此外,尚有其他补体成分的受体,如Ciq受体、C3a受体、C5a受体等。因对其了解不够清楚,不拟介绍。
表3-5 补体受体的特征
| 名称 | 别名 | CD分类 | 配体特异性 | 细胞分布 |
| CR1 | IA受体 C3b受体 C4B/C3b受体 |
CD35 | C3bi、C3b C4b、iC4b C3c |
红细胞、中性粒细胞 单核细胞、巨噬细胞 B细胞、树突状细胞 肾小球上皮细胞 |
| CR2 | C3d受体 EB病毒受体 |
CD21 | Ic3b、C3dg C3d、EB病毒、 1FN-α |
B细胞、树突状细胞 |
| CR3 | iC3b受体 Mac-1抗原 |
CD11b/CD18 | IC3b、植物凝集素、某些细胞多糖 | 中性粒细胞、单核细胞、巨噬细胞、树突状细胞、NK细胞 |
| CR4 | gp150/95 | CD11C/CD18 | Ic3b、C3d、C3dg | 中性粒细胞、单核细胞、巨噬细胞、血小板 |
一、CR1(CD35)
CR1作为免疫粘附(immuneadherent,IA)受体而引起免疫粘附现象早已熟知。此受体也称为C3b受体或C3b/C4b受体。据报道,红细胞上的CR1数约为50~1400个/细胞,其数目显着少于B细胞和吞噬细胞,但体内90%的CR1却存于红细胞上。
提纯的CR1为分子量约200kD的糖蛋白,但后来发现它有4种分子量不同的同种异型。最近,Wong等(1986)已经阐明,分子量的差异是由于基因不同所致。
CR1的免疫功能可能有以下几方面:①中性粒细胞和单核-巨噬细胞上的CR1,可与结合在细菌或病毒上的C3b结合,促进吞噬细胞的吞噬作用;②促进两条激活途径中的C3转化酶(C42),C3bBb)的激活;③作为I因子的辅助因子,促使C3b和C4b灭活;④红细胞上的CR1可与被调理(结合有C3b)的细胞、病毒或免疫复合物等结合,以便运送到肝、脾进行处理,SLE病人免疫复合物量明显增多,其红细胞膜上的CR1在体内有运送免疫复合物的作用;⑤B淋巴细胞膜上的CR1与CR2协同作用下,可促使B细胞活化。
二、CR2(CD21)
CR2旧称C3d受体,已经证明,它是B细胞上的EB病毒受体。CR2配体按其亲和性的高低程度依次为C3dg、C3d、Ic3b。C3b亲和性虽低,但亦可与其反应。
CR2的免疫功能尚未阐明清楚,但实验表明,当加入CR2配体时可使B细胞活化。据此推想,在抗体的二次应答中它也许会想某种作用,即借结合在抗原复合物上的C3裂解产物,引起针对该抗原的二次抗体应答。
三、CR3(CD11b/CD18)
CR3亦称为Ic3b受体,CR3的配体是iC3b,但CR1、CR2、也和iC3b反应。CR3与配体结合时尚需有二价离子存在,为其特点。
CR3是由分子量165kD的α链(CD11b)和95kD的β链(CD18)非共价结合的糖蛋白,识别此分子的单克隆抗体有Mac-1和Mo-1等。CR3与CR4(CD11C/CD18)有共同的β链,因此其功能也多有相似之处,白细胞粘附缺陷病(leucocyteadhesion deficiency)病人缺乏这种共同的β链。病人的中性粒细胞虽正常,但不能停留在感染的部位,因此病人易反复遭受感染。这表明CR3和CR4均与吞噬功能密切相关。
四、CR4(gp150/95,CD11c/CD18)
中性粒细胞和单核-巨噬细胞高度表达本受体。其配体为iC3b,但针对其他补体受体的单克隆抗体不能阻断CR4与iC3b的结合,证明CR4的存在。CR4与gp150/95为同一分子,对其功能尚有诸多不明之处。据认为CR4在排除组织内与iC3b的结合的颗粒上起作用。它和CR3一样,与配体结合需有二价离子的存在。CR3很可能在机体防御上有重要作用。
第四节 补体的生物学活性
补体系统是人和某些动物种属,在长期的种系进化过程中获得的非特异性免疫因素之一,它也在特异性免疫中发挥效应,它的作用是多方面的。补体系统的生物学活性,大多是由补体系统激活时产生的各种活性物质(主要是裂解产物)发挥的。补体成分及其裂解产物的生物活性列于表3-6。
| 补体成分或裂解产物 | 生物活性 | 作用机制 |
| C5~C9 | 细胞毒作用溶菌、杀菌作用 | 嵌入细胞膜的磷脂双层结构中,使细胞膜穿孔、细胞内容物渗漏 |
| C3b | 调理作用 | 与细菌或细胞结合使之易被吞噬 |
| C3b | 免疫粘附作用 | 与抗原抗体复合物结合后,粘附于红细胞或血小板,使复合物易被吞噬 |
| C1、C4 | 中和病毒作用 | 增强抗体的中和作用,或直接中和某些RNA肿瘤毒 |
| C2a | 补体激肽 | 增强血管通透性 |
| C3a、C5a | 过敏毒素 | 与肥大细胞或嗜碱性粒细胞结合后释放同组胺等介质,使毛细胞血管扩张 |
| C3a、C5a | 趋化因子 | 借其梯度浓度吸引中性粒细胞及单核细胞 |
一、细胞毒及溶菌、杀菌作用
补体能溶解红细胞、白细胞及血小板等。当补体系统的膜攻击单位C5~C9均结合到细胞膜上,细胞会出现肿胀和超威结构的改变,细胞膜表面出现许多直径为8~12mm的圆形损害灶,最终导致细胞溶解。
补体还能溶解或杀伤某些革兰氏阴性菌,如霍乱弧菌、沙门氏菌及嗜血杆菌等,革兰氏阳性菌一般不被溶解,这可能与细胞壁的结构特殊或细胞表面缺乏补体作用的底物有关。
二、调理作用
补体裂解产物C3b与细菌或其他颗粒结合,可促进吞噬细胞的吞噬,称为补体的调理作用。C3裂解产生出的C3b分子,一端能与靶细胞(或免疫复合物)结合;其另一端能与细胞表面有C3b受体的细胞(单核细胞、巨噬细胞、中性粒细胞等)结合,在靶细胞与吞噬表面之间起到桥染作用,从而促进了吞噬。LgG类抗体借助于吞噬细胞表面的lgG-Fe受体也能起到调理作用;为区别于补体的调理作用而称其为免疫(抗体)的调理作用。LgM类抗体本身起调理作用,但在补体参与下才能间接起到调理作用。
三、免疫粘附作用
免疫复合物激活补体之后,可通过C3b而粘附到表面有C3b受体的红细胞、血小板或某些淋巴细胞上,形成较大的聚合物,可能有助于被吞噬清除。
四、中和及溶解病毒作用
在病毒与相应抗体形成的复合物中加入补体,则明显增强抗体对病毒的中和作用,阻止病毒对宿主细胞的吸附和穿入。
近年来发现,不依赖特异性抗体,只有补体即可溶解病毒的现象。例如RNA肿瘤病毒及C型RNA病毒均可被灵长类动物的补体所溶解。据认为这是由于此类病毒包膜上的Cl受体结合Clq之后所造成的。
五、炎症介质作用
炎症也是免疫防御反应的一种表现。感染局部发生炎症时,补体裂解产物可使毛细血管通透性增强,吸引白细胞到炎症局部。
(一)激肽样作用
C2a能增加血管通透性,引起炎症性充血,具有激肽样作用,故称其为补体激肽。前述Ci INH先天性缺陷引起的遗传性血管神经水肿即因血中C2a水平增高所致。
(二)过敏毒素作用
C3a、C5a均有过敏毒素作用,可使肥大细胞或嗜碱性粒细胞释放组胺,引起血管扩张,增加毛细血管通透性以及使平滑肌收缩等。
C3a、C5a的过敏毒素活性,可被血清中的羧肽酶B(过敏毒素灭活因子)所灭活。
(三)趋化作用
C5a有趋化作用,故又称为趋化因子,能吸引具有C5a受体的吞噬细胞游走到补体被激活(即趋化因子浓度最高)的部
第五节 血清补体水平与疾病
人血清补体含量相对稳定,只在患某些疾病时,血清补体总量或各成分含量才可能发生变动。目前可以根据补体的溶血活性测定其总含量,亦可用免疫扩散法定某些补体成分的含量。
恶性肿瘤等少数疾病病人血清补体总量可较正常人高2~3倍,对其意义并不清楚。在某些传染病中亦可见到代偿性增高。
血清补体总量低于正常值者,称为低补体血症。低补体血症可见于以下几种情况:①补体成分的大量消耗:可发生在血清病、链球菌感染后肾小球肾炎、系统性红斑狼疮、自身免疫性溶血性贫血、类风湿性关节炎及同种异体移植排斥反应等。在这些疾病,除补体总量下降外,尚可伴有Clq、C4、C2、C3及C5各成分的减少。②补体的大量丢失,多见于外伤、手术和大失血的病人。补体成分随血清蛋白的扩大量丧失而丢失,发生低补体血症。③补体合成不足:主要见于肝病人,例如肝硬化、慢性活动性肝炎和急性肝炎的重症病例。
第四章 细胞因子
第一节 细胞因子的概述
一、胞因子的概念
机体的免疫细胞和非免疫细胞能合成和分泌小分子的多肽类因子,它们调节多种细胞生理功能,这些因子统称为细胞因子(cytokines)。细胞因子包括淋巴细胞产生的淋巴因子和单核巨噬细胞产生的单核因子等。目前已知白细胞介素(interleukin,IL),干扰素(interferon,IFN)、集落刺激因子(colony stimulating factor,CSF)、肿瘤坏死因子(tumornecrosis factor,TNF)、转化生长因子(transforming growth foctor,TGF-β)等均是免疫细胞产生的细胞因子,它们在免疫系统中起着非常重要的调控作用,在异常情况下也会导致病理反应。
研究细胞因子有助于阐明分子水平的免疫调节机制,有助于疾病的预防、诊断和治疗,特别是利用细胞因子治疗肿瘤、感染、造血功能障碍、自身免疫病等,已收到初步疗效,具有非常广阔的应用前景。
二、细胞因子的命名
(一)白细胞介素
在1979年第二届淋巴因子的国际会议上,将介导白细胞间相互作用的一些细胞因子命名为白细胞介素(IL),并以阿拉伯数字排列,如IL-1、IL-2、IL-3。随着分子免疫学的研究进展,不断有新的IL被命名,迄今已正式命名到IL-15,可以预期,还会有更多的IL被发现。目前的研究发现,许多IL不仅介导白细胞相互作用,还参与其它细胞的相互作用,如造血干细胞、血管内皮细胞、纤维母细胞、神经细胞、成骨和破骨细胞等的相互作用(表4-1)。
表4-1 白细胞介素的特性(IL)
| IL | 曾用名称 | 产生细胞 | 效应 |
| 1 | 淋巴细胞活化因子(LAF) | 单核巨噬细胞,树突状细胞,纤维母细胞内皮细胞 | T和B细胞的增殖和分化,刺激造血细胞,参予炎症反应 |
| 2 | T细胞生长因子 | 活化的T细胞 | T和B细胞的增殖分化,增强NK细胞,单核细胞杀伤活性 |
| 3 | 多集落刺激因子(multi-CSF) | 活化的T细胞 | 多能造血干细胞增殖,促进肥大细胞,嗜酸,嗜碱性粒细胞增殖与分化 |
| 4 | B细胞刺激因子(BSF-1) B细胞生长因子(BCGF-1) |
活化的T细胞 | B和T细胞增殖,刺激造血祖细胞增殖与分化,诱导lgE、lgG产生 |
| 5 | B细胞生长因子-Ⅱ (BCGF-Ⅱ) |
活化的T细胞 | 促进B细胞增殖与分化,促进嗜酸性粒细胞增殖与分化,诱导lgA产生 |
| 6 | B细胞刺激因子-2(BSF-2) B细胞分化因子(BCDF) |
淋巴细胞 单核细胞 纤维母细胞 |
促进B细胞分化、促进肝细胞产生急性期蛋白,抑制乳腺癌细胞、刺激骨髓瘤细胞、刺激造血细胞,参与炎症 |
| 7 | 淋巴细胞生素(LPO) | 骨髓及胸腺基质细胞 | 促进前T、前B细胞增殖,促进成熟T细胞生长,促进血小板生成 |
| 8 | 中性粒细胞趋化因子(NCF) 粒细胞活化因子(NAF) |
单核巨噬细胞 血管内皮细胞 |
中性粒细胞活化和趋化作用,T细胞趋化作用,促进血管生成,参与炎症 |
| 9 | P40 肥大细胞生长增强活性T 细胞生长因子(TCGFⅢ) |
活化的T 细胞 | 促进TH产生细胞因子,促进肥大细胞增殖,刺激造血细胞 |
| 10 | 细胞因子合成抑制因子(CSIF) | 活化的T细胞,B细胞单核巨噬细胞 | 抑制TH产生细胞因子,促朝进胸腺细胞增殖,促进B细胞增殖 |
| 11 | (一) | 骨髓基质细胞 | 促进B细胞分化,刺激造血细胞,促进血小板生成 |
| 12 | 细胞毒性淋巴细胞成熟因子(CLMF) | B细胞 | 促进TC,NK,LAK细胞杀伤功能,透导细胞免疫 |
| 13 | P600 | 活化的T细胞 | 抑制细胞因子分泌和表达,刺激B细胞增殖和CD23表达,透导lgE产生 |
(二)集落刺激因子
在进行造血细胞的体外研究中,发现一些细胞因子可刺激不同的造血干细胞在半固体培养基中形成细胞集落,这类因子被命名为集落刺激因子(CSF)。根据它们的作用范围,分别命名为粒细胞CSF(G-CSF),巨噬细胞CSF(M-CSF),粒细胞和巨噬细胞CSF(GM-CSF)和多集落刺激因子(multi-CSF,又称IL-3)。不同发育阶段的造血干细胞起促增殖分化的作用,是血细胞发生必不可少的刺激因子。广义上,凡是刺激造血的细胞因子都可统称为CSF,例如刺激红细胞生成素(erythropoictin,Epo)、刺激造血干细胞的干细胞因子(stem cellfactor,SCF)、可刺激胚胎干细胞的白血病抑制因子(leukemia inhibitory factor,LIF)等均有集落刺激活性。此外,CSF也作用于多种成熟的细胞,促进其功能具有多相性的作用(表4-2)。
表4-2 集落刺激因子的特性
| 细胞因子 | 产生细胞 | 效应 |
| Multi-CSF | 活化的T细胞 | 刺激造血干细胞增殖,促进肥大细胞,嗜酸、嗜碱粒细胞增殖分化 |
| GM-CSF | 活化的T细胞,巨噬细胞,纤维母细胞等 | 刺激粒细胞,巨噬细胞集落形成刺激粒细胞功能 |
| G-CSF | 纤维母细胞,骨髓基质细胞,膀胱癌细胞株等 | 刺激粒细胞集落,刺激粒细胞功能 |
| M-CSF | 巨噬细胞 | 刺激巨噬细胞集落、刺激粒细胞功能,降低血胆固醇 |
| SCF | 纤维母细胞,骨髓和胸腺的基质细胞 | 刺激髓系、红系、巨核系及淋巴系造血祖细胞 |
| Epo | 肾细胞 | 刺激红系造血祖细胞 |
| LIF | 基质细胞、单核细胞 | 促进某些白血病细胞株的分化促进胚胎干(ES)细胞的增殖,抑制ES细胞的分化 |
(三)干扰素
干扰素(IFN)是最先发现的细胞因子,早在1957年,lssacs等人发现病毒感染的细胞产生一种因子,可抵抗病毒的感染,干扰病毒的复制,因而命名为干扰素。根据其来源和结构,可将IEN分为IFN-α、IFN-β、IFN-γ,它们分别由白细胞、纤维母细胞和活化T细胞产生。IFN-α为多基因产物,有十余种不同亚型,但它们的生物活性基本相同。IFN除有抗病毒作用外,还有抗肿瘤、免疫调节、控制细胞增殖及引起发热等作用。
(四)肿瘤坏死因子
TNF是一类能直接造成肿瘤细胞死亡的细胞因子,根据其来源和结构分为两种,即TNF-α和TNF-β.前者由单核巨噬细胞产生;后者由活化的T细胞产生,又名淋巴毒素(lymphotoxin)。TNF除有杀肿瘤细胞作用外,还可引起发热和炎症反应,大剂量TNF-α可引起恶液质,呈进行性消瘦,因而TNF-α又称恶液质素(cac hectin)。
(五)淋巴因子
由活化的淋巴细胞产生的细胞因子都可称为淋巴因子(lymphokine),如IL-2、3、4、5、6、7、8、9、10、11、12、13,TNF-β,IFN-γ等均为淋巴因子。
(六)单核因子
由单核已噬细胞产生的细胞因子统称单核因子(monokine),如IL-1、6、8,TNF-α、IFN-α等。
三、细胞因子的作用特点
目前发现并正式命名的细胞因子有数十种,每种细胞均有其独特的、起主要作用的生物学活性。尽管种类繁多、产生细胞和作用细胞多样、生物学活性广泛、发挥作用的机制不同,但众多的细胞因子具有以下共同的特性:
1.天然细胞因子是由细胞产生的 正常的静息或休止(resting)状态的细胞必须经过激活后才能合成和分泌细胞因子。通常是由抗原、丝裂原或其它刺激物激活免疫细胞和相关细胞,6~8小时后细胞培养上清中即可检测出细胞因子,于24~72小时期间细胞因子水平最高。但是有些细胞株不需外源刺激就可以自发地分泌某些细胞因子。
2.细胞因子的产生和作用具有多向性(pleiotropism)即单一刺激如抗原、丝裂原、病毒感染等可使同一种细胞分泌多种细胞因子,而一种细胞因子由多种不同类型的细胞产生可作用于多种不同类型的靶细胞。
3.细胞因子的合成和分泌过程是一种自我调控的过程通常情况下,细胞因子极少储存,即不以前体形式贮存在细胞内,而是经过适当刺激后迅速合成,一旦合面后便分泌至细胞外以发挥生物学作用,刺激消失后合成亦较快地停止并被迅速降解。
4.为低分子量的分泌型蛋白质常被糖基化。分子量大小不等,大多数为15~30kD,小者仅8~10kD,一般不超过80kD。
5.细胞因子需与靶细胞上的高亲和力受体特异结合后才发挥生物学效应。
6.生物学效应极强 细胞因子在pM(10-12M)水平就能发挥显著的生物学效应。这与细胞因子与靶细胞表面特异性受体之间亲和力极高有关,其解离常数在10-12~10-10M之间。
7.单一细胞因子可具有多种生物学活性,但多种细胞因子也常具有某些相同或相似的生物学活性。
8.主要参与免疫反应和炎症反应影响反应的强度和持续时间的长短。涉及到感染免疫、肿瘤免疫、自身免疫、移植免疫等诸多方面。
9.以非特异性方式发挥生物学作用且不受MHC限制。
10.某种细胞因子对靶细胞作用的强弱取决于细胞因子的局部浓度,靶细胞本身的类型(即作用于自身产生细胞)和旁分泌方式(paracrine,即作用于邻近的靶细胞)短暂性地产生并在局部发挥作用。
11.天然细胞因子大多是在近距离发挥局部作用 大多是通过自分泌方式(autocrine,即作用于自身产生细胞)和旁分泌方式(paracrine,即作用于邻近的靶细胞)短暂性地产生并在局部发挥作用。
12.细胞因子的作用并不是孤立存在的,它们之间通过合成分泌的相互调节,受体表达的相互调控、生物学效应的相互影响而组成细胞因子网络(addidveeffect)也可以取得协同效应(synergy),甚至取得两种细胞因子单用时所不具有的新的独特的效应。
第二节 细胞因子及其受体的结构
一、细胞因子的分子结构
不同细胞因子之间的结构上有很大的差异,一般,多数细胞因子为小分子多肽,分子量不超过60kD,多由100个左右的氨基酸组成。不同细胞因子之间无明显的氨基酸序列的同源性。
多数细胞因子以单体形式存在,少数因子如IL-5、IL-12、M-CSF、TGF-β等以双体形式存在。
给大多数细胞因子带有糖基,但这些糖基多与细胞因子的生物活性无关,可能起延长细胞因子体内半衰期的作用。
二、细胞因子受体
细胞因子都是通过与靶细胞表面高亲合力的特异性受体结合后才能发挥其生物学效应的。细胞因子受体与其它膜表面受体一样,均由3个功能区组成,即膜外区(细胞因子结合区)。跨膜区(疏水性氨基酸富有区)和膜内区(信号传导区)。细胞因子受体存在有单链、双链或三链不同形式的结构。最近的研究发现,有些细胞因子受体共同使用一条多肽链,如IL-3、IL-5和GM-CSF共同使用同一β链,IL-2、IL-4和IL-7共同使用同一γ链。由于细胞因子在受体水平存在相似性,因而会使用共同的信号传导途径,发挥类似的生物学效应。根据细胞因子受体膜外区的氨基酸序列,可将其主要分为三个受体家族:
(一)造血生长因子受体家族(HPR)
大部分细胞因子如IL-2、3、4、5、6、7、9等的受体均属于这一家族,其典型结构特点是含有Trp-Ser-X-Trp-Ser(W-S-X-W-S)的五联保守序列,与细胞因子结合功能密切相关。
(二)lg超家族
IL-1受体、M-CSF受体等属于这一家族,IL-6受体同时含有lg超家族和HPR家族两个结构区。这一超家族的特点是均在膜外区含有lg样的分子构型,每个lg样功能区由100个左右的氨基酸组成,通过二硫键形成稳定的发夹样反平行的β片层折叠结构。
(三)干扰素受体超家族
干扰素α和β共用同一个受体,与干扰素γ受体的结构有类似之外,均含有一段200个氨基酸的保守序列,其中4个半胱氨酸是共有的。
第三节 细胞因子的生物学活性
细胞因子具有非常广泛的生物学活性,包括促进靶细胞的增殖和分化,增强抗感染和细胞杀伤效应,促进或抑制其它细胞因子和膜表面分子的表达,促进炎症过程,影响细胞代谢等。
一、免疫细胞的调节剂
免疫细胞之间存在错综复杂的调节关系,细胞因子是传递这种调节信号必不可少的信息分子。例如在T-B细胞之间,T细胞产生IL-2、4、5、6、10、13,干扰素γ等细胞因子刺激B细胞的分化、增殖和抗体产生;而B细胞又可产生IL-12调节TH1细胞活性和TC细胞活性。在单核巨噬细胞与淋巴细胞之间,前者产生IL-1、6、8、10,干扰素α,TNF-α等细胞因子促进或抑制T、B、NK细胞功能;而淋巴细胞又产生IL-2、6、10,干扰素γ,GM-CSF,巨噬细胞移动抑制因子(MIF)等细胞因子调节单核巨噬细胞的功能。许多免疫细胞还可通过分泌细胞因子产生自身调节单核巨噬细胞的功能。许多免疫细胞还可通过分泌细胞因子产生自身调节作用。例如T细胞产生的IL-2可刺激T细胞的IL-2受体表达和进一步的IL-2分泌,TH1细胞通过产生干扰素γ抑TH2细胞的细胞因子产生。而TH2细胞又通过IL-10、IL-4和IL-13抑制TH1细胞的细胞因子产生。通过研究细胞因子的免疫网络调节,可以更好地理解完整的免疫系统调节机制,并且有助于指导细胞因子做为生物应答调节剂(biologicalresponsemodifier,BRM)应用于临床治疗免疫性疾病。
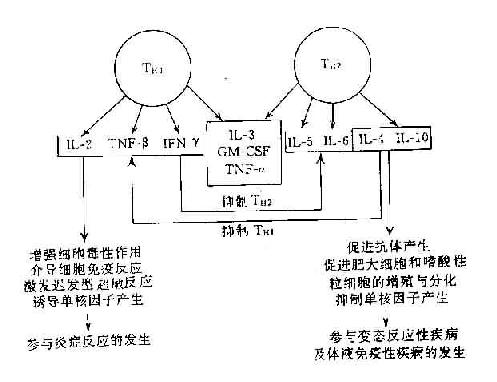
图4-1 细胞因子与TH1、TH2的相互关系
二、免疫效应分子
在免疫细胞针对抗原(特别是细胞性抗原)行使免疫效应功能时,细胞因子是其中重要效应分子之一。例如TNFα和TNFβ可直接造成肿瘤细胞的凋零(apoptosis),使瘤细胞DNA断裂,细胞萎缩死亡;干扰素α、β、γ可干扰各种病毒在细胞内的复制,从而防止病毒扩散;LIF可直接作用于某些髓性白血病细胞,使其分化为单核细胞,丧失恶性增殖特性。另有一些细胞因子通过激活效应细胞而发挥其功能,如IL-2和IL-12刺激NK细胞与TC细胞的杀肿瘤细胞活性。与抗体和补体等其它免疫效应分子相比,细胞因子的免疫效应功能,因而在抗肿瘤、抗细胞内寄生感染、移植排斥等功能中起重要作用。
三、造血细胞刺激剂
从多能造血干细胞到成熟免疫细胞的分化发育漫长道路中,几乎每一阶段都需要有细胞因子的参与。最初研究造血干细胞是从软琼脂的半固体培养基开始的,在这种培养基中,造血干细胞分化增殖产生的大量子代细胞由于不能扩散而形成细胞簇,称之为集落,而一些刺激造血干细胞的细胞因子可明显刺激这些集落的数量和大小因而命名为集落刺激因子(CSF)。根据它们刺激的造血细胞种类不同有不同的命名,如GM-CSF、G-CSF、M-CSF、multi-CSF(IL-3)等。目前的研究表明,CSF和IL-3是作用于粒细胞系造血细胞,M-CSF作用于单核系造血细胞,此外Epo作用于红系造血细胞,IL-7作用于淋巴系造血细胞,IL-6、IL-11作用于巨核造血细胞等等。由此构成了细胞因子对造血系统的庞大控制网络。某种细胞因子缺陷就可能导致相应细胞的缺陷,如肾性贫血病人的发病就是肾产生Epo的缺陷所致,正因如此,应用Epo治疗这一疾病收到非常好的效果。目前多种刺激造血的细胞因子已成功地用于临床血液病,有非常好的发展前景。
四、炎症反应的促进剂
炎症是机体对外来刺激产生的一种病理反应过程,症状表现为局部的红肿热痛,病理检查可发现有大量炎症细胞如粒细胞、巨噬细胞的局部浸润和组织坏死,在这一过程中,一些细胞因子起到重要的促进作用,如IL-1、IL-6、IL-8、TNFα等可促进炎症细胞的聚集、活化和炎症介质的释放,可直接刺激发热中枢引起全身发烧,IL-8同时还可趋化中性粒细胞到炎症部位,加重炎症症状.在许多炎症性疾病中都可检测到上述细胞因子的水平升高.用某些细胞因子给动物注射,可直接诱导某些炎症现象,这些实验充分证明细胞因子在炎症过程中的重要作用.基于上述理论研究结果,目前已开始利用细胞因子抑制剂治疗炎症性疾病,例如利用IL-1的受体拮抗剂(IL-1receptor antagonist,IL-lra)和抗TNFα抗体治疗败血性休克、类风湿关节炎等,已收到初步疗效。
五、其它
许多细胞因子除参与免疫系统的调节效应功能外,还参与非免疫系统的一些功能。例如IL-8具有促进新生血管形成的作用;M-CSF可降低血胆固醇IL-1刺激破骨细胞、软骨细胞的生长;IL-6促进肝细胞产生急性期蛋白等。这些作用为免疫系统与其它系统之间的相互调节提供了新的证据。
第四节 细胞因子的临床意义
一、细胞因子与疾病
正常情况下,细胞因子表达和分泌受机体严格的调控,在病理状态下、细胞因子会出现异常性表达,表现为细胞因子及其受体的缺陷,细胞因子表达过高,以及可溶性细胞因受体的水平增加等。
(一)细胞因子及其受体的缺陷
包括先天性缺陷和继发性缺陷两种病理情况,例如先天性的性联重症联合免疫缺陷病人(XSCID),表现为体液免疫和细胞免疫的双重缺陷,出生后必须在无菌罩中生活,往往在幼儿期因感染而夭折。现已发现这种患者的IL-2受体γ链缺陷,由此导致IL-2、IL-4和IL-7的功能障碍,使免疫功能严重受损。细胞因子的继发性缺陷往往发生在感染、肿瘤等疾病以后,如人类免疫缺陷病毒(HIV)感染并破坏TH后,可导致TH细胞产生的各种细胞因子缺陷,免疫功能全面下降,从而表现出获得性免疫缺陷综合征(AIDS)的一系列症状。
(二)细胞因子表达过高
在炎症、自身免疫病、变态反应、休克等疾病时,某些细胞因子的表达量可成百上千倍地增加,例如为风湿关节炎的滑膜液中可发现IL-1、IL-6、IL-8水平明显高于正常人,而这些细胞因子均可促进炎症过程,使病情加重。应用细胞因子的抑制剂有可能治疗这为类症性细胞因子水平升高的疾病。
(三)可溶性细胞因子受体水平升高
细胞膜表面的细胞因子受体可脱落下来,成为可溶性细胞因子受体,存在于体液和血清中,在某些疾病条件下,可出现可溶性细胞因子受体的水平升高。这类分子可能结合细胞因子,使其不再与膜表面的细胞因子受体结合,因而封闭了细胞因子的功能。
二、细胞因子与治疗
目前,利用基因工程技术生产的重组细胞因子做为生物应答调节剂(BRM)治疗肿瘤、造血障碍、感染等已收到良好的疗效,成为新一代的药物。重组细胞因子做为药物具有很多优越之处。例如细胞因子为人体自身成分,可调节机体的生理过程和提高免疫功能,很低剂量即可发挥作用,因而疗效显着,副作用小,是一种全新的生物制剂,已成为某些疑难病症不可缺少的治疗手段。目前已批准生产的细胞因子药物包括干扰素α、β、γ,Epo,GM-CSF,G-CSF,IL-2,正在进行临床试验的包括IL-1、3、4、6、11,M-CSF,SCF,TGF-β等(表4-3、4-4。)这些细胞因子的主要适应症包括肿瘤、感染(如肝炎、AIDS)、造血功能障碍、创伤、炎症等。
表4-3 已批准生产的细胞因子多肽药物
| 药物名称 | 适应症 |
| IFNα | 白血病、Kaposi肉瘤、肝炎、恶性肿、AIDS |
| IFNV | 慢性肉芽、生殖器疣、恶性肿瘤、过敏性皮炎、感染性疾病、类风湿关节炎 |
| G-CSF | 自身骨髓移植、化疗导致的粒细胞减少症、AIDS、白血病、再生障碍性贫血 |
| GM-CSF | 自身骨髓移植、化疗导致的血细胞减少症、AIDS、再生障碍性贫血、MDS |
| Epo | 慢性肾功能衰竭导致的贫血、恶性肿瘤或化疗导致的贫血、失血后贫血 |
| IFNβ | 多发性硬化症 |
表4-4 已批准临床试验的细胞因子多肽药物
| IL-Iα | 放疗、化疗所致的骨髓抑制、恶性肿瘤 |
| IL-1β | 放化疗所致的骨髓抑制、癌症、促进伤口愈合 |
| IL-3 | 骨髓衰竭、血小板缺乏、自身骨髓移植、化疗佐剂、外周血干细胞移植 |
| IL-4 | 免疫缺陷、恶习性肿瘤、疫苗佐剂 |
| IL-6 | 放化疗所致血小板减小、恶习性肿瘤、疫苗佐剂 |
| M-CSF | 恶性肿瘤、白血病、骨髓移植、降胆固醇 |
| TNF | 恶性肿瘤 |
| 干细胞因子(SCF) | 骨髓衰竭 |
| TGF-β | 炎症 |
| IL-11 | 血小板减少症 |
| IL-1受体拮抗剂 | 败血性休克,类风湿关节炎 |
| PLXY321 | 骨髓衰竭 |
细胞因子疗法(cytokine therapy)基本上可分为两种,即细胞因子补充和添加疗法及细胞因子阻断和拮抗疗法。
(一)细胞因子补充和添加疗法
通过各种途径使患者体内细胞因子水平增加,充分发挥细胞因子的生物学作用,从而抗御和治疗疾病。目前已有多种细胞因子(多为基因重组产品)试用于临床治疗,经大量临床资料验证,以下几种细胞因子的临床适应症比较明确,临床疗效比较肯定。
1.IFN 不同型别的IFN各有其独特的性质和生物学活性,其临床应用适应症和疗效有所不同。IFN-α主要用于治疗病毒性感染和肿瘤。IFN-α对于病毒性肝炎(主要是慢性活动性肝炎)、疱疹性角膜炎、带状疱疹、慢性宫颈炎等有较好疗效。IFN-α对于血液系统恶性疾病如毛细胞白血病(有效率达80%以上)等疗效较显著,但对实体肿瘤的疗效较差。虽然IFN-γ的免疫调节作用强于IFN-α,但其治疗肿瘤的效果弱于IFN-α,目前有人应用IFN-γ治疗类风湿关节炎、慢性肉芽肿取得了一定疗效。
2.IL-2 目前多将IL-2与LAD/TIL合用治疗实体肿瘤,对肾细胞癌、黑色素瘤、非何杰金淋巴瘤、结肠直肠癌有较显著的疗效,应用IL-2(或与IFN合用)治疗感染疾病亦取得了一定疗效。
3.TNf 由于其全身应用副作用严重且疗效差,目前多倾向将其局部应用如瘤灶内注射治疗某些肿瘤和直肠癌,其确切疗效尚待进一步评价。
4.CSF 目前主要应用GM-CSF和G-CSF治疗各种粒细胞低下患者。例如与化疗药物合用治疗肿瘤可以降低化疗后粒细胞减少程度,使粒细胞的数量和功能能尽快回升并能提高机体对化疗药物的耐受剂量,从而提高治疗肿瘤的效果。对再生障碍性贫血和AIDS亦有肯定疗效。用于骨髓移植后可使中性粒细胞尽快恢复,降低感染率。此外,应用EPO治疗肾性贫血取得了非常显著的疗效。
(二)细胞因子阻断和拮抗疗法
其基本原理是抑制细胞因子的产生和阻断细胞因子与其相应受体的结合及受体后信号传导过程,使细胞因子的病理性作用难以发挥。该疗法适用于自身免疫性病、移植排序反应、感染性休克等的治疗。例如抗TNF单克隆抗体可以减轻甚至阻断感染性休克的发生,IL-1受体拮抗剂对于炎症、自身免疫性疾病等具有较好的治疗效果。
三、细胞因子的检测
细胞因子检测是判断机体免疫功能的一个重要指标,因而具有重要的实验室研究价值,同时还可能在临床上有诸多实用价值、包括许多疾病的诊断、病程观察、疗效判断及细胞因子治疗监测等。但是,由于细胞因子在体内的含量甚微,给细胞因子的检测带来困维。目前细胞因子的主要检测方法包括:
(一)依赖性细胞株
一些肿瘤细胞株必须依赖于细胞因子方能在体外增殖,如DTLL细胞株依赖IL-2;FDC-PL细胞株依赖于小鼠IL-3;TF-1细胞株依赖于人IL-3和人GM-CSF,因而可利用这些依赖细胞株检测相应的细胞因子。这种方法敏感性高,特异性也不错,但可异的是并非所有细胞因都能找到相应的细胞株,因而限制了它的应用。
(二)功能检测
利用一些细胞因子的功能特性,可建立相应的活性测定方法,如干扰素的抑制病毒感染效应,肿瘤坏死因子对L929细胞的杀伤作用等。这样的方法敏感性高,但特异性不够,容易受一些扰因素的影响。
(三)免疫测定
利用抗原抗体反应的原理,制备出抗细胞因子的单克隆抗体或多克隆抗体,可进行细胞因子的免疫检测。这种方法的优点是特异性强、操作简便,缺点是灵敏度不够,且不能代表活性测定的结果。从目前的国际发展趋势来看,已研制出了高灵敏度、特异性高、高度配套的细胞检测试剂盒,其应用范围正在扩大,有良好的发展前景。
(四)功能测定与抗体抑制
为解决功能定特异性不够,免疫测定灵敏度不够的问题,可将两种方法结合起来,利用各自的长处,有可能得到较为可靠的结果。在这一方法中,所用的抗细胞因子抗体必须是具有中和活性的抗体。
(五)分子杂交技术
利用分子生物学技术,制备出细胞因子的基因探针,可通过分子杂交技术检测细胞内细胞因子mRNA的表达,这是一种高度敏感和高度特异的检测技术,目前在实验室研究中使用较广,其缺点是操作较为繁琐,测定结果只能代表细胞因子基因的表达,而不能代表活性细胞因子的水平。
(六)多聚酶链反应技术(PCR)
PCR(polymerasechain reation)技术是一种高效的基因体外扩增技术,目前PCR技术已用于细胞因子的检测中,首先将细胞因子产生细胞的RNA提取出来,再经逆转录合成cDNA,以cDNA为模板,在细胞因子引物的引导下,即可进行PCR扩增。这种技术是迄今最敏感的细胞因子检测技术,操作也较简便,缺点与分子杂交技术类似,并且不容易对细胞因子表达水平进行定量。
第五章 免疫细胞膜分子(一):主要组织兼容性抗原
本世纪初即已发现,在不同种属或同种不同系的动物个体间进行正常组织或肿瘤移植会出现排斥,它是供者与受者组织不相容的反映。其后证明,排斥反应本质上是一种免疫反应,它是由组织表面的同种异型抗原诱导的。这种代表个体特异性的同种抗原称为组织兼容性抗原(histocompatibility antigen)或移植抗原(transplantation antigen)。机体内与排斥反应有关的抗原系统多达20种以上,其中能引起强而迅速排斥反应者称为主要组织兼容性抗原,其编码基因是一组紧密连锁的基因群,称为主要组织兼容性复合体(major histocompatibilitycomplex,MHC)。现已证明,控制机体免疫应答能力与调节功能的基因(immune uesponse gene,Ir gene )也存在于MHC内。因此,MHC不仅与移植排斥反应有关,也广泛参与免疫应答的诱导与调节。不同种属的哺乳类动物其MHC及编码的抗原系统有不同的命名,小鼠的主要组织相容性抗原系统称为H-2系统,人的则称为人白细胞抗原系统(human leucocyte antigen,HLA)。但它们的组成结构、分布和功能等却很相似。小鼠由于具有繁殖快、易于饲养等特点成为进行MHC研究的最重要动物。迄今对人类MHC的认识在很大程度上也来自对小鼠MHC即H-2复合体的研究。
第一节 MHC基因结构
一、小鼠H-2基因复合体
(一)H-2复合体的结构
本世纪30年代,Gorer在鉴定近交系小鼠血型抗原时曾发现4组红细胞抗原,命名为抗原Ⅰ、Ⅱ、Ⅲ和Ⅳ。其中抗原Ⅱ只存在于某些品系而不存在于另一些品系小鼠中。其后,Snell等用近交系小鼠中生长的肿瘤分别移植于其杂交子代,肿瘤只能在抗原Ⅱ阳性小鼠体内生长,在抗原Ⅱ阴性小鼠体内则被排斥,证明了抗原Ⅱ是一种组织兼容性抗原,故称小鼠的组织兼容性抗原为H-2(histocompatibility antigen-2,H-2)。以后,相继证明编码H-2抗原的基因定位于小鼠第17对染色体上,并证明是由多基因座组成,故称此基因群为主要组织相容性基因复合体。
这是一组紧密连锁的基因群,位于第17对染色体上的一个狭窄的区段内,它是由4个遗传区域(uegion)组成,即K区、I区、S区和D区。其中I区又可分为二个亚区(subrugion)即I-A和I-B亚区。在每区或亚区内至少包括一个基因座,如K区基因称为H-2K座。D区至少含有二个座,即H-2D座和H-2L座。I-A亚区含有Aα和Bβ二个座,I-E亚区含E-α和E-β二个座,S区含有6个座。
K和D区基因可编码H-2抗原系,I区基因编码的分子称为I区相关抗原或Ia抗原系(I-region associated antigen,Ia)。S区基因可分别编码补体成分(C4和B因子等)、性限制蛋白(sex-Iimited protem,SIP)以及TNF等因子(图5-1)
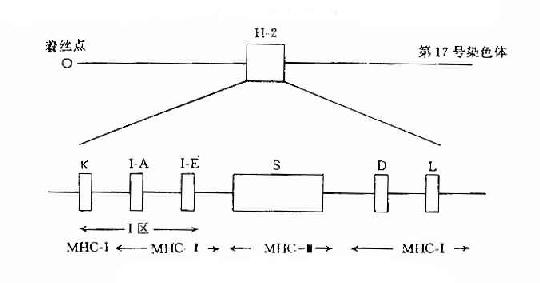
图5-1小鼠H-2复合体结构示意图
(二)H-2复合体的功能
Kiein于1981年按其功能将MHC基因座分为4类,即Ⅰ类座包括K、D和L座,其编码的分子称为Ⅰ类分子,即K、D和L分子。Ⅱ类座其编码的分子称为Ⅱ类分子即Ia抗原。Ⅲ类座其编码的分子称为Ⅲ类分子(包括血清因子、补体分子及TNF等)。Ⅳ类座位于D座右侧,是否属于H-2复合体尚未确定,但与H-2连锁,它包括Tla座和Qa座,其编码的分子称为Ⅳ类分子(Tla分子和Qa分子)。
1.Ⅰ类基因(H-2K,H-2D基因) Snell于50年代偶然发现H-2基因座不是由一个基因组成,他观察到二个品系小鼠(k/k和d/d)杂交的子代(F1:k/d)鼠能接受第三个品系小鼠,(a/a)的肿瘤移植,他对这种意外结果解释为H-2基因座含有二个基因(K/D),a/a品系小鼠具有来自k/k小鼠的一个基因(K)和来自d/d小鼠的另一个基因(D)。这种组合衍生自二个染色体上的相应位置分别称为K座(K locus)和D座(DLocus),二个座分别编码不同的H-2抗原(K分子和T分子)即Ⅰ类分子。
在不同的品系中,K和D分子可能具有不同的抗原特异性称之为特有抗原(prviate antigen)。在K和D分子之间也存在一引些共同的抗原特异性称之为共有抗原(public antigen)。不同的抗原特异性可用编码抗原基因座名称和按检出顺序标明之,如K33、D2等。
在一条染色体上K和D座存在的基因总合称为H-2的单体型(haplotype),不同的单体型可用小写字母表示之。如C57BL品系小鼠的H-2单体型为H-2b,它的二个基因座编码的抗原特异性为K33和D2。
2.Ⅱ类基因(免疫应答基因)近年来对免疫应答的遗传控制进行了系统研究,证明运动对许多抗原的免疫应答是受常染色体显性基因控制,称此基因为免疫应答基因(immune response gene,Ir基因)。McDevitt等研究了小鼠对人工合成多肽体抗原的免疫应答,首先证明了Ir基因与H-2复合体呈连锁关系,定位于H-2K和H-2D座之间,因与免疫应答相关,故称此区段为I区。
通过不同品系小鼠之间交配获得一种具有相同K和D基因的特殊重组体。有这种重组体小鼠进行相互免疫,惊奇地发现在K和D基因之间的染色体区段也控制细胞膜表面的同种异型抗原,将这种新发现的同种异型抗原称为I区相关抗原,即Ia抗原。这种抗原与K和D分子不同,它主要存在于B细胞、巨噬细胞、树突状细胞以及活化的T细胞上,而在其它组织上均未能发现Ia抗原的存在。其后证明Ia分子与多肽抗原呈递相关。
3.Ⅲ类类基(系指H-2S区的基因)此区含有6个座,包括C4、C2、Bf、Slp、TNF等基因。分别编码C4分子、C2分子、补体B因子,性限制蛋白及肿瘤坏死因子(TNF)等。
二、人类HLA基因复合体
对人主要组织兼容性抗原系统及其基因复合体的认识比小鼠约晚10年,法国学者Dausset在1958年首先发现,肾移植后出现排斥反应的患者以及多次输血的患者血清中含有能与供者白细胞发生反应的抗体。后者所针对的抗原即人类主要组织相溶性抗原。由于该抗原首先在白细胞表面被发现且含量最高,而且白细胞抗原(human leucocyte antigen,HAL);人类MHC,即编码HLA的基因群自然数为HAL复合体。
(一)HLA复合体定位及结构
HLA复合体位于人第6号染色体的短臂上。该区DNA片段长度约3.5~4.0×千个碱基对,占人体整个基因组的1/3000。图5-2显示HLA复合体结构。HLA复合体共有数十个座,传统上按其产物的结构、表达方式、组织分布与功能可将这些基因座分为三类。
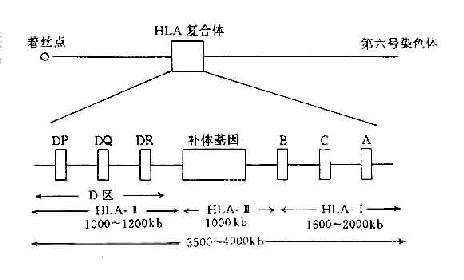
图5-2 人类HLA复合体结构示意图
1.HLA-Ⅰ类基因在Ⅰ基因区内存在多达31个有关的Ⅰ类基因座,其中HLA-A、HLA-B和HLA-C为经典的HLA-Ⅰ类基因,其它基因的产物分布有限,且其功能不明,另外还有许多伪基因.
2.HLA-Ⅱ类基因 HLA-Ⅱ类基因区包括近30个基因座,其中经典的Ⅱ类基因一般指DR、DP和DQ,它们编码的产物均为双肽链(α、β)分子。近年来,陆续发现了一些位于Ⅱ类基因区的新基因座,其中某些基因的产物与内源性抗原的处理与呈递有关。
3.HLA-Ⅲ类基因 HLA-Ⅲ类基因区域至少已发现36个基因座,其中C2、C4、Bf座编码相应的补体成分,另外还有21羧化酶基因(CYP21A、B)肿瘤坏死因子基因(TNFA、B)以及热休克蛋白70(heat shock protein70,HSP70)基因。补体C4由二个不同的基因(C4A与C4B)编码。HLA-Ⅲ类基因区结构见图5-3。
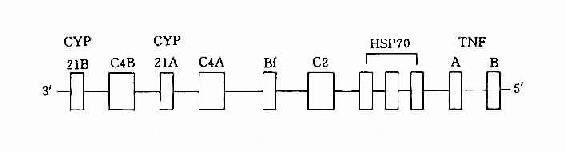
图5-3 HLA-Ⅲ基因区结构示意图
(二)HLA等位基因及编码产物的命名
按WHO-HLA命名委员会发布的资料,仅经典的HLA-Ⅰ、Ⅱ类座(A、B、C、DR、DQ、DP)等位基因即达279个。表5-1列出了至1991年11月已识别的HLA特异性。根据该委员会制定的命名原则,凡确定新的HLA抗原特异性都要明确其DNA序列。此外,下列几种情况在HLA特异性编号后加W(work shop)标记。
表5-1 已识别的HLA特异性(1991)
| A | B | C | D | DR | DQ | DF |
| A1 | B5 B51(5) | Cw1 | Dw1 | DR1 | DQ1 | DPw1 |
| A2 | B7 B5102 | Cw2 | Dw2 | DR103 | DQ2 | DPw2 |
| A210(2) | B703 B5103(7) | Cw3 | Dw3 | DR2 | DQ3 | DPw3 |
| A3 | B8 B52(5) | Cw4 | Dw4 | DR3 | DQ4 | DPw4 |
| A9 | B12 B53 | Cw5 | Dw5 | DR4 | DQ5(1) | DPw6 |
| A10 | B13 B54(22) | Cw6 | Dw6 | DR5 | DQ6(1) | |
| A11 | B14 B55(22) | Cw7 | Dw7 | DR6 | DQ7 | |
| A19 | B15 B54(22) | Cw8 | Dw8 | DR7 | DQ18(3) | |
| A23(9) | B16 B57(17) | Cw9(w3) | Dw10 | DR8 | DQ19(3) | |
| A24(9) | B17 B54(17) | Cw1(w3) | Dw11(w7) | DR9 | ||
| A2403(9) | B18 B59 | Dw12 | DR10 | |||
| A25(10) | B21 B60(40) | Dw13 | DR11(5) | |||
| A26(10) | B22 B61(40) | Dw14 | DR12(5) | |||
| A28 | B27 B62(15) | Dw15 | DR13(5) | |||
| A29(19) | B35 B63(15) | Dw16 | DR13(6) | |||
| A30(19) | B37B64k(14) | Dw17(w7) | DR14(6) | |||
| A31(19) | B38(16 B65(14) | Dw18(w6) | DR1403 | |||
| A32(19) | B39(16) B67 | Dw19(w6) | DR1404 | |||
| A33(19) | B40 B70 | Dw20 | DR15(2) | |||
| A34(10) | B4005(21) B71(70) | Dw21 | DR16(2) | |||
| A36 | B41 B72(70) | Dw22 | DR17(3) | |||
| A43 | B42 B73 | Dw23 | DR18(3) | |||
| A66(10) | B44(12) B75(15) | DR51 | ||||
| A68(28) | B45(12) B76(15) | Dw24 | ||||
| A69(28) | B46 B77(15) | Dw25 | DR52 | |||
| A74(19) | B47 B7801 | B-26 | DR53 | |||
| B48 | ||||||
| B49(21) Bw4 | ||||||
| B50(21) Bw6 |
①Bw4和Bw6作为表位以其它B座等位基因个区别;②C座的特异性加w,以与补体相区分;③由经典细胞学分型方法鉴定D和DP特异性加W。
(三)HLA复合机遗传特征
HLA复合体具备某些有别于其它真核基因系统的特征。
1.单体型遗传方式 HLA复合体是一组紧密连锁的基因群。这些连锁在一条染色体上的等位基因很少发生同源染色体间的交换,构成一个单体型(haplotype)。在遗传过程中,HLA单体型作为一个完整的遗传单位由亲代传给子代。有必要区分HLA表型、基因型与单体型这三个概念。某一个体HLA抗原特异性型别称为表型(phenotype);HLA基因在体细胞两条染色体上的组合称为基因型(genotype);HLA基因在同一条染色体上的组合称为单体型(haplotype)(表5-2)。
| 受检者 | 甲 A1 A2 B8 B12 |
乙 A1 A1 B8 B12 |
丙 A1 A1 B8 B8 |
| 表型 | HLA-A1、2:B8、12 | HLA-A1:B8、12 | HLA-A1、B8 |
| 基因型 | HLA-A1、A2 HLA-B8、B12 |
HLA-A1、A1 HLA-B8、B12 |
HLA-A1、A1 HLA-B8、B8 |
| 单体型 | HLA-A1、B8/A2、B12 | HLA-A1、B8/A1、B12 | HLA-A1、B8/A1、B8 |
二倍体(diploid)生物的每一细胞均有两个同源染色体组,分别来自父母双方。故子女的HLA单体型也是一个来自父方,一个来自母方。在同胞之间比较HLA单体型型别只会出现下列三种可能性:二个单体型完全相同或完全不同的机率各占25%;有一个单体型相同的机率占50%。至于亲代与子代之间则必然有一个单体型相同,也只能有一个单体型相同(图5-40。这一遗传特点在器官移植供者的选择以及法医的亲子鉴定中得到了应用。
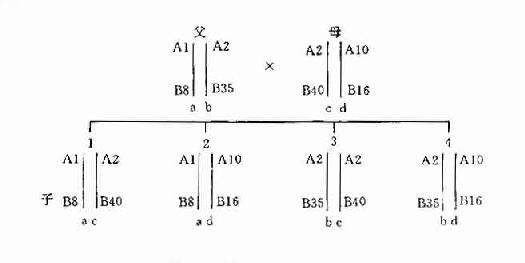
图5-4 HLA 单体型遗传示意图
注:a、b、c、d代表单体型
A1、B8、A2、B35等代表HLA基因座等位基因
2.多态性现象 多态性(polymorphism)是指在一随机婚配的群体中,染色体同一基因座有两种以上基因型,即可能编码二种以上的产物。HLA复合体是迄今已知人体最复杂的基因复合体,有高度的多态性。HLA的多态性现象乃由于下列原因所致:①复等位基因(multiple alleles):位于一对同源染色体上对应位置的一对基因称为等位基因(allele);由于群体中的突变,同一座的基因系列称为复等位基因。前已述及,HLA复合体的每一座均存在为数众多的复等位基因,这是HLA高度多态性的最主要原因。由于各个座位基因是随机组合的,故人群中的基因型可达108之多。②共显性(codominance);一对等位基因同为显性称为共显性。HLA复合体中每一个等位基因均为共显性,从而大大增加了人群中HLA表型的多样性,达到107数量级。因此,除了同卵双生外,无关个体间HLA型别全相同的可能性极小。
HLA的高度多态性显示了遗传背景的多样性,这可能是高等动物抵御不利环境因素的一种适应性表现,从而维持种属的生存与延续具有重要的生物意义,但也对组织移植过程中寻找配型合的供体带来很大的困难。
3.连锁不平衡 HLA复合体各等位基因均有其各自的基因频率。基因频率是指某一特定等位基因与该基因座中全部等位基因总和的比例。随机婚配的群体中,在无新的突变和自然选择的情况下,基因频率可以代代维持不变,由于HLA复合体和各基因座是紧密连锁的,若各座的等位基因随机组合构成单体型,则某一单体型型别的出现频率应等于该单体型各基因比其它基因能更多或更少地连锁在起,从而出现连锁不平衡(linkage disepuilibrium)。例如,在北欧白人中HLA-A1和HLA-B8频率分别为0.17和0.11。若随机组合,则单体型A1-B8的预期频率为0.17×0.11=0.019。但实际所测行的A1-B8单体型频率是0.088故A1-B8处于连锁不平衡,实测频率与预期频率间的差值(△0.088-0.19=0.069)为连锁不平衡参数。在HLA复合体中已发现有50对以上等位基因显示连锁不平衡。产生连锁不平衡的机制尚不清楚。
第二节 MHC抗原
一、HLA抗原的分子结构
1987年Bjorkman等首先借助X线晶体衍射技术弄清了HLA-A2分子的立体结构。其后,其它HLA-Ⅰ、Ⅱ类分子结构的研究也取得了进展,从而对这些分子的生物学功能提供了较确切的解释。
(一)HLA-Ⅰ类分子
所有的HLA-Ⅰ类分子均含有二条分离的多肽链,一条是由MHC基因编码的α链或称重链(44kD)。根据对HLA-A2和Aw68分子的晶体结构分析,Ⅰ类分子可分为四个区:(图5-5):①氨基端胞外多肽结合区:该区由二个相似的各包括90个氨基酸残基的片段组成,分别称为α1和α2。该功能区含有与抗原结合的部位。后者呈深槽状,其大小与形状适合于已处理的抗原片段,约容纳8~10个氨基酸残基。Ⅰ类分子的多态性残基也位于该区域。②胞外lg样区:该区又称为重链的α3片段,包括90个氨基酸残基,与免疫球蛋白的恒定区具有同源性。Ⅰ类分子与TC细胞表面CD8分子的结合部位即在α3片段。Ⅰ类分子的β链又称β2微球蛋白,也结合于该区。β链由第15号染色体的基因编码,它不插入细胞膜而游离于细胞外。β2微球蛋白与α1、α2、α3片段的相互作用对维持Ⅰ类分子于然构型的稳定性及其分子表达有重要意义。③跨膜区:该区氨基酸残基形成螺旋状穿过浆膜的脂质双层,将类分子锚定在膜上。④胞浆区:该区位于胞浆中,可能与细胞内外信息传递有关。
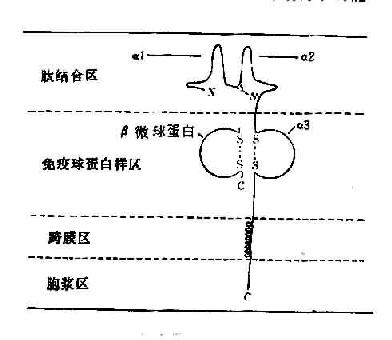
图5-5 HLA-Ⅰ类分子结构示意图
(二)HLA-Ⅱ类分子
所有的Ⅱ类分子均由二条以非共价键连接的多肽链(α、β)组成。二条链的基本结构相似,但分别由不同的MHC基因编码,且均具有多态性。虽然Ⅱ类分子的晶体衍射结构尚未得到,但光谱分析已证明与Ⅰ类分子具有某种相似性。Ⅱ类分子二条多肽链也可分为四个区,见(图10-6):①肽结合区:α链与β链的胞外部位均可再分为二个各含90个氨基酸残基的片段,分别称为α1、α2和β1、β2。肽结合区包括α1和β1片段,该二片段构成肽结合的裂隙(cleft),约可容纳14个氨基酸残基。Ⅱ类分子的多态性残基主要集中在α1和β1片段,这种多态性决定了多肽结合部位的生化结构,也决定了与肽类结合以及T细胞识别的特异性和亲和力。②lg样区:此区由α2和β2片段组成,两者均含链内二硫键,并属于lg基因超家族。在抗原呈递过程中,TH细胞的CD4分子与Ⅱ类分子结合的部位即位于该lg样非多肽态区域。③跨膜区和胞浆区:该二区与Ⅰ类分子α链的相应区域结构相似。
二、HLA抗原的组织分布
各类HLA抗原的组织分布不同。Ⅰ类抗原广泛分布于体内各种有核细胞表面,包括血小板和网织红细胞。除某些特殊血型者外,成熟的红细胞一般不表达Ⅰ类抗原。不同的组织细胞表达Ⅰ类抗原的密度各异。外周血白细胞和淋巴结、脾细胞所含Ⅰ类抗原量最多,其次为肝、皮肤、主动脉和肌肉。但神经细胞和成熟的滋养层细胞不表达Ⅰ类抗原。Ⅱ类抗原主要表达在某些免疫细胞表面,如B细胞、单核/巨噬细胞,树突状细胞,激活的t 细胞等,内皮细胞和某些组织的上皮细胞也可检出HLA-Ⅱ抗原。另外,某些组织细胞在病理情况下也可异常表达Ⅱ类抗原。Ⅰ、Ⅱ类抗原主要分布在细胞表面,但也可能现于体液中,血清、尿液、唾液、精液及乳汁中均已检出可溶性HLA-Ⅰ、Ⅱ类抗原。HLA-Ⅲ类抗原一般指几种补体成分,它们均分布于血清中。
三、HLA抗原表达的调控
在各类型细胞表面HLA分子表达与否以及表达的密度,可以受不同的因素调节。一般认为,调控HLA分子表达的主要环节是转录速率。可能影响HLA分子表达的因素有:①组织细胞的分化阶段:HLA分子是造血干细胞和某些免疫细胞的分化抗原,在细胞分化、成熟的不同阶段,各类HLA抗原的表达可有改变。例如HLA-DQ分子是人单核细胞的成熟标记;Ⅱ类抗原仅表达在激活的T细胞表面。②某些疾病状态:某些传染性疾病、免疫性疾病、造血系统疾病以及肿瘤均可影响HLA抗原表达。如AIDS病患者单核细胞HLA-Ⅱ类抗原表达明显减少,某些肿瘤细胞表面HLA-Ⅰ类抗原表达减少。③生物活性物质:某些细胞因子,例如三类干扰素(α、β、γ)以及TNFα、THFβ均可增强不同类型细胞HLA-Ⅰ类抗原表达;具有Ⅱ类抗原诱生能力的细胞因子包括IFNγ、TNFα、IL-6及GM-CSF等。此外,某些激素、某些神经递质和神经肽也可影响HLA分子表达。
HLA分子在免疫应答与免疫调节中是一类关键的分子,故各种因素对HLA分子表达的调控可能是体内免疫调节网络的重要组成部分。同时,受各种调节因子的影响,HLA分子的异常表达也参与某些疾病的发病机制。
第三节 MHC分子的功能
MHC最初是在研究排斥反应的过程中发现的。MHC分子作为代表个体特异性的主要组织抗原,在排斥反应中起重要作用。自从60年代发现了Ir基因,70年代发现了细胞毒性T细胞与靶细胞间相互作用的MHC限制性后,对MHC的生物学作用有了更深入的认识。MHC的主要功能包括:
一、参与对抗原处理
MHC分子在多个环节参与对抗原处理。外源性抗原在APC内被降解成免疫原性多肽,并与MHC-Ⅱ类分子结合成稳定的复合物,从而保证了多肽不被进一步降解为氨基酸。80年代末还发现,内源性抗原在靶细胞中须与胞浆中的一种蛋白酶体(proteasome)结合才能进一步分解为免疫原性多肽片段,后者再在一种肽链转运蛋白的参与下被转运到内质网腔与新合成的MHC-Ⅰ分子结合。已证明蛋白酶体相关基因及肽链转运基因均位于MHC-Ⅱ类基因区内。
二、约束免疫细胞间相互作用
70年代中期Zinkernagel等发现,细胞毒性T细胞只杀伤具有同一MHC表型的病毒感染的靶细胞。这意味着T细胞识别细胞表面抗原决定簇的同时,还须识别细胞上的MHC分子。以后证实,不仅TC靶细胞间,而且Mφ-TH,TH-B以及TH-TC间的相互作用也受MHC约束。这一现象,即具有同一MHC表型的免疫细胞才能有效地相互作用,称为MHC限制性(MHC restriction)。
巨噬细胞(Mφ)与TH细胞间的相互作用受MHC-Ⅱ类抗原的约束。TH的TCR联合识别免疫原性多肽片段的表位( epitope)以及MHC-Ⅱ分子α1、β1功能区的多态性决定簇。同时,TH细胞表面的CD4分子识别MHC-Ⅱ类分子α2、β2功能区的非多肽性决定簇,由此启动免疫应答。因此,只有MHC-Ⅱ类分子阳性细胞才具有抗原呈递能力,且细胞表面Ⅱ类分子密度与其抗原呈递能力呈正相关。
TC与病毒感染的靶细胞相互作用受MHC-Ⅰ类抗原的约束。TC的TCR联合识别靶细胞表面的病毒抗原以及MHC-Ⅰ类分子α2和β2功能区的多态性决定簇。同时,TC表面的CD8分子识别Ⅰ类分子α3区的非多态性决定簇。
三、参与对免疫应答的遗传控制
机体对某种抗原物质是否产生应答以及应答的强弱是受遗传控制的。控制免疫应答的基因称为Ir基因。小鼠Ir基因位于H-2Ⅰ区内。人的Ir基因定位目前尚无直接证据,但一般认为也位于HLA-Ⅱ类等位基因的个体,其对特定抗原的免疫应答能力各异。
四、诱导自身或同种淋巴细胞反应
MHC分子可作为自身或同种反应的刺激分子从而诱导免疫应答或参与免疫调节。
1.参与免疫调节 非T细胞(Mφ、B细胞等)在体外能诱导自身T细胞发生增殖反应,此即自身混合淋巴细胞反应(autologous mixed Iymphocyte reaction,AMLR)。在AMLR中非T细胞表面的刺激决定簇是HLA-DQ(小鼠H-2I-A)分子。自身反应性T细胞增殖后可表达HLA-DR(小鼠H-A I-E)抗原,后者又作为刺激分子激活某些T细胞,此T-T AMLR。AMLR代表体内免疫细胞间的一种调节机制,有助于维持免疫自稳,故MHC-Ⅱ类分子通过诱发AMLR而参与免疫调节。
2.诱导免疫反应 MHC分子是一种同种异型抗原,可诱导同种反应的发生,典型的例子是体外的同种异型混合淋巴细胞反应和体内同种移植排斥反应。在这两种情况下,反应性T细胞对非已MHC抗原的识别不受自身MHC限制。
五、参与T细胞分化过程
早期T细胞在胸腺中发育为成熟T细胞的过程中,伴随着一系列表面标志的变化。MHC分子对T细胞的分化发育起着重要作用,早期T细胞必须与表达MHC-Ⅰ或Ⅱ类抗原的胸腺上皮细胞接触才能分别分化成CD8+或CD4+T细胞。
第四节 HLA的医学意义
HLA领域的研究工作在医学实践中有十分重要的意义。
一、HLA与疾病相关性
不同个体对疾病易感性的差异在很大程度上是由遗传因素所决定。在群体调查中比较患者与正常人某些特定等位基因及其产物的频率,这是研究遗传决定的对疾病易感性的主要方法。
HLA是目前已知的具有最复杂多态性的人类基因系统,且Ir基因正位于HLA复合体内,因此考虑到HLA与某些免疫性疾病可能存在相关性。60年代末通过对患者与正常人HLA抗原频率的群体调查,发现了某些疾病与特定的HLA型分别呈非随机分布。最典型的例子是91%以上的北美白人强直性脊柱炎患者带有HLA-B27抗原。这种现象,即二个遗传学性状在群体中同时出现呈非随机分布,称为关联(association)。HLA是第一个被发现与疾病有明确联系的遗传系统。迄今已发现60余种疾病与HLA有关联,这些多属于病因或发病机制未知、与免疫异常有关,或有家族倾向及环境诱发因素的疾病。特定疾病与某种HLA型别的相关性可通过相对危险性(relative risk,RR)来评估,其计算公式为:
RR=P+×C―/P―×C+
式中P+为具有某种抗原的病人数;C―为不带此抗原的对照组人数;P―为不带此抗原的病人数;C+为具有此抗原的对照组人数。RR表示带某种HLA抗原的人与无此种抗原的人在患某种疾病的危险性上的比值。RR=1时,两者无关联;若RR>4,则认为此病与某种HLA抗原肯定有关联;RR值越大,表示带此抗原的人患某病的危险性越大。反之,若RR<1,表示带此抗原者某病有抵抗性。
在评估HLA与疾病的相关性时须注意下面几点:①发现HLA与某种疾病有关联,并不意味着携带某抗原就一定会患某病,HLA本身并不是病因而仅仅是一种遗传标志;②HLA抗原在群体中的分布与民族、人种、地理环境等有关,在研究与疾病的关联时应综合分析才有参考价值;③研究对象须是随机选择,无亲缘关系的:对照组与疾病相关性可能有助于某些疾病的辅助诊断,疾病的预测、分类以及预后的判断。表5-3列出某些疾病与HLA的相关性。
表5-3 HLA 和疾病的相关性
| 疾病 | HLA抗原 | 相对危险性RR |
| 强直性脊柱炎 | Ⅰ类型 B27 | >100 |
| 青少年类风湿性关节炎 | B27 | 24 |
| Reiter病 | B27 | 30~50 |
| 牛皮癣性关节炎 | B17 | 6 |
| Bechat综合征 | Cw6 | 9 |
| 发作性睡眠 | B51 | 10~15 |
| 寻常天疱疮 | Ⅱ类 DR2 | 20 |
| I型糖尿病 | DR4 | 24 |
| 多发性硬化症 | DR3/DR4 | 20 |
| 全身性红斑狼疮 | DR2 | 4 |
| 全身性硬化症 | Ⅲ类 C4AQO C4BQO C4AQO |
6 11 9 |
迄今已检出了众多的HLA基因多态性标志。因此,有可能在DNA水平上探讨HLA与疾病的相关性,甚至发现一些与经典HLA抗原未表现出关联,但与HLA基因型别关联的疾病。可以预期,随着DNA水平的研究不断深入,最终有可能在HLA复合体中发现某些疾病的易感基因,甚至测出这些基因的核苷酸序列。这将有助于阐明某些疾病的发病机制,并在此基础上制订全新的防治措施。
HLA与疾病关联的机制尚未完全清楚,已提出的一些学说包括:①分子模拟学说:该学说认为,由于HLA抗原本身与某种病原物质相似,机体或者不能对该病原物质产生有效的免疫应答,或者在对病原物的应答中发生交叉反应反而损害了自身组织;②受体学说:HLA抗原可能作为外来病原物质的受体,两者结合导致组织损伤;③免疫应答基因学说:人的HLA基因就是Ir基因,特定的Ⅱ类基因型可能导致特定的异常免疫应答,从而表现为易感某种疾病;④连锁不平衡学说:特定的HLA基因可能与某病的易感基因连锁,HLA型别仅是一种检出的遗传标志。一般认为,与HLA有关联的不同病种可能有不同的机制。
二、HLA表达异常与疾病的关系
HLA表达异常即细胞表面HLA分子质与量的异常,可参与疾病发生。
(一)HLA-Ⅰ类抗原表达异常
在小鼠及许多人类肿瘤或肿瘤衍生的细胞株均已发现MHC-Ⅰ类抗原表达缺失或密度降低。若将Ⅰ类基因转染给肿瘤细胞株,则恶变细胞可发生逆转,且浸润性与转移性消失或降低。这可能是由于MHC-Ⅰ类抗原缺失的肿瘤细胞不能补TC识别并攻击,从而导致肿瘤免疫逃逸(sneaking through)。
(二)HLA-Ⅱ类抗原表达异常
器官特异性自身免疫疾病的靶细胞可异常表达HLA-Ⅱ类抗原。诸如Graves病患者的甲状腺上皮细胞、原发性胆管肝硬化患者的胆管上皮细胞、Ⅰ型糖尿病患者的胰岛β细胞等均可发现HLA-Ⅱ抗原异常表达。其机制可能是局部感染诱生IFN-γ,后者诱导Ⅱ类抗原表达。Ⅱ类抗原乃抗原呈递的效应分子,一旦靶细胞异常表达Ⅱ类抗原,就可能以组织特异性方式把自身抗原呈递给自身反应性T细胞,从而启动自身免疫反应。激活的自身反应性TH又可分泌大量IFN-γ,诱导更多的靶细胞表达Ⅱ类抗原,加重和延续自身免疫反应,最终导致迁延不愈的自身组织损伤。
三、HLA与排斥反应
移植物存活率很大程度上取决于供者和受者之间HLA型别相合的程度。在肾移植中,各HLA座配合的重要性依次为HLA-DR、HLA-B、HLA-A。近年来特别重视HLA-DP对移植器官长期存活的意义。在骨髓移植中,为预防严重的移植物抗宿主反应(graft versus host reaction,GVHR),一般要求从同胞中选择HLA全相同的个体作为供者。此外,某些输血反应以及习惯性流产也与HLA不兼容所导致的排斥反应有关。
四、HLA与法医
由于HLA复合体的高度多态性,在无关个体间HLA表型全相同的机率极低,故HLA复合体被看作是伴随个体终生的特异性遗传标记。借助HLA基因型和(或)表型检测,可用于法医上的个体识别。另外,由于HLA复合体具有高度多态性以及单倍型遗传的特点,使HLA分型成为鉴定亲子关系的重要手段。
第五节 HLA分型技术
HLA分型并不只是一种应用性的临床检测指标,免疫遗传学研究的发展,很大程度上依赖于以分型为主要手段的HLA多态性分析。60年代建立的并不断完善的血清学及细胞学分型技术主要侧重于分析HLA产物特异性;80年代起建立的DNA分型方法则侧重于基因的分型。
一、血清学分型技术
(一)HLA-Ⅰ类抗原的检测
HLA-A、B、C抗原型别鉴定均借助微量淋巴细胞毒试验(microlymphocytotoxicitytest)或称补体依赖的细胞毒试验(complement dependent cytotoxicitytest)。原理为取已知HLA抗血清加入待测外周血淋巴细胞,作用后加入免补体,充分作用后加入染料,在倒置显微镜下判断结果,着染的细胞为死亡细胞,表示待检淋巴细胞表面具有已知抗血清所针对的抗原。标准抗原清取自多次经产妇或计划免疫志愿者。
(二)HLA-DR、DQ抗原检测
该二抗原分型方法同HLA-Ⅰ类抗原,但所用抗血清须经过血小板吸收以去除针对Ⅰ类抗原的抗体。另外,待测细胞须是经纯化的B细胞。
血清学分型是一项古老的技术,虽然近年来已建立许多新的分型技术,但血清学方法目前仍是HLA分型的基础。
二、细胞学分型技术
HLA-Dw特异性与HLA-DP特异性可分别通过纯合分型细胞(homozygote typing cell,HTC)及预致敏淋巴细胞试验(primed lymphocyte test,PLT)检测。二种方法的基本原理均是判断淋巴细胞在识别非已HLA抗原决定簇后发生的增殖反应。由于分型细胞来源困难以及操作手续繁琐,细胞学分型技术下正逐渐淘汰。
三、HLA的DNA分型技术
上述传统的HLA分型方法有许多不足之处,近年来国内外已将HLA分型技术由抗原水平发展到基因水平。
(一)限制性片段长度多态性检测技术
这是首先建立的对多态性进行检测的DNA分析技术。个体间抗原特异性来自氨基酸顺序的差别,后者由编码基因的碱基顺序不同所决定。这种碱基顺序的差别造成限制性内切酶识位置及酶切位点数目的不同,从而产生数量和长度不一的DNA酶切片段。用特异性探针对整个基因组DNA酶切片段进行杂交,即可分析限制性长度片段多态性(restriction fragment lengthpolymorphism,RFLP)。一定的内切酶组合所得到的HLA-RFLP可以和传统方法测定的HLA特异性型别相关。80年代末发展起来的PCR(polymerase chain reaction)技术已被用于RFLP分析,即用等位特异限制酶裂解PCR扩增的片段,然后再进行分析,从而大提高了灵敏度。
(二)PCR/SSO技术
此法乃用人工合成的HLA型别特异的寡核苷酸序列作为探针,与待检细胞经PCR扩增的HLA基因片段杂交,从而确定HLA型别,PCR技术可将HLA复合体上指定基因片段特异性地扩增5~6个数量级;而专门设计的SSO(序列特异的寡核苷酸sequencedpecific oligonucleotide)探针又能探测出等位基因间1~2个核苷酸的差异,故PCR/SSO技术具有灵敏度、特异性强、需样本量少等优点。
(三)PCR/SSP技术
目前常规的HLA-DNA分型技术,包括上述的PCR/RFLP、PCR/SSO等,最终均需用标记的特性探针与扩增产物进行杂交,再分析结果。PCR/SSP方法用乃设计出一整套等位基因组特异性引物(sequence specific primer,SSP),借助PCR技术获得HLA型别特异的扩增产物,可通过电泳直接分析带型决定HLA型别,从而大大简化了实验步骤。
由于传统方法在Ⅱ类抗原分型方面困难较大,故上述几种基因分析型方法目前主要用于Ⅱ类基因座。此外,目前已建立的HLA基因分型技术还包括PCR单链构像多态性分析(PCR-single strand conformational polymorphism,PCR-SSCP)和PCR 异源二聚体电泳多态即PCR指纹图(PCr fingerprinting)分析。DNA分型技术的应用,使HLA型别分析达到了更精细的水平,并因此发现了更多的HLA多态性。HLA的DNA分型技术现已成为血清学方法的竞争者,并可能在不久的将来完全取而代之。
HLA是目前所知人体最复杂的遗传多态性系统。HLA研究涉及免疫学、生物学、遗传学、分子生物学、医学等多个学科,并已发展成为一个独立的学科分支。迄今HLA研究已达到相当深入的水平,并在诸多方面取得显著进展,包括HLA复合体结构;HLA分子结构及其表达的调控;HLA分子功能,尤其是在抗原处理、呈递及T细胞识别中的作用;HLA的DNA分型及多态性研究;HLA与疾病的关系;HLA与移植的关系等。HLA研究不仅使器官移植成为一种极有价值的治疗手段,并给基础与临床免疫带来了突破性进展。已经证实,HLA复合体中存在控制免疫应答的基因以及HLA参与约束免疫细胞间相互作用,这表示HLA涉及生命活动的各个水平与多个方面。可以预期,对HLA的研究将继续成为免疫遗传学最活跃的部分;对HLA的应用将扩展到基础、临床、预防医学的各个领域。
第六章 免疫细胞膜分子(二):白细胞分化抗原
机体免疫系统是由中枢淋巴器官、外周淋巴器官、免疫细胞和免疫分子所组成。免疫应答过程有赖于免疫系统中细胞间的相互作用,包括细胞间直接接触和通过释放细胞因子或其它介质间接的作用。免疫细胞间或介质与细胞间相互识别的物质基础是免疫细胞膜分子,包括细胞表面的多种抗原,受体和其它分子,细胞膜分子通常也称为细胞表面标记(cell surface marker)。免疫细胞膜分子的研究对于深入了解免疫应答的本质以及临床某些疾病的诊断、预防和治疗都具有十分重要的意义。
免疫细胞分子的种类相当繁多,主要有T细胞抗原识别受体(TCR)、B细胞抗原识别受体(BCR)、主要组织相容性抗原、白细胞分化抗原、粘附分子、促分裂素受体、细胞因子受体、免疫球蛋Fe段受体以及其它受体和分子。
第一节 白细胞分化抗原
白细胞分化抗原是白细胞(还包括血小板、血管内皮细胞等)在正常分化成熟不同谱系(lineage)和不同阶段以及活化过程中,出现或消失的细胞表面标记。它们大都是穿膜的蛋白或糖蛋白,含胞膜外区、穿膜区和胞浆区。有些白细胞分化抗原是以磷脂酰肌醇(inositol phospholipids,IP)连接方式“锚”在细胞膜上。少数白细胞分化抗原是碳水化合物半抗原。白细胞分化抗原参与机体重要的生理和病理过程。例如:①免疫应答过程中免疫细胞的相互识别,免疫细胞抗原识别、活化、增殖和分化,免疫效应功能的发挥;②造血细胞的分化和造血过程的调控;③炎症发生;④细胞的迁移如肿瘤细胞的转移。
一、人白细胞分化抗原
80年代以来,由于单克隆抗体、分子克隆、基因转染细胞系等技术在白细胞分化抗原研究中得到广泛深入的应用,有关白细胞分化抗原的研究和应用进展相当迅速。在世界卫生组织(WHO)和国际免疫学会联合会(IUIS)的组织下,自1982年至1993年先后举行了五次有关白细胞分化抗原的国际学术讨论会。并应用以单克隆抗体鉴定为主的聚类分析法,将识别同一分化抗原的来自不同实验室的单克隆抗体归为一个分化群(cluster of differentiation,CD)。在许多场合下,抗体及其识别的相应抗原都用同一个CD序号。
表6-1 抗人白细胞分化抗原McAb分组
| 分组 | CD编号 |
| T细胞 | CD1~CD8,CD27,CD28,CD60,CD98~CDw101 |
| B细胞 | CD10,CD19~CD24,CD37,CD39,CD40,CD72~CD86 |
| 活化细胞 | CD25,CDw26,CD30,CD69~CD71,CD95~CD97 |
| 髓样细胞 | CD9,CD11b~CD17,CD31~CD36,CD64~CD68,CD87~CD93,CD115 |
| NK/非谱系细胞 | CD11a,CD18,CD29,CD38,CD43,CE45~CD48,CD52~CD59,CD94 |
| 血小板 | CD41,CD42,CD63,CD107 |
| 内皮细胞 | CD105,CD106,CDw109 |
| 粘附分子 | CD11a,CD44,CD49~CD51,CD61,CD62,CD102~CD104,CDw108 |
| 细胞因子受体 | CDw116,CD117,CD120~CD122,CD124,CD126~CDw128,CDw130 |
注:①CD是流水编号,但CD110~CD114、CD118、CD123,CD125和CD129暂缺,CD67和CD66b是重复的;
②凡CD中带有W抗原或抗体如CDw108,CDw109尚需继续进行全面鉴定;
③有些CD抗原又可进一步划分为不同的成分,一般用小写英文字母表示;
④CD九个组划分的特色性是相对的,实际上,许多CD抗原的细胞分布较为广泛。
(一)CD的分类
迄今为止,CD的序号已从CD1命名至CD130(见附表)。可大致划分为T细胞、B细胞、激活细胞、髓样细胞、NK/非谱系细胞、血小板、内皮细胞、粘附分子和细胞因子受体等九个组(表6-1)。
(二)CD的应用
CD抗原及其相应的单克隆抗体在基础和临床免疫学研究中已得到广泛的应用,在基础免疫学研究中CD主要应用于:①CD抗原的基因克隆,新CD抗源及新配体的发现;②CD抗原结构与功能关系;③细胞激活途径和膜信号的传导;④细胞分化过程中的调控;⑤细胞亚群的功能。在临床免疫学研究中,CD单克隆抗体可用于:①机体免疫功能的检测;②白血病、淋巴瘤免疫分型;③免疫毒素用于肿瘤治疗、骨髓移植以及移植排斥反应的防治;④体内免疫调节治疗。
二、小鼠白细胞分化抗原
大多数白细胞分化抗原在生物进化过程中具有保守性,这是不同种属动物执行相同或相似生物学功能的需要。小鼠是免疫学常用的实验动物,而且对某些人白细胞分化抗原的结构和功能的了解首先是从小鼠或小鼠源性的细胞实验模型得知的,表6-2列举了与人CD抗原类同的小鼠造血细胞表面抗原。
表6-2 与人CD抗原类同的小鼠造血细胞表面原
| 小鼠表面抗原 | CD类同物 | 分布 | 功能 | 分子量 (kD) |
染色体定位 |
| LYt-1 | CD5 | T,B亚型 | 70 | 19 | |
| LYt-2 | CD8a | CTL | CTL粘附 | 30 | 6 |
| LYt-3 | CD8b | CTL | CTL粘附 | 35 | 6 |
| L3T4 | CD4 | Th/Ti | 结合MHCⅡ类Ag | 52 | 6 |
| Ly5 | CD45 | 白细胞、干细胞、滤泡树突细胞、有核红细胞、胸腺细胞 | B细胞成熟 | 200、210 200、190 |
1 |
| Ly-5 | CD4R5? | 前B、B,CTLsub | 220 | 1 | |
| Ly-15 | CD11a | T、B、髓样细胞、NK、红样细胞、髓样干细胞 | CTL粘附 | 177 | 7 |
| Ly-17 | CD32 | B、髓样、干细胞、T?郎格罕细胞 | FclgG 2b/1受体 | 55~60 | 1 |
| LY37 | CD2 | T、B、Thy | T细胞活化红细胞受体 | 50~60 | 3 3 |
| Ly38 | CD1 | ||||
| Ly40 | CD11b | MФ,B,Ly1阳性B细胞 | iC3b受体 | 165 | |
| Ly43 | CD23 | N | LgE Fe受体 | 49 | 1 |
| Ly42 | CD25 | T、B | IL-2受体α链 | 47~53 | |
| Ly44 | CD20 | B |
第二节 粘附分子
粘附分子(adhesion molecules,AM)是指介导细胞与细胞间或细胞与基质间相互接触和结合的一类分子,大都为糖蛋白,分布于细胞表面或细胞外基质(extracellular matrix,ECM)中。粘附分子以配体受体相对应的形式发挥作用,导致细胞与细胞间、细胞与基质间或细胞-基质-细胞之间的粘附。参与细胞的信号传导与活化、细胞的伸展和移动、细胞的生长及分化、肿瘤转移、创伤愈合等一系列重要生理和病理过程。
目前按粘附分子的结构特点,可将其分为粘合素超家族的粘附分子、免疫球蛋白超家族的粘附分子、选择凝集素家族粘分子、钙离子依赖的细胞粘附素家族粘附分子及其它未归类的粘附分子。
一、粘合素超家族
粘合素超家族(integrin superfamily)的粘附分子主要介导细胞与细胞外基质的粘附,使细胞得以附着而形成整体(integration),故得名。此外,粘合素超家族的粘附分子还介导白细胞与血管内皮细胞的粘附。
(一)粘合素分子的基本结构
粘合素超家族的粘附分子都是由α、β两条链由非共价键连接组成的异源双休(heterodimer)。α链的分子量为120~180kD,β链的分子量为90~110kD,不同的α链(或称亚单位)或β链(或称亚单位)氨基酸组成和序列有不同程度的共源性,在结构上有其共同的特点。α和β亚单位均由胞浆区、穿膜区、胞膜外区三部分组成。胞浆区一般较短,可能与细胞骨架相联。穿膜区富含疏水氨基酸。β亚单位的胞膜外部分含有4个富含半胱氨酸的重复序列,靠近外侧N端的40~50kD的氨基酸残基通过链内二硫键紧密折叠在一起(图6-1)。
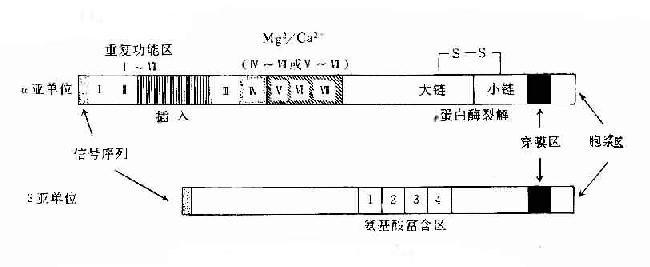
图6-1 粘附分子结构模式图
(二)粘合素分子的组成
目前已知至少有14种α亚单位和8种β亚单位,除α7和αIEL外其它粘附分子亚单位均已基因克隆成功。α亚单位和β亚单位组合构成粘合素分子并不是随机的,多数α亚单位只能与一种β亚单位结合成异源双体,而大部分β亚单位则可以结合数种不同α亚单位。目前按β亚单位的不同可将粘合素超家族分为7个不同的组,在同一组粘合素分子的不同成员中,β链相同,α链不同。已知α链和β链有20种左右的组合形式。表6-3概括了目前常见的粘合素超家族粘附分子β1、β2和β3组的结构及其相应配体。
表6-3 粘合素超家族粘附分子β1、β2、β3组结构及其相应配体
| 分组 | 成员 | α/β亚单位 分子量(kD) |
亚单位 结构 |
分布 | 配体 |
| VLA组 (β1组) |
VLA-1 VLA-2 VLA-3 VLA-4 VLA-5 VLA-6 (α7β1) (α8β1) VNR-β1 |
210/13(CD49a/CD29) 165/130(CD49d/CD29) 135+25/130(CD49c/CD29) 150/130(cd49d/CD29) 135+25/130(CD49e/CD29) 120+30/130(CD49f/CD29) (-/CD29) (-/CD29) 150/130 (CD51/CD29) |
α1β1 α2β1 α3β1 α4β1 α5β1 α6β1 α7β1 α8β1 αvβ1 |
广泛 广泛 广泛(但未见在淋细胞表面) 淋巴细胞Mo 广泛 广泛 某些细胞系 |
CA,LM CA,LM FN,LM,CA FN,VCAM-1 FN LM LM(?) FN,(VN) |
| 白细胞粘 附受体组 (β2) |
LFA-1 Mac1/CDR3 P150,95/CR4 |
180/95(CD11b/CD18) 165/95(CD11b/CD18) 150/95(CD11c/CD18) |
αLβ2 ΑMβ2 αXβ2 |
白细胞 吞噬细胞大颗粒淋巴细胞 吞噬细胞大颗粒淋巴细胞 某些T细胞 |
ICAM-1 ICAM-2,3 ic3b,FB X因子,ICAM-1 FB,ic3b |
| 血小板糖 蛋白组 (β3组) |
9pⅡbⅢa VNR/β3 |
120+25/105(CD51/CD61) 125+24/105(CD51/CD61) |
αⅡβ3 αvβ3 |
血小板、巨核细胞、单核细胞、内皮细胞、中性细胞 广泛 |
FB,FN,vWF,TSP, VN,FB,vWF,TSP,FN,CA |
注:FN:纤维粘连蛋白:LM:层粘连蛋白;TSP:血栓海绵蛋白;VLA:很晚出现的抗原;CA:胶原蛋白:VN:粘连蛋;FB:血纤维蛋白;vWF:von Witlebrand因子;X因子;Factor X:ICAM-1(2,3),细胞间粘附分子-1(2,3);VCAM-1:血管细胞粘附分子-1。
(三)粘合素分子的分布
粘合素分子在体内分布很广泛,多数粘合素分子可以表达于多种组织、细胞,如VLA组的粘合素分子在体内广泛分布于各种组织、细胞,而多数细胞可同时表达数种不同的粘合素分子。对体外培养哺乳动物来源的细胞系粘合素分子表达进行检测,发现每一种细胞系同时表达2~10种不同的粘合素分子,但不同类型的细胞表达粘合素分子的种类是不同的。某些粘合素分子的表达则具有显著的细胞类型特异性,如gpⅡ/bⅢα(Ⅱb/Ⅲβ)主要表达在巨核细胞和血小板,LAF-1、Mac-1、P150/95只表达在白细胞表面,α6β4特异性表达在上皮细胞。此外,每一种细胞粘合素分子的表达可随其表达细胞分化与生长状态的改变而变化。
(四)粘合素分子识别配体的短肽序列
粘合素分子在与配体结合时所识别的只是配体分子中由数个氨基酸组成的短肽序列。不同的粘合素分子可以识别相同的短肽序列或同一个配体中不同的短肽序列。由于同一短肽序列可以存在于几种不同的配体中,因此,一种粘合素分子可能有几种细胞间质成分做为配体,而每一种细胞间质中的配体也可能被几种不同的粘合素分子所识别。α5β1、αvβ1、αⅡbβ3、αvβ3等粘合素分子,可识别配体分子中的RGD(Arg-Gly-Asp,精氨酸-甘氨酸-天冬氨酸)序列。多种细胞间质成分(包括FN,VN、FB、vWF)都含有RGD序列,它们在体内的分布极为广泛。含有RGD序列的人工合成肽可以抑制上述粘合素分子与配体的结合。
二、免疫球蛋白超家族
在参与细胞间相互识别、相互作用的粘附分子中,有许多分子具有与lgV区或C区相似的折叠结构,其氨基酸组成也有一定的同源性,属于免疫球蛋白超家族(immunogiobulinsuperfamily,IGSF)的成员。免疫球蛋白超家族粘附分子的种类、分布及其配体见表6-4。免疫球蛋白超家族粘附分子的配体多为免疫球蛋白超家族中的粘附分子或粘合素超家族的粘附分子,在这种情况下,相互识别的一对IGSF分子或粘合素免疫球蛋白超家族粘分子实际上是互补配体的关系。
表6-4 免疫球蛋白超家族粘附分子的种类、分布和识别配体
| IGSF粘附分子 | 分布 | 分子量(Kd) | 配体 |
| LFA-2(CD2) | T细胞、胸腺细胞、大颗粒淋巴细胞 | 50 | LFA-3(IGSF) |
| LFA-3(CD58) | 广泛 | 40~65 | LFA-2(IGSF) |
| ICAM-1(CD54) | 白细胞、内皮细胞、某些肿瘤细胞、上皮细胞、肝细胞、平滑肌细胞 | 80~114 | LFA-1(粘合素超家族) |
| ICAM-2(CD102) | 内皮细胞 | 60 | LFA-1(粘合素超家族) |
| ICAM-3(CD50) | T细胞、单核细胞、中性粒细胞 | 140/108 | |
| CD4 | 抑制细胞诱导亚群、辅助细胞诱导亚群 | 55 | MHC-Ⅱ(IGSF) |
| CD8 | 抑制性T细胞/杀伤性T细胞 | 34/34 | MHC-Ⅰ(IGSF) |
| MHC-Ⅰ | 广泛 | 44 | CD8(IGSF) |
| MHC-Ⅱ | B细胞、活化T细胞、活化内皮细胞、巨噬细胞 | 32~34/29~32 | CD4(IGSF) |
| CD28 | T细胞 | 44 | B7/B7(IGSF) |
| B7/B71(CD80) | 活化B细胞、活化单核细胞 | 60 | CD28(IGSF) |
| N-CAM-Ⅰ | 神经元、胚胎细胞 | 97~220 | N-CAM-Ⅰ(IGSF) |
| VCAM-Ⅰ(CD106) | 内皮细胞、上皮细胞、树突细胞、巨噬细胞 | 100,110 | VLA-4粘合素超家族 |
| PECAM-Ⅰ(CD31) | 白细胞、血小板、内皮细胞 | 140 | PECAM-Ⅰ(IGSF) |
注:LFA:淋巴细胞功能相关抗原;ICAM:细胞间粘附分子;VDAM:血管细胞粘附分子;PECAM:血小板内皮细胞粘附分子;N-CAM:神经细胞粘附分子。
三、选择素家庭
选择素(selectin)家庭最初被称为外源凝集素细胞附分子家庭(selectincellabhesion moleculefamily,LEC-CAM家族)。selectin是由select和lectin两词衍生而来,目前国内尚无统一译法,选择素一词似为妥当。
(一)选择素分子的基本结构
选择素分子为穿膜的糖蛋白、可分为胞膜外区、穿膜区和胞浆区。选择素家族各成员胞膜外部分有较高的同源性,结构类似,均由三个功能区构成:①外侧氨基端(约120个氨基酸残基)均为钙离子依赖的外源凝集素功能区(calcium depenednt Icetindomain),可以结合碳水化合物基团,是选择素分子的配体结合部位;②紧邻外源凝集素功能区的表皮生长因子样功能区(epidermal growthfactor like domain, EGF样区),约含35个氨基残,EGF样功能区虽不直接参加与配体的结合,但对维持选择素分子的适当构型是必需的;③靠近膜部分是数个由约60个氨基本酸残基构成的补体结合蛋白(complement bindingprotein)重复序列。各种选择素分子的穿膜区和胞浆没有同源性。选择素分子的胞浆区与细胞内骨架相联。
(二)选择素家族的组成
目前已发现选择素家族中有三个成员:L-选择素、P-选择素和E-选择素,L、P和E分别代表白细胞、血小板和内皮细胞。这三种细胞是最初发现相应选择素分子的细胞,故得名。选择素家族成员的细胞分布和相应配体见表6-5。
| 选择素家族组成 | 分子量(kD) | 分布 | 配体 | 功能 |
| L-选择素(CD62L)(LAM-1,LECAM-1) | 9p75~80 | 白细胞 | CD15s(S-Lewis)在外周淋巴结HEV上PNAd | 白细胞与内皮细胞粘附,向炎症部位游走,淋巴细胞归巢到外周淋巴淋巴结 |
| P-选择素(62P) (GMP-140,PAGEM) |
9p140 | 贮存于巨核细胞、血小板α颗粒和血管内皮细胞,WeibelPalade小体,凝血酶和组胺诱导后表达于细胞表面 | CD15a(S-Lewisx)CD15 | 白细胞与内皮细胞和血小板粘附 |
| E-选择素(CD62E)(ELAM-1) | 9p115 | 细胞因子活化血管内皮细胞 | 中性粒细胞CD15s(S-Lewis)、淋巴细胞上CLA | 白细胞与内皮细胞粘附,向炎症部位游走 |
注:LAM:白细胞粘附分子;ELAM:内皮细胞白细胞粘附分子;LECAM:白细胞内皮细胞粘附分子:PNAd:外周淋巴结定居素;GMP:颗粒蛋白:Slewis;唾液酸化的路易斯寡糖;PADGEM:血小板活化依赖的颗粒外膜蛋白CLA:皮肤淋巴细胞相关抗原
(三)选择素分子识别的配体
与其它粘附分子不同,选择素分子识别的配体都是一些寡糖基团,主要是具有唾液酸化的路易斯寡糖(Sialyl-Lewis)或类似结构的分子。与蛋白质分子抗原不同,直接决定细胞表面某种寡糖表达的因素,主要是与某些特的糖基转移酶或碳水化合物修饰酶的作用有关。这些酶的作用可能与细胞的生长与代谢状态有密切关联。一种寡糖基团可以存在于多种糖蛋白或糖脂分子上,并分布于多种细胞表面,因此选择素分子的配体在体内的分布较为广泛。已发现然白细胞、血管内皮细胞、血管内皮细胞、某些肿瘤细胞表面及血清中某些糖蛋白分子上都存在有选择素分子识别的碳水化合物基因。
四、钙离子依赖的粘附分子家族
最初发现一种介导细胞间相互聚集的粘附分子,在有Ca2+存在时可以抵抗蛋白酶的水解作用。以后又发现另外两种作用和特性与其类似的粘附分子,它们的氨基酸组成也有同源性,因此将其命名为钙离子依赖的粘附分子家族(Ca2+dependent cell adhesion molecule family,Cadherm家族)。钙离子依赖的粘附分子家族的粘附分子对于生长发育过程中细胞的选择性聚集具有至关重要的作用。
(一)Cadheria分子结构
Cadherin分子均为单链糖蛋白,约含723-748个氨基酸残基,不同的Cadherin分子在氨基酸水平上有43%-58%的同源性。Cadherin分子由胞浆区、穿膜区和胞膜外区三部分组成,其胞膜区有数个重复功能区,并含有由3-5个氨基酸残基组成的重复序列。近膜部位含有4个保守的半胱氨酸残基,分子外侧N端的113个氨基酸残基构成Cadherin分子的配体结合部位。此外胞膜外部分具有结合钙离子的作用。Cadherin分子的胞膜内部分高度保守,并与细胞内骨架相连。
(二)Cadherin家庭的组成和分布
目前已知Cadherin家族共有3个成员,E-Cadeherin、N-Cadherin和P-Cadherin。不同的Cadherin分子在体内有其独特的组织分布,它们的表达随细胞生长发育状态的不同而改变。Cadherin分子以其独特的方式相互作用,其配体是自身相同的Cadherin分子。
表6-6 Cadherin家族的组成、分布及其配体
| Cadherin家族成员 | 分子量(kD) | 分布 | 配体 |
| E-Cadherin | 124 | 上皮组织 | E-Cadherin |
| N-Cadherin | 127 | 神经组织、横纹肌、心肌 | N-Cadherin |
| P-Cadherin | 118 | 胎盘、间皮组织、上皮组织 | P-Cadherin |
五、其它未归类的粘附分子
除了上述四为类粘附分子外,还有一些粘附分子目前尚未归类,包括一组作为selectin分子的配体的CD15、CD15s(s-Lewis),此外,还有CD44、MAd、MLA等粘附分子,兹列于表6-7。
粘附分子参与机体许多重要的生理和病理过程,主要包括:①通过表达于白细胞粘附分子CD11a/CD18、CD11b/CD18、CD11c/CD18、VLA-4、L-selectin、CD15、CD15s、和P-selectin相互粘附,参与炎症的发生;②通过表达于淋巴细胞上的归巢(Iymphocyte homingreceptor,LHR)、L-selectin、CLA、LFA-1、VLA-4、CD44、LPAM-2分别与表达于血管内皮细胞上的定居素(addressin)PNAd、E-selectin、ICAM-1、ICAM-2、VCAM-1、MAd、CAM相互粘附使淋巴细胞向外周淋巴器官,皮肤炎症部位或粘膜相关淋巴组织的回归;③通过CD/MHCⅡ类分子非多态部分、CD8/MHC1类分子非多态部分、LFA-1/ICAM-1、LFA-2/LFA-3、CD28/B7的相互作用参与免疫应答中APC呈提抗原、抗原识别、免疫细胞相互协作以及CTL杀伤靶细胞等多个环节;④通过Cadherin、N-CAM、CD31等分子的自身粘附,以及某些粘附分子与细胞外基质的粘附,参与细胞的发育、分化、附着及移动;⑤E-Cadherin、家庭些成员以及CD44分子等与肿瘤的浸润、转移有关;⑥通过血小板表达的粘附分子参与动脉、静脉中血栓形成以及其它形式的凝血过程。
表6-7 尚未归类粘附分子的主要特征
| 种类 | 结构 | 主要分布细胞 | 配体 | 功能 |
| PANd | 50~200kD,含有唾液酸化的寡糖决定簇 | 外周淋巴结高内皮细胞 | L-selectin | 淋巴细胞向淋巴结归位 |
| CLA | 含有唾液酸化的寡糖决定簇 | 记忆T细胞 | E-selectin | 向皮肤炎症部位归位 |
| CD44(ECMRⅢ) | 90~200kD | 广泛分布,在T细胞中主要存在于记忆T细胞 | FN、CA、透明质酸,MAd | 淋巴细胞向炎症部位、粘膜相关淋巴组织归位,粘附ECM |
| MAd | 60kD | 炎症部位血管内皮细胞、粘膜相关淋巴组织 | CD44,LPAM-2 | 淋巴细胞向炎症部位及粘膜相关淋巴组织归位 |
| CD36 | 9p88,血小板 GpⅢb |
血小板髓样细胞、内皮细胞 | CA,TSP? | 血小板粘附 |
注:PANd:外周淋巴结定居素;MAd:粘膜血管定居素;CLA:皮肤淋巴细胞相关抗原:LPAM:淋巴细胞集合淋巴结粘附分子;ECM:细胞外基质。
白细胞、血管内皮细胞或其它细胞表面的粘附分子可脱落下来,进入血液可为可溶性粘附分子(soluble adhesion molecules,sAM)。此外,某些粘附分子的mRNA存在着不同的剪接形式,其中有的mRNA翻译后产物可能不表达在细胞表面,而是直接分泌进入血液,成为可溶性粘附分子的另一个重要来源。在结构上,可溶性粘附分子一般缺少其对应膜结合粘附分子的穿膜和胞浆部分,其分子量也比相应膜结合粘附分子为小。由于可溶性粘附分子通常具有膜结合附分子的结合活性,因此可能作为机体调节细胞粘附作用的一个途径发挥作用。在某些疾病状态下,粘附分子的表达或脱落增加,导致血清中可溶性粘附分子的水平显著升高,使可溶性附分子的检测可能成为监测某些疾病状态的指征。
第三节 其它免疫细胞膜分子
免疫细胞膜分子种类繁多,分类的方法各有不同的角度。如前所述,CD抗原主要是应用单克隆抗体等技术,对于执行各种功能的细胞膜分子所进行的分类,几乎是包罗万象。在CD中,实际上包括了粘附分子中部分Ig超家族成员、大部分粘合素超家族成员和所有选择素成员。除此之外,从功能分类的角度,细胞膜分子还包括免疫活性细胞抗原识别受体、主要组织兼容性抗原、细胞因子受体、T和B淋巴细胞的分化抗原,这些内容将在本书有关的章节中分别阐述。本节主要介绍促分裂原及其在淋巴细胞上相应的结合分子以及各种IgFe受体。
一、促有丝分裂原受体
有丝分裂原(mitogen)来自植物蛋白或细菌产物,它能与多种细胞膜糖类及寡糖基分子结合,后者为促使丝分裂原受体、结合后能促使细胞活化和诱导细胞分裂。由于细胞膜含有不同糖基,故可认为是多克隆活化剂,它与抗原特异性的克隆活化是不同的。
T和B细胞表面都有分裂素受体,在体外可非特异性刺激静止淋巴细胞向母细胞转化。这种转化细胞DNA合成增加,出现细胞体积增大,胞浆增多,嗜碱性以及产生有丝分裂等形态变化。这种转化过程对研究淋巴细胞功能变化及淋巴细胞早期活化过程的生化变化甚为重要。这种淋巴细胞转化过程可用3H-TdR掺入,检测DNA合成变化或借光细胞转化,常用于T细胞功能检测。美洲商陆(PWM)可诱导T和B细胞转化,而细菌脂多糖(LPS)能引起B细胞转化(珍6-8)。
表6-8 常见促有丝分裂原的特征
| 名称 | 来源 | 分子量(kD) | 糖特异性 | 特性及应用 |
| 刀豆素A(ConA) | 刀豆 | 102 | α-D-mannosyl- α-D-glucose |
T细胞促有丝分裂原,分离细胞膜糖蛋白 |
| 植物血凝素(PHA) | 云豆 | 120 | N-actyl-D-galactosamine | T细胞促有丝分裂原 |
| 美洲商陆丝裂原(PNA) | 美洲商陆 | 32 | β-N-acetyl-D-glucosamine | B细胞、T细胞有丝裂原 |
| 大豆凝集素(SBA) | 花生 | 110 | D-galactosyl-(β1-3)-N-acetyl-D-galactosamine | 分离胸腺细胞亚群(皮质不成熟胸腺细胞与PNA凝集为PNA+细胞) |
| 大豆凝集素(SBA) | 大豆 | 120 | N-acetyl-D-galactosamine D-galactose |
凝集免疫活性B细胞、净化人骨髓用于骨髓移植 |
二、Ig Fe受体
Ig分为IgM、IgD、IgA、IgD和IgE五类。各类Ig的不同功能主要与其结构有关。机体内许多细胞表面具有不同类IgFe的受体,通过Fe受体与IgFe的结合,参与Ig介导的生理功能或病理损伤过程。目前已鉴定明确的Fe受体有FeγR、FcαR和FcεR.
(一)FeγR
1.FeγR的结构和分布 FeγR可分为FeγRⅠ、FeγRⅡ和FeγRⅢ三类,它们的结构和分布有所不同。
(1)FeγRⅠ(CD64):为70kD穿膜糖蛋白,属Ig超家族,胞膜外区有3个C2结构,FeγRⅠ主要分布于单核细胞、巨噬细胞、中性粒细胞等。IFN-γ可刺激单核细胞、巨噬细胞中性细胞表达FeγRⅠ水平增加5~10倍,G-CSF也这种促进作用。
(2)FeγRⅡ(CD32),为40kD穿膜糖蛋白,属于Ig超家族,胞膜外区有2个C2结构,FeγRⅡ表达于除红细胞外的其它血细胞。
(3)FeγRⅢ(CD16):为50~70kD糖蛋白,属Ig超家族,有2个C2结构。主要分布于巨噬细胞、NK细胞和嗜酸性粒细胞,中性粒细胞表面。
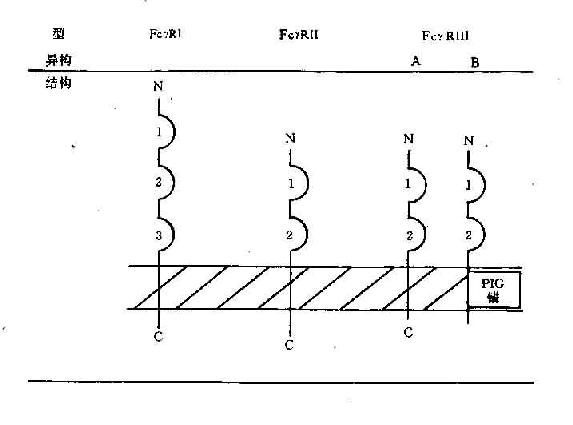
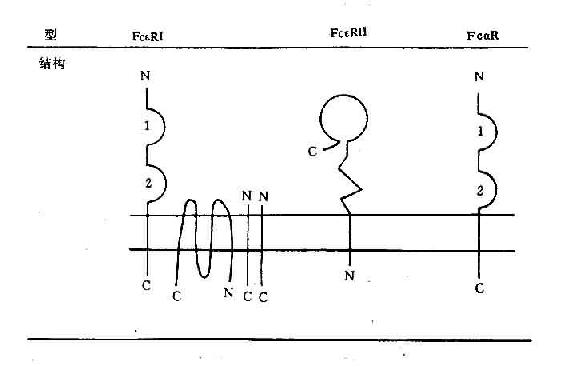
图6-2 人Feγ(上图)和人Feα、Feε受体(下图)结构示意图
2.FeγR的功能 FeγR的功能主要是通过髓样细胞和NK细胞来发挥的。
(1)单核-巨噬细胞:FeγRⅠ、Ⅱ和Ⅲ均可介导入单核细ADCC来杀伤肿瘤等靶细胞。这种ADCC效应为Mg2+依赖,并需要LFA-1等粘附分子参与。IFN-γ可促进单核细胞FeγRⅠ介导的杀伤作用.单核-吞噬细胞可能通过FeγRⅠ、Ⅱ、Ⅲ发挥调理吞噬和清除免疫复合物作用。
(2)中性粒细胞:新鲜分离的中性粒细胞不能通过FeγR溶解靶细胞,但在IFN-γ刺激后可通过FcγRⅠ和FcγRⅡ介导杀伤作用,对FcγRⅠ主要是诱导其表达水平升高,而对FcγRⅡ表达水平并未见改变,可能是通过杀伤机制的调节。GM-CSF也能通过FcγRⅡ明显增强中性细胞的杀伤水平。活化中性粒细胞通过FcγRⅠ、Ⅱ发挥调理吞噬和清除免疫复合物作用。
(3)嗜酸性粒细胞:未刺激的嗜酸性粒细胞没有杀伤作用,GM-CSF、TNF和IL-5等是嗜酸性粒细胞发挥ADCC效应的有效激活剂,在抗寄生虫和抗肿瘤中有重要作用。GM-CSF激活作用主要是通过FcγRⅡ介导的。
(4)NK细胞:通过FcγRⅢA介导ADCC杀伤肿瘤细胞等靶细胞,IL-2和IFN-γ可明显提高NK细胞的杀伤活性,但并不明显改变FcγRⅢ的表达水平。
(二)FcαR
FcαR(CD89)为分子量60kD的穿膜糖蛋白,属Ig超家族,胞膜外有2个C2功能区,呈中等亲和力,主要表达于单核细胞、巨噬细胞、中性粒细胞等,介导吞噬,ADCC以及炎症介质的释放。
(三)FcεR
FcεR的结构和分布 FcεR可分为FcεRⅠ和FcεRⅡ两类,它们的结构、分布以及介导的作用有所不同。
(1)FcεRⅠ:为高亲和力受体,K值10-9~10-10M。由α、β、γ-γ四条链组成。FcεRⅠ主要分布于嗜碱性粒细胞和肥大细胞。
(2)FcεRⅡ(CD23):低亲和力受体,分子量45kD,单链穿膜糖蛋白。胞膜外C端侧25kD部分又称为IgE结合因子(IgE-BF),FcεRⅡ可在蛋白水解酶裂解后形成可溶性CD23分子(Scd23)即IgE-BF。
2.FcεR的功能
(1)FcεRⅠ:嗜碱性粒细胞和肥大细胞具有高亲和力FcεRⅠ,当相应变应原与嗜碱性粒细胞、肥大细胞表面lgE/FcεRⅠ复合物结合后,使细胞脱颗粒,合成和释放多种介质,介导Ⅰ型速发型超敏反应。
(2)FcεRⅡ:FcεRⅡ为B细胞分化激活抗原,在变态反应性疾病患者PBMC中CD23密度明显增加,血清sCD23升高。sCD23具有BCGF活性,促进B细胞产生IgE,并与IL-4有协同作用。此外,FcεRⅡ还可介导IgE依赖的ADCC和容噬作用。
三、细胞因子受体
免疫细胞表面表达多种细胞因子受体(cytokine receptor),不同免疫细胞表达细胞因子受体的种类、密度和亲和力有所差别。
1.T细胞表面的细胞因子受体多种细胞因子可调节T细胞的功能,这是因为T细胞存在着相应的细胞因子受体,如IL-1R、IL-2R、IL-3R、IL-4R、IL-6R、IL-7R、IL-8R、IL-9R、IL-12R、TNF-αR、G-CSFR和TGF-βR等。静止和活化T细胞因子受体的数目和亲和力可有很大差别,如静止T细胞只表达IL-β链,与IL-2配体结合是中亲和力,当T细胞活化后同时表达IL-2Rα链和β链,并组成高亲和力受体。
2.B细胞表面的细胞因子受体多种细胞因子调节B细胞的活化、增殖和分化是通过与B细胞表面相应的细胞因子受体结合而发挥调节作用的。B细胞的细胞因子受体主要有IL-1R、IR-2R、IL-4R、IL-5R、IL-6R、IL-7R、IL-11R、IL-12R、IFN-γR、TNF-α和TGF-βR等。
3.单核-巨噬细胞表面的细胞因子受体单核-巨噬细胞表面有多种细胞因子受体,如MCFR、MIFR、MAFR、IFNR、M-CSFR、GM-CSFR等,相应的细胞因子作用后可调节单核-巨噬细胞的吞噬功能、细胞毒作用、MHCⅡ类抗原的表达以及单核因子的合成和释放。
四、羊红细胞受体
人T细胞表面有能与绵羊红细胞结合的受体,称为E受体,E受体在体外可与绵羊红细胞表面的配体在一定条件下结合,可在T细胞表面形成花环状,称为E花环。用这个方法可以检测人外周血T细胞的相对百分数,可作为判断人T细胞免疫功能指标之一。
E受体已证明是分子量为30~60kD的糖蛋白分子。应用单克隆抗体鉴定E受体,认为它是一种新的人T细胞分化抗原,命名为白细胞分化抗原2(Leu-5,OKT11,CD2)。目前认为E受体可能是介导Ca2+依赖的T细胞旁路活化途径。这一途径是与T细胞抗原受体活化途径完全不同的另一活化途径。
五、补体受体
Uhr等在60年代发现由抗原、抗体与补体分子形成免疫复合物与部分豚鼠淋巴细胞结合,如从复合物中除去补体,则复合物与细胞的结合明显减少。证明了细胞表面有补体受体(complement receptor,CR)的存在。其后应用抗绵羊红细胞抗体(A)和补体(C)致敏的绵羊红细胞(E)形成的复合物(EAC)可与细胞表面的补体结合形成花环,称为EAC花环。用以检测CR。
多数B细胞表面有CR,除B细胞外,单核 -巨噬细胞、中性粒细胞、K细胞、哺乳类动物血小板、人及灵长类红细胞上均有补体受体。B细胞的补体受体与其活化有关,补体受体也能促进吞噬细胞的吞噬作用。此外,如免疫粒附作用以及抗体依赖的细胞介导的细胞毒作用也与补体有关。
六、内分泌激素、神经递质和神经肽胺体
免疫细胞表面可具有多种激素、神经递质和神经肽的受体,如雌激素、甲状腺素、肾上腺皮质激素、肾上腺素、前列腺素E、生长激素、胰岛素等激素的受体,内啡肽、脑啡肽、P物质等神经肽受体,组胺、乙酰胆碱、5-羟色胺、多巴胺等神经递质受体。免疫细胞表面的激素、神经肽和神经递质受体是机体神经内分泌免疫网络中的一个重要环节。
第七章 免疫细胞(一):造血干细胞
在人和动物周围血中,存在形态不同、功能各异的多种血细胞。它们是红细胞、粒细胞、单核细胞、淋巴细胞及血小板。其生命亦各不同,如人红细胞生命周期约120天,粒细胞约20~62小时,血小板约为5~10天,单核细胞存在于骨髓者约为50天,存在于周围血者可超过200天,而淋巴细胞可存活数月至数年。这些血细胞可不断死亡与新生以维持血细胞的动态平衡异常,可使血细胞数量和质量发生改变,将会引起名种血液病或免疫性疾病。各种血细胞都起源于共同的祖先细胞,即造血干细胞。
第一节 造血干细胞的特性
一、造血干细胞的起源
造血干细胞(hemopoietic stem cell,HSC)是存在于造血组织中的一群原始造血细胞,它不是组织固定细胞,可存在于造血组织及血液中。造血干细胞在人胚胎2周时可出现于卵黄囊,第4周开始转移至胚肝,妊娠5个月后,骨髓开始造血,出生后骨髓成为干细胞的主要来源。在造血组织中,所占比例甚少,如在小鼠骨髓中105核细胞中的有10个,在脾中105有核细胞中只有0.2个。
二、造血干细胞的形态
干细胞是一种嗜碱性独核细胞,其大小约为8μm,呈圆形,胞核为圆形或肾形,胞核较大,具有2个核仁,染色质细质而分散,胞浆呈浅蓝色不带颗粒,在形态上与小淋巴细胞极其相似,但淋巴细胞体积较小,染色质浓染,核仁不明显且有细胞器。因此很难用形态学识别干细胞,并与其它独核细胞相区别。
造血干细胞可包括三级分化水平,即多能干细胞(pleuripotent stem cell),定向干细胞(Committed stem cell)及其成熟的子代细胞。
关于对造血干细胞的功能分析,长期以来仅限于对小鼠干细胞的研究,而对人干细胞的存在只是来自间接证据,因为不能在人体内进行如鼠体内的功能分析法。70年代以来,由于建立了新的体外细胞培养技术,大大促进了对人干细胞的直接研究。
三、造血干细胞的表面标志
由于造血组织中造血干细胞在形态学方面无法与其它单核细胞区别,而且数量极少,这为造血干细胞的分离纯化并对其功能分析和分化的研究造成极大困难。
近年来由于单克隆抗体技术的进步,流式细胞仪(FACS)的应用,以及对小鼠和人造血干细胞表面标志的研究,取得了很大进展,为造血细胞的分离纯化及鉴定创造了条件。
1.Thy-1与丝裂原(wheat germ agglutinin,WGA)Visseer等发现小鼠骨髓中造血干细胞对WGA有高亲和性。利用这一特性,应用FACS自骨髓中分离造血干细胞应及核系Mac-1等谱系抗原与WGA反应性相结合,即可自骨髓中Lin-/WGA+细胞群中分离造血干细胞,也获得良好结果。
也有学者发现正常小鼠骨髓细胞中,也能表达低密度Thy-1抗原(Thy-11。)。如与上述标志组合,即自骨髓Thy-11。Lin-,WGA+细胞群中,分离造血干细胞,可用于对造血细胞的功能分析。
2.干细胞抗原(stemcellantigen-1,Sca-1) 有学者制备一种抗原前T细胞杂交瘤的单克隆抗体,用这种单抗检出的抗原分子称为干细胞抗原-1(Sca-1)。其后有人自骨髓中Thy-1Io、Lin-、Sca-1+细胞群中,可分离纯人造血干细胞。
3.原癌基因(c-kit) 最近证明造血干细胞与c-kit基因密切相关。C-kit可编码一种穿膜酪氨酸激酶受体分子。应用单克隆抗体证明此分子可存在于造血干细胞膜上,其后证明它的配体分子是造血干细胞因子(stem cell factor,SCF)。它是信号传导分子,对造血干细胞的分化具有重要作用。目前,小鼠多能干细胞表面分子标志可视为Thy-1Io、WGA+、c-kit+、Lin-。
c-kit分子可高频率表达于多能干细胞表面,但骨髓中c-kit+细胞可分化为各种血细胞,而胸腺中c-kit细胞可分化为淋巴细胞,不能分化为髓系细胞,所以胸腺内c-kit+细胞,可能是淋巴样干细胞(表7-1)。
表7-1 胸腺及骨髓中c-kit+细胞分化机制
| 胸腺c-kit | 骨髓c-kit | |
| 粒细胞系 | - | + |
| 单核细胞系 | - | + |
| 红细胞系 | - | + |
| T细胞 | + | + |
| B细胞 | + | + |
4.CD34对人体造血干细胞表面标志的研究,是用单克隆抗体CD34证明的。CD34单克隆抗体检测的抗原即为CD34分子。自人骨髓细胞中应用FACS可分离纯化CD34+细胞群,如与造血因子共同体外培养可获得含有各种血细胞的混合集落,所以CD34+细胞为骨髓中造血干细胞,CD34抗原可视为骨髓造血细胞标志之一。
第二节 造血干细胞的分化
一、多能干细胞
多能干细胞是由Till和McCulloch等在60年代初,应用脾集落形成细胞定量法,首先在小鼠体内证明的。他们给经射线照射的小鼠输入同系鼠骨髓细胞,在10~14天后在脾内形成可见的结节,它是由单一骨髓细胞发育分化而成的细胞集落,称之为脾集落形成单位(colony forming unit-spleen,CFU-S)。集落数与输入的细胞数成正比,它可分化发育为红细胞、粒细胞及巨核细胞。CFU-S长期以来用体内集落法进行检测。
在70年代后Johnson和Metcalf等应用鼠胎肝细胞体外培养法,证明具有CFU-S性质的干细胞可在体外培养成功,这是在研究干细胞方法学上的重大改进。
其后,Haral等用小鼠骨髓细胞在甲基纤维素中加入红细胞生成素(erythropoietin,EPO)及脾细胞培养上清,进行体外培养,可形成含有红细胞、巨核细胞以及巨噬细胞的集落,称为混合集落形成单位(CFU-Mix)。其后,小林登等在80年代用人骨髓细胞亦报告CFU-Mix培养成功。即由多能干细胞可进一步分化为定向髓系多能干细胞及淋巴系干细胞。淋巴系干细胞是T和B细胞的共同祖先细胞,但目前尚不能用脾集落实验证明其存在。
二、单能干细胞
单能干细胞是一类具有向特定细胞系分化能力的干细胞,也称为祖细胞(progenitor)。如进行体内移植不能形成脾集落,但在一定造血因子的存在下,可在体外培养并形成细胞集落,称为代表外培养集落,称为体外培养集落形成单位(colony forming unit-culture,CFU-C),因此它与多能干细胞不同,它可包括分化为红细胞的红系干细胞,可分化为粒细胞和单核细胞的粒、单核细胞干细胞系及可分化为血小板的巨核干细胞系。
1.红系干细胞应用骨髓细胞加甲基纤维素在大量EPO存在下,进行体外培养可产生大型红细胞集落,可含有1000个以上的细胞,形成如爆发火花样的集落,称此干细胞为爆式红细胞集落形成细胞(burstunit-erythoid ,BFU-E)。如用小剂量EPO则产生小型集落,由8~50个细胞组成,称此干细胞为红细胞系集落形成细胞(colony forming unit-E,CFU-E)BFU-E是更早期的红系干细胞,而CFU-E则为较晚期的红系干细胞。
2.粒细胞-单核细胞系干细胞此系细胞在功能上与BFU-E或CFU-E属同级干细胞。应用软琼脂法将骨髓细胞进行体外培养,在集落刺激因子(CFS)存在下,可产生粒细胞和单核细胞集落,称此集落形成细胞为体外培养集落形成细胞(colonyformingunti-culture,CFU-C)。将CFU-C进行体内移植不能产生脾集落,所以CFU-D不具有CFU-S的特性,仅具有前驱细胞和前驱单核细胞的特征。
3.巨核干细胞系亦称巨核细胞集落形成细胞(colonyforming unti-megakaryocyte,CFU-M),Metcalf及其分泌的细胞因子和细胞外基质(extra-cellular matrix,ECM)组成,因此对造血干细胞发育分化过程的体外研究,有很大局限性,它不一定能真实反映体内情况,分析实验结果时,必须注意这种局限性。目前仍有很多关于造血干细胞发育分化的问题有待阐明。
表7-2 血细胞的分化与成熟
| 多能干细胞 | 多能定向干细胞 | 单能定向干细胞 | 成熟子代细胞 |
| 髓系干细胞 | 红系干细胞 粒、单核系干细胞 巨核干细胞 |
红细胞 粒细胞/单核细胞 血小板 |
|
| 淋巴系干细胞 | 前驱B细胞 前驱T细胞 |
B细胞 T细胞 |
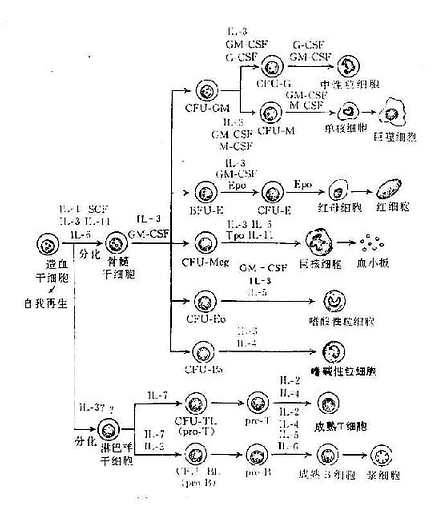
图7-1 造血干细胞分化与造血因子
第三节 造血干细胞与淋巴细胞的发生
由于用脾集落法未能证明淋巴细胞的发生,所以造血干细胞与淋巴细胞在发生学的关系,直到60年代Wu等建立了放射诱导染色体标记技术后才逐步得到阐明。
Wu等用照射诱导小鼠骨髓干细胞染色体发生一定程度的畸变,做为标记,但又不影响其细胞分裂。将这种细胞输入另一照射小鼠体内后,可以重建其造血和免疫功能。
由于它们具有特殊的畸形染色体,因此在照射宿主体内,任何二种细胞只要它们有共同的标记染体,应表明它们是来自同一干细胞。由于在照射诱导条件下,骨髓细胞中分化程度不同的干细胞,可以产生不同类型的染色体畸变,所以通过核型分析就能检查不同细胞的共同前体细胞。
Abramon等在70年代,用上述方法,发现在受体小鼠骨髓细胞、脾集落形成细胞以及经植物血凝素(PHA)和脂多糖(LPS)等丝裂原刺激的体外培养脾细胞中,都发现了一种共同的标记染色体,这证明它们都是从供体骨髓中的多能干细胞分化而来,从而有力的证明了无论是髓系干细胞和淋巴细胞,都是来自共同的造血干细胞。
目前已证明在小鼠骨髓中存在有前驱T细胞(pro-T)和前驱B细胞(pro-B)。ProT进入胸腺后可发育分化为成熟T细胞,pro-B则在骨髓内发育分化为成熟B细胞。但尚未直接证明在小鼠骨髓中存在有淋巴系干细胞。虽然如此,多数学者认为淋巴系干细胞可能是存在的。其检测困难可能是由于数量太少,或是由于对照射过于敏感,在照射过程中被选择地排除了。
近年的实验证明。在小鼠骨髓中c-kit+细胞可分化为各种血细胞及T和B细胞,但如将胸腺内c-kit+细胞移植于小鼠体内,则丧失其分化为髓系细胞的能力,仍能分化为T和B细胞。提示这种胸腺c-kit细胞可能是淋巴系干细胞。
第八章 免疫细胞(二):淋巴细胞系
淋巴细胞是具有特异免疫识别功能的细胞系,人和哺乳类动物的淋巴细胞系是由形态相似、功能各异的不均一细胞群所组成。按其个体发生、表面分子和功能的不同,可将淋巴细胞系分为T细胞和B细胞二个亚群,每个亚群又可分为不同的亚类。另外还有一群单核细胞,其来源可能与淋巴细胞相关,但不具有特别识别功能,称为天然杀伤细胞(natural killer cell,NK)可归类为第三群淋巴细胞。
成熟的T和B细胞均为单核的小淋巴细胞。在光学显微镜下,单纯从形态学是能加以区别的。但在它们的细胞膜上都有不同的分子结构,包括膜抗原分子和膜受体分子。这些表面标志都是结合在膜上的巨蛋白分子,可用不同的方法检测,借以鉴定和区分淋巴细胞系的不同亚群和亚类。
研究这些膜分子的结构与功能将有助于了解淋巴细胞活化的机制。研究这些膜分子基因的表达与调控,对了解淋巴细胞的起源、分化与成熟都具有十分重要的理论意义。并且在淋巴细胞的分类、诊断与相关疾病的治疗及发病学等方面都具有应用意义。
第一节 T细胞
一、T细胞主要表面分子
T细胞是由一群功能不同的异质性淋巴细胞组成,由于它在胸腺内分化成熟故称为T细胞。成熟T细胞由胸腺迁出,移居于周围淋巴组织中淋巴节的副皮质区和脾白髓小动脉的周围。不同功能成熟的T细胞均属小淋巴细胞,在形态学上不能区分,但可借其细胞膜表面分子不同加以鉴别(表8-1)。
在T细胞发育不同阶段以及成熟T细胞在静止期和活化期,其细胞膜分子表达的种类和数量均不相同。这些分子为抗原性不同的糖蛋白。它们与T细胞对抗原的识别、细胞的活化、信息的传递、细胞的增殖和分化以及T细胞的菜单达相关。它们也与T细胞在周围淋巴组织中的定位相关。
由于这些分子在T细胞表面相当稳定,故可视为T细胞的表面标志,可以用以分离。鉴定不同功能的T细胞。这些分子的单克隆抗体对临床相关疾病的诊断和治疗也具有重要应用价值。
表8-1 T细胞主要表面分子
| 名称 | 生化特性 | 配体 | 功 能 粘附 信号传导 |
| TCR | αβ异二聚γδ异二聚体 | MHC-肽复合分子 | + + |
| CD3 | 五聚体 | - | - + |
| CD4 | 单体分子 | MHCⅡ类分子 | + + |
| CD8 | 双体分子 | MHCⅠ类分子 | + + |
| CD28 | 同二聚体分子 | B7/BB1 | + + |
| CD2(LFA-2) | 单体分子 | CD58(LFA-3) | + + |
| CD11α/CD18 (LFA-1) |
αβ异二聚体分子 | CD54 (ICAM-1) (ICAM-2) |
+ + |
| CDw49/CD29 (VLA-4、5、6) |
αβ异二聚体分子 | VCAM-1 | + ? |
| CD44)(Pgp-1) | 单体分子 | ECM | + + |
| CD45 | 单体分子 | ? | ? + |
(一)T细胞抗原识别受体(TCR)
1.TCRαβ TCR是T细胞识别蛋白抗原的特异性受体,不同的T细胞克隆其抗原识别受体的分子结构也是不相同的。大多数成熟T细胞(约占95%)的TCR分子是由α和β二条异二聚体肽链组成的TCRαβ分子。二条肽链都由膜外区、穿膜区及胞浆区组成。TCR属于Ig超家族,膜外区可包括可变区(V区)及稳定区(C区)。
编码人TCRα链和β链基因座分别定位于第14号和7号染色体。α链是由V、J、C基因段编码的肽链。每个基因座又各有不同的等位基因,在T细胞发育分化早期与Ig基因一样经历基因重排、转录和转译成为肽链。TCR的特异性是由α链和β链的V-J及V-D-J基因片段决定的,故二条链基因重排后可形成千万种不同特异性的TCR分子,故可识别环境中多种多样的抗原。在通常情况下,异种蛋白抗原分子必须与细胞表面的自身MHC分子结合才能TCR识别。所以TCR只能识别细胞膜上的MHC分子与抗原分子,这是与B细胞识别原的主要不同特性。
2.TCRγδ另一种TCR是由γ和δ链组成的TCRγδ分子,它是由γ和δ基因编码的分子。这种TCRγδ细胞多见一胸腺内早期T细胞(CD4-,CD8-,TCRγδ+),而在人周围血成熟T细胞(CD3+,TCRγδ+)中所占的比例甚少,约为1%~10%。在小鼠脾、表皮细胞和肠粘膜上皮细胞中亦可发现γδ+T细胞。对这种新发现的T细胞的生理功能尚不不清楚,但它们可能是具有原始受体的第一防线的防御细胞,与清除表皮及上皮细胞内异物有关,它们可能是具有原始受体的第一防线的防御细胞,与清除表皮及上皮细胞内异物有关。它们可识别高度保守的抗原,如结核杆菌、肠毒素和热休克蛋白等抗原,在人和小鼠均表明它们可识别MHC或MHC样分子。
(二)CD3分子
此分子可表达于所有成熟T细胞表面,它是由五条肽链非共价结合组成的复合分子,分别称为γ、δ、ε、ζ和η链。五条肽链均由胞外区、穿膜区和胞浆区组成。γ、δ和ε为单体,ζ和η链其胞外区可由双硫键连接组成为同二聚体ζζ(约占90%)和异二聚体ζη分子(约占10%)。
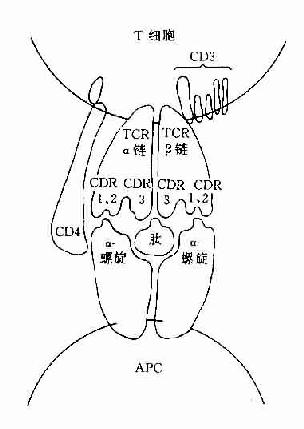
图8-1 TCR识别普通抗原
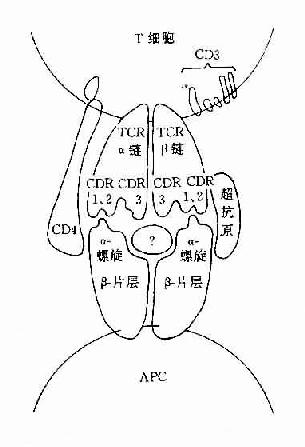
图8-2 TCR识别超抗原
CD3分子可与TCR分子以非共价结合形成一个TCR-CD3复合受体分子,是T细胞识别抗原的主要识别单位。其中TCR是识别异种抗原和自身MHC分子多态性决定族的受体,而CD3分子交不参予抗原识别,它具有稳定TCR结构和传递活化信号的作用。
(三)CD4和CD8分子
这二种分子可同时表达于胸腺内早期胸腺细胞,称为双阳性胸腺细胞(CD4+、CD8+,DP)。而在成熟T细胞这二种分子是互相排斥的,只能表达一种分子,故可将成熟T细胞分为二类,即CD4+细胞和CD8+细胞。在外周淋巴组织中CD4+T约占65%,CD8+T约占35%。
这二种分子同属于Ig超家族,都不具有多样性。其分子结构都由胸外区、穿膜区及胸内区组成。CD4分子为55KD的单体,CD8分子为34KD多肽组成的双体分子。
这二种分子与抗原识别无关,但可与带有MHC分子的细胞结合,它们是细胞与细胞间相互作用的粘附分子。CD4分子是MHCⅡ类分子的受体,它可与MHCⅡ类分子的非多态区结合。CD8分子可与MHCⅠ类分子的非多态区结合。因此这二种分子具有增强TCR与抗原呈递细胞或靶细胞的亲和性,并有助于激活信号的传递。
(四)CD28分子
这种分子可表达于全部CD4+T细胞及50%CD8+细胞。它是80~90KD的由双硫键连接的同源二聚体分子,属Ig基因超家族。
近年的研究证明T细胞的活化需要双信号,即由TCR-CD3复合分子可提供起始信号或第1信号,还必须有协同刺激信号(costimulatouy signal)或第2信号才能使T细胞活化。在T细胞膜上已发现有多种分子与协同刺激信号产生有关,如CD2、LFA-1、VLA-4及CD28分子等。称这种分子为辅助分子或协同刺激受体分子。
其中以CD28分子最为重要,已证明它的配体分子存在于B细胞或其它抗原呈递细胞上,命名为B7或BB1分子。它是50KD单体分子的穿膜蛋白,也属Ig基因超家族。B7/BB1分子在静止期B细胞、巨噬细胞或树突状细胞等表达弱,而活化型细胞表达增强。
(五)CD2分子
此分子亦称为LFA-2、Len-5或羊红细胞受体等名称。为55KD单体分子,属Ig基因超家族,亦为穿膜糖蛋白分子。可存在于成熟T细胞及胸腺细胞,亦可发现于NK细胞。
CD2分子是细胞间粘附分子,其配体分子称为白细胞功能相关抗原-3(LFA-3,CD58),为55-70KD糖蛋白分子。可广泛表达于造血细胞和非造血细胞。CD2分子与羊红细胞上LFA-3结合形成花环,称为E-花环,可用鉴定和分离人T细胞。
CD2也是信号传导分子,可使T细胞活化,它不依赖于TCR途径,是T细胞活化第二途径。特别是在胸腺内早期发育阶段的胸腺细胞尚未表达TCR,此时胸腺细胞的活化与增殖可能是通过CD2分子与胸腺上皮细胞表面的LFA-3分子结合而使之活化。
(六)极迟活化分子
极迟活化分子(very late activation,VLA)或称β1粘合素(β1integrins),本族分子具有共同的β链(CD29),计有3种分子即VLA-4、VLA-5和VLA-6分子。它们可表达于静止T细胞上,但活化T细胞有仅数量增多而且对特异配体的亲和力也增强。VLA分子可与细胞外基质(ECM)配体分子相结合,可为T细胞活化提供协同刺激信号。VLA-4还可使淋巴细胞与Peyer小体的高内皮微静脉以及炎症部位的内皮细胞结合,其配体分子称为血管细胞粘附分子-1(VCAM-1)。
(七)细胞因子受体
细胞因子受体(cytokine receptor,CKR)可表达于静止及活化T细胞表面,静止T细胞表面的细胞因子受体亲和力弱,数量少,而活化T细胞表面CKR亲和力高且数量多。
T细胞表面可有多种细胞因子受体,包括IL-2R、IL-4R、IL-6R及IL-7R等。其中IL-2R由α(P55)及β(P70)链组成,α链为低亲和力,β链为中等亲和力,而αβ异聚体分子则为高亲和力受体。
(八)CD44及CD45分子
CD44分子亦称Pgp-1细胞外基质受体Ⅲ或Hermes分子。它可表达于多种细胞,包括T细胞、胸腺细胞、B细胞、粒细胞、巨噬细胞、红细胞、神经细胞、上皮及纤维母细胞等。CD44分子可使淋巴细胞与高内皮微静脉(HEV)结合,移行于血管,组织和淋巴之间,与淋巴细胞再循环密切相关,可视为一种归巢受体(homingreceptor,HR)。人记忆T细胞比未受体抗原刺激的天然T细胞可表达高水平CD44分子。
CD45分子亦称白细胞共同抗原(leukocyte common antigen)包括一组膜糖蛋白,只表达于不成熟和成熟白细胞,可包括T和B细胞、胸腺细胞、单核-巨噬细胞以及中性粒细胞。CD45分子的异构体(isofoums)常限定在某些T细胞表面表达,故称之为CD45R。
未受抗原刺激的天然T细胞可表达CD45RA,而记忆T细胞可表达CD45RO。另外,CD45R分子胞浆区含有内源性酪氨酸磷酸酶活性,它可能对各种活化途径具有重要调节作用。
二、T细胞亚群的分类及功能
T细胞是不均一的群体,按其抗原识别受体,可将T细胞分为二大类。一类是TCRαβ、T细胞,另一类是TCRγδ细胞(表8-2)。
表8-2 TCRαβ+T细胞与TCRγδT细胞的特性
| TCRαβT细胞 | TCRγδT细胞 | |
| 分子结构 | 二硫键相连的异二聚体分子 | 二硫键相连的异二聚体分子 |
| 多样性 | 多 | 少 |
| 分布 | 周围血60%~70% | 周围血1%~10%表皮及肠粘膜上皮 |
| 表型 | CD4+CD8+(DP)60% CD4-CD8-(DN)35% CD2+100% CD5+>95% |
CD4-CD8-(DN) CD2+ CD5- |
| 发育 | 胸腺(发生晚) | 胸腺(发生早)存在胸腺外途径 |
| 功能 | 识别与MHC分子结合的多肽复合 分子抗原 |
可能的作用 · 第一线防御细胞的原始受体 · 可识别MHC或MHC样分子 · 识别由MHC 样分子呈递的抗原 |
TCRαβT细胞也是不均一的群体,根据其表型(phenotype)即其细胞表面的特征性分子的不同,可将成熟T细胞分为二个亚类(subsets)即CD4+T细胞和CD8+细胞。
根据TCRαβT细胞的功能可将其分为二类。一类为调节性T细胞,可包括辅助性T细胞(helperT lymphocte,TH)和抑制性T细胞(suppressorT lymphocyte,Ts)。另一类为效应性T细胞(effectorT cell),可包括杀伤性T细胞(eytolytie T cell,CTL,或TC)和迟发型超敏性T细胞(delayed type hypersensitivity Tlymphoctye,TDTH)。
(一)TCRαβT细胞
二类T细胞表型分子均呈CD2+、CD3+阳性,但γδT细胞为CD4-、CD8-双阴性细胞(double negative cell,DN)或CD8+,而αβT细胞其表型为CD4+或CD8+单阳性细胞(single positive cell,SP)。
在末梢血主要为αβT细胞可占95%,而γδT细胞只占1%~10%。αβT细胞为主要参予免疫应答的T细胞,而对γδT细胞功能不十分了解,可能是具有原始受体的第一防线的防御细胞,与抗原感染有关。
(二)CD4+细胞
TCRαβTCD4+细胞(简称为CD4+细胞)的分子表型为CD2+、CD3+、CD4+、CD8-。其TCR识别抗原是MHCⅡ类分子限制性。CD4+T细胞也是不均一的细胞群,按其功能可包括二种T细胞,即辅助性T细胞(TH),和迟发型超敏性T细胞(TDTH)。前者为调节性T细胞,后者为效应性T细胞。
CD4+T细胞能促进B细胞、T细胞和其它免疫细胞的增殖与分化,协调免疫细胞间的相互作用。T细胞在静止状态不产生细胞因子,活化后才能产生。
近年来,根据建立的小鼠TH细胞克隆,分析其产生的细胞因子种类,发现具有不同的调节功能,可将TH细胞分为二类,即TH1和TH2(表8-3)。TH1与细胞免疫及迟发型超敏性炎症形成有关,故亦称为炎症性T细胞,相发于TDTH细胞。TDTH细胞。TH2可辅助B细胞分化为抗体分泌细胞,与体液免疫相关,相当于TH细胞。
表8-3 小鼠TH1及TH2特性
| 特性 | TH1(炎症性T,Tinf) | TH2(辅助性T,TH) |
| 功能 | ||
| Ig产生 | + | ++ |
| B细胞增殖 | + | ++ |
| 迟发型超敏性(DTH) | ++ | - |
| 细胞毒性(CTL) | ++ | - |
| MФ活化 | + | + |
| 细胞因子 | ||
| IL-2 | ++ | - |
| IFN-γ | ++ | - |
| TNF-β | ++ | - |
| IL-3 | ++ | ++ |
| GM-CSF | + | ++ |
| TNF-α | + | ++ |
| IL-4 | - | ++ |
| IL-5 | - | ++ |
| IL-6 | - | ++ |
| IL-10 | - | ++ |
| 细胞因子受体 | ||
| IL-1 | - | ++ |
| IL-2 | ++ | ++ |
| IL-4 | + | ++ |
近年一些学者在过敏性疾病的患者及健康人末硝血中也建立了人TH1和TH2克隆,也证实了在人也存在TH1和TH2细胞(表8-4)。这二类细胞是互相制约的,它们的失调与感染性疾病以及自身免疫性疾病相关。
(三)CD8+T细胞
CD8+T细胞也是不均一的细胞群,按其功能可包括抑制性T细胞(TS)和杀伤性T细胞(TC),前者为调节性T细胞,后者为效应性T细胞。
1.TC细胞 杀伤T细胞(TC)其分子表型为CD2+、CD3+、CD4+、CD8+。其TCRαβ只能识别自己MHCⅠ类分子与抗原肽片段结合的复合分子,所以是MHCⅠ类分子限制性。TC细胞主要识别存在于靶细胞表面上的MHCⅠ类分子与抗原结合的复合物,如被病毒感染的靶细胞或癌细胞等。因此,TC效应细胞与抗原病毒免疫、抗肿瘤免疫以及对移植物的移植排斥反应有关。
表8-4 人TH1及TH2特性
| 特性 | TH1 | TH2 |
| 细胞因子 | ||
| IL-2 | + | ± |
| IFN-γ- | + | - |
| IL-4 | - | + |
| IL-5 | - | + |
| 辅助功能 | ||
| IgG/IgA/IgM产生 | + | ++ |
| IgE产生 | - | + |
| 细胞毒性 | + | - |
| 抗原反应性 | ||
| TT.PPD | + | - |
| 变应原 | - | + |
注:TT,破伤风类毒素;PPD:纯化结核菌素
2.Ts细胞 Ts细胞是一类与TH细胞和Tc细胞性质不同的淋巴细胞。Ts细胞是美国学者Gershon于70年代在小鼠体内证明它的存在。他是给小鼠经静脉注射大剂量抗原(羊红细胞)则小鼠呈现不应答状态即耐受状态。如果把这种耐受小鼠的淋巴细胞,注入正常同基因小鼠同素小鼠体内,可抑制其抗体产生。其后证明这种具有抑制作用的淋巴细胞是Thy-1+T细胞,故称这种细胞为Ts细胞。
现已证明,人Ts细胞的分子表型与Tc相同,也是CD2+、CD3+、CD4+、CD8+。它的功能是抑制免疫应答的活化期。Ts细胞的抑制作用是通过它所分泌的抑制因子(TSF)介导的,其作用的靶细胞是抗原特异的TH和或B细胞。
Ts细胞可发挥两种重要作用,首先它对在胸腺内不能形成自身耐受的自身反应性T细胞克隆有抑制作用,同时它对非已抗原透发的免疫应答也有抑制作用。实验证明,Ts细胞功能变化是引起各种免疫功能异常的重要原因之一。
由于对Ts细胞的研究进展缓慢,尚有许多疑问有待解决。这主要是因为尚不能获得较大量的纯化Ts细胞,对建立稳定的Ts细胞克隆以及建立具有特异抑制活性的Ts杂交瘤均未获成功。因此,对Ts细胞的一些基本问题,如Ts细胞抗原识别受体(TCR)的性质及其分泌的抑制因子(TSF)的特性等问题,均有待明确。故目前尚不能描述它们的分子结构及作用方式。
Ts细胞是否是一种独立的T细胞功能亚类,学者间还存在很大争论,今后必需证明它的TCR性质和找出其独特的表面标志,才能解决这一问题。
(四)CD45RA与CD45ROT细胞
近年应用单克隆抗体发现一组新的细胞膜表面分子,命名为CD45分子。它可广泛存在于造血系细胞膜表面,故也称之为白细胞共同抗原(leukocyte common antigen,LCA),分子量约为200KD的糖蛋白分子。根据其胞外区表位的不同已发现有6种异构体分子,在人已鉴定出3种异构体分子,即CD45RA、CD45RB和CD45RO。应用这种异构体分子可将T细胞分为二个新亚群。凡未经抗原刺激的T细胞可称之为原始T细胞(naive tcell,Tn)为CD45RA+T细胞群,而经抗原刺激分化为记忆T细胞(memory T cell,Tm)为CD45RO+细胞群,二群T细胞功能特性不同(表8-5)。
表8-5 Tn与Tm特性
| 特性 | Tn | Tm |
| CD45 | CD45RA | CD45RO |
| 归巢受休表达 | 高水平 | 低水平 |
| 粘附分子表达 | 低水平 | 高水平 |
| 再循环 | 血流→淋巴组织 | 直接移行至抗原部位 |
| 寿命 | 短(数目) | 长(数月) |
| 再次抗原刺激 | - | +++ |
T细胞可随血流及淋巴分布于体内各部位,在正常情况下,T细胞在周围组织中的数目是相对稳定的。如在胸导管淋巴液中可占90%,在脾中约占30%,淋巴节中约占75%,末梢血中可占60%~80%。CD4+和CD8+细胞的比例,在周围各组织中大致相同,即CD4+约占60%,CD8+约占30%。CD8+的比值在正常人约为2,若其比值<1.0或>2.0可视调节细胞(TH/TS)比例异常,与临床一些疾病相关。可应用抗各种表型抗原的单克隆抗体检测全T细胞的数量及其亚类((TH/TS)的比值,常有助于疾病的诊断。
三、T细胞在胸腺内的发育
在一个体内能特异识别各种抗原的T细胞总数称之为T细胞库(T cell repertoire),成熟的T细胞库具有二种基本特性。其一为T细胞识别抗原是MHC限制性的,即每一个体的T细胞只能识别与其自身MHC分子结合的异种抗原分子。另一特性为T细胞库对自己抗原是耐受性的,即每一个体的T细胞不能单独识别自己MHC分子或是与之结合的自己抗原分子,即所谓自身耐受现象。
如果不能维持自身耐受,将导致发生抗自己组织抗原的免疫应答和自身免疫性疾病。所以了解成熟T细胞库是如何发育形成的,不仅对了解T细胞特异性的产生是重要的,而且有助于揭示自身免疫病的致病机制。
胸腺是T细胞发育成熟的主要部位,故称之为中枢免疫器官。胸腺微环境为T细胞发育分化创造了条件。对T细胞发育细胞发育分化的研究主要是在小鼠体内进行的,并由此推论至人类。
(一)胸腺微环境
胸腺微环境主要由胸腺基质细胞(thymic stroma cell,TSC)细胞外基质(extracellular matrix,ECM),和细胞因子等组成。当T祖细胞(pro-T)自胚肝或骨髓进入胸腺后,在胸腺微环境作用下,可诱导其发育分化。在其分化成熟过程中,可先后发生各种分化抗原的表达,各种细胞受体的表达,并通过正和负选择过程,最终形成T细胞库。最后成熟T细胞被迁移出胸腺,并定居于周围淋巴器官,参于淋巴细胞再循环,可分布于全身组织等一系列复杂过程。
1.胸腺基质细胞胸腺基质细胞可包括起源于胸腺胚基内胚层的上皮细胞和来源于骨髓的巨噬细胞、树突状细胞(dendritic cell,DC)、纤维母细胞、网织细胞和肥大细胞等。在基质细胞中以上皮细胞数量最多、分布最广,可分为皮质上皮细胞和髓质上皮细胞。它们在T细胞分化不同阶段都起重要作用,上皮细胞主要与正选择过程相关,而巨噬细胞等则与负选择过程相关。
2.细胞外基质 T细胞在胸腺内的发育是由皮质向髓质移行的过程中完成的。在此过程发育中的T细胞即胸腺细胞需与胸腺基质细胞直接相互接触,或是通过细胞外基质介导二种细胞间接触,因此ECM在T细胞的分化发育中也起重要作用。现已确定的细胞外基质有胶原蛋白(collegen),网状纤维、葡糖胺以及一些糖蛋白如纤维粘连素(fibronectin,FN),层粘连蛋白(laminin,LN)等。
3.细胞因子胸腺细胞和胸腺基质细胞都能分泌细胞因子,并都有一些细胞因子受体,可相互调节胸腺细胞与胸腺基质细胞的分化发育和维持胸腺微环境的稳定(表8-6)。
表8-6 胸腺细胞和上皮细胞产生的细胞因子及受体
| 细胞因子 | 细胞因子受体 | |||
| 胸腺细胞 | 上皮细胞 | 胸腺细胞 | 上皮细胞 | |
| IL-1 | + | + | + | + |
| IL-2 | + | - | + | + |
| IL-3 | + | + | - | - |
| IL-4 | + | - | + | + |
| IL-6 | + | + | + | + |
| IL-7 | + | + | + | + |
| IL-8 | - | + | - | - |
| IFNγ | + | - | + | + |
| IFNα | + | + | + | + |
| TGFα | - | - | - | + |
| GM-CSF | - | + | - | - |
| M-CSF | - | + | - | - |
| G-CSF | - | + | - | - |
(二)T细胞在胸腺内的发育过程
通过对小鼠T细胞发育的研究表明,当来自胚肝或骨髓的T祖细胞(pro-t)进入胸腺后,可经历不同的发育阶段,其TCRαβ、CD3以及协同受体CD4和CD8等分子的表达水平不同,是受高度调节的发育过程。
实验证明,小鼠T细胞在胸腺内的分化发育可分为三个阶段:即早期T发育为双阴性细胞阶段,其主要表型为CD4-和CD8-,故称为双阴性细胞(DN)。第二阶段为不成熟胸腺细胞,即由DN细胞经单阳性细胞(CD4-、CD8+、)进而分化为双阳性(CD4+、CD8+、)细胞(doublepositive,DP)。第三阶段为由DP细胞经正、负选择过程,分化发育为具有免疫功能的成熟T细胞,只表达CD4+或CD8+,故称为单阳性细胞(single positive,SP),然后迁出胸腺,移居于周围淋巴器官。
上述四群细胞都是不均一的群体,而且由一个分化阶段发育为另一阶段还有许多移行型细胞,因此对T细胞发育的了解尚有许多问题需待进一步深入研究。
1.早期T细胞发育阶段由胚或骨髓干细胞衍生的T细胞进入胸腺后经前T细胞(pre-T)发育为双阴性细胞,这一过程可视为早期T细胞发育阶段。
Pro-T细胞(表型为CD410、CD3-、CD8+、CD25-、C-kit+、Lin-、TCRαβ-)通过其表面粘附分子与胸腺毛细胞血管内皮细胞上的配体分子结合,并在上皮细胞分泌的多种趋化因子作用下,穿过血胸屏障进入胸腺。在皮质区进行增殖和分化,经Pre-T(表型为CD3-、CD4-、CD8-、CD25-、C-kit10,其TCRβ及γ基因发生重排及转录)进一步发育为DN细胞(其表型为CD3+、CD4-、CD8-、CD25-、TCRαβ-),但其TCRβ-βCD3可表达于细胞表面,与基质细胞配基结合后,经p56lek传导信号,诱导CD4/CD8分子表达及TCRβ基因发生等位排斥。由此使T细胞发育进入DP阶段,并发生胸腺内的选择过程,最终发育为单阳性(SP)的成熟T细胞库。
2.胸腺选择过程 主要发生于DP阶段,此时TCRαβ基因重排、转录及表达,形成TCRαβ-CD3复合分子,并具有识别配基(自已MHC分子+自己抗原分子)的功能。DP细胞与不同胸腺基质细胞(TSC)相互作用,可导致不同的结果。
胸腺细胞经选择作用后,能存活或被排除,基于它们TCRαβ的特异性,决定于TCR与MHC分子的结合和在胸腺内表达的抗原分子。阳性选择过程可使能自己MHC分子限制性的T细胞克隆增殖,产生功能性成熟T细胞;而阴性选择过程,可使对自己抗原反应性T细胞克隆被排除或不应答,形成自身免疫耐受(表8-7,图8-3)。这是二个顺序过程,提示阳性选择可能发生在阴性选择之前。
图8-3胸腺内TCR特异选择
1)阳性选择(positiveselection,PS):主要发生在DP细胞与皮质型上皮细胞之间的相互作用。凡TCR与自已MHc 分子有亲和性的胸腺细胞可与之结合并导致克隆增殖,而无亲和性的胸腺细胞将导致死亡。在此过程中大部分DP细胞死亡,只有小部分DP细胞存活并增殖。此过程可排除所有非已MHC限制性T细胞克隆,保存自己MHC限制性T细胞克隆和潜在的有害的自身反应性T细胞克隆。此过程可使DP细胞分化为SP细胞。
2)阴性选择(negativeselection,NS):主要发生于DP细胞与胸腺内巨噬细胞(MФ),树突状细胞(DC)或髓质上皮细胞间的相互作用。胸腺细胞TCR与存在于上述细胞上自己抗原与自己MHC复合物有高亲和性者结合,可导致自身反应性T细胞克隆死亡并被排除,称之为克隆排除(clonal deletion)或克隆存在但受抑制不能活化,称之为克隆不应答(clonal anergy)。现已证明克隆排除与细胞程序性死亡(PCDD)相关,克隆不应答与缺乏活化信号相关,称这种耐受为中枢耐受。但不在胸腺表达的自己抗原,其自身的反应性T细胞仍能发育成熟,并漏出周围淋巴组织,可能由Ts细胞抑制其活性,导致周围自身耐受,所以自身耐受的形成是由多种机制完成的。经胸腺阴性选择作用后,排除了自身反应性T细胞克隆,只有识别非已抗原与自已MHC分子结合的T细胞克隆存活,并由DP细胞分化为具有功能的单阳生(SP)细胞(CD4+或CD8+T细胞)。所以成熟T细胞库表现为自己MHC限制性和自己耐受二种特征。
表8-7 胸腺内阳性/阴性选择
| 胸腺外组织(胚肝,骨髓) | T祖细胞(progenitor-T,Pro-T) |
| 胸腺皮质 | ↓ CD4-CD8-(DN) ↓ CD4+CD8+(DP) ↓ 阳性选择 获得自己MHC限制性 CD4+ CD8+(SP) (自身反应与非自身反应性克隆) |
| 胸腺髓质 | 阴性选择↓排除自反性克隆或不应答(自己耐受) CD4+ CD8+ (MHCⅡ限制TH) (MHCⅠ限制性TC) |
| 周围淋巴组织 | CD4+ CD8+ (TCRαβ) (TCRαβ) |
第二节 B细胞
B细胞首先证明是在鸟类淋巴样器官法氏囊内发育成熟的,故称之为B细胞。哺乳类动物B细胞,在胚胎早期系在胚肝,晚期至出生后则在骨髓内分化成熟。成熟B细胞可定居于周围淋巴组织,如淋巴结的皮质区和脾的红髓及白髓的淋巴小结内。
B细胞是体内唯一能产生抗体(免疫球蛋白分子)的细胞。体内含有识别抗原特异性不同的抗体分子,其多样性是来自千百万种不同B细胞克隆。每一B细胞克隆的特性是由其遗传性决定的,可产生一种能与相应抗原特异结合的免疫球蛋白分子。外周血中,B细胞约占淋巴细胞总数的10%~15%。
一、B细胞膜主要表面分子
(一)B细胞抗原识别受体(BCR)
BCR与TCR一样,也是由复合分子组成。即由特异识别抗原的分子信号传导分子组成的BCR复合分子(图8-4)。BCR识别抗原分子早已证明是由B细胞表面免疫球蛋白分子(surface immunoglobulin,sig)组成,它是由二条相同的重链(H)和二条相同的轻链(L)构成的4肽链分子。sIg均为单体结构,在正常人外周血中多数B细胞可同时表达sIgM和sIgD,少数B细胞只表达sIgG、sIgA或sIgE。sIg是鉴别B细胞的主要特征,可用荧光素标记的抗Ig抗体检测B细胞。
近年的研究证明BCR还存在另一组分子,是由二硫键连接的异二聚分子组成,称之为sIgα和Ig-β链(分别命名为CD79a和CD79b)。它们的分子结构相关,是由Ig超家族基因mb-1和B29分别编码的糖蛋白分子,它们的功能与信号传导有关,与TCR中CD3分子的作用相似。
BCR能识别可溶性蛋白抗原分子,它识别的表位是构像决定簇,这一特性与TCR明显不同(表8-8)。B细胞经BCR对抗原的摄取、加工和呈递作用,通过信号传导可引起胞浆内一系列生化变化及核内基因的活化、增殖、分化、不应答或诱导细胞程序性死亡。
表8-8 BCR与TCR识别抗原的比较
| · BCR-Igα、Igβ · 配体-受体相互作用,抗原-BCR · 直接结合游离抗原 · 可与任何蛋白质抗原发生应答 · 识别的抗原表位空间构型决定簇15AA |
TCAR-CD3 三分子复合物、抗原-MHC-TCR 不能与游离抗原结合 只能与MHC·肽应答 识别的抗原表位降解的线性肽片段8~12AA |
(二)Fc受体
许多免疫细胞表面都有Fc受体,它是结合免疫球蛋白Fc段的分子结构。结合不同类别Ig的Fc受体,其性质各异,细胞上FcR的类型和数目也是不固定的。
大多数B细胞表面具有IgGFe受体Ⅱ(FerR),能与IgGFe段结合。活化B细胞此受体密度明显增高,分化至晚期又下降。FerR可与免疫复合物结合,有利于B细胞对抗原的捕获和结合,以及B细胞的活化和抗体产生。如将鸡红细胞(E)与其IgG抗体(A)结合形成的复合物与B细胞混合后,可见B细胞周围有红细胞粘附形成的花环,称为EA花环,也是检测B细胞的一种方法。
近年发现在活化B细胞表面可具有IgEFe受体(FerRⅡ)即CD23分子,它是一种B细胞生长因子受体,可能与B细胞分化增殖有重要作用。
(三)补体受体(CR)
大多数B细胞表面有能与C3b和C3d结合的受体,分别称为CRⅠ和CRⅡ(即CD35和CD21)。CRⅠ主要见于成熟B细胞,活化B细胞其密度明显增高,但进入分化晚期又下降。CR可与抗原和抗体及补体形成的免疫复合物结合,促进B细胞的活化,CRⅡ也是EB病毒的受体。
(四)细胞因子受体(CKR)
活化B细胞可表达多种细胞因子体,如IL-1、IL-2、IL-4、IL-5以及IFN-γ等受体,与相应因子结合可促进B细胞的增殖和分化。
(五)丝裂原受体
B细胞表面的丝裂原受体与T细胞不同,因此刺激B细胞转化的丝裂原也不同。如用美洲商陆(PWM),或脂多糖与外周血淋巴组织共同培养时,B细胞相应受体可与之结合而被激活,并进行增殖分化为淋巴母细胞,称为B细胞有丝分裂原反应,也称淋巴细胞转化试验,可用于对B细胞的功能检测。
(六)主要组织相容性抗原(MHC)
B细胞发育未成熟时,已表达MHCⅡ类分子,活化B细胞MHCⅡ类分子表达明显增多。MHCⅡ类分子能增强B和T细胞间的粘附作用,同时也是呈递抗原的分子。MHCⅡ类分子交联与信号传导有关,可促进B细胞活化。近年证明超抗原可与MHCⅡ类分子有高亲和性,亦与促进B细胞的活化有关。
(七)B细胞分化抗原(CD分子)
近年来应用单克隆抗体鉴定出存在于B细胞表面的特有抗原分子,而不存在于其它免疫细胞上。这些抗原可表达于B细胞发育分化的不同阶段,故称为分化抗原,对B细胞的分化和鉴定具有重要意义。
通过对CD分子的结构与功能研究,表明这些分子不仅是B细胞的特异表面标志,而且具有重要的生理功能。实验证明B细胞的活化,除了由BCR与其相应抗原结合后提供活化的起始信号外,还需由其表面的辅助分子与其相应配体分子结合后,提供的协同刺激信号,才能使B细胞处于活化状态,即B细胞的活化与T细胞一样,也是由双信号介导的。
目前已发现有一系列辅助分子参与这一过程,它们是CD19、CD21、CD20、CD22、CD40及CD45等分子。这些分子对B细胞的活化、增殖、分化或耐受体形成都具有重要作用(表8-9)。
表8-9 参与B细胞信号传导的主要CD分子
| CD | 分子量(KD) | 化学性质 | 表达细胞 | 功能 |
| CD19 | 95 | 糖蛋白 | 前B细胞 成熟B细胞 |
B活化调节 发育调节 |
| CD20 | 35 | 糖蛋白 | 前B细胞 成熟B细胞 |
活化、增殖、分化 |
| CD21 | 145 | 糖蛋白 | 成熟B细胞 | B活化调节 B发育调节 |
| CD22 | 135 | 糖蛋白 | 成熟B细胞 | B活化调节 |
| CD40 | 活化B细胞 | B细胞增殖、分化调节 | ||
| CD45 | 180~220 | 糖蛋白 | 成熟B细胞 | B细胞活化调节 |
二、B细胞亚类
(一)CD54+B细胞的生物学特性
根据B细胞表型的不同,目前可将B细胞分为二个亚类。最初认为Ly-1(CD5)抗原是小鼠T细胞的表面标志,但以后发现在一部分B细胞群中其面也可表达Ly-1抗原,即Ly-1+(CD5+)B细胞,称这种细胞群为B1细胞。而另一亚类B细胞,其表型则为即Ly-1-(CD5-)B细胞,即通常B细胞,称之为B2细胞。在人也证明存在与小鼠相当的B细胞亚类,即CD5+(Leu-1+)B细胞(B1)和(CD5-(Lun-1+)B细胞(B2)二个亚类。
B1细胞群和B2细胞群无论在起源、表型和生物学特性等方面均有所不同。近年根据表型的不同可将B1细胞群进一步分为Bia和Blb。B细胞亚类表型见表8-10。
表8-10 B细胞亚类表型
| 膜标志 | B1 | B2(通常B细胞) | |
| B1a | B1b | ||
| LgM | +++ | +++ | + |
| LgD | ± | ± | +++ |
| CD5 | + | - | - |
| CD11 | + | + | - |
| CD23 | - | - | + |
| CD44 | + | + | - |
| MHCⅡ | +++ | +++ | +++ |
CD5+B细胞比通常B细胞(CD5-)出现早。新生期小鼠脾细胞及腹腔中CD5+B细胞约占30%,随着鼠龄的增长而减少。成年鼠腹腔CD5+B细胞约占20%~40%,脾只占1%~2%,而在末梢血、淋巴结及骨髓内未发现,故正常小鼠CD5+B细胞主要存在于腹腔中。人胎脾细胞CD5+B细胞可占90%,但随年龄增长而减少。
CD5+B细胞与通常B细胞可能存在不同分化途径,其前驱细胞骨髓内不存在,胎儿期可能由大网膜内前驱细胞产生。分化后前驱细胞供给停止,但其自身有再生能力,藉以维持其细胞库。
CD5+B细胞与通常B细胞其表面标志也不同,CD5+B与通常B细胞比较,CD45R抗原呈弱阳性,sIgM强阳性,sIgd弱阳性。腹腔CD5+B其Mac-1+、CD23+为特征而通常B细胞为Mac-1+、CD23-。
通常B细胞(CD5-)一般受外来抗原刺激,经活化、克隆扩增,发生体细胞突变,产生高亲和性特异性抗体。而CD5+B细胞对外源抗原只产生有限的应答,主要对一些自已抗原产生应答,其应答特征是不依赖T细胞的,其产生的抗体也无亲和性成熟。故CD5+B细胞产生的抗体为低亲和性和多反应性的IgM型自身抗体及一些天然抗体(表8-11)。
表8-11 小鼠B细胞亚类比较
| CD5+(Ly-1)B | CD5-B(通常B细胞) | |
| 发生 | 早 | 晚 |
| 发育部位 | 腹腔/胸腔 | 淋巴器官 |
| 成体细胞群 | 自我再生 | 不断新生 |
| 成体细胞来源 | 成熟Ly-IB(腹腔) | Ig-祖细胞(骨髓、肝) |
| 发育调节 | 成熟Ly-IB反馈抑制 | ? |
| 形态 | 大 | 小 |
| 抗体产生 | ||
| IgM自身抗体 | +++ | ? |
| IgM抗菌抗体 | +++ | +~+++ |
| 抗半抗原 | ? | +++ |
| TD抗原 | - | ++ |
| 亲和力成熟 | - | + |
(二)CD5+细胞的作用
通常B细胞来自集合淋巴结(peyer'spatches,PP)抗原刺激后,可再回归肠产生高亲和性特异性抗体。而存在于固有层的CD5+B细胞,可接受肠道内抗原刺激,产生多价低亲和性抗体,以防御外来微生物的入侵。故肠道内可有二类B细胞发挥抗感染免疫作用。
CD5+B细胞是IgM型自身抗体的主要产生细胞,它可能形成自身反应细胞库,与自身免疫病的发生有关。已发现天然自身免疫病NZB小鼠体内CD5+B细胞比率高并与自身抗体产生相关。用xid基因导入NZB小鼠,则CD5+B细胞消失,自身抗体也下降。在人慢性风湿性关节炎、Sjogren症候群,以及全身性硬皮病等患者末梢血中,CD5+B细胞比正常人明显增加,而且在关节液中发现CD5+B细胞也增多。上述发现提示CD5+B细胞与自身免疫病的发生相关,但在系统性红斑狼疮患者中未发现CD5+B细胞增加现象,所以CD5+B细胞是否与各种自身免疫病相关,尚有待进一步研究。
三、B细胞的发育
鸟类的法氏囊是B细胞分化的场所。哺乳类动物在胚胎早期,B细胞分化的最早部位是卵黄囊,此后在脾和骨髓,出生后则在骨髓内分化成熟。
B细胞分化过程可分为二个阶段,即抗原非依赖期和抗原依赖期。在抗原非依赖期,B细胞分化与抗原刺激无关,主要在中枢免疫器官内进行。而抗原依赖期是指成熟B细胞受抗原刺激后,可继续分化为合成和分泌抗体的浆细胞阶段,主要在周围免疫器官内进行。
(一)骨髓微环境
早期B细胞的增殖与分化,其发生是与骨髓造血微环境(hemopoietic inductive microenviroment,HIM)密切相关。HIM是由造血细胞以外的基质细胞(stroma cell)及其分泌的细胞因子和细胞外基质(extracellular matrix,ECM)组成。基质细胞可包括巨噬细胞、血管内皮细胞、纤维母细胞、前脂肪细胞、脂肪细胞等。由间质细胞分泌的纤粘连蛋白、胶原蛋白及层粘连蛋白等形成细胞外基质,此外还可合成和分泌众多的细胞因子。HIM的作用主要是通过细胞因子可调节造血细胞的增殖与分化,通过粘附分子可使造血细胞与间质细胞相互直接接触,有利于造血细胞的定位和成熟细胞的迁出(表8-12,图8-5)。
表8-12 骨髓微环境与造血干细胞的相互作用
| 基质细胞 | 相互作用的媒介分子 细胞外基质 |
细胞因子 |
| 纤维母细胞 | 纤粘连蛋白 | SCF |
| 巨噬细胞 | 层粘连蛋白 | G-CSF |
| 内皮细胞 | 胶原蛋白等 | M-CSF |
| 前脂肪细胞 | GM-CSF | |
| 脂肪细胞 | IL-4 | |
| IL-6 | ||
| IL-7 | ||
| TGF-β |
图8-5 骨髓基质细胞与造血干细胞相互作用示意图
(二)B细胞在骨髓内的发育
B细胞与其它血细胞一样,也是由骨髓内多能干细胞分化而来。过去曾认为T和B细胞可能来自共同的淋巴样干细胞,但迄今对基分化途径、分化部位以及其特异的表面标志尚未明确,有待进一步研究。
已证明,B细胞在骨髓内的发育,可经过祖B细胞(pro-B)、前B细胞(pre-B)、不成熟B细胞(immatureB)及成熟B细胞(mature)几个阶段。成熟B细胞释放至周围淋巴组织,构成B细胞库,在此阶段经抗原刺激后,可继续分化为合成和分汔抗体的浆细胞,即抗原依赖的分化阶段。
B细胞在骨髓内分化各阶段的主要变化为免疫球蛋白基因的重排和膜表面标志的表达。B细胞在发育分化过程中,同样也经历选择作用,以除去非功能性基因重排B细胞和自身反应性B细胞,形成周围成熟的B细胞库(表8-13,图8-13)。
表8-13 B细胞分化特征
| Pro-B | Pre-B | 不成熟B | 成熟B | PC | |
| 抗原依赖 | - | - | + | + | - |
| 基质细胞依赖(配体?) | + | + | - | - | - |
| H链V基质重排 | - | DJ→VDJ | VDJ | VDJ | - |
| H链蛋白 | μ- | μ+ | μ+ | μ+δ+ | + |
| L链蛋白 | k-λ- | k-λ- | K+或λ+ | K+或λ+ | + |
| Vpre-B/γ5蛋白 | + | + | ± | + | - |
| SIgM | - | - | + | + | - |
| SIgD | - | - | - | + | - |
| thy-1 | + | - | - | - | - |
| B220 | + | + | + | + | - |
| Tdt | + | - | - | - | - |
| mb-1(CD79a) | + | + | + | + | - |
| B29(CD79b) | - | + | + | + | - |
| CD19 | + | + | + | + | - |
| CD21 | - | + | + | + | - |
| PCA-1 | - | - | - | - | + |
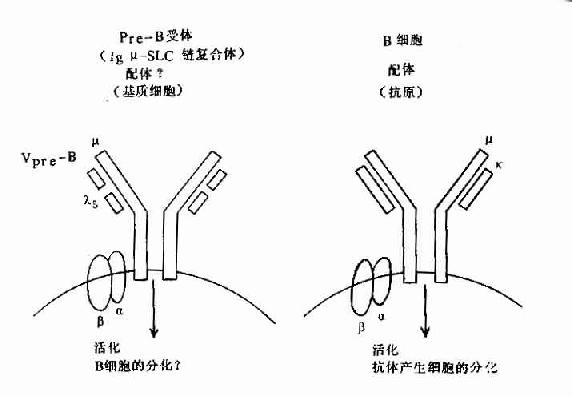
图8-6 pre-B受体(μ-SLC)与B细胞抗原受体机能
1.祖B细胞 这种发育早期的B细胞,发生在人胚胎约第9周开始,小鼠约第14天开始。尚未表达B细胞系的特异表面标志,也未发生lg基因重排,仍处于胚系基因(germline)阶段。但祖B细胞的晚期可出现B系特异标志,Thy-1+、Tdt+、B200+、mb-1+等分子。
2.前B细胞 是由祖B细胞分化而来,约占成人骨髓有核细胞的5%。前B细胞能检出的最早标志是lg重链基因重排,随后在胞浆中可检测出IgM的重链分子,即μ链。但无轻链基因重排,因此也无膜Ig表达。
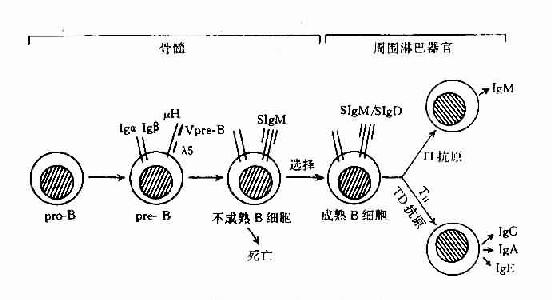
图8-7 B细胞分化膜式图
但近年在小鼠前B细胞株中,克隆出二个前B细胞特有的基因,并与Cγ与Vγ同源,分别命名为λ5和Vpre-B基因,在人也证明前B细胞中存在此种基因。它们编码的蛋白Vpre-B和λ5可非共价结合,形成伪轻链(pseudo L chain,Фl)或替代轻链(surrogate L chain)。此伪L链可与μ链结合形成μ重链与伪L链复合体,并表达于前B细胞膜上构成其受体,与信号传导有关,对前B细胞的进一步分化具有重要作用。
此阶段还表达MHCⅡ、Tdt、CD19、CD10、CD20和CD24等分化抗原。其中CD19、CD20、和CD22在胞浆中的出现均早于μ链。前B细胞对抗原无应答能力,不表现免疫功能。
3.不成熟B细胞 此阶段发生L链基因重排,故可组成完整的IgM分子,并表达于膜表面(IgM),可称为Bμ细胞。此种细胞如与抗原结合,易使膜受体交联,产生负信号,使B细胞处于受抑状态,不能继续分化为成熟B细胞。这种作用可能是使自身反应B细胞克隆发生流产,是形成B细胞自身耐受的机制之一。
不成熟B细胞开始丧失Tdt和CD10,但可表达CD22、CD21及FcR。同时CD19、CD20以及MHCⅡ类分子表达量增加。
4.成熟B细胞 随着B细胞的进一步分化,可发育为成熟B细胞,并离开骨髓进入周围免疫器官。此时膜表面可同时表达sIgM和sIgD,但其V区相同,而C区不同,故其识别抗原特异性是相同的。成熟B细胞可发生于一系列膜分子变化,可表达其它多种膜标志分子,如丝裂原受体、补体受体、Fc受体、细胞因子受体,病毒受体以及一些其它分化抗原等。
5.浆细胞(PC) 成熟B细胞可在周围淋巴器巴接受抗原刺激,在TH细胞及抗原呈递细胞的协助下,及其产生的细胞因子作用下可使B细胞活化,增殖并分化为合成和分泌抗体的浆细胞。此阶段B细胞可逐渐丢失一些膜分子如CD19和CD22等。并可发生Ig的类别转换,从产生IgM转换为产生Igg 、IgA或IgE的B细胞。
在此期分化过程中,有部分B细胞可恢复为小淋巴细胞,并停止增殖和分化,SIgD可消失,且寿命长,可生存数月至数年。当再次与同抗原相接触时易于活化和分化,故称此种细胞记忆B细胞,与机体的再次免疫应答相关。
当成熟B细胞分化为浆细胞时,B细胞表面的部分标志消失,并出现一些新的浆细胞特有标志,如浆细胞抗原-1(PCA-1)等分子。一种浆细胞只能产生一种类别的Ig分子,并且丧失产生其它类别的能力。浆细胞寿命长较短,其生存期仅数日,随后即死亡。
第三节 第三群淋巴细胞
在淋巴细胞中,除T和B细胞外,还发现一群没有T和B细胞表面标志的淋巴样细胞。一些学者认为它们可能是与T和B细胞并列的第三群淋巴细胞。目前认为它们是来源于其它细胞系,有待深入研究后才能确定其归属。
一、自然杀伤细胞(NK细胞)
1.NK细胞的特性 NK细胞来源于骨髓,主要存在于血液和淋巴样组织,特别是存于脾中。由于其胞浆中含有颗粒故有称为大颗粒淋巴细胞(large granular lymphocyte,LCL)。
从系统发生看,NK细胞被认为是原始杀伤T细胞,但它没有抗原识别受体,能杀伤肿瘤细胞和病毒感染细胞,所以是非特异杀伤作用,但无MHC分子的限制性,故名自然伤细胞。
虽然NK细胞对靶细胞的作用范围远大于杀伤T细胞,但其杀伤作用也不是随机的而是有一定范围的。NK细胞可以杀伤某些病毒感染细胞,但对正常未感染细胞无杀伤作用。NK细胞可杀伤某些肿瘤细胞株,特别是对造血细胞来源的肿瘤细胞更为敏感,但不是对所有肿瘤细胞均有作用。
2.NK细胞的表面标志 从细胞表型来看,NK细胞既不是T细胞也不是B细胞。NK细胞没有Ig或TCR基因重排,也不表达CD3分子。但NK细胞可表达CD2分子和低亲和性的IgGFc受体FcRⅢ(CD16)。如使CD2或CD16交联可促使NK细胞增殖和分泌细胞因子。值得注意的是尽管NK细胞缺乏CD3分子,但它能表达CD3的同二聚体ζ链分子,并与CD16联在一起。当IgG与CD16结合后它在信号传递中也发挥重要作用。
3.NK细胞的杀伤作用 当IgG与靶细胞结合并与NK细胞的CD16结合时即可引起NK细胞对靶细胞的杀伤作用,称这种作用为抗体依赖的细胞介导的细胞毒性作用(ADCC)。NK细胞是ADCC的重要介导细胞。但NK细胞识别敏感靶细胞上的分子尚未明确。
NK细胞可合成和分泌THF,但无LT。在一定条件下也可合成和分泌IFN-γ可活化巨噬细胞,能杀伤感染的病原微生物。
二、淋巴因子活化的杀伤细胞
近年来有些学者应用分离正常人或小鼠淋巴细胞加入白细胞介素-2(IL-2)在体外培养使之活化增殖,发现这种经IL-2活化增殖的淋巴细胞在体外能杀伤自体和异体新鲜肿瘤细胞,但对自体和异体外周血淋巴细胞无杀伤作用,称这种细胞为淋巴因子活化的杀伤细胞(lymphokine activated killercells,LAK)。并证明了LAK细胞与NK细胞和Tc(TCL)不是同一的细胞群。LAK细胞对肿瘤的治疗具有重要意义。
LAK细胞的前体细胞也属于大颗粒淋巴细胞(LGL),但不是NK细胞和T细胞。LAK的前体细胞有仅存在于人外周血中,也存在于人的骨髓和胸导管中,表明其分布较为广泛。对这种前体细胞的特性和起源有待深入研究。
三、肿瘤浸润淋巴细胞
近来美国学者Rosenberg应用在和和动物肿瘤组织中分离出的淋巴细胞加入IL-2在体外培养。实验证明这种活化增殖的肿瘤浸润淋巴细胞(tumor infiltuating lymphocyte,TIL)具有比LAK细胞更强的杀伤瘤细胞的作用。LAK细胞具有广谱杀瘤作用,而TIL细胞有特异杀瘤作用。TIL前体细胞为Lyt-2+,与杀伤T细胞的表面标记相同。TIL细胞对肿瘤的过继免疫治疗更具有应用前景。
第九章 免疫细胞(三):单核吞噬细胞系统
游离于血液中的单核细胞(monocyte)及存在于体腔和各种组织中的巨噬细胞(macrophage,MФ)均来源于骨髓干细胞,它们具有很强的吞噬能力,且细胞核不分叶,故命名为单核吞噬细胞系统(mononuclear phagocyte system,MPS)。单核/巨噬细胞是一类主要的抗原呈递细胞,在特异性免疫应答的诱导与调节中起着关键的作用。
第一节 单核吞噬细胞系统
一、单核吞噬细胞系统细胞的来源与分化发育
MPS细胞起源于骨髓,其分化与更新受细胞因子复杂网络的调控。在某些细胞因子,如多集落刺激因子(multi-colony stimulating factor,multi-CSF)、巨噬细胞集落刺激因子(macrophage-CSF,GM-CSF)等的刺激下,骨髓中的髓样干细胞经原单核细胞(monoblast)、前单核细胞(pre-monocyte)分化发育为单核细胞并进入血流。外周血单核细胞占白细胞总数1%~3%,它在血流中仅存留几小时至数十小时,然后粘附到毛细血管内皮,穿过内皮细胞接合处,移行至全身各组织并发育成熟为巨噬细胞。组织损伤和炎症可加速单核细胞向组织移行。巨噬细胞在组织中寿命可达数月至数年。在不同组织中存留的巨噬细胞由于局部微环境的差异,其形态及生物学特征均有所不同,名称也各异(表9-1)。一般认为除少数单核细胞或低分化的巨噬细胞外,成熟的巨噬细胞很少有或没有增殖能力,并不断被骨髓前体细胞分化的细胞所补充。另外,单核吞噬细胞系统细胞的分化发育还可受各种细胞因子如IL-2、IL-4以及干扰素等影响。
表9-1 单核吞噬细胞系统细胞的发生和分布
| 骨髓 | 血液 组织 |
| 多能干细胞 ↓ 髓样干细胞 ↓ 单核干细胞 ↓ 前单核细胞 ↓ 单核细胞 |
→单核细胞→巨噬细胞→结缔组织:组织细胞 肺:肺泡巨噬细胞 肝:枯否(Kupffer)细胞 脾与淋巴结:游走与固定巨噬细胞 浆膜腔:胸、腹腔巨噬细胞 神经组织:小胶质细胞 骨:破骨细胞 关节:滑膜A型细胞 |
二、单核吞噬细胞系统细胞的解剖学特征
(一)形态结构
单核细胞一般为圆形,直径约10~20μm;巨噬细胞大小不等,直径约10~30μm或更大,常有伪足,呈多形性。单核/巨噬细胞有圆形或椭圆形的核,胞浆中富含溶酶体及其他各种细胞器。
(二)单核吞噬细胞系统细胞的表面分子
1.表面受体 MPS细胞表面有多达80种以上受体分子,它们与相应的配体结合,分别表现感应与效应功能。包括捕获病原异物,加强调理、趋化、免疫粘连、吞噬、介导细胞毒作用等。例如,免疫球蛋白Fc受体(FcγRⅠ即CD64、FcγRⅡ即CD32、FcγRⅢ即CD16)补体受体(CD1即CD35、CD3即CD11b/18或Mac-1)可以分别与IgG的Fc段及补体C3b片段结合,从而促进单核/巨噬细胞的活化和调理吞噬功能。此外,单核/巨噬细胞还表达各种细胞因子、激素、神经肽、多糖、糖蛋白、脂蛋白及脂多糖的受体,从而可感应多种调控其功能的刺激信号。
2.表面抗原 MPS细胞表面具有多种抗原分子,它们对MPS细胞的鉴定与功能有重要意义。例如,MPS细胞表达MHC抗原,尤其MHC-Ⅱ类抗原是巨噬细胞发挥抗原呈递作用的关键性效应分子;单核/巨噬细胞还表达多种粘附分子(abhesionmolecule),如选择素L(L-selectin)、细胞间粘附分子(intercellular adhesion molecule,ICAM)和血管细胞粘附分子(vascylar cell adhesion molecule,VCAM)等,它们介导MPS细胞与其他细胞或外基质间的粘附作用,从而参与炎症与免疫应答过程。近年来应用单克隆抗体鉴定出许多单核吞噬细胞的表面分化抗原,如OKM-1、Mac-120、MO1~4等,但这些抗原也可能表达在其他起源于髓样干细胞的细胞(如中性粒细胞)表面。另外,成熟的单核细胞可表达高密度的CD14,这是一种相对特异的单核细胞表面标志。
三、单核吞噬细胞系统细胞的生理特点
(一)一般性质
MPS细胞又称大吞噬细胞,它具有吞噬细胞的一般特征,如何通过吞饮摄入液体异物,也可通过吞噬摄取颗粒性异物,还可识别某些化学刺激物的浓度,表现出定向运动的能力,即具有趋化性。MPS细胞在吞噬异物后,细胞内会发生一系列代谢改变,如糖代射增强,能量产生增加,活性氧生成增多等。MPS细胞胞浆中还含有非特异性酯酶、碱性磷酸二酯和过氧化物酶等。在细胞分化和激活过程中,这些酶的量及细胞内的定位可发生改变。此外,由于MPS细胞表达丰富的粘附分子,对玻璃与塑料制品具有强的粘附性,故又被称为粘附细胞(adherentcell),借助这个特性可将MPS细胞与淋巴细胞分离。
(二)单核吞噬细胞系统细胞的激活
MPS细胞在环境因素刺激下,可发生形态、膜分子表达以及细胞代谢与功能的短暂、可逆性变化,这一过程称为MPS细胞的激活,也是它有别于其他吞噬细胞(如中性粒细胞)的一个重要特征。与分化过程不同,活化是在病理条件下表现出的可逆性功能状态。单核吞噬细胞的激活是一个复杂的多步骤过程,在不同的活化阶段,涉及不同刺激因子的作用,细胞形态及功能也发生相应的改变。以巨噬细胞(Mф)为例,体内的Mф一般处于静止状态,病原体等异物通过直接接触激发Mф内的生理生化反应。环核苷酸第二信使cAmp/cGMP水平升高,使静止态Mф转变为应答性Mф。后者在IFN-γ等刺激因子启动下转变为致敏的Mф,然后在脂多糖或某些细胞因子作用下转变为活化的Mф。在上述变化过程中,Mф表现出形态改变(浆膜呈不规则波浪形,细胞器增加,膜分子表达改变),代谢增强(胞内蛋白质合成与ATP生成增加,磷酸戊糖代谢增强)以及功能增强(吞噬率及吞噬速度增高,杀菌及杀瘤能力增强,分泌活性及抗原呈递能力增强)等(表9-2)。
表9-2 巨噬细胞的激活
| 静止Mф→ | 病原体 应答性Mф→ |
IFN-γ 致敏的Mф→ |
LPS等 活化Mф |
|
| 吞噬功能 | + | ++ | +++ | ++++ |
| 趋化 | + | ++ | +++ | ++++ |
| 杀瘤活性 | - | - | - | + |
| 抗原呈递 | - | - | + | + |
| TNF分泌 | - | - | - | + |
| 活性氧产生 | - | + | ++ | ++ |
| MHC-Ⅱ分子 | - | - | + | + |
| 转铁蛋白受体 | - | + | - | - |
IFN-γ:γ干扰素
LPS:脂多糖
TFN:肿瘤坏死因子
一般认为,只有激活的单核吞噬细胞才是具有活跃生物学作用的效应细胞。在病理情况下,MPS细胞的异常激活也参与某些疾病的发生与发展。
(三)单核吞噬细胞系统细胞的分泌活性
MPS细胞是一类重要的分泌细胞。在许多组织和器官中,MPS细胞是分泌性蛋白的主要来源,其分泌物种类之多在体内仅肝细胞才能与之相比。一般情况下,活化的MPS细胞才有活跃的分泌能力。现已发现MPS细胞可分泌多达100种以上的酶类和其他生物活性物质。这些物质的分子量不一,从分子量仅32的超氧阴离子至分子量达440000的纤维粘连蛋白;功能也各异,参与从促进细胞生长到导致细胞死亡的全部活动。此外,由于MPS细胞的体内分布广泛、可以移动,以及其分泌产物作用的多样性,这种分泌活性具有重要的生理与病理意义。表9-3列出了MPS细胞所分泌的几类主要产物,MPS细胞的许多功能都有赖于这些分泌产物的参与。
表9-3 单核吞噬细胞系统细胞的分泌产物
| 种类 | 实例 |
| 补体 | C1~C9,B、D、I、H因子,C1抑制物 |
| 凝血因子 | V、VⅡ、ⅠX、X因子,凝血酶原 |
| 酶类 | 各种中性蛋白酶,酸性水解酶,溶菌酶 |
| 生物活性酯类 | 花生四烯酸衍生物(前列腺素、白三烯等) |
| 激素样物质 | VitD3,促肾上腺皮质激素,β内啡肽 |
| 细胞因子 | IL-1、IL-3、IL-6,TFN-a,IFN-a,-β、FGF |
| 反应性中间产物 | 活性氧(1O2、H2O2、OH-,O2-),亚硝酸盐 |
| 其他 | 多种生长因子及刺激因子,嘌呤及嘧喧产物,各种结合蛋白、连接蛋白及酶抑制物等 |
FGF:纤维细胞生长因子
四、单核吞噬细胞系统细胞的功能
MPS细胞具有重要的生物作用,不仅参与非特异性免疫防御,而且是特异性免疫应答中一类关键的细胞,广泛参与免疫应答、免疫效应与免疫调节。
(一)免疫防御功能
病原微生物侵入机体后,在激发免疫应答以前即可被MPS细胞吞噬并清除,这是机体非特异免疫防御机制的重要环节。由于其吞噬能力较强,故有人将MPS细胞称为机体的清道夫。在致病微生物激发机体产生特异性抗体后,覆盖于病原体表面的IgG及补体激活片段C3b可与MPS细胞表面的FcR及CR1结合,发挥调理作用,使病原体更易被吞噬。被吞入的细菌可被细胞内的某些酶类或活性氧所杀灭;另一方面,在对异物颗粒的吞噬、杀灭过程中,可能出现酶体外漏现象,从而造成对邻近正常组织的损伤。
(二)免疫处自稳功能
机体生长、代谢过程中不断产生衰老与死亡的细胞以及某些衰变的物质,它们均可被单核吞噬细胞吞噬、消化和清除,从而维持内环境稳定。
(三)免疫监视功能
MPS细胞构成机体肿瘤免疫的重要一环。一般认为只有激活的巨噬细胞才能有效地发挥杀瘤效应,其机制可能是:①吞噬肿瘤细胞;②借助抗瘤抗体的ADCC作用杀伤瘤细胞;③产生TNf 及IL-1等细胞因子,直接或间地发挥杀瘤作用;④产生某些酶及活性氧分子直接杀伤或抑制肿瘤细胞生长。
(四)抗原呈递功能
MPS细胞是最重要的一类抗原呈递细胞。外来抗原经单核吞噬细胞处理后呈递给T细胞,这是诱发免疫应答的先决条件。此外,在抗原呈递过程中MPS细胞产生的IL-1也是TH活化不可缺少的刺激信号。
(五)免疫调节功能
MPS细胞在免疫调节中发挥重要的作用。由于激活程度及分泌产物的不同,MPS细胞的免疫调节作用有双相性;另一方面,体内各种因素也可通过影响单核吞噬细胞的膜分子表达等途径调节MPS细胞功能状态。
1.正相调节作用 MPS细胞可通过下列途径启动和增强免疫应答,包括:①抗原呈递作用,诱导免疫应答启动;②分泌具有免疫增强作用的各类生物活性物质,如IL-1、TNF-a、补体成分、各类生长因子等。
2.负相调节作用巨噬细胞过度激活可成为抑制性巨噬细胞,后者可分泌多种可溶性抑制物如前列腺素、活性氧分子等,抑制淋巴细胞增殖反应或直接损伤淋巴细胞。
3.体内各种因素通过调控MPS细胞功能状态而发挥免疫调节作用多种神经肽及激素样物质如P物质、皮质激素、性激素等均可通过相应受体而调控巨噬细胞的功能状态;另外,某些神经肽与细胞因子(如IL-1、TNF-a、IFN-γ)可诱导巨噬细胞MHC-Ⅱ类抗原的表达,从而调控其抗原呈递功能。
(六)其他功能
MPS细胞还广泛参与炎症、止血、组织修复、再生等过程。
第二节 其他抗原呈递细胞
除了MPS细胞外,体内还有其它某些细胞具有原呈递功能。
一、树突状细胞
树突状细胞(dendritic cell,DC)是体内不同于MPS细胞的另一类重要的抗原呈递细胞,其共同的生物学特性是细胞表面有许多树枝状突起,胞内具有丰富的线粒体,但粗面内质网、溶酶体与核糖体不发达,细胞表面无绵羊红细胞受体及SmIg。DC在混合淋巴细胞反应中是重要的刺激细胞。一般认为DC无吞噬功能,但由于其表面表达较高密度的MHC-Ⅱ分子,且具有树突状突起,表面积较巨噬细胞更大,有利于接触抗原并呈递给T细胞,故DC在抗原呈递中发挥重要作用。来源于骨髓前体细胞的DC分布于外周血或各类淋巴组织中,一般只占所在器官全部细胞的1%以下。由于所居留的组织部位不同或处于不同的发育阶段,DC可有不同的名称,并表现出某些特有的生物学特征(表9-4)。
表9-4 各类DC的主要生物学特征
| 类别 | 体内分布 | MHC-Ⅱ | FcR | C3R | Birbeck颗粒 |
| 滤泡树突状细胞 | 淋巴滤泡 | +/? | + | + | - |
| 淋巴样树突状细胞 | 淋巴组织 | ++++ | - | -/+ | - |
| 并指状细胞 | 淋巴组织 | ++++ | - | - | - |
| 朗格罕细胞 | 表皮及某些上皮 | ++++ | + | + | + |
1.滤泡树突状细胞(folliculardendritic cell,.FDC) FDC定居于淋巴结浅皮质区淋巴滤泡生发中心内。FDC与抗原抗体复合物高度亲合力,能够捕获和滞留抗原,并在记忆B细胞发育中起重要作用,是参与再次免疫应答的APC。
2.淋巴样树突状细胞(Lymphoiddendritic cell,LDC) LDC主要分布在淋巴结和脾内,在移植排斥反应中起重要作用。
3.并指状细胞(interdigitatingcell,IDC)IDC主要定位于淋巴组织胸腺依赖区,可能由皮肤Langerhans细胞移行而来。在淋巴组织中,IDC的星状突起插入其它细胞之间,故命名为并指状细胞。它可能是淋巴结中主要的APC,并对抗原特异性T细胞具有很强刺激作用。
4.朗格罕细胞(Langerhanscell,LC) LC位于表皮和胃肠上皮,其特征性胞内结构是胞浆中的柱状Birbeck颗粒,该颗粒参与LC抗原呈递作用的各个环节。LC是定居在皮肤中的APC,约占皮肤细胞总数的5%~10%,在介导接触性皮肤超敏反应中起关键作用。
二、B细胞
正常B细胞及B淋巴瘤细胞系均表达MHC-Ⅱ类抗原,也属于抗原呈递细胞。与B细胞抗原呈递功能相关的膜分子是SmIg,后者与抗原具有高亲和力,从而可以高度特异性地浓缩非已抗原,并以与MHC-Ⅱ类分子结合成复合体的形式将抗原呈递给TH。故尤其对低度的抗原,B细胞是一类有效的APC。
三、内皮细胞及其他抗原呈递细胞
人的内皮细胞也表达MHC-Ⅱ类抗原并可与TH细胞相互作用,故也是一种APC,它在介导迟缓型超敏反应中发挥重要作用。此外,某些上皮细胞、神经胶质细胞、间质细胞等在静止状态下或在γ干扰素的诱导下可表达MHC-Ⅱ类抗原,并具有APC的功能。
病毒感染的细胞以及肿细胞等作为细胞免疫效应的靶细胞可将非已抗原呈递给细胞毒性T细胞,因此从广义上讲这些靶细胞也属于抗原呈递细胞。
第三节 抗原呈递细胞的抗原呈递作用
细胞在其表面以能被T细胞受体(TcR)特异性识别的方式表达抗原的过程称为抗原呈递。APC以MHC-Ⅱ分子限制的方式将抗原递给辅助性T细胞(TH);各种靶细胞心以MHC-Ⅰ限制的方式将抗原呈递给细胞毒性T细胞(TC)。APC的抗原呈递作用是一个涉及抗原摄取、处理与呈递的复杂过程。各类APC呈递抗原的机制不尽相同,本章主要以巨噬细胞对非已抗原的呈递为例叙述。
一、抗原摄取
非已抗原(如细菌抗原或可溶性抗原)以非特异性方式与巨噬细胞结合,后者借助吞噬、胞饮、吸附或FcR、CR1介导的调理作用摄取抗原。这个过程也称为内吞作用(endocytosis)。
二、抗原加工
T细胞通常不能识别天然蛋白抗原的决定簇。被APC摄入的天然抗原须在胞内通过代谢而修饰成能与MHC-Ⅱ类分子结合的、具有强免疫原性的肽段,此过程称为抗原的处理(antigen processing)。被巨噬细胞摄入的抗原在胞内形成吞噬小体(phagosome),然后与溶酶体融合,形成吞噬酶体(phagolysosome)。后者是一种酸性的囊泡,天然抗原在其内受多种酸性水解酶作用,90%以上的成分被完全裂解为氨基酸并失去免疫原性,10%左右降解为具有α-螺旋结构的免疫原性肽段。后者暴露出与MHC-Ⅱ类分子具有特异亲和力的疏水性残基,并以抗原识别位(agretope)通过非共价键与MHC-Ⅱ类分子肽结合区结合成稳定的螺旋结构。由细胞内粗面内质网合成的MHC-Ⅱ类分子通过与免疫原性多肽的结合,使后者得以避免被完全水解。所形成的多肽MHC-Ⅱ分子复合物可能在高尔基复合体参与下被转运到细胞膜表面TcR识别。
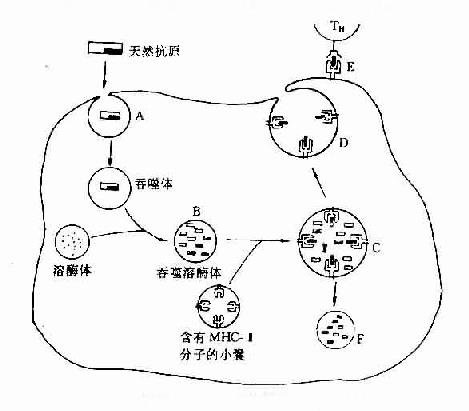
图9-1 巨噬细胞对抗原的摄取、加工及呈递
A.内吞
B.天然抗原在吞噬溶酶体中降解;
C.免疫性多肽与MHC-Ⅱ分子结合复合物;
D.多肽-MHC-Ⅱ分子复合物的转动与表达;
E.TH的TCR联合识别多肽-MHC-Ⅱ分子复合物;
F.未与-MHC-Ⅱ分子结合的肽链彻底降解
三、抗原呈递
表达于巨噬细胞表面的多肽-MHC-Ⅱ分子复合物被呈递给TH细胞。供TcR识别的先决条件是两种细胞的直接接触并相互作用。这种细胞间的相互作用涉及APC与TH表面多种分子。除了TcR特异性地同时识别多肽-MHC-Ⅱ分子的复合物外,某些粘附分子也参与抗原呈递过程。例如TH表面的淋巴细胞功能相关抗原1(lymphocytefunctiom-associatedantigen-1,LFA-1)、CD2和CD4分子可分别与APC表面的细胞间粘附分子1(ICAM-1)、淋巴细胞功能相关抗原3(LFA-3)和MHC分子形成共轭物,并促进TcR与多肽-MHC分子复合物的相互作用。此外,在TcRαβ链识别抗原过程中,TH细胞表面的CD3分子参与刺激信号的传递并介导T细胞产生淋巴因子及发挥效应功能。
由上可见,APC呈递抗原供TcR识别并导致T细胞激活是一个受到严格调节的复杂过程。其中某些细节尚未弄清,有待进一步探讨。
第二篇 免疫系统的生理功能
免疫应答
免疫系统最重要的生理功能是对“自己”和“非已”抗原分子的识别及应答,这种识别作用是由免疫细胞完成的。免疫细胞对抗原分子的识别、活化、分化和效应过程,称之为免疫应答。免疫细胞的识别功能,是在个体发生中获得的,因此在免疫应答过程中,抗原分子对免疫细胞只起选择和触发作用。
免疫细胞在抗原识别过程中,可被诱导活化、分化并产生效应分子(抗体)和效应细胞,称之为正免疫应答。亦可被诱导使免疫细胞处于不活化状态,称之为免疫耐受或负免疫应答,因而不能产生排已效应。机体通过上述二种机制,借以维持自身免疫稳定性。
在免疫功能正常条件下,机体对“非已”抗原可形成正免疫应答,并产生排异效应,发挥免疫保护作用,如抗感染免疫和抗肿瘤免疫。而对“自己”抗原,则形成自身耐受状态或负免疫应答,因而不能产生排已效应。机体通过上述二种机制,借以维持自身免疫稳定性。
但在免疫功能失调情况下,则机体可对“非已”抗原产生高免疫应答性或负免疫应答。前者可形成超敏感性,易造成机体组织的免疫损伤,发生变态反应性疾病,而后者则不能产生排异效应。因之可降低机体的抗感染免疫和抗肿瘤免疫。如果打破对自身抗原的耐受性,也可对自身抗原产生正免疫应答而出现排已效应,形成所谓自身免疫现象,如造成组织损伤,则可发生自身免性疾病。因之在不同条件下免疫应答过程,既可产生保护作用,亦可产生免疫病理作用。免疫应答类型如下:

第十章 抗原
第一节 抗原的概念和特性
一、抗原的概念
在免疫学发展的早期,人们应用细菌或其外毒素给动物注射,经一定时期后,用体外实验证明,在其血清中存在一种能使细菌发生特异性凝集反应的物质。称之为凝集素,或能特异性中和外毒素性的物质,称之为抗毒素。其后将血清中这种具有特异性反应的物质统称为抗体(antibody,Ab)。而将能刺激机体的物质统称为抗原(antigen,Ag)。
随着现代免疫学的发展,已经证明,当抗原分子进入机体后,能触发免疫细胞一系列的复杂的生物学过程,称之为免疫应答。既能诱导正免疫应答,也能诱导负免疫应答。因此,上述抗原的概念已不能完全概括其函义。目前认为凡能诱导免疫系统发生免疫应答,并能与其产生的抗体或效应细胞在体内或体外发生特异性反应的物质,可称之为抗原。
二、抗原的特性
根据现代抗原的概念,抗原必须具备二种特性,即免疫原性和抗原性。
(一)免疫原性
抗原的免疫原性(immunogenicity)是指抗原分子能诱导免疫应答的特性。它涉及抗原分子与免疫细胞间的相互作用,即它必须经过抗原呈递细胞的加工、处理和呈递作用,以及能被T和B细胞的抗原识别受体所识别。因此抗原的免疫原性与抗原分子的化学性质相关,更与机体的免疫应答特性相关。
(二)抗原性
抗原的抗原性(antigenicity)是指抗原分子能与免疫应答产物,即抗体或效应T细胞发生特异反应的特性,故亦称之为抗原的反应原性(reactivity)。它只涉及抗原分子与抗体分子或T细胞的抗原受体分子(TCR)间的相互作用,即分子与分子间的相互作用。只是抗原分子表面的有限部位能与抗体分子结合,称此部位为抗原决定簇(antigen determinant)或表位(epitope)。因此抗原的抗原性主要决定于抗原分子的化学性质。如抗原为蛋白质分子,其抗原性可决定于其氨基酸序列或其空间构型。
第二节 抗原的免疫原性
抗原的免疫原性,首先决定于其自身的化学特性,但同一种抗原,对不同种动物或同种动物不同个体间其免疫原性强弱,可表现很大差异,因此一种抗原的免疫原性是由其化学性质和宿主因素决定的。具有免疫原性的物质称为免疫原(immunogen)。
一、免疫原性的化学基础
许多天然物质可诱导免疫应答,其中大分子蛋白质和多糖具有强免疫原性,小分子多肽及核酸也具有免疫原性。
(一)化学组成
大分子蛋白质,分子量大于10000者,可含有大量不同的抗原决定簇,是最强的免疫原。如异种血清蛋白、酶蛋白及细菌毒等,是强免疫原蛋白质的例子。
多糖是重要的天然抗原,纯化多糖或糖蛋白、脂蛋白以及糖脂蛋白等复合物中的糖分子部分都具有免疫原性。在自然界,许多微生物有富含多糖的荚膜或胞壁,细菌内毒素是脂多糖,以及一些血型抗原(A、B、C、H)也是多糖。
核酸分子多无免疫原性,但如与蛋白质结合形成为核蛋白则有免疫原性。在自身免疫病中,可见对天然核蛋白诱导的免疫应答产生的抗DNA或RNA抗体。
此外,多肽类激素如胰岛素虽为小分子量(6000)亦具有免疫原性。来自一种动物的胰岛素,如长期用于另一种动物,亦能诱导免疫应答产生抗体。
(二)分子量
凡具有免疫原性的物质,其分子量都较大,一般在1万以上,小于1万者呈弱免疫原性,低于4000者一般不具有免疫原性。许多小的免疫性原性分子可激发细胞免疫,而不产生抗体。亦有大分子量物质,如明胶分子量可达10万,但因其为直链氨基酸结构,易在体内降解为低分子物质,所以呈弱免疫原性。可见免疫原性除与分子量有关外,还与其化学结构相关。
(三)化学结构
在蛋白质分子中,凡含有大量芳香族氨基酸,尤其是含有酷氨酸的蛋白质,其免疫原性强;而以非芳香族氨基酸为主的蛋白质,其免疫原性较弱。蛋白质和多糖抗原,凡结构复杂者免疫原性强,反之则较弱。其复杂性是由氨基酸和单糖的类型及数量等决定的。如聚合体蛋白质分子较单体可溶性蛋白质分子的免疫原性强。
二、宿主因素与免疫原性
免疫原性物质进入机体后能否诱导产生免疫应答,除上述化学基础外,尚受宿主因素的影响,而且是更要的因素。
(一)异种性
在免疫功能正常条件下,只有异种或同种异体的免疫原性物质才能诱导宿主的正免疫应答,即只有“非已”抗原才能引起正免疫应答。这是由于免疫系统在个体发育过程中,对“自己”抗原产生耐受,不能识别,而对“非已”抗原则能够识别所致。因此抗原来源与宿主种系关系越远,其免疫原性也越强,如微生物抗原、异种血清蛋白等物质对人是强免疫原。反之种系关系较近,则免疫原性也弱,如鸭血清蛋白对鸡呈弱免疫原性,而对兔则表现为强免疫原性。得但目前证明在正常个体也可诱发生理性自身免疫应答,只有超出一定范围才能直病理性自身免疫应答。
(二)宿主遗传性
在同种动物不同个体间结感染的抵抗力存在明显差异的事实,已早为人知,但不能解释其产生的原因,只以个体差异说明之。其后,用已知人工合成抗原给不同近交系动物免疫,每一近交系动物其遗传背景相同,结果发现有的品系能产生抗体,称为高应答品系(hkgh responder)。有的品系不能产生抗体,称为无或低应答品系(nonrespondre)。例如应用人工合成抗原二硝基苯-多聚-左旋-赖氨酸(DNP-poly-L-L)在荷兰猪品系2(GP strain2)可以引起应答,而对品系13(GP strain13)则不能引起应答。这充分证明个体遗传性对免疫应答的控制作用。在70年代McDevitt等应用人工合成抗原在近交系小鼠体内发现了控制免疫应答的基因座(immuneresponslocus)定位于H-2复合体的Ⅰ区,称此基因为免疫应答基因-1(immune uesponse,Ⅰr-1)。
(三)免疫佐剂
免疫佐剂的物质有:①微生物及其产物,常用的微生物有分枝杆菌、短小棒状杆菌、百日咳杆菌以及处左兰氏阴性杆菌的提取物脂多糖,自分枝杆菌的提取物质胞壁酰二肽等。②多聚核苷酸,如多聚肌苷酸:胞苷酸(poly1:C),多聚腺苷酸(poly1:A:μ)等。③弗氏佐剂(Freundadjuvant),这是目前最常用于动物实验的佐剂,它是将抗原水溶液与油剂(石蜡油或植物油)等量混合,再加乳化剂(羊毛脂或叶吐温80)制成油包水抗原乳剂,称之为不完全弗氏佐剂。如在不完全佐剂中加入分枝杆菌(如死卡苗)则称为完全弗氏佐剂。④无机物,如明矾及氢化铝等。
佐剂的作用机制尚不完全清楚:①它可能增加抗原的表面面积,易为巨噬细胞所吞噬;②延长抗原在体内的存留期,增加与免疫细胞接触的机遇;③诱发抗原注射部位及其局部淋巴结的炎症反应,有利于刺激免疫细胞的增殖作用。
第三节 抗原的抗原性
自发现抗体后,用血清学方法在体外实验,证明了天然抗原与其相应抗体发生特异性结合,这是一个重要的免疫学现象,称这种特性为抗原的抗原性。在早期由于尚未建立对蛋白质抗原进行分析的方法,为研究抗原性的化学本质造成了困难。奥地利免疫化学家Landsteiner在本世纪20年代创建了人工结合抗原,并应用血清学方法对抗原性的化学本质进行了系统的研究,为抗原、抗体的相互作用提供了大量知识,为天然抗原化学性质的研究奠定了基础。
一、人工结合抗原
Landsteiner首创用已知化学结构的低分子化合物或化学基团与免疫原性蛋白质进行偶联,制备了偶氨蛋白。由于低分子化合物本身无免疫原性,单独免疫动物不能对其产生抗体,如与蛋白质偶联再免疫动物则能对其产生抗体,并能单独与其抗体结合。故称此种无免疫原性低分子化合物为半抗原(hapten,H),称免疫原性蛋白质为载体(cauuier,C)自此建立了半抗原与载体的概念(H-C)。因此可以认为半抗原是外加在免疫原分子上的已知化学结构的化学基团,在一定意义上它与抗原分子上未知化学结构的天然抗原决定簇是同义语(图10-1)。
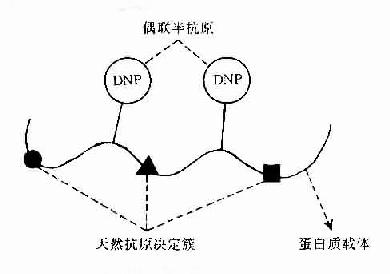
图10-1 半抗原载体结合物
常用为载体的免疫原性蛋白质有牛血清蛋白(BSA)、牛血清丙种球蛋白(BGG)、卵清蛋白(OA)、鸡丙种球蛋白(CGG)、钥孔嘁血蓝蛋白(KLH)及人工合成多聚赖氨酸(PLL)等。常用为已知结构的半抗原有二硝基苯酚(DNP)和三硝基苯酚等低分子化分物。
Landsteiner有带有不同酸基的有机物为半抗原,分别与同一种载体偶联制备了几种酸基不同的半抗原载体结合物,然后免疫动物。用所得抗体与已知半抗原进行体外补体结合实验,结果证明,带不同酸基的半抗原只能与其相应抗体结合。同理,他用氨基苯甲酸的三种异构物(邻位、间位、对位)分别与同一种载体蛋白偶联的半抗原载体结合物,只能与其相应抗体结合(表10-1,2)。上述实验证明,抗原与抗体的特异结合是与抗原分子表面的特殊结构的化学基团相关。将抗原分子表面能与其抗体结合的部位称为抗原决定簇,即抗原的抗原性是由其抗原决定簇的性质、数目和空间构型所决定,自此建立了抗原决定簇的概念。为以后研究天然蛋白质的抗原性提供了理论依据。
表10-1 不同酸基对半抗原与抗体反应特异性的影响
| 半抗原 | ||||
| 抗下列半抗原-载体 免疫血清 |
苯胺NH2 | 对氨基苯甲酸NH2 | P对氨基苯磺酸 | 对氨基苯砷酸 |
| 载体-苯胺 载体-对氨基苯甲酸 载体-对氨基苯磺酸 载体-对氨基苯砷酸 |
+++ - - - |
- ++++ - - |
- - ++++ - |
- - - +++ |
表10-2 化学基团(COOH)位置对半抗原体反应特异性的影响
| 半抗原 | ||||
| 抗下列半抗原-载体 免疫血清 |
苯胺 | 氨基苯甲酸 | ||
| 邻位 | 间位 | 对位 | ||
| 载体-苯胺 载体-邻位氨基苯甲酸 载体-间位氨基苯磺酸 载体-对位氨基苯砷酸 |
+++ - - - |
- ++++ - - |
- - ++++ - |
- - - +++ |
+:阳性反应;-:阴性反应
抗原除与其相应抗体发生特异反应外,也可与其它相关抗体发生反应,称这种现象为交叉反应。这是由于在二种不同的抗原分子中具有相同的抗原决定簇引起的,称为共同簇或共同抗原.也可能由于二种不同决定簇具有相似的结构,但并非相同,也能引起交叉反应。在发生学上较近的种属间,其抗原产生的抗体,彼此间易出现交叉反应。如牛血清清蛋白(BSA)与其它种属清蛋白之间的交叉反应(表10-3)。
表10-3 牛血清蛋白与其它种属清蛋白的交叉反应
| 清蛋白来源 | 交叉反应%(BSA) | 清蛋白来源 | 交叉反应 %(BSA) |
| 人 猪 羊 马 地鼠 |
15 32 75 13 13 |
豚鼠 狗 小鼠 大鼠 猫 |
5 13 10 17 25 |
二、载体决定簇与半抗原决定簇
单独应用半抗原不能诱导机体产生抗体,只有将半抗原与载体蛋白结合后,才能诱导机体既能产生抗载体蛋白抗体,也能产生半抗原抗体,已为实验所证明。这就提出了为什么单独应用半抗原不能产生抗体,载体在抗体产生中发挥什么作用等问题。
为了回答上述问题,有的学者应用牛血清蛋白-二销基苯(BSA-DNP)和卵白蛋白-二硝基苯(OA-DNP)为载体结合半抗原,观察了载体在抗体产生中的作用,他们首先应用BSA-DNP对小鼠进行初次免疫,然后再分别应用BSA-DNP和OA-DNP进行再次免疫,观察载体对抗DNP抗体产生的影响.他们发现,只有当初次与再次免疫时,半抗原需要在相同载体上才能产生半抗原抗体,称此为载体效应(表10-4)。证明载体不是单纯起运载半抗原的作用,而是具有载体特异性。因此提出一个完全抗原分子,必须具有载体决定簇和半抗原决定簇。
表10-4 载体-半抗原效应
| 实验组别 | 初次免疫 | 再次免疫 | 抗DNP抗体 |
| 1 2 3 |
BSA-DNP BSA-DNP BSA-DNP+OA |
BSA-DNP OA-DNP OA-DNP |
+++ + +++ |
其后Mitchison等在70年代应用载体效应过继转移实验,证明了在抗体形成过程中,有对载体特异的细胞和对半抗原特异的细胞,分别称为载体反应细胞和半抗原反应细胞。并进一步证明T细胞是载体反应细胞,对抗体产生起辅助作用。B细胞是半抗原反应细胞,是产生抗体的细胞,自此阐明了载体效应的细胞学基础。
载体-半抗原概念极其重要,它可解释为什么低分子量化合物与体内载体蛋白质分子结合诱发超敏性反应产生的药物过敏症。如苯胺类染料、镇静剂司眠脲、退热剂阿司匹林、氨基比林以及多种抗生素分解产物等是诱发药物过敏症的原因。
三、天然蛋白质的抗原性
绝大多数免疫原性物质是大分子蛋白质或细胞组分,但只是其有限的部位能与其相应抗体结合,此部位称为抗原决定簇或表位(前述载体-半抗原效应已证明一个抗原分子须有T细胞决定簇和B细胞决定簇)。由于天然大分子蛋白质结构复杂,并具有空间构型,因此对其单一抗原决定簇的化学组成、定位及其结构研究十分困难。但近年来由于免疫化学技术的发展,已能研究其空间结构,由于单克降抗体技术的发展,已能分离鉴定单一抗原决定簇,因此,对蛋白质抗原性的研究已取得很大进展。
(一)B细胞决定簇(表位)
抗原分子的B细胞决定簇大小不同,其最大表面积约为50~70mm约由4~6氨基酸残基或糖基组成。100个氨基酸残基多肽可有14到20个非重叠决定簇,由线状排列彼此相邻的氨基酸组成,故称为线性或连续性决定簇。而球蛋白是有三维空间的折叠肽链,故其大多数决定簇被掩盖在内部,可称为隐蔽性决定簇。只存在于其表面的决定簇可被免疫细胞识别,或与抗体结合者称为功能性决定簇(图10-2)。组成这种决定簇的氨基酸,是由折叠的肽链将有同位置的氨基酸使之相邻成为有一定空间构型的决定簇,故称为构像决定簇或不连续决定簇。现已证明抗原分子的抗原性是由其组成的氨基酸予列、空间构型及其决定簇片段的移动决定的。
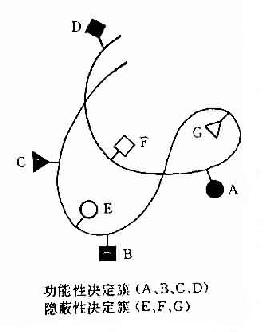
图10-2 球蛋白分子抗原决定簇
在球蛋白分子表面可带有多种抗原决定簇,其中有些决定簇更容易与淋巴细胞接触,比其它决定簇能激发较强的免疫应答,称这种决定簇为优势决定簇。每个抗原分子上其功能性决定簇的总数称为抗原价,即能与抗体分子起反应的最大数量的抗原决定簇,一般分子量大于10万者可有2个抗原价,大分子如分子量为40万者可有10~12个抗原价。
(二)T细胞决定簇(表位)
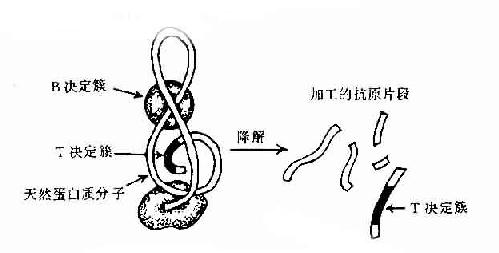
图10-3 抗原分子的T与B决定簇
现已证明T细胞决定簇为免疫原性多肽片段,属连续性决定簇。但它不存在天然蛋白分子表面,必须经抗原呈递细胞加工处理为小肽分子,然后再与自己MHC分子结合才能被T细胞所识别。而B细胞决定簇可存在于天然抗原分子表面,不须经加工处理,即可直接被B细胞所识别(图10-3)。
在天然大分子蛋白质抗原直接证明其存在有T细胞决定簇和B细胞决定簇是十分困难的。但用小分子已知结构的免疫原进行研究已证明其存有2种决定簇。胰腺高血糖素激素(glucagon)由29个氨基酸组成,有免疫原性。由其产生的抗激素抗体可识别其氨基末端。由其产生的杀伤T细胞可识别其羧基末端,相当于激素分子的载体部分。由此证明胰高血糖素分子的氨基端为B细胞决定簇,而羟基端为T细胞决定簇(图10-4)。
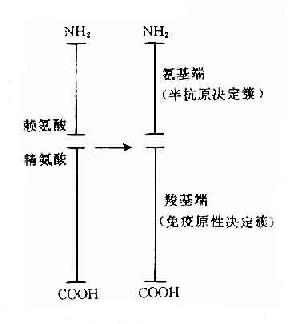
图10-4 高血糖素决定簇结构示意图
第四节 抗原的分类
一、天然抗原
根据抗原性物质与机体的亲缘关系可分为“自己”(self)与“非已”(non-self)抗原。即与机体种系发生关系愈远,其遗传性差异越大,其免疫原性也愈强。
(一)“自己”抗原
正常自身组织成分及体液组分处于免疫耐受状态,不能激发免疫应答,但如打破自身耐受,则可引起自身免疫应答;另一些自身组织成分虽具有免疫原性,但在正常情况下,由于组织屏障,不能进入血流,因此不能与免疫细胞接触,也不能激发免疫应答,称此种抗原为隐蔽性身抗原,如脑组织、眼晶状体蛋白及精子等。一旦因外伤或手术等原因,可使此种抗原进入血流时,则可引起自身免疫应答。受病原微生物的感染或应用某些化学药物,可与自身组织蛋白结合,改变其分子结构,形成修饰的自身抗原,也能引起免疫应答。
(二)非已抗原
来自异种动物的抗原物质称为异种抗原。如来自外部侵入人体的各种病原微生物及其产物的外毒素,注射的异种动物免疫血清,以及吸入和食进的异种蛋白,例如花粉和食物均属异种抗原。由于与人种属关系远为强免疫原。此外癌细胞可在人体内产生特异性癌抗原,但对其免疫原性迄今尚未能证实。
在同种动物不同个体间也存在各种组织成分抗原性的差异,称此种抗原为同种异型抗原。这种抗原受遗传支配,它可在遗传性不同的另一些个体内引起免疫应答,称之为异型免疫应答。如人血型抗原不同输血时可引起输血反应,组织相容性抗原或移植抗原型不同可引起移植排斥反应。此外,免疫球蛋白分子上存在的Gm、Am、Km标记均属异型抗原,可用以鉴别IgG、IgA及K轻链的异型。
在不同种属动物组织间也可发现有共同抗原,称这种抗原为异嗜性抗原。Forssman首先发现这种抗原,故亦称之为Forssman抗原。即这种抗原无种属特异性,它可共同存于人、不同种动物与微生物之间,因此它与疾病的发病学和诊断有一定意义。
目前已发现多种异嗜性抗原,如大肠杆轿O86含有人的B血型物质,肺炎球菌14型含有人A血型物质,它们与人血型抗体的产生有关。有些病原微生物与人体某些组织具有共同抗原成分,是引起免疫性疾病的原因之一。如溶血性链球菌一些抗原可与肾小球基底及心肌组织有有共同抗原成分,它们可能与急性肾小球肾炎和风湿病的发病有关。又如大肠杆菌O14型脂多糖与人结肠粘膜有共同抗原,可能与溃疡性结肠炎的发病有关。
某些疾病的诊断也可借助于对异嗜性抗原的检测。例如引起原发性非典型肺炎的病原支原体与MG株链球菌有共同抗原,可藉其血清中抗体对此种链球菌的凝集反应进行诊断,引起斑疹伤寒的立克次体与变形杆菌一些菌株间有共同抗原,可藉其血清中抗休对变型杆菌的的凝集反应进行诊断,称之为Weil-Felix反应。此外传染性单核细胞增多症患者血清中,可出现凝集羊红细胞的异嗜性抗体,可用羊红细胞凝集反应进行诊断。
二、人工抗原
用化学合成法或基因重组法制备含有已知化学结构决定簇的抗原,称之为人工抗原。它可包括人工结合抗原、人工合成抗原和基因重组抗原。无论对免疫学理论研究和分子疫苗的制备都具有重要意义。
(一)人工结合抗原
将无免疫原性的简单化学基团与蛋白质载体偶联,或将无免疫原性的有机分子如二硝基苯(DNP)或三硝基苯(TNP)与蛋白质载体结合,形成载体-半抗原结合物,均属人工结合抗原。应用此种抗原证明了抗原与抗体特异结合的化学基础,以及在抗体生成过程中T与B细胞的协同作用。
(二)人工合成抗原
用化学方法将活化氨基酸聚合,使之成为合成多肽,只由一种氨基酸形成的聚合体称为同聚多肽,如由左旋赖氨酸形成的共同聚多肽(PLL)。由二种或二种以上氨基酸形成的聚合多肽称为共聚多肽,如由酪氨酸、谷氨酸与多聚丙氨酸和赖氨酸组成的聚合成多肽(T、G)-AL。应用这种人工合成多肽可研究氨基酸种类、序列与蛋白质抗原性及免疫原性的关系,也可研究机体遗传性与免疫性的关系。
对天然蛋白质抗原性的研究证明,任何一个氨基酸片段,只要具有合适的构型,都有抗原性,甚至一小段合成的小肽与合适的载体相联接,也能诱导产生抗体,并能与其天然分子构型相结合,这就提示,可根据天然蛋白质抗原的免疫原性片段进行氨基酸序列分析,或由其编码DNA推导的氨基酸序列,进行构建人工合成多肽疫苗。
(三)基因工程抗原
近年来由于分子生物学技术的进步,已有可能将编码免疫原性氨基酸序列的基因克隆化并与适当载体(如细菌粒或病毒)DNA分子相结合,然后引入受体细胞中(如原核细胞的大肠杆菌或真核细胞酵母菌及哺乳类动物细胞)使之表达,即能获得免疫原性之融合蛋白,经纯化后可做为疫苗,此即基因工程疫苗。
应用分子生物学技术制备基因重组疫苗的另一进展,是将目的抗原决定簇的DNA序列插入另一种比较安全的活病素基因组中(如牛痘苗),制备所谓重组感染载体多价疫苗。
随着70年代分子病毒学的发展,特别是对病毒基因的结构、功能与复制方面知识的积累,为迅速研制病毒亚单位疫苗、合成多肽苗以及基因工程疫苗奠定了基础。
一些重要病毒如乙型肝炎病毒、脊髓灰质炎病毒、疱疹病毒以及流感病毒等的蛋白质多肽,都已利用基因工程进行了成功的表达,有的已进入临床试验阶段。我国也报导了正在进行研制基因工程乙型肝炎病毒疫苗和在牛痘苗表达系统中研制乙肝病毒的重组感染载体的多价疫苗。
三、胸腺依赖抗原与胸腺非依赖抗原
实验证明,由抗原激发的免疫应答是多细胞相互作用的结果,即由抗原呈递细胞、T细胞和B细胞共同参与予完成的。大多数抗原激发的体液免疫应答,必须有TH细胞参予才能完成,称这种抗原为胸腺依赖抗原(thymus-dependent antigen,TD Ag)。但也有少数抗原物质,不须TH细胞参予,可单独刺激B细胞产生抗体,称这种抗原为胸腺非依赖抗原(thymus independentantigen,TIAg)。这二种抗原的区别主要在于其抗原决定簇的结构不同所致。TD抗原在其分子结构上,既具有载体功能的决定簇,也具有抗原性决定簇。且在其分子表面出现多种不同抗原决定簇,但缺乏重复出现的同一决定簇,TD抗原主要是大分子蛋白质。而TI抗原多数为大分子多聚体,带有重复出现的同一抗原决定簇,且降解缓慢,故不须TH参加即能直接刺激B细胞,TI抗原主要是多糖类物质(图10-5、表10-5、6)。
图10-5 TD与T1抗原种类
表10-5 TD与TI抗原种类
| TD | TI | |
| 人丙种球蛋白 牛血清清蛋白 卵白蛋白 类毒素 |
羊红细胞 组织相容性抗原等 |
肺炎球菌荚膜多糖 脂多糖 聚合鞭毛 DNP-聚蔗糖 聚乙烯基吡络烷酮(PVP) |
表10-6 TD抗原与TI抗原的特性
| 特性 | TD抗原 | TI抗原 TⅠ-1 TⅠ-2 |
|
| 化学特性 | 蛋白质 | 脂多糖 | 多糖 |
| 抗体应答 | + | + | |
| 无胸腺鼠 | - | + | -/少 |
| 无T细胞培养物 | - | ||
| 抗体应答的特点 | - | ||
| 类别转换 | + | - | - |
| 亲和性成熟 | + | - | - |
| 记忆B细胞 | + | - | - |
| 多克隆B细胞活化剂作用 | - | + | - |
| 诱导DTH能力 | + | - | - |
四、超抗原
(一)超抗原的概念
超抗原(supper antigen,Sag)是一类由细菌外毒素和逆转录病毒蛋白构成的抗原性物质。它们能与多数T细胞结合并为T细胞活化提供信号。而上述的普通抗原只能与少数对应T细胞结合并使之活化。因此称这种能与多数T细胞结合的抗原为超抗原。
(二)超抗原与T细胞结合的特征
超抗原主要与CD4+T细胞结合,而和普通抗原肽与T细胞的结合有很大差异。超抗原既能与APC细胞上MHCⅡ类分子结合,也能与TCR Vβ链结合是其作用特点。
超抗原无需经APC加工可直接与MHCⅡ类分子非多态区外侧结合,而不是与肽结合沟结合,故无MHc 限制性。
在T细胞方面超抗原只与TCRVβ片段结合,而与D和J区无关,也与TCRα链无关。任一已知超抗原能与其特殊殊的Vβ片段结合,所以一种超抗原可活化多数T细胞,约占T细胞库的1/20~1/5,这远远超过普通抗原活化T细胞的数量(表10-7)。
表10-7 超抗原的作用特性
| 普通抗原 | 超抗原 | |
| T细胞一次应答 | - | + |
| T细胞反应频率 | 1/106~1/104 | 1/20~1/5 |
| MHCⅡ类分子 | 肽结合沟 | 非多态区(α-螺旋) |
| 结合部位 | 外侧 | |
| MHC限制性 | + | - |
| APC存在 | + |
(三)超抗原的种类
1.内源性超抗原(病毒性) 70年代初Festenstein发现在MHC相同,而MHC以外基因区不同的纯系鼠间进行淋巴细胞混合培养,可引起很强的T细胞增殖反应,将刺激这种增殖反应的抗原称为次要淋巴细胞刺激抗原(minor lymph'ocyte stimulating antigen,Mlsag)。
近年来证明这种内源性MLs抗原是小鼠乳腺肿瘤病毒(mouse mamary umor virus,MMTV)产生的蛋白。MMTV是一种逆转录病毒,以前病毒(provirus)形式整合于小鼠细胞DNA中。这种小鼠可终生制造这种病毒蛋白,因之可视为一种自身超抗原。这种小鼠内源性MLs抗原的化学性质现已证明是一种糖蛋白。
由于MLs抗原的来源已经清楚,故目前称这种小鼠的内源性超抗原为病毒性超抗原。人类是否也有这种病毒性超抗原,目前尚不能肯定,但有人提出人类免疫缺损病毒(HIV)也是逆转录病毒,有可能是人类的病毒性超抗原。
2.外源性超抗原(细菌性)外源性超抗原是一类细菌性外毒素组成,主要由革兰氏阳性细菌产生。如金黄色葡萄球菌产生的肠毒素(staphylococcus enterotoxin,SE)以及链球菌产生的致热外毒素等。
(四)超抗原的生物学意义
1.超抗原与T细胞的耐受诱导实验证明在胸腺内分化发育中的T细胞如与超抗原结合,可诱发程序性细胞死亡,导致克隆排除。用抗Vβ单克隆抗体在周围血中检测不出带有特殊Vβ受体的T细胞,为T细胞耐受诱导机制的研究提供了有力的实验模式。
2.超抗原与疾病葡萄球菌感染所产生的外毒素主要是可溶性蛋白分子,近年来的研究证明葡萄球菌外毒素对靶细胞并无直接毒性作用,而是通过活化多数T细胞所释放的大量细胞因子产生的生物学效应引起的毒性休克综合征等临床征状。
一些疾病,例如原因不明的川畸病,风湿性关节等疾病,发现与某些Vβ阳性T细胞的增殖相关。周围组织中存在的自身反应性T细胞克隆可为外源性超抗原激活而引发自身免疫病。也有学者认为HIV引发的人艾滋病,其发病学与其超抗原相关。

图10-6 抗原分类
第十一章 免疫应答(一):B细胞介导的体液免疫
第一节 免疫应答的概念与过程
一、免疫应答的概念
抗原性物质进入机体后激发免疫细胞活化,分化和效应过程称之为免疫应答(immuneresponse)。但对这一过程的认识是随着免疫学的发展逐步深化和建立较为完整的概念。在免疫学发展的早期,人们发现抗原性物质进入体内后可在血液中检测出抗体,而对抗原是不产生应答的,其指导学说为侧链学说和指令学说。
进入近代免疫学时期,已知淋巴细胞可能是抗体产生细胞,但尚无直接证明,实验认为抗原只对抗体产生细胞起选择激发作用,并且认为抗体只是由单一淋巴细胞克隆完成的,彼此无关联。在这一时期已证明除存在体液免疫外,还存在有细胞免疫。对“自己”抗原提出了自身耐受的概念,在打破自身耐受的条件下可以发生自身免疫现象,并证明在自身免疫性疾病患者血清中有自身抗体存在。这一时期的指导学说是由Burnet提出的细胞系或克隆选择学说。
进入现代免疫学时期,已证明在高等动物和人体内存在有结构复杂的免疫系统,是由免疫器官、免疫细胞和免疫分子组成的。同时也证明了免疫应答是由多细胞系完成的。并认为它们之间存在着相互协同的和相互制约的关系,在正常免疫生理条件下,它们处于动态平衡,借以维持机体的免疫稳定状态。抗原进入可激发免疫系统打破了这种平衡,从而诱发了免疫应答,再建立新的平衡状态。在此时期还证明了自身耐受是由多种机制形成的,存在着生理性“自身识别”与病理性“自身识别”。其指导学说是由Jerne提出的免疫网络学说。
二、免疫应答的过程
现代免疫学的发展,为了解免疫应答过程提供了细胞学基础。虽然免疫应答过程的效应表现,主要是以B细胞介导的体液免疫和以T细胞介导的细胞免疫。但体内和体外的实验已证明,这二种免疫应答的产生都是由多细胞系完成的,即由单核吞噬细胞系、T细胞和B细胞来完成的。所以免疫应答过程不是单一细胞系的行为,而是多细胞系相互作用的复杂行为。这一过程包括:①免疫细胞对抗原分子的识别过程,即抗原分子与免疫细胞的相互作用;②免疫细胞的活化和分化过程,即免疫细胞间的相互作用;③效应细胞和效应分子的排异作用。(表11-1)。
表11-1 免疫应答过程
| 识别 | 活化与分化 | 效应 | |||
| 抗原的摄取、处理和加工抗原的呈递抗原的识别 | 膜受体的交联 膜信号的产生与传递 细胞增殖与分化 生物活性介质的合成与释放 |
对靶细胞或分子的排异作用 引起组织的损作用(炎症) 免疫应答的调节作用 |
|||
| 抗原→ Mφ T B |
T与B细胞的境殖与分化 抗体的产生与释放 细胞因子的产生与释放 效应T细胞的产生 免疫记忆细胞的产生 |
抗体分子 效应T细胞 免疫增强系统 补体分子 细胞因子 K/NK细胞 Mφ粒细胞系 肥大细胞 红细胞 血小板 |
排异 或排已 |
免疫保护 免疫病理 |
抗感染 抗肿瘤 自身免疫 变态反应 移植排斥 移植物抗 宿主反应 |
对免疫应答过程的了解,就是要对上述过程进行深入的探讨。现已主证明免疫细胞间的相互作用,既表现相互协同又表现相互拮抗,同时细胞间的相互作用是由其分泌的介质完成的。近年来的实验又证明,免疫细胞在其相互作用中,可表现为具有组织相容性基因的限制性,即所谓MHC限制性,表明免疫细胞的活动是受遗传控制的。上述发现,既揭示了免疫应答过程的复杂性,又反映了它是严密控制和精细的调节过程,这对保持机体自身免疫稳定性是十分重要的。因此,目前对免疫应答机制的研究,已由细胞水平、分子水平进入了基因水平,虽然如此,对这一复杂过程的认识是极其有限的,众多的问题还有待解决。
1.抗原识别阶段此阶段可包括抗原的摄取、处理和加工,抗原的呈递和对抗原的识别,分别由Mφ、T和B细胞完成。
2.免疫细胞的活化和分化阶段此阶段可包括抗原识别细胞膜受体的交联、膜信号产生与传递、细胞增殖与分化以及生物活性介质的合成与释放,主要由T和B细胞完成。
3.免疫应答的效应阶段此阶段主要包括效应分子(体液免疫)和效应细胞(细胞免疫)对非已细胞或分子的清除作用,即所谓排异效应,及其对免疫应答的调节作用。此阶段除抗体和效应T细胞参予外,即非特异免疫细胞和分子参加才能完成排异和免疫调节作用。
第二节 抗体产生的细胞学基础
一、抗体产生的一般规律
当第一次用适量抗原给动物免疫,需经一定潜伏期才能在血液中出现抗体,含量低,且维持时间短,很快下降,称这种现象为初次免疫应答。若在抗体下降期再次给以相同抗原免疫时,则发现抗体出现的潜伏期较初次应答明显缩短,抗体含量也随之上升,而且维持时间长,称这种现象为现次免疫应答或回忆应答。由于对抗体分子结构研究的进展,发现初次应答产生的抗体主要是IgM分子,对抗原结合力低,为低亲和性抗体。而再次应答则主要为IgG分子,且为高亲和性抗体。TD抗原可引起再次应答,而TI抗原只能引起初应答。对初次和再次应答现象机制的研究,对抗体特异性、多样性、免疫记忆以及对自身抗原而受性机制等问题的研究,都必须以抗体生成的细胞学为基础(图11-1,表11-2)。
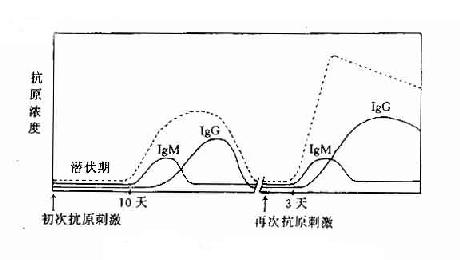
图11-1初次及再次免疫应答
表11-2 初次与再次免疫应答特性
| 特性 | 初次 | 再次 |
| 抗原呈递 | 非B细胞 | B细胞 |
| 抗原浓度 | 高 | 低 |
| 抗体产生 | ||
| 延迟相 | 5~10天 | 2~5天 |
| Ig类别 | 主要为IgM | IgG、IgA等 |
| 亲和力 | 低 | 高 |
| 无关抗体 | 多 | 少 |
二、抗体产生的细胞学基础
抗体产生是由多细胞完成的,Miller等在60年代,首先证明了淋巴细胞是不均一的细胞群。他用早期摘除鸡的胸腺和法氏囊的方法证明了有二类不同的的淋巴细胞,即T和B细胞。前者与细胞免疫有关,后者与抗体形成有关(表11-3)。
表11-3 新生期摘除胸腺及法氏囊对免疫功能的影响(鸡)
| 全身X-线照射 | 周围血淋巴细胞数 | Ig浓度 | 抗体产生 | 移植物排斥反应 |
| 未身X-线照射 | 148 000 | ++ | +++ | ++ |
| 胸腺摘除 | 9 000 | ++ | + | - |
| 法氏囊摘除 | 13 200 | - | - | + |
+阳性反应;-阴性反应
Claman 给经X-线照射小鼠移入同系骨髓细胞(B细胞来源)和胸腺细胞(T细胞来源),然后用羊红细胞免疫,结果证明只有同时移入两种细胞才能产生抗体。因此证明了抗体产生需要T和B细胞共同参予。
Unanue等在70年代又证明了巨噬细胞在抗体形成中的重要作用。他们应用纯化细胞的体外培养技术研究这一问题。根据小鼠细胞对玻璃面或塑料面的粘附性,可将脾细胞分为二种,其一为有粘附性细胞属巨噬细胞(Mφ),另一种为非粘附性细胞属淋巴细胞,包括T和B细胞。当将这二种细胞分别与羊红细胞(抗原)在体外培养时,皆不能产生抗体,只有在二种细胞混合培养时才能产生抗体,自此证明了Mφ也参予抗体的产生(表11-4,5)。
表11-4 T和B细胞在抗体产生中的作用
| X-线照射鼠入的细胞 | 抗体产生 |
| 脾细胞(含有T和B) | ++ |
| 胸腺细胞(T细胞) | ± |
| 骨髓细胞(B细胞) | + |
| 胸腺细胞+骨髓细胞 | +++ |
表11-5 Mφ在抗体产生中的作用
| 体外培养细胞 | 抗体产生 |
| 粘附细胞+羊红细胞 非粘附细胞+羊红细胞 粘附细胞 + +羊红细胞 非粘附细胞 |
- - +++ |
表11-6 促进B细胞增殖和分化的细胞因子
| 名称 | 作用 |
| IL-1 IL-4 IL-5 IL-6 IL-2 |
促进B细胞活化与增殖 促进活化B细胞增殖 促进B细胞分化 与IL-1协同 |
在同一时期Gershon等又证明了抑制性T细胞(TS)的存在,对免疫应答起抑制作用。因此TH和TS可视为免疫调节细胞,而TC和TD可视为细胞免疫的效应细胞。通过上述研究,证明了抗体产生需要三种细胞参予,即单核吞噬细胞系、T细胞系和B细胞系。从而否定了过去认为抗体产生是由单一淋巴细胞克隆产生的观点。因此抗体产生不只是涉及抗原与免疫细胞间的相互作用,即对抗原的识别和抗原的激发作用,同时也涉及免疫细胞间的相互作用,,即免疫细胞活化,增殖与分化过程。这二个过程是紧密交织在一起的,为此必须进一步探讨在免疫应答过程中,三种细胞各自发挥什么作用?以及它们之间的相互作用又是怎样进行的。
三、免疫细胞在抗体生成中的作用
上述三类细胞都参予抗体生成过程,但各自发挥的作用不同。现已证明Mφ抗原处理和呈递细胞,无特异识别抗原的功能。T细胞系主要是TH和TS,它们对免疫应答有调节功能,所以是免疫调节细胞,有特异识别抗原的功能。B细胞系既具有呈递抗原的作用又是产生抗体的细胞,也具有特异识别抗原的功能。
(一)Mφ的作用
Mφ在免疫应答的全过程都发挥重要作用,在抗原识别过程中,即在免疫应答的诱导期,它表现为具有摄取、处理加工、存贮和呈递抗原的作用。它活化后还能分泌多种细胞因子,其合成和分泌的IL-1有促进T和B细胞的活化作用。因此,不能认为Mφ只是机械的将抗原决定簇呈递给淋巴细胞,它还具有调节淋巴细胞功能的作用。
抗原性物质进入体内后,必须先经Mφ摄取、加工处理,然后才能呈递给淋巴细胞。Mφ是有吞噬细胞功能的细胞,已证明在其细胞表面有多种受体分子,但无抗原识别受体。它主要是以吞噬、吞饮和被动吸附等方式捕捉抗原,可摄取任何抗原性特质,所以是非特异性的摄取抗原性物质。
摄入的抗原大分子,可在细胞内被降解为许多小肽片段。其中一些免疫原性决定簇可与细胞内的自己MHCⅡ类分子相结合,然后运送至细胞膜表面,形成所谓修饰的自身复合物分子(即异种抗原X+自己MHCⅡ类分子)此即Mφ对抗原的处理和加工过程。
Mφ将这种复合物分子,呈递给有抗原识别功能的淋巴细胞,才能激发免疫应答。不难看出,识别这种复合物的抗原识别受体,必须是既能识别异种抗原X,又能同时识别自已MHC分子。这就是免疫细胞间相互作用的MHC限制性的由来。
(二)淋巴细胞的作用
淋巴细胞具有抗原识别受体,所以T和B细胞都是抗原识别细胞。每一细胞克隆可识别一种抗原决定簇,所以这种识别是有特异性的。B细胞表面抗原识别受体是膜Ig分子,它可识别天然蛋白质抗原分子表面的构像抗原决定簇(即B决定簇),在识别抗原时无MHc 限制性。而T细胞抗原识别受体为异二聚体分子,即TCRαβ,它能同时识别经加工处理的序列决定簇肽片段(即T决定簇)和自己MHC分子,所以有MHC限制性。
四、细胞因子在抗体产生中的作用
细胞因子(cytokines)在抗体产生应答过程中的作用有下述特点:
1.细胞因子的作用既无抗原特异性也无MHC限制性当TH细胞受刺激活化后,它所分泌的细胞因子就可作用于任何抗原特异性的B细胞和任何MHC单倍型(haplotype)的B细胞。
2.在B细胞产生免疫应答的不同时期有不同的细胞因子起作用即B细胞的增殖期与分化期,或Ig的分泌期可有不同的细胞因子在起作用(表11-6)。此外,不同的细胞因子间的组合有的起拮抗作用,有的起协同作用。
3.细胞因子还可作用于旁路(bystander)B细胞使之活化这些B细胞对抗体应答的抗原没有特异性(非抗原特异性B细胞)。它们存在于抗原刺激的特异B细胞周围,在抗原活化特异B细胞时,因产生细胞因子而被活化并产生非特异抗体。
4.在刺激B细胞增殖分化的细胞因子中,有些是来源于巨噬细胞或其他非T细胞所产生(如粒细胞、肥大细胞等)。
第三节 抗体形成过程中免疫细胞间的相互作用
在抗体生成过程中,对TD抗原的应答已证明是由Mφ、T系细胞和B系细胞相互作用的结果,那么Mφ直接呈递抗原的对象是T细胞还是B细胞?或者二者都是?就现有资料分析,它们可能存在着Mφ与T的相互作用,T与B的相互作用以及Mφ与B细胞之间的相互作用。
一、巨噬细胞与TH细胞之间的相互作用
TH细胞必须由静止状态的TH转变活化为TH才能辅助B细胞产生抗体。关于TH细胞活化的机制,根据现有实验资料提出一个双信号假说。
近年的实验证明在抗原呈递细胞(APC)表面至少有二种分子与TH细胞的活化相关。一种是抗原呈递分子,它是由MHC分子组成,它可与外源性或内源性抗原肽片段结合,然后运送至细胞表面并呈递给T细胞,通过TCR/CE3刺激产生第1活化信号。另一种分子即所谓协同刺激分子(costimulating molecules,CM),它是由一组粘附分子组成,它不仅能促进APC与T细胞的直接接触,而且也具有诱导信号传递的功能。这组分子可与T细胞上的协同刺激分子受体(costimulatory moleculesrecptor,CMR)结合,刺激其产生协同激信号,即所谓第2信号。
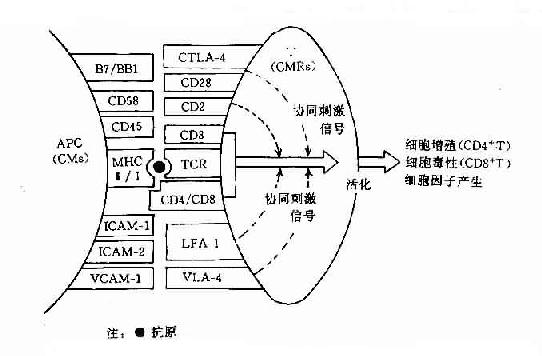
图11-2 T细胞活化主要协同刺激分子(CM)及其受体分子(CMR)的组成和作用示意图
T细胞上的CMR或称为辅助分子(accessory molecules)也是由一组粘附分子组成(表11-7)。对CMR及其配体的分子结构与功能及信号传导途径有待深入研究,但对其中的CD28分子和CTLA-4分子及其配体B7/BB1分子被认为是产生协同刺激信号的主要分子(图11-2)。
在这二种信号的作用下,才能使T细胞活化并合成和分泌IL-2和表达IL-2R,最终导致细胞分裂和克隆扩增。如无第2信号存在则T细胞不被活化也不引起克隆扩增,处于克隆不应答状态(clonol aneergy)(图11-3)。
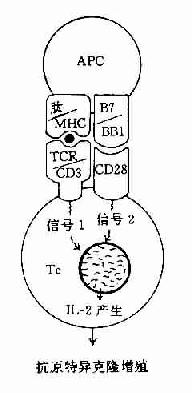
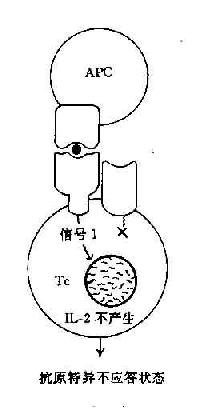
图11-3 协同刺激信号与T细胞活化状态
表11-7 T细胞表面主要辅助分子
| 名称 | 化学性质 | 基因族 | 细胞分子 | 配体分子(APC) | 功能 | |
| 粘附分子 | 信号传导 | |||||
| CD2(LFA-2) | 55kD单体 | Ig | 成熟T细胞 胸腺细胞 |
CD58(LFA-3) | + | + |
| CD4 | 55kD单体 | Ig | CD4+T细胞 | MHCⅡ分子 | + | + |
| CD8 | 78kD单体 | Ig | CD8+T细胞 | MHCⅡ分子 | + | + |
| CD11a/CD18 (LFA-1) |
180/95kD双体 | 粘合素 | 骨髓衍生细胞 | CD54(ICAM-1) | ? | + |
| CD28 | 90kD同二聚体 | CD4+ CD8+T(50%) |
B7/BB1 | + | + | |
| CDw49/CD29 (VLA-4、5、6) |
异二聚体 | 粘合素 | 白细胞 其它细胞 |
细胞外基质VCAM-1 | + | + |
| gP39(CD40L) | CD4+T细胞 | CD40 | ||||
阻断或给予第2信号,可以人为调节免疫应答使之增强或或抑制,对免疫治疗提供了新的手段。如阻断第2信号的产生可使T细胞处于免疫耐受状态,降低机体的免疫应答,这对防止移植排斥的发生和对超敏性疾病以及自身免疫性疾病的治疗是有利的。如将B7基因导入一定的肿瘤细胞则可增强机体的抗肿瘤免疫应答,目前这方面的实验研究已有较多的报道(图11-4)。
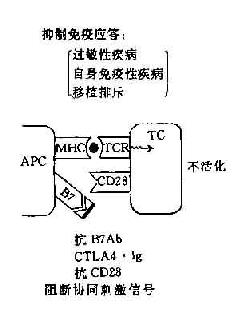
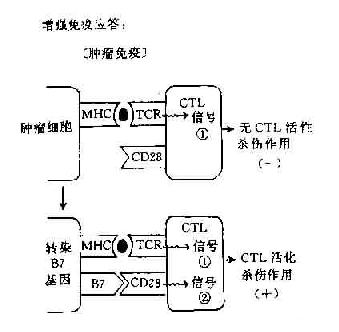
图11-4 协同刺激信号与免疫应答调节
二、TH细胞与B细胞之间的相互作用
(一)B细胞对T细胞依赖抗原的应答
一般情况下当大量抗原进入未经免疫的机体后,诱发初次免疫应答时其抗原呈递细胞多由巨噬细胞完成。经Mφ活化TH细胞后再由活化的TH细胞辅助B细胞产生抗体和形成记忆B细胞。但当再次免疫应答发生时,抗原呈递细胞则主要由已扩增的B细胞克隆承担。由于其膜Ig受体亲和力增高故对少量抗原也能摄取,故可取代巨噬细胞的抗原呈递作用。
过去曾认为B细胞与TH细胞间的相互作用是通过抗原的桥联作用使之发生接触,即B细胞的抗原受体可识别抗原分子的半抗原部分,而TH细胞的抗原受体可识别抗原分子的载体部分。但近年的实验证明B细胞与Mφ相同,也是通过抗原呈递作用与TH细胞相互作用。即B细胞可通过其膜Ig受体蛋白质抗原,即T依赖性抗原结合,经内化作用将抗原摄入。然后经过加工处理,使T细胞决定簇与MHCⅡ类分子结合,形成MHC-肽分子复合物并运送至B细胞表面,将其呈递给TH细胞,所以B细胞与TH细胞间的相互作用也是MHC限制性的。
B细胞和TH细胞通过其粘附分子及抗原呈递作用可彼此直接接触,并能相互诱导使之活化。活化B细胞在TH细胞的辅助下,B细胞最终增殖分化为合成和分泌各类免疫球蛋白分子的浆细胞。
B细胞可通过其抗原呈递作用刺激T细胞抗原受体(TCR/CD3)产生活化信号1,并通过其表面B7及其它协同刺激分子与T细胞表面的相应受体分子如CD28、IFA-1等相结合,可激发产生协同刺激信号(即信号2),在双信号作用下可使TH细胞活化。
B细胞要通过其BCR即表面Ig受体与抗原结合,Iga和Igβ链与CD3分子相当,可传递活化信号1。近年证明在B细胞表面表达的CD40分子可与T细胞表面的相应配体分子gP39(即CD40配体分子,CD40L)结合可激发其产生活化信号2,在此双信号作用下可使B细胞活化(图11-5)。
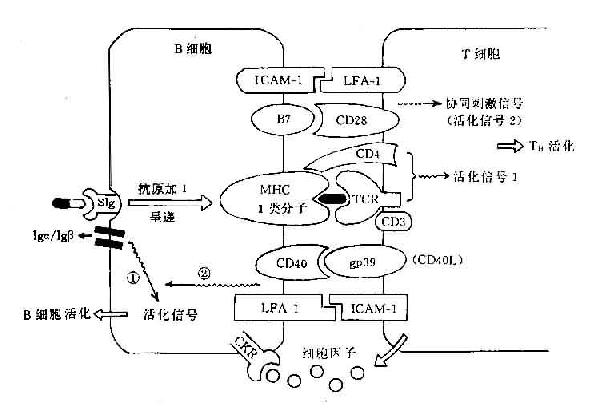
图11-5 B细胞与TH细胞间相互作用
活化的B细胞在活化的TH细胞分泌的多种细胞因子作用下,可增殖分化为分泌抗体的浆细胞和记忆B细胞。在再次应答时可发生Ig类别转换及抗体亲和力成熟等一系列变化。
(二)B细胞对非T细胞依赖抗原的应答
B细胞对非细胞依赖抗原(T1)的活化机制与T细胞依赖抗原完全不同。对Ⅰ型T1抗原,例如细菌脂多糖抗原,在高浓度时,它是B细胞的多克隆活化剂。这类抗原的决定簇部分可与B细胞表面的抗原受体结合,另外它具有促分裂素(mitogen)的结构,可与其相应受体结合。在这两部分结构的结合作用下,使B细胞多克隆活化。
而Ⅱ型T1抗原的结构特点是具有多个重复出现的抗原决定簇呈线性排列,在体内不易降解,例如肺炎球菌等多糖抗原。这些抗原决定簇对B细胞抗原受体亲和力强,由于受体交联而使B细胞活化(图11-6)。
A.Ⅰ型T1抗原是多克隆活化剂 B.Ⅱ型T1抗原有多个重复排的抗原决定簇使受体交联
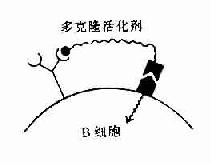
图11-6 T1抗原对B细胞的活化作用
T1抗原虽可被APC摄取,但不能被加工处理,所以不能与MHCⅡ类分子结合,故B细胞对T1抗原的应答无TH细胞参予,只表现初次应答的特性而不出现次应答的一系列变化。
三、巨噬细胞与B细胞的相互作用
这二种细胞间的相互作用尚不能肯定。但由于B细胞在大多数情况下需要有TH的协同,所以B细胞活化至少是间接的需要Mφ对B细胞的活化有直接作用,其分泌的IL-1对B细胞活化有促进作用(图11-7)。
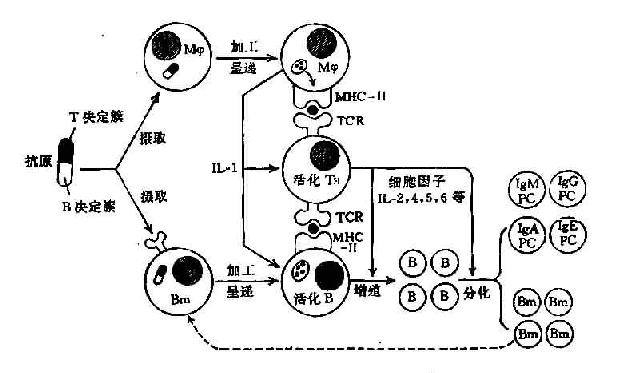
图11-7 抗体产生过程中免疫细胞间相互作用
第四节 免疫记忆
用同一抗原再次免疫时,可引起比初次更强的抗体产生,称之为再次免疫应答或免疫记忆,无论在体液免疫或细胞免疫均可发生免疫记忆现象。在体液免疫时,对TD抗原的再次应答可表现为抗体滴度明显上升,免疫球蛋白类别可由IgM转换为IgG,而且抗体亲和力增强。提示再次应答不仅发生抗体量的变化,而且也发生了质的变化。实验证明,免疫记忆的基础是免疫记忆细胞的产生。
一、免疫记忆细胞
在载体-半抗原效应的研究中,已证明T细胞及B细胞都与免疫记忆有关。即在免疫应答过程中,既能产生B记忆细胞(Bm),也能产生TH记忆(THm)。免疫记忆现象可以解释为对特异抗原应答的淋巴细胞数量增加的现象。
用有限稀释法计数在载体-半抗原效应中免疫记忆细胞的数量变化,发现在T细胞群中对载体特异的T细胞辅助活性比初次应答可增强10倍。这不仅是由于TH细胞数量的增加,也反映了TH功能的增强所致。
有相同方法也证明了在再次应答中对半抗原特异的细胞数量亦增加,由其产生抗体性质的变化,表明B记忆细胞也伴随有质的变化。关于前进B细胞(Bp)、成熟B细胞(Bv)、记忆B细胞(Bm)的特性可见表11-8。
表11-8 Bp、Bv、Bm细胞的特性
| Bp | Bv | Bm | |
| 更新速率 | 快(数日) | 快(数日) | 慢(数月~数周) |
| 再循环 | 无 | 无 | 有 |
| 组织分布 | |||
| 胚胎期 | 肝、脾 | - | - |
| 成年期 | 骨髓 | 骨髓、脾、淋巴节 | 胸导管、脾、淋巴结 |
| 耐受性产生 | 易 | 难 | 难 |
| 对抗原亲和力 | - | 低 | 高 |
| 过继抗体产生 | 慢(2~3周) | 快(1~3周) | 快(1周) |
| 电泳迁移率 | - | 快 | 慢 |
二、免疫球蛋白类别的转换
在初次应答时开始出现的抗体是IgM,当达到高峰时才开始出现IgG,而IgG高峰虽出现较晚,但能维持较长时间。在再次应答时产生IgG的潜伏期明显缩短,水平更高。
这种由IgM转换为IgG只是Ig分子的类别变化,其识别抗原的特异性则仍相同。表明这二类Ig分子V区结构相同,只是C区结构发生了变化。实验证明,给新生小鼠注入抗μ血清,可抑制IgG和IgM的产生,提示这种转换可能是由产生IgM的细胞变为产生IgG的细胞,而不是由不同亚群的B细胞产生的。
三、抗体亲和力的变化
在抗体生成过程中,抗体分子的平均亲和力随着时间的延长而增加,这种现象称为抗体分子亲和力的成熟。实验证明,在免疫应答过程中,IgG的亲和力可增加达数百倍。这种亲和力的成熟现象,被认为是由于存在具有不同亲和力Ig受体的B细胞。在免疫应答初期可因存在较大量的游离抗原分子,因此与低亲和力受体的B细胞结合较多,故其所产生抗体分子的平均亲和力较低。当抗原量逐渐减少时,则与带有高亲和力受体细胞的结合多于低亲和力受体细胞,因之抗体分子的平均亲和力随时延长而增高。
第五节 体液免疫的效应
免疫应答最终效应是将侵入机体的非已细胞或分子加以清除,即排异效应。但抗体分子本身只具有识别作用。,并不具有杀伤或排异作用,因此体液免疫的最终效应必须借助机体的其它免疫细胞或分子的协同作用才能达到排异的效果。
一、抗体分子的中和作用
由于抗体分子有特异识别作用,它可与侵入机体的病毒或外毒素分子结合,从而阻断了病毒进入细胞的能力或中和了外毒素分子的毒性作用。从而发挥抗体分子的保护作用。
二、抗体分子的调理作用
单核吞噬细胞系统以及中性粒细胞的表面,都带有IgG或IgM分子的Fc受体或补体分子受体。因此,由抗体与抗原形成的免疫复合物极易被这种具有吞噬功能的免疫细胞所吞噬杀伤或降解并被排除。
三、补体介导的细胞溶解作用
补体分子可经第一活化途径或旁路活化途径溶解靶细胞。但补体分子在无抗体分子存时,不能被活化。因此,抗体分子可借补体的作用溶解细胞,被溶解的细胞再经吞噬细胞系统加以排除。
四、抗体依赖细胞介导的细胞毒性作用
凡是具有IgG、Fc段受体的吞噬细胞或具有杀伤活性的细胞都参予这种作用。因此参予抗体依赖细胞介导的细胞毒性作用(ADCC)的细胞可有巨噬细胞、中性粒细胞和杀伤细胞(K细胞)等。
第六节 体液免疫应答的调节
无论体液免疫应答与细胞免疫应答,都不能无限制的发展下去,在免疫系统内存在着复杂的调节机制,以控制免疫应答的发展,这是一种对生理功能的保护作用。
一、抗体的反馈调节
当抗体产生后,可不断与抗原结合,并被清除。这是抗原被清除的原因之一,因此可终止免疫应答发生。
二、免疫抑制细胞的作用
免疫系统内已证明有抑制性细胞存在,特别是抑制性T细胞,即TS细胞,对免疫应答有重要调节作用。当免疫应答发展到一定程度时,即能诱发抑制性T细胞的作用。其作用机制可能是它分泌的特异性抑制性因子(TSF)和它参予的网络调节。
三、免疫网络调节
现已证明每一种特异性抗体分子(Ab1)都具有其独特型决定簇,并具有自己抗原性。当抗体分子产生至一定量时,其独特型决定簇可激发其自体产生抗独特型抗体(Ab2),并可连续发展下去。此种抗独特型抗体可促进或抑制免疫应答。其后证明独特型决定簇除存于B细胞的抗原受体外,也存在于TH和TS细胞的抗原识别受体分子上,因此抗独特型抗体亦可通过TH及TS细胞的作用发挥免疫调节作用。Jerne根据抗独特型诱发的免疫调节作用,于1974年提出了他的独特型免疫网络学说(immune network theory)。
第十二章 免疫应答(二):T细胞介导的细胞免疫
第一节 细胞免疫的概念
凡是由免疫细胞发挥效应以清除异物的作用即称为细胞免疫。参予的细胞称为免疫效应细胞。目前认为具有天然杀伤作用的天然伤细胞(NK)和抗体依赖的细胞介导的细胞毒性细胞(antibody dependentcell-mediatedcytotoxicity,ADCC)如巨噬细胞(Mφ)和杀伤细胞(K)以及由T细胞介导的细胞免疫均属细胞免疫的范畴。前二类免疫细胞在其细胞表面不具有抗原识别受体,,因此它们的活化无需经抗原激发即能发挥效应细胞的作用,故可视之为非特异性细胞免疫。而效应T细胞则具有抗原识别受体,因此它们必需经抗原激发才能活化发挥其效应细胞的作用,故可视之为特异性细胞免疫。
由T细胞介导的细胞的免疫有二种基本形式,它们分别由二类不同的T细胞亚类参予。一种是迟发型超敏性的T细胞(TDH,CD4+),该细胞和抗原起反应后可分泌细胞因子。这些细胞因子再吸引和活化巨噬细胞和其它类型的细胞在反应部位聚集,成为组织慢性炎症的非特异效应细胞。另一种是细胞毒性T细胞(TC,CD8+),对靶细胞有特异杀伤作用。
上述二种类型的效应T细胞的存在虽然均可经体外实验分别证实。但通常在体内反应过程中,二种类型的效应细胞均有不同程度的表现。
引起细胞免疫的抗原多为T细胞依赖抗原(TD抗原),与体液免疫相同,参予特异细胞免疫的细胞也是由多细胞系完成的。即由抗原呈递细胞(巨噬细胞或树突状细胞)、免疫调节细胞(TH和TS)以及效应T细胞(TDTH和TC)等。
在无抗原激发的情况下,效应T细胞是以不活化的静息型细胞形式存在。当抗原进入机体后,在抗原呈递细胞或靶细胞的作用下使静息型T细胞活化增殖并分化为效应T细胞。即由T细胞介导的细胞免疫应答也需经过抗原识别(诱导期)、活化与分化(增殖期)和效应期才能发挥细胞免疫作用。
由T细胞介导的主要细胞免疫现象有:①迟发型超敏性反应;②以胞内寄生物的抗感染作用;③抗肿瘤免疫;④同种移植排斥反应;⑤移植物抗宿主反应;⑥某些药物过敏症;⑦某些自身免疫病。
第二节 CD4+T细胞介导的细胞免疫
这是由CD4+T细胞激发的特异性细胞免疫应答,它可引起组织的慢性炎症,它是以淋巴细胞(主要是T细胞)和单核吞噬细胞系细胞浸润为主的渗出性炎症。
由于免疫细胞的激活、增殖和分化以及其它炎症细胞的聚集需要较长时间,所以炎症反应发生较迟,持续时间也长,故称此种炎症的反应为迟发型超敏反应(delayedtypehy persensitiyty,DTH)。诱发这种的反应的T细胞称为迟发型超敏性T细胞(TDTH)。
这种由CD4+T细胞介导的细胞免疫与临床传染性变态反应、接触性皮炎、移植排斥反应以及一些自身免疫病的组织损伤有关。
一、CD4+T细胞在DTH反应中的作用
Chase(1942)应用已被抗原致敏的豚鼠的淋巴细胞转移给正常豚鼠,然后用致敏抗原经皮内攻击,可引起皮肤的DTH反应,而用致敏豚鼠血清转移不能引起DTH反应,首先证明了细胞免疫存在的事实。在无丙种球蛋白患者,即体液免疫缺损患者亦可产生DTH反应,在人体内也证明了DTH反应与抗体无关。
其后在小鼠内证明参予这种反应的淋巴细胞是Lyt-1+T细胞(与人CD4+T细胞相当),其表型与辅助性T细胞(TH)相同,并且两者在识别抗原的MHC限制性上也相同。但两者在功能上完全不同,前者介导细胞免疫,而后者则参予体液免疫。近年的研究证明小鼠CD4+T细胞根据其合成和分泌的细胞因子不同,可分为TH1和TH2两种亚类。TH1介导细胞免疫,TH2参予体液免疫。
二、CD4+T细胞的活化
CD4+T细胞的活化需有抗原呈递细胞参予,主要为巨噬细胞(MФ),其次表皮内的Langerhans细胞和血管内皮细胞亦可发挥抗原呈递细胞的作用(图12-1)。
实验证明,经亚致死量X射线照射的动物只有当输入淋巴细胞和骨髓干细胞(供给巨噬细胞的来源)时才能引起DTH反应。
巨噬细胞在DTH反应中可发挥两方面作用,首先在诱导期它具有呈递抗原的作用,在效应期非致敏的巨噬细胞在活化的CD4+T细胞释放的细胞因子作用下,可成为DTH中重要的炎症细胞。
巨噬细胞通过吞噬或吞饮作用,将外源性蛋白质抗原摄取进入胞内,,经加工后产生的抗原肽片段与其自己MHCⅡ类分子结合形成复合物,然后运送至细胞表面并呈递给CD4+T细胞,自此开始了CD4+T细胞活化的诱导期。
CD4+T细胞活化需有双信号刺激,即其抗原识别受体(TCRαβ)与抗原呈递细胞上的肽-MHCⅡ的复合物结合后,可通过CD3复合分子传递第一信号。CD4+T细胞上其它辅助分子如CD2、LFA-1、CD4及CD28等分子可与APC上相应的配体分子如LFA-3、ICAM-1、MHCⅡ及B7分子等结合,不仅增强了CD4+T细胞与APC间的粘附作用,同时可向CD4+T细胞传递协同刺激信号(Costimulatory Signal)使之活化并产生多种细胞因子,它们既能促进CD4+T细胞克隆的扩增又是CTH反应的分子基础。如无辅助信号发生则CD4+T细胞处于不应答(anergy)状态。
三、迟发型超敏性炎症的形成
CD4+T细胞经抗原识别、活化和克隆增殖并合成和分泌大量各种细胞因子,其中最重要的有白细胞介素-2(IL-2)、肿瘤坏死因子(TNF)、淋巴毒素(LT)和干扰素(IFN-γ)等,它们是产生DTH反应的分子基础。
(一)IL-2
抗原活化的T细胞可借其IL-2的自分泌和旁分泌作用促进T细胞增殖,其中包括抗原特异的T细胞和邻近的旁路T细胞(bystandercell)。当淋巴细胞大量渗出时,在抗原攻击部位出现的T细胞90%以上是旁路T细胞。IL-2除能刺激t 细胞增殖外,还能促使CD4+T细胞合成细胞因子,其中包括IL-2、TNF、TFN-γ和淋巴毒素(LT)等。特别在DTH晚期LT分泌量可大于TNF。
(二)IFN-γ
由CD4+T细胞分泌的IFN-γ可作用于抗原呈递细胞如巨噬细胞和内皮细胞,增加它们MHCⅡ类分子的表达。可提高其呈递抗原效率。这是又一种重要的诱导DTH反应的放大机制。
(三)TNF和LT
肿瘤坏死因子和淋巴毒素可作用于血管内皮细胞使之表达粘附分子和分泌趋化性细胞因子如IL-8等。这些分子有利于吸引血流内白细胞如中性粒细胞、淋巴细胞以及单核细胞等与血管内皮粘附并迁移和外渗至组织内引起组织炎症反应(图12-2)。IFN-γ和IL-4对内皮细胞也有类似的作用。
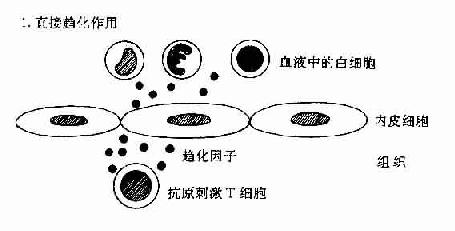
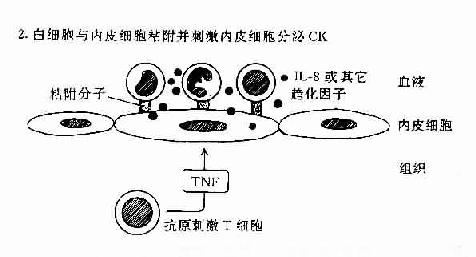
图12-2 DTH反应中动员白细胞的机制:T细胞和内皮细胞所起的作用。
T细胞可分泌作用于白细胞的趋化因子;或分泌TNF,它可增加内皮细胞-白细胞粘附分子的表达,并刺激内皮细胞分子分泌CK(如IL-8)促使白细胞游走至组织中。
(四) 自血流经内皮细胞渗出的单核细胞进入炎症部位的组织后,在细胞因子的作用下可分化为巨噬细胞,此过程可称之为巨噬细胞活化。IFN-γ是强有力的巨噬细胞活化因子,只有活化的巨噬细胞才具有杀伤胞内的微生物、杀伤肿瘤细胞的功能,而静息的单核细胞是无这些功能的。所以活化的巨噬细胞是DTh 反应中主要的清除抗原和引起炎症的效应细胞。
活化的巨噬细胞可分泌许多引起炎症的细胞因子的生长因子。如其分泌的TNF、IL-1和IL-6在急性期可通过其作用于T细胞,炎症细胞和内皮细胞以增强其细胞介导的免疫反应引起局部组织损伤。在慢性期则可刺激纤维母细胞增生和产生胶原纤维,其分泌的PDGF和TGF-β可增强这种作用。此过程称为纤维化是DTH反应的最终结局。
在慢性DTH反应中,活化巨噬细胞自身可发生变化,其胞浆和胞浆内细胞器有所增加,其形态类似皮肤上皮细胞,故称为上皮样巨噬细胞。有时它们融合形成多核巨细胞。在一些持久性细胞内细菌感染如结核杆菌感染形成的簇状活化巨噬细胞是一种可触知的结节性炎症组织称之为肉芽肿。这种内芽肿性炎症是慢性DTH的一种形成。
总之,急性DTH反应细胞介导免疫的形成之一。它的发生首先是CD4+T细胞识别可溶性蛋白质抗原或CD8+T细胞识别胞内的微生物衍生物抗原和对活化T细胞产生的细胞因子应答的结果。
在细胞因子中特别是TNF可活化衬里毛细血管后静脉的内皮细胞,它可吸引血流中中性粒细胞、淋巴细胞和单核细胞外渗至局部组织内引发炎症。其后IFN-γ可作用于聚集的单核细胞使之活化为具有杀伤功能和清除抗原能力的巨噬细胞,成为DTH的最终效应细胞。
如抗原刺激持久存在,则巨噬细胞可长期活化并继发分泌细胞因子和生长因子,造成组织纤维化形成慢性DTH反应。
在早期DTH反应中以活化CD4+T细胞和活化巨噬细胞浸润为主,这些细胞和聚集在活化的血管内皮细胞周围并外渗至局部组织内。在晚期慢性DTH反应中以簇状上皮样巨噬细胞和巨细胞为主并伴有大量纤维母细胞形成组织纤维化以替原有组织(图12-3)
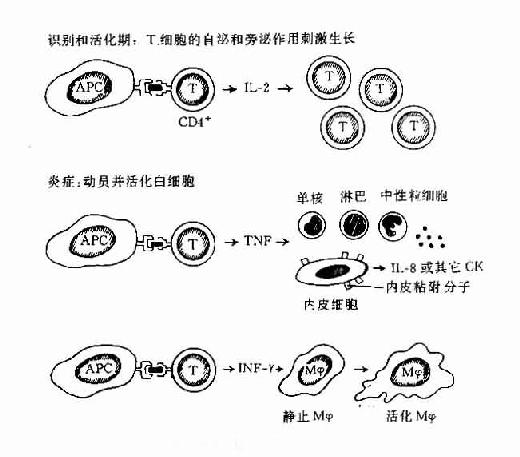
图12-3 DTH反应的过程
DTH开始由T细胞识别APC表面与MHC分子结合的抗原,这种细胞可以是CD4+T也可以是CD8+T细胞;由T细胞分泌的不同的CK在DTH不同阶段起不同的作用。
第三节 CD8+T(TC)T细胞介导的细胞免疫
CD8+T细胞(TC或CTL细胞)能杀伤表达抗原的靶细胞,它在抗毒感染、急性同种异型移植物排斥和对肿瘤细胞的杀伤作用是重要的效应细胞。
绝大多数TC细胞表达CD8分子,其抗原识别受体(TCRαβ)可识别多肽抗原与自己MHCⅠ类分子形成的复合物。这些非已多肽抗原是在靶细胞内合成经加工后与自己MHCⅠ类分子结合并运送到靶细胞表面的。少数TC细胞可表达CD4分子并识别和自己MHCⅡ类分子的结合的多肽抗原(图12-4)
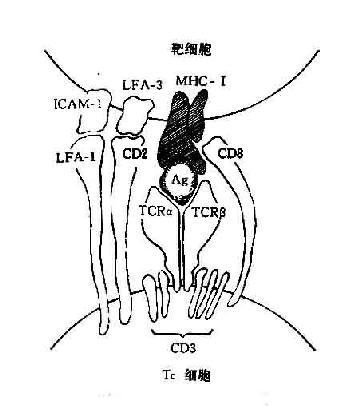
图12-4 TC细胞抗原识别
一、CD8+T(TC)T细胞的活化
在正常机体中TC细胞以不活化的静息T细胞的形式存在。因此它也必须经过抗原激活并在T辅助(TH)协同作用下,才能分化发育为效应杀伤T细胞(TC)。
杀伤T细胞(TC)的活化也需要双信号,即TCR与靶细胞膜上MHC类分子与抗原肽分子复合物结合后,可通过CD3复合分子传递第一信号;而TC细胞上的其它辅助分子(accesssory molecules)如CD2,LFA-1、CD8及CD28分子等可与靶细胞上相应的配体分子如LFA-3、ICAM-1、MHCⅠ类分子及B7分子等结合,不仅可增强TC细胞与靶细胞的粘附作用,同时也向TC细胞传递协同信号(costimulatorysignal)使之活化。在活化CD4+T细胞分泌的细胞因子(如IL-2)作用下使之克隆增殖并分化为效应杀伤T细胞(TC)(图12-5)。
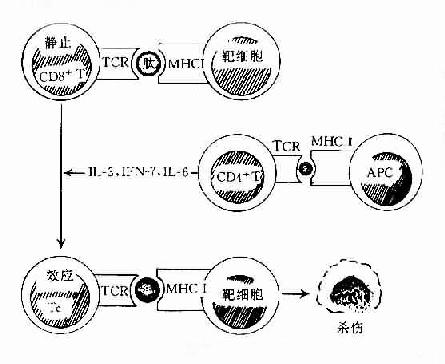
图12-5 T细胞的发生
二、TC细胞杀伤靶细胞的机制
杀伤T细胞对靶细胞的杀伤作用是抗原特异性的,只杀伤相应靶细胞而对其它细胞无损伤作用。杀伤T细胞必需与靶细胞直接触才有杀伤作用。当靶细胞被溶解时,TC细胞本身不受损伤并与之解离,因此一个杀伤T细胞可连续杀伤多个靶细胞,其杀伤机制可能是其分泌的多种细胞毒素所致。
(一)穿孔素蛋白(perferin)
杀伤T细胞活化后可诱发脱颗粒作用,排出其胞浆颗粒内已合成的一种蛋白质——穿孔素。这种蛋白在颗粒内是单体,当与胞外高浓度Ca2+接触后即发生聚合。这种聚合多发生在靶细胞膜的脂质层,并形成离子透过通道,因之大量离子和水分可进入细胞造成细胞溶解。这种细胞溶解作用类似于补体的膜攻击复合物的作用,并且穿孔蛋白的结构也与C9有同源性。此外,颗粒中的其它成分如丝氨酸酯酶和蛋白聚糖也有损伤细胞的作用。
(二)细胞毒素
杀伤T细胞可泌一种蛋白质毒素,它与颗粒内的物质不同,而类似于淋巴毒素的物质。这种细胞毒素可活化靶细胞内的DNA降解酶,导致靶细胞核DNA的裂解,引起靶细胞的程序性死亡(Programmed cell death,PCD)。
由TC细胞分泌的细胞毒素引起的靶细胞死亡并不出现由于渗透压增高引起的细胞膨胀导致的细胞溶解。而穿孔蛋白杀伤靶细胞也不引起DNA裂解导致的细胞程序性死亡。这两种杀伤机制在TC的杀伤作用中可能是互补的(图12-6)。
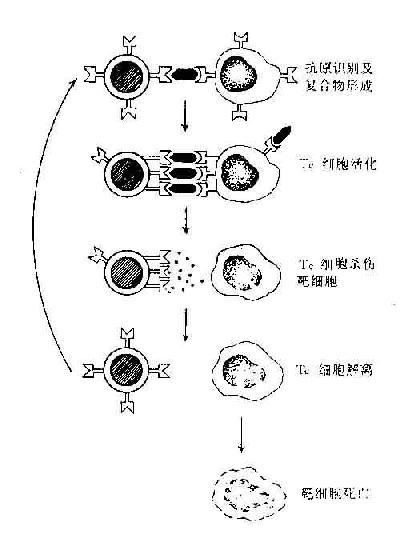
图12-6 T细胞杀伤靶细胞过程
第十三章 免疫应答(三):免疫耐受
免疫耐受(immunologic tolerance)是指免疫活性细胞接触抗原性物质时所表现的一种异性的无应答状态(a state of specific unresponsiveness)。它是免疫应答的另一种重要类型,其表现与前述的正相免疫应答相反,亦与各种非特性的免疫抑制不同,后者无抗原特异性,对各种抗原均呈无应答或低应答(表13-1)。
按照免疫耐受形成的特点,可分为天然与获得两种。
免疫耐受既可天然获得,亦可人工诱导。前者称天然耐受(naturaltolerance),后者称获得耐受(acpuiredtolerance)。外来的或自身的抗原均可诱导免疫耐受,这些抗原称耐受原(tolerangen)。针对自身抗原呈现的免疫耐受(self tolerance)。
按照免疫耐受的程度,又可分为完全耐受和不完全耐受。后者又有多种形式。如仅对T细胞或B细胞产生的耐受分别称T细胞耐受或B细胞耐受。又如免疫活性细胞仅对抗原分子上的某一特定决定簇产生耐受而不涉及对其它决定簇的应答,这些现象称为分离耐受(splittolerance)。不完全耐受尚可表现为抗体分泌细胞在再次受抗原刺激后,产生低亲和力抗体或缺失抗体类别转换,是为免疫偏离(immune deviation)。
表13-1 免疫耐受与免疫抑制的比较
| 免疫耐受 | 免疫抑制 | |
| 原因 | 细胞系消失或不活化,Ts细胞的抑制作用 | 免疫活性细胞发育缺损或增殖分化障碍 |
| 产生条件 | 可先天或后天获得,特别是在免疫功能未成熟或减弱时容易形成 | 先天缺损,或人为产生,如X-射线、免疫抑制药物、抗淋巴细胞血清作用 |
| 特异性 | 高 | 无 |
| 持续性 | 长期的,一时性的或终生 | 一时性 |
| 临床应用 | 实验治疗阶段 | 已应用于变态反应,自身免疫病和移植 |
| 合并症 | 无 | 感染与肿瘤 |
第一节 免疫耐受现象的发现
一、天然耐受现象
1945年Owen观察到异卵双生小牛胎盘血管融合,血液交流而呈自然的联体共生,可在一头小牛的血液中同时存在有两种不同血型抗原的红细胞,成为血型镶嵌体(chimeras)。这种小牛不但允许抗原不同的血细胞在体内长期存在,不产生相应抗体,而且还能接受双胞胎另一小牛的皮肤移植而不产生排斥反应。但是不能接受其他无关个体的皮肤移植。Owen称这一现象为天然耐受。Burnet等人认为异卵双生牛体内,对异型血细胞的耐受现象的产生是由于胚胎期免疫功能尚未成熟,异型血细胞进入胚胎牛体内,能引起对异型细胞产生抗体的免疫细胞克隆受抑制或被消灭,故此小牛出生后对胚胎期接触过的异型红细胞抗原不会发生免疫应答。根据这个理论,不少人进行了诱导实验性耐受工作。
二、实验诱导的耐受性
1953后Medawar等将CBA系黑鼠的淋巴细胞接种入A系白鼠的胚胎内,待A系白鼠出生8周后,将CBA黑鼠的皮肤植至该A系白鼠体上,可存活不被排斥。这一实验证实了胚胎期接触抗原物质,出生后对该抗原就有特异的免疫耐受现象。这一发现使人们对于耐受机制的认识有了重大的突破,提示胚胎期接触抗原将导致耐受。其后又证明在成年动物也可引起免疫耐受性,但较胚胎期困难的多。
第二节 影响免疫耐受形成的因素
抗原性物质进入机体后,有时导致正相免疫应答,有时导致免疫耐受或负相免疫应答。这两种不同免疫应答的出现,取决于诸多因素的影响,而主要与抗原物质及机体两方面的因素有关。
一、抗原方面的因素
(一)抗原的性质
耐受原仅是一个功能性定义,有许多因素可影响某抗原使之成为免疫原或耐受原。例如牛或人的丙种球蛋白(BGG、HGG)呈大分子聚合状态时具免疫原性,而分子较小的非聚合单体则是良好的耐受原。给动物注射这种耐受原后,对以后再注入的聚合丙种球蛋白表现为无应答。一般来说分子量小的抗原其免疫原性差,导致耐受能力强,并随分子量大小而递减或递增。例如多聚鞭毛素(分子量104KD)、单体鞭毛素(分子量40KD)及由单体鞭毛素提取的成分A(分子量18kD)三者的免疫原性依次递减,而致耐受原性则依次递增。
此外,可溶性抗原常为致耐原,而颗粒性抗原则易于引起正相免疫应答。易被吞噬细胞迅速摄取的抗原常诱发免疫应答,而缓慢或不易被吞噬细胞摄取的抗原则多为致耐原。抗原表位密度高,即抗原分子表面具有许多相同重复的抗原决定簇者,其致耐原强。
(二)抗原的剂量
足以诱导耐受的抗原剂量随抗原种类、动物的种属、品系及年龄、且参与效应细胞类型等的不同而有所差异。一般来说,抗原剂量越大所诱导的耐受越完全和持久。
Mitchison在1964年首先报告高、低带耐受性(high-zone,low-xone tolerance)现象。当他给小鼠注射低剂量(10-8M)与高剂量(10-5M)牛血清白蛋白(BSA)后,动物出现耐受。而中等剂量(10-7M)BSA引起良好的免疫应答。
T、B细胞产生耐受所需抗原剂量明显不同。T细胞所需抗原量较B细胞要小100-10000倍,而且发生快(24小时内达高峰),持续长(数月)。而B细胞形成耐受不但需要抗原量大,且发生缓慢(1-2周),持续时间短(数周)(表13-2)。
表13-2 低带与高带耐受主要特征比较
| 低带耐受 | 高带耐受 | |
| 参与细胞 | T细胞 | T、B细胞 |
| 产生速度 | 快 | 慢 |
| 持续时间 | 长 | 短 |
| 抗原 | TD | 任何抗原 |
Waigle研究指出,小剂量抗原引起T细胞耐受,而大剂量抗原则引起T细胞和B细胞都耐受。
致耐受所需抗原量与个体的年龄有关,即随年龄相应增大。与抗原的类别亦有关,即强免疫原性抗原大量注入时能引起耐受,继续注入大量抗原使耐受性增强;胸腺非依赖抗原高剂量易致耐受,胸腺依赖抗原用高、低剂量均可引起耐受。
(三)抗原注射途径
一般来说,抗原经静脉注射最易诱导耐受性,腹腔注射次之,皮下及肌肉注射最难。但不同的部位静脉注射引起后果可各异。HGG经颈静脉注入引起免疫,肠系膜静脉注入引起耐受;IgG或白蛋白注入静脉能致耐受,注入周围静脉则引起免疫应答。有些半抗原经皮内注射能诱导抗体生成及迟发型变态反应,但通过口服则发生耐受性。
通过肠系膜及门静脉注射易于致耐受的原因可能是由于肝起着生物学过滤的作用,将抗原解聚,聚合抗原被肝内枯否细胞吞噬降解,从而除去了免疫原性强的抗原部分,剩下非聚合抗原进入外周血流或淋巴道。
二、机体因素
(一)年龄因素
年龄与耐受易感程度密切相关。Owen与Billingham等人的资料表明胚胎期与新生期的免疫系统接触抗原(不论是天然或人工的)后,极易导致终生或长期的耐受性。其后,许多实验证实这一现象的普遍性。这主要与免疫系统发育未成熟有关,体外实验证明未成熟细胞大30倍以上。成年机体一般亦不易诱导耐受,常须联合应用其他免疫抑制措施,以加速其诱导过程。
(二)遗传因素
小鼠免疫耐受及维持的难易程度随品系不同而异。自身免疫病好发鼠(NZB×NAW)F1品系难于诱导耐受,所诱导出的耐受性维持时间短。所有自发产生类似人类系统性红斑狼疮(SLE)品系小鼠不易用半抗原或非聚合的免疫球蛋白诱发耐受。
(三)免疫抑制的联合应用
前已提及,单独使用抗原一般不易对成年机体诱发耐受性,而常需要与各种免疫抑制措施联合应用。常用的有效方法是全身淋巴组织照射,应用抗淋巴细胞血清(anti-lym-phocyte serum,ALS),抗TH细胞抗体(人抗CD4、小鼠抗L3T4),环磷酰胺,环孢素A,糖类皮质激素等免疫抑制药物。
上述现象不仅已被许多实验所证明,而且在器官移植临床工作中已被证实是延长移植物存活的有效措施,认为是常规防止移植物排斥的方法。
单纯免疫抑制药物并不能诱导出抗原特异性的免疫耐受。这些药物必须与抗原联合应用,在免疫耐受形成过程中起促进作用,降低耐受原剂量,阻断抗原刺激后免疫活性细胞的分化。
例如环磷酰对抗原诱导免疫耐受有促进作用。现已证明,环磷酰胺同时作用于T及B细胞。它参与免疫耐受诱导的机制可能与其阻止B细胞表面免疫蛋白受体的再生有关。
又如全身淋巴组织照射时用铅板遮蔽骨髓、肺及其他生命重要的非淋巴器官,因此剂量即使高达40戈瑞(Cy)亦无副反应。这种处理可使机体胸腺及二级淋巴器官中已成熟的淋巴细胞受到破坏,造成类似新生期的状态。此时胸腺和二级淋巴器官中未成熟的淋巴细胞可重新形成集落,细胞表面虽有抗原受体表达但尚未发育成熟。因此,全身淋巴组织照射后能用多种抗原诱导出持久的免疫耐受,如输注同种异体骨髓能建立起同种骨髓嵌合体且不发生移植物抗宿主病。这种情况下,耐受性的维持与体内产生特异性的抑制细胞有关,称为天然抑制细胞。这种细胞见于新生及照射过的动物脾内,它们不具有通常T细胞表面标志,表型类似NK细胞,但对NK细胞敏感的靶细胞并无杀伤作用。
第三节 免疫耐受的维持和终止
一、影响免疫耐受持续时间的因素
(一)抗原因素
抗原的持续存在是维持机体免疫耐受性的必要因素。因免疫系统中不断有新的免疫活性细胞产生,持续存在的抗原可使新生的免疫细胞不断耐受。一旦体内的抗原消失,则已建立起来的免疫耐受可使耐受性也逐渐消退,对特异抗原可重新出现免疫应答。
多次重复注射耐受原可使耐受状态延长,持续时间长短与使用抗原次数有关。
抗原的性质与耐受性维持时间也有关。一些有生命的耐受原,如活的淋巴细胞、病毒等能在体内繁殖,此种抗原在体内持续时间长,因而诱导的耐受性亦不易消退。在一些无生命的抗原中,分解缓慢的抗原较分解迅速的抗原所诱导的耐受性持续时间长。如D氨基酸多聚体在体内分解缓慢,只需一次性注射就诱导出长达一年的耐受状态。
(二)机体因素
免疫系统处于未成熟状态时,如胎儿、新生期、经适当的免疫制措施后,所诱导的免疫耐受性维持时间长。
二、免疫耐受的终止
(一)自发终止
已建立了耐受性的个体如无抗原的再度刺激,免疫耐受性随着体内抗原被清除而自行消退,重新出现对特异抗原的免疫应答,此即为免疫耐受性的自发终止。
(二)特异终止
使用各种模拟抗原物质,可特异地破坏已建立的耐受性。
1.注射化学结构改变的耐受原如通过理化及生物因素使抗原结构改变。
2.注射置换载体的新抗原将耐受原的半抗原部分连接到另一载体上,形成新抗原。例如,事先以BSA-DNP诱发家兔产生耐受性,将DNP连接至HAS上,若将其注射至耐受家兔,可使其再度出现抗DNP抗体,即原有的特性免疫耐受性终止。
3.注射与耐受原有交叉反应的抗原具有共同抗原决定簇的各种抗原物质能够诱导交叉反应。人体对自身抗原有免疫耐受性,接受交叉抗原刺激后,可能导致自身耐受性的终止,而出现自身免疫性。
第四节 免疫耐受的机制
1975年著名免疫学家Burnet提出克隆选择学说,并以克隆清除(clonaldeletion)学说解释免疫耐受现象。他的观点曾对免疫学的发展产生深远影响。随着近代基础免疫学,尤其是免疫调节研究的迅速发展,当前对免疫耐受机制的认识已远远超越了这一学说当时的涵义。它的发生涉及到免疫应答过程中任何一个正、负调节系统。下述几种重要观点,其各自均有相应的实验证据。
一、克隆清除
Burnet的克隆选择学说提出体内约存在着102-107具有免疫活性的细胞克隆,每一克隆细胞都具有其特异的、能与其相应抗原决定簇起反应的受体。但处于未成熟阶段的T、B反应细胞系因接触抗原而被清除,则造成免疫耐受。现知大量未成熟自身反应性T细胞在胸腺内因接触相应的自身抗原后,发生程序性死亡而被清除,这是维持自身耐受最有效的机制。
克隆清除学说强调了免疫耐受诱导过程的中枢衰竭机制。这一学说尚不能解释许多客观存在的现象:①已建立的耐受性可以、甚至易于被破坏,即对原先的耐受原重新出现免疫应答;②给已建立耐受性的动物输注同品系正常动物的淋巴细胞(含反应克隆)并不能使动物恢复对耐受原的免疫应答;③将已建立耐受动物的淋巴细胞转移到同品系正常动物体内,能使其产生对相同抗原的耐受性;④成年机体对大多数自身抗原虽呈免疫耐受,但业已发现成年机体内可检测到对自身抗原起反应的T和B细胞克隆的存在。
以上事实提示,在免疫耐受,尤其是获得性免疫耐受的机体内,自身反应细胞克隆并未被彻底清除,而是处于功能受抑或无能状态(clonalanergy)。凡是细胞表面抗原受体被封闭,抗原不能与细胞表面受体结合,缺少T细胞或巨噬细胞的辅助作用,以及T细胞与巨噬细胞主动抑制作用,抗独特型网络的主动抑制等都可能参与耐受的诱导过程。导致反应细胞克隆的不应答,而不能发生正相免疫应答。
二、克隆不应答
(一)免疫活性细胞缺乏激活信号
现已知T细胞必须的激活信号至少包括:①由特异抗原与自身MHCⅠ类或Ⅱ类抗原的复合物激发的信号;②由协同刺激因子(costimulator)激发的信号。缺乏足够的激活信号则导致免疫不应答。目前认为,一些针对胸腺内不表达的自身抗原(如器官特异抗原)的自身反应性T细胞克隆存在于正常机体,但因带有这些自身抗原的细胞表面通常有具有MHCⅡ类抗原,因此不能激活相应T细胞克隆。
(二)免疫活性细胞激活受阻
1.免疫活性细胞表面抗原受体被封闭则可产生不应答。适量双价或多价抗原与免疫活性细胞表面抗原受体结合,受体聚集成帽状,使细胞活化而产生免疫应答(图13-1B)。而单价抗原(monomeric antigen)与免疫活性细胞表面抗原各个受体结合(图13-1A),抗原占据整个细胞的表面受体,对受体起封闭作用,则不能激活免疫细胞。如分子表面有许多相同重复决定簇的非胸腺依赖抗原在体内不易被分解,能与B细胞表面的抗原受体呈牢固、广泛交联,可使受体封闭。高剂量多价抗原使细胞表面抗原受体广泛交联,使液态镶嵌的细胞膜不能流动,膜受体呈“冻结”状态,细胞不被活化(图13-1C)。
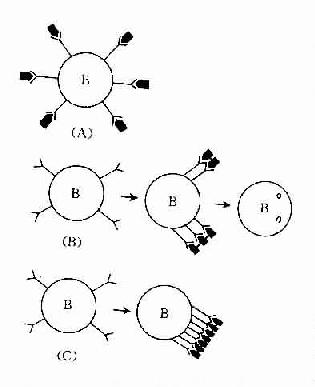
图13-1 B细胞表面抗原受体的封闭
(A)单价抗原占据B细胞表面抗原受体;
(B)适量双价抗原使B细胞表面受体交联成帽状,内吞;
(C)大量 多价抗原使B细胞表面受体交联“冻结”
2.抗原不能抵达免疫活性细胞表面有时机体在初次接触抗原后,产生抗体过剩,抗体与再次进入的抗原在体液中结合,使抗原不能到达细胞表面受体上,因而也可造成免疫无反应性。
(三)缺乏辅助细胞
胸腺依赖抗原(自然界大多数抗原均属此类)激发免疫应答均需TH细胞巨噬细胞的参与,若缺乏辅助细胞,免疫活性细胞单独不能作出有效应答。
1.缺乏辅助性T细胞(TH) 前已述及T/B细胞对同一抗原产生耐受性时,表现不同的特征。小剂量抗原便足以使T细胞产生耐受,此时B细胞虽未产生耐受,但因失去T细胞的辅助而不能活化,但是T细胞的耐受性维持时间大大超过B细胞(如图13-2所示)。B细胞虽恢复免疫应答,但T细胞仍处于耐受状态,因而出现T、B反应性呈分离状态的区域(表13-3)。这时,B细胞仍缺乏必要的T细胞辅助而不能产生有效的免疫应答。
图13-2 T、B 细胞发生耐受的不同特征
2.缺乏巨噬细胞辅助巨噬细胞在免疫应答形成中,起着重要的摄取抗原、加工和呈递抗原的作用,从而参与了特异性免疫应答。所以巨噬细胞的功能缺陷也是耐受诱导的重要的原因。
表13-3 T细胞与B细胞耐受特征
| T细胞 | B细胞 | |
| 克隆清除 | 蛋白质抗原胸腺内诱导 机制:不成熟T细胞与抗原高亲和力结合导致和序性细胞死亡(PCD) |
蛋白质抗原及非蛋白质抗原导部位骨髓或周围尚不肯定 机制、:程序性细胞死亡(PCD) |
| 克降不应答 | APC缺乏协同刺激因子 | 多价抗原与不成熟B细胞结合 |
| 抗原性质 | 可溶性蛋白质静脉或口服无佐剂参与 | 大剂量多糖类抗原多聚蛋白质抗原(重复表位)无TH参与 |
| 耐受期限 | 期限长 | 期限短 |
| 抗原耐受剂量 | 剂量低 | 剂量高 |
三、抑制细胞的作用
(一)TS细胞的作用
70年代Gershon等首先提出TS细胞的现象。将耐受动物的脾或胸腺细胞转输给同品系正常动物后,使后者获得耐受性,又称为传染性耐受(infectious tolerance)。如果在转输前将脾细胞用抗Thy-1血清加补体处理,去除T细胞,则受体动物不会发生过继性耐受。
TS细胞的作用通常是抗原特异性的,它可能是通过阻止抗原呈递,阻断TH细胞的功能。抑制B细胞分化以及阻断B细胞分化为抗体分泌细胞等环节发挥作用。
(二)自然抑制细胞的作用
自然抑制(natural suppressor,NS)细胞主要抑制T细胞参与的免疫应答,无抗原特异性。这些细胞可能在新生与成年动物的耐受诱导中均起作用。NS细胞形态上为大颗粒淋巴细胞(large granularlymphocytes,LGL),见于胚胎及新生期、出生后数天内消失,抗原不能诱导,表面无T、B细胞特有的标志、对B细胞无抑制作用,成年动物照射后,先是NS细胞的再现,照射后短期内导入抗原,继之便出现TS细胞。照射促使骨髓移植物存活,可能与此种机制有关。抑制功能:混合淋巴细胞反应、TC细胞生成GVH反应。
(三)巨噬细胞的抑制作用
已有文现献报告抑制性单核-巨噬细胞亚群的存在。其抑制作用可能是由花生四烯酸代谢产物所介导。因阿司匹林和消炎痛能逆抑制作用。我国学者发现耐受动物的腹腔巨噬细胞有抑制同系正常动物混合淋巴细胞反应的作用,此作用并有抗原特异性。在对照组中,正常动物的巨噬细胞却能增强抗原特异性的混合淋巴细胞反应。
(四)抗独特型网络的作用
每个T、B细胞克隆均具有其独特型。B细胞表面及分泌的免疫蛋白超变区抗原结合部位是独特型的物质基础。免疫球蛋白独特型结构本身具抗原性,被相应细胞克隆识别而产生抗独特型抗体可进一步诱导抗-抗独特型第一系列连锁反应。对免疫应答起“自限”作用。T、B细胞参与的免疫应答均受独特特型网络的调节。有人报道给新生鼠注射抗特型抗体导致长期独型耐受,而对成年动物注射抗独特型抗体,可引起短暂的独特型耐受。
抗独特抗体所引起的耐受性,仅针对抗体的独特型部分,机体对抗原其他决定簇的免疫应答依然存在。
第五节 免疫耐受的临床意义
首先,免疫耐受的诱导、维持和破坏影响着许多临床疾病的发生、发展和转归。人们企图诱导和维持免疫耐受性来防治超敏性疾病、自身免疫性疾病以及移植物的排斥反应。某些感染性疾病以及肿瘤生长过程中,设法解除免疫耐受、激发免疫应答将有利于对病原体的清除及肿瘤的控制。
根据免疫耐受发生机制的多样性,对Ⅰ型变态反应患者诱导免疫耐受的可能途径是通过B克隆清除或主动抑制。处理的方法有注射表面高密度多聚耐受原、变性蛋白抗原或脱敏疗法等。
自身免疫病的发生至今认为主要与自身耐受的破坏有关,去除导致耐受破坏的因素,当然有利于对自身免疫病的防治。
现代医学虽然已将古人幻想的器官移植变为现实,但同种异体免疫排斥现象仍是器官移植中主要存在的问题。免疫抑制疗法上的进步有利于延长移植物存活,但非特异抑制所带来的副作用仍有待解决。若能将特异抑制(免疫耐受)成功地应用于临应,收到较好的效果,无疑是在此领域中的重大突破。
在麻风及慢性粘膜皮肤念珠菌病患者中,若体内出现良好的细胞免疫应答,虽抗体生成低下或甚至缺如,临床预后仍良好,并常伴随有效的防御性免疫。反之,如细胞免疫水平低下,抗体效价虽高,而预后较差,多呈进行性感染。这种分离耐受现象对感染性疾病的预后有重要影响。乙型肝炎病毒携带者伴有极轻微的肝炎病变,可能与新生期发生感染而使机体对病毒产生部分耐受性有关。
在对肿瘤患者的免疫治疗中,解除患者的免疫耐受状态也是一项有意义的措施。近年,美国两家实验室报导将一种协同刺激因子B7的基因转染黑色素瘤细胞,并用这种转染细胞进行防治黑色素瘤的实验性研究,获得可喜的成功。为这一领域的研究开阔了新的途径。
第十四章 免疫应答(四):免疫调节
免疫应答作为一种生理功能,无论是对自身成分的耐受现象,还是对“非已”抗原的排斥都是机体的免疫调节机制的控制下进行的。免疫调节机制是维持机体内环境稳定的关键,如果免疫调节功能异常,对自身成分产生强烈的免疫攻击,造成细胞破坏,功能丧失,就会发生自身免疫病。如果对外界病原微生物感染不能产生适度的反应(反应过低可造严重感染,反应过强则发生过敏反应),也可造成对机体的有害作用。因此,免疫调节机制不仅决定了免疫应答的发生,而且也决定了反应的强弱。这一调节作用是精细的、复杂的。调节功能是作用于免疫应答过程中的多个环节。
第一节 免疫系统的调节
一、抗原的调节作用
免疫应答的发生是由抗原刺激免疫系统的细胞开始的。抗原的存在是应答发生的前提,但是抗原在体内可被分解代谢,而浓度逐渐降低,抗体产生也不断下降。已有实验证明,在免疫应答过程中,由于注射大量抗体,清除了抗原,导致抗体分泌细胞数量减少,抗体合成也明显下降。
二、抗体的调节作用
(一)抗体的反馈调节作用
抗体对免疫应答也有反馈调节作用。抗体是免疫应答的产物,抗体产生之后又可抑制其后的抗体产生。将抗体注入非免疫的机体,可阻止其后注入抗原引起的免疫应答,这一现象在临床上应用成功地预防了新生儿溶血性疾病的发生。该疾病是因母子间RH血型不符引起的。应用抗Rh因子抗体给分娩Rh+胎儿的Rh-产妇注射,由于分娩过程中进入母体Rh抗原被注入的Rh抗体所清除,因而抑制了Rh母亲进一步产生抗体,也就防止了因Rh抗体(IgG)通过胎盘使下次妊娠的Rh+胎儿产生溶血症。
免疫应答过程中用血浆交换法去除循环血中的抗体,使血液中的抗体浓度不断降低,可促使抗体产生增加。注射IgG抗体可明显促使抗体形成细胞数量下降,可反馈控制抗体过度合成,这可能是由于抗体结合抗原后降低抗原的刺激作用。
(二)抗原抗体复合物的调节作用
抗原抗体复合物也有调节免疫应答的作用。免疫复合物抗原可与B细胞表面的抗原受体结合,复合物中的抗体可与B细胞表面的Fc受体结合,当B细胞表面的抗原受体的Fc受体因抗原抗体复合物的作用而发生交联时,就可产生抑制信号,可抑制B细胞分化为抗体形成细胞。但当抗原量多,抗体量少时形成的复合物可与抗原呈递细胞(APC)表面的Fc受体结合,则可增强抗原呈递细胞的功能,进而增强B细胞产生抗体的反应。所以免疫复合物的调节作用在反应初期由于抗原量大,多表现为增强反应,而到后期由于抗体量增多可中和抗原而起抑制作用。此外,抗体类别不同,作用也不同,在反应初期,当IgM产生多时,形成的复合物有增强作用,而后期IgG多时,则起抑制作用(图14-2)
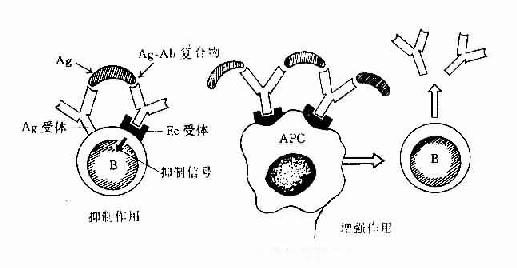
图14-1 免疫复合物的免疫调节作用
三、免疫细胞的调节作用
T细胞和单核-巨噬细胞既是免疫应答的效应细胞,也参予免疫应答的调节。
(一)TH细胞的调节作用
抗原刺激在机体内发生的体液免疫或细胞免疫都是由抗原呈递细胞和T辅助细胞(TH)的相互作用开始的。TH细胞因分泌细胞因子种类不同而分成TH1和TH2两类,诱发体液免疫作用的是TH2,诱发细胞免疫起辅助作用的是TH1。
TH1和TH2还可通过各自分泌的细胞因子相互制约。TH1细胞主要产生IL-2和IFN-r,后者可抑制TH2增殖和功能,而TH2产生IL-4、IL-5和IL-10,特别是IL-10是个重要的免疫抑制因子,它可抑制TH1分泌IL-2和IFN-r,抑制MHCⅡ类分子的表达。并可抑制Mф产生IL-1、IL-6等。
(二)TS细胞的调节作用
在免疫应答过程中,经辅助性诱导T细胞(CD4+T)的作用可活化抑制性T细胞(TS),使之分化成为效应TS细胞。它可分泌抗原特异及非特异抑制因子,可抑制杀伤性T细胞(TC)、辅助性T细胞(TH)及B细胞的功能,发挥负反馈调节作用。如此,当外来抗原侵入机体后经APC活化TH细胞以后启动正免疫应答,产生效应分子和(或)效应细胞以清除外来抗原。与此同时在免疫应答后期可启动TS细胞使之活化及分化发育为效应TS细胞,以抑制免疫应答,籍以维持机体的免疫稳定平衡。
(三)TC(CTL)细胞的调节作用
T细胞抑制免疫应答也可通TC的作用,因为TC可针对T或B细胞表面TCR或BCR可变区的独特型决定基而起特异杀伤作用。由于TC细胞杀伤T或B细胞而引起免疫抑制作用。
四、独特型网络调节
(一)免疫网络学说的提出
这一学说是Jerne(1972)根据现代免疫学对抗体分子独特型的认识而提出的。这一学说认为在抗原刺激发生之前,机体处于一种相对的免疫稳定状态,当抗原进入机体后打破了这种平衡,导致了特异抗体分子的产生,当达到一定量时将引起抗Ig分子独特型的免疫应答,即抗抗体的产生。因此抗体分子在识别抗原的同时,也能被其它抗体分子所识别。这一点无论对血流中的抗体分子或是存在于淋巴细胞表面作为抗原受体的Ig分子都是一样的。在同一动物体内一组抗体分子亦可被另一组淋巴细胞表面抗独特型抗体分子所识别。而一组淋巴细胞表面抗原受体分子亦可被另一组淋巴细胞表面抗独特型抗体分子所识别。这样在体内应形成了淋巴细胞与抗体分子所组成的网络结构。网络学说认为,这种抗抗体的产生在免疫应答的调节中起着重要作用。使受抗原刺激增殖的克隆受到抑制,而不至于无休止地进行增殖。籍以维持免疫应答的稳定平衡。
(二)独特型网络的细胞
独特型决定簇存在于Ig的V区,也可存在于各类T细胞及B细胞的抗原识别受体的V区。因此在体内形成由独特型(idiotype,Id)和抗独特型(antiId)组成的免疫网络。
就淋巴细胞来说,构成这种网络结构的淋巴细胞有四种类型。当抗原进入机体后可与相应的抗原反应细胞相结合,进行增殖、分化并产生抗体分子。这种抗原反应细胞可与另外三种淋巴细胞构成网络。一组是独特型反应细胞,即抗独特型淋巴细胞组,能识别抗原受体的独特型,具有抑制抗原反应淋巴细胞的作用,另一组能增强抗原反应淋巴细胞的作用,它的受体带有与抗原构型相同的独特型,因此也能被抗原反应细胞所识别,Jerne称此组淋巴细胞为内影像组。内影像概念是免疫网络理论的重要组成部分。第三组淋巴细胞为非特异平行组,其抗原识别受体与抗原反应细胞不同,但独特型却与之相同,本组细胞可促进独特型细胞的活性,可加强对网络的抑制作用。同样这三组淋巴细胞也各自通过其独特型的联系和其它淋巴细胞也形成网络,如此不断扩展。所以机体对某一特定抗原应答不只表现为抗原反应细胞的应答,而是通过独特型联结起来的一个庞大的免疫网络整体反应,它们通过连续不断的识别过程,产生促进或抑制作用,以维持机体免疫应答的相对稳定状态(图14-2)。
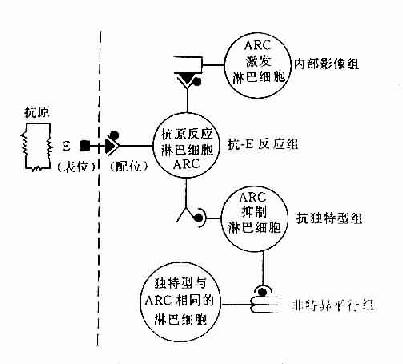
图14-2 免疫网络学说
(三)独特型网络理论的应用意义
独特型理论为人工调控免疫应答提供新的思路,特别是处于超敏状态下如过敏症、自身免疫病和器官移植时,已有利用抗Id抗体的抑制作用进行实验治疗成功的报导。例如用B大鼠的移植抗原注射A大鼠,自A品系大鼠获得抗体,用此抗体对A大鼠进行免疫产生抗Id抗体就可抑制由T细胞介导的对B移植抗原的排斥反应。这可能因为抗-Id反应灭活了引起排斥反应的淋巴细胞,也就是抗-Id封闭了B细胞受体上的Id。另外一种完全不同的方法是应用抗原内影像的抗-Id刺激抗原特异T抑制细胞活化,能阻断对同一抗原上对其他抗原决定簇起反应的B细胞活化,这也就是抗原本身的桥梁作用。
某些情况下也可应用抗原内影像即抗-Id代替抗原刺激产生抗体(图14-3)。这种情况用于抗原数量少,难以获得时,如某些寄生虫抗原、某些癌相关的胚胎抗原、用化学合成方法得到的抗原或用基因克隆法得到的重组抗原难以折叠成天然分子构型的蛋白质抗原,选择有抗原表位(epiope)构型的抗-Id代替抗原进行免疫以克服抗原不足的困难。
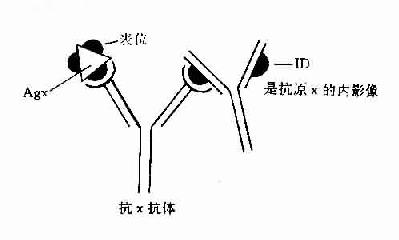
图14-3 内影像图解
第二节 遗传对免疫应答的调节
一、高应答品系与低应品系的产生
小鼠可选择性的培育出产生高或低抗体应答的品系,经过几代培养,一些品系可以稳定的对多种抗原产生高滴度抗体,而另一些品系则可稳定的产生低水平的抗体(图14-4)。
经研究证明上述高或低应答小鼠,至少有10个基因座和这种反应高低有关,其中主要是影响Mф特性基因,观察Mф从血液中清除碳颗粒或吞噬SRBC的能力来比较两品系小鼠Mф功能的不同,发现高应答品系小鼠的Mф功能活性好,有较多的细胞表面经处理过的抗原,而低应答品系小鼠的Mф相反。
图14-4 高或低应答品系小鼠培养过程
用SRBC免疫一组小鼠,SRBC是多决定簇抗原。图中每支小鼠的抗体滴度由圆圈表示,
选出Ab滴度最高的雌雄交配繁育后代。用抗原再免疫,同样再选出滴度最高的一对繁育后代。经过20代后,所有后代均是对SRBC产生高滴度抗体,同时对其他多种抗原也是高抗体应答,同样方法也可选育出低应答品系小鼠
二、MHC(Ir基因)对免疫应答的影响
已发现对多种简单的TD抗原的应答能力是由MHC的基因决定的。例如H-2b单体型(haplotype)小鼠对合成多肽抗原(T,G)-A-L反应很好,而H-2k小鼠则反应很差,产生抗体很少。H-2b单体型小鼠(具有特殊H-2基因)对(T,G)-A-L抗原是高应答小鼠,因为它们具有适宜Ir基因。对另一种合成抗原(G,G)-A-L,是用组氨酸(H)代替了酪氨酸(T),反应情况则完全相反,原来对(T,G)-A-L反应差的对(H,G)-A-L反应很好,说明各种不同系小鼠应答能力高低不但与Ir基因结构有关,也与抗原构造有关(表14-1)。
表14-1 H-2单倍型对合成多肽抗原的应答
| 抗原 | H-2单倍型 | ||||
| B | K | D | A | S | |
| (T,G)-A-L | 高 | 低 | 中 | 低 | 低 |
| (H,G)-A-L | 低 | 高 | 中 | 高 | 低 |
这种H-2单倍型与应答能力高低之间的关系仅仅是用结构明确、构造简单的抗原进行研究的结果。因为对这些简单抗原决定簇的应答是由Ir基因控制的。
三、Ir基因控制T-B细胞间的协作
用几种基因重组小鼠品系研究对简单合成抗原的应答,见有14-2。
表14-2 不同品系小鼠Ir基因与免疫应答的关系
| 小鼠品系 | H-2区 | 对(H,G)-A-L | ||||
| K | IA | I-E | S | D | 应答 | |
| A | k | k | k | b | b | 高 |
| A.TL | s | k | k | k | b | 高 |
| B.10.A(4R) | k | k | b | b | b | 高 |
| B.10 | B | b | b | b | b | 低 |
| A.SW | s | s | s | s | s | 低 |
表中三个高反应品系小鼠具有相同的I-AK和H-2Db,而B.10小鼠只有H-2Db,它是低反应的。所以高反应必然与I-Ak有关系。由於小鼠的I-A亚区基因的点突变,导致基因编码的MHCⅡ类分子改变(也就是影响Ⅱ类分子多形特异部位)从而改变小鼠从高应答变成低应答状态。I-A亚区基因点突变也大大降低了T细胞增殖能力。抗原特异T细胞增殖能力与宿主应答状态有密切关系,即高应答动物的T细胞增殖能力也强,反之则弱。
第三节 神经内分泌免疫网络调节
一、神经内泌对免疫系统的调节
已证明免疫细胞上有接受神经递质和激素刺激的受体,可以说几乎所有的免疫细胞上都有不同的神经递质及内分泌激素的受体。这些内分泌激素和神经递质都具有免疫调节功能,如肾上肾上腺皮质激素,它是最早发现的具有调节免疫功能的激素,它几乎对所有的通过免疫细胞都的抑制作用,包括淋巴细胞、巨噬细胞、中性粒细胞和肥大细胞。刺激下丘脑可通过促肾上腺皮质激素释放因子(CRF)引起垂体释放ACTH,通过血液循ACTH可促进肾上腺皮质释放糖皮质激素,因而形成下丘脑-垂体-肾上腺轴。各种应激刺激可以使血中肾上腺皮质激素含量增高,所以由应激引起免疫抑制与这类激素的作用有密切关系。除此之外还存非垂体-肾上腺轴的免疫调节作用,这包括生长激素、生乳素和阿片肽等的作用。其中已证明生长激素和生乳素对多种免疫细胞有促分化和增强功能的作用,而阿片肽对免疫细胞影响增强和抑制的报导均有,作用复杂,有待深入研究。
二、免疫系统对神经内泌系统的调节作用
免疫系统可以通过多种途径影响神经内分泌功能。免疫细胞本身可以产生和释放内分泌激素,也可以通过它们所产生的细胞因子作用于神经内分泌及全身各器官系统。
(一)免疫细胞产生的内分泌激素
1980年Blalocd等证明人白细胞干扰素中有ACTH和r-内啡肽的活性片段。他们用胃蛋白酶消化人白细胞干扰素,可得到具有ACTH活性的小分子片段。经受体分析也证明,人IFN-α能与与3H双氢吗啡竞争受体,且比吗啡强300倍以上。他们用抗ACTH和r-内啡肽的荧光抗体染色,发现人外周血淋巴几乎100%呈现阳性。这些结果说明免疫细胞可以产生某些内分泌激素。此外,Zurawski在小鼠T辅助细胞株中找到啡肽前体的mRNA(preproenkephalin mRNA)在cDNA文中可达0.4%。以ConA)刺激T辅助细胞后清液中可以测到脑啡肽样免疫活性物质。这一发现从基因表达证明小鼠TH细胞可以合成和释放脑啡肽。目前已发现免疫细胞合成的神经递质和激素达10余种(表14-3)。
表14-3 免疫细胞产生的神经内分泌肽
| 名称 | 产生细胞 | 名称 | 产生细胞 |
| ACTH | 淋巴细胞和巨噬细胞性 | 生长抑制素 | 单核细胞、肥大细胞、多形核白细胞 |
| 内啡肽 | 淋巴细胞、巨噬细胞 | 脑啡肽 | 辅助性T细胞 |
| 生长激素 | 淋巴细胞 | 精氨酸升压素(AVP) | 胸腺上皮细胞 |
| 生乳素 | 淋巴细胞 | 催产素 | 胸腺上皮细胞 |
| 绒毛膜促性腺素 | T细胞 | 神经垂体激素运载蛋白 | |
| 血管活性肠肽(VIP) | 单核细胞、肥大细胞、多形核白细胞 | TSH | 胸腺上皮细胞、T细胞 |
(二)免疫细胞产生的细胞因子对神经内分泌系统的作用
免疫细胞产生的淋巴因子和单核因子除对自身活动进行调节外,还可作用到神经内分泌系统,从而影响全身系统的功能活动,其中报导较多的有IL-1、IL-2及干扰素等。
IL-1可刺激下丘脑使体温升高,故又称为内源性致热原。神经系统内星形胶质细胞和小胶质细胞也可产生IL-1,在神经细胞发育和修复中发挥作用。IL-1还可引起慢波睡眠,在外周,它可抑制食欲。机体在对抗原刺激发生反应高峰阶段,血液中糖皮质激素增加而出现抑制免疫的作用。这可能由于IL-1作用于垂体,通过ACTH促使肾上腺皮质激水平升高引起的。
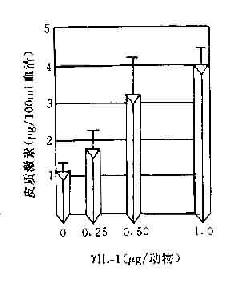
图14-5 由于IL-1和淋巴因子产生使糖皮质激素含量增加而产生免疫抑制
第三篇 免疫病理
第十五章 超敏反应
若机体已被某抗原致敏,当再次接触相同抗原时则二次免疫应答被增强.在摄入的抗原较大或机体的免疫处于高应答状态时,则因免疫应答而导致组织损伤,此即称为超敏反应(hypersensitivity)。1963年Coombs和Gell根据反应发生的速度、发病机制和临床特征将超敏反应分为Ⅰ、Ⅱ、Ⅲ和Ⅳ型。Ⅰ~Ⅲ型由抗体介导,可经血清被动转移。而Ⅳ型由T细胞介导,可经细胞被动转移,反应发生较慢,故称迟发型超敏反应。有人提出第Ⅴ和Ⅵ型,但未获公认,故本章只介绍Ⅰ~Ⅵ型超敏反应重点。
第一节 Ⅰ型超敏反应
一、概念
Ⅰ型超敏反应在四型超敏反应中发生速度最快,一般在第二次接触抗原后数分钟内出现反应,故称速发型超敏反应(immediate hypersensitivity)或变态反应(allergy)。Von Pirquet提出变态反应一词,意指机体第二次接触相同抗原后所出现的改变了的反应。Richet和Portie将因多次注射动物抗血清所引起的异常反应称为过敏症(anaphylaxis),以示与保护性反应(prophylaxis)相区别。1921年Prausnitz将其好友Kustner对鱼过敏的血清注入自己前臂皮内,一定时间后将鱼提取液注入相同位置,结果注射局部很快出现红晕和风团反应,他们将引起此反应的血清中的因子称为反应素(reagin)。这就是著名的P-K试验,动物被动皮肤过敏试验(passive cutaneous anaphylaxis,PCA)其原理就是P-K试验。目前临床上用于诊断变态反应的皮肤试验也由此衍生而来。1966年ishizaka发现并证明IgE抗体是介导Ⅰ型超敏反应的主要抗体,至此历经45年之久终于揭开了反应素的化学本质。嗣后Ⅰ型超敏反应的发病机制、特异的体外诊断方法和变反原纯化技术等领域均获得蓬勃发展。
(一)变应原
凡经吸入或食入等途径进入体内后能引起IgE类抗体产生并导致变态反应的抗原性物质称为变应原(allergen)。多数天然变应原的分子量为1万~7万道尔顿。分子量过大不能有效地穿过呼吸道和消化道粘膜,而分子量过小难以将肥大细胞和嗜碱性粒细胞膜上两个相邻近IgE抗体及其受体桥联起来,因而不能触发介质的释放。
引起变态反应的重要变应原有吸入性变应原和食物变应原两大类。
1.吸入性变应原广泛存在于大自然界中,预防接触吸入性变应原较难。
(1)种类繁多的植物花粉:花粉产量大,授粉期长,质轻,粒小,致敏花粉多属风媒花粉。花粉的播散具有区域性和季节性特点。在北美豚草(Ragweed)是主要的致敏花粉,我国北方地区秋季主要致敏花粉是野生植物蒿属花粉。
(2)真菌:真菌在自然界中的分布极广,其孢子和菌丝等是重要的变应原。
(3)螨:螨属节肢动物门蜘蛛纲,屋尘螨、粉尘螨和土内欧螨具有相同的抗原性均可引起变态反应。每0.1g被褥尘中含屋尘螨可高达3000个。
(4)上皮变应原:家养狗、猫和兔等的脱落上皮、毛、唾液、尿液等已成为人类尤为儿童的重要变应原。
(5)屋尘:屋尘的成分复杂,它可能含有上皮脱屑、毛、脱落的人上皮、螨、昆虫和蟑螂的碎片及其排泄物、真菌、细菌、花粉、工业品、丝、棉、麻、尼龙、化纤等。
(6)羽毛:衣服、被褥、枕芯、垫料、地毯、壁毯等中的鸡鸭鹅鸽等羽毛也是变应原。有人报道,农牧民、兽医、饲养员、屠宰人员、毛皮革制造业者和科研人员对动物皮毛和排泄物的过敏较常见。
(7)昆虫变应原:飘散在空气中的飞蛾、蜜蜂、甲虫、蟑螂、蚊蝇的鳞片、毫毛,脱屑和排泄物吸入取后可引起致敏,养蚕工人可对蛾毛、蛾尿、蚕丝和蚕尿过敏。
(8)植物变应原:除上述豚草和蒿属花粉外,植物纤维如木棉和除虫菊等吸入后可引起致敏。烟草的致敏作用国内外均有报道。
2.食物变应原常见的过敏性食物有蛋白质含量较高的牛奶和鸡蛋;海产类食物,如无鳞鱼、海蟹、虾、海贝等;蛋白质含量高且不易消化的食物如蛤蟆类、鱿鱼;含有真菌食物,如蘑茹等。因保鲜食品,冷藏食品及人工合成饮料日益增多,因而食物添加剂(染料、香料等),防腐剂,保鲜剂和调味剂就成了一类新的重要变应原。
药物可经口服、注射和吸入等途径进入体内,少数病人用药后出现局部或全身药物过敏反应,如药疹、阿司匹林性哮喘、青霉素过敏性休克等。
(二)Ⅰ型超敏反应性疾病的发病率
欧洲人群中Ⅰ型超敏反应的发病率为25%~35%,瑞典为30%~40%。我国北京地区的发病率高达37.7%。Ⅰ型超敏反应的重要性不仅在于它是一类常见病,多发病,还在于它涉及临床各个学科,特别是儿科、内科、耳鼻咽喉科和皮肤科。随着工农畜牧业的发展,三废的出现,生活环境和生活方式的改变,新的变应原不断出现,石油、橡胶、化纤、塑料、人造革制品、药物和农药所致的变态反应及各种职业性变态反应性疾病日见增多。
(三)Ⅰ型超敏反应的特点
1.发生快,几秒钟至几十分钟内出现症状,消退亦快;为可逆性反应;
2.由结合肥大细胞和嗜碱性粒细胞上的IgE抗体所介导;
3.主要病变在小动脉,毛细血管扩张,通透性增加,平滑肌收缩;
4.有明显个体差异和遗传背景;
5.补体不参与此型反应。
二、IgE合成的调节及其受体
(一)IgE合成的调节
IgE合成受4个因素调节,即遗传因素,接触变应原的机会,抗原的性质和TH细胞及其产生的因子,现分述如下。
1.遗传因素常可见在一个家庭成员中高IgE水平与特应症(atopy)发生之间的相关性,特应症是指一类与遗传密切相关的速发型变态反应,也就是过敏性素质(体质)或对环境中常见抗原产生IgE抗体应答的倾向性,对变态反应性疾病的易感性。与正常人相比,他样血清IgE明显升高,肥大细胞数较多而且胞膜上IgE受体也较多。家系调查表明,特应症由常染色体显性遗传,但同一家系中不同成员所患的特应症可以不同。他们产生高IgE抗体的能力可能与组织相容性复合体Ⅱ类(MHC ClassⅡ)中的某些特殊位点有关。有报道反指出,屋尘螨特异性CD4+T细胞克隆对螨的应答受HLA-DRAB1和HLA-DRAB3基因产物的限制,说明这些基因产物在T细胞识别变应原中具有重要的功能。
2.接触变应原的机会接触变应原的机会是特异性IgE抗体水平高低的重要决定因素。一般而言,反复接触某一些应原才会引起对该变应原的特应性反应。有些过敏性鼻炎或哮喘患者乔迁异地后,由于地理环境的改变,避开了当地固有的植物花粉而使病情减轻。食物引起的过敏反应在婴幼儿较多见,这与婴幼儿胃肠粘膜屏障尚未成熟而使食物蛋白质等易进入体内有关。昆虫可以螫刺、吸入、接触和食入等方式而使人致敏,其中对昆虫毒液的过敏最具有重要性,如蜜蜂、黄蜂在其尾部有毒囊,内含毒液。当蜂类螫刺人体时,毒囊从尾部脱落,排毒管刺入皮肤并将毒液注入人体内。蜂毒液中引起过敏反应的蛋白质毒素主要是磷脂酶A2。而蚊、蚤、蚂蚁、臭虫等通过其唾液管将吃得开液排入人体内而引起荨麻疹、红斑等局部皮肤过敏性反应。
3.抗原的性质以相同途径进入人体的抗原,有的引起强速发型超敏反应,有的则不能,虽其确切原因尚不明,但与抗原本身的特性,特别是被T细胞识别的表位的特性有关。有些药物如青霉素,能引起强烈IgE抗体应答。这些药物与蛋白质结合,形成半抗原(药物)-载体(蛋白质)结合物,而成为新抗原(neoantigens)。
有些蛋白质抗原与有利于IgE抗体合成的具有佐剂作用的物质天然共存,如在同一寄生虫体内可能同时存在抗原和佐剂。又如在接触环境中变应原时有呼吸道病毒感染则对总IgE和特异性IgE抗体的产生起佐剂作用。最近报道,浮游于空气中排放的柴油废气颗粒(diesel exhaust particulates,DEP)直径小于1μm,在城市空气中的浓度可高达2~500μg/m2,DEP对动物产生IgE起佐剂作用。近30年来变态反应性鼻炎和哮喘发病率的增加与空气污染和柴油废气排放增加相平行。
第二次接触抗原的途径与速发型反应的类型可能有关,全身性过敏反应一般与抗原直接进入血循环有关,如昆虫毒液或药物所致的超敏反应;外源性哮喘和花粉症常由于吸入抗原所致;而荨麻疹是食物变态反应的常见表现。
4.TH细胞和细胞因子 IgE抗体的类别转换(isotype switching)取决于TH细胞,说明T细胞非依赖性抗原不能诱发IgE抗体的产生。Okumur和Tada早就证明,B细胞产生IgE抗体需T细胞辅助,但近年由于有了T细胞克隆、重组细胞因子和抗细胞因子抗体故可详细剖析T细胞所起的精确作用。已知鼠和人的TH细胞均可根据分泌细胞因子种类的不同而分成为TH1和TH2两个亚群,TH1细胞分泌IIL-2、IFN-γ和淋巴毒素,但不分泌IL-4、IL-5和IL-6;相反,TH2细胞分泌IL-4、IL-5、IL-6和IL-10,但不分泌IL-2、IFN-γ和淋巴毒素。TH1细胞分泌的细胞因子主要的生物学作用是增强免疫系统的细胞毒活性和介导迟发超敏反应,而TH2细胞分泌的细胞因子主要在抗体形成及变态反应过程中起作用。TH1和TH2之间通过细胞因子而互相调节。1986年以来在鼠和人的体内、体外研究表明,IL-4促进IgE合成,而IFN-γ抑制IL-4所诱导的IgE合成,说明TH1和TH2细胞均调控IgE的合成。IL-4除诱导人和鼠合成IgE外,还能诱导人IgG4和鼠IgG1抗体合成。变应原致敏B细胞合成IgE需IL-4的机制之一是IL-4为B细胞提供了活化信号,因而B细胞由产生IgM转换成产生IgE抗体,所以IL-4是个Ig类转换因子。特应患者可能有较多产生IL-4的变应原特异性T细胞并能分泌较多IL-4。IL-4能在mRNA水平上阻断单核细胞、CD3+、CD4+或CD8+T细胞由植物凝集素(Lectin)所诱导的IFN-γ产生,也能抑制IL-1、TFN-α和PGE2的产生,而这些细胞因子均能抑制IgE合成。因此IL-4和IFN-γ量的比例和相互制约的平衡调节可能是IgE合成的重要决定因素。
除IL-4外,单核细胞、B细胞、内皮细胞和T细胞产生的IL-6也能增加IgE合成,IL-6可能为增加IgE合成提供了一类非特异性信号。IL-3和IL-5对IL-4所诱导的IgE合成也有协同作用。IL-10能抑制小鼠T细胞产生IFN-γ,因此可能通过间接上调IgE合成而加重变态反应。
NK细胞刺激因子也即IL-12是1989年新发现的细胞因子,是至今发现的Ils中唯一由B细胞产生的IL。IL-12是已知的对人体T细胞和NK细胞的增殖、细胞毒性和淋巴因子的产生有直接调节作用的唯一细胞因子,如诱导T细胞和NK细胞产生IFN-γ。IL-12是IgE抗体合成的强抑制剂,其作用机制可能是:增加IFN-γ合成而抑制IgE合成;通过非IFN-γ依赖的机制使IgE合成下降;Ig类别转换因子样作用,可下调IgE合成。IL-12很小的剂量就能显示很强的生物学效应,在I型超敏反应性疾病的防治中似具有潜在的应用前景。
肥大细胞与TH2细胞相似,也能分泌IL-4和IL-5而不分泌IFN-γ和IL-2。能影响肥大细胞数目、活化状态及组胺等介质释放的细胞因子使变态反应加重。这些因子包括GM-CSF、IL-3、IL-4、IL-9和组胺释放的细胞因子(histamine ueleasingfactors,HRFs)。HRFs由多种细胞产生,其主要作用是使嗜碱性粒细胞脱颗粒和释放组织胺。
(二)IgE Fc受体
IgE重链Fc段受体(FCεR)有两类,第一类称高亲和力IgE受体,以FCεRⅠ表示;第二类为低亲和力IgE受体,以FCεRⅡ表示。它们均能与IgE结合,但它们的表达细胞、分子结构等均不同。
1.FCεRⅠ FCεRⅠ只存在于肥大细胞和嗜碱性粒细胞膜上,这两种细胞在Ⅰ型超敏反应中起重要作用。当变应原或抗FCεRⅠ抗体使这些细胞膜上相邻的两个FCεRⅠ桥联起来时则引起一系列生化反应,继而释放出诸如组胺等各种与变态反应和炎症有关的生物活性介质。最近有报道,人皮肤中的郎格罕细胞上也表达有FCεRⅠ/。
2.FCεRⅡ/CD23FCεRⅡ/CD23存在于B细胞、单核-巨噬细胞、嗜酸性粒细胞、NK细胞、树突状细胞、郎格罕细胞和血小板上。现已证实,活化T细胞上也有FCεRⅡ/CD23。1986年Kikutani在人、1988和1989年Waldschmidt等在小鼠用单克隆抗体证明。sIgM+和sIgD+的B细胞90%以上表达FCεRⅡ,而sIgG+和sIgA+的B细胞则不表达FCεRⅡ。正常人外周血B细胞大多为FCεRⅡ阳性,过敏病人的B细胞和单核细胞表达FCεRⅡ大量增加。1987年有两个研究组均证实,FCεRⅡ就是人B细胞表面分化抗原CD23,是B细胞早期的表面标志,故多以FCεRⅡ/CD23表示之。IL-4能增加上述细胞FCεRⅡ/CD23的表达。
FCεRⅡ/CD23不稳定,经蛋白水解酶作用可在体内行裂解成大小不等的片段,其中位于羧基端能与IgE结合的25KD的片段较稳定,称为IgE结合因子(IgE-BF)或可溶性CD23(sCD23)。当IgE与FCεRⅡ/CD23结合后能防止FCεRⅡ降解成sCD23,IFN-γ、-α和前列腺素E2能抑制IL-4所诱导的CD23表达和sCD23的释放。
FCεRⅡ/CD23和IgE-BF/sCD23对IgE合成具有正调节作用。IgE-BF/sCD23能诱导正常人外周血单核细胞合成IgE。sCD23能诱导肥大细胞释放组胺加重临床症状。
三、组织损伤机制
肥大细胞和嗜碱性粒细胞膜表面有大量IgE Fc受体,每个肥大细胞表面FCεRⅠ的数目约4万~10万。呼吸道和胃肠道粘膜及特应性反应的局部皮肤内均有大量肥大细胞。IgE抗体与FCεRⅠ高亲和力地结合,这时如不再接触相应的变应原则不会出现任何临床症状。但一旦接触了相应变应原,则变应原与肥大细胞和嗜碱性粒细胞膜表面上的IgE抗体结合,从而使膜相邻近的FCεRⅠ发生相互连接(桥联)。FCεRⅠ桥联后触发细胞膜一系列的生物化学反应,胞外Ca2+流入胞内。此时两个同时平行发生的过和被启动,即脱颗粒,释放出颗粒中预合成的介质和合成新的介质。预合成的介质主要是组胺、蛋白水解酶、肝素和趋化因子(如β-葡萄糖醛酸脂酶、芳香基硫酸脂酶、过氧化物歧化酶、过氧化酶等)。释放的介质立即直接作用五靶细胞、靶组织、靶器官,引起速发的临床症状。FCεRⅠ桥联后细胞膜脂质发生磷脂甲基化代谢,在磷脂酶A2和甲基转移酶作用下膜磷脂降解,释放出二十碳不饱和脂肪酸即花生四烯酸。花生四烯酸以两条途径继续代谢,其一为环氧合酶途径(cyclooxygenase pathway),形成白细胞三烯(leukotrienes,LTs)和血小板活化因子(platelet activating factor,PAF)。LTs包括LTB4、LTC4、LTD4和LTE4。LTC4、LTD4和LTE4即过敏性嗜酸性粒细胞趋化因子(eosinophil chemotactic factor,NCF)、过敏性慢反应物质。(slow-reacting substance of anaphylaxis,SRS-A)。
肥大细胞等所释放的介质按其作用方式可归成三类,即:趋化剂,包括中性粒细胞趋化因子(neutrophil chemotactic factor,NCF)、过敏性嗜酸性粒细胞趋化因子(eosinophil chemotactic factor,ECF-A)和LTB4,其作用是将中性粒细胞等细胞吸引到肥大细胞活化部位;炎性活化剂,包括组胺、血小板活化因子、类胰蛋白酶和激肽原酶,它们引起血管舒张、水肿和组织损伤;致痉剂,包括组胺、PGD2、LTC4和LTD4,它们直接引起支气管平滑肌痉挛(表15-1)。
组胺与靶细胞上的受体结合,组胺受体有H1、H2和H3三种,很多种类的细胞均有组胺受体。
前列腺素、LTs和PAF这三类新合成的介质均为脂类介质。
PGD2与平滑肌细胞上的受体结合,是血管扩张剂和支气管收缩剂。阿司匹林和其它非固醇抗炎药能抑制环氧合酶而阻断PGD2合成。
肥大细胞产生的LTs与平滑肌细胞上的特异性受体结合,引起长时间的支气管收缩。若注入皮内,则产生长时间的红肿反应。LTs在速发型超敏反应的迟缓相反应(4~6小时出现反应)中起重要作用,是引起支气管收缩的主要介质。至今尚无能阻断入花生四烯酸5-脂氧合酶途径代谢的抑制药,阿司匹林由于抑制环氧合酶途径、增强5-脂氧合酶途径,产生更多的LTs而使哮喘病性加重。
表15-1 肥大细胞源性介质的作用
| 作用方式 | 介质名称 | 合成方式 | 效应 |
| 趋化剂 | NCF ECF-A LTB4 |
预合成 预合成 新合成 |
中性粒细胞 嗜酸性粒细胞 单核细胞 嗜碱性粒细胞 |
| 活化剂 | 组织胺 PAF 类脂蛋白酶 激肽原酶 |
预合成 新合成 预合成 预合成 |
血管舒张和血管通透性 小血栓 蛋白解酶活化C3 作用于激肽→血管舒张→水肿 |
| 致痉剂 | 组织胺 PGD2 LTC4 LTD4 |
预合成 新合成 新合成 新合成 |
致痉剂使支气管平滑肌收缩、粘膜水肿和粘液分泌 |
PAF主要由嗜碱性粒细胞产生,具疏水性,在胞浆内可被酶迅速破坏。PAF有直接收缩支气管的作用,引起内皮细胞退缩和松驰血管平滑肌。PAF在Ⅰ型超敏反应的迟缓相中能激活炎症性白细胞。
最近有人把细胞因子也列入新合成的介质之中,原因是培养的肥大细胞能产生肿瘤坏死因子(TNF)、IL-1、IL-4、IL-5、IL-6和各种集落刺激因子(colony-stimulatingfactors,CSFs)如GM-CSF和IL-3。肥大细胞受IgE-介导而活化时释放的细胞因子主要与迟缓相反应有关。速发型超敏反应的迟缓相(latephase ueaction)与迟发型超敏反应的炎症相(inflammatory phase)之间的主要区别是细胞因子的来源。前者经IgE传递和由肥大细胞介导,而后者由T细胞传递,T细胞直接分泌有关的细胞因子。
除抗原与结合在肥大细胞、嗜碱性粒细胞上的IgE抗体结合使FCεRⅠ桥联而引起脱颗粒释放介质的机制外,尚有其它因素也能引起脱颗粒和释放出介质。如过敏毒素C3a和C5a、蜂毒素(mellitin)以及合成的ACTH,可待因和吗啡等均能直接引起肥大细胞脱颗粒。植物凝集素(lectin)通过与IgE分子上的受体结合使IgE交联而引起脱颗粒。
四、常见的Ⅰ型超敏反应性疾病
Ⅰ型超敏反应性疾病涉及皮肤、呼吸道、耳鼻咽喉、眼、消化道、血液系统、神经系统和循环系统等。现从该型常见病中择花粉症、支气管哮喘、特应性皮炎和食物过敏作一简介。
(一)花粉症
即枯草热,也称变态反应性鼻炎,主要因吸入植物花粉致敏引起,因此具有显季节性和地区性特点。该病的临床表现主要在鼻、眼部和呼吸道。检查可见鼻粘膜苍白水肿、眼结膜充血等。根据症状及花粉浸液皮肤试验结果诊断并不困难。抗组胺药能显着控制临床症状,也可在鼻、眼局部应用类固醇和肥大细胞稳定剂如色甘酸二钠等药物。花粉季节前脱敏治疗常能收到较好效果。
(二)支气管哮喘
是变应原或其它因素引起的支气管高反应性下出现的广泛而可逆的气道狭窄性疾病。我国北京地区的发病率约5%,是儿科和内科的重要呼吸疾病。好发于儿童和青壮年,有明显家族史。病情迁延、病程较长、频敏发作,并发症较多。美国每年因哮喘死亡约2000~3000例,且有增加趋势。引起哮喘的因素十分广泛复杂,吸入性和食入性变应原以及感染特别是呼吸道病毒感染均为哮喘发生的重要原因。其主要病理变化是小支气管平滑肌挛缩、毛细血管扩张,通透性增加、小支气管粘膜水肿、粘膜腺体分泌增加、粘液栓形成,因而气道变窄,患者感觉胸闷、呼吸困难。这些病理改变和症状主要是LTs和组胺作用的结果。支气管哮喘的分型、鉴别诊断、防治和预后方面虽已取得很大进展,但仍有大量问题有待解决。
(三)特应性皮炎
也称异位皮炎,是常见的皮肤变态反应性疾病,约70%病人有阳性家族史。大多病人血清IgE水平升高。病变以皮疹为主,特点是剧烈瘙痒。急性期的病理改变是细胞间质水肿和上皮内疱疹形成,真皮浅层可有水肿,血管扩张和淋巴细胞、嗜酸性粒细胞等浸润。亚急性期表皮内有小疱和角化现象,有大量淋巴细胞浸润;慢性特应性皮炎主要表现表皮角化和增生、皮肤增厚、苔癣化、血管周围大量炎性细胞浸润,常有色素沉着。皮疹好发于肘窝、腘窝、颈部和面部。此病可分婴儿型、儿童型和成人型。婴儿的特应性皮炎也称婴儿湿疹,多在生后4~6月发病,病变有渗出型和干燥型两种。成人型多在青年期发病,表现为泛发的融合的扁平丘疹,病损皮肤增厚和苔癣化。特应性皮炎对理化等刺激异常敏感。大多病人间歇发作,冬季易复发。诊断主要依据典型的皮肤表现和阳性家族史。
(四)食物变态反应
食物变态反应一般现于进食后数分钟~1小时。其症状有口周红斑、唇肿、口腔疼痛、舌咽肿、恶心、呕吐等。引起幼儿过敏的常见食物为鸡蛋、牛奶、鱼和坚果果仁等。
第二节 Ⅱ型超敏反应
一、概 念
当IgG和IgM类抗体与靶细胞表面抗原结合,通过募集和激活炎症细胞及补体系统而引起靶细胞损伤,所以此型超敏反应也称抗体依赖的细胞毒超敏反应、溶细胞型或细胞毒型超敏反应。这些抗体能与自身抗原或与自身抗原有交叉反应的外来抗原特异性结合。这些自身抗体可以与靶抗原结合或以游离形式存在于血循环中。抗体、补体、巨噬细胞(MФ)和NK(K)细胞均参与该型反应。该型反应中的靶细胞主要是血细胞和某些组织成分。
二、组织损伤机制
Ⅱ型超敏反应中最常见的形式是由直接针对细胞或组织上的抗原并能结合补体的IgG或IgM类抗体所引起。细胞表面抗原与相应抗体结合导致细胞崩溃死亡、组织损伤或功能异常。参与Ⅱ型超敏反应的抗原、抗体及组织损伤机制分述如下:
(一)抗原
Ⅱ型反应中的靶细胞主要是血液细胞,白细胞、红细胞和血小板均成为反应的攻击目标。某些组织特别是肺基底膜和肾小球毛细血管基底膜也是该型反应中的常见抗原。机体产生抗细胞表面抗原或组织抗原的原因可能有:
1.同种异型抗原或抗原体的输入同种不同个体间血型不匹配的输血引的输血反应以及母子因Rh或ABO血型不符所致的新生儿溶血症是典型的例子。
2.感染病原微生物特别是病毒感染可致自身细胞或组织抗原的抗原性改变,以致机体将它们视为外来异物发生免疫应答;有些病原微生物与自身组织抗原有交叉反应性,如有的链球菌株细胞壁与人肺泡基底膜及肾小球毛细胞血管基底膜具有交叉抗原性,因此抗链球菌的抗体也能与肺、肾组织中的交叉抗原结合并引起损伤。
3.药物多数药物为半抗原,它们可吸附在血细胞表面,成为新抗原被机体免疫系统识别.
4.免疫耐受机制的破坏因物理、化学、生物、外伤等使机体免疫耐受机制失灵,从而产生了抗自身抗原的抗体。
(二)抗体
介导Ⅱ型超敏反应抗体主要属IgG和IgM类,是针对自身细胞或组织抗原的,因此多为自身抗体。IgM为五聚体,能最有效地结合抗原、激活补体和介导吞噬作用。IgG的CH2和IgM的CH4功能区均有与Clq结合的位点。
(三)抗体引起靶细胞或组织损伤的主要机制
1.补体介导的细胞溶解 IgM或IgG类自身抗体与靶细胞上的抗原特异性结合后,经过经典途径激活补体系统,最后形成膜攻击单位,直接引起膜损伤,靶细胞溶解死亡。
2.炎症细胞的募集和活化在抗体所在处由于局部补体活化产生的过敏毒素C3a和C5a对中性粒细胞和单核细胞具有趋化作用,因此常可见有这两类细胞的聚集。这两类细胞的表面均有IgG Fc受体,故IgG抗体与靶细胞结合并被激活。活化的中性粒细胞和MФ产生水解酶和细胞因子等而引起细胞或组织损伤。
3.覆盖有抗体的靶细胞被吞噬如自身免疫性溶血性贫血时机体产生了抗体自身红细胞的抗体,被自身抗体结合和调理的红细胞易于被肝脾中的MФ所吞噬,因而红细胞减少引起贫血。
4.依赖抗体的细胞介导的细胞毒作用(ADCC)覆盖有低浓度IgE抗体的靶细胞能通过细胞外非特异性杀伤机制,包括被非致敏淋巴网状细胞非特异性地杀伤。因淋巴网状细胞表面有能与Igg Fc的CH2和CH3功能区结合的特异性受体,这种杀伤作用称为ADCC。吞噬的和非吞噬的髓样细胞以及K细胞均有ADCC活性。如人单核细胞和IFN-γ活化的中性细胞藉助其FcγRⅠ和FcγRⅡ杀伤覆盖有抗体的瘤细胞,而K细胞通过FcγRⅢ杀伤靶细胞。在ADCC中效应细胞与靶细胞间的接触十分重要。细胞弛缓素B因干扰细胞移动而能抑制ADCC反应。聚合IgG因牢固地结合Fc受体而阻断效应细胞与靶细胞表面上的抗体相互作用。在体外嗜酸性粒细胞杀伤覆盖有IgG或IgE抗体的血吸虫。ADCC在体内的作用如何尚待阐明,但这种细胞毒机制对于像寄生虫和实体瘤这类难以经吞噬而杀伤的细胞靶而言可能是积极意义的。
5.抗细胞表面受体、抗激素、抗交叉抗原等自身抗体也具有重要致病作用。
三、常见的Ⅱ型超敏反应性疾病
(一)同种不同个体间的Ⅱ型超敏反应
1.输血反应 ABO血型是人红细胞膜上最主要的系统。AB血型的人有A和B基因,其红细胞表面有A和B抗原,而O型血的人没有A和B基因,故只合成H物质。A型血的人血清中有天然抗B抗体,B型血的人则相反,而O型血的人有抗A和抗B抗体。这些同族血细胞凝集素结合,补体被激活,红细胞被破坏,出现溶血、血红蛋白尿等现象。结合了同族血细胞凝集素的红细胞也可被吞噬细胞吞噬消灭。
2.新生儿溶血症 Rh血型为一重要抗原系统,其中RhD抗原最重要。如母亲为Rh阴性,胎儿为Rh阳性,在首次分娩时,胎儿血进入母体内,母亲被胎儿的Rh阳性红细胞的致敏,产生了以IgG类为主的抗Rh抗体。当再次妊娠时,抗Rh抗体经胎盘进入胎儿体内,并与胎儿红细胞膜上的RhD抗原结合,红细胞被溶解破坏。分娩后72小时内给母体注射抗RhD血清能成功的预防Rh血型不符所引起的溶血症。
母子间ABO血型不符引起的新生儿溶血症在我国并不少见,病性较轻,但至今尚无有效的预防措施。
3.移植排斥反应器官移植后的排异反应其机制十分复杂,细胞免疫和体液免疫均参与。针对移植抗原的抗体对移植物可有直接细胞毒性,或引起吞噬细胞的粘附或由K细胞行使非特异性攻击。当抗体与血管内皮表面上抗原结合时,抗体亦可引起血小板粘附。超急排斥反应为受者体内预存的抗体所介导。
(二)自身免疫性Ⅱ型超敏反应
1.自身免疫性溶血性贫血患者产生了抗自身红细胞抗体,主要为IgG类。引起红细胞溶血的主要机制是:如补体活化至C9,则红细胞直接被溶解;如补体仅激活C3,则覆盖有IgG抗体和C3b的红细胞被肝脾中的吞噬细胞吞噬消化。引起红细胞溶解的自身抗体有温抗体和冷抗体两类,它们分别在37°C和20°C以下发挥作用。
2.肺出血肾炎综合征 即Goodpasture综合征,是由自身抗体引起的以肺出血和严重肾小球肾炎为特征的疾病。自身抗体与肺泡和肾小球毛细血管基底膜中第Ⅳ型胶原结合并在局部激活补体和中性白细胞。显微镜下可见坏死、白细胞浸润及抗体和补体沿基底膜呈线状沉积。
3.自身免疫性受体病抗细胞表面受体的自身抗体与相应受体结合导致细胞功能紊乱,但无炎症现象和组织损伤。细胞功能的异常可以表现为受体介导对靶细胞的刺激作用,也可表现为抑制作用。
(1)Grave病:是刺激性作用的一个例子。病人产生了抗甲状腺上皮细胞刺激激素(thyroid-stimulating hormone,TSH)受体的自身抗体,TSH的生理功能是刺激甲状腺上皮细胞产生甲状腺素。自身抗体与TSH受体结合其作用与TSH本身相同,因而导致对甲状腺上皮细胞刺激的失调,甚至在无TSH存在下也能产生过量甲状腺素,出现甲状腺功能亢进。Roiitt称这种刺激型超敏反应为V型超敏反应,但多数人认为它是Ⅱ型超敏反应的一种特殊表现形式。
(2)重症肌无力:是抗受体抗体介导的功能受抑制的病症。80%以上患者有针对神经肌肉接头处突触后膜上乙酰胆碱受体的抗体,补体参与发病过程。神经肌肉传导障碍导致晨轻暮重、活动后加重、休息可减轻的渐进性骨髓无力及各种受累器官的症状。因受体内吞和在胞内的降解,受体数目减少。
(3)胰岛素抗性糖尿病:有些对胰岛素无反应的糖尿病人抗胰岛素体的自身抗体,受体与自身抗体结合后,胰岛素不能与其受体结合。
4.抗激素自身抗体所致的疾病有的恶性贫血与抗体内源性因子即肠道吸收维生素B12辅因子的自身抗体有关。自身抗体与该因子结合后,辅因子功能被抑制,结果维生素B12缺乏,造成血细胞生成异常和幼巨细胞贫血。
(三)抗交叉的反应性抗原的抗体致的疾病
急性风湿热是抗与自身蛋白质有交叉反应的外来抗原的抗体所致疾病的最好例子。其特征是关节炎、心脏瓣膜损伤引起的心内膜炎和心肌炎。抗链球菌细胞壁蛋白质的抗体与心肌细胞上的交叉抗原结合而引起心肌损伤。
(四)Ⅱ型药物反应
药物为半抗原,结合于血液有形成分的表面则成为细胞-药物复合物并导致细胞毒抗体的产生。如与持续服用氯丙嗪或非那西汀有关的溶血性贫血,与服氨基匹林或奎尼丁有关的粒细胞缺乏症,用司眠脲引起的血小板减少性紫癜等均属此类。
第三节 Ⅲ型超敏反应
一、概 念
Ⅲ型超敏反应的抗体虽与Ⅱ型超敏反应中的抗体相似,主要也是IgG和IgM类抗体,但所不同之处是这些抗体与相应可溶性抗原异性结合形成抗原抗体复合物(免疫复合物),并在一定条件下沉积在肾小球基底膜、血管壁、皮肤或滑膜等组织中。免疫复合物激活性补体系统,产生过敏毒素和吸引中性粒细胞在局部浸润;使血小板聚合,释放出血管活性胺或形成血栓;激活Mφ使释放出IL-1等细胞因子。结果引起以充血水肿、局部坏死和中性粒细胞浸润为特征的炎症性反应和组织损伤,此型超敏反应亦称免疫复合物介导的超敏反应。
二、Ⅲ型超敏反应的发病机制
(一)影响疫复合物沉积的因素
下列因素与免疫复合物的沉积程度有关:
1.循环免疫复合物的大小这是一个主要因素,因很小的免疫复合物容易从肾排出,或在血液中循环,不易发生沉积,大的免疫复合物易被单个核吞噬细胞吞噬和清除。一般而言分子量约100万左右的中等大小的可溶性免疫复合物于沉积在组织中。
2.机体清除免疫复合物的能力免疫复合物在组织中沉积的程度与机体从血循环中清除它们的能力呈反比。循环免疫复合物的清除由单核吞噬细胞系统以及结合补体蛋白质的功能的完整性所决定。吞噬细胞功能缺陷促进免疫复合物持续存在并继而在组织中沉积。C2或C4先天性缺陷的病人常可引起Ⅲ型超敏反应,其原因是抗原体反应所产生的C3b不足,或因缺乏补体受体介导的吞噬作用面导致免疫复合物在血流中持续循环。在这种情况下,沉积在组织中的免疫复合物通过补体非依赖的机制或通过激活C3旁路而使炎症细胞聚集在免疫复合物沉积的局部。
3.抗原和抗体和理化特性抗原和抗体的表面电荷、价、它们之间结合的亲和力、抗体的类别等均影响免疫复合物的形成和沉积。复合物中的抗原如带正电荷,那么这种复合物就很容易与肾小球基底膜上带负电的成分相结合,因而沉积在基底膜上。这种复合物产生的组织损伤一般较重而且持续时间较长。
4.解剖和血流动力学因素这些因素对于决定免疫复合物的沉积位置是重要的。为行使形成尿液或滑膜液的功能,肾小球和滑膜中的毛细胞血管是在高流体静压下通过毛细胞血管壁而超过滤的,因此它们成为免疫复合物最常沉积的部位之一。
5.炎症介质的作用免疫复合物与炎症细胞结合并刺激它们在局部细胞因子和血管活性胺等介质,使血管通透性增加。并由于内皮细胞之间的间距增大而增加了免疫复合物在血管壁的沉积,结果放大了组织损伤、使病情加重。
在体内,免疫复合物形成的结局不但取决于抗原和抗体的绝对量,而且还取决于它们的相对比例。抗原抗体的相对比例决定了复合物的性质以及在体内的分布。抗体过剩和轻度抗原过剩的复合物迅速沉积在抗原进入局部。
(二)免疫复合物引起组织损伤和致病的机制
在免疫应答过程中,抗原抗体复合物的形成是一种常见现象,但大多可被机体的免疫系统清除,可而不具有致病作用。但如复合物的数量、结构、清除情况或局部功能的和解剖的特性等因素造成大量复合物沉积在组织中时,则引起组织损伤和出现相关的免疫复合物病。
1.抗原抗体复合物与补体结合补体被活化,释放出过敏毒素-C3a和C5a。过敏毒素引起肥大细胞脱颗粒、释放出组胺、趋化因子等生物活性介质从而使血管通透性增加。趋化因子吸引多形核细胞流动和汇集,多形核细胞将免疫复合物吞噬,中性蛋白水解酶和胶原酶等蛋白水解酶、激肽形成酶和阳离子从中性粒细胞中释放出,损伤局部组织和加重炎症反应。活化的C567附着细胞表面并结合C8和C9,通过反应性溶解作用使损伤进一步加重。抗原抗体复合物激活补体系统是Ⅲ型超敏反应中引起炎症反应和组织损伤的最主要原因。
2.免疫复合物引起血小板聚合 结果释放出5-羟色胺等血管活性胺以及形成血栓,后者使血流滞或血管完全被堵导致局部组织缺血。
3.可溶性免疫复合物被Mφ吞噬后不易被消化,而成为一个持续的活化刺激动因,Mφ被激活释放出IL-1等细胞因子,加重了炎症反应。
三、常见的Ⅲ型超敏反应性疾病
(一)局部形成的免疫复合物所致的炎症损伤
1.Arthus反应 Maurice Arthus用马血清皮内免疫家免几周后发理,再次重复注射同样血清后在注射局部均出现红肿反应,3~6小时的反应达高峰。红肿程度随注射次数增加而加重,注射5~6次后,局部出现缺血性坏死,反应可自行消退或痊愈,此即Arthus反应。其机制是所注射的抗原与血管内的抗体结合形成可溶性免疫复合物并沉积在注射部位的小动脉壁上,引起免疫复合物介导的血管炎。补体活化后迅速产生的过敏毒素引起肥大细胞脱颗粒。血小板聚合并释放出血管活性胺,使红肿加剧。皮损中有大量多形核白细胞浸润。
2.对吸入抗原的反应对吸入外源性抗原的肺内Arthus型反应与人类很多超敏反应性疾病有关,它们多表现为与职业有关的超敏反应性肺炎,如农民肺患者吸入嗜热放线菌孢子或菌丝后6~8小时内出现严重呼吸困难,是吸入的抗原与特异性IgG抗体结合成免疫复合物所致。临床上尚有许多与此相类似的肺部Ⅲ型超敏反应,并根据患者的职业或致敏抗原的性质给予相应的病名,如养鸽者病(因吸入鸽干粪中的血清蛋白质)、干乳酷洗涤者肺(因吸入青霉菌孢子)、蔗尘肺、皮革者肺(吸入牛蛋白质)、剥枫树皮者病(吸入Cryptostrama孢子)、红辣椒者病和盖草屋顶者病等。这些都是由于反复吸入工作环境中的抗原性物质而产生的抗原抗体复合物介导的职业性疾病。
3.对内源性抗原的反应感染因子在局部释放的抗原常引起Ⅲ型超敏反应,如淋巴管中的死丝虫引起炎症反应,使淋巴流动受阻。在有高水平抗体的患者,治疗使抗原突然释放出而产生免疫复合物介导的Ⅲ型超敏反应。如用Dapsone治疗结节性麻风病人后皮肤上出现的红斑结节,用青霉素治疗梅毒病人发生的Jarisch-Herxheimer反应(治疗后梅毒增剧反应)等。
(二)循环免疫复合物所致的疾病
1.血清病 与Arthus反应不同,血清病是一种由循环免疫复合物引起的全身的Ⅲ型超敏反应性疾病。用马抗白喉或破伤风类毒素的抗血清被动免疫以预防和治疗这些严重疾病到今仍不失为一个重要的手段。有些病人在注射动物抗血清后7~10天出现体温升高、全身荨麻疹、淋巴结肿大、关节肿痛等症状。有的还可有轻度急性肾小球肾炎和心肌炎。血清中补体水平下降。由于该病主要因注射异种动物血清所致,故称为血清病。用抗蛇毒抗体治疗蛇咬伤,用鼠源性单克隆抗体治疗恶性肿瘤或自身免疫病,用抗淋巴细胞或抗胸腺细胞血清治疗移植排斥反应时也可出现血清病。在停止注入上述血清后,症状一般不经治疗可自行消退。
由于一次注射大量异种蛋白抗原引起的血清病称急性血清病,其特征是有大量免疫复合物沉积,因反复注射异种蛋白抗原所致者称慢者称慢性血清病,复合物形成较少,并常沉积在肾、动脉和肺中。
血清病的发病机制是由于注射的抗原量过大、致使在机体中产生相应抗体时血循环中仍存在有较多所注射的抗原,一旦抗原、抗体相遇就形成比例不等的可溶性复合物。当中等大小的复合物未能被单核吞噬细胞系统吞噬清除时则附着在皮肤、关节、肾和心等处。关于免疫复合物为什么特别容易沉积在某局部的确切机制仍不明,但最近认为在某特定位置产生复合物的一个机制是在抗体合成开始之前该组织已有抗原在局部沉积,因而抗体出现后就与存在于该组织上的抗原结合,在此情况下,复合物在局部而非在血循环中形成。
2.免疫复合物性肾小球肾炎在有慢性感染和自身免疫情况下,因抗原持续存在而使免疫复合物的沉积长期存在。很多肾小球肾炎与循环免疫复合物有关,如系统性红斑狼疮病人肾中有DNA/抗DNA/补体沉积物。最明显的是由肾原性(nephritogenic)链球菌某些菌株感染以后所引起的肾病以及与三日疟有关的尼日利亚儿童的肾病综合征。病毒慢性感染过程中也可出现复合物性肾炎,如淋巴细胞性脉络从脑膜炎病毒感染小鼠的肾小球肾炎,这是人类很多肾小球肾炎一个代表性模型。
3.复合物在身体其它部位的沉积脉络膜从是一个主要的过滤场所故也有利于免疫复合物的没积,这是系统性红斑狼疮病人出现中枢神经系统症状的原因,脑脊液中C4水平常下降。在亚急性硬化性泛脑炎病人的神经组织中有麻疹抗原和相应抗体的复合物沉积。在血清病和系统红斑狼疹的皮疹中,其表皮与真皮连接的基底膜上有lg和C3沉积。最近报告,结节性多动脉炎病损部位含有乙型肝炎病毒的免疫复合物。青毒素等药物与人体蛋白质结合后具有了抗原性,与相应抗体结合的复合物亦可引起Ⅲ型超敏反应。
第四节 Ⅳ型超敏反应
一、概 念
细胞介导的免疫反应有不同的类型。与上述的由特异性抗体介导的三种类型的超敏反应不同,Ⅳ型或迟发型超敏反应(delayed type hypersensitivity,DTH)是由特异性致敏效应T细胞介导的细胞免疫应答的一种类型。在豚鼠、大鼠和小鼠中,对绝大多数蛋白质抗原的DTH反应均可经CD4+T细胞被动转移。但最近证明,CD8+T细胞也可被动转移DTH样反应。如抗病毒的DTH反应主要是由CD8+T细胞介导的。而对注射入体内的蛋白质或细胞外的抗原主要由CD4+T细胞所介导。DTH反应中的最终效应细胞是活化的单个核吞噬细胞。
该型反应均在接触抗原24小时反应出现反应,故称为迟发型超敏反应。在对胞内寄生菌如分枝杆菌、单核细胞增多性李斯德氏菌、病毒、真菌感染的许多变态反应中;对某些简单化学物质的接触性皮炎中以及对移植组织器官的排斥反应中均可见DTH反应。
典型的皮肤DTH反应
1.Jones-Mote反应是一种以可溶性抗原单独注射或抗原加福氏不完全佐剂免疫动物后所出现的皮肤DTH反应。24小时反应达到高峰,红肿明显,但硬结持续时间较短,皮肤的反应消退较早。其组织学改变的主要特征是皮损中有大量嗜碱性粒细胞浸润,故现亦称此反应为皮肤嗜碱性粒细胞超敏反应(cutaneous basophil hypersensitivrity,CBH)。不过致敏T细胞仍是引起CBH的主要细胞,因注射抗T细胞血清后CBH被抑制,提示嗜碱性细胞的大量浸润可能是一种较早出现的继发反应的表现。
2.结核菌素反应 临床上具有诊断意义的结核菌素试验是DTH的原型。在被试者前臂皮内注射结核素(结核杆菌菌体脂蛋白)或分枝结核杆菌的纯化蛋白衍生物(purified protein derivative,PPD)后,如被检者曾有结核感染史但已痊愈或接种过介苗,则在注射后约4小时,中性粒细胞聚集在注射部位后毛细静脉周围,随继中性粒细胞的浸润迅速消退。约12小时,注射部位小静脉周围代之以T细胞和单核细胞浸润(各约占50%)。这些小静脉的内皮细胞肿胀,细胞器生物合成增加,血浆大分子外漏,纤维蛋白原从血管进入周围组织中后变成纤维蛋白。由于注射部位血管外组织间隙内纤维蛋白原从血管进入周围组织中后变成纤维蛋白。由于注射部位血管外组织间隙内纤维蛋白的沉积和T细胞及单核细胞的聚集而引起组织红肿和硬结。硬结为DTH反应的最主要特征,注射后约18小时出现。24~48小时达高峰,之后红肿和硬结自行消退。
对常见抗原如念球菌抗原DTH反应阴性提示T细胞功能缺陷,因而患者对正常情况下能抵抗的微生物如分枝结核杆菌和真菌极易感。如抗原在组织中持续存在,则结核菌素反应可进展演变成肉芽肿反应。
3.肉芽肿肉芽肿样超敏反应是临床上最重要的迟发型超敏反应。是由于致病因子(通常为微生物如分枝结核杆菌等)持续存在于Mφ内而又有能被清除灭活,而引起的一种特征性炎症反应。偶尔抗原抗体复合物或非免疫性物质如滑石粉等也可引起肉芽肿。肉芽肿一般需2周才出现反应,4周时反应达到高峰。在DTH反应晚期,活化Mφ的细胞浆和细胞器均增加。参与肉芽肿的活化Mφ的组织形态学类似皮肤上皮细胞,故称上皮样巨噬细胞,有时数个活化Mφ融合成有多个核的巨大细胞。若这些细胞在抗原如分枝杆菌四周融合包绕,则出现明显可触及的炎症性结节,此即肉芽肿。如将可溶性蛋白质抗原吸附在乳胶颗粒上,则因乳胶颗粒不能消化在组织中长期存在而引起实验性肉芽肿。
二、组织损伤机制
上已提到,血沮抗体不能从一致敏的个体将DTH反应转移给一正常个体。DTH的转移需要淋巴样细胞,特别是T细胞。在人类,活的外周白细胞以及从它们提取的低分子量的转移因子均已使DTH转移成功。转移因子可能含有多能刺激已致敏T细胞介导DTH的物质。
急性DTH是细胞介导免疫的一种形式。在反应中,CD4+T细胞识别可溶性蛋白质抗原,CD8+T细胞识别细胞内微生物抗原,它们通过分泌细胞因子对抗原进行应答。其中TNF激活后毛细静脉的血管内皮细胞,血管内皮细胞将中性粒细胞,继之将淋巴细胞和单核细胞募集到组织中。INF-γ则能使聚集的单核细胞分化成Mφ。而将抗原清除。但如抗原持续存在,则Mφ处于慢性活化状态,并分泌更多细胞因子和生长因子,最后损伤组织被纤维组织所代替。在DTH早期,炎症浸润细胞中富集具有活化细胞表型特征(如IL-2受体P55表达增加)的CD4+T细胞和活化的Mφ。而DTH晚期,上皮样Mφ和巨细胞与纤维母细胞和新血管数目均有增加。
DTH反应包括三个连续的过程,它们是:
1.识别相(cognitive phase) CD4+T和某些CD8+T细胞识别存在于抗原呈递细胞(APC)表面上的外来蛋白质抗原。
在皮肤DTH中,将抗原呈递给CD4+T细胞并启动DTH反应的APC可能有三类:第一是存在于上皮中的特定的APCS如郎格罕细胞。它们能将抗原运输到引流淋巴结并在此与抗原特异性T细胞接触,活化的T细胞在数目和跨越内皮屏障的能力方面均有增加。第二是皮肤中的Mφ和单核细胞,它们一旦离开血液循环并进入DTH反应部位的血管外组织中就分化成DTH的最终效应细胞即活化的巨噬细胞。单核细胞分化成效应细胞称为巨噬细胞活化。活化过程是新的基因或原有基因转录增加的结果,表现为各种基因表达产物量的增加。活化的Mφ能完成诸如杀灭被吞细胞菌等静止单核细胞所不能完成的功能。可溶性细胞因子特别是IFN-γ和脂多糖等细菌产物均能引起基因转录和Mφ活化。活化的Mφ能过分泌炎症介质引起局部炎症反应,清除微生物抗原,使DTH消退。最后一类APCs可能是后毛细静脉内皮细胞。抗原进入局部的小静脉内皮细胞在DTH中的作用除作为APC启动T细胞活化外,还能调节白细胞的浸润,因此它在炎症反应中具有重要作用。人、狒狒和狗的小静脉内皮细胞表达与呈递抗原有关的MHCⅡ类分子。在豚鼠诱导内皮细胞表达MHCⅡ分子是DTH反应中最早的表现之一。而由CD8+T细胞介导的对病毒抗原的DTH的反应中,内皮细胞呈递抗原与MHCⅠ类分子密切相关。但需指出,上述APC s中没有一类APC能单独在所有种属、所有组织启动各种抗原的DTH反应。
2.激活相(activation phase) 为T细胞分泌细胞因子和增殖相。一旦T细胞被APCs激活,就能通过分泌细胞因子而介导DTH。下面3个细胞因子对炎症反应的发生最为重要:
(1)IL-2:IL-2能引起抗原活化T细胞的自泌性增殖。IL-2还能放大CD4+T细胞合成的IL-2、IFN-γ、TFN和淋巴素(lymphotoxin,LT)。
(2)IFN-γ:IFN-γ能作用于内皮细胞和Mφ等APCs,增加MHCⅡ类分子表达,提高将抗原呈递给局部CD4+T细胞的效率,这也是诱导DTH的一个重要放大机制。IFN-γ能增强炎症处浸润单核细胞消灭抗原的能力。IFN-γ产仅是最强的激活Mφ的细胞因子,也是DTH中最重要的细胞因子。
(3)TNF和LT:它们能放大小静脉内皮细胞结合和活化白细胞的能力,从而导致炎症反应。
3.效应相(effector phase) 在DTH中,效应相可分成炎症和消退两步。炎症指的是血管内皮细胞被细胞因子激活,血管中的白细胞聚集于抗原进入的局部组织中。消退是由于外来抗原被细胞因子活化的Mφ所消除。
三、常见的Ⅳ型超敏反应性疾病
(一)接触性皮炎
接触性皮炎是一种由T细胞介导的对环境中抗原的湿疹样皮肤病。引起本病的抗原主要是天然的或合成的有机化合物和金属,如镍、染料、磺胺等药物和有毒植物等,但以毒葛和槲叶毒葛最常见。在美国50%接触性皮炎由这两种抗原引起。外来半抗原物质可能与郎格罕细胞表面分子结合形成新抗原、富含MHC分子的郎格罕细胞将抗原加工处理并呈递给T细胞。病理特征为小静脉周围有淋巴细胞浸润包绕,上皮细胞有水疱和坏死,有嗜碱和嗜酸性粒细胞,间隙纤维蛋白沉积,皮肤和上皮水肿。急性皮损表现为红肿和水疱,重症者可有剥脱性炎,慢性表现为丘疹和鳞屑。
(二)移植排斥反应
B细胞和T细胞均参与移植排斥反应,但迟发型超敏反应的一个显著临床表现是移植排斥反应。在典型同种异体间的移植排斥反应中,受者的免疫系统首先被供体的组织抗原所致敏。克隆增殖后,T细胞到达靶器官、识别移植的异体抗原,启动一系列变化,导致淋巴细胞和单个核细胞局部浸润等炎症反应甚至移植器官的坏死。
(三)与自身免疫病的关系
引起自身免疫的主要机制有多克隆淋巴细胞的刺激,与自身抗原部分交叉反应性外来抗原的侵入以及免疫调节的异常。大多自身免疫的确切发病机制仍不明。很多器官特异性自身免疫病认为是由自身反应性T细胞引起的。有些胰岛素依赖性糖尿病人胰岛四周有淋巴细胞和Mφ浸润,β细胞被破坏。将患自发性糖尿病的大鼠或小鼠的CD4T细胞转移给正常鼠可引起相似损伤。实验性变态反应性脑脊髓炎(experimental allergicencephalomyelitis,EAE)是经髓鞘碱性蛋白(meylin basic protein,MBP)免疫小鼠后由CD4T细胞引起的神经性疾病。脑和脊髓神经周围有活化巨噬细胞,髓鞘被破坏,神经传导异常等,该病可经MBP特异的CD4T细胞转移。最近研究证明,鼠EAE是由MBP特异的、表达Vβ8和/Vβ13的、MHCⅡ类限制的T细胞介导的。实验性自身免疫性甲状腺炎也有类似迟发超敏反应的炎症现象。
(四)与传染病的关系
Ⅳ型超敏反应的组织损伤与感染关系密切,结核病时的肺空洞形成、干酪化和全身毒血症以及麻风病人皮肤肉芽均与细胞介导的超敏反应有关。抗原持续存在引起局部慢性迟发型超敏反应,致敏T细胞连续释放出淋巴因子导致大量Mφ聚集。天花和花疹的皮疹以及单纯疱疹的皮损主要是由于细胞毒性T细胞广泛损伤病毒感染的细胞迟发超敏反应引起。在念珠菌病、皮肤霉菌病、球孢子菌病、组织胞浆菌病等真菌病以及血吸虫病等寄生虫病时均已证明有细胞介导的超敏反应。
上述四型超敏反应各具特征,Ⅰ型主要由lgE抗体介导,故补体不参与,由肥大细胞等释放的介质引起组织损伤,症状发生和消退在四个型中最快,与遗传关系也最明显。Ⅱ型由抗组织和细胞表面抗原的IgG或IgM类抗体介导,血细胞是主要靶细胞,补体活化白细胞聚集并活化以及受体功能异常为该型反应机制。Ⅲ型由循环可溶性抗原与IgM或IgG类抗体形成的复合物介导,补体参与反应,白细胞聚集和被激活。Ⅰ~Ⅲ型均可经血清抗体转移。Ⅳ型超敏反应由CD+T细胞介导,引起组织损伤的机制是Mφ和淋巴细胞的局部浸润、活化及细胞因子的产生。
需指出,临床实际情况是复杂的,常可见两型或三型反应同存。因大多免疫应答体液免疫和细胞免疫均参与,如移植排斥反应和结核杆菌感染时的发病机制和组织损伤绝非由单独一型超敏反应所能解释,可能以某一型为主或在疾病发展的不同阶段由不同型超敏反应所主宰。第二点需强调的是一种抗原在不同条件下可引起不同类型的超敏反应,典型的例子是药物如青霉素,它可引起Ⅰ型过敏性休克;结合于血细胞表面可引起Ⅱ型反应;如与血清蛋白质结合可能出现Ⅲ型反应,而青霉素油膏局部应用可引起Ⅳ型超敏反应。
第十六章 自身免疫和自身免疫病
自身免疫(autoimmunity)是指机体免疫系统对自身抗原发生免疫应答,产生自身抗体和(或)自身致敏淋巴细胞的现象。自身耐受(self tolerance)是指机体免疫系统对自身抗原不产生免疫应答,无免疫排斥的现象。
通常高等动物的免疫系统具有高度分辨“自己”与“非已”抗原物质的能力。在一般情况下,机体对“非已”抗原发生免疫排斥,而对自身抗原呈现自身耐受,其主要机制已如前述。
第一节 生理性自身免疫现象
1990年Ehrlich提出,在正常情况下,机体对自身抗原不产生免疫应答(即自身耐受性),只有当自身耐受遭到破环时才发生自身免疫。他曾认为机体一旦对自身抗原发生免疫应答,即将对机体造成严重的危害称之为自身中毒恐怖(horrorautotoxicus)。这个观点长期统治着免疫学领域,使自身免疫与自身免疫病两个概念等同起来。现代免疫学观点趋向于将这两种概念分开,对自身免疫的生理意义有许多崭新的认识。
现知自身免疫现象在正常人体内可起维持机体生理自稳的作用。正常人血清可以测得多种天然自身抗体,诸如抗肌动蛋白、肌凝蛋白、角蛋白、DNA、细胞色素C、胶原蛋白、髓鞘碱性蛋白、白蛋白、铁蛋白、IgG、细胞因子、激素等抗体,但这些抗体起着维持机体自稳的作用。体内产生的自身抗体有助于清除受损伤组织及其分解产物。
不同淋巴细胞克隆间的相互识别,在体内可构成独特型免疫网络,亦属于自身免疫现象,它在通常情况下起生理性免疫调节作用,使机体对外来抗原的应答有一定的自限性。
1975年Opelz等报道的自身混合淋巴细胞反应(autologous mixedlymphocytereaction,AMLR)是一种典型的自身免疫现象,已得到较深入的研究。AMLR系统中,自身的DR+细胞作为刺激细胞,CD+自身反应性T细胞(auto-ueactive Tcell)作为应答细胞被刺激而分裂增殖。早期增殖T细胞是TH,能分泌IL-2、B细胞生长因子、B细胞分化因子。晚期增殖细胞是TS或TC细胞。AMLR系统表明,机体在无外来抗原刺激下,自身反应性T细胞能识别自身抗原而产生辅助、抑制和杀伤效应。其中早期生成的TH细胞为诱导晚期TS,TC提供条件,而对被生物或理化因子作用而改变的自身细胞以及衰老蜕变的自身细胞有杀伤和清除作用。由此可见,AMLR对维持免疫自稳、自身耐受也有重要生理意义。
免疫应答过程各时相中自身MHC的限制作用更是说明机体在对外来抗原的识别和排斥时,均须以对自身抗原识别为基础。换句话说,在许多情况下,免疫细胞若不能识别自己,也就无法识别异已。
当自身免疫表现为质和量的异常,自身抗体和(或)自身致敏淋巴细胞攻击自身靶抗原细胞和组织,使其产生病理改变和功能障碍时,才形成自身免疫(autoimmune disease)。自身免疫与自身免疫病的关系可能有三种性况,①自身免疫引起疾病;②疾病引起自身免疫;③某些因素同时引前两者。
第二节 病理性自身免疫应答的诱因
一、自身抗原与佐剂的作用
(一)隐蔽抗原的释放
隐蔽抗原指体内某些与免疫系统在解剖位置上处于隔绝部位的抗原成分。按Burnet学说,由于这些抗原在胚胎期未曾与免疫系统发生过接触,故体内能与这些抗原起反应的免疫活性细胞未消失。在手术、外体或感染等性况下,隐蔽抗原释入血流或淋巴道与免疫系统接触,从而发生自身免疫。精子、眼晶状体、神经髓鞘磷脂碱性蛋白、某些器官、细胞(如甲状腺、胃壁细胞等)特异的微粒体抗原属此类型。实验证明,将眼晶状体或精子抗原注入动物自身体内,可诱发自身抗体。人体输精管结扎可形成抗自身精子的抗体以及眼球损伤后则可发生交感性眼炎。
(二)经改变的自身抗原
一系列生物、物理、化学因子均可使自身抗原成分改变以致引起自身免疫反应。微生物感染机体,破坏组织、细胞造成自身组织抗原改变,使之成为非已的物质而产生自身抗体。例如肺炎支原体感染可改变红细胞表面的Ⅰ血型抗原,产生抗红细胞的冷凝集素。又如在感染过程中,中性粒细胞吞噬细菌后释放出溶酶体酶,改变了自身IgG分子结构。这种变性的IgG可作为非已物质刺激机体产生抗IgG抗体,这种抗体主要是IgM,即类风湿因子。类风湿因子。类风湿因子在少部分正常人(老年人)中以及在很多慢性病患者体内均可发现,如梅毒、瘤型麻风、结核、乙型肝炎以及一些寄生虫感染。此外,溶酶体酶也可改变自身细胞表面抗原,使产生抗粒细胞抗体,引起粒细胞减少。
近年来人们注意到病毒感染与自身免疫的发生有密切关系,如风疹和乙型肝炎病毒感染后可发生血管炎和关节炎;巨细胞病毒和EB病毒感染可引起Coombs试验阳性的溶血性贫血;系统性红斑狼疮(SLE)患者血清中可测出抗麻疹病毒、EB病毒等抗体。
在病毒感染如乙型肝炎病人中还常发现抗核抗体、抗线粒体、抗平滑肌抗全等多种自身抗体。现已知病毒感染宿主时,在病毒进入细胞复制繁殖的过程中,病毒抗原能整合到宿主细胞表面,使宿主细胞膜抗原或组织相容性抗原、微丝肌动蛋白等成分发生改变。
化学药物引起自身抗原的改变也并不少见。如长期服用α-甲基多巴的患者中有10%~15%Coomba试验阳性,约有1%可发生自身溶血性贫血。这种病人在红细胞成熟过程中受药物影响改变了红细胞膜上的Rh系统的e抗原,产生抗红细胞抗体。又如长期服用肼苯达嗪、普鲁卡因酰胺、异烟肼等药物可引起红斑狼疮样综合症,常可测得抗核抗体。这些药物能与细胞内组蛋白或DNA结合,改变自身组织成分产生自身抗体。长期来观察到组织中损伤也可引起自身免疫反应,推测可能是由于组织抗原受到部分酶解,使天然分子中原处于隐匿部位的抗原决定簇暴露,被机体作为新抗株加以识别,这种看法有一定的实验根据,例如兔甲状腺球蛋白经胰酶消化处理后可使兔产生免疫反应,经白细胞蛋白酶消化的兔的甲状腺球蛋白也能引起兔的甲状腺炎。
(三)交叉抗原
某些微生物的抗原与自身组织成分有共同抗原性。因此在感染这些微生物后,机体所产生的抗体或致敏淋巴细胞对有关的自身组织也可产生免疫反应。如A组溶血性链球菌某些型别的胞壁抗原和胞浆膜抗原与人肾基底膜及心瓣膜成分相同,也与人心肌、骨骼肌、小动脉平滑肌相同,因此溶血性链球菌感染与风湿病和肾小球肾炎有密切关系(表16-1)。又如大肠杆菌O14与结肠粘膜有类似的抗原性,它与溃疡性结肠炎的发生有关。
最近研究注意到热休克蛋白(heat shock protein,HSP)或称应激蛋白(stress protein,SP)在诱导自身疫病发生中的作用。1926年Ritossa首先观察到正常果蝇暴露于高温后,其唾液腺染色体蓬松隆起。12年后,Tissieres等证实果蝇染色体遇热后的上述变化是由染色体内基因转录合成一种特定的蛋白质所致,遂提名为热休克蛋白。此后的研究发现,除温度外,各种应激因素,如感染、创伤、化学品等生物、理化因子、均可诱生这类蛋白合成增加,故又称应激蛋白。现知HSP存在于一切生物细胞,包括原核及真核细胞。按其分子量大小成分HSP90,HSP70,HDP60,小HSP四个家族,各含数个成员。HSP在进化上具有很大的保守性。因此其它物种来源的(各种病原体)HSP与人类的HSP(或其它抗原)有很大的相似性,或称分子模拟(molecularmimicry)。目前认为,感染诱导自身免疫病的重要原因之一是与HSP的参加有关。
表16-1 与人体组织起交叉反应的链球菌抗原
| 菌体抗原 | 细菌 | 人体组织抗原 | ||
| 组别 | 型别 | |||
| 细胞壁M蛋白 | A | 1,5,19,29 | 心肌 | |
| 胞壁蛋白-脂肪- | A | 心肌 | ||
| 糖复合物 | G | 除24型外 | 骨格肌 | |
| 胞壁多糖体 | A | 心瓣膜粘蛋白 | ||
| 胞膜糖蛋白 | A | 肾小球基底膜 | ||
| 细胞膜 | A | 12 | 组织相容性抗原 | |
至今研究最多的为HSP60家族的作用,该家族成员包括分子量60KD上下的多个蛋白质。微生物的HSP65(HSP60家族)是优势蛋白,感染该微生物的人体中有40%T细胞应答是针对这一蛋白质的。该蛋白质有仅与人类HSP60相当,而且已经检出至于少与人类19个已知自身抗原的氨基酸序列有相似性,并与相应自身免疫的发生有关。仅举数例列表(16-2)。
表16-2 HSP60与人自身抗原相似性
| HSP60区域 | 已知自身抗原 | 自身抗原区域 | 相似程度% | 有关疾病 |
| 1~17 | 髓过氧化物酶 | 594~610 | 60 | 肾小球肾炎 |
| 7~21 | 细胞色素P450 | 359~372 | 64 | 慢性活动性肝炎 |
| 65~75 | 甲状腺球蛋白 | 393~403 | 58 | 慢性甲状腺炎 |
| 86~100 | 肌凝蛋白重链 | 516~530 | 62 | 柯萨基心肌炎 |
| 101~123 | 细胞角蛋白 | 83~105 | 58 | 类风湿性关节炎 |
| 108~117 | DNA-结合蛋白 | 73~82 | 58 | SLE |
| 468~480 | 乙酰胆碱受体 | 133~145 | 63 | 重症肌无力 |
(四)非特异免疫细胞刺激剂
上述自身抗原仅激活相应抗原特异的淋巴细胞克隆。而非特异免疫细胞刺激剂,如佐剂、T、B细胞多克隆激活剂和近年来发现的超抗原,通过多克隆激活静止的自身反应性T、B细胞,促进自身免疫应答甚至自身免疫病的形成。福氏完全佐剂联合自身组织匀浆或已知纯化自身抗原被广泛用于诱发实验性自身免疫病的方法并获得满意结果。
二、机体因素
内因包括机体内的各种重要条件因素,相同外因作用下,内因条件不同,后果也不同。
(一)遗传因素
临床上早就发现自身免疫性疾病的发生有家族史倾向。在动物实验研究中陆续发现了几种自身免疫病的品(NZB、NAB/NAWF1小鼠OS来亨鸡等)进一步提示遗传与自身免疫病的关系。70年代以来,对人白细胞抗原(HLA)的研究有了很大的进展。发现HLA与某些疾病,特别是与某些自身免疫性疾病的发生密切相关。如患有强直性脊椎炎的病人中90%以上带有HLA-B27抗原。凡带有HLA-B8、DW3、DRW3单体型的人发生多种自身免疫病的危险性比带有其他型的人高得多。Addison病与B8、DR3有关,胰岛素依赖型糖尿病(又称型或青年型糖尿病)与B8、DR3、DDR4、DR3/4有关,类风湿关节炎与DR4有关。慢性甲状腺炎(Hashimoto病HLA-DR5有关。新近,人们对MHC与疾病关联的研究深入到了分子水平。糖尿病低抗者DQβ链第57位是天门冬酸,而易感者常出现丝氨酸、缬氨酸、丙氨酸。在NOD(nonobese diabetic)转基因小鼠中证实了上述结果。
利用小鼠胰岛素依赖型糖尿病(IDDM)模型研究发现,疾病发生受多基因控制。基因之一是与H-2K端相连锁。第二个糖尿病基因座在第9对染色体位于Thy-1与MDD1基因标志之间。通过返交试验发现易感动物至少有3个隐性致糖尿病基因。
遗传易感倾向并非绝对,疾病的外显率也受环境因素影响。
(二)机体免疫系统功能失常
统计数字表明体液或细胞免疫缺陷者自身免疫病的发生率高于正常随机人群。先天性或后天获得性低丙球蛋白血症者自身免疫病的发生率可高达14%,而正常人群(指无免疫缺陷)中的发生率为0,001~0.01%。细胞免疫缺陷常同时伴有肿瘤与自身免疫的高发现象。
胸腺功能不全、慢性病毒感染、增生性变化等与自身免疫的发生有关。SLE患者血清中胸腺激素含量下降,胸腺萎缩,试用胸腺素治疗曾观察到症状缓解。摘除胸腺对重症肌无力者有显著疗效。
(三)年龄、性别及内分泌的影响
临床观察老年人中自身抗体检出率增高,在60~70岁以上的老年人中有50%以上可以检出自身抗体。临床观察也发现自身免疫病多好发于妇女,据统计SLE患者,女性比男性多9倍以上。动物实验证实了性激素在自身免疫病发展中的作用。将雄性NZB小鼠进行阉割,可加速病变、病情加剧、寿命缩短。而雌性病鼠接受雄激素治疗则可延长寿命。
第三节 病理性自身免疫发生机制
目前认为上述诱因导致自身免疫的形成是通过多种机制而实现的。不同情况下由不同机制起主要作用,有时也可能由几种机制同时或先后起作用。
一、禁忌株突变
通过体细胞突变可能产生被Burnet称为禁忌的细胞株。使在正常情况下已遭克隆清除的自身反应性T.B细胞再现。
二、T、B细胞活化信号的出现
正常人体内存在一些自身反应性T.B细胞克隆,因缺乏足够的激活信号而处于无应答状态(失活或静止状态)。一旦获得足够的激活信号,便可产生正相应答。
现有实验证明,在某些自身免疫病中受累器官细胞表面,或是出现了原先不表达的DR/I-A抗原,或是DR/IA的抗原较原先表达增多。病毒感染导致自身免疫病的可能机制是通过机体释放的淋巴因子,如IFN-r和IL-1等。使得原先不表达MHC-Ⅱ类抗原的组织细胞出现DR/I-A抗原。同种免疫可以诱导出自身免疫,可能亦与此机制有关。例如造成GVH病动物体内角质细胞表面表达I-A抗原,I-A阳性T细胞增加。这些质和量改变的MHCⅡ类抗原可激发自身免疫反应。实验证明,注射抗H-21区抗原的抗体可预防或减弱小鼠实验性重症肌无力、脑脊髓和Ⅱ型胶原性关节炎等。
三、B细胞被多克隆激活
在T细胞处于耐受的情况下,用B细胞多克隆激活剂直接刺激B细胞,可导致自身抗体的产生。例如,给小鼠注射LPS与自身抗原并用,则可导致特异性自身抗体生成。甲状腺球蛋白与LPS合用可诱发抗甲状腺球蛋白特异抗体。
四、TH细胞旁路激活
此学说的基本观点是机体对某些自身抗原的耐受性仅是由于T细胞处于耐受状态,使B细胞缺少辅助信号而不能有效地活化。一旦通过旁路机制获取T细胞辅助信号,B细胞即可活化,产生自身抗体(图16-1,2)
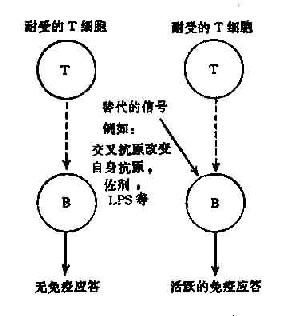
图16-1 T细胞旁路活化机制
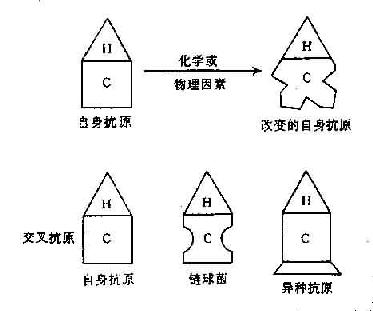
图16-2 破坏T细胞对自身抗原的耐受性
佐剂、病毒、细胞产物、以及某些药物具有非特异地激活T、B细胞的作用(多克隆激活),它们诱发自身免疫的机制可能就是通过替代因子的旁路作用,绕过耐受的T细胞,使B细胞活化。
T细胞旁路机制不但可诱导自身抗体生成,也能引起细胞介导的自身免疫性损伤,如实验性变态反应性脑脊髓炎。甲状腺炎等。
五、自身反应克隆脱抑制
TS细胞能抑制自身反应细胞的激活,TS细胞数量或功能降低,TH和(或)TCS细胞数量增多或活跃,使自身反应细胞发生脱抑制而功能亢进,都可导致自身免疫的发生。
早期系统的实验资料曾对SLE样综合征自发品系NZB及NAB/NZW小鼠自出生后逐月进行免疫功能检测。从时间顺看,这种动物体内最早出现的是T细胞调节功能紊乱,约在出生后1个月,动物血清中胸腺激素活性下降,TS细胞功能减退。T细胞对诱导免疫耐受呈抵抗,然后再出现B细胞功能亢进。接近3月龄时,血清中才出现抗核抗体、抗淋巴细胞表面抗体及其他抗血细胞抗体等多种自身抗体。
受动物实验启示,临床免疫工作者测定各种自身免疫病患者外周血T细胞亚群变化,也发现类似变化。应用抗T细胞分化抗原单克隆抗体测定时,发现SLE和类风湿关节炎患者在病性活动期,TS细胞比例下降,用Con A在体外刺激病人淋巴细胞不诱发非特异的TS细胞。
六、独特型网络激活
独特型-抗独特型的相互作用极为复杂。在不同的条件下,对自身免疫产生不同的调节作用,有时抑制(自身耐受),有时增强。外来或体自身抗原均可通过此网络活化而造成自身免疫。根据独特型网络的基本理论,有以下几种可能性(图16-3):
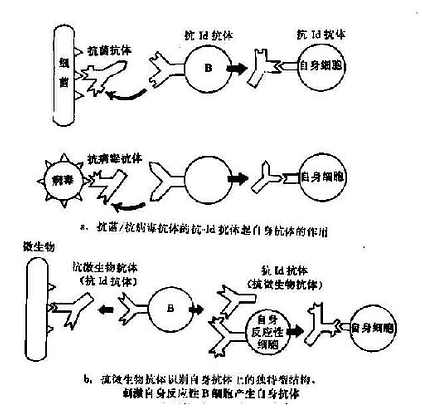
图16-3 独特型相互作用形成自身免疫
1.针对抗原(细菌、病毒、激素等)所产生的抗体,具有与自身细胞膜抗原相似或相同的决定簇,故其所激发的抗独特型抗体能与自身细胞表面抗原结事(图16-3a)。已有实验证据揭示这种可能性的存在,如小鼠注射胰岛素后所产生的抗体能进一步诱发生成抗独特型抗体。这种抗体不仅能与激发抗体结合,也能与胰岛素受体结合,造成胰岛素抵抗型糖尿病。
2.抗微生物抗体本身可能就是一种抗自身抗体的抗独特型抗体,它能激活具有独特表位的自身的反应性B细胞(图16-3b)。
第四节 自身免疫性疾病
一、自身免疫性疾病的基本特征
自身免疫性疾病往往同时具有以下特点:①患者血液中可测行高效价自身抗体和(或)自身组织成分起反应的致敏淋巴细胞。②自身抗体和(或)自身致敏淋巴细胞作用于靶抗原所在组织、细胞,造成相应组织器官的病理性损伤和功能障碍。换句话说,患者组织器官损伤的范围取决于自身抗体或致敏淋巴细胞所针对的自身抗原分布格局。③在动物实验中可复制出相似的病理模型,并能通过患者的血清或淋巴细胞使疾病被动转移。④病情转归与自身免疫反应强度密切相关。⑤除一些病因明了的继发性自免疫性疾病可随原发疾病的治愈而消退外,多数原因不明的自身免疫常呈反复发作和慢性迁延。⑥疾病的发生有一定的遗传倾向。
二、自身免疫性疾病的分类
自从60年代初公认存着自身免疫性疾病以来,现已确认属于这种类型的疾病有30余种,其分类方法主要有二。其一是按疾病累及的系统区分(表16-3);其二是按器官特异性分为两类(表16-4)。
表16-3各系统自身免疫病
| 不同系统疾病 | 自身免疫病举例 |
| 结缔组织疾病 | 类风湿关节炎、系统性红斑狼疮、皮肌炎、硬皮病 |
| 神经肌肉疾病 | 多发性硬化症、重症肌无力、脱髓鞘疾病 |
| 内分泌性疾病 | 原发性肾上腺皮质萎缩、慢性甲状炎、青少年型糖尿病 |
| 消化系统疾病 | 慢性非特异性溃疡性结肠炎、慢性活动性肝炎、恶习性贫血与萎缩性胃炎 |
| 泌尿系统疾病 | 自身免疫性肾小球肾炎、肺肾出血性综合症 |
| 血液系统疾病 | 自身免疫性溶血性贫血、特发性血小板减少性紫癜、特发性白细胞减少症 |
图16-4 两类常见的自身免疫病及其相应的自身抗原
| 自身免疫病 | 自身抗原 |
| 器官特异性自身免疫病: | |
| 慢性甲状腺炎 | 甲状腺球蛋白、微粒体、细胞膜表面抗原、第二胶质抗原(CA2) |
| 毒性弥漫性甲状腺肿(Graves病) | 甲状腺细胞表面TSH受体 |
| 原发性肾上腺皮质萎缩( Addison病) | 肾上腺细胞 |
| 恶性贫血 | 胃壁细胞、内因子 |
| 慢性溃疡性结肠炎 | 结肠上皮细胞 |
| 男性自了性不育症 | 精子 |
| 青少年型胰岛素依赖性糖尿病 | 胰岛细胞 |
| 伴共济失调-毛细血管扩张的胰岛素低抗型糖尿病 | 胰岛素受体 |
| 重症肌无力 | 乙酰胆碱受体 |
| 自身免疫性溶血性贫血 | 红细胞 |
| 特发性血小板减少性紫癜 | 血小板 |
| 干燥综合征(Sjogrens syndrome) | 唾液腺管、细胞核、甲状腺球蛋白 |
| 非器官特异性自身免疫病: | |
| 类风湿关节炎 | 变性IgG |
| 系统红斑狼疮 | 核成分(DNA、DNA-核蛋白、RNA、Sm抗原)、红细胞、血小板、细胞浆成分(线粒体、微粒体) |
三、自身免疫病组织损伤机制
已有大量的资料证明,自身免疫病理损伤是由自身免疫应答的产物包括自身抗体和(或)自身致敏淋巴细胞引起的,后者造成病理损伤的机制与各型超敏反应相同(表16-5),以Ⅱ型至v型多见。Ⅱ型超敏反应中,自身抗体与细胞膜或基底膜自身抗原结合,在膜表面形成免疫复合物。后者通过结合并激活补体链锁反应,在膜表面出现补体活化反应产物C56789,对膜产生破坏性攻击,造成靶细胞裂解或基底膜损伤。此外覆盖免疫复合物的靶细胞被吞噬细胞加速吞噬(免疫调理)以及K细胞进行非天噬性杀伤。Ⅲ型超敏反应中,自身抗体与自身抗原在血循环中相遇,形成免疫复合物,在一定的物件下,沉积于相应部位的组织间隙。局部免疫复合物结合并激活补体,补体活化反应产物导致局部发生炎症反应。N型超敏反应中,自身致敏淋巴细胞攻击局部靶组织,造成局部炎症。V型超敏反应则由自身抗体结合并刺激靶细胞,使其功能亢进。
表16-5 自身疫应答产物造成病理损伤的机制(举例)
| 自身免疫病 | 自身免疫应答产物 | 超敏反应类型 | 病损特征 |
| (Goodpasture综合症) | 抗肾小球,肺泡基底膜N胶原 | Ⅱ | 肾炎,伴蛋白尿、肺出血 |
| 自身免疫性溶血性贫血 | 抗红细胞膜蛋白抗体 | Ⅱ | 溶血 |
| 自身免疫性血小板减少性紫癜 | 抗血小板膜蛋白、如gpⅡb/Ⅲa抗体 | Ⅱ | 血小板破环,减少 |
| 重症肌无力 | 抗神经肌肉接头处乙酰胆碱受体的抗体和自身致敏淋巴细胞 | Ⅱ.Ⅳ(?) | 乙酰胆碱受体破坏,神经冲动传递低下,肌无力 |
| 类风湿性关节炎 | 抗IgG抗体(类风湿因子)抗HSP致敏淋巴细胞(?) | Ⅲ.N(?) | 关节腔炎症 |
| 系统性红斑狼疮 | 抗DNA、核蛋白、各种血细胞膜抗原等抗体 | Ⅱ. Ⅲ | 血细胞减数,多部位(肾、关节、血管)炎症 |
| 实验性变态反应性脑脊髓炎 | 抗髓碱性蛋白之自身致敏T细胞 | Ⅳ | 脑脊髓炎症 |
| 实验性变态反应性神经炎 | 抗外周鞘碱性蛋白之自身致敏T细胞 | Ⅳ | 神经炎 |
| 某些自身免疫性甲状腺炎 | 抗甲状腺滤泡上皮细胞之致敏T细胞 | Ⅳ Ⅳ |
甲状腺炎 |
| 甲状腺功能亢进 | 抗TSH受体抗体 | Ⅴ | 甲状腺细胞分泌甲状腺素增加 |
第五节 自身免疫病治疗原则
自身免疫病的治疗尚缺乏理想的方法。通常针对疾病的病理变化和组织损伤所致的后果进行治疗,也可通过调节免疫应答的各个环节阻断疾病进程来达到治疗的目的。
(一)抗炎药物
大剂量皮质激素的应用可有效地抑制一些重症自身免疫病所致的炎症反应。其它抗炎药物如水杨酸制剂、各种合成的前列腺素抑制剂等也广泛采用。淋巴因子和补体的拮抗剂亦有利于抑制炎症反应。
(二)免疫抑制剂
环孢素A(cycrosporinA)是目前一种广为推荐的免疫抑制剂,它是一种不溶性的真菌代谢产物,能有效地抑制T细胞介导的细胞免疫反应。对T细胞的作用主要是抑制某些基因特别是IL-2基因的转录,从而阻断IL-2的合成和分泌,使T细胞的扩增和分化受阻。它还能抑制c-myc和IFN-γ基因的转录,后者对于T细胞的活化和扩增也有影响。环孢素A是一种兼有抗有丝分裂和抗炎效应的免疫抑制剂。已证实它对眼色素层炎、早期Ⅰ型糖尿病、肾病综合症、牛皮癣等有较好的疗效,对特发性血小板减少性紫癜、系统性红斑狼疮、多发性肌炎、Crohn病、原发性胆汁性肝硬化、重症肌无力症、类风湿性能关节炎均有一定的治疗效果。FK-506是继环孢素A后发现的另一种真菌代谢物,其结构与环孢素A不同,但它的作用与环孢素A极为相似。FK-506应用剂量较低,故其副作用较小。其它的抗有丝分裂的非特异性免疫抑制剂如硫唑嘌呤、环磷酰胺、环磷酰胺、氨甲喋呤常与皮质激素联合应用作为常规免疫抑制剂治疗一些自身免疫病。
(三)免疫调节
它是根据调节免疫应答规律以达到阻断自身免疫过程提出的一种治疗设想。包括下列的一些措施。
1.清除或使某些免疫活性细胞失活实验研究发现,体内应用抗MHCⅡ分子与抗CD4单克隆抗体,可减轻系统性红斑狼疮和类风湿性关节炎的发展。
2.独特型的抑制
(1)抗体的调控抗独特型抗体在调节外来抗原诱发的抗体生成起重要作用,它可能对自身抗体的生成起抑制作用。
(2)T细胞疫苗 给动物注射髓鞘碱性蛋白特异的碱活T细胞克隆(亚致病剂量),能有效地预防实验性变态反应性脑脊髓炎的发生。这可能是通过诱导生成针对效应T细胞受体独特型的抑制性T细胞所致。
(3)抗原封阻或清除相应的自身反应性淋巴细胞已有实验证明,赃与自身抗原类似的多肽片段,同自身抗原竞争性地结合到抗原呈递细胞的MHC分子上,阻断自身抗原诱发的T细胞应答,达到治疗自身免疫性变态反应性脑脊髓炎的效果。也有使用导向技术,将各处毒素或放射性物质偶联到自身抗原上,以此偶联物选择性地杀灭特异的自身反应性淋巴细胞。此外,有人致力于研究出针对自身抗原特异的抑制因子提供临床使用。
(四)血浆置换
此疗法的目的在于降低自身免疫病人血浆中的免疫复合物的含量,减轻免疫复合物在组织中沉积。对于是治疗有生命威胁的免疫复合物所致的血管炎、系统红斑狼疮、肺肾出血性综合征等有一定的治疗效果。若与抗有丝分裂的药物联合应用不着,疗效更佳。
(五)对症治疗
通常在治疗某些器官特异性的自身免疫病时,祗需调整器官损伤所造成的代谢障碍,即可达到控制病情的效果。如自身免疫性甲状腺炎的粘液性水肿患者可采用甲状腺替代疗法,青年型糖尿病患者用胰岛素控制血糖,恶性贫血患者用维生素B12,甲状腺功能亢进者用抗甲状腺药物等。
第十七章 免疫缺陷
免疫缺陷病是免疫系统中任何一个环节或其组分因先天发育不全或后天因各种因素所致损害而使免疫活性细胞的发生发展、分化增殖和代谢异常并引起免疫功能不全所出现的临床综合症。病种已达数十种之多,发病机制甚复杂。
免疫缺陷病已成为临床上一组极重要常见病,尤多见于儿科和内科。自1981年美国报道第一例获得性免疫缺陷综合症(acguried immunodeficiencysyndrome,AIDS,艾滋病)以来,获得性免疫缺陷的重要性已远远超出了医学领域。
由于实验技术的进步,75%以上的免疫缺陷病已可确诊,但有些免疫缺陷病的发病机制仍不甚清楚。治疗手段除抗感染等常规方法外,根据病因,补充酶或免疫球蛋白、骨髓移植、基因治疗等新技术正在应用和完善中。
第一节 免疫缺陷病的分类
多数学者倾向于将免疫缺陷病分为先天性或原发性免疫缺陷病和后天的或获得性免疫缺陷两大类型。
一、原发性免疫缺陷病
该类免疫缺陷病是免疫系统先天性发育不全所致,根据所累及的免疫细胞或组分可以是特异性免疫缺陷,如B细胞或T细胞缺陷、两者联合缺陷等;也可以是非特异性效应机制的缺陷,如补体或中性粒细胞缺陷。
(一)抗体缺陷病
是B细胞发育和(或)功能异常所致,约占原发性免疫缺陷病的50%~70%,其中以各类免疫球蛋白(immunglobulins,lgs)均缺少的低丙球蛋白血症和某一类lg选择性缺陷最为常见(表17-1)。
表达式7-1 原发性免疫缺陷病
| 分类 | 占原发性免疫缺陷病% | 代表性疾病 |
| 特异性免疫 | ||
| 1.B细胞缺陷 | 50%~75% | 性联低丙球蛋白血症、选择性IGA、IgM或IgG亚类缺陷、IgM升高的免疫球蛋白缺陷、Ig重链缺失、常见的可变的免疫缺陷 |
| 2.T细胞缺陷 | 5%~10% | 先在性胸腺发育不全、与嘌呤核苷磷酸化酶缺乏有关的T细胞缺陷、与膜糖蛋白缺乏有关的T细胞缺陷、与MHCⅠ或Ⅱ类抗原缺乏有关的T细胞缺陷 |
| 3.B和T细胞缺陷 | 10%~25% | 严重联合免疫缺陷、共济失调毛细胞血管扩张、Wiskott-Aldrich综合症 |
| 非特异性免疫 | ||
| 1.吞噬细胞缺陷 | 1%~2% | 慢性肉芽肿病、白细胞粘附缺陷、6-磷酸葡萄糖脱氢酶缺陷、髓过氧化物酶缺陷 |
| 2.补体缺陷 | <1% | 补体1~9任一组分的缺陷、C1-抑制物缺乏、D或H或1因子缺乏、补体受体缺陷 |
(二)T细胞缺陷病
因胚胎期胸腺发育不全致使T细胞数目减少或功能障碍所致,占原发性免疫缺陷病的5%~10%。DiGeorge综合症或先天性胸腺发育不全是该类免疫缺陷病的代表。
(三)T和B细胞联合免疫缺陷病
因T和B细胞发育异常引起体液和细胞免疫均缺陷,约占原发性免疫缺陷病的10%~25%。其中因骨髓造血干细胞缺损所致的严重联合免疫缺陷病最为典型和严重。
(四)吞噬细胞缺陷病
因中性粒细胞或单核细胞或巨噬细胞(Mφ)吞噬功能障碍引起,相对发病率约1%~2%。吞噬功能至少包括吞噬细胞粘附于血管内皮、通过组织移行至炎症部位、吞噬已调理的颗粒和在胞内杀死摄入的微生物四个步骤。慢性肉芽肿病是由于吞噬细胞缺乏能杀灭所吞微生物的酶所致。
(五)补体系统缺陷病
补体是人血清中一组具有重要非特异性免疫功能的蛋白质,由9个成分组成。临床上可见与各种单一补体组分缺陷、补体掐制物缺陷、补体活化中某些因子缺陷及补体受体缺陷有关的病征。
二、继发性免疫缺陷病
造成继发性免疫缺陷的原因很多很复杂,除人类免疫缺陷病毒(humanimmunodeficiency virus,HIV)所致的AIDS外,更常见的继发性免疫缺陷从病原学分析可归成两类:
(一)其它疾病过程中合并的免疫抑制
营养不良、肿瘤和感染是引起继发性免疫缺陷的三大因素
1.营养不良蛋白质、脂肪、维生素和矿物质摄入不足影响免疫细胞的成熟、降低机体对微生物的免疫应答。
2.肿瘤肿瘤病人因细胞和体液免疫损而易患感染,如Hodgkin病患者常对皮内注入破伤风类毒素等抗原无DTH反应,其他淋巴细胞在体外对多克隆隆刺激剂无增殖应答等。
3.感染各种类型的感染特别是病毒感染可导致免疫抑制。麻疹病毒和人类亲淋巴细胞病毒(human Tlymphotropic virus-1,HTLV-1)感染CD4+细胞。HIV和HTLV-1使TH细胞恶变为成熟T细胞白血病/淋巴瘤。结核杆菌和许多真菌的慢性感染常导致免疫缺陷。寄生虫感染如非洲慢性疟疾感染儿童其T细胞功能受抑制并可能与EB病毒引起的恶性肿瘤的发生有关。
(二)因治疗其它疾病而合并的免疫缺陷
因为治疗炎症性疾病或预防移植排斥目的而使用杀死或灭活淋巴细胞的免疫抑制剂是最常见的原因,如激素和环孢菌素A等。化辽药物对成熟的和非成熟的淋巴细胞、粒细胞和单核细胞前体均有细胞毒性,故化疗病人常伴有免疫抑制。放射治疗也有同样副作用。
另外手术、创伤、烧伤和脾切除等均可引起继发免疫缺陷。
第二节 免疫缺陷病的一般特征
一、感染
对各种感染的易感性增加是免疫缺陷最主要、最常见和最严重的表现和后果,感染也是患者死亡的主要原因。患者年龄越小,感染频率越高,病性也越重。感染可表现为反复的或持续的,急性的或慢性的。两次感染之间无明显间隙。感染的部位以呼吸道最常见。感染的性质主要取决于免疫缺陷的类型,如体液免疫、吞噬细胞和补体缺陷时的感染主要由化脓性细胞如葡萄球菌、链球菌和肺炎双球菌等引起。临床表现为气管炎、肺炎、中耳炎、化验室脓性脑膜炎和脓皮病等。细胞免疫缺陷时的感染主要病毒、真菌、胞内寄生菌和原虫等引起。
免疫缺陷者体内正常菌群及空气、土壤和水中无致病力或致病力很弱的微生物,如大肠杆菌、绿脓杆菌、变形杆菌等均十分易感,这类型感染称为机会性感染。
二、恶性肿瘤
世界卫生组织(WHO)报告,原发性免疫缺陷尤以T细胞免疫缺陷者恶性肿瘤的发病率比同龄正常人群高100~300倍,以白血病和淋巴系统肿瘤等居多。
三、伴发自身免疫病
原发性免疫缺陷者有高度伴发自身免疫病的倾向,正常人群自身免疫病的发病率约0.001%-0.01%,而免疫缺陷者可高达14%,以SLE、类风湿性关节炎和恶性贫血等较多见。
四、多系统累和症状的多变性
在临床和病理表现上,免疫缺陷是高度异质性的,不同免疫缺陷由免疫系统不同组分缺陷引起,因此症状各异,而且同样疾病不同患者表现也可不同。免疫缺陷时可累及呼吸系统、消化系统、造血系统、内分泌系统、骨关节系统、神经系统和皮肤粘膜等,并出现相应功能障碍的症状。
五、遗传性倾向性
多数原发性免疫缺陷病有遗传倾向性,约1/3为常染色体遗传,1/5为性染色体隐性遗传,15岁以下原发性免疫缺陷病患者,>80%为男性。
六、发病年龄
约50%以上原发性免疫缺陷从婴幼儿开始发现,如DiGeorge综合征出生后24~48小时发病,严重联合免疫缺陷病出生6个月内发病,性联低丙球蛋白血症始于生后6~8个月。年龄越小病情越重,治疗难度也较大。
第三节 常见的原发性免疫缺陷病
一、B细胞缺陷性疾病
由于血清Ig测定的常规化,故先天性抗体产生缺陷病免疫学诊断较易。
(一)性联低丙种球蛋白血症
首例病于1952年由Bruton报道,故亦称Bruton低丙种球蛋白血症,为最常见的先天性B细胞免疫缺陷病。
患儿血清Igs水平很低或测不出,外周血和淋巴组织中b 细胞减少或缺乏,淋巴结中无生发中心,组织中无浆细胞。前B细胞虽VDJ重排及μ链产生正常,但轻链基因的重排和表达有缺陷,因此前B细胞不能成熟为sIgM阳性B细胞。而患儿T细胞的成熟、数目及功能基本正常。
该病由在一条X 染色体上携带有缺陷基因但表现型正常的母亲传给其子。该基因座位于X染色体长臂q21.3 ~22区带。已证明,该病并非由X染色体上单一基因的缺陷而是多基因异常的结果。
患儿有结膜、咽、皮肤、中耳、气管和肺部反复化脓性感染,但对胞内寄生菌和真菌感染反应正常。Lgs制剂治疗有效。
(二)选择性免疫球蛋白缺陷
1.选择性IgA缺陷 是最常见的一种选择性Ig缺陷。发病率约1/700,常染色体显性或陷性遗传。但有些病人则是胚胎期风疹病毒感染或接触药物造成,血清IgA水平<50μg/M1,IgM和IgG水平正常或略高。表达IgA的B细胞不能分化成分泌抗体的浆细胞,但α链基因和膜IgA表达均正常。
2.选择IgM缺陷 大多由B细胞分化异常引起,其IgM抗体多属自身抗体,能与自身细胞对TH细胞的刺激无反应。
3.选择性IgG亚类缺陷 大多由B细胞分化异常引起,少数因不同恒定区基因缺失所致。
4.IgM升高的IgG和IgA缺陷 为性联遗传病,其IgM抗体多属自身抗体,能与自身血细胞反应。病人IgG和IgA重链转换有障碍。
二、T细胞缺陷性疾病
(一)DiGeoge综合症(先天性胸腺发育不良)
此先天性选择性T细胞缺陷系妊娠早期第三、四咽囊发育障碍,致使胸腺、甲状旁腺、主动脉弓、唇和耳等发育不良。因T细胞不能成熟而致细胞免疫缺陷、低血钙、肌肉颤搐,大血管和面部畸形等。血中T细胞缺乏或大量减少,但抗体水平基本正常。患者对胞内寄生菌、病毒和真菌易感。胚胎胸腺移植有效,但T细胞可能在胸腺外组织中成熟,故随年龄增长病性可自然缓解,5岁前常可恢复正常。无胸腺的裸鼠是T细胞选择性缺陷的天然动物模型。
(二)T细胞活化和功能缺陷
近年才有此方面报道,其机制可能有:T细胞受体(TCR):CD3复合物表达缺陷;TCR:CD3复合物信号传导异常;IL-2和IFV-γ等细胞因子产生缺陷;IL-2或IL-1受体表达缺陷。
三、T和B细胞联合缺陷性疾病
(一)严重联合免疫缺陷
严重联合免疫缺陷病(severe combined immunoideficiencydisease,SCID)是因干细胞分化缺陷而表现T、B细胞减少,体液和细胞免疫均缺陷。出生6个月起发病,对各种类型感染均易感。
SCID有性联隐性和常染色体隐性两种遗传方式,后者首例病人在瑞士发现,故也称Swiss型低丙种球蛋白血症。
约20%SCID由腺苷脱氨酶(adenodine deaminase,ADA)缺陷引起,ADA催化腺苷和脱氧腺苷脱氨而分别成为肌苷和2-脱氧肌苷。位于2号染料色体上的ADA基因缺失或突变则引起ADA缺陷。ADA分布极广,在淋巴细胞中尤丰富。ADA缺乏导致脱氧腺苷和脱氧三磷酸腺苷蓄积在胞内特别是淋巴细胞内,这两种代谢产物对淋巴细胞具有毒性,它们能抑制核糖核苷酸还原酶活性而阻碍DNA合成。
ADA基因已克隆出,可将有功能ADA基因转染入自身骨髓细胞并将它们回输病人以达到治疗目的。
少数常染色体隐性遗传SCID由位于第14号染色体上的嘌呤核苷磷酸化酶(purine nucleosidephosphorylase,PNP)基因缺失或突变所致,PNP将肌苷和鸟苷分别催化成次黄嘌呤和鸟嘌呤,PNP缺乏导致有毒性的脱氧鸟苷和脱氧三酸鸟苷蓄积在胞内。
最近发现,MHCⅡ类基因表达缺陷也可引起常染体隐性遗传性SCID,称为裸淋巴细胞综合症。患者B细胞、Mφ和树突状细胞上不表达或很少表达HLA-DP、DQ和DR抗原。此缺陷是一种DNA-结合蛋白异常引起MHCⅡ类基因转录降低,因而抗原不能呈递给CD4+细胞。
HLA匹配同胞骨髓移植可获免疫重建,也有用9周以下的胚肝和14周以下的胚胎胸腺移植进行治疗的。
SCID突变品系CB-17小鼠有T细胞受体和Ig基因重排及表达缺陷,但人类尚未证实这种缺陷所致的SCID。
(二)Wiskott-Aidrich综合症
为性联隐性传缺病。以湿疹、血小板减少和感染(有荚膜化脓菌为主)三联症为特点。引起本病的基因位于X染色体短臂P11.1区带。患者膜蛋白糖苷化障碍,故CD43等表达间障碍。随年龄增长,病情加重,淋巴瘤发病率增加。胸腺移植和胸腺因子治疗可达到完全或部分免疫重建。
(三)共济失调毛细血管扩张症
共济失调毛细血管扩张(ataxia-telangiectasia)为多系统异常病,神经、血管、内分泌和免疫系统均被累及。现为共济失调、毛细血管扩张、鼻窦和呼吸道反复感染。多在2岁前发病,40%以上病人有选择性IgA缺陷。随年龄增长病性加重、并发肿瘤和自身免疫病增加,如45%患者伴发非何杰金淋巴瘤。该病可能与多基因缺陷有关,DNA修复机制也有缺陷,24%病人14号染色体有异常。
四、吞噬细胞缺陷病
(一)慢性肉芽肿病
慢性肉芽肿症(chronicgranulomatous disease,CGD)约2/3为性联隐性遗传,1/3为常染色体隐性遗传。由遗传和生物化学研究表明,CGD有三种类型:有细胞色素b缺陷的性联CGD;细胞色素b正常的常染色体遗传CGD和细胞色素b缺陷的常染色体遗传CGD。
CGD患者的中性粒细胞和单核细胞吞噬细菌后不能产后呼吸爆发,不能杀灭摄入的致病菌。辅酶Ⅱ(nicotinamideadenine dinucleotide phosphate, NADPH)氧化酶是呼吸爆发中的关键酶,它能将氧(O2)转变成过氧化物(O2-)。细胞色素是b氧化型NADPH组分之一,性联CGD患者中性粒细胞色素b缺陷故不能产生具有杀菌作用的过氧化物。细胞色素b为由91和22kD组成的异二聚体,大多性联CGD病人编码91kD链的基因有缺陷,该基因位于X染色体P21区带。最近发现NADPH氧化酶中的47kD和67KD组分的缺陷与常染色体遗传CGD也有关。
患者对低毒力的过氧化氢酶阳性菌如葡萄球菌、大肠杆菌等易感,淋巴结、皮肤、肝、肺、骨髓等有慢性化脓性肉芽肿,肝脾肿大。患者白细胞四唑氮蓝(nitrovlueterazoliu,NBT)试验阴性有助诊断。
(二)白细胞粘附缺陷
白细胞粘附缺陷(leukocytead hesion deficiency,LAD)者有细菌和真菌反复感染,伤口难愈。依赖于粘附作用的白细胞功能有异常,如粘附于内皮细胞、中性粒细胞聚集和趋化、吞噬、细胞毒作用等。与白细胞粘附于其它细胞及吞噬作用有关的β2整合素或CD11-CD18家族包括白细胞功能相关抗原-1即CD11a-CD18、Mac-1(CD11b-CD18)和p150,95(CD11c-CD18)表达缺陷,病人大多有95kDβ链(CD18)的缺陷。骨髓移植和基因治疗有效。
(三)Chediak-Higashi综合征
为常染色体隐性遗传病,有反复化脓菌感染、眼、皮肤白化病和各器官有淋巴细胞浸润。中性粒细胞、单核细胞和淋巴细胞含巨大胞浆颗粒,白细胞和单核细胞的溶酶体、黑素细胞、神经系统细胞和血小板均被殃及。引起胞浆颗粒融合失控的分子机制尚不明。
五、补体缺陷病
补体1~9任一组分、补体调节因子以及补体受体都可以发生缺陷。C3对于经典和旁路补体活化途径都是至关重要的。C4一个等位基因的缺失较常见。补体调节因子中C1抑制物(C1-inhibitor,C1-INH)缺陷最常见,C1-INH缺陷引起遗传性血管神经性水肿。患者皮下和粘膜下组织反复水肿。喉头水肿可致窒息死亡。C3受体缺陷儿童不能表达3种CD11膜蛋白,这3种蛋白的a链各异(C11a,b和c),但β链相同(CD18),它们是粘合素分子促进粘附的成分,参见白细胞粘附缺陷部分。
第四节 继发性免疫缺陷病
很多原因都可导致继发性免疫缺陷,但本节只讨论由人类免疫缺陷病毒(HIV)引起的获得性免疫缺陷综合症(AIDS)。
一、流行性况
自从1981年发现首例AIDS患者以来,现已在全世界广泛流行。美国疾病控制中心报告,1992年每100个男性公民和每800个女性公民中各有1人已感染了HIV。仅1992年内美国HIV新感染者妁达4~8万例。就全世界而言,约每13秒钟就有1个新感染者,每9分钟有1人死于AIDS。到2000年,全世界HIV感染者将达3000万~1亿,其中儿童约1000万。据WHO估计,1993年中,感染HIV的青年和成年人已达1300万,其中非洲撒哈拉800多万,北美和西欧150多万,拉丁美洲和加勒比海150万。北非和中东7.5万,东欧和中亚5万。现在感染人数上升最多最快的是亚洲特别是南亚和东南亚,如在泰国,求医的性病患者中,HIV感染率从1989年的0%上升到1992年的6%;到1992年底,在做泰国一般人群中HIV感染在北方地区为4%,印度HIV感染者增加也相当快。我国HIV感染者已达1000多人,主要集中在云南边境地区。WHO估计,到2000年,全世界HIV新感染者90%将在发展中国家。
在全世界的HIV主要是HIV-1。但在非洲特别是西非已从AIDS病人中分离出几株HIV-2,欧洲、南美和美国等也有HIV-2。临床表现为胃肠症状、神经系统疾病和免疫缺陷。克隆和序列分析表明,HIV-1和HIV-2之间的差别在55%以上,抗HIV-2抗体与HIV-1的Gag和PoI蛋白及猴免疫缺陷病毒均有交叉反应。
二、传播方式
AIDD为传染性性病,其传播方式主要有三,其中以性接触最具重要性。
(一)性接触
1.同性恋和(或)双性恋约占70%病例。男同性恋者HIV感染率甚高,尤以有色人种居多。HIV感染者精液中的HIV经直肠粘膜传给健康的同性性伴。
2.异性恋 约占4%病例。精液中的HIV感染细胞与子宫腔中Mφ、淋巴细胞、上皮细胞相互作用而使女方感染。阴道分泌物中的HIV感染细胞能将HIV传给男性尿道口中的Mφ、淋巴细胞、上皮细胞相作用而使女方感染。阴道分泌物中的HIV感染细胞能将HIV传给男性尿道品口中的Mφ或淋巴细胞。
现已证实,任何一方生殖器溃疡性疾病都能增加经性接触传播HIV的危险性。
(二)注射途径
1.输血 约占2.5%病例。HIV感染者的血液、血浆中的游离HIV特别是病毒感染血细胞可使受血者被感染。在发达国家,HIV的检测已成为输血前的常规。但接解尚未能测出抗-HIV抗体的新近HIV感染者的血液仍有传染HIV的危险,因HIV感染后1周~3个月才能测出相应抗体。
2.血制品 约占1%病例。输注带有或污染有HIV的人血清白蛋白、Igs和抗凝血因子等可染上HIV。我国已有数例血友病人因注射进口抗凝血因子浓缩物而感染HIV。
3.静脉毒瘾者因共用污染有HIV的针头和注射器而被感染约占18%病例。有的国家经静脉注射毒品而患AIDS的病人占总AIDS病例的1/3~2/3。曼谷静脉“吸”毒者HIV阳性(HIV(+))率达40%以上。我国云南边境HIV(+)者也多以此途径被染。在医院中使用未灭菌针头或污染HIV的器具而使病人被动感染HIV以及医务人员被染有HIV的针头扎破皮肤感染的例子均已有报道。
(三)母婴垂直传播
HIV可经胎盘和母乳传递给下一代。
HIV感染者各种体液中大多能分离出游离HIV或感染细胞(表7-2)。
表17-2 HIV感染者体液中HIV和感染细胞染细胞的检出率
| 体液 | 标本数 | 阳性标本数 | 阳性率 | 感染颗粒数/ML(感染细胞%) |
| 无细胞体液中游离病毒 | ||||
| 血浆 | 43 | 100% | 1~500 | |
| 泪液 | 5 | 2 | 40% | <1 |
| 耳分泌物 | 1 | 12.5% | 5~10 | |
| 唾液 | 55 | 3 | 5.5% | <1 |
| 汗 | 2 | 0% | - | |
| 粪便 | 2 | 0% | - | |
| 尿 | 5 | 1 | 20% | <1 |
| 阴道和宫颈液 | 16 | 5 | 31.3% | <1 |
| 精液 | 15 | 5 | 33.3% | 10~50 |
| 乳汁 | 5 | 1 | 20% | <1 |
| 脑脊液 | 40 | 21 | 52.5% | 10~1000 |
| 体液中感染细胞 | ||||
| 外周血单个核细胞 | 96 | 93 | 96.6% | 0.001~0.1% |
| 唾液 | 11 | 4 | 36.4% | <0.01% |
| 支气管液 | 24 | 3 | 12.5% | 未测 |
| 阴道和宫颈液 | 16 | 7 | 43.8% | 未测 |
| 精液 | 28 | 11 | 39.3% | 0.01%~5% |
三、HIV的致病机制
(一)HIV的基因及基因产物的主要功能
HIV于1983年首次分离出,但它是生物理学医学研究得最广泛的一个病毒。所分离出的大量HIV已进行了克隆和序列分析。HIV的基因及其表达产物已得到鉴定(表17-3),
表17-3 HIV基因、蛋白质产物及戎功能
| 基因名称 | 蛋白质产 物大小(KD) | 功能 |
| Gag | P25(p24) p17 |
衣壳结构蛋白质基质蛋白质 |
| Pol(多聚酶) | P55,p63 | 逆转录酶(RT),Rnase,H |
| pR(蛋白酶) | P15 | 病毒蛋白转录后加工 |
| IN(整合酶) | P11 | HIV,cDNA整合 |
| env | g120, gp41(gp36) |
HIV,cDNA整合 包膜表面蛋白质 包膜表面蛋白质 |
| Tat | P14 | 结合到病毒LTR序列并激活病毒所有基因的转录 |
| Rev | P19 | 调节病毒mRNA的表达,为gag和env基因表达后的转录所需 |
| nef | P27 | 抑制HIV转录和延缓HIV复制 |
| vif | P23 | 增加HIV的感染力和细胞-细胞间传播有助病毒复制 |
| vpr | P18 | 有助病毒复制;激活转录 |
| vpu | P15 | 有助HIV的释放;可能为新病毒子的包装所需(?) |
| vpx | P15 | 对HIV的感染力有利 |
| Tev | P26 | 是Tat的Rev的激活剂 |
(二)HIV感染的过程
1.急性HIV综合征初次感染HIV后3~6周50%~70%病人有急性单核细胞增多症样综合症,高度病毒血症,HIV广泛播散。1周~3月内出现抗HIV体液和细胞免疫应答,但HIV仍在淋巴结中持续表达。
2.潜伏期
(1)细胞潜伏期:HIV基因组以非整合状态停留在某些非活化细胞中数天但无病毒复制的现象,这种静息感染与经典的病毒潜伏不同,它是全部毒基因组在细胞中的但表达被抑制。细胞潜伏在临床上的反映是感染了HIV但抗HIV抗体和病毒血症均阴性。细胞潜伏的机制仍不明,也不知为何有些HIV株较易进入潜伏状态,可能机制:①HIV DNA的甲基化;②Tat、Rev、Vpu和Vpr表达不足或缺乏;③Nef蛋白质的表达;④抑制了一些能与某些蛋白质相互作用的细胞内因子;⑤CD8+细胞因子抑制HIV的表达。
(2)临床潜伏期:HIV感染后到临床疾病出现前这段时间称潜伏期。临床潜伏期是指临床无症状但HIV仍在宿主体内积极复制,这段时间虽无临床症状,但感染过程仍在进行。表现为免疫系统的渐进性衰退,如CD4+T细胞的减少等。
潜伏期平均10年,HIV(+)儿童和非洲HIV(+)者潜伏期较短,感染毒力较强的株潜伏期也较短。因此强毒力突变HIV株的出现,特别在宿主体内是一个值得注意的问题。
3.临床疾病期 AIDS的发生是免疫系统进行衰退的必然结果,是初次感染HIV时就开始的免疫抑制的终末阶段。患者有进行性全身性淋巴结肿大,机会性感染(如卡氏肺囊虫性肺炎)或肿瘤(如卡波氏肉瘤)。HIV或其产物对神经系统直接或间作用所致的神经系统疾病等。进展成AIDS后一般2年内死亡。
(三)AIDS的发病机制
(1)造血干细胞:T细胞、B细胞、Mφ、NK细胞、巨核细胞、树突状细胞、前髓细胞、干细胞、胸腺上皮细胞等。
(2)神经系统:脑中毛细血管内皮细胞、星形胶质细胞、少突神经胶质细胞、脉络丛、成神经细胞瘤细胞、Mφ、神经节。
(3)皮肤:朗格罕细胞、纤维母细胞。
(4)肠:柱状和杯状细胞、肠嗜铬细胞等。
(5)其它:心肌细胞、肾小管细胞、滑膜、枯否细胞、肺纤维毒细胞等。
2.HIV进入细胞机制
(1)CD4分子:HIVgp120羟基端第4保守部分(氨基酸413~447)与CD4+细胞表面CD4分子的V1区高亲和力地结合。结合后gp120和CD4的构型都发生了改变。故CD4分子是HIV的主要受体,CD4+细胞是HIV攻击的主要靶细胞。但外周血单个核细胞仅为总淋巴细胞的1%~3%。已发现淋巴器官主要是淋巴结中有大量HIv DNA。组织中特别是淋巴器官中的Mφ是HIV复制和播散的主要场所和贮库。
(2)融合受体:由表17-2可见,HIV也能感染CD4-细胞,与HIV进入有关的CD4-细胞表面分子的性质不明,最近在脑细胞上鉴定出一融合受体,为脂糖受体(如半乳糖苷神经酰胺)可能与HIV进入CD4-细胞有关。
(3)淋巴细胞功能相关抗原-1:此抗原在HIV细胞-细胞间的传播中起重要作用。HIV可经Mφ淋巴细胞,单核细胞或淋巴细胞达上皮细胞。中和抗体不能阻断感染细胞将HIV传给未感染细胞。
(4)Fc和补体受体:已发现HIV-1感染过程中的抗体依赖的增强现象。非中和抗体的Fab与病毒结合,经补体或Fc受体使HIV植入细胞内。
(5)表型混合(phenotypicmixing):经HIV和鼠逆转录病毒共感染的细胞能形成假病毒子(pseudotypevirion),在其包膜内有HIV基因组。能与HIV形成表型混合的病毒有HIV-2,HTLV-1,鼠异嗜性、双嗜性和多嗜性C型逆转录病毒,疱疹毒和疱疹性口炎病毒。
HIV的感染和复制受HIV受体的存在和数目,HIV包膜的结构、构型、电荷、刺突的数目和糖基化程度,细胞蛋白酶,HIV调节基因和辅佐基因Tat、rev、nef、vif、vpu和vpr表达程度等因素的影响。
3.CD4+细胞减少的机制 HIV(+)者血中CD4+T细胞以25~40个/μ1/年的速度下降,出现症状时CD4TT细胞一般<300个/μ1,如其数急转直下降至约200个/μ1,则为疾病恶化的先兆。
(1)HIV及其包膜蛋白的直接细胞致病作用:gp120能直接损伤细胞膜,使细胞溶解破坏死亡的现象已得到证实。感染细胞的死亡也可能是蛋白质合成被抑制的结果。未整合HIv DNA在胞内蓄积具有毒性,HIV Tat蛋白能杀伤脑细胞。
(2)感染细胞-未感染细胞形成合胞体:感染HIv CD4+细胞的胞膜与未感染CD4+细胞的胞膜相融合,形成有多个核的巨大细胞。合胞体的形成与HIV的细胞致病作用及CD4+细胞丢失有关。Gp120的V3超变区参与融合过程,淋巴细胞功能相关抗原-1在细胞融合中也起作用。
(3)程序性细胞死亡(programmedcell death):细胞凋亡是机体保持内环境稳定的一种生理性细胞自杀机制。它与免疫系统的成熟与完善(如自身反应性T细胞克隆的排除等)。衰老、胚胎发育、与器官的形成等密切相关。此过程要求细胞的活化蛋白质的合成和Ca2+依赖的内源性内切酶的作用。T细胞活化后不是引起细胞增殖而是导致细胞凋亡。HIV(+)无症状者的成熟T细胞体外经Ca2+载体、抗T细胞受体的抗体激活后能诱导T细胞的细胞凋亡,故有人认为HIV(+)者CD4+T细胞的缺陷和丢失是激活所诱导T细胞细胞凋亡的结果。
1)HIVgp120或gp120抗gp120复合物使CD4分子交叉连接起来使淋巴细胞为进一步刺激时引起凋亡作好准备,当用特异抗原或超抗原激活这些细胞时就能诱导病理性细胞凋亡以及触发邻近未感染的、活化细胞的细胞凋亡,因而死亡的T细胞不一定都需HIV感染。
2)活化信号的缺陷,T细胞的最适激活需要T细胞受体的刺激和来自APC的第二信号,当感染的APC提供的信号有偏差或T细胞已被IL-2预激活时,则连续的T细胞受体刺激导致细胞凋亡。
认识细胞凋亡在AIDS发病机制中的重要性对研究和治疗新策略的确定有重要意义,如临床上也许应将抗氧化剂如N-乙酰-半胱氨酸,维生素C和E及超氧化岐化酶与其它抗病毒药联用。
(4)自身免疫机制:MHCⅡ类分子尤为HLA-DR和DQ与HIV-lap120及gp41蛋白质具有结构同源性,抗gp120和gp41的抗体与HLAⅡ分子有交叉反应,故有人提出了gh120为“同种异表位”假说,gp120与CD4结合引起了长期的同种异基因免疫应答。病毒所触发的自身免疫性破坏,是通过细胞抗原的分子模拟所致。HIV对免疫系统的作用与自身免疫病有相似之处。有的HIV(+)者有抗TH、抗B细胞和抗CD4分子的自身抗体等。
(5)超抗原:HIV本身可能有一个作用像超抗原如致病微生物抗原在HIV的免疫致病中可能起重要作用。
(6)特异性细胞毒T细胞对HIV感染细胞的破坏作用。
4.HIV表达的诱导 HIV在T细胞、单核细胞和Mφ中的有效复制取决于这些细胞的活化和分化状态。
HIV与其它病毒共感染如巨细胞病毒、单纯疱疹病毒、乙肝炎病毒、HTLV-1和人疱疹病毒增加HIV的表达。
有些细胞因子能调节、诱导HIV从潜伏或慢性感染状态进入活跃表达状态,如IL-1、IL-3、IL-6、TFF-β、IFN-γ和GM-CSF等;而IFN-α、IFN-β、IL-4和转化生长因子-β等能抑制HIV感染。细胞因子无需入循环,局部产生后在组织水平上就能调节HIV表达。
四、AIDS的治疗
HIV感染所致的CD4+细胞的死亡和免疫功能的衰竭是不可逆的和致死性的。
虽现有针对IFV感染过程中不同阶段的许多药物,但遗憾的是至今尚无一个高效、低毒、安全的药物问世,现有的药物大多处于实验研究或临床试用阶段(表17-4)。美国已批准临床应用的药物有三个,即叠氮胸苷(3’-azidothymidine,AZT)、二脱氧肌苷(2’,3'-dideoxyinosine,ddI)和二脱氧胞苷(2’,3’-dideoxycytidine,ddC),均逆转录酶抑制剂。1985年AZT开始临床试用,能延长生存期,但不能完全抑制病情且毒性大。其原因在于:HIV基因组序列的突变,在HIV复制部们药物浓度不足以及耐药株的产生。联合用药是今后的方向。
表17-4 已应用和(或)研制中的抗HIV治疗制剂
| 类型 | 代表性制剂 | 主要作用 |
| 逆转录酶抑制剂 | AZT,ddI,ddC,d4T,3TC,FLT,PMEA等 | 抑制逆转录酶,作用于HIV整合前阶段 |
| 蛋白酶抑制剂 | 肽底物类似物 | 作用于HIV复制的整合后阶段阻断HIV在急、慢性感染细胞中的复制 |
| Tat抑制剂 | R05-3335,R024-7429 | 阻断HIV在急、慢性感染细胞中的复制 |
| HIV进入阻断剂 | sCD4,CD4lgG,CD4-PE40 | 阻止gp120与CD4结合,阻止合胞体形成 |
| 抗病毒核酸制剂 | 反意聚合苷酸RNA类似物等 | 针对HIV编码的核酸 |
| 抗已感染的细胞 | 天花粉蛋白 抗病毒抗体(ADCC) rCD4毒素 抗gp120毒素 CD8+细胞 |
这些制剂以不同机制发挥作用 |
| 免疫重建 | HIV治疗性疫苗 将env基因引入患者纤维母细胞并回输 表达env的载体 抗TNF制剂 IFN-α CD8+MHC1类限制性CTL IL-2或PEG-IL-2同基因骨髓移植 |
这些制剂以不同机制发挥作用 |
目前虽已有作用于HIV复制的不同阶段和具有不同作用机制的药物,但最后的成功不仅取决于正确使用这些药物,而且还取决于疾病基本过程和HIV表型改变规律的了解。
五、AIDS的预防
AIDS尚无法治疗,但是可以预防。最强大的预防武器是宣传教育。能预HIV感染的疫苗称预防性疫苗,而能阻止感染后进展成AIDS的疫苗称治疗性疫苗。至今尚无有明确应用前景的HIV疫苗可供广泛使用。疫苗研制中的主要困难在于对HIV的免疫应答了解仍不够。另一重要障碍是HIV变异株的不断出现。在HIV感染者中,HIV-1的突变率为0.1%-1%年。这就意味着,每HIV(+)者体内,HIV的细胞致病作用和复制变得越来越强。
一个好的预防性疫苗应是很小的剂量就能诱导出长期稳定的、全身的粘膜的保护性免疫,并对世界上流行的抗原性的抗原性不同的HIV株均有保护作用。它必须有效、安全、稳定、易保存,使用简便和价廉。目前HIV疫苗制备中的实验性免疫原的类型见表17-5。
表17-5 HIV疫苗制备中实验性免疫原的类型
| 免疫原 | 主要优点 |
| 活减毒HIV株 | 能诱导出长期的特异性细胞和体液免疫 |
| 灭活HIV | 制备简单,能模拟自然感染 |
| HIV蛋白亚单位如gp120,160,17或HIV蛋白质的合成肽 | 安全,纯度高,易制备,可排除致病性HIV表位 |
| 多价HVI蛋白亚单位混合物 | 能足以诱导出针对大多亚单位的T细胞表位 |
| 在BCG,牛痘等活载体中的HIV蛋白亚单位免疫 | 为细胞免疫的强诱导剂 |
| 抗CD4或gp120的独特型抗体 | 能诱导出广泛的中和抗体以克服HIV的变异性 |
| 胞内免疫(基因治疗) | 将HIV耐受基因引入CD4+细胞中 |
| 用HIV蛋白质的cDNA直接免疫 | 动物中抗流感染的保护性研究结果有希望 |
| 用宿主CD4或MHC分子免疫 | 非病毒性免疫原:当从感染细胞芽生时HVI掺入宿主MHC中 |
免疫缺陷病已成为临床上很重要一组疾病。先天性免疫缺陷病发病年龄早。多有遗传倾向性,感染所致死亡率高,基因治疗可能会带来希望。HIV的流行已产生了严重的社会问题和伦理学问题。对HIV研究已较广泛,但其高度的变异性和更强毒株的出现已引起人们的极大关注。对其发病机制已提出了各种解释,但任何单一因素似都不能圆满解释HIV感染后CD4+细胞的死亡。现有治疗措施仍令人失望,有效疫苗的研制正在进行中。AIDS的最终解决需要世界各国政府和全球学科工作者的共同努力。
第十八章 肿瘤免疫
肿瘤免疫学(tumorImmunology)是研究肿瘤的抗原性、机体的免疫功能与肿瘤发生、发展的相互关系,机体对肿瘤的免疫应答及其抗肿瘤免疫的机制、肿瘤的免疫诊断和免疫防治的科学。
早在本世纪初就曾有人设想肿瘤细胞可能存在着与正常组织不同的抗原成分,通过检测这种抗原成分或用这种抗原成分诱导机体的抗肿瘤免疫应答,可以达到诊断和治疗肿瘤的目的,但这方面研究在随后的几十年中没有取得明显的进展。直到50年代,由于发现肿瘤特异移植抗原以及机体免疫反应具有抗肿瘤作用,免疫学在肿瘤的诊断和治疗上的应用才引起了重视。60年代以后,大量的体外实验证明,肿瘤患者的淋巴细胞,巨噬细胞和细胞毒抗体等均有抗肿瘤效应。60年代末提出了免疫监视(immunesurveillance)的概念,为肿瘤免疫学理论体系的建立打下了基础。70年代单克隆抗体的问世,推动了肿瘤免疫诊断技术和肿瘤免疫治疗的发展,特别是80年代中后期,随着分子生物学和免疫学的迅速发展和交叉渗透,对肿瘤抗原的性质及其呈递过程,抗体的抗肿瘤免疫机制等有了新的认识,推动了肿瘤免疫的发展同时也促进了肿瘤免疫诊断与治疗的应用。
第一节 肿瘤抗原
肿瘤抗原是指细胞恶性变过程中出现的新抗原(neoantigen)物质的总称。细胞恶性变过程中由于基因突变或正常静止基因的激活都可以产生新的蛋白分子。这些蛋白质在细胞内降解后,某些降解的短肽可与MHCⅠ类分子在内质网中结合,并共表达于细胞表面,成为被CD8+CTL识别和杀伤的肿瘤特异抗原。此外,某些细胞在恶性变后,可使正常情况下处于隐敝状态的抗原决定簇暴露出来,成为肿瘤相关抗原,可被B细胞识别产生抗肿瘤抗体。
目前已在动物自发性肿瘤和人类肿瘤细胞表面都发现了肿瘤抗原。为了叙述方便,一般将肿瘤抗原进行分类,下面介绍两种对抗肿瘤抗原分类方法。
一、根据肿瘤抗原特异性的分类法
(一)肿瘤特异抗原
肿瘤特异抗原(tumorspecificantigen TSA)是指只存在于某种肿瘤细胞表面而不存在于正常细胞的新抗原。这类抗原是通过近交系小鼠间进行肿瘤移植的方法证明的实验过程,先用化学致癌剂甲基胆蒽(methyl-cholanthrene,MCA)诱发小鼠皮肤发生内瘤,当肉瘤生长至一定大小时,予以手术切除。将此切除的肿瘤移植给正常同系小鼠后可生长出肿瘤。但是,将此肿瘤植回原来经手术切除肿瘤的小鼠,则不发生肿瘤,表明该肿瘤具有可诱导机体产生免疫排斥反应的抗原。鉴于此类抗原一般是通过动物肿瘤移植排斥实验所证实,故又称为肿瘤特异移植抗原(tymor spicific transplantationantigen,TSTA)或肿瘤排斥抗原(tumor rejection antigen,TRA)。
以往曾对人肿瘤细胞是否有特异抗原(tumor specific antigen,TSA)存在争议,但最近已在人黑色素瘤等肿瘤细胞表面证实了存在这类TSA。它是一个静止基因活化的产物,以9个氨基酸的短肽或与HLA-A1分子共表达于某些黑色素瘤细胞表面,称为MAGE-1,它是第一个证实并清楚其结构的人肿瘤特异抗原。TSA只能被CD8+CTL所识别,而不能被B细胞识别,因此是诱发T细胞免疫应答的主要肿瘤抗原。
(二)肿瘤相关抗原
肿瘤相关抗原(tumor-associated antigen,TAA)是指一些肿瘤细胞表面糖蛋白或糖脂成分,它们在正常细胞上有微量表达,但在肿瘤细胞表达明显增高。此类抗原一般可被B细胞识别并产生相应的抗体。
二、根据肿瘤发生的分类法
(一)化学或物理因素诱发的肿瘤抗原
实验动物的研究证明,某些化学致癌剂或物理因素可诱发肿瘤,这些肿瘤抗原的特点是特异性高而抗原性较弱,常表现出明显的个体独特性。即用同一化学致癌剂或同一物理方法如紫外线、X-射线等诱发的肿瘤,在不同的宿主体内,甚至在同一宿主不同部位诱发肿瘤都具有互不相同的抗原性。由于人类很少暴露于这种强烈化学、物理的诱发环境中,因此大多数人肿瘤抗原不是这种抗原。
(二)病毒诱发的肿瘤抗原
实验动物及人肿瘤的研究证明,肿瘤可由病毒引起,例如EB病毒(EBV)与B淋巴细胞瘤和鼻咽癌的发生有关;有乳头状瘤病毒(HPV)与人宫颈癌的发生有关。EBV和HPV均属于NDA病毒,而属于RNA病毒的人嗜T细胞病毒(HTLV-1)可导致成人T细胞白血病(ATL)。同一种病毒诱发的不同类型肿瘤(无论其组织来源或动物种类如何不同),均可表达相同的抗原且具有较强的抗原性。动物实验研究已发现了几种病毒基因编码的抗原,例如SV40病毒转化细胞表达的T抗原和人腺病毒诱发肿瘤表达的ELA抗原。
(三)自发肿瘤抗原
自发性肿瘤是指一些无明确诱发因素的肿瘤。大多数人类肿瘤属于这一类。自发肿瘤的抗原有二种:一种是TAA;另一种是TST。TAA被B细胞识别诱发体液免疫应答,TsA被CD8+CTL识别,诱发细胞免疫应答。目前已证明小鼠自发肿瘤和人肿瘤细胞表面具有肿瘤特异性抗原。
(四)胚胎抗原
胚胎抗原是在胚胎发育阶段由胚胎组织产生的正常成分,在胚胎后期减少,出生后逐渐消失,或仅存留极微量。当细胞恶性变时,此类抗原可重新合成。胚胎抗原可分为两种,一种是分泌性抗原,由肿瘤细胞产生和释放,如肝细胞癌变时产生的甲胎蛋(alphafetoprotein,AFP),另一种是与肿瘤细胞膜有关的抗原,疏松地结合在细胞膜表面,容易脱落,如结肠癌细胞产生癌胚抗原(carcinoembryonic antigen,CEA)。AFP和CEA是人类肿瘤中研究得最为深入的两种胚胎抗原,它们抗原性均很弱,因为曾在胚胎期出现过,宿主对之已形成免疫耐受性,因此不能引起宿主免疫系统对这种抗原的免疫应答。但作为一种肿瘤标志,通过检测肿瘤患者血清中AFP和CEA的水平,分别有助于肝癌和结肠癌的诊断。
第二节 机体抗肿瘤免疫的机制
机体的免疫功能与肿瘤的发生有密切关系,当宿主免疫功能低下或受抑制时,肿瘤发生率增高。
正常机体每天有许多细胞可能发生突变,并产生有恶性表型的瘤细胞,但一般都不会发生肿瘤,对此,Burner提出了免疫监视学说,认为机体免疫系统通过细胞免疫机制能识别并特异地杀伤突变细胞,使突变细胞在未形成肿瘤之前即被清除。但当机体免疫监视功能不能清除突变细胞时,则可形成肿瘤。目前认为,机体的免疫监视,而在机体内不断生长的,目前尚无完全令人满意的解释。
肿瘤发生后,机体可通过免疫效应机制发挥抗肿瘤作用。机体抗肿瘤免疫的机制包括细胞免疫和体液免疫两方面,这两种机制不是孤立存在和单独发挥作用的,它们相互协作共同杀伤肿瘤细胞,一般认为,细胞免疫是抗肿瘤免疫的主要方式,体液免疫通常仅在某些情况下起协同作用。对于大多数免疫原性强的肿瘤,特异性免疫应答是主要的,而对于免疫原性弱肿瘤,非特异性免疫应答可能具有更主要的意义。
一、体液免疫机制
抗肿瘤抗体虽然可通过以下几种方式发挥作用,但总体来说,抗体并不是抗肿瘤的重要因素。
(一)激活补体系统溶解肿瘤细胞
细胞毒性抗体(IgM)和某些IgG亚类(IgG1、IgG3)与肿瘤细胞结合后,可在补体参与下,溶解肿瘤细胞。
(二)抗体依赖性细胞介导的细胞毒作用
IgG类抗体能使多种效应细胞如巨噬细胞、NK细胞、中性粒细胞等发挥ADCC效应,使肿瘤细胞溶解。该类细胞介导型抗体比上述的补体依赖的细胞毒抗体产生快、在肿瘤形成早期即可在血清中检出。
(三)抗体的调理作用
吞噬细胞可通过其面Fc受体而增强吞噬结合了抗体的肿瘤细胞,具有这种调理作用的抗体是IgG类。
(四)抗体封闭肿瘤细胞上的某些受体
例如转铁蛋白可促进某些肿瘤细胞的生长,其抗体可通过封闭转铁蛋白受体,阻碍其功能,从而抑制肿瘤细胞的生长。
(五)抗体使肿瘤细胞的粘附特性改变或丧失
抗体与肿瘤细胞抗原结合后,可修饰其表面结构,使肿瘤细胞粘附特性发生改变甚至丧失,从而有助于控制肿瘤细胞的生长的转移。
二、细胞免疫机制
细胞免疫比体液免疫在抗肿瘤效应中发挥着更重要的作用。除了下述几种在细胞免疫机制中起作用的效应细胞外,目前认为中性细胞,嗜酸性粒细胞也参与抗肿瘤作用。
(一)T细胞
在控制具有免疫性肿瘤细胞的生长中,T细胞介导的免疫应答反应起重要作用。抗原致敏的T细胞只能特异地杀伤、溶解带有相应抗原的肿瘤细胞,并受MHC限制。可包括MHCⅠ类抗原限制的CD8+细胞毒性T细胞(CTL)和MHCⅡ类抗原限制的CD4+辅助性T细胞(TH)。若要诱导、激活T细胞介导的抗肿瘤免疫反应,肿瘤抗原须在细胞内加工成肿瘤肽,然后与MHCⅠ类分子结合共表达于肿瘤细胞表面,而被CD8+CTL识别。或者先从肿瘤细胞上脱落下,然后由抗原呈递细胞(APC)摄取,加工成多肽分子,再由细胞表面的MHCⅡ类抗原分子呈递给CD4+TH细胞。目前认为,激活T细胞需要双重信号刺激(见图11-3),T细胞抗原受体与肿瘤抗结合后,提供T细胞活化的第一信号,由APC上的某些分子如细胞间粘附分子(intercellular adhesionmolecules,ICAMs)、淋巴细胞功能相关抗原3(lymphocytefunction associatedantigen3,LFA-3)、血管细胞粘附分子(vascular cell adhesion molecule-1VCAM-1)、B7等与T细胞上相应的受体结合后,可向T细胞提供活化的第二信号。在提供T细胞活化的膜分子中,B7分子研究得较清楚。B7可与T细胞上的相应受体即CD28/CTLA-4相结合,B7起到与抗原共同刺激T细胞的作用。由于肿瘤细胞虽可表达MHCⅠ类抗原分子,但缺乏B7分子,故不能有效地激活T细胞介导的抗肿瘤免疫。CD8+CTL杀伤肿瘤细胞的机制有二:一是通过其抗原受体识别肿细胞上的特异性抗原,并在TH细胞的辅助下活化后直接杀伤肿瘤细胞;二是活化的CTL可分泌淋巴因子如γ干扰素、淋巴毒素等间接地杀伤肿瘤细胞。CD4+T可产生淋巴因子增强CTL的功能并可激活巨噬细胞或其他APC,从而参与抗肿瘤作用。
(二)NK细胞
NK细胞是细胞免疫中的非特异性成分,它不需预先致敏即能杀伤肿瘤细胞,其杀伤作用无肿瘤特异性和MHC限制性。NK细胞是一类在肿瘤早期起作用的效应细胞,是机体抗肿瘤的第一道防线。
自然细胞毒细胞(natural cytototxic cell,NC)是另一类在功能、表面标志、杀瘤细胞谱方面与NK细胞有所不同的抗肿瘤效应细胞,在体内抗肿瘤免疫效应中也起一定作用。
(三)巨噬细胞
巨噬细胞在抗肿瘤免疫中不仅是作为呈递抗原的APC,而且也是参与杀伤肿瘤的效应细胞。体内注射选择性的巨噬细胞抑制剂,如硅石或抗巨噬细胞血清,能加速机体内肿瘤生长;而使用卡介苗或短小棒状杆菌等使巨噬细胞激活,则肿瘤生长受到抑制,肿瘤转移亦减少。病理活检的资料表明,病人的肿瘤组织周围若有明显的巨噬细胞浸润,肿瘤转移扩散的发生率较低,预后也较好;反之,肿瘤转移扩散率高,预后较差。巨噬细胞杀伤肿瘤细胞的机制有以下几个方面:①活化的巨噬细胞与肿瘤细胞结合后,通过释放溶细胞酶直接杀伤肿瘤细胞;②处理和呈递肿瘤抗原,激活T细胞以产生特异性抗肿瘤细胞免疫应答;③巨噬细胞表面上有Fc受体,可通过特异性抗体介导ADCC效应杀伤肿瘤细胞;④活化的巨噬细胞可分泌肿瘤坏死亡因子(TNF)等细胞毒性因子间接杀伤肿瘤细胞。
第三节 肿瘤的免疫学检测
肿瘤的免疫学检测的主要目的是对肿瘤进行免疫学诊断和评估宿主的免疫功能状态。
一、肿瘤的免疫学诊断
(一)检测肿瘤抗原
这是目前最常用的肿瘤免疫学诊断法,如AFP的检测对原发性肝细胞性肝癌有诊断价值,CFA的检测有助于诊断直肠癌、胰腺癌等。但对于人类肿瘤特异性抗原的检测进展不大。
(二)检测肿瘤抗体
例如在黑色素瘤患者血清中可查到抗自身黑色素瘤抗体,在鼻咽癌和Burkitt淋巴瘤患者的血清中检测出EB病毒的抗体,且抗体水平的变化与病情的发展和恢复有关。
(三)肿瘤的放射免疫显像诊断
将放射性核素如131Ⅰ与抗肿瘤单抗结合后,从静脉注入体内或腔内注射均可将放射性核素导向肿瘤的所在部位,用γ照相机可以显示清晰的肿瘤影像,目前已用于临床诊断,是一种有较好前景的肿瘤诊断新技术。
二、对肿瘤患者免疫功能状态的评估
一般肿瘤病人的免疫功能变化不大,晚期肿瘤病人免疫功能可受抑制,在治疗后免疫功能状态改善,表明治疗方法得当,患者生存期可延长。
第四节 肿瘤的免疫治疗
肿瘤的免疫治疗是以激发和增强机体的免疫功能,以达到控制和杀灭肿瘤细胞的目的。免疫疗法只能清除少量的,播散的肿瘤细胞,对于晚期的实体肿瘤疗效有限。故常将其作为一种辅助疗法与手术、化疗、放疗等常规疗法联合应用。先用常规疗法清扫大量的肿瘤细胞后,再用免疫疗法清除残存的肿瘤细胞,可提高肿瘤治疗的效果。虽然目前已经建立了多种免疫方法,并在动物实验中取得了良好疗效,但当临床应用时受到的影响因素很多,其临床治疗的效果尚需进一步提高。
目前,肿瘤免疫治疗的方法有以下几种:
一、非特异性免疫治疗
是指应用一些免疫调节剂通过非特异性地增强机体的免疫功能,激活机体的抗肿瘤免疫应答,以达到治疗肿瘤的目的。例如:卡介苗,短小棒状杆菌,酵母多糖,香菇多糖,OK432以及一些细胞因子如IL-2等均属于此类。
二、主动免疫治疗
肿瘤的主动免疫治疗是指给机体输入具有抗原性的瘤苗,刺激机体免疫系统产生抗肿瘤免疫以治疗肿瘤的方法。该法应用的前提是肿瘤抗原能刺激机体产生免疫反应。此种方法对地手术后清除微小的转移瘤灶和隐匿瘤、预防肿瘤转移和复发有较好的应用效果。
目前治疗用瘤苗有以下几类:
(一)活瘤苗
由自体或同种肿瘤细胞制成,使用时有一定的危险性,较少用。
(二)减毒或灭活的瘤苗
自体或同种肿瘤细胞经过射线照射,丝裂霉素C,高低温等处理可消除其致瘤性,保留其免疫原性与佐剂合用,对肿瘤的治疗有一定的疗效。
(三)异构的瘤苗
自体或同种肿瘤细胞经过碘乙酸盐,神经氨酸酶等修饰处理增强了其免疫原性,可作疫苗应用。
(四)基因修饰的瘤苗
将某些细胞因子的基因或MHCⅠ类抗原分子的基因,粘附分子如B7基因等转移入肿瘤细胞后,可降低其致瘤性,增强其免疫原性,这种基因工程化的肿瘤苗在实验动物研究中,取得了肯定的效果,人体应用的前景尚待评价。
(五)抗独特型抗体
抗独特型抗体是抗原的内影像,可以代替肿瘤抗原进行主动免疫。目前已用于治疗B淋巴细胞瘤。
三、被动免疫治疗
肿瘤的被动免疫治疗是指给机体输注外源的免疫效应物质,由这些外源性效应物质在机体内发挥治疗肿瘤作用。目前主要有以下两大类:
(一)抗肿瘤导向治疗
利用高度特异性的单克隆抗体为载体,将细胞毒性的杀伤分子带到肿瘤病灶处,可特异地杀伤肿瘤细胞。目前根据所用的杀伤分子的性质不同,肿瘤的导向治疗可分为:①放射免疫治疗(radioimmunotherapy),将高能放射性核素与单克隆抗体连接,可将放射性核素带至瘤灶杀死肿瘤细胞;②抗体导向化学疗法(antibody-mediated chemotherapy),抗肿瘤药物与单抗通过化学交联组成的史疫偶联物,可以将药物导向肿瘤部位,杀伤肿瘤细胞,常用的有氨甲蝶呤(MTX)、阿霉素等;③免疫毒素疗法(immunotoxintherapy),将毒素与单克隆抗体相连,制备的免疫毒素对肿瘤细胞有特异性的强杀伤活性。常用的毒素有两类:一类是植物毒素,包括篦麻籽毒素(RT)、相思子毒素(abrin)、苦瓜毒素(MD)等。另一类是细胞毒素,包括白喉毒素(DT)、绿脓杆菌外毒素(PE)。经过临床应用,单克隆抗体导向疗法取得了一定的治疗效果,但其存在的某些问题限制其临床应用和疗效提高。如目前所用的单克隆抗体多为鼠源单克隆抗体,应用人体后会产生抗鼠源单克隆抗体的抗体,使其不能反复应用影响了其疗效。用基因工程的方法,使鼠源抗体人源化可减少这个问题。目前认为用导向药物治疗实体瘤的效果有限。在腔内肿瘤如膀癌的治疗方面,可能有较好的效果。导向药物在清除转的小肿瘤灶可能具有较好的治疗效果。
(二)过继免疫疗法
过继免疫疗法(adoptive immunotherapy)是取对肿瘤有免疫力的供者淋巴细胞转输给肿瘤者,或取患者自身的免疫细胞在体外活化、增殖后,再转输入患者体内,使其在患者体内发挥肿瘤作用。过继免疫疗法的效应细胞具有异质性,如CTL、NK细胞、巨噬细胞、淋巴因子激活的杀伤细胞(lymphokine-activatedkillercells,LAK)和肿瘤浸润性淋巴细胞(tumor-infiltrating lympbocytes,TIL)等都在杀伤肿瘤细胞中起作用。LAK细胞是外周血淋巴细胞在体外经过IL-2培养后诱导产生的一类新型杀伤细胞,其杀伤肿瘤细胞不需抗原致敏且无MHC限制性,有人认为LAK细胞主要成分是NK细胞。TIL是从实体肿瘤组织中分离得到的,经体外IL-2培养后可获得比LAK细胞更强的杀伤活性。CTL是TIL细胞的主要成分。目前已将LAK细胞,TIL与IL-2合用对临床治疗晚期肿瘤患者,对于某些类型肿瘤患者如黑色素瘤、肾细胞癌确有一定治疗效果。
第十九章 移植免疫
机体丧失功能的器官,可以通过器官移植重建其生理功能。器官移植的实验研究则在本世纪初开始。Carrel等首先发现,狗的自体肾移植可维持良好的功能,而同种异体肾移植则总是在移植后1周左右被排斥。器官移植排斥的机制不清。直到40年代,英国科学家Medawar应用家兔皮肤植实验模型,进行了一系列研究,证实了移植排斥反应本质是受体免疫系统对移植器官的免疫排斥反应。进一步的研究证明,引起小鼠移植排斥的主要抗原存在于第17对染色体上的主要组织相溶性基因复合物(H-2)编码的抗原。这些移植排斥的免疫学基础研究,大大促进了临床器官移植的发展。一般将器官移植分为自体移植(autologous transplantation)同种移植(isogeneic transplantation),和异种移植(heterogous transplantation)。在人的同种移植中,同卵双生子之间,由于遗传背景完全相同,互相之间移植的器官不会受到排斥,临床上进行的器官移植主要是遗传背景不完全相同的同种异基因移植(allogeneic transplantation)。1954年美国医生Murray第一次施行同卵双生姐妹之间的肾移植获得长期生存,此后许多同种异基因肾移植也获得成功。肾移植已是临床治疗晚期肾功能衰竭的主要手段。1956年,美国医生Thomas第一次给一位白血病患者进行骨髓移植获得成功,目前异基因骨髓移植已成为临床许多疾病,包括遗传病、血液系统疾病赃物射病的重要治疗方法,Murray和Thomas的工作标志着器官移植已成为临床疾病治疗的手段,对医学的发展具有重要的意义。为表彰他们的贡献,1990年他们被授予诺贝尔医学奖。
60年代后期起,由于HLA配型技术和免疫抑制药物的应用,使临床器官移植成功率大幅度提高。除肾移植和骨髓移植外,肝、胰、心、肺及心肺联合移植也都相继在临床开展。80年代以后,由于环孢素A及FK-506等高效免疫抑制的临床应用,进一步提高了移植器官的存活率,使临床器官移植进入了一个新的阶段。
第一节 器官移植排斥的类型
一、宿主抗移植物反应
受者对供者组织器官产生的排斥反应称为宿主抗移植物反应(host versus graft reaction,HVGR)根据移植物与宿主的组织兼容程度,以及受者的免疫状态,移植排斥反应主要表现为三种不同的类型。
(一)超急排斥
超急排斥(hyperacute rejection)反应一般在移植后24小时发生。目前认为,此种排斥主要由于ABO血型抗体或抗Ⅰ类主要组织兼容性抗原的抗体引起的。受者反复多次接受输血,妊娠或既往曾做过某种同种移植,其体内就有可能存在这类抗体。在肾移植中,这种抗体可结合到移植肾的血管内皮细胞上,通过激活补体有直接破坏靶细胞,或通过补体活化过程中产生的多种补体裂解片段,导致血小板聚集,中性粒细胞浸润并使凝血系统激活,最终导致严重的局部缺血及移植物坏死。超急排斥一旦发生,无有效方法治疗,终将导致移植失败。因此,通过移植前ABO及HLa 配型可筛除不合适的器官供体,以预防超急排斥的发生。
(二)急性排斥
急性排斥(acute uejection)是排斥反应中最常见的一种类型,一般于移植后数天到几个月内发生,进行迅速。肾移植发生急性排斥时,可表现为体温度升高、局部胀痛、肾功能降低、少尿甚至无尿、尿中白细胞增多或出现淋巴细胞尿等临床症状。细胞免疫应答是急性移植排斥的主要原因,CD4+T(TH1)细胞和CD8+TC细胞是主要的效应细胞。即使进行移植前HLA配型及免疫抑制药物的应用,仍有30%~50%的移植受者会发生急性排斥。大多数急性排斥可通过增加免疫抑制剂的用量而得到缓解。
(三)慢性排斥
慢性排斥(chronic rejection)一般在器官移植后数月至数年发生,主要病理特征是移植器官的毛细血管床内皮细胞增生,使动脉腔狭窄,并逐渐纤维化。慢性免疫性炎症是导致上述组织病理变化的主要原因。目前对慢性排斥尚无理想的治疗措施。
二、移植物抗宿主反应
如果免疫攻击方向是由移植物针对宿主,即移植物中的免疫细胞对宿主的组织抗原产生免疫应答并引起组织损伤,则称为移植物抗宿主反应(graft versus host reaction,GVHR)。GVHR的发生需要一些特定的条件:①宿主与移植物之间的组织兼容性不合;②移植物中必需含有足够数量的免疫细胞;③宿主处于免疫无能或免疫功能严重缺损状态。GVHR主要见于骨髓移植后。此外,脾、胸腺移植时,以及免疫缺陷的新生儿接受输血时,均可发生不同程度的GBHR。
急性GVHR一般发生于骨髓移植后10~70天内。如果去除骨髓中的T细胞,则可避免GVHR的发生,说明骨髓中T细胞是引起GVHR的主要效应细胞。但临床观察发现,去除骨髓中的T细胞后,骨髓植入的成功率也下降,白血病的复发率,病毒、真菌的感染率也都升高。这说明,骨髓中的T细胞有移植物抗白血病的作用,可以压倒残留的宿主免疫细胞,避免宿主对移植物的排斥作用;也可以在宿主免疫重建不全时,发挥抗微生物感染的作用。因此,选择性地去针对宿主移植抗原的T细胞,而保留其余的T细胞,不但可以避免GVHR,而且可以保存其保护性的细胞免疫功能。
第二节 移植反排斥的机制
一、移植排斥的遗传学基础
引起移植免疫应答的抗原称为移植抗原,又称组织兼容性抗原。根据抗原性的强弱及引起移植排斥反应的强度,组织兼容性抗原又可分为主要组织兼容性抗原(major histocompatibility antigen)和次要组织兼容性抗原(minor histocompatibility antigen)二大类。主要组织兼容性抗原是引起移植排斥的主要抗原,它在不同的动物中有不同的命名。人的主要组织兼容性抗原为人类白细胞抗原,即HLA抗原。小鼠的主要组织兼容性抗原称为H-2抗原。狗为DL-A,鸡为B系统,大鼠为H-1系统,黑猩猩为ChLA等。编码主要组织相容性抗原的基因称为主要组织相容性基因复合体(MHC)。人和小鼠的MHC结构,详见第五章。
(一)HLA及HLA抗原
HLA位于人类第6对染色体短臂上,由一群多功能的连锁基因组成,其中HLA-A、B、C位点称Ⅰ类基因,编码HLAⅠ类分子;HLA-Dr 、DQ、DP称Ⅱ类基因,编码HLAⅡ类分子。HLAⅠ类和Ⅱ类基因是呈共显性表达,即位于父源和母源的同源染色体上的一对等位基因都能表达各自的抗原。
与移植排斥有关的主要是HKA-Ⅰ类、Ⅱ类基因编码的HLA-Ⅰ类、Ⅱ类抗原。这些分子都是糖蛋白。HLAⅠ类抗原广泛分布于白细胞等所有的有核细胞表面。HLA-Ⅱ类抗原分布较局限,主要存在于 B细胞、单核巨噬细胞系统的细胞,上皮细胞及内皮细胞表面。
由于HLA是具有多个基因座的共显性表达的等位基因,因此在人群中存在着众多的同种异型,形成了HLA抗原的多态性。这为寻找HLA相同的器官移植供体造成了极大的困难。在无血缘关系的无关个体之间,HLA完全相配的个体的机率几乎为零。
(二)H-2和H-2抗原
小鼠H-2基因复合体位于第17对染色体上,由K、I、S、D四个基因区域组织。它们之间彼此独立而又紧密连锁,分别编码三类分子。编码Ⅰ类分子为K区的K座和D区的D、L座。编码Ⅱ类分子的座位在Ⅰ区中的A亚区和E亚区。A亚区和E亚区都有α、β二个座,所以共有Aα、Bβ、Bα、Bβ四个座分别为Ⅱ类分子I-A和I-E抗原编码。
Ⅰ类分子是TC细胞识别的移植抗原,在移植排斥中起重要作用;和HLA抗原一样,小鼠H-2Ⅰ类抗原广泛分布于各种组织、细胞的膜表面,不同的是小鼠成熟红细胞表面也H-2抗原,而人红细胞表面不存在HLA抗原。
H-2Ⅱ类抗原也是选择性地存在于B细胞和抗原呈递细胞上。其它少数细胞,如内皮细胞、精子和激活的T细胞上也有H-2Ⅱ类抗原的表达。Ⅱ类抗原与处理过的外源性抗原肽结合,对激活TH细胞具有重要作用,因此也是移植排斥的重要抗原。
(三)次要组织兼容性抗原
某些纯系小鼠中,雄鼠移植到雄鼠,或从雌鼠移植到雄鼠的移植物不会受到排斥,但雄性小鼠的移植物在同系雌鼠中有相高的排斥发生率。在同一纯系的雄性和雌性个体之间唯一的遗传学差别在雄性的Y染色体上。所以对这种不兼容性的最简单的解释就是,Y染色体可以编码一种决定组织性的抗原,即H-Y抗原,属次要组织兼容性抗原。与移植排斥有关的其他组织兼容性座的研究,近年来已有报道,但远不如主要组织兼容性座那么清楚。次要组织兼容性抗原可引起程度不同的,较弱的移植排斥反应,因此除同卵双生子之间的器官移植外,其他HLA相合的器官移植仍有相当比例的排斥反应发生。
二、移植排斥的免疫学基础
同种异基因器官移植后,由于供、受者之间的组织兼容性抗原不同,它们可以刺激相互的免疫系统,引起宿主抗移植物或移植物抗宿主的移植排斥。在实体器官移植中,移植物中完整的活细胞。脱落的细胞,或由于移植前灌洗不彻底而残留在器官中的淋巴细胞(又称过客淋巴细胞,passengerlymphocyte)都可以是启发免疫应答的抗原。移植抗原诱发的细胞免疫和体液免疫应答都参与排斥过程。
(一)细胞免疫在移植排斥中的作用
在移植排斥中,树突状细胞、单核巨噬这一类抗原呈递细胞,在启动移植排斥的免疫应答中的作用至关重要。它们的主要作用是:①摄取、处理并呈递抗原给TH/TD细胞、B细胞,提供活化第一信号;②分泌IL-1等第二信号分子,导致TH细胞活化。TH细胞一旦被激活,就可以释放IL-2、IL-4、IL-5、IL-6及IFN-γ等一系列细胞因子。在这些细胞因子的作用下识别了移植抗原的TD细胞、TC细胞、B细胞,就开始增殖、分化为效应TC细胞、TD细胞和抗体分泌细胞,导致移植排斥的发生。TC细胞可通过直接杀伤作用杀伤靶细胞,TD细胞则通过诱发迟发型超敏反应性炎症参与移植排斥。目前认为,细胞免疫应答是移植排斥的主要机制;CD4+的TD细胞和CD8+的TC细胞是主要的效应细胞。
(二)抗体在移植排斥中的作用
抗体在移植排斥中的作用比较复杂。它可以通过传统的途径,即活化补体和ADCC作用参与移植排斥。在某些性况下,也可以起到封闭抗体的作用,保护移植物不受排斥。
1.抗体激活补体参与移植排斥抗体与移植抗原结合后,可以激活补体,直接破坏靶细胞;同时也可通过补体-血凝系统的活化,导致血管扩张,通透性增加,多形核白细胞的趋化浸泣润,血小板凝集,血栓形成等一系列病理性变化,导致移植器官被排斥。参与这种作用的抗体主要是IgM类抗体,超急排斥中最为典型,在肾移植中最为常见。
2.抗体通过ADCC作用参与移植排斥 抗体与移植物结合后,可通过其Fc段与具有IgGFc受体的K细胞、单核巨噬细胞结合,导致它们活化,直接破坏移植的器官。参与这种ADCC作用的抗体是IgG的某些亚类,如IgG2。
3.增强抗体与移植排斥抗体除参与称植排斥外,在某些情况下可保护移植物不被排斥,这种抗体称为增强抗体(enhancing antibody)。增强抗体可与植入组织上的抗原结合,但不激活补体,也不引起细胞毒效应,却可阻断其他抗体或T细胞与这一抗原决定簇结合,从而对移植物起到保护作用,因此此类抗体又称为封闭抗体(bioking antibody)。
第三节 移植排斥的防止
一、HLA配型
器官移杆的供、受者之间组织兼容性程度越高,器官存活的机率就越大。因此,在器官移植前,慎重选择供者是至关重要的。一般供者的ABO血型必需与受者一致,这是比较容易做的。此外,供者的HLA组织型别也应尽可能与受者相近。在HLA各座中,DR座最为重要,其他座配型不同,通过免疫抑制可控制其排斥强度,而DR座配型不同,则器官存活率明显降低。一般有亲缘关系供、受者之间HLA型别相近的机会大得多。
HLA配型一般是鉴定供、受者的HLA表现型,即检查HLA抗原。近年来,随着分子生物学的发展,HLA的DNA定型法也已发展起来。
二、免疫抑制
采取免疫抑制措施可以有效地抑制植排斥的发生。
(一)免疫抑制药物
免疫抑制药物的应用,促进了人体器官移植的发展。60年代,由于硫唑嘌呤的问世,使器官移植存活率有了很大的提高。这个时期,硫唑嘌呤、皮质激素以及抗人胸腺细胞球蛋白的应用,使肾、肝、心移植都能在临床开展起来,并取得了部分成功。70年代末,由于新一代高效免疫抑制剂环孢素A(GsA)的出现,使各种器官移植有了突破性的进展。CsA不但具有更强的免疫抑制作用,而且可以相对选择性地作用于T细胞。因此,从1978年以后,CsA已广泛应用于临床器官移植。GsA与其它免疫抑制药物联合应用,可以提高作用效果,且可以减少GsA的用量,减少毒副作用。近年来,临床采用GsA与强的松二联疗法,和用GsA与强的松和硫唑嘌伶的三联疗法,以及CsA与强的松、硫唑嘌呤和抗人胸腺细胞球蛋白和四联疗法,都取得了很好的效果。80年代初期发现的另一种真菌代谢产物FK-506,具有比CsA更强的免疫抑制作用和相同的靶细胞选择性。目前,FK-506已应用于临床肾、肝、心以及心肺移植中,并发现与CaA合用效果更佳。
(二)抗胸腺细胞球蛋白和抗T细胞单克隆抗体
抗胸腺细胞球蛋白抗T细胞单克隆抗原可与T细胞结合,通过活化补体去除T细胞。抗CD3单抗还可以阻止T细胞识别移植抗原,防止移植排斥的发生。这二种抗体在临床上已得到广泛应用。
(三)输血效应
由于担心受者被HLA抗原及其他抗原致敏,发生超急排斥,所以多年来曾禁止给移植受者输血。后来发现,移植前接受输血的病人,肾移植存活时间可明显延长。80年代,进一步的临床实验研究证明了这种观察结果。此后,在许多移植中心都采取了预输血的方案。输血的这种作用的机制还不是很清楚,一般认为可能是:①输血可活化TS细胞;②输血可产生封闭抗体;③输血可产生抗T细胞的独特型抗体,阴断T细胞识别抗原。确切机制尚有待进一步阐明。
三、移植耐受的诱导
由于免疫抑制药物本身的毒性,以及应用免疫抑制药物后患者免疫功能长期低下,容易导致感染,所以长期使用免疫抑制剂来防止称植排斥会产生许多严重的副作用。解决移植排斥的根本方法,是诱导供、受体间的免疫耐受。因此,如何诱导成年个体间的免疫耐受具有重要的实际意义。近年来,移植耐受的研究已取得了许多重要的进展,主要有以下几种诱导耐受的方法。
(一)用照射的方法诱导耐受
1.全淋巴照射(TLI)小鼠经全淋巴照射后输入大量异基因骨髓,可形成不同程度的嵌合体。由于异基因骨髓在受体内分化、发育,并经过胸腺的选择,可以导致耐受的产生。所以嵌合体的水平越高,移植物存活时间越长。这种模式已应用于临床肾移植,可减少免疫制剂的用量。在某些研究中,诱导免疫耐受后,甚至在完全撤除免疫抑制剂后,机体对供体的MLR和细胞毒作用仍十分低下,移植物不被排斥。
2.紫外线照射用紫外线照射小鼠,同时在照射部位涂布抗原,可以灭活朗格罕细胞的抗原呈递功能,使其对相应抗原的细胞免疫反应下降;胰岛移植前,将供体的血液用紫外线照射后输给受体,可诱志免疫耐受,使以后植入的胰岛长期存活;异基因骨髓移植前经紫外线照射也可以降低GVHR。紫外线照射除对APC的作用外,可诱导TS细胞活性,抑制免疫应答。
(二)药物诱导耐受
1.环磷酰胺(CY)诱导耐受 从静脉注射供体脾细胞,48小时后腹腔注射CY的方法,可诱导H-2不同的受体小鼠产生不完全耐受。其表现为对供体细胞的特异性免疫应答降低,MLR和CTL活性明显抑制,DTH反应也明显降低,并可接受供体来源的肿瘤细胞不被排斥,但对供体的皮肤移植物仍会排斥,只是排斥期延长,在H-2相同,而只有次要组织相容性抗原不同的品系间,这种方法则可诱导完全耐受。在上述模型基础上,将骨髓细胞和脾细胞的耐受原,再合并用CY和胸腺细胞血清,则可在H-2完全不同的品系小鼠间诱导完全的移植耐受。表现为耐受小鼠对供体鼠各种同种异型的特异反应消失,移植的皮肤可以长期存活不受排斥。这类耐受产生的主要机制是克隆排除。
2.环孢素A(CyA)诱导的耐受 对家兔的肾移植研究发现,短期应用CsA并进行肾移植后6个月,无关第三者的皮肤可被迅速排斥,而来自肾移植供者的皮肤可以稳定植活。狗和猴肾移植中也获得相似的结果。CsA诱导的耐受大多为诱导Ts细胞。
(三)抗体诱导耐受温表
1.抗淋巴细胞血清(ALS)诱导耐受 注射ALS的小鼠,在皮肤移植后1周,静脉输注供体来源的骨髓,在受体小鼠体内可检出供体来源的血细胞,也即形成微量骨髓嵌合体。这样,与供体抗原反应的T细胞将在胸腺中被阴性选择去除,形成对供体组织的免疫耐受。表现为同种异型反应性消失,移植供体皮肤下被排斥等。目前,用抗淋巴细胞球蛋(ALG)进行骨髓输入已应用于临床肾移植中。
2.抗T细胞单克隆抗体诱导耐受 抗CD4单克隆抗体被广泛应用于实验性免疫耐受的诱导。用抗CD4单抗处理PCG大鼠,移植组织不相容的PVG·RTIa大鼠的心脏,获得长期存活。停止注射抗体后,CD4+T细胞群逐渐恢复,但供体心脏不被排斥,这时移植新的PVG·RTIa移植物也可长期存活,而移植无关大鼠的心脏,则迅速被排斥。
3.抗独特型(Id)抗体 抗T细胞抗原受体(TCR)的独特型抗体可诱导对移植抗原的耐受,这方面的实验研究已有报道,但人体应用尚未见报道。
4.抗粘附分子的抗体粘附分子是免疫细胞活化所必需的细胞表面分子。近来的研究证明,用抗粘附分子的单克隆抗体可阻断免疫细胞活化,延长移植物的存活,并导致免疫耐受的产生。
移植耐受的研究已经取得了许多重要进展。近来研究证明,不但未成熟的T细胞在胸腺内可经程序性死亡途径导致克隆排除,成熟的T细胞也可经此途径导致克隆排除,因此,移植耐受的研究必将对器官排斥的最终解决作出贡献。
第四篇 免疫学的临床应用
第二十章 免疫学检测法
免疫学检测技术的用途非常广泛,它们可用于有关免疫疾病的诊断、疗效评价及发病机制的研究。如对传染病、免疫增殖性疾病、免疫缺损病、超敏反应、自身免疫病、移植排斥反应肿瘤的免疫学检测,对诊断、治疗均有很大帮助。此外在医学生物学研究中对抗原性物质或细胞的定性、定量检查不仅推动了对各种免疫学现象的研究,而且扩大免疫学与医学生物许多领域的联系。本章仅介绍常用免疫学检测方法的原理,简要过程和实用意义。
第一节 抗原或抗体的检测
一、检测的原理
借助抗原和抗体在体外特异结合后出现的各种现象,对样品中的抗原或抗体进行定性、定量、定位的检测。
1.抗原与抗体的亲和力(affinity)抗原抗体的结合就像酶与底物的结合,激素与其受体的结合一样不是化学的反应,而是非共价键的可逆的结合。抗原决定簇和抗体分子可变区互补构型,造成两分子间有较强的亲和力。空间构型互补程度不同,抗原和抗体分子之间结合力强弱也不同。互补程度高,则亲和力强。此外,反应温度、酸碱度和离子浓度对抗原和抗体分子上各基因的解离性和电荷特性也有重要的影响,抗体与抗原决定簇之间的结合力大小可用亲合力来表示。高亲合力的抗体与抗原的结合力强,即使抗原浓度很低时也有较多的抗体结合抗原形成免疫复合物。
2.抗原或抗体外检测原理根据抗原抗体结合形成免疫复合物的性状与活性特点,对标本中的抗原或抗体进行定性、定位或定量的检测。定性和定位检测比较简单,即用已知的抗体和待检样品混合,经过一段时间,若有免疫复合物形成的现象发生,就说明待检样品中有相应的抗原存在。若无预期的现象发生,则说明样品中无相应的抗原存在。同理也可用已知的抗原检测样品中是否有相应抗体。
对抗原或抗体进行定量检测时,以反应中加入抗原和抗体的浓度与形成免疫复物的浓度呈函数关系。
(1)根据免疫复合物产生的多少来推算样品中抗原(或抗体)的含量:在一定的反应条件下,加入的已知抗体(或抗原)的浓度一定,反应产生的免疫复合物多少与待检样品中含有相应抗原(或抗体)量成正比。也就是抗体浓度一定时,免疫复合物越多则样品中的抗原量也越多。可用实验性标准曲线推算出样品中抗原(或抗体)的含量。如免疫单向扩散试验、免疫比浊试验和酶联免疫检测等都属于这类方法。
(2)抗原或抗体效价滴定的原理:当抗原抗体复合物形成多少不能反应抗原抗体反应强弱时,就不能以检测反应强度来对抗原或抗体进行定量。在实际工作中,把浓度低的反应成分(抗原或抗体)的浓度固定,把浓度高的另一种反应成分作一系列稀释。例如用人血清作抗原免疫3只家兔,比较3只家兔产生抗体的多少,即滴定3只兔血清抗体效价,可用双向琼脂扩散法来滴定,例如将抗体浓度固定,将抗原作不同的稀释度,分别将抗原或抗体滴入琼脂的相应小孔中,观察免疫兔血清与不同稀释度的抗原出现明显沉淀浅的抗原稀释度(如甲兔的抗体效价为1/2000,而丙免的是1/8000则可比较出后者比前者产生抗体的效价要高)。也就是表示效价的稀释度越高,样品中所含待检成分越多。因人血清(抗原)和抗体(免疫兔血清)相比,浓度高,故应稀释抗原。
二、抗原或抗体检测的实用意义
1.抗体检测的意义检测抗体可用于评价人和动物免疫功能的指标。抗体用于临床治疗或实验研究时也需做纯度分析和定量测定。临床上检测病人的抗病原生物的抗体、抗过敏原的抗体、抗HLA抗原的抗体、血型抗体及各种自身抗体,对有关疾病的诊断有重要意义。
2.抗原检测的意义可做为抗原进行检测的物质可分为以下四类:
(1)各种微生物及其大分子产物:用于传染病诊断、微生物的分类及鉴定以及对菌苗、疫苗的研究。
(2)生物体内各种大分子物质:包括各种血清蛋白(如各类免疫球蛋白、补体的各种成分)、可溶性血型物质、多肽类激素、细胞因子及癌胚抗原等均可做为抗原进行检测。在对这些成分的生物学作用的研究以及各种疾病的诊断有重要意义。
(3)人和动物细胞的表面分子:包括细胞表面各种分化抗原(如CD抗原)、同种异型抗原(血型抗原或MHC抗原)、病毒相关抗原和肿瘤相关性情抗原等。检测这些抗原对各种细胞的分类、分化过程及功能研究、对各种与免疫有关的疾病的诊断及发病机制的研究,均有重要意义。
(4)各种半抗原物质:某些药物、激素和炎症介质等属于小分子的半抗原,可以分别将它们偶联到大分子的载体上,组成人工结合的完全抗原。用其免疫动物,制备出各种半抗原的抗体,应用于各种半抗原物质的检测,例如对某些病人在服用药物后进行血中药物浓度的监测。对运动员进行服用违禁药品的检测,都是应用半抗原检测的方法。
三、抗原或抗体检测的方法
由于各种检测方法中所用的抗原性状不同,出现结果的现象也不同。最广泛应用方法有下述几种:
(一)沉淀反应
可溶性抗原与抗体结合,在两者比例合适时,可形成较大的不溶性免疫复合物。在反应体系中出现不透明的沉淀物,这种抗原抗体反应称为沉淀反应(precipitation neaction)。
1.环状沉淀试验先将含抗体的未稀释的免疫血清加到直径小于0.5cm的小试管底部。将稀释的含有可溶性抗原的材料重叠于上,让抗原与抗体在两液体的界面相遇,形成白色免疫复合物沉淀环,故名为环状沉淀试验(ring precipitationtest),此法简便易行,需用材料较多是其缺点。
2.单向免疫扩散试验单向免疫扩散试验(single immunodiffusion)是在凝胶中进行的沉淀反应。将抗体混入加热溶解的琼脂中,倾注于玻片上,制成含有抗体的琼脂板,在适当位置打孔,将抗原材料加入琼脂板的小孔内,让抗原从小孔向四周的琼脂中扩散,与琼脂中的抗体相遇形成免疫复合物。当复合物体积增加到一定程度时停止扩散,出现以小孔为中心的圆形沉淀圈,沉淀圈的直径与加入的抗原浓度成正相关。本方法简便,易于观察结果,可测定抗原的灵敏度(最低浓度)约为10~20μg/ml,常用于定量测定人或动物血清IgG、IgM、IgA和C3等,其缺点是需1~2天才能看结果(图20-1)
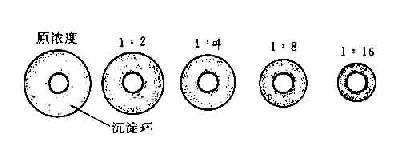
图20-1 单向免疫扩散试验示意图
3.免疫比浊法 当抗体浓度高,加入少量可溶性抗原,即可形成一些肉眼看不见的小免疫复合物,它可使通过液体的光束发生散射,随着加入抗原增多,形成的免疫复合物也增多,光散射现象也相应加强。免疫比浊法(immunonephelomytry)就是在一定的抗体浓度下,加入一定体积的样品,经过一段时间,用光散射浊度计(nephelometry)测量反应液体的浊度,来推算样品中的抗原含量。本法敏感、快速简便,可取代单向扩散法定量测定免疫球蛋白的浓度。
4,双向免疫扩散试验 双免疫扩散试验(double immunodiffusion)是在琼脂板上按一定距离打数个小孔,在相邻的两孔内分别放入抗原和抗体材料。当抗原和抗体向四周凝胶中扩散,在两孔间可出现2~3条沉淀线,本法常用于抗原或抗体的定性或定量检测,或用于两种抗原材料的抗原相关性分析(图20-2)。
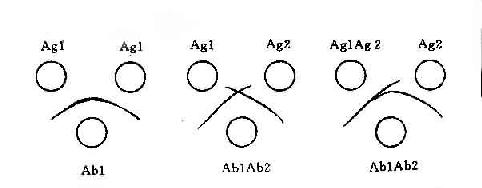
图20-2 双向免疫扩散试验示意图
5.对流免疫电泳 对流电泳(counterimmunoelectrophoresis)是一敏感快速的检测方法,即在电场作用下的双向免疫扩散。将琼脂板放入电泳槽内,使琼脂板的两孔沿着电场的方向,于负极侧的孔内加入抗原,于正极侧的孔内加入抗体,通电后,抗原带负电荷向正极泳动,抗体分子虽也带负电荷,但因分子量大,向正极的位移小,而受琼脂中电渗作用向负极移动,抗原和抗体能较快地集中在两孔之间的琼脂中形成免疫复合物的沉淀线。只需1小时左右即可观察结果。
6.免疫电泳 免疫电泳(immunoelectrophoresis)的方法分成两个步骤,即先进行电泳,再进行琼脂扩散。先将样品加入琼脂中电泳,将抗原各成分依电泳速度不同而分散开。然后在适当的位置上沿电泳方向挖一直线形槽,于槽内加入含有针对各种抗原混合抗体液,让各抗原成分与相应抗体进行双向免疫扩散,可形成多答卷沉淀线。常用此法进行血清的蛋白种类分析。对于免疫球蛋白缺损或增多的疾病的诊断或鉴别诊断有重要意义(图20-3)。


图20-3 免疫电泳法基本步示决图
7.免疫印迹法免疫印迹法(immunoblotting)又称为Western印迹法,用于AIDS的血清抗体检测。第一步,为电泳分离HIV抗原,在电场中根据分子量大小不同病毒抗原各成分散开。第二步,将电泳分离的蛋白质转移到硝酸纤维膜上(电印迹),然后将印迹有病毒抗原的硝酸纤维膜浸湿于病人血清中。如果病人血清中含有与一种或几种抗原相对应的抗体的话,则在该抗原印迹部位形成免疫复合物沉淀。在洗去未沉淀的抗原和抗体后,在膜上加标记的抗人免疫球蛋白的抗体,此抗体可以和病毒抗原与人抗体形成的免疫复合物发生反应,最后加入显色底物(如果抗人Ig是用酶标记的)或做放射自显影(抗人Ig用125Ⅰ标记)以显示结果(图20-4)。
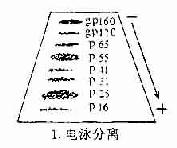
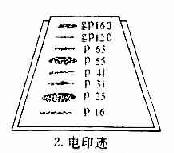
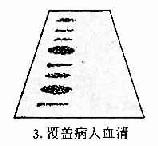

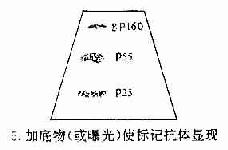
图20-4 用免疫印迹法检查患者血清中的HIV病毒抗体
第一步:经电泳将HIV混合抗合抗原按分子量大小分离;
第二步:将已分离的抗原经电印迹转移到硝酸纤维膜上;
第三步:将待检病人血清加入覆盖于硝酸纤维膜上;
第四步:加入标记的第二抗体使之覆盖膜上;
第五步:加入显色底物(或放射自显影)显现第二抗体
(二)凝集反应
细菌、红细胞或表面带有抗原的乳胶颗粒等都是不溶性的颗粒抗原,当与相应抗体结合,抗原与抗体结合形成凝集团块,即称为凝集反应(agglutination)。
1.直接凝集 直接凝集(directagglutination)是将细菌或红细胞与相应抗体结合产生的细菌凝集或红细胞凝集现象。可用于传染病诊断如肥达氏反应(Widal reaction)诊断伤寒病。或利用血细胞凝集现象检查血型。
2.间接凝集 间接凝集(indirectagglutination)是用可溶性抗原包被在乳胶颗粒或红细胞表面,与相应抗体混合出现的凝集现象。如用γ球蛋白包乳胶颗粒检测类风湿关节炎病人血清中的类风湿因子,用甲状腺球蛋白包被乳胶颗粒用于检测甲状腺球蛋的抗体。也可以将抗体吸附到乳胶颗粒上检查临床标本中的抗原,如细菌或真菌性脑膜炎抗体包被的乳颗粒,一旦与含有相应抗原的脑脊液混合,便可发生凝集,可进行快速诊断。故凝集反应即可测定抗原,也可测抗体,方法简便、敏感。
3.抗球蛋白试验 抗球蛋白试验(antiglobulintest,coombs test)的原理为间接凝集试验。例如应用于诊断自身免疫溶血性贫血症时,Rh+红细胞与抗Rh血清间的反应。因抗Rh抗体是IgG只有两个结合价,分子较小(不如IgM结合价多,分子大)很难直接引起Rh+红细胞凝集。如果加入抗IgG的抗体,就可帮助抗Rh的IgG的抗体凝集红细胞。也就是经抗Ig的作用提高凝集反应的灵敏度。
(三)补体参与抗原抗体反应
这一类反应主要包括溶血反应(hemolytic assay)、补体介导的细胞毒试验(complement mediated cytotoxicuty test)及补体结合试验(complement fixation test)。
1.溶血反应 抗体与红细胞表面抗原相遇,形成红细胞-抗体复合物即可使加入反应中的补体活化,导致红细胞溶解,此方法可用于红细胞的各种抗原或相应抗体的检测,此法比凝集反应敏感。溶血反应也是用于抗体分泌细胞即空斑形成细胞(PFC)检测的原理。
2.补体介导的细胞毒试验各种有核细胞与针对其表面抗原的抗体相遇,所形成的免疫复合物能活化反应中的补体,引起细胞膜穿孔,在一定时间内,细胞仍能维持一定的形态不破碎,加入水溶性染如伊红Y(eosin Y)或台盼蓝(trypanblue)后,染料即可进入被活化补体穿孔的细胞,不带相应抗原细胞膜保持完整的活细胞不着色。此方法可用于带各种抗原的细胞的检测,如进行细胞MHC抗原的鉴定,和进行淋巴细胞中T细胞总数或其亚类的计数。在一些免疫学实验中也可用这种方法,根据需要特异地消除带某种抗原的细胞。
3.补体结合试验当抗原(可溶性或颗粒性)与相应抗体结合,由于浓度低不出现可见反应时,应用补体结合试验可检出此抗原抗体反应,它比凝集反应或沉淀反应灵敏度高。本法包括两个抗原抗体系统。一为检测系统由待检样品与已知抗原(或抗体)组成;另一为指示系统,由绵羊红细胞(SRBC)和抗SRBC组成。另加入作为补体的新鲜豚鼠血清。试验时试管中先加入检测系统和补体,混合经37℃30分钟使抗原、抗体、补体形成复合物,再加入指示系统,如出现溶血现象,说明检测系统中没有相对应的抗原抗体,补体是游离的指示系统的SRBC和抗体结合而出现溶血,即为反应阴性。如不出现溶血,表明检测系统中有抗原抗体复合物并结合补体,则指示系统无多余的补体作用而没有溶血现象,即为阳性。
在敏感的抗原、抗体检测方法(如酶标方法)出现之前补体结合试验曾广泛用于检测各种细菌、病毒或螺旋体(如梅毒)的抗原或抗体,由于本试验影响因素多,结果不稳定现已被新检测方法所代替。
四、用标记抗体或抗原进行的抗原、抗体反应
用荧光素、同位素或酶标记抗体或抗原,用于抗原或抗体检测是目前广泛应用的敏感、可靠的方法。上述三种常用的标记物与抗原或抗体化学连接之后不改变后者的免疫特性。本方法可用于定性、定量或定位检测。
1.免疫荧光技术免疫荧光技术(immunofluorescencetechni)是用化学方法使荧光素标记的抗体(或抗原)与组织或细胞中的相应抗原(或抗体)结合,进行定性定位检查抗原或抗体的方法。
(1)直接荧光法:把荧光抗体加到待检的细胞悬液,细胞涂片或组织切片上进行染色,经抗原抗体反应后,洗去未结合的荧光抗体,将待检标本在荧光显微镜下观察,有荧光的部位即有相应抗原存在,此法可用于病毒感染细胞、带某种特异抗原的细胞(如T细胞和B细胞)或病原菌的检查,也可用于组织中沉着的免疫复合物的检查。本法的缺点是检查多种抗原,就需分别制备相应的多种标记抗体。
(2)间接荧光法:可克服直接法需制备多种荧光抗体的复杂操作。将组织或细胞上的抗原直接与相应抗体(不标记荧光)结合,此为第一抗体,再把能与第一抗体特异结合的荧光标记的抗免疫球蛋白抗体加入,此为荧光标记的第二抗体,观察结果与直接法相同。间接法比直接法敏感性高,如果用于检查抗原的第一抗体是人或动物的只需制备一种抗人或动物的免疫球蛋白荧光抗体(图20-5)。
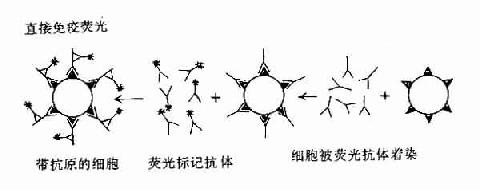
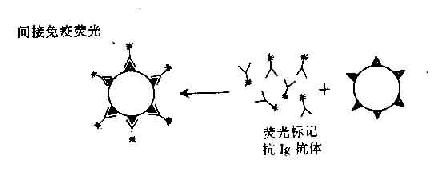
图20-5 免疫荧光直接法及间接法原理示意图
免疫荧光技术在传染病诊断上有广泛的用途,如在细菌、病毒、螺旋体感染的疾病,检查抗原或抗体,如查出IgM抗体,可做为近期接触抗原的标志,所以使用荧光标记抗IgM可诊断近期感染。除微生物学方面的应用外,还可利用单克隆抗体鉴定淋巴细胞的亚类。使用流式细胞仪(fluorescene-activated cell sorting,FACS),能自动检测细胞的大小、荧光强度。针对细胞表面不同抗原,可以使用两种不同的荧光染料,如用异硫氰荧光素(FITC)发黄绿荧光,用罗丹明(TMRITC)发红色荧光。由于荧光颜色不同标记两种不同的抗体,对同一细胞进行双标记染色。对淋巴细胞亚类鉴定起着巨大推动作用。应用间接荧光法也用于自身免疫病的抗核抗体检查。
2.放射免疫分析法放射免疫分析法(radioimmunoassay RIA)应用竞争性结合的原理,应作放射性同素标记抗原(或抗体)与相应抗体(或抗原)结合,通过测定抗原抗体结合物的放射活性判断结果,本方法可进行超微量分析,敏感性高,可用于测定抗原、抗体、抗原抗体复合物。本法常用的同位素有125Ⅰ和131Ⅰ。
放射免疫分析常用的有液相法和固相法两种:
(1)液相法:将待检标本(例如含胰岛素抗原)与定时的同位素标记的胰岛素(抗原)和定时的抗胰岛素抗体混合,经一定作用时间后,分离收集抗原抗体复合物及游离的抗原,测定这两部分的放射活性,计算结合率。在反应系统中,待检标本的胰岛素抗原与同位素标记的胰岛素竞争夺战 性与胰岛素抗体结合。非标记的抗原越多,标记抗原与抗体形成的复合物越少。非标记抗原含量与标记抗原抗体复合物的量呈一定的函数关系。预先用标准的非标记抗原作成标准曲线后,即可查出待检标本中胰岛素的含量(图20-6)。
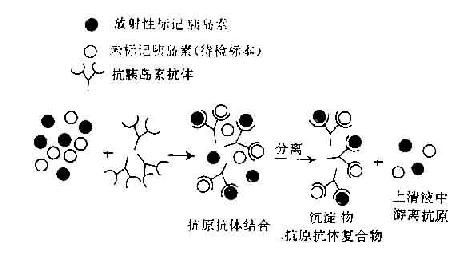
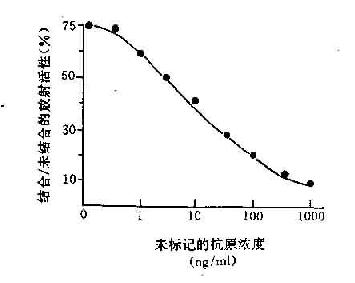
图20-6 液相放射免疫分析法原理及标准曲线
(2)固相法:将抗原或抗体吸附到固相载体表面,然后加待检标本,最后加标记抗体。测定固相载体的放射活性,常用的固相载体有溴化氰(CNBr)海豹化的纸片或聚苯乙烯小管(图20-7)。

图20-7 固相放射免疫分析法原理
放射免疫分析法应用范围广泛,包括多种激素(胰岛素、生长激素、甲状腺素等)维生素、药物、IgE等。
3.酶联免疫分析法酶联免疫分析法(enzyme immunoassay,EIA)是当前应用最广泛的免疫检测方法。本法将抗原抗体反应的特异性与酶对底物高效催化作用结合起来,根据酶作用底物后显色,以颜色变化判断试验结果,可经酶标测定仪作定量分析,敏感度可达ng水平。常用于标记的酶有辣根过氧化物酶(horseradish peroxidase)、碱性磷酶(alkaline phosphatase)等。它们与抗体结合不影响抗体活性。这些酶具有一定的稳定性,制成酶标抗体可保存较长时间。目前常用的方法有酶标免疫组化法和酶联免疫吸附法。前者测定细胞表面抗原或组织内的抗原;后者主要测定可溶性抗原或抗体。本法既没有放射性污染又不需昂贵的测试仪器,所以较放射免疫分析法更易推广。
图20-8 生物素-酶标亲合素系统反应示意图
(1)酶联免疫吸附试验(enzymelinked immunosorbent assay,ELISA):是与上述固相RIA相似的原理,将抗原或抗体吸附在固相载体表面。使抗原抗体反应在固相载体表面进行政区。可用间接法、双抗体夹心法或竞争法测定抗原或抗体。
(2)夹心法(sandwichassay):将已知的特异抗体包装在固相载体(塑料板凹孔或纸片上),加入待检标本,标本中的抗原即可与载体上的抗原结合,洗去未结合的材料后加入该抗原的酶标记抗体,洗去未结合的酶标抗体,加底物显色,用酶免疫检测仪测量颜色的光密度,可定量测定抗原。
间接法(indirecr ELISA)常用于检查特异抗体。先将已知特异抗原包被固相载体,加入待检标本(可能含有相应抗体),再加入酶标抗Ig的抗全(即第二抗体),经加底物显色后,根据颜色的光密度计算出标本中抗体的含量。
(3)BAS-ELISA:近年来对酶免设分析法的改进是使用生物素-亲合素-过氧化物酶复合物作为指示剂,组成一新的生物放大系统进一步提高检测的敏感度。可用来检测多种抗原抗体系统如细菌、病毒、肿瘤细胞表面抗原等。一个亲合素(avidin)分子可以结合4个生物素分子(biotin)。结合非常稳定。亲合素和生物素都可与抗全、酶、荧光素等分子结合,而不影响后者的生物活性。一个抗体分子可偶联90个生物素分子,通过生物素又可连接多个亲合素。因此大提高检测的敏感度。目前应用生物-酶标亲合素系统(biotinavidin system- ELISA,BAS-ELISA),它是通过生物素标记抗体连接免疫反应系统,同时借助生物素化酶或酶标亲合素引入酶与底物反应系统。
表20-1 免疫学测定方法敏感性比较
| 测定方法 | 敏感性(每升) |
| 单向免疫扩散试验 | <1~2mg |
| 双向免疫扩散试验 | <1mg |
| 火箭电泳 | <0.5mg |
| 对流电泳 | <0.1mg |
| 免疫电泳 | <5~10mg |
| 凝集试验 | 1μg |
| 被动血凝试验 | 1μg |
| 血凝抑制试验 | 0.1μg |
| 补体结合试验 | 0.1μg |
| 放射免疫分析法 | <1pg |
| 酶联免疫吸附试验 | <1ng |
| 定量免疫荧光分析 | <1pg |
第二节 体液免疫功能的检测
临床上一个反复发作的化脓感染,常使医生想到患者是否有免疫缺陷病,一般原发免疫缺陷发病年龄很小,而继发免疫缺陷病人多在30岁以上。绝大多数免疫缺陷病人多表现为体液和细胞免疫同时受损,所以应全面检查这两方面的功能。遗憾的是,目前应用的检测方法的局限性,其结果常难以得出明确结论。
一、免疫球蛋白的定量检测
1.血清免疫球蛋白的测定 血清免疫球蛋白(Ig)的测定是检查体液免疫功能最常用的方法。由于目前还没有发现由IgD和IgE缺陷所致疾病,所以通常检测IgG、IgM、IgA,这三类Ig就可以代表血清Ig的水平(表20-2)。检测发现三类Ig水平均明显低下,就可考虑体液免疫缺陷。但在分析儿童Ig水平时,应注意Ig的水平随年龄而变化。体液免疫功能缺陷首先考虑患者血清Ig 水平,如果所有类别Ig水平均降低,即称为一般性联低丙种球蛋白血症。如果免疫球蛋白水平极度低下,或IgG、IgM、IgA,三类Ig总量低于2mg/ml则称为严重低丙种球蛋白血症或无丙种球蛋白血症(agammaglobulinemia)。如果只一种或两种Ig水平降低,则称为异常丙种球蛋白血症(dysgammaglobulinemia)。一般性低丙种球蛋白血症多见于继发性免疫缺陷病。无丙种球蛋白血症常见于原发免疫缺陷病。但是常有约50%IgA缺陷病人无临床症状,伴有反复感染的IgA缺陷病人常同时有IgG的缺陷。常规的定量检测血中Ig的方法是单向免疫扩散和免疫比浊法。
表20-2 人类血清免疫球蛋白正常量
| 类别 | 变化较大时期(mg/ml) | 达到成人水平与均值 |
| IgG | 1 ~5岁8.0 ~10.0 4 ~8岁 8.0 ~10.0 9 ~13岁 10 ~11.0 |
8岁以后 12.0±2.6mg/ml (150±321IU/ml) |
| IgA | 1 ~2岁0.5 4 ~8岁 1~1.5 9 ~13岁 1.5~2.0 |
12岁以后 2.0±0.5mg/ml (140±36IU)/ml) |
| IgM | 1 ~4岁1.0 4 ~8岁 1.0 9 ~13岁 1.0 |
男性1岁 女性2岁 1.1±0.3mg/ml (130±40IU)/ml) |
注:IU=国际单位
2.分泌型IgA(SIgA)的测定SIgA是粘膜抗感染的重要因素,但是粘膜抗感染还包括少量渗出的IgM和IgG,还有细胞免疫的作用。由SIgA缺陷病人常可检测出针对牛奶或其他食物蛋白的沉淀抗体和自身抗体,说明机体对抗原蛋白质吸收异常,同时也存在免疫调节系统的功能紊乱。一般来说血清IgA缺陷病人常伴有SIgA缺陷,反之亦然。说明在机体中血清IgA和SIgA之间有某种生物相关性。最近也有报导少数SIgA缺陷病人的血清IgA水平正常,因而分别检查血清中和分泌液中IgA水平还是有必要的。目前用免疫比浊法可较精确地测定分泌液中IgA时和IgM和IgC水平。在用单向免疫扩散和免疫比浊法定量IgA时,因抗血清是针对这两型共有的α链的,故不能区分SIgA和血清来源的IgA。而应用抗分泌小体的抗体用酶免疫分析法,可区分血清IgA和分泌型IgA,并可对SIgA进行定量。
二、常见抗体的测定
检测体液免疫功能的另一种方法是定量测定正常人体内的几种常见的抗体水平。常见的抗体通常是指嗜异性凝集素、抗溶血素O抗体以及麻疹病毒、脊髓灰质炎病毒的抗体。
在严重免疫缺陷病人缺乏上述抗体,常见抗体的缺损可验证或支持免疫蛋白测定的结果。然而对于比较复杂的免疫缺陷,由于这类抗体主要反映过去的免疫应答能力,此外这种初次应答能力持续期短,易于消退,所以对新近发生的继发性免疫缺陷的诊断帮助不大。
三、B细胞数目及功能的检测
原发性免疫缺陷和继发性免疫缺陷均可导致体液免疫功能下降。原发性体液免疫功能缺陷可能由于B细胞分化障碍,细胞内合成Ig功能紊乱或由于抑制性细胞功能过强。继发性体液免疫功能降低可能由于蛋白质大量丢失,蛋白质吸收障碍、营养不良、免疫抑制治疗的副作用,病毒感染(艾滋病)等。在诊断原发性体液免疫功能缺损中可检查B细胞的数目和功能以确定造成缺损的原因。
1.外周血B细胞数目的检测首先进行常规的外周血白细胞总数和分类计数检查,这些结果是评价病人免疫系统功能状态的基本资料。由于在全血中淋巴细胞所占比例很少,而T细胞和B细胞不能藉形态学特征分类,所以外周血B细胞数检测需先从全血分离出富含淋巴细胞的单个核细胞(peripheral bloodmononuclear cell,PBM)。再依靠B细胞表面有免疫球蛋白分子或其他特征来检查B细胞。常用的方法是将待检者的PBM用FITC标记的免疫抗人Ig作直接免疫荧光染色,在荧光显微镜下显荧光的细胞为带有表面免疫球蛋白的B细胞。正常人B细胞的约占PBM的10%。
2.外周血B细胞功能的检测分离受检者血液PBM细胞,体外培养时加入B细胞刺激物如RWM(美洲商陆刺激素)或SAC(金黄色莆萄球菌来源的刺激物)后由B细胞变成Ig分泌细胞的数量。体液免疫功能缺损患者,其PBM对PWM和SACA刺激的反应降低,产生Ig分泌细胞数正常人显著减少。在进一步检查这种免疫缺损的原因,则应检查是由B细胞或TH细胞缺损所致,还是由于TS细胞数量或活性增强引起的。
抗体形成细胞计数:检查人类Ig分泌细胞是用反向溶血空斑检测(reversed hemolytic plaque assay)法。将待检人的PBM、用SPA包被的SRBC(SPA-SRBC)、兔抗人Ig抗体、补体四种成分混合,灌入用两张玻片做成的小室,密封好,放入温箱培养1-3小时,,在此期间,作为抗人Ig抗体的免疫IgG的FC段可与SRBC表面SPA结合,当Ig分细胞分泌出游离的Ig分子时,这些人Ig分子与SRBC表面的抗人Ig抗体结合形成免疫复合物,即可活化补体,使SPA-SRBC溶解,因此在Ig分泌细胞周围形成一个圆形的溶血区,称为溶血空斑,每一个溶血的空斑就代表一个Ig分泌细胞。
检查小鼠Ig分泌细胞应用的溶血空斑试验比较简单,即SRBC免疫注射小鼠,4天后取脾制成单个细胞悬液,加入一定量SRBC(靶细胞)混合,在补体参加下,产生抗体的细胞分泌出的Ig与SRBC(抗原)结合在补体作用下,溶血,表现肉眼可见的溶血空斑。计数空斑数代表分泌抗体的细胞数。
第三节 细胞免疫功能的检测
细胞免疫(CMⅠ)是由多种细胞相互作用的结果。免疫细胞间相互作用导致多种细胞因子的释放。因此细胞功能测定不仅涉及T细胞的数量和功能与包括各类因子活性测定,因此评价机体的细胞免疫功能不仅程序复杂,且很难标准化
一、迟发型过敏反应的体外检测方法
皮肤试验和接触性过敏的诱发是检测迟发型过敏反应(DTH)的两种常用方法。皮肤试验中诱发对曾经使病人致敏的抗原的再次应答,而接触性过敏是测试受者对从未接触过的物质发生致敏的能力。
1.皮肤试验 用皮肤试验诊断DTH,常用的抗原有结核菌纯蛋白衍生物(PPD)、腮腺炎病毒、念珠菌素等,在人类试验时在前臂皮内注射少量可溶性抗原,24~48小后,测量红肿硬结的大小,硬结直径大于10mm即被看作为阳性。表明受试者对该病原菌有了一定的细胞免疫能力,若皮试无反应,可用更高浓度的抗原重复试验,若仍无反应即为阴性,需排除皮试技术误差,也可能受试者从未接触过此抗原,也可能由于细胞免疫功能缺损,或由于细胞免疫功能缺损,或由于严重感染(麻疹、慢性播散性结核)造成的无反应性。
2.接触性过敏常应用低分子量化合物如二硝基氯苯(DNCB)诱生接触性过敏。化合物与皮肤蛋白质结合而导至DTH反应。在动物试验时,初次皮肤上涂抹DNCB后间隔7~10天再激发刺激,则皮肤出现即为阳性。此试验人类已不使用。
二、细胞免疫的体外检测方法
体外检测淋巴细胞的数量和功能,最易采集的是血标本,首先需分离或纯化淋巴细胞,一般使用萄聚糖-泛影葡胺配成比重为1.077的淋巴细胞分层液,当将血液重叠于淋巴细胞分层液之上离心时,由于红细胞(1.092)、多形核白细胞(1.090)、淋巴细胞(1.070)的比重不同而相互分开。淋巴细胞和单核细胞在血浆和分层液交界处形成一薄层。仔细分出这一薄层的细胞,其中淋巴细胞占80%,单核细胞占20%,淋巴细胞中T细胞占80%,B细胞占4%~10%,其作为非DT、非B细胞。
1.T细胞计数
(1)E花环法:人类T细胞表面有SRBC受体(CD2)能与SRBC结合形成玫瑰花环样结构,将经分层液分离现的RBM悬液与SRBC在含有血清的平衡盐水中混合,经37℃培养5~10分钟放4℃过夜,取细胞悬计数,外周血淋巴细胞中约70%~80%淋巴细胞结成花环即为T细胞。目前此方法已用来分离T细胞,而不用做T细胞计数。
(2)用单克隆抗体计数T细胞:将人的PBM分成三等份,分别用小鼠抗人CD3、CD4和CD8的单克隆抗体作第一抗体与细胞结合,再用FITC标记的兔抗小鼠IgG抗体作第二抗体进行间接免疫荧光染色,在荧光显微镜下或流式细胞仪检测结果,在PBM中被CD3抗体染上荧光的细胞称为CD3+细胞即总T细胞。正常人在PBM中T细胞占70%~80%。正常人的CD4+细胞和CD8+细胞之和应与CD3+细胞数一致。CD4+细胞与CD8+细胞的比值正常人约为2/1而艾滋病患者则比值小于1.7。
2.T细胞活化试验T细胞能被非特异的物质称为有丝分裂原所激活而向淋巴母细胞转化。T细胞转化过程可伴随有DNA、RNA、蛋白质的合成增加,最图导致细胞分裂。在光学显微镜下可计数转化后的淋巴细胞数,也可用氚标记的胸腺嘧啶核苷(3HTdR)掺入正在分裂的淋巴细胞,用液闪测定仪检查掺入正在分裂的淋巴细胞,用液测量仪检查掺入的3H-TdR的多少确定淋巴细胞转化率。最近有一种不用同位素,又可用仪器测量的淋巴细胞增殖反应的检查法,称为MTT检测法,MTT是一种甲氮唑盐,它是细胞线粒体脱氢酶的底物,细胞内的酶可将MTT分解产生蓝黑色甲(fromazan)产物。该产物的多少与活性细胞数正相关。结果可用酶标检测仪(595mm)测量汇丰银行密度,做为MTT法的检查指标。此法的结果与3H-TdR掺入法平行,并能反应试验中的活细胞数(表20-3)。
表20-3 淋巴细胞增殖反应的刺激物
| 分裂原 | T细胞 | B细胞 |
| 植物血凝素(PHA) | + | - |
| 刀豆蛋白A(ConA) | + | - |
| 美洲商陆(PWM) | + | + |
| 葡萄球菌蛋白A(SPA) | ±﹡ | + |
| 副伤寒杆B(SPB) | ± | + |
注: PWH主要是T细胞分裂原,也可通过刺激T细胞分泌可溶性因子诱导B细胞增殖分化;
﹡SPA诱导B细胞分裂不需要T细胞协助,但诱导B细胞激活抗体分泌细胞需要T细胞协助
3.细胞毒试验TC细胞、NK细胞、LAK细胞、TIL细胞对其靶细胞有直接的细胞毒(杀伤)作用。常用的栓测细胞毒效应的方法是51Cr-Na2Cro4盐水溶液与靶细胞胞混合,于37℃培养1小时左右,51Cr即可进入靶细胞,与胞浆蛋白结合,洗去游离的51Cr后,即可得到51Cr标记的靶细胞,将待检细胞毒性的细胞与51Cr标记的靶细胞混合(比例约为50:1或100:1)靶细胞被杀伤越多,释放到上清液中的液游离的51Cr越多,且不能被其他细胞吸收。用γ射线测量仪检测上清液中的cpm值,即可计算出待检细胞杀伤活性的高低。
细胞毒试验检测Tc细胞效应功能是否健全,及经IgG介导的ADCC效应,或NK细胞在抗肿瘤免疫中的作用是有意义的。
4.混合淋巴细胞的反应(MIR)是体外研究T细胞的较好的方法,双向MLR常被用来筛选骨髓移植的供体。来自不同供体的淋巴细胞分别与病人的淋巴细胞混合培养4~5天,在最后8小时掺入51TdR掺入法测T细胞的反应性。或用细胞毒法观察受刺激的T细胞与活的靶细胞混合(靶细胞来自与刺激细胞相同的个体)如果T细胞受刺激后产生了细胞毒T细胞,可杀死活的细胞,根据靶细胞释放51Cr的多少算出T细胞移动抑制因子)和LIF(白细胞移动抑制因子)来评估细胞免疫功能。近年来应用测定IL-2的免疫酶技术,操作简单,并能定量以取代了MIF和LIF的测定。单个核细胞与分裂原一起培养24小时,然后测定清液中的IL-2活性。在细胞免疫功能缺损时,特别是AIDS病人,IL-2分泌明显降低。而有些疾病,如多发性硬化、类风湿关节炎、移植排斥反应等病人体内血清中IL-2水平升高,表明病人T细胞活性增高。发生移植排斥反应的病人尿中IL-2也可升高。
也可用酶联免疫吸附试验测定各种体液中活化的T细胞脱落的IL-2受体(CD25),一般来说IL-2的水平和IL-2受体水平是平行的,IL-2和IL-2受体的检测可用于对某些疾病的监测,如移杆排斥、自身免疫病以及接受免疫抑制治疗的病人。
对体外培养的细胞进行细胞因子产生能力检测是检查细胞培养上清液中细胞因子的生物活性或抗原性。现已可用核酸杂交技术,即从组织中或细胞中提取RNA,与同位素或酶标记的该种细胞因子的cDNA探针作分子杂交试验,即印迹(dot blotting)或Northern印迹,若查出有某种因子的mRNA存在,即说明该细胞在所处培养条件下有产生某种细胞因子的能力。
第四节 分子生物学技术在免疫学诊断中的应用
一、BCR和TCR基因重排检测
对血细胞恶性变如白血病、淋巴瘤等的诊断,长期以来多应用细胞形态学检查和免疫细胞表型分析。由于这些方法在特异性和敏感性上的限制,对于丢失了细胞表面标志,或分化较好难以和正常细胞区别。也可能由于恶性细胞数量少,混在大量正常细胞中难以查出。近年来由于分子生物学技术的广泛应用,且由于获得了Ig片段的特异基因克隆及TCR各链的基因克隆,在此基础上发展了应用Ig基因重排作为B细胞的特异标记,诊断B细胞来源的白血病的和应用TCR基因重排为T细胞特异标志诊断T细胞恶性变引起的白血病,从而将白血病的细胞学分类法提高到基因水平分析,建立了免疫基因型诊断的新方法,大大提高了诊断的敏感性和特异性。该方法不但可以确定细胞来源、分化程度,且由于DNA分析的高度敏感性而能查出显微镜不能看到的微小变化,从而能监测治疗效果,发现微量残留病变细胞。
该方法首先要从待检的细胞中分离出总DNA。在非T、非B细胞的Ig和TCR基因不发生重排称为胚基因(germ line)。而T和B细胞在分化早期即有TCR和Ig基因重排,重排后的Ig和TCR片段,转移至硝酸纤维膜或尼龙膜上,然后用同位素或酶标记的Ig血病细胞进行分类鉴定,若有Ig基因重排说明恶性细胞来源于B细胞,若有TCR基因发生重排,则为T细胞来源的。如果既无Ig基因重排,又无TCR基因重排的淋巴细胞则属非T、非B细胞来源的瘤细胞。
二、限制酶切片段长度多态性组织配型法
迄今,一直是血清学和细胞学方法进行HLA抗原结构分析,最近已开始应用分子生物学基因克隆技术进行HLA定型。由于人们已常握了HLA共同和特异的抗原的核苷酸序列,才有可能用此新方法进行组织配型检验。
限制酶切片段长度多态性(restriction fragment length polymorphism,RFLP)组织配型技术的原理是目前已掌握了编码HLA抗原的核苷酸序列,包括各等位基因共有的和专有的序列。HLA-A、-B、-C位点的Ⅰ类重链基因的核苷酸序列有高度同源性,由这些基因片段克隆可得HLAⅠ类专用的探针,因为检测HLAⅠ类抗原序列的标志,目前也已得到Ⅱ类抗原特异的探针。由于HLA等位基因的多态性是表现在其核苷酸序列的差异上,由这些基因中克隆出的特异DNA片段,就可检测这些基因的差别。由于核苷酸序列不同,被限制性内切酶作用部位(切点)也不同,这种酶切点只有4~6个核苷酸长度。因此来源于不同HLA单倍型的DNA可被一种内切酶切成不同长度的片段。在实际工作中,从细胞中提取基因组DNA(genomic DNA)的多态性比实际HLA-Ⅱ类抗原的多态性还要复杂,因为基因的内含子(不转录基因)序列不同,和外显子(转录并翻译成蛋白质)序列差别均在酶切后的细胞总DNA中。
RFLP组织配型检测主要包括4个步聚(印迹):①提取细胞总DNA,用限制性内切酶消化;②凝胶电泳;③将凝胶中分离好的DNA片段转移至尼龙膜上;④经变性处理后用同位素标记的探针进行分子杂交。经放射自显影,得到显影带(bands)。即可得知分子量大小不同的DNA片段(图20-9)。
图20-9用RFLP进行组织定型比较三个标本的组织定型
RFLP组织配型实验是用于血清学或细胞学检测失败的样品,如HLA抗原不表达(裸细胞)细胞脆性大而破碎,淋巴细胞减少没有足够的样品时。由于分子生物学方法采样少、特异、敏感的优点可弥补常规方法的不足。此外,RFLP组织配型法还可查出DNA变异及基因重组的情况,而血清学方法则不能。PFLP组织配型为器官移植、骨髓移植选择适宜的供体,用比较供体,受体限制酶切片段的长度的差异。两者的RFLP越接近。差别越小,移植效果越好,近年来发展的PCR-RFLP以其简单、敏感、可靠、价廉且无需同位素等优点,已取代了RELP法。
第二十一章 免疫治疗学
免疫治疗(immunotherapy)至少已有百多年的历史。近十多年来,由于单克隆抗体技术的发展以及基因治疗和重组细胞因子疗法的兴起,免疫治疗已逐渐发展成为一门崭新的学科-免疫治疗学。免疫治疗包括两方面的内容,一是免疫调节,即用物理、化学和生物学手段调节机体的免疫功能,使原有的免疫功能增强或减弱;二是免疫重建,即将免疫功能正常个体的造血干细胞或淋巴细胞移植给患有免疫功能缺陷的个体,使后者的免疫功能正常全部或部分得到恢复。根据治疗的性质和对免疫系统的作用特点,可将免疫治疗分为免疫增强和免疫抑制两大类(表21-1)。
表21-1 免疫治疗的分类
| 治疗剂 | 免疫增强疗法 | 免疫抑制疗法 |
| 化学制剂 | 左旋咪唑、噻米替啶,多聚核苷酸、乙氨酮、乙丙酯肌苷、二乙二硫氨甲酸 | 烷化剂抗代谢药、皮质激素、亚黄酰吡啶、环磷酰胺、硫唑嘌呤 |
| 微生物制剂 | 卡介苗,胞壁酰二肽、短小棒状杆菌、多糖类 | 环孢素A,抗生素类、FK-506,优青糖苷 |
| 免疫系统产物 | iRNA,胸腺,免疫球蛋白,细胞因子, | 抗淋巴细胞球蛋白(ALG),多克隆抗体或单克隆抗体-毒素偶联物,细胞因子-毒素偶联物 |
| 其它 | 中草药,骨髓细胞,胚脂肝,胸腺移植 | 射线照射,胸导管引流,血浆交换疗法,切除扁桃体,淋巴结,脾,胸腺 |
第一节 免疫增强药物及免疫增强疗法
免疫增强包括免疫刺激、过继免疫和免疫重建。免疫刺激疗法即应用免疫刺激剂激发免疫系统,而达到增强免疫功能的目的;过继免疫治疗即用同种异体的淋巴细胞输给受者,使受者的免疫功能得到补偿。免疫重建是通过胚胎肝或骨髓干细胞移植,用于治疗原发性和继发性免疫缺陷病。这些具有免疫增强作用的制剂称为免疫增强剂。
一、免疫增强剂
目前已知具有免疫增强作用的药物主要有以下几类:
(一)化学制剂
一些化学制剂具有明显的免疫刺激作用,如左旋咪唑、多聚核苷酸、西咪替丁、异丙酯骼酐等都能通过不同的方式刺激机体的免疫功能。其中左旋咪唑和西咪替丁是研究得比较多的免疫增强药物。
1.左旋咪唑(levomisole)原为一种驱虫药,70年代发现具有免疫增强作用。其作用方式是刺激吞噬细胞的吞噬功能;促进T细胞产生IL-2等细胞因子,增强NK细胞的活性等。左旋咪唑对免疫功能低下的机体具有较好的免疫增强作用,对正常的机体作用不明显。
2.西咪替丁(cimetidine)是一种组胺拮抗剂,可与组胺2(HZ)受体结合,竞争性地抑制组胺的作用,临床主要用于胃及十二指肠溃疡治疗。80年代初,由于发现TS细胞表面具有H2受体;组胺与TS细胞的H2受体结合后,可使TS细胞活化而抑制机体的免疫功能。西咪替丁通过与TS细胞的H2受体结合,可以阻止组胺对TS细胞的活化作用,从而增强机体的免疫功能。研究表明,西咪替丁可以增强正常或免疫缺损小鼠的免疫功能,并能明显抑制肿瘤的生长。
左旋咪唑和西咪替丁都有临床应用治疗肿瘤的报道。
3. isoprinosine (ISO)为人工合成的免疫调节剂。体外实验表明,ISO能促进免疫功能,如T细胞增殖,活化T细胞花环形成及活化巨噬细胞。在组织培养中可抑制DNA和RNA病毒的复制,这些病毒包括单纯疱疹病毒,腺病毒,牛痘病毒(DNA病毒)。和脊髓灰质炎病毒,A及B型流感病毒,鼻病毒。ECHO病毒和东方马脑炎病毒(RNA病毒)。体内试验证实有增强细胞介导的免疫反应且具有抗病毒感染作用,临床效应证实,ISO可明显缩短大多数病毒性疾病的病程,显著减轻临床症状,这些病毒性疾病包括流感病毒感染,鼻病毒感染,唇及外阴疱疹,带状疱疹病毒感染,病毒性肝炎,风疹和病毒性耳炎。此外,由于ISO的免疫调节作用和抗HIV活性,可能在AIDS的治疗中有一定疗效。
(二)微生物制剂
微生物以及从微生物提出的某些成分具有非特异地刺激免疫功能的作用,研究和应用比较多的有:
1.卡介苗(BCG) 卡介苗为牛型结核杆菌的减毒活疫苗,原用于结核病的预防接种,后发现它具有强的非特异免疫刺激作用。卡介苗可活化巨噬细胞;促进IL-1、IL-2、IL-4、TNF等多种细胞因子的产生;增强NK细胞和K细胞的活性。卡介苗目前已用于多种肿瘤的免疫治疗,其中膀胱癌术后,用卡介苗灌注防止肿瘤复发具有肯定的效果。此外,卡介苗也应用于黑色素瘤、白血病的治疗取得一定的治效。卡介苗的有效成分是其细胞壁成分、胞壁酰二肽。
2.短小棒状杆菌 短小棒状杆菌是一种革兰氏阳性小型棒状杆菌,可以非特异地刺激机体免疫功能,临床局部射治疗黑色素瘤有一定疗效。其作用方式主要是活化巨噬细胞,促进IL-1、IL-2等细胞因子的产生。短小棒状杆菌有发热、头痛、恶心、呕吐等副作用。与其他化疗药物联合应用治疗肿瘤,可减少剂量,提高治疗效果。
3.微生物提取物 一些细菌和真菌,尤其食用菌如香茹、灵芝等的多糖成分,有明显的非特异免疫刺激作用,可以促进淋巴细胞的分裂、增殖并产生多种细胞因子。目前一些真菌多糖已在临床应用,作为传染病和恶性肿瘤的辅助治疗药物。
4.中药及其有效成分 许多药物植物,如黄芪、人参、枸杞子、刺五加等都有明显的免疫刺激作用。一些中药方剂,从中药中提取的多糖,如黄芪多糖、枸杞子多糖、刺五加多糖等发现具有增加抗体产生,促进IL-2、IL-3、IFN-γ等细胞因子的分泌,明显地提高机体的细胞免疫和体液免疫功能及抗衰老的作用。
二、免疫增强药物的适应症和副作用
免疫增强药物的副作用一般较轻。卡介苗等局部应用的副作用是引起广泛的炎症反应性组织损伤。这种副作用与功能相关,难以避免。口服副作用较经,但疗效也降低,多糖类药物肌肉注射时有一过性发热等,一般均不影响治疗。
(一)恶性肿瘤
晚期肿瘤病人大多伴有免疫功能紊乱,在手术切除肿瘤后,使用免疫增强药物有利于调整机体的免疫功能,提高机体抗肿瘤作用,减少肿瘤的复发。在肿瘤放疗和化疗以后,机体免疫功能受到明显损害,使用免疫增强药物可以促进机体免疫功能的恢复。目前在肿瘤治疗中应和较多的免疫增强药物有卡介苗、香茹多糖、多抗甲素等。
(二)免疫缺陷病
先天性免疫缺陷病用免疫增强药物治疗没有明显的疗效。对某些继发性免疫缺陷,应用免疫增强疗法有一定的效果。实验研究发现,刺五加多糖、枸杞、当归补血汤等中药都可促进辐射损伤小鼠的免疫功能恢复,加速骨髓移植后造血与免疫功能的重建。在艾滋病的治疗中,一些中药方剂取得一定疗效。患者主观症状改善,CD4+T细胞比例上升等。
(三)传染病
一些感染性疾病,特别是慢性、反复性的病毒感染、真菌感染,往往都与免疫功能紊乱有关。应用免疫增强疗法,可以起到明显的辅助治疗效果。如左旋咪唑在治疗儿童上呼吸道反复感染,复发性疱疹性口腔炎等都有较好的效果。
第二节 免疫抑制剂及免疫抑制疗法
一、免疫抑制剂
目前发现的具有免疫抑制作用的药物主要有以下几类:
(一)化学制剂
用于免疫抑制治疗的化学制剂大部分来源于抗肿瘤物,主要有烷化剂和抗代谢药二大类。
1.烷化剂常用的烷化剂包括氮芥、苯丁酸氮芥、环磷酰胺等。它们的作用主要是破坏DNA的结构,从而阻断其复制,导致细胞死亡,因此处于增殖中的细胞对烷化剂比较敏感。T、B细胞被抗原活化后,进入增殖、分化阶段,对烷化剂的作用也较敏感,因此可以达到抑制免疫应答的作用,在烷化剂中,环磷酰胺的毒性较小,应用最广,它对B细胞有很强抑制作用,因此在适当剂量下可以明显抑制抗体的产生。T细胞的不同亚类对环磷酰胺的敏感性不同,TS细胞较敏感,TH细胞稍差。目前环磷酰胺主要用于器官移植和自身免疫病的治疗。
2.抗代谢药用于免疫抑制的抗代谢药主要有嘌呤和嘧啶的类似物,以及叶酸拮抗剂二大类。前者如硫唑嘌呤,主要通过于干扰DNA复制而起作用;后者有氨甲蝶呤等,主要通过干扰蛋白质合成起作用。硫唑嘌呤对淋巴细胞作用有较强的选择性抑制作用,因此在器官移植中应用较多。
(二)激素
许多激素都可以通过神经-内分泌-免疫网络参与免疫应答的调节。糖皮质激素具有明显的抗炎和免疫抑制作用,对单核-巨噬细胞、中性粒细胞、T、B细胞均有较强的抑制作用,因此在临床广泛应用于抗炎及各型超敏反应性疾病和治疗。在器官移植中,糖皮质激素也是常用的免疫抑制剂。
(三)真菌代谢产物
70年代后期起,陆续发现一些真菌的代谢产物具有选择性较好的强免疫抑制作用,主要有环孢素A和FK-506。它们的临床应用极大推动了器官移植的发展。
1.环孢素A(cyclosporinA,CsA) CsA是从真菌培养液中分离出来的一种只含11个氨基酸的环形多肽。对T细胞,尤其是TH细胞有较好的选择性抑制作用,而对其他的免疫细胞的抑制作用则相对较弱,因此在抗器官移植排斥中取得了很好的疗效;也用于自身免疫病的治疗,因此是一种具有很高临床使用价值的免疫抑制剂。目前已用人工合成的方法大量生产,取得重大社会、经济效益。CsA可通过多种途径抑制T细胞的功能,其作用机制较复杂,目前已有很多深入的研究,在此不再赘述。
2.FK-506 FK-506是80年代发现的一种大环丙酯抗生素,由土壤真菌产生。与CsA一样,FK-506也可选择性地作用于T细胞,且作用比CsA强10~200倍。FK-506与CsA合用具有明显的协同作用。目前FK-506已在临床器官移植中应用,取得了很好的效果。FK-506的作用机制也较复杂,目前发现它可明显抑制IL-2、IL-3、IFN-γ等细胞因子的产生;抑制IL-2受体的表达。
(四)中药及其有效成分
一些中药具有不同程度的免疫抑制作用。目前我国研究开发的雷公藤多甙是效果较为肯定的免疫抑制剂。实验研究证明,雷公藤多甙能明显抑制小鼠的细胞免疫和体液免疫功能,能延长皮肤、心、肾等移植物的存活时间,在骨髓移植中能降低GVHR的强度;在临床应用治疗肾炎、红斑狼疮、类风湿关节类等都取得明显疗效,且无明显毒副作用,因此是一种有前途的免疫抑制药。雷公藤制剂与其它免疫抑制剂联用可能会有更好的效果。其他一些中药如川芎、当归等也有报道可抑制免疫应答,但剂量关系很大,不同的剂量可有免疫增强和抑制二种作用,故临床应用效果难以肯定。
二、免疫抑制药物的适应症和副作用
免疫抑制药物大多具有明显的毒副作用,主要是骨髓抑制,肝、肾毒性等。CsA无明显骨髓抑制作用是其优点,但肝、肾毒性较大,长期使用病人不易承受。由于免疫抑制药物的作用是非特异的,所以可导致机体免疫功能的下降,病原微生物感染增加,长期应用可能提高肿瘤发病率。
由于已开发出了具有强力免疫抑制的药物,免疫抑制疗法在临床治疗上的重要性和效果,都远较免疫增强疗法令人印象深刻。目前,免疫抑制疗法主要应用于:
(一)抗移植排斥
器官移植的主要障碍是移植排斥。目前尚无有效的诱导免疫耐受的方法,因此免疫抑制药物的应用是器官移植成功的关键措施之一。免疫抑制药物在器官移植中应用详见第二十章。
(二)变态反应性疾病
机体对变原的免疫应答,可导致变态反应性疾病的发生。抑制免疫应答可以控制变态反应强度,缓解症状。临床上严重的Ⅰ型超敏反应发生时,用激素治疗可取得明显疗效。治疗变态反应一般不使用环磷酰胺,CsA等强力免疫抑制药。
(三)自身免疫病
一些自身免疫性疾病,如类风湿关节炎、红斑狼疮以及肾病综合症等用免疫抑制药物治疗能明显改善症状,抑制病程发展,临床使用较多的免疫抑制药主要是激素。近来我国使用雷肥藤制剂治疗肾炎、红斑狼疮和类风湿关节炎都取得明显效果。少数报道应用CsA和环磷酰胺治疗自身免疫病也有明显效果。
(四)感染性炎症
在细菌性炎症过程中,中性粒细胞的浸润及大量炎症介质的释放,会引起组织的严重损伤。免疫抑制药物可抑制炎症反应的强度,减轻反应症状;与有效抗生素配合应用,有利于炎症的控制。临床应用较多的是激素,如强的松等。应用激素控制细菌性炎症应注意与抗菌药物合用,以免感染扩散。
第三节 生物应答调节与免疫治疗
一、生物应答调节剂的概念
早已发现,机体对抗原的特异免疫功能可以通过抗体或免疫细胞转移给其他个体,称为被动免疫疗法,或过继免疫疗法(adoptive immunotherapy)。近30年来,免疫学研究的一个重要进展,是确认为免疫系统本身,包括免疫器官、免疫细胞、免疫分子,甚至免疫分子的基因都是具有重要治疗价值的生物制剂,从而大大地扩展了过继免疫疗法的概念和使用范围。70年代中期单克隆抗体技术的建立,以及80年代开始应用基因工程技术生产的各种细胞因子,把免疫治疗推向了一个新的阶段,并提出了生物应答调节剂(biological response modifier,BRM)的概念。目前BRM的概念已被广泛接受,但它本身尚无一个固定的限定范围。从目前这一概念的应用情况看,BRM主要是指免疫系统的成分和免疫应答的产物,它们从器官到基因种类很多,组成了一个大的新型药物系统。在多种疾病的免疫治疗上起重要作用。
二、生物应答调节剂的种类及生物学功能
(一)造血干细胞与胸腺
一切免疫细胞都来自于造血干细胞,造血干细胞移植是免疫器官的移植。用于移植的造血干细胞主要来自于骨髓和胚肝细胞。造血干细胞移植可重建受者的造血与免疫功能,在临床具有重要的治疗价值。目前,骨髓和胎移植已是治疗各种血液系统疾病、遗传病、放射病以及某些免疫缺陷病的重要手段。
胸腺是T细胞分化、成熟的重要免疫器官。胸腺移植已被用于治疗由于先天胸腺发育不良的免疫缺陷患者。
(二)单克隆抗体与导向药物
1.单克隆抗体(monoclonal antibody,McAb)抗体作为免疫治疗的生物制剂,在临床应用已有一个世纪。长期以来,抗体主要来自于经抗原免疫的异种劝物(如马)的血清。由于一种抗原(如细菌)有多个不同的抗原决定基,每一个抗原决定基都可以被一个B细胞克隆所识别,并产生出针对它的抗体,因此这种异种免疫血清中含明的抗体是多克隆抗体(polyclonalantibody)。多克隆抗体的一个明显缺点是特异性较差。针对一个抗原的多克隆抗体与其他抗原发生叉反应的现象是很普遍的。用淋巴细胞杂交瘤技术,已可以大量制备针对任何抗原决定基的单克隆抗体。其中一些具有治疗价值。如抗T细胞及其亚类的抗CD3、抗CD4、抗CD8单克隆抗体,它们在移植排斥及某些自身免疫病的应用中,已取得了明显的疗效。抗各种细胞表面分子的单克隆抗体,如抗IL-2受体的单克隆抗体,抗粘附分子的单克隆抗体都有明显的免疫调节作用,在自身免疫病的治疗,防止肿瘤转移等方面都有重要的使用潜力。
单克隆抗体的另一重要应用是肿瘤治疗。在过去10多年来,抗各种人肿瘤相关抗原的单克隆抗体得到了广泛的研究。目前,针对各种人肿瘤细胞的单克隆抗体已经大量制备出来,它们都能较特异地识别肿瘤细胞,而基本上不与正常组织起反应。抗肿瘤单克隆抗体在肿瘤的诊断及分型方面是一种有用的工具;但在肿瘤的治疗上,由于大多抗肿瘤单克隆抗体不能直接杀伤肿瘤细胞,所以单独应用肿瘤没有明显效果。
2.导向药物(targeteddrug)利用抗肿瘤单克隆抗体特异识别肿瘤细胞的特点,将它作为导向载体与各种杀伤分子,如毒素、抗癌药物、放射性核素等,进行化学交联,可以构建成一种对肿瘤细胞具有高度特异的强杀伤活性的杂交分子,称为导向药物。抗肿瘤单抗与毒素的交联物又称免疫毒素(immunotoxin,IT)。用于制备IT的毒素主要有:①植物毒蛋白,这类毒素主要有篦麻毒素(ricin)、相思子毒素(abrin)以及苦瓜毒素(mormordin)、商陆抗病毒蛋白(PAP)、天花粉蛋白等。它们都可以通过灭活核糖体,阻断蛋白质合成,杀伤靶细胞。②细胞毒素,主要有白喉外毒素(DT),绿脓杆菌外毒素(PE)等。它们主要通过抑制延长因子-2阻断蛋白质合成,杀死靶细胞。上述这些毒素都具有极强的毒性,1个分子的篦麻毒素进入细胞细胞就足以杀死该细胞。因此,免疫毒素是目前研究最多的导向药物。
抗肿瘤单克隆抗体与抗癌药物的交联物,又称免疫交联物(immunoconjugate)。用以制备这类导向药物的抗癌药物主要有阿霉素(adriamycin)、氨甲蝶呤(MTX)等。它们主要通过阻断DNA合成来杀死靶细胞。抗癌药物杀细胞作用比毒素低得多,增加抗体分子携带的药物分子数,可以增强其杀伤活性,但常会导致抗体活性的下降与丧失。这类导向药物的优点是分子较小,同时如有非特异杀伤不会有严重后果。但由于杀伤力不高,临床应用前景不被看好。
用于与抗肿瘤单克隆抗体交联的放射性核素主要有125Ⅰ、131Ⅰ、111In等。这种放射性免疫交联物可用于肿瘤的诊断与治疗。与肿瘤细胞结合的放射性免疫交联物放出的γ射线,可以用γ照像机摄像,获得清晰的肿瘤显像。此技术称为放射免疫显像(radioimmunoimaging);放射性免疫交联物也可用于肿瘤治疗。标记了大量高能核素的抗肿瘤单克隆抗体与肿瘤细胞结合后,可以通过辐射损伤杀死靶细胞及其周围的肿瘤细胞。此技术又称为放射免疫治疗( radiommunotherapy)。放射性免疫交联物在临床肿瘤的诊断与治疗上有广阔的应用前景,是目前肿瘤导向诊断与治疗的一个十分活跃,并富有成果的领域。
目前,基因重组抗体与基因重组免疫毒素都已研究成功,并在实验研究中取得了好的效果,这为大规模地生产各种单克隆抗体和导向药物奠定了基础。
(三)细胞因子及细胞因子活化的免疫细胞
1.细胞因子细胞因子是机体免疫细胞和一些非免疫细胞产生的一组具有广泛生物活性的异质性肽类调节因子,包括:①白细胞介素(ILS);②集落刺激因子(CSF);③干扰素(IFN);④肿瘤坏死因子(TNF);⑤转化生长因子(TGF);⑥小分子免疫肽,如转移因子、胸腺肽等。各种细胞因子的生物学功能,请参考第六章。它们的临床治疗,目前主要有两个方面:
(1)促进造血与免疫功能重建:在放射性骨髓损伤,肿瘤放疗及化疗后以及骨髓移植后,机体的免疫功能十分低下,极易受细菌、病毒及其他致病因子的感染。大多数细胞因子除作用于成熟的免疫细胞,参与免疫应答的调节外,还具有促进骨髓干细胞增殖、分化心及促进T细胞在胸腺内发育的作用。如各各CSF、EPO、IL-3、IL-6、IL-7、IL-9、干细胞因子(SCF)等都可刺激不同的造血干细胞的增殖分化。不同细胞因子之间可协同促进造血与免疫功能的重建。
(2)恶性肿瘤的治疗:一些细胞因子,如TNF本身就有杀肿瘤细胞作用。但大多数细胞因子本身并不能杀伤肿瘤细胞,但可通过增强免疫系统的功能来抑制肿瘤的生长。IL-2、IL-4、IL-6、IFN-γ等都有这种作用。但细胞因子单独应用,需大剂量,毒副作用强,因此目前认为细胞因子联合应用或细胞因子与抗肿瘤药物联合应用,可以提高肿瘤的治疗效果,减少副作用。
2.细胞因子活化免疫细胞细胞因子肿瘤治疗中的另一种方法是通过体外与免疫细胞共育,以使这些细胞活化,然后再回输入患者体内,进行过继免疫细胞疗法。在这方面研究得最多的是淋巴细胞激活的杀伤细胞(lymphokine activated killercell,LAK)和肿瘤浸润淋巴细胞(tumor infiltrating lymphocyte,TIL)。LAK是从肿瘤患者外周血中分离的单个核细胞,在体与IL-2共育,使之活化并增殖后,回输入病人体内,可抑制肿瘤生长。TIL是从手术切除的患者肿瘤组织中分离出来的淋巴细胞,它们在体外经IL-2活化并增殖后,再回输入患者体内,具有比LAK细胞更强的杀肿瘤活性。LAK和TIL回输体内后,必需同时应用大剂量的IL-2才能维持其活性。据国外报道,大约有20%~30%的患者对这种过继转移免疫细胞疗法有效,其中以黑色素瘤和肾癌最为敏感。我国用胎脾和胎胸腺细胞经体外IL-2活化后,进行了过继转移治疗肿瘤也取得了相同的治疗效果。
(四)肿瘤疫苗
肿瘤疫苗与传统疫苗在概念上不同,它主要不是用于肿瘤的预防,而是通过瘤苗的接种来刺激机体对肿瘤的免疫应答来治疗肿瘤。由于人肿瘤相关抗原的免疫原性很弱,不足以有效地刺激机体的免疫应答,因此单纯用自身或同种肿瘤细胞作瘤苗治疗肿瘤的效果不好。用肿瘤细胞卡介苗等佐剂联合应用,能提高免疫应答效果,在一些晚期肿瘤患者取得了一定的治疗效果。说明用肿瘤疫苗激发机体的抗肿瘤免疫应答是完全可能的。
目前,肿瘤疫苗主要有二类:第一类对肿瘤抗原表位性质的研究,导致了肿瘤分子疫苗的产生。具有肿瘤抗原决定基的肽疫苗和多糖疫苗已在研制,有的已在临床试用。此外,利用某种抗独特型抗体个有抗原内影像的特点,研制肿瘤独特型疫苗的工作也在进行中。第二类,确定了抗肿瘤免疫应答的主要效应细胞是TC细胞,导致了基因转染的肿瘤细胞疫苗的出现。TC细胞识别肿瘤表面的肽抗原(peptide)与MHCⅠ类分子的复合物,必需要有第二信号才能活化。这个第二信号可以由TC细胞表面的CD28分子与粘附分子B7的结合来提供。B7分子主要存在于活化的B细胞和抗原呈递细胞表面。在通常性况下,肿瘤细胞合成的胞内抗原经胞内降解、处理后,形成的肿瘤肽抗原与MHCⅠ类分子结合后,共表达于瘤细胞表面。其表面的肽抗原-MHCⅠ类分子复合物被TC细胞识别,同时其表面B7分子也与TC细胞的CD28分子结合,这样TC细胞就可被活化,从而杀伤带有该肽抗原的肿瘤细胞。大多数肿瘤细胞由于没有B7分子,因此肿瘤细胞虽具有肽抗原与MHCⅠ类分子的复合物,但由于不能提供第二信号,所以不能活化TC细胞。如果用B7分子的基因转染肿瘤细胞,使之表达膜B7分子则这种肿瘤细胞就可以直接活化TC细胞,并被其杀伤。因此,B7分子又称为共刺激因子(costimulating factor)。此外,用IL-2、IL-4、IL-6、IFN-γ等基因转染的肿瘤细胞本身可以分泌这此细胞因子,导致抗肿瘤免疫应答的产生。实验研究发现,接种了这种工程化的肿瘤细胞后,原先已生长的亲本(parent)野生型肿瘤细胞也开始消退;并且以后再接种野生型的肿瘤细胞也不再生长,这说明工程化的肿瘤细胞具有典型的抗肿瘤疫苗效应。有意义的是,用放射线将这种工程瘤苗杀伤死后,仍然可以获得相同的抗肿瘤效果。这就为肿瘤疫苗的研制展示了光明的前景。
(五)肿瘤基因治疗
在疾病的基因治疗中,肿瘤的基因治疗是后起,然而进展极为迅速的领域。与其他体细胞基因治疗相比,肿瘤细胞作为基因治疗的靶细胞,具有两个优越性:其一,恶性肿瘤细胞有易识别的、较特异的表面标志(肿瘤相关抗原),因此易于体内目的基因的导向转染;第二,肿瘤细胞是基因治疗要消灭的靶子(这与其它体细胞基因治疗的目的不同),目标较单纯,所以较少难以预测的后果,较为安全。目前肿瘤基因治疗可考虑的目的基因有:①抗癌基因,如P53等;②癌基因反义链;③药物敏感基因;④细胞因子基因。转染了P53基因和癌基因反义链的肿瘤细胞,其恶性表型明显受控,出现逆转为正常细胞的征象。但肿瘤细胞是由于多基因突变的结果,单一基因的纠正前景并不看好。目前公认最有希望的是细胞因子基因治疗。因为细胞因子基因转染的肿瘤,可通过激活免疫系统来杀死肿瘤细胞,不必考虑肿瘤细胞本身恶性变的机制,易于达到治疗目的。目前困难之处在于如何将细胞因子基因在体内导向转染肿瘤细胞,这在目前还没有很理想的方法。目前采取的办法是在体外用细胞因子转染TIL细胞,使之本身能分泌细胞因子,,如IL-2等,然后将此工程化的TIL细胞回输体内,希望它能识别肿瘤细胞,并通过活化免疫系统来杀伤转移的或残存的肿瘤细胞。目前用TNF和IL-2基因转染的TIL细胞治疗晚期人黑色素瘤的临床试验已经开始,并有报告取得明显疗效。这种“体外-体内”(ev-vivo)法基因治疗的关键是基因运载细胞(ITIL细胞)能否特异识别肿瘤细胞,对此目前还有争论。
免疫治疗作为一种疾病治疗手段,至今已有一个多世纪,只是在近20年才取得突破性的进展,这主要表现在两个方面:①选择性较好的强力免疫抑制剂CsA等发现,它们的临床应用使器官移植的面貌发生了革命性的变化;②生物应答调节剂的出现,大批量生产已导致一代新型药物的产生,已形成一个庞大的生物技术产业。上述研究的进展,使免疫治疗已作为一种独立的治疗手段被医学所接爱受,它们的临床应用将从根本上改变疾病治疗的面貌。免疫治疗学的进一步发展,必将对整个医学的发展产生深远的影响。
主要参考资料
郑武飞,等.医学免疫学.北京:人民卫生出版社,1989.
龙振洲,等. 医学免疫学.北京:北京医科大学教材料,1991.
何俊森,等. 医学免疫学.郑州:河南科学技术出版社,1993.
吴敏毓,等. 医学免疫学.合肥:中国科技大学出版社,1993.
丁桂凤,等编译. 医学免疫学纲要.北京:北京医科大学-中国协和医科学联合出版社,1992.
AbbasAk,et al.Cellular and Molecular Immunology.Philadelphia W.B.Saunders Co.1991
RoittI.M.Essential Immunology,7th ed.London Black well Scientific Publications,1991.
RoittI.M.er al.Immunology.3rd ed.Mandarin Offset(HK)Ltd,1993.
StitesDP. Terr AI.Basic and Clinical Immunology.8th ed,1994.
