1.抗体是球蛋白 早在40年代初期Tiselius和Kabat就证实了抗体活性与血清丙种球蛋白组分相关。他们用肺炎球菌多糖免疫家兔,可获得高效价免疫血清。然后加入相应抗原吸收以除去抗体,将去除抗体的血清进行电泳图谱分析,发现丙种球蛋白(γ-G)组分明显减少,从而证明了抗体活性是存在于丙种球蛋白内。
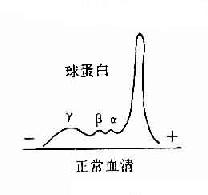
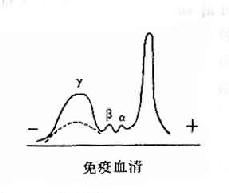
图2-1 兔血清电泳分离图
其后,经对不同免疫血清的电泳分析,超速离心分析和分子量测定等方法,发现大部分抗体活性存在于γ球蛋白内,但有小部分抗体活性可存在于β球蛋白内。它们的离心常数分别为7S和平共处9S,分子量分别为16万和万。因此它们分别被命名为7Sγ球蛋白分子(16万)19S,β2巨球蛋白分子(β2M,90万)和β2A球蛋白分子,所以从早期对抗体性质的研究证明抗体不是由均质性球蛋白组成,而是由异性球蛋白组成。
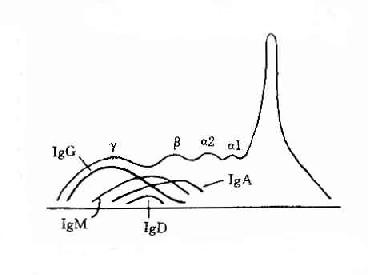
图2-2 不同类免疫球收白的电泳分离图
2.免疫球蛋白为了准确描述抗体蛋白的性质,在60年代初提出将具有抗体活性的球蛋白称为免疫球蛋分子(immunoglobulin,lg)。γ球蛋白则必称为IgG,β2M称为IgM,而β2A称为IgA。其后又相继发现二类Ig分子,分别称为IgE和IgD。故在血清中现已发现有五类免疫球蛋白分子,它们的结构与功能是各不相同的。
