Porter等对血清IgG抗体的研究证明,Ig分子的基本结构是由四肽链组成的。即由二条相同的分子量较小的肽链称为轻链和二条相同的分子量较大的肽链称为重链组成的。轻链与重链是由二硫键连接形成一个四肽链分子称为Ig分子的单体,是构成免疫球蛋白分子的基本结构。Ig单体中四条肽链两端游离的氨基或羧基的方向是一致的,分别命名为氨基端(N端)和羧基端(C端)。
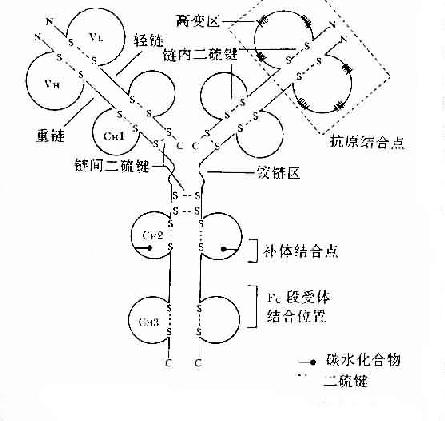
图2-3 免疫球蛋白分子的基本结构示意图
(一)轻链和重链
由于骨髓瘤蛋白(M蛋白)是均一性球蛋白分子,并证明本周蛋白(BJ)是Ig分子的L链,很容易从患者血液和尿液中分离纯化这种蛋白,并可对来自不同患者的标本进行比较分析,从而为Ig分子氨基酸序列分析提供了良好的材料。
1.轻链(lightchain,L) 轻链大约由214个氨基酸残基组成,通常不含碳水化合物,分子量约为24kD。每条轻链含有两个由链内二硫键内二硫所组成的环肽。L链共有两型:kappa(κ)与lambda(λ),同一个天然Ig分子上L链的型总是相同的。正常人血清中的κ:λ约为2:1。
2.重链(heavychain,H链) 重链大小约为轻链的2倍,含450~550个氨基酸残基,分子量约为55或75kD。每条H链含有4~5个链内二硫键所组成的环肽。不同的H链由于氨基酸组成的排列顺序、二硫键的数目和们置、含的种类和数量不同,其抗原性也不相同,根据H链抗原性的差异可将其分为5类:μ链、γ链、α链、δ链和ε链,不同H链与L链(κ或λ链)组成完整Ig的分子分别称之为IgM、IgG、IgA、IgD和IgE。γ、α和δ链上含有4个肽,μ和ε链含有5个环肽。
(二)可变区和恒定区
通过对不同骨髓蛋白或本周蛋白H链或L链的氨基酸序列比较分析,发现其氨基端(N-末端)氨基酸序列变化很大,称此区为可变区(V),而羧基末端(C-末端)则相对稳定,变化很小,称此区为恒定区。
1.可变区(variableregion,V区) 位于L链靠近N端的1/2(约含108~111个氨基酸残基)和H链靠近N端的1/5或1/4(约含118个氨基酸残基)。每个V区中均有一个由链内二硫键连接形成的肽环,每个肽环约含67~75个氨基酸残基。V区氨基酸的组成和排列随抗体结合抗原的特异性不同有较大的变异。由于V区中氨基酸的种类为排列顺序千变万化,故可形成许多种具有不同结合抗原特异性的抗体。
L链和H链的V区分别称为VL和VH。在VL和VH中某些局部区域的氨基酸组成和排列顺序具有更高的变休程度,这些区域称为高变区(hypervariable region,HVR)。在V区中非HVR部位的氨基酸组面和排列相对比较保守,称为骨架区(fuamework rugion)。VL中的高变区有三个,通常分别位于第24~34、50~65、95~102位氨基酸。VL和VH的这三个HVR分别称为HVR1、HVR2和HVR3。经X线结晶衍射的研究分析证明,高变区确实为抗体与抗原结合的位置,因而称为决定簇互补区(complementarity-determining regi-on,CDR)。VL和VH的HVR1、HVR2和HVR3又可分别称为CDR1、CDR2和CDR3,一般的CDR3具有更高的高变程度。高变区也是Ig分子独特型决定簇(idiotypic determinants)主要存在的部位。在大多数情况下H链在与抗原结合中起更重要的作用。
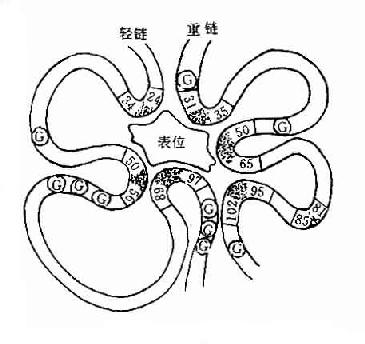
图2-4 与表位结合高变区示意图(G表示相对保守的甘氨酸)
2.恒定区(constantregion,C区) 位于L链靠近C端的1/2(约含105个氨基酸残基)和H链靠近C端的3/4区域或4/5区域(约从119位氨基酸至C末端)。H链每个功能区约含110多个氨基酸残基,含有一个由二锍键连接的50~60个氨基酸残基组成的肽环。这个区域氨基酸的组成和排列在同一种属动物Ig同型L链和同一类H链中都比较恒定,如人抗白喉外毒素IgG与人抗破伤风外毒素的抗毒素IgG,它们的V区不相同,只能与相应的抗原发生特异性的结合,但其C区的结构是相同的,即具有相同的抗原性,应用马抗人IgG第二体(或称抗抗体)均能与这两种抗不同外毒素的抗体(IgG)发生结合反应。这是制备第二抗体,应用荧光、酶、同位毒等标记抗体的重要基础。
(三)功能区
Ig分子的H链与L链可通过链内二硫键折叠成若干球形功能区,每一功能区(domain)约由110个氨基酸组成。在功能区中氨基酸序列有高度同源性。
1.L链功能区 分为L链可变区(VL)和L链恒定区(CL)两功能区。
2.H链功能区 IgG、IgA和IgD的H链各有一个可变区(VH)和三个恒定区(CH1、CH2和CH3)共四个功能区。IgM和IgE的H链各有一个可变区(VH)和四个恒定区(CH1、CH2、CH3和CH4)共五个功能区。如要表示某一类免疫蛋白H链恒定区,可在C(表示恒定区)后加上相应重链名称(希腊字母)和恒定区的位置(阿拉伯数字),例如IgG重链CH1、CH2和CH3可分别用Cγ1、Cγ2和Cγ3来表示。
IgL链和H链中V区或C区每个功能区各形成一个免疫球蛋白折叠(immunoglobulin fold,Ig fold),每个Ig折叠含有两个大致平行、由二硫连接的β片层结构(betapleated sheets),每个β片层结构由3至5股反平行的多肽链组成。可变区中的高变区在Ig折叠的一侧形成高变区环(hypervariable loops),是与抗原结合的位置。
3.功能区的作用
(1)VL和VH是与抗原结合的部位,其中HVR(CDR)是V区中与抗原决定簇(或表位)互补结合的部位。VH和VL通过非共价相互作用,组成一个FV区。单位Ig分子具有2个抗原结合位点(antigen-bindingsite),二聚体分泌型IgA具有4个抗原结合位点,五聚体IgM可有10个抗原结合位点。
(2)CL和CH上具有部分同种异型的遗传标记。
(3)CH2:IgGCH具有补体Clq结合点,能活化补体的经典活化途径。母体IgG借助CH2部分可通过胎盘主动传递到胎体内。
(4)CH3:IgGCH3具有结合单核细胞、巨噬细胞、粒细胞、B细胞和NK细胞Fc段受体的功能。IgMCH3(或CH3因部分CH4)具有补体结合位点。IgE的Cε2和Cε3功能区与结合肥大细胞和嗜碱性粒细胞FCεRI有关。
4.铰链区(hingeregion)铰链区不是一个独立的功能区,但它与其客观存在功能区有关。铰链区位于CH1和CH2之间。不同H链铰链区含氨基酸数目不等,α1、α2、γ1、γ2和γ4链的铰链区较短,只有10多个氨基酸残基;γ3和δ链的铰链区较长,约含60多个氨基酸残基,其中γ3铰链区含有14个半胱氨酸残基。铰链区包括H链间二硫键,该区富含脯氨酸,不形成α-螺旋,易发生伸展及一定程度的转动,当VL、VH与抗原结合时此氏发生扭曲,使抗体分子上两个抗原结合点更好地与两个抗原决定簇发生互补。由于CH2和CH3构型变化,显示出活化补体、结合组织细胞等生物学活性。铰链区对木瓜蛋白酶、胃蛋白酶敏感,当用这些蛋白酶水解免疫球蛋白分子时常此区发生裂解。IgM和IgE缺乏铰链区。
(四)J链和分泌成分
1.J链(joining chain) 存在于二聚体分泌型IgA和五聚体IgM中。J链分子量约为15kD,由于124个氨基酸组成的酸性糖蛋白,含有8个半胱氨酸残基,通过二硫键连接到μ链或α链的羧基端的半胱氨酸。J链可能在Ig二聚体、五聚体或多聚体的组成以及在体内转运中的具有一定的作用。
2.分泌成分(secretorycomponent,SC) 又称分泌片(secretory piece),是分泌型IgA上的一个辅助成分,分子量约为75kD,糖蛋白,由上皮细胞合成,以共价形式结合到Ig分子,并一起被分泌到粘膜表面。SC的存在对于抵抗外分泌液中蛋白水解酶的降解具有重要作用。
(五)单体、双体和五聚体
1.单体 由一对L链和一对H链组成的基本结构,如IgG、IgD、IgE血清型IgA。
2.双体 由J链连接的两个单体,如分泌型IgA(secretory IgA,SIgA)二聚体(或多聚体)IgA结合抗原的亲合力(avidity)要比单体IgA高。
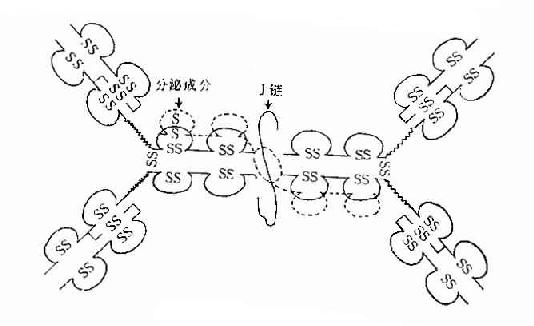
图2-5 分泌型IgA结构示意图
3.五聚体 由J链和二硫键连接五个单体,如IgM。μ链Cys414(Cμ3)和Cys575(C端的尾部)对于IgM的多聚化极为重要。在J链存在下,通过两个邻近单体IgMμ链Cys之间以及J链与邻μ链Cys575之间形成二硫键组成五聚体。由粘膜下浆细胞所合成和分泌的IgM五聚体,与粘膜上皮细胞表面pIgR(poly-Ig receptor,pIgR)结合,穿过粘膜上皮细胞到粘膜表面成为分泌型IgM(secretory IgM)。
(六)酶解片段
1.本瓜蛋白酶的水解片段Porter等最早用木瓜蛋白酶(papain)水解兔IgG,从而区划获知了Ig四肽链的基本结构和功能。
(1)裂解部位:IgG铰链区H链链间二硫键近N端侧切断。
(2)裂解片段:共裂解为三个片段:①两个Fab段(抗原结合段,fragmentof antigen binding),每个Fab段由一条完整的L链和一条约为1/2的H链组成,Fab段分子量为54kD。一个完整的Fab段可与抗原结合,表现为单价,但不能形成凝集或沉淀反应。Fab中约1/2H链部分称为Fd段,约含225个氨基酸残基,包括VH、CH1和部分铰链区。②一个Fc段(可结晶段,fragmentcrystallizable),由连接H链二硫键和近羧基端两条约1/2的H链所组成,分子量约50kD。Ig在异种间免疫所具有的抗原性主要存在于Fc段。
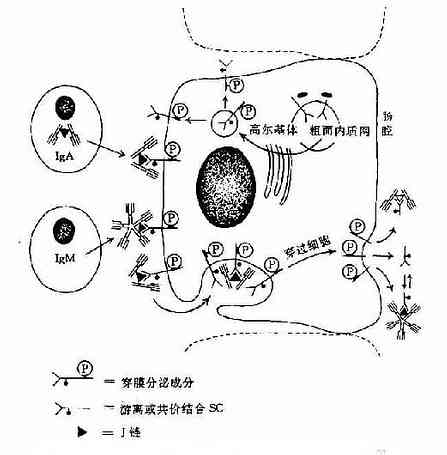
图2-6 人分泌型IgA和分泌型IgM的局部产生示意图
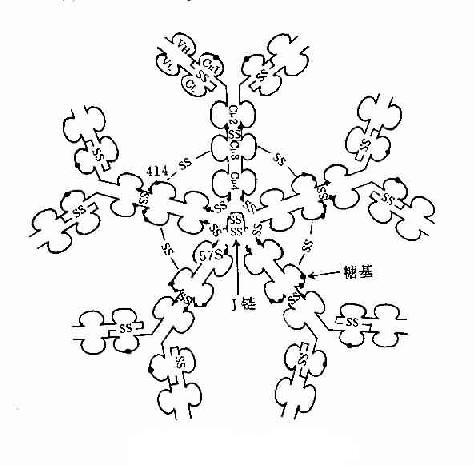
图2-7 IgM结构示意图
2.胃蛋白酶的水解片段Nisonoff等最早用胃蛋白酶(pepsin)裂解免疫球蛋白。
(1)裂解部位:铰链区H链链间二硫键近C端切断。
(2)裂解片段:
1)F(ab')2:包括一对完整的L链和由链间二硫键相连一对略大于Fab中Fd的H链,称为Fd',约含235个氨基酸残基,包括VH、VH1和铰链区。F(ab')2具有双价抗体活性,与抗原结合可发生凝集和沉淀反应。双价的F(ab')2与抗原结合的亲合力要大于单价的Fab。由于应用F(ab')2时保持了结合相应抗原的生物学活性,又减少或避免了Fc段抗原性可能引起的副作用,因而在生物制品中有较大的实际应用价值。虽然F(ab')2与抗原结合特性方面同完整的Ig分子一样,但由于缺乏Ig中部分,因此不具备固定补体以及与细胞膜表面Fc受体结合的功能。F(ab')2经还原等处理后,H链间的二硫可发生断裂而形成两个相同的Fab'片段。
2)Fc'可继续被胃蛋白酶水解成更小的片段,失去其生物学活性。
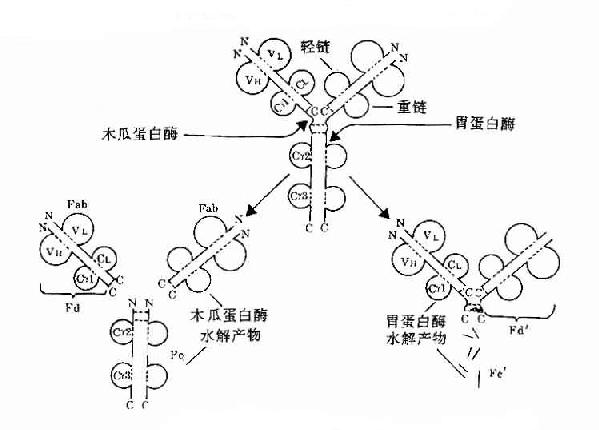
图2-8 Ig酶水解片段示意图
