参与补体经典激活途径的成分包括C1~C9。按其在激活过程中的作用,人为地分成三组,即识别单位(Clq、Clr、Cls)、活化单位(C4、C2、C3)和膜攻击单位(C5~C9),分别在激活的不同阶段即识别阶段、活化阶段和膜功击阶段中发挥作用。
(一)识别阶段
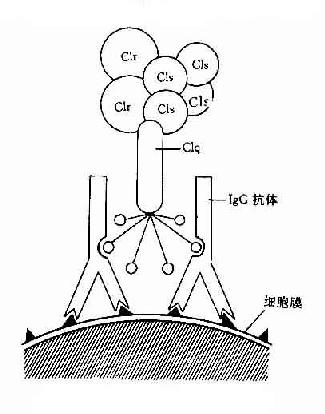
图3-1 CIq示意图
C1与抗原抗体复合物中免疫球蛋的补体结合点相结合至C1酯酶形成的阶段。
C1是由三个单位Clq、Clr和Cls依赖Ca+结合成的牢固的非活性大分子。
Clq:Clq分子有6个能与免疫球蛋白分子上的补体结合点相结合的部位。当两个以上的结合部位与免疫球蛋白分子结合时,即Clq桥联免疫球蛋白之后,才能激活后续的补体各成分(图3-1)IgG为单体,只有当其与抗原结合时,才能使两个以上的IgG分子相互靠拢,提供两个以上相邻的补体结合点不能与Clq接触,只有当IgM与抗原结合,发生构型改变,暴露出补体结合部位之后,才能与Clq结合。一个分子的IgM激活补体的能力大于IgG。Clq与补体结合点桥联后,其构型发生改变,导致Clr和Cls的相继活化。
Clr:Clr在C1大分子中起着连接Clq和Cls的作用。Clq启动后可引起Clr构型的改变,在活性的Clr,后者可使Cls活化。
Cls:Clr使Cls的肽链裂解,其中一个片段Cls具有酯酶活化,即CI的活性。此酶活性可被C1INH灭活。
在经典途径中,一旦形成Cls,即完成识别阶段,并进入活化阶段。
(二)活化阶段
CI作用于后续的补体成分,至形成C3转化酶(C42)和C5转化酶(C423)的阶段。
C4:C4是CI的底物。在Mg2+存在下,CI使C4裂解为C4a和C4b两个片段,并使被结合的C4b迅速失去结合能力。CI与C4反应之后能更好地显露出CI作用于C2的酶活性部位。
C2:C2虽然也是CI的底物,但CI先在C4作用之后明显增强了与C2的相互作用。C2在Mg2+存在下被CI裂解为两个片段C2a和C2b。当C4b与C2a结合成C4b2b(简写成C42)即为经典途径的C3转化酶。
C3:C3被C3转化酶裂解在C3a和C3b两个片段,分子内部的疏酯基(-S-CO-)外露,成为不稳定的结合部位。硫酯基经加水分解,成为-SH和-COOH也可与细菌或细胞表面的-NH2和-OH反应而共价结合。因此,C3b通过不稳定的结合部位,结合到抗原抗体复合物上或结合到C42激活C3所在部位附近的微生物、高分子物质及细胞膜上。这点,对于介导调理作用和免疫粘附作用具有重要意义。C3b的另一端是个稳定的结合部位。C3b通过此部位与具有C3b受体的细胞相结合(图3-2)。C3b可被I因子灭活。C3a留在液相中,具有过敏毒素活性,可被羟肽酶B灭活。
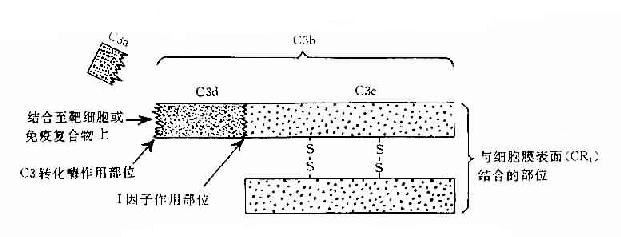
图3-2 C3分子及其裂解产物生物活性示意图
C3b与C42相结合产生的C423(C4b2b3b)为经典途径的C5转化酶。至此完成活化阶段。
(三)膜攻击阶段
C5转化酶裂解C5后,继而作用于后续的其他补体成分,最终导致细胞受损、细胞裂解的阶段。
C5:C5转化酶裂解C5产生出C5a和C5b两个片段。C5a游离于液相中,具有过敏毒素活性和趋化活性。C5b可吸附于邻近的细胞表面,但其活性极不稳定,易于衰变成C5bi。
C6~C9:C5b虽不稳定,当其与C6结合成C56复合物则较为稳定,但此C5b6并无活性。C5b6与C7结合成三分子的复合物C5b67时,较稳定,不易从细胞膜上解离。
C5b67即可吸附于已致敏的细胞膜上,也可吸附在邻近的,未经致敏的细胞膜上(即未结合有抗体的细胞膜上)。C5b67是使细胞膜受损伤的一个关键组分。它与细胞膜结合后,即插入膜的磷脂双层结构中。
若C5b67未与适当的细胞膜结合,则其中的C5b仍可衰变,失去与细胞膜结合和裂解细胞的活性。
C5b67虽无酶活性,但其分子排列方式有利于吸附C8形成C5678。其中C8是C9的结合部位,因此继续形成C5~9,即补体的膜攻击单位,可使细胞膜穿孔受损。
目前已经证明,不C5b、C6、C7结合到细胞膜下是细胞膜仍完整无损;只有在吸附C8之后才出现轻微的损伤,细胞内容物开始渗漏。在结合C9以后才加速细胞膜的损伤过程,因而认为C9是C8的促进因子。(图3-3)。
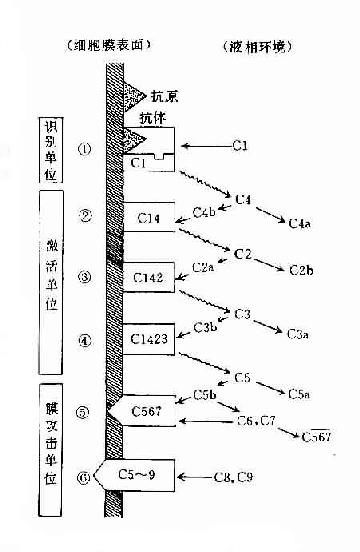
图3-3 经典途径的激活
