1987年Bjorkman等首先借助X线晶体衍射技术弄清了HLA-A2分子的立体结构。其后,其它HLA-Ⅰ、Ⅱ类分子结构的研究也取得了进展,从而对这些分子的生物学功能提供了较确切的解释。
(一)HLA-Ⅰ类分子
所有的HLA-Ⅰ类分子均含有二条分离的多肽链,一条是由MHC基因编码的α链或称重链(44kD)。根据对HLA-A2和Aw68分子的晶体结构分析,Ⅰ类分子可分为四个区:(图5-5):①氨基端胞外多肽结合区:该区由二个相似的各包括90个氨基酸残基的片段组成,分别称为α1和α2。该功能区含有与抗原结合的部位。后者呈深槽状,其大小与形状适合于已处理的抗原片段,约容纳8~10个氨基酸残基。Ⅰ类分子的多态性残基也位于该区域。②胞外lg样区:该区又称为重链的α3片段,包括90个氨基酸残基,与免疫球蛋白的恒定区具有同源性。Ⅰ类分子与TC细胞表面CD8分子的结合部位即在α3片段。Ⅰ类分子的β链又称β2微球蛋白,也结合于该区。β链由第15号染色体的基因编码,它不插入细胞膜而游离于细胞外。β2微球蛋白与α1、α2、α3片段的相互作用对维持Ⅰ类分子于然构型的稳定性及其分子表达有重要意义。③跨膜区:该区氨基酸残基形成螺旋状穿过浆膜的脂质双层,将类分子锚定在膜上。④胞浆区:该区位于胞浆中,可能与细胞内外信息传递有关。
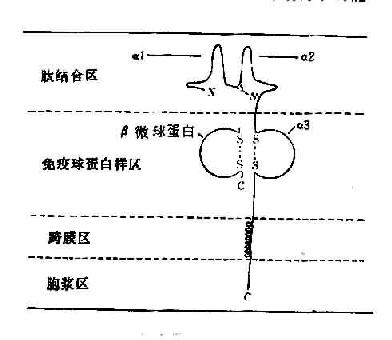
图5-5 HLA-Ⅰ类分子结构示意图
(二)HLA-Ⅱ类分子
所有的Ⅱ类分子均由二条以非共价键连接的多肽链(α、β)组成。二条链的基本结构相似,但分别由不同的MHC基因编码,且均具有多态性。虽然Ⅱ类分子的晶体衍射结构尚未得到,但光谱分析已证明与Ⅰ类分子具有某种相似性。Ⅱ类分子二条多肽链也可分为四个区,见(图10-6):①肽结合区:α链与β链的胞外部位均可再分为二个各含90个氨基酸残基的片段,分别称为α1、α2和β1、β2。肽结合区包括α1和β1片段,该二片段构成肽结合的裂隙(cleft),约可容纳14个氨基酸残基。Ⅱ类分子的多态性残基主要集中在α1和β1片段,这种多态性决定了多肽结合部位的生化结构,也决定了与肽类结合以及T细胞识别的特异性和亲和力。②lg样区:此区由α2和β2片段组成,两者均含链内二硫键,并属于lg基因超家族。在抗原呈递过程中,TH细胞的CD4分子与Ⅱ类分子结合的部位即位于该lg样非多肽态区域。③跨膜区和胞浆区:该二区与Ⅰ类分子α链的相应区域结构相似。
