分子或晶体中相邻原子间强烈的相互作用力称为化学键。化学键的基本类型有:离子键(电价键)、共价键、配价键和金属键等。
以阳离子和阴离子之间静电引力形成的化学键 叫离子 键。
分子中原子间通过共享电子对所形成的化学键为共价键。
配价键是一种特殊的共价键,其共享电子对是一个原子单独提供的。这种由一个原子单独提供一对电子与另一个原子共享所形成的共价键,叫配位共价键,简称配价键。
自1916年刘易斯提出经典的共价键理论以来,共价键理论有了很大的发展。现代共价键理论有两种,一是价键理论,二是分子轨道理论。本书不介绍轨道理论。
(一)价键理论的基本要点
价键理论,又称电子配对法,其基本要点如下:
1.具有自旋相反的未成对电子的两个原子相互接近,可以形成稳定的共价键。
如果A、B两个原子各有一个自旋相反的未成对的电子,那么这两个未成对电子可以相互配对形成稳定的共价键,这对电子为A、B两原子所共有。如果A、B各有两个或三个未成对的电子,则自旋相反的单电子可两两配对形成共价键或叁键。
如果A原子有两个未成对电子,B原子有一个未成对电子,那么一个A原子能与两个B原子结合形成AB2型分子。
2.原子中未成对的电子数等于原子所能形成的共价键数目。
共价键是由成键原子中自旋相反的未成对电子配对形成的。一个原子的一个电子和另一个原子的一个电子配对以后,不能再和第二个电子配对。因为这时其中必有两个电子的自旋方向相同而相斥。也就是说一个原子所能形成共价键的数目是一定的。原子中未成对的电子数等于原子所能形成的共价键数目,这就是共键价的饱和性。例如,H原子只有一个未成对电子,它和另一个H原子的未成对电子配对后,就不能再与第二个H原子的电子配对了。
3.成键电子的电子云重叠越多,核间电子子云密度越大,形成的共价键越牢固。
共价键的生成是由于自旋相反的单电子相互配对,电子云重叠的结果。因此,当两个原子形成分子时,电子云重叠的程度越大,则两原子间的电子云密度越大,生成的共价键越牢固,所以,在形成共价键时,电子云总是尽可能达到晨大程度的重叠,这叫电子云最大重叠原理。
根据电子云最大重叠原理,在形成共价键时,原子间总是尽可能沿着电子云最大重叠方向成键。s电子云呈球形对称分布,p、d、f电子云在空间都有一定的伸展方向。在形成共价键时,除了s电子云和s电子云可以在任何方向上都能达到最大程度的重叠外,p、d电子云的重叠,只有在一定方向上才能使电子云有最大程度的重叠。即共价键是有方向性的。例如,当氢原子1s电子云和氯原子的3p电子云重叠形成HCL分子时,氢原子的1s电子云总是沿着氯原子未成对电子的3p电子云对称轴方向作最大程度的重叠(图4-9(a))。其他方向都不能形成稳定的分子(图4-9(b)(c))。
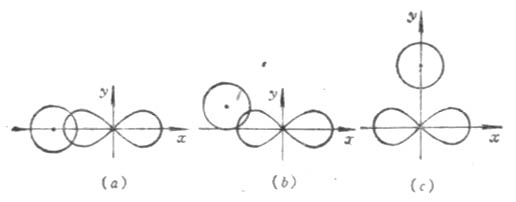
图4-9 氢原子的1s电子云与氧原子的3Pχ电子云的三种重叠情况
(二)共价键的类型
共价键有两种成键方式。一种是电子云以:“头碰头”方式相重叠,电子云及重叠部分沿键轴(两核间连线)呈圆柱形对称分布,重叠部分绕轴旋转任何角度形状不会改变,这种键叫σ键。另一种是成键的两个电子云的对称轴相平行,以“肩并肩”方式相重叠,电子云重叠部分对通过键轴的一个平面具有对称性,这种键称为π键。
例如在N2分子中,氮原子的电子层结构为1s22s22p1x2p1y2p1z三个未成对的p电子分占三个互相垂直的p轨道。当两个氮原子结合成N2分子时,px电子云沿x轴方向以“头碰头”方式重叠形成一个σ键,每个原子剩下的两个p电子云不能再沿x轴方向“头碰头”重叠,只能让p电子云的对称轴平行,以“肩并肩”方式重叠形成两个π键。如图4-10。
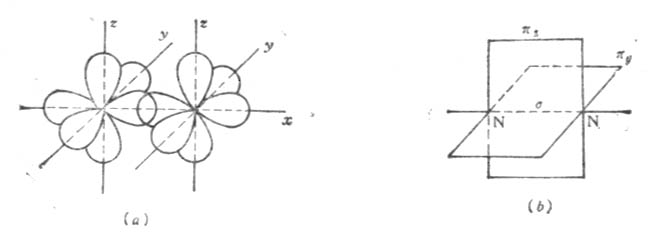
图4-10 N2分子形成示意图
由于σ键电子云重叠程度较π键大,因而σ键比π键牢固。一般来说,π键容易断开,化学活泼性较强。π键不能单独存在,只能与σ键共存于具有双键或叁键的分子中。σ键不易断开,是构成分子的骨架,可单独存在于两原子间。通常在以共价键结合的两原子间只能有一个σ键。
