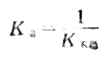将氨水加到硝酸银溶液中,则有[Ag(NH3)2]+配离子生成,反应式为:
Ag++2NH3→[Ag(NH3)2]+
此反应称为配合反应(也叫络合反应)。
由于配离子是由中心离子和配位体以配价键结合起来的,因此,在水溶液中比较稳定。但也并不是完全不能离解成简单离子,实质上和弱电解质类似,也有微弱的离解现象。
![]()
(一)配合物的稳定常数
配合物的稳定性,可以用生成配合物的平衡常数来表示,例如:
![]()
应用化学平衡原理,可得:
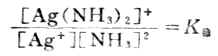
K稳值越大,表示形成配离子的倾向越大,此配合物越稳定。所以配离子的生成常数又称为稳定常数(附录八)。
(二)分布稳定常数
配合物在溶液中的生成与离解,与多元酸、碱相似,也是分级进行的,而且各级离解或生成常数也不一样。例如,Cu2+与NH3逐步配合过程中的分步稳定常数(30℃)分别为:
K1,K2,K3,K4称为逐级稳定常数。由上可见,配合物的逐级稳定常数随着配位数的增加而下降。一般认为,随着配位体数目增多,配位体之间的排斥作用加大,故其稳定性下降。
配合物的逐级稳定常数和稳定常数间有下述关系:
K= K1·K2·K3·K4…Kh
对[Cu(NH3)4]2+来说,其稳定性k 为:
K= K1·K2·K3·K4
K=(1.41×104)(3.17×103)(7.76×102)(1.39×102)=4.8×1012
(三)不稳定常数
在水溶液中,[Ag(NH.3)2]+是稳定的,不过像其他弱电解质一样也有少数[Ag(NH.3)2]+发生离解,可用下式表示:
![]()
则平衡常数表达式为:
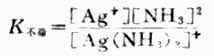
K不稳值愈大,表示配离子离解愈多,故称K不稳为配离子的不稳定常数。
K稳和K不稳互成倒数: